Настоящее изобретение относится к новым производным гидроксамовой кислоты, которые могут использоваться в качестве активного компонента при терапии диабетической ангиопатии, а также к способам их получения.
Одним из наиболее часто встречающихся заболеваний обмена веществ является сахарный диабет, главным симптомом которого является нарушение баланса метаболизма углеводов в организме. Сахарный диабет часто сопровождается патологическими деформациями сосудов, например сужения сосудов в конечностях, патологическая деформация сосудов глазного дна и т.д. Хотя, в дополнение к инсулину, известно значительное число эффективных лекарств в области лечения диабетической ангиопатии, связанной с основным заболеванием, результаты, обеспечиваемые доступными на рынке составами, крайне посредственны. Это положение вызвано тем явлением, что сахарный диабет приводит к изменениям адренергических рецепторов сосудов и, следовательно, медицинское лечение имеющимися на рынке лекарствами приводит к адренергической реакции, отличной от реакций, происходящих в кровеносных сосудах пациентов-недиабетиков (Nature New Biology, 243, N 130, 276 (1973); Szemeszet, III, 23(1974); Endocrynology, 93, 752 (1973). Адренергические рецепторы кровеносных сосудов у пациентов-диабетиков подвергаются превращению в бета-рецепторы из-за количественного увеличения обмена веществ. За трансформацию рецептора ответственность несет выделение модулятора (Amer. J. Physiol. 218, 869/1970/). После добавления модулятора к органу альфа агонисты альфа не будут больше проявлять активности, так как рецептор трансформирован в бета-форму.
Исходная чувствительность альфа может быть восстановлена путем добавления бета-блокирующего агента в организм.
В случае качественного изменения обмена веществ на модели диабета или в живом человеке агонисты альфа, например норадреналин, остаются эффективными, этот эффект, однако, может быть компенсирован добавлением бета-блокирующих агентов. Это представляет собой первое функциональное изменение, которое может обнаруживаться при диабете, например, добавлением Аллоксана (гексагидропиримидин-тетраон), 24 часа спустя после введения. В случае диабета несовершенное преобразование альфа-бета- рецептора, возможно, вызванное образованием альтернативного, так называемого "Фальш"-модулятора, служит в качестве отправной точки патологических изменений.
Известно, что обычные бета-блокирующие агенты (индерал, 1-(метилэтиламино)-3-(1-нафталинокси)-2-пропанол, Вискен, 4,5-дигидро-2-(5-метил-2-(1-метилэтилфенокси)-метил-1H-имидазол) противопоказаны при терапии диабетической ангиопатии.
Известны производные OF-(3-амино-2-оксипропил)-амидоксима (патент Венгрии N 177578), селективные к диабету, блокирующие адренергические рецепторы.
Задачей настоящего изобретения является создание новых производных гидроксамовой кислоты, обладающих антиангиопатической активностью при диабете.
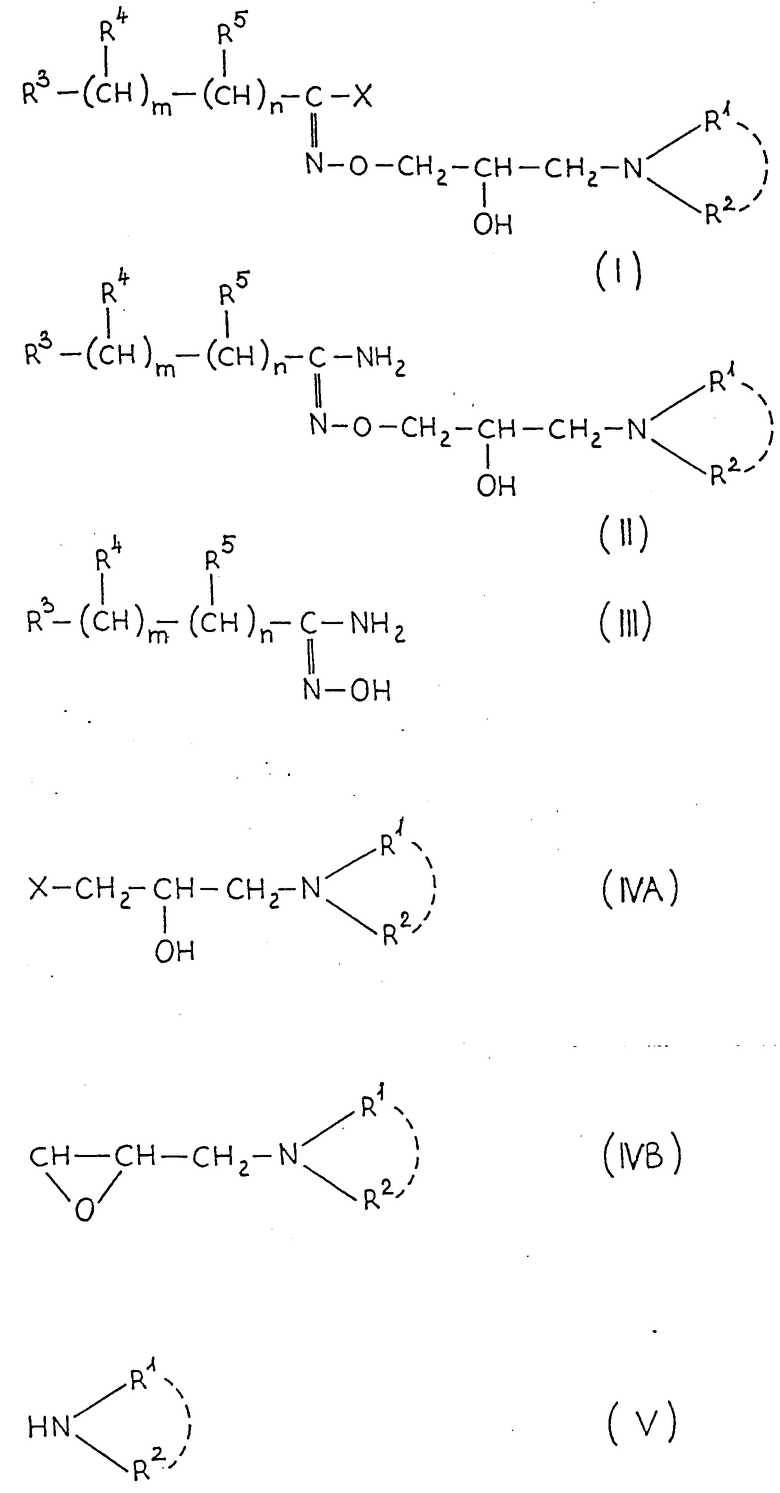
Поставленная задача достигается новыми производными гидроксамовой кислоты общей формулы I: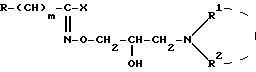
где: X представляет собой атом галогена;
R представляет собой фенил, который может быть замещен /C1-C4/алкоксигруппой, или пиридил;
m 0,2;
R1 представляет собой атом водорода или /C1-C5/алкил;
R2 представляет собой /C1-C5/алкил, /C5-C7/циклоалкил или R1 и R2 вместе с атомом азота, к которому они присоединены, образуют гетероциклический радикал, выбранный из группы, содержащей: пиридинил, пиперидинил, который может быть замещен двумя /C1-C4/алкильными группами, пирролидинил, морфолинил, пиперазинил, замещенный /C1-C4/алкильной группой и 1,2,3,4- тетрагидроизохинолинил, замещенный двумя /C1-C4/алкоксигруппами; и их кислотно-аддитивные соли.
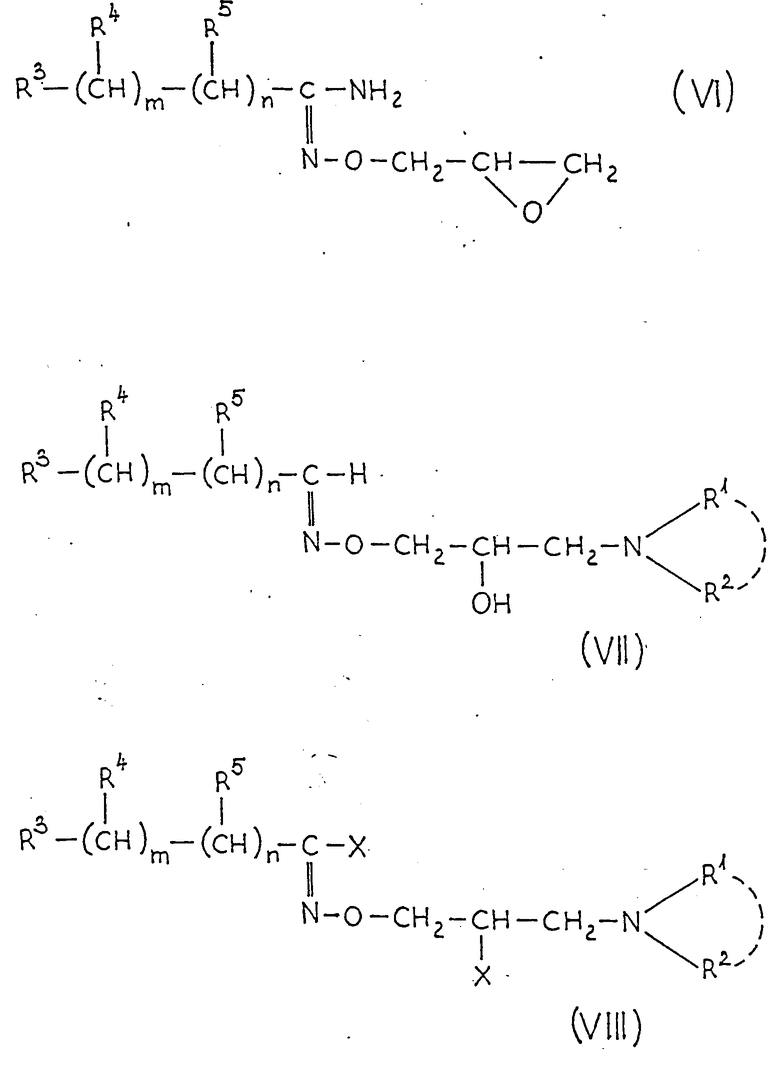
Настоящие соединения не влияют или влияют очень слабо, на адренергические рецепторы здоровых кровеносных сосудов, но проявляют сильное воздействие на адренергические рецепторы, деформированные сахарным диабетом. Этот эффект возникает прежде всего как селективный бета-блокирующий эффект, следовательно, соединения общей формулы (I) применимы при медицинском воздействии на диабетическую ангиопатию, способ получения которых заключается в том, что соединение общей формулы (VII):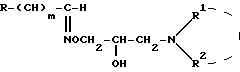
где R, R1 и R2, m имеют вышеуказанные значения, подвергают обработке галоидирующим агентом и полученное при этом соединение общей формулы /VIII/: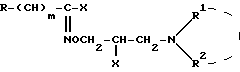
где X, R, R1 и R2, m имеют вышеуказанные значения, подвергают гидролизу в водно-щелочной среде с последующим выделением целевого продукта в форме основания или в виде кислотно-аддитивной соли или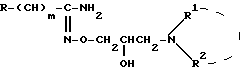
где R, R1 и R2, m имеют вышеуказанные значения, диазотируют в присутствии нитрита натрия и галоидводородной кислоты с последующим разложением полученной при этом соли диазония и выделением целевого продукта в форме основания или в виде кислотно-аддитивной соли.
Продукты реакции могут быть отделены от реакционной смеси известными по себе методами, например кристаллизацией и экстрагированием, при использовании воды в качестве реакционной среды. Когда используют органические растворители, применяют кристаллизацию или выпаривание с последующей промывкой водой и экстрагированием. Продукты могут быть выделены в виде их солей или из изолированных оснований могут быть образованы соли путем использования молярного эквивалента минеральных или органических кислот, предпочтительно фармацевтически приемлемых солей, или, при желании, из солей могут быть получены свободные основания.
Общий бета-блокирующий эффект соединений общей формулы (I) изучен на анестезированных кошках. В этих испытаниях кроме регистрации кровяного давления и частоты пульса также изучали влияние испытываемых материалов на сократимость левого желудочка. В качестве эталонного материала использовали индерал /1-изопропиламино-3-(нафтилокси)-пропан-2-ол/.
Бета-блокирующий эффект соединений согласно настоящему изобретению испытан на спиральном и/или кольцевом препарате аорты крыс /J. Pharmacol. Exp. Therap. 158, 531 (1967)/. Экспериментальный диабет был наведен с помощью стрептозотоцина /2-(3-нитрозо-3-метилуреидо)-2-деокси-D-глюкоза/. Реакцию оценивали как положительную, когда альфа-стимулирующий эффект норадреналина на контрольный препарат, то есть тот, который не был обработан стрептозотоцином, не испытывал воздействие, а получал защиту на диабетической аорте. При испытаниях, проводимых с использованием соединений согласно настоящему изобретению, происходил общий селективный эффект, проявляющийся, в случае нормальных испытаний, в отсутствие или в присутствии только легкого бета-блокирующего эффекта.
Проведены эксперименты для изучения того, защищает ли индерал сокращение, наведенное норадреналином, на спиральных препаратах аорты животных-диабетиков, обработанных стрептозотоцином. В качестве контроля использовали животных, предварительно не обработанных стрептозотоцином. Полученные результаты существенно соответствовали известным из литературы /Amer. J. Physiol. 218, 869 (1970)/, то есть альфа-стимулирующий эффект норадреналина был защищен индералом при испытаниях с диабетом, но не при нормальных испытаниях (Endocrinology, vol. 93, N3, сент. 1973 г.).
Было обнаружено, что соединения общей формулы (I) проявляли некоторый общий бета-блокирующий эффект. По сравнению с контрольным бета-блокирующим индералом испытанные соединения проявляли эффект на два порядка ниже в ингибировании бета-блокирующего D,L-1-(3,4-диокси-фенил)-2-изопропиламино-этанола.
В то же время соединения общей формулы (I) производили значительный параллельный сдвиг вправо на кривой дозы реагирования на норадреналин на кольце аорты крысы, больной диабетом (и/или на спирали), в порядке значения эффекта индерала. Доза индерала была 0,5 мкг/мл, в то время как доза соединения общей формулы (I) составляла 1,0 мкг/мл.
В соответствии с этим, галогенангидриды 0-(3-амино-2-оксипропил) гидроксамовой кислоты общей формулы (I) могут предпочтительно использоваться в терапии любого рода диабетической микро- и макроангиопатии, в частности диабетической ретинопатии и диабетической нефропатии, в случае сахарного диабета. Вышеуказанные соединения могут быть использованы сами по себе или в виде фармацевтических препаратов профилактики или для лечения в активной фазе этого заболевания, также как и в острых случаях.
Галогенангидриды гидроксамовой кислоты общей формулы (I) являются эффективными исключительно на пациентах в стадии формирования диабета и неэффективны для лиц-недиабетиков.
Изобретение дополнительно иллюстрируется в следующих примерах.
Пример 1.
2,3 г натрия растворяют в 200 мл абсолютного этанола и затем добавляют 12,1 г бензальдоксима. При температуре кипения раствор 3-пиперидино-2-окси-1-хлорпропана, полученный из 9,3 г эпихлоргидрина и 9,5 г пиперидина в 50 мл абсолютного этанола с помощью известных по себе способов, добавляют по каплям. Реакционную смесь кипятят в течение 8 ч с обратным холодильником, осажденную соль фильтруют при комнатной температуре и растворитель удаляют дистилляцией в вакууме. Остаток в 100 мл 5%-ного натра и маслянистый продукт экстрагируют бензилом. После сушки и выпаривания экстракта бензола получают 8,2 г О-(3-пиперидино-2-окси-1-пропил)-бензальдоксима. Гидрохлорид этого продукта отделяют от его раствора изопропанола путем введения газообразной соляной кислоты или добавления соляной кислоты в этаноле к раствору. Температура плавления 137oC (из изопропанола).
Анализ на базе C15H23ClN2O2: мол. вес 298,81.
Рассчитано: C 60,29; H 7,76; N 9,37; Cl 11,86.
Найдено: C 60,35; H 8,00; N 9,25; Cl 11,90.
2,98 г О-(3-пиперидино-2-окси-1-пропил)-бензальдоксима кипятят в 20 мл тионилхлорида в течение 3 ч. Хлорид О-(3-пиперидино-2-хлоро-1-пропил)- бензгидроксамовой кислоты отделяют добавлением примерно 100 мл 20%-ного водного основания до pH= 11, с последующим экстрагированием хлороформом. Экстракт хлороформа сушат на сульфате натрия и выпаривают. Маслоподобный продукт может быть преобразован в соединение общей формулы различными путями:
а) 3,4 г маслянистого продукта гидролизуют с помощью 20 мл 20%-ного NaOH при 55 60oC в течение 2 ч при перемешивании, экстрагируют бензолом, раствор сушат с помощью твердого осушающего агента и затем выпаривают. К остатку добавляют 50 мл соляной кислоты в этилацетате. При перемешивании осаждают гидрохлорид из хлорида 0-3-пиперидино-2-окси-1-пропил- бензгидроксамовой кислоты.
Выход: 2,1 г, ЯМР (основание, CDCl3: 7,4 8,0 м (5H); 3,9 4,4 м (3H); 2,2 2,8 м (6H); 1,3 1,8 м (6H); 3,5 с (OH). Температура плавления 140 142oC (из изопропанола).
Анализ: на основе C15H22Cl2N2O2.
Вычислено: C 54,22; H 6,37; N 8,43; Cl 21,14.
Найдено: C 53,12; H 6,26; N 8,19; Cl 20,84%
б) 0,81 г (4,74 ммоль) AgNO3 растворяют в 4 мл воды и при перемешивании к этому по капле добавляют 0,19 г NaOH (4,74 ммоль) в 3 мл воды. Водную суспензию AgOH перемешивают вместе с 1,5 г (4,74 ммоль) хлорида О-(3-пиперидино-2-хлоро-1-пропил)-бензгидроксамовой кислоты при 50oC в течение 3 ч. Затем суспензию экстрагируют бензолом, слой бензола высушивают сульфатом натрия, фильтруют, выпаривают и подвергают этапу солеобразования, описанному в процессе а). Выход конечного продукта составляет 95% Физические данные конечного продукта идентичны вышеописанным.
в) 3,0 г (9,49 ммоль) хлорида О-(3-пиперидино-2-хлор-1-пропил)-бензгидроксамовой кислоты растворяют в 10 мл этанола, при перемешивании добавляют 0,86 г (1,05 •10-2 моль) ацетата натрия в 15 мл воды и смесь перемешивают в течение 3 ч при 50oC. Реакционную смесь выпаривают в вакууме и остаток экстрагируют бензолом. Экстракт в бензоле высушивают на сульфате натрия и выпаривают, получая в результате 2,12 г маслянистого хлорида О-(3-пиперидино-2-ацетокси-1-пропил)-бензгидроксамовой кислоты. Полученный таким образом сложный эфир растворяют в 20 мл этанола с последующим добавлением 20 мл воды. К этой смеси добавляют 0,25 г NaOH в 20 мл воды и перемешивают при 40oC в течение одного часа, экстрагируют бензолом, бензольный экстракт осушивают сульфатом натрия и выпаривают. Из остатка получают соль согласно способу процесса а). Выход 90% Качество продукта идентично качеству продукта в процессе а).
Пример 2.
Следуют процессу, описанному в примере 1, но начинают с 3-пиридил-альдоксима и 3-пиперидино-2-окси-1-хлор-пропана, получая О-(3-пиперидино-2-окси-1-пропил)-3-пиридил-альдоксим, который вводят в реакцию с тионилхлоридом согласно примеру 1. После удаления тионилхлорида выпариванием изопропанол добавляют к остатку, обеспечивая таким образом кристаллизацию хлорида О-(3-пиперидино-2-хлор-1-пропил)-3-пиридил-гидроксамовой кислоты в виде дигидрохлорида. Температура плавления 142oC (из изопропанола). Выход 85%
Анализ на основе C14H21Cl4N3O. Молекуляр. вес 389,15.
Вычислено: C 43,21; H 5,44; N 10,79; Cl 36,44.
Найдено: C 42,97; H 5,62; N 10,59; Cl 36,80.
Согласно другому варианту получения вышеуказанный дигидрохлорид хлорида О-(3-пиперидино-2-хлор-1-пропил)-3-пиридил-гидроксамовой кислоты не выделяют, вместо этого к остатку после выпаривания добавляют 10% NaOH до pH=11, согласно примеру 1, и полученную таким образом смесь экстрагируют хлороформом. Слой с хлороформом сушат, выпаривают и затем гидролизуют с использованием любого из процессов а), б) и в) из примера 1. Смесь после гидролиза экстрагируют бензолом, высушивают на сульфате натрия и выпаривают. Остаток растворяют в ацетоне с последующим добавлением малеиновой кислоты и выделением полученного таким образом хлоридмалеината О-(3-пиперидино-2-окси-1-пропил)-3-пиридил-гидроксамовой кислоты путем фильтрования.
ЯМР (основание, CDCL3: 9,03, 8,59, 8,00, 7,1 7,4, 3,84 c (3H), 1,1 1,8 (6H), 5,28 c (OH).
Температура плавления 125oC (из ацетона). Выход 65%
Анализ на базе C18H24ClN3O6: молекулярный вес 413,79.
Вычислено: C 52,24, H 5,84, N 10,15, Cl 8,55;
Найдено: C 52,26, H 5,99, N 9,87, Cl 8,46.
Пример 3.
К 3,5 г (10 ммоль) О-(3-пиперидино-2-окси-1-пропил)-бензамидоксим-дигидрохлорида добавляют 40 ммоль хлористого водорода (в 37%-ной форме) при 5oC при энергичном перемешивании. После добавления 5 мл диоксана смесь охлаждают до 0oC с использованием льда с солью. При той же самой температуре добавляют по каплям раствор из 1,38 г (20 ммоль) NaNO2 в 6 мл воды в течение 1,5 ч, с последующим интенсивным перемешиванием в течение 4 ч при температуре окружающей среды. Кислую реакционную смесь подщелачивают добавлением 10% -ной гидроокиси натрия до pH=11, а затем экстрагируют с помощью 100 мл бензола. Бензольный слой высушивают над сульфатом натрия и выпаривают. Из остатка получают хлорид О-(3-пиперидино-2-окси-1-пропил)-бензгидроксамовой кислоты путем добавления насыщенного раствора соляной кислоты в этилацетате и выделяют фильтрованием. Температура плавления 139 -141oC.
Анализ на основе C15H22Cl2N2O2: молекулярн. вес 333,25.
Вычислено: C 54,22, H 6,37, N 8,43, Cl 21,14.
Найдено: C 54,62, H 6,16, N 8,09, Cl 20,71.
Пример 4.
Следуют процессу, описанному в примере 3, но вместо соляной кислоты используют бромистый водород в качестве галоид-водорода, получая в результате гидрохлорид бромида О-(3-пиперидино-2-окси-1-пропил)-бензгидроксамовой кислоты. Выход 27% Температура плавления 138oC (из изопропанола).
Анализ на основе C15H22BrClN2O2: молекулярный вес 377,71.
Вычислено: C 47,63, H 5,87, N 7,41.
Найдено: C 47,60, H 6,19, N 7,50.
Пример 5.
Следуя процессу, описанному в примере 3, дигидрохлорид амидоксима О-(3-пиперидино-2-окси-1-пропил)-никотиновой кислоты диазотируют с использованием соляной кислоты в качестве галоидводорода. После диазотирования и реакции "выпаривания" из хлорида О-(3-пиперидино-2-окси-1-пропил)-3-пиридил-гидроксамовой кислоты получают малеинат в сухом органическом растворителе путем добавления молярного эквивалента малеиновой кислоты, а затем отделяют. Температура плавления 125oC (из ацетона). Выход 58%
Анализ на базе C18H24ClN3O6: молекулярный вес 413,79.
Вычислено: C 52,24, H 5,84, N 10,15, Cl 8,55.
Найдено: C 52,26, H 5,99, N 9,87, Cl 8,46.
ЛД50: 110 мг/кг живого веса на крысах Wistar.
Пример 6.
Следуя способу, описанному в примере 5, но с использованием бромистого водорода вместо соляной кислоты в качестве галоидводорода, получают малеинат бромида О-(3-пиперидино-2-хлор-1-пропил)-3-пиридил-гидроксамовой кислоты. Выход 58% Температура плавления 117oC (из ацетона).
Анализ на основе C18H24BrN3O6: молекулярный вес 457,25.
Вычислено: C 47,36, H 5,21, N 9,16, Br 17,13.
Найдено: C 47,67, H 5,31, N 8,80, Br 16,78.
Пример 7.
Следуют процессу, описанному в примере 3, но с использованием дигидрохлорида гидроксамовой кислоты О-(3-пиперидино-2-окси-1-пропил)-3,3-дифенил-пропионовой кислоты в качестве компонента амидоксима в реакции диазотирования, получают дигидрохлорид гидроксамовой кислоты хлорида О-(3-пиперидино-2-окси-1-пропил)-3,3-дифенил-пропионовой кислоты.
Выход 30% Температура плавления 149 152oC (из изопропанола).
ЯМР (основание, DMSOd6): 7,1 7,6 м (1OH), 4,5 т (14), 3,34d (2H), J=7,5 Гц, 3,9 br c (3H), 2,3 3,0 м (6H), 1,3 -1,9 м (6H), OH с экранированием.
Анализ по C23H30Cl2N2O2: молекулярный вес 437,40.
Вычислено: C 63,15, H 6,51, N 6,40, Cl 16,21.
Найдено: C 63,50, H 6,79, N 6,31, Cl 16,47.
Пример 8.
Следуя процедуре, описанной в примере 3, но с использованием дигидрохлорида амидоксима О-(3-диэтиламино-2-окси-1-пропил)-3,3-дифенил-пропионовой кислоты в качестве исходного компонента амидоксима, получают дигидрохлорид гидроксамовой кислоты О-(3-диэтиламино-2-окси-1-пропил)-3,3-дифенил-пропионовой кислоты. Выход 32% Температура плавления 155oC (из изопропанола).
Анализ по C22H30Cl2N2O2: молекулярный вес 425,40.
Вычислено: C 62,11, H 7,10, N 7,52, Cl 16,66.
Найдено: C 62,10, H 6,98, N 7,45, Cl 17,00.
Пример 9.
Следуя процессу, описанному в примере 3, но с использованием О-(3-изопропиламино-2-окси-1-пропил)-бензамидоксимдигидрохлорида в качестве исходного компонента амидоксима получают гидрохлорид О-(3-изопропиламино-2-окси-1-пропил)-бензгидроксамовой кислоты. Выход 12% Температура плавления 122oC (из изопропанола).
Анализ по C13H20Cl2N2O2: молекулярный вес 307,22.
Вычислено: C 50,82, H 6,56, N 9,11, Cl 23,08.
Найдено: C 51,12, H 6,58, N 9,05, Cl 22,89.
Пример 10.
N-/2-гидрокси-3-(пиридин-1-ил)-пропокси/-2-пиридинкарбоксимидоил хлорид (Z)-2-бутендиоат (1:1).
Процесс проводят аналогично примеру 3, но используют О-/2-гидрокси-3-(пиперидин-1-ил)-пропил-карбоксамидоксим дигидрохлорид в качестве амидоксима и продукт выделяют в виде малеината в среде ацетона. Выход 1,3 г (31%).
Т.пл. 61 64oC (из этилацетата).
TLC: Rf=0,67 (кизельгель 60, элюент: PhMe-MeOH-EtOAc-cc.NH4OH (7:6:6:1).
IR: ([см-1 J/KBr): 3416, 1670, 1574, 1506, 1367, 1055, 997, 991, 864, 791, 717.
1HNMR (250 MHz, DMSO; referent DMSO 2,50 [ppm]): 8,70d, 1H, 7,90 b, 2H, 7,53m, 1H (пиридин 6-3/4-5), 6,03s, 2H (CH=CH),4,32 bs, 3H (NOCH2+CHOH), 3,3-3,0 b, 6H(3•NCH2), 1,75 b, 4H/2•CH2 (3)/, 1,54 b, 2H/CH2(4)/.
13C-NMR (63MHz, DMSO; referent DMSO 39,3 [ppm]): 166,8, 148,5, 125,1, 136,8, 121,7, 149,1 (пиридин 2-3-4-5-6). 135,3 (CH=CH), 137,8 (C(C1)=N), 76,9 (NOCH2), 63,0 (CHOH), 57,9 (CH=CH2-N), 52,6 /CH2(2)/, 21,9 /CH2(3))/, 20,8 /CH2(4)/.
Пример 11.
N-/2-гидрокси-3-(диэтиламино)-пропокси/-3-пиридин- карбоксимидоилхлорид гидрохлорид (1:1).
К раствору 1,0 г (3,7 ммоль) N-/2-гидрокси-3-диэтиламино-пропокси/-3-пиридинкарбоксимид-амид (CAS /131 782-74-6/, CA 90 435907) в 5 мл воды и 1,8 мл HCl при 5 0oC добавляют по каплям раствор 0,81 г NaNO2 (11,7 ммоль) в 3 мл воды и смесь перемешивают в течение 1 ч при той же температуре. Затем 0,78 г NaOH в 4 мл воды добавляют и продукт экстрагируют 2•10 мл воды. Эфирный раствор промывают водой 3•10 мл, высушивают над N2SO4 и выпаривают. Маслянистый осадок (0,53 г) растворяют в 5 мл изопропанола и продукт преципитируют добавлением 4 M HCl/изо- P2OH.
Выход: 0,35 г (29). Т.пл. 117 -118oC.
TLC: Rf=0,66 (кизельгель 60, элюент: PhMe-MeOH-Et OAС-cc. NH4OH (7:6:6: 1).
IR: /(см-1)/KBr: 3292, 2959, 2854, 1578, 1475, 1484, 1409, 1273, 1099, 1049, 976, 901, 838, 704.
1H-NMR (250 MHz, DMSO; referent DMSO 2,50 [ppm]): 10,35b, 1H (NH+), 8,97d, 8,70dd, 8,17m, 7,55m (пиридин 2-6-4-5-), 6,02d, 1H (OH), 4,45 4,25m, 3H (NOCH2+CHOH), 3,4 3,0m, 6H (3•NCH2), 2,25t, 6H (2•CH3).
13C-NMR (63 MHz, CDCl3, referent CDCl3 77,0 [ppm]): 151,0, 128,6, 134, 123,1, 148,0 (пиридин 2-3-4-5-6), 135,2 /C(C1)= N/, 78,2 (NOCH2), 65,5 (CHOH), 55,5 (CH-CH2-N), 47,1 (CH2-CH3), 11,8 (CH3).
Пример 12.
N-/2-гидрокси-3-(пирролидин-1-ил)-пропокси/-3-пиридинкарбокси-мидоил хлорид (Z)-2-бутендиоат (1:1).
N-/2-гидрокси-3-(пирролидин-1-ил)-пропокси/-3-пиридинкарбоксимид-амид- дигидрохлорид (СА /131782-78-0/, СА 90 435907) диазотируют согласно примеру 11. Продукт выделяют в виде малеината из этилацетата. Выход 0,3 г (25%), т. пл. 89 -92oC.
TLC: Rf=0,58 (кизельгель 60, элюент PbMe-MeOH-EtOAc-cc. NH4OH (7:6:6:1).
IR: ([см-1]/KBr): 3323, 2953, 1585, 1497, 1385, 1366, 1194, 1070, 1022, 876, 864, 704.
1H-NMR (250 MHz, DMSO; referent DMSO 2,50 [ppm]): T 333K 8,97d, 8,69dd, 8,15m, 7,53m (пиридин 2-6-4-5), 6,03s, 2H (CH CH), 4,4-4,2m, 3H (NOCH2+CHOH), 3,4-3,1m, 6H(3•NCH2), 1,9bs, 4H(2•CH2).
13C-NMR (63 MHz, DMSO, referent DMSO 39,3 [ppm]): 166,8 (COOH), 151,3, 127,5, 134,2, 123,5, 147,0 (пиридин 2-3-4-5-6), 135,6, (CH=CH), 134,6 /C(CI) /, 64,2 (CHOH), 55,9 (CH-CH2-N), 53,6 (NCH2), 22,1 (CH2).
Пример 13.
Аналогично были получены следующие соединения:
N-/2-гидрокси-3-(2,6-диметилпиперидин-1-ил)-пропокси/-3- пиридинкарбоксиимидоил хлорид.
Т.пл. 78,5 79oC (изо Pr2O).
TLC: Rf=0,66 (кизельгель 60, элюент: PhMe-MeOH-EtOAc-cc. NH4OH 7:6:6:1).
IR ([см-1] /KBr): 3090, 2930, 1580, 1435, 1379, 1307, 1275, 1204, 1094, 1049, 1020, 980, 914, 714.
1HNMR (250 MHz, CDCl3; referent TMS 0,0 [ppm]): 9,09d, 8,66dd, 8,12m, 7,35m (пиридин 2-6-4-5-), 4,33d, 2H (NOCH2), 2,6m, 2H(2•NCH), 1,8 1,2m, 6H(3•CH2), 1,12d, 6H (2•CH3).
13NMR (63 MHz, CDCl3, referent CDCl3 77,0 [ppm]): 151,0, 128,7, 134,3, 123,0, 148,0 (пиридин 2-3-4-5-6), 135,1 /C(Cl)N), 78,5 (NOCH2), 66,9 (CHOH), 55,2 (NCH2), 59,3 57,7 (2•CH), 33,2 -32,9 δ /2•CH2 (3)/, 24,1 (CH2(4)/, 21,9-21,6 (2•CH3).
N-/2-гидрокси-3-(морфолин-1-ил)-пропокси/-3-пиридин-карбоксамидоил (Z)-2-бутендиоат (1:1).
Т.пл. 137 138oC.
TLC: Rf= 0,45 (кизельгель 60, элюент: PhMe-MeOH-EtOAc-cc. NH4OH (7:6:6: 1).
IR ([cm-1] /KBr): 3310, 1580, 1483, 1464, 1443, 1354, 1072, 1024, 982, 870.
1H-NMR (250 MHz, DMSO; referent DMSO 2,50 [ppm]): 9,00d, 8,72dd, 8,18dd, 7,57m (пиридин 2-6-4-5), 6,03s, 2H (CH= CH), 5,9b, 1H(OH), 4,2-4,3b, 3H (NOCH2+CHOH), 3,80 d, 4H (2•OCH3, 3,0-3,3b, 6H (3•NCH2).
13C-NMR (63 MHz, DMSO; referent DMSO 39,3 [ppm]): 167,0 COOH), 151,5, 127,8, 134,4, 123,7, 147,2 (пиридин 2-3-4-5-6), 135,2 (СH=СH), 134,2 /С(CI)= N/, 77,1 (NOCH2), 63,1 (CHOH), 58,4 (CH2-N), 63,2, 51,7 (морфолин).
N-/2-гидрокси-3-(4-метилпиперазин-1-ил)-пропокси/-3-пиридин-карбоксимидоил хлорид (Z)-2-бутендиоат (1.2).
Т.пл. 174 175oC.
TLC: Rf= 0,51 (кизельгель 60, элюент: PhMe-MeOH-EtOAc-cc. NH4OH (7:6:6: 1).
IR ([см-1] /KBr): 3207, 1693, 1578, 1456, 1358, 1304, 1020, 974, 864, 702.
1H-NMR (250 MHz, DMSO; referent TMS 0,0 [ppm]): 8,97d, 8,72dd, 8,17m, 7,56m (пиридин 2-6-4-5), 6,15s, 4H(CH= CH), 4,3m, 2H (NOCH2), 4,05m, 1H (CHOH), 3,25 2,5m, 16H (5•NCH2, NCH3, 2•NH+, OH), 11-14b (2•COOH).
13C-NMR (63 MHz, DMSO; referent DMSO 39,3 [ppm]): 166,8 (COOH), 151,3, 127,9, 134,3, 123,7, 147,1 (пиридил 2-3-4-5-6), 134,2 /C(CI)=N/133,2 (CH= CH), 78,0 (NOCH2), 65,7 (CHOH), 59,1 (CH-CH2-N), 55,2, 50,0 (NCH2), 42,3 (CH3).
N-/2-гидрокси-3-проп-2-ил-амино)-пропокси/-3-пиридин-карбоксимидоил хлорид (Z)-бутендиоат (1:1).
Т.пл. 108 109,5oC.
TLC: Rf= 0,55 (кизельгель 60, элюент: PhMe-MeOH-EtOAc-cc. NH4OH (7:6:6: 1).
IR ([cm-1(KBr): 3200 (b), 1582, 1479, 1383, 1358, 1200, 1119, 1057, 986, 876, 700.
1H-NMR (250 MHz, DMSO; referent DMSO 2,50 [ppm]):9,08d, 8,72dd, 8,17m, 7,57m (пиридин 2-6-4-5), 8,04b, 2H( NH
13C-NMR (63 MHz, DMSO; referent DMSO 39,3 (ppm)/: 167,1 (COOH), 151,5, 127,7, 134,3, 123,7, 147,1 (пиридин 2-3-4-5-6), 135,9 (CH=CH), 135,9 (CH= CH), 134,8 /C(CI) N/ 76,7 (NOCH2); 64,8 (CHOH), 49,7 (NCH2), 46,2, 18,6 es, 17,9 (изопропил).
N-/2-гидрокси-3-(трет. бутиламино)-пропокси/-3-пиридин-карбоксамидоил хлорид (Z)-2-бутеноат (1:1).
Т.пл. 148,5 149oC.
TLC: Rf= 0,51 (кизельгель 60, элюент: PhMe-MeOH-EtOAc-cc. NH4OH (7:6:6: 1).
IR ([см-1] /KBr): 3500-2700 (b), 2986, 1632, 1582, 1470, 1356, 1204, 1124, 1067, 1034, 997, 874, 698.
1H-NMR (250 MHz, DMSO; referent DMSO 2,50 [ppm]): 12,4b, 1H(COOH), 8,98d, 8,72dd, 8,17m, 7,58m (пиридин 2-6-4-5), 8,35b, 2H( NH
13C-NMR (63 MHz, DMSO; referent DMSO 39,3 [ppm]): 167,0 (COOH), 151,5, 127,5, 134,3, 123,7, 147,1 (пиридин 2-3-4-5-6), 135,8 (CH= CH), 134,6 (C(CI)-N/, 70,6 (NOCH2), 64,7 (CHOH), 56,2 (CH2-N), 43,4, 24,8 (бутил).
N-/2-гидрокси-2-(циклогексиламино)-пропокси/-3-пиридин-карбоксимидоил хлорид (Z)-2-бутендиоат (1:1).
Т.пл. 135,5 136,5oC.
TLC: Rf 0,64, кизельгель 60, элюент PhMe - MeOH-EtOAc-cc.NH4OH 7:6:6:1.
IR[cm-1] /KBr: 3500-2700 (b), 2943, 1590, 1454, 1350, 1200, 1040, 1003, 989, 872, 737, 714.
1H-NMR (250 MHz, DMSO; referent DMSO=2,50 (ppm): 8,98 d, 8,72 dd, 8,17m, 7,57m, 1H (пиридин 6-3/4-5), 8,4b, 2H ( NH
13C-NMR (63 MHz, DMSO; referent DMSO=39,3 (ppm): 167 (COOH), 151,5, 127,7, 134,3, 123,7, 147,1 (пиридин 2-3-4-5-6), 135,8 (CH=CH), 134,8 (C(CI)= N), 76,7 (NOCH2), 64,7 (CHOH), 56,1 (CH2-N), 45,9 (N-CH3), 28,5-27,8 (2•CH2(2)), 24,5-23,8 (2•CH2(3)), 23,7 (CH2(4)).
N-/2-гидрокси-3-(5,6-диметокси-1,2,3,4-тетрагидроизохинолин- 2-ил/-пропокси/-3-пиридинкарбоксимидоил хлорид.
Т.пл. 111,5 112oC.
TLC: Rf 0,50, кизельгель 60, элюент CHCl3 CeOH 9:1.
IR[cm-1] /KBr: 3132 (b), 2949, 2812, 1580, 1514, 1488, 1384, 1289, 1225, 1128, 1053, 994, 922, 845, 810, 710, 700.
1H-NMR (250 MHz, DMSO; referent TMS=0,0 (ppm): 9,08d, 8,65d, 8,12d, 7,35m (пиридин 6-3-4-5-), 6,63s, 6,53s (Ph), 4,38d, 2H (NOCH2), 4,22m, 1H (CH-CH), 3,65 ABq, 2H(NCH2), 3,83 (2•s, 6H (2•CH3), 3,0-2,6m, 6H (3•CH2).
13C-NMR (63 MHz, CDCl3; referent CDCl3=77,0 (ppm): 151,1, 128,6, 134,4, 123,1, 148,0 (пиридин 2-3-4-5-6), 147,6, 147,2, 126,0, 125,8, 111,3, 109,3 (Ph), 135,4 (C(CI)=N), 78,1 (NOCH2), 65,7 (CHOH), 60,0 (CH2-), 55,8 (OCH3), 55,6 (N-CH2-Ph) 51,1 (N-CH2-CH2), 28,5 (CH2-CH2-Ph).
Пример 14.
N-/2-гидрокси-3-/(1-пиперидил)-пропокси/-α-(3,4-диметокси-фенил)-ацетимидоил хлорид.
3,87 г (10 ммоль) N-/2-гидрокси-3-/(1-пиперидил)-пропокси/- a -(3,4-диметоксибензил)-ацетамидин гидрохлорид (CAS/131782-83-7/) растворяют в 15 мл воды. Раствор охлаждают до -4/-5oC, добавляют 9,8 мл HCl и раствор 2,76 г (40 ммоль) NaNO2 в 8 мл воды (по каплям) при той же температуре. Смесь перемешивают при той же температуре дополнительно 2 ч и подщелачивают добавлением 2 NaOH/8 мл воды. Продукт экстрагируют 3x15 мл бензола, бензольный раствор промывают 15 мл воды и 15 мл насыщенного раствора NaCl, сушат над Na2SO4 и выпаривают.
2,9 г маслянистого остатка растворяют в 10 мл этилацетата, подкисляют HCl в этилацетате до pH 2 и выпаривают. Обработкой масла 20 мл ацетона получают 0,4 г твердого продукта непрореагировавшего продукта. Ацетоновый фильтрат выпаривают, осадок растворяют в 15 мл воды.
pH доводят до 8 NaHCO3 с последующей экстракцией 3х10 мл воды, высушивают над Na2SO4 и выпаривают. Сырой продукт был исследован хроматографически на 60 г кизельгеля в смеси ацетон-этилацетат (1:1). Выход: 1,02 (27,5%), бесцветное масло.
TLC: Rf=0,80, кизельгель 60, элюент PhMe-MeOH-EtOAc-cc. NH4OH 7:6:6:1.
IR[cm-1]/film: 3400 (b), 2930, 1605, 1590, 1515, 1460, 1260, 1235, 1145, 1020, 980, 845, 745, 635.
1HNMR (250 MHz, CDCl3; referent TMS=0,0 (ppm): 6,82s, 2H and 6,77s, 1H (фенил), 4,17m, 2H (NOCH2), 4,05m, 1H(CH), 3,86 2•s, 67 (2•OCH3), 3,71s, 2H (Ph-CH2), 3,6b, 1H(OH), 2,38d, 2H (CH2-CH2-N), 2,58m, 2H, 2,37m, 2H, 1,56m, 4H and 1,45m, 2H (пиперидин).
13C-NMR (63 MHz, CDCl3; referent CDCl3=77,0 (ppm): 149,0, 148,3, 127,1, 121,3, 112,1 and 111,2 (фенил), 139,1 (C)CI)=N), 77,3 (NOCH2), 65,3 (CH), 60,9 (CH2-CH2-N), 55,8 (OCH3), 42,3 (Ph-CH2), 54,6, 25,9 and 24,1 (пиперидин). Структурные формул соединений I VIII приведены в таблице.
| название | год | авторы | номер документа |
|---|---|---|---|
| ПРОИЗВОДНОЕ ПИРИДИН-1-ОКСИДА И СПОСОБЫ ЕГО ПРЕОБРАЗОВАНИЯ В ФАРМАЦЕВТИЧЕСКИ ЭФФЕКТИВНЫЕ СОЕДИНЕНИЯ | 2001 |
|
RU2281282C2 |
| АРИЛСУЛЬФОНИЛМЕТИЛЬНЫЕ ИЛИ АРИЛСУЛЬФОНАМИДНЫЕ ПРОИЗВОДНЫЕ АРОМАТИЧЕСКИХ СОЕДИНЕНИЙ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ИХ ОСНОВЕ И СПОСОБ ЛЕЧЕНИЯ РАССТРОЙСТВ, ВОСПРИИМЧИВЫХ К ЛЕЧЕНИЮ ЛИГАНДАМИ ДОФАМИНОВЫХ D РЕЦЕПТОРОВ, С ИХ ПОМОЩЬЮ | 2005 |
|
RU2442781C2 |
| СПОСОБ ЛЕЧЕНИЯ ИЛИ ПРОФИЛАКТИКИ ФИЗИОЛОГИЧЕСКИХ И/ИЛИ ПАТОФИЗИОЛОГИЧЕСКИХ СОСТОЯНИЙ, ОПОСРЕДУЕМЫХ РЕЦЕПТОРАМИ, СТИМУЛИРУЮЩИМИ СЕКРЕЦИЮ ГОРМОНА РОСТА, ТРИАЗОЛЫ И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ИХ ОСНОВЕ | 2006 |
|
RU2415134C9 |
| ЗАМЕЩЕННЫЕ 3-ОКСО-1,2,3,4-ТЕТРАГИДРОХИНОКСАЛИНЫ, ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ (ВАРИАНТЫ), СПОСОБ ИХ ПОЛУЧЕНИЯ И ПРИМЕНЕНИЯ | 2003 |
|
RU2251546C1 |
| СПОСОБ ПОЛУЧЕНИЯ ДИСПИРОИНДОЛИНОНОВ | 2018 |
|
RU2682678C1 |
| ПРОИЗВОДНЫЕ АНДРОСТАНА, ЗАМЕЩЕННЫЕ ПО 16-ПОЛОЖЕНИЮ ЧЕТВЕРТИЧНОЙ АММОНИЕВОЙ ГРУППОЙ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 1993 |
|
RU2124021C1 |
| СПОСОБ УЛУЧШЕНИЯ СТАБИЛЬНОСТИ УСИЛИТЕЛЕЙ СЛАДКОГО ВКУСА И КОМПОЗИЦИЯ, СОДЕРЖАЩАЯ СТАБИЛИЗИРОВАННЫЙ УСИЛИТЕЛЬ СЛАДКОГО ВКУСА | 2011 |
|
RU2576451C2 |
| N-(1H-ИМИДАЗОЛ-2-ИЛ)БЕНЗАМИД И СОДЕРЖАЩАЯ ЕГО ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ В КАЧЕСТВЕ АКТИВНОГО ИНГРЕДИЕНТА | 2020 |
|
RU2806754C1 |
| ИНГИБИТОРЫ БЕТА-ЛАКТАМАЗ И ИХ ПРИМЕНЕНИЕ | 2018 |
|
RU2815314C2 |
| ИНГИБИТОРЫ GCN2 И ИХ ПРИМЕНЕНИЕ | 2019 |
|
RU2811408C2 |
Сущность изобретения: производные гидроксамовой кислоты общей формулы (I), приведенной в описании, где m=0 и 2, x - атом галогена, R - фенил, который может быть замещен (C1-C4)алкоксигруппой, или пиридил, R1 - водород или (C1-C5)алкил, R2 - (C1-C5)алкил, (C5-C7)циклоалкил или R1 и R2, взятые вместе с атомом азота, с которым они связаны, образуют гетероциклический радикал, и их кислотно-аддитивные соли получают либо путем обработки соединения общей формулы (VII), приведенной в описании, где R1 - R2 имеют вышеуказанные значения, галоидирующим агентом с последующим гидролизом в водно-щелочной среде и выделением целевого продукта в форме основания или в виде кислотно-аддитивной соли; либо путем диазотирования соединения общей формулы (II), приведенной в описании, с последующим разложением полученной при этом соли диазония и выделением целевого продукта в форме основания или в форме кислотно-аддитивной соли. 3 с.п. ф-лы, 1 табл.
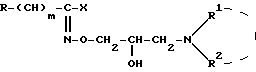
где m 0 или 2;
X атом галогена;
R фенил, который может быть замещен C1 - C4-алкоксигруппой, или пиридил;
R1 атом водорода или C1 C5-алкил;
R2 C1 C5-алкил, C5 - C7-циклоалкил;
или R1 и R2, взятые вместе с атомом азота, к которому они присоединены, образуют гетероциклический радикал, выбранный из группы, содержащей пиридинил, пиперидинил, который может быть замещен двумя C1 C4-алкильными группами, пирролидинил, морфолинил, пиперазинил, замещенный C1 C4-алкильной группы и 1,2,3,4-тетрагидроизохинолинил, замещенный двумя C1 C4- алкоксигруппами;
и их кислотно-аддитивные соли.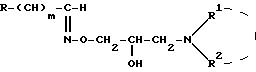
где R, R1 и R2 имеют вышеуказанные значения, подвергают обработке галоидирующим агентом и полученное при этом соединение общей формулы VIII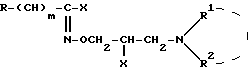
где m, X, R, R1 и R2 имеют вышеуказанные значения, подвергают гидролизу в водно-щелочной среде с последующим выделением целевого продукта в форме основания или в виде кислотно-аддитивной соли.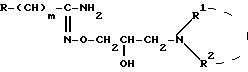
где m, R, R1 и R2 имеют вышеуказанные значения, диазотируют в присутствии нитрита натрия и галоидводородной кислоты с последующим разложением полученной при этом соли диазония и выделением целевого продукта в форме основания или в виде кислотно-аддитивной соли.
| Патент США N 4308399, кл | |||
| Способ восстановления хромовой кислоты, в частности для получения хромовых квасцов | 1921 |
|
SU7A1 |
| Патент США N 4323688, кл | |||
| Способ восстановления хромовой кислоты, в частности для получения хромовых квасцов | 1921 |
|
SU7A1 |
Авторы
Даты
1997-10-20—Публикация
1989-10-19—Подача