Изобретение относится к новым гетероциклическим производным и их фармацевтическому использованию. Более конкретно, данное изобретение относится к новым гетероциклическим производным, имеющим индолиновое кольцо, индольное кольцо или тетрагидрохинолиновое кольцо, которые обладают ингибирующей активностью в отношении ацил-CoA: холестерин ацилтрансферазы (далее ACAT) и ингибирующей активностью в отношении перокисления жиров, и их терапевтическому использованию.
Уровень техники
Хорошо известно, что атеросклероз является крайне важным фактором, приводящим к различным нарушениям кровообращения, поэтому были проведены активные исследования в попытке достигнуть подавления развития или регрессии артериального склероза. В частности, несмотря на то, что получено подтверждение полезности некоторых фармацевтических агентов, которые снижают уровень холестерина в крови или на стенках артерий, идеальный фармацевтический агент, демонстрирующий положительный клинический эффект при отсутствии побочных эффектов, не получен. В качестве фармацевтического агента, который эффективно предотвращает или лечит артериальные склерозы, желателен фармацевтический агент, который непосредственно ингибирует отложение холестерина на стенках артерии, и исследования в этой области развиваются. Однако идеальный фармацевтический агент до сих пор не открыт.
В последнее время выяснили, что холестерин в крови накапливается на артериальных стенках в форме сложного эфира и это значительно развивает атеросклероз. Снижение уровня холестерина в крови приводит к снижению накопления сложного эфира холестерина на стенках артерии, что эффективно для подавления развития и снижения риска атеросклероза.
Пищевой холестерин превращается в сложный эфир в слизистой мембране тонкой кишки и попадает в кровь в виде хиломикрона. Известно, что ACAT играет важную роль в генерировании сложного эфира холестерина в слизистой мембране тонкой кишки. Таким образом, если этерификация холестерина может быть подавлена с помощью ингибирования ACAT в слизистой мембране тонкой кишки, абсорбция холестерина слизистой мембраной и в крови вероятно может быть предотвращена, что, в конечном результате, ведет к снижению уровня холестерина в крови.
На стенках артерии ACAT этерифицирует холестерин и вызывает накопление сложного эфира холестерина. Полагают, что ингибирование ACAT на стенках артерии позволит эффективно подавлять накопление сложного эфира холестерина. Исходя из вышеизложенного, можно сделать вывод, что ингибитор ACAT может явиться эффективным лекарственным препаратом для лечения гиперлипемии и атеросклероза в результате снижения абсорбции холестерина в тонкой кишке и накопления холестерина на стенках артерии.
Как было опубликовано, обычно такими ингибиторами ACAT могут быть, например, амид и производные мочевины [J. Med. Chem., 29: 1131 (1986), Japanese Patent Unexamined Publication Nos. 117651/1990, 7259/1990, 234839/1992, 327564/1992 и 32666/1993]. Тем не менее, получение и фармакологические исследования этих соединений показали, что они далеки от удовлетворительных.
В то же время, гиперокисление липопротеинов низкой плотности (ЛНП) также несет значительную ответственность за внутриклеточное включение холестерина, накопленного в виде его сложного эфира на стенках артерии. В дополнение, известно, что гиперокисление жиров в живом организме тесно связано с появлением атеросклероза и ишемической болезни сердечных сосудов и сосудов головного мозга.
Соответственно, соединение, имеющее как ACAT-ингибирующую активность, так и активность, ингибирующую перокислением жиров, является крайне полезным в качестве фармацевтического продукта, поскольку оно эффективно снижает накопление сложного эфира холестерина на стенках артерии и ингибирует перокисление жиров в живых организмах, посредством этого предотвращая и вылечивая различные болезни сосудов, возникших по описанным выше причинам.
Следовательно, объектом настоящего изобретения является соединение, обладающее ACAT-ингибирующей активностью и активностью, ингибирующей перокисление жиров, а также его фармацевтическое использование как, в частности, ACAT-ингибитора и ингибитора перокисления жиров.
Подробное описание изобретения
Были проведены интенсивные исследования для получения упомянутого выше объекта и обнаружено, что некоторые гетероциклические производные, имеющие индолиновое кольцо, индольное кольцо и тетрагидрохинолиновое кольцо, имеют превосходную растворимость в воде по сравнению с общеизвестными ингибиторами ACAT и обладают активностью, ингибирующей перокисление жиров в дополнение к сильной ACAT-ингибирующей активности, и, таким образом, указанное соединение обеспечивает превосходную пероральную абсорбцию, сильный антигиперлипемический эффект и антиатеросклеротический эффект, что привело к созданию настоящего изобретения.
Таким образом, настоящее изобретение относится к гетероциклическим производным формулы (I)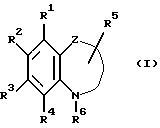
где один из R1, R2 и R3 является гидрокси, карбокси, алкоксикарбонилом, группой формулы -NR9R10, где R9 и R10 каждый независимо является атомом водорода, или низшим алкилом, или алкилом, или алкенилом, замещенным гидрокси, кислотной группой, алкоксикарбонилом или группой формулы -NR9R10, где R9 и R10 каждый независимо является атомом водорода или низшим алкилом и два другие каждый независимо является атомом водорода, низшим алкилом или низшим алкокси;
или R3 либо R4 являются группой формулы -NHCOR7, где R7 является алкилом, алкоксиалкилом, алкилтиоалкилом, циклоалкилом, циклоалкилалкилом, арилом, арилалкилом или группой формулы -NHR8, где R8 является алкилом, циклоалкилом, циклоалкилалкилом, арилом или арилалкилом и другие являются атомом водорода, низшим алкилом или низшим алкокси; R6 является алкилом, алкенилом, алкоксиалкилом, алкилтиоалкилом, циклоалкилом, циклоалкилалкилом или арилалкилом; и
Z является связывающей группой, образующей 5- или 6-членное кольцо вместе с атомом азота, замещенным R6, атомом углерода бензольного кольца, к которому указанный атом азота присоединен и атомом углерода, соседним с указанным атомом углерода,
и их фармацевтически приемлемые соли.
Данное изобретение также относится к фармацевтическим композициям, ACAT ингибиторам и ингибиторам перокисления жиров, содержащим указанное выше гетероциклическое соединение или его фармацевтически приемлемую соль.
В данном описании, каждый символ означает следующее.
Низший алкил в определении R1, R1a, R1b, R1c, R2, R2c, R3, R3a, R3b, R3c, R4, R4c, R5, R5c, R9, R9c, R10 и R10c может иметь линейную и разветвленную структуру и от 1 до 6 атомов углерода. Примеры включают метил, этил, пропил, изопропил, бутил, изобутил, втор-бутил, трет-бутил, пентил, изопентил, неопентилгексил и подобные.
Низший алкокси в определении R1, R1b, R1c, R2, R2c, R3, R3b, R3c, R4, R4c, R5 и R5c может иметь линейную или разветвленную структуру и от 1 до 6 атомов углерода. Примеры: метокси, этокси, пропокси, изопропокси, бутокси, изобутокси, втор-бутокси, трет-бутокси, пентилокси, изопентилокси, неопентилокси, гексилокси и подобные.
Алкил в определении R6, R6a, R6b, R6c, R7, R7a, R7b, R7c, R8, R8b и R8c может иметь линейную или разветвленную структуру и предпочтительно от 1 до 20 атомов углерода. Примеры: метил, этил, пропил, изопропил, бутил, изобутил, втор-бутил, трет-бутил, пентил, изопентил, неопентил, гексил, гептил, октил, нонил, децил, ундецил, додецил, тридецил, тетрадецил, пентадецил, гексадецил, гептадецил, нонадецил, изоцил, 1,1-диметилпропил, 1,1-диметилбутил, 1,1-диметилгексил, 1,1-диметилгептил, 3,3-диметилбутил, 4,4-диметилбутил и подобные.
В алкоксиалкиле в определении R6, R6b, R6c, R7, R7b и R7c алкоксильный фрагмент предпочтительно имеет от 1 до 6 атомов углерода и алкильный фрагмент предпочтительно имеет от 1 до 6 атомов углерода. Примеры алкоксиалкилов включают этоксибутил, этоксигексил, бутоксибутил, бутоксигексил, гексилоксибутил, гексилоксигексил и подобные.
В алкилтиоалкиле в определении R6, R6b, R6c, R7, R7b и R7c оба алкильных фрагмента предпочтительно имеют от 1 до 6 атомов углерода. Примеры алкилтиоалкилов включают этилтиоэтил, этилтиогексил, бутилтиобутил, бутилтиогексил, гексилтиобутил, гексилтиогексил и подобные.
Циклоалкил в определении R6, R6a, R6b, R6c, R7, R7a, R7b, R7c, R8, R8b и R8c предпочтительно имеет от 3 до 8 атомов углерода. Примеры включают циклопропил, циклобутил, циклопентил, циклогексил, циклогептил, циклооктил и подобные.
В циклоалкиле в определении R6, R6a, R6b, R6c, R7, R7a, R7b, R7c, R8, R8b и R8c циклоалкильный фрагмент предпочтительно имеет от 3 до 8 атомов углерода и алкильный фрагмент предпочтительно имеет от 1 до 3 атомов углерода. Примеры циклоалкилалкилов включают циклопропилметил, циклобутилметил, циклопентилметил, циклогексилметил, циклопропилэтил, циклопропилпропил, циклогептилметил, циклооктилметил и подобные.
Примеры арила в определении R7, R7b, R7c, R8, R8b и R8c включают фенил, нафтил и подобные.
Арилалкил в определении R6, R6b, R6c, R7, R7b, R7c, R8, R8b и R8c имеет упомянутый ранее арильный фрагмент и его алкильный фрагмент предпочтительно имеет от 1 до 4 атомов углерода. Примеры арилалкилов включают бензил, 1-фенилэтил, 2-фенилэтил, 1-фенилпропил, 2-фенилпропил, 3-фенилпропил и подобные.
Алкенил в определении R6, R6b и R6c может иметь линейную или разветвленную структуру и предпочтительно от 3 до 12 атомов углерода. Примеры включают пропенил, изопропенил, бутенил, пентенил, гексенил, гептенил, октенил, 3,3-диметил-2-пропенил и подобные.
Кислотная группа в определении R1, R2 и R5 представлена карбоксигруппой, группой сульфоновой кислоты, группой фосфоновой кислоты и подобными.
Примеры алкоксикарбонила в определении R1, R1c, R2, R2b, R2c, R5 и R5c включают метоксикарбонил, этоксикарбонил, пропоксикарбонил, изопропоксикарбонил, бутоксикарбонил, изобутоксикарбонил, втор-бутоксикарбонил, трет-бутоксикарбонил и подобные.
Алкил, замещенный в R1, R2, R2a, R2b и R5, может иметь линейную или разветвленную структуру и предпочтительно от 1 до 8 атомов углерода. Примеры включают метил, этил, пропил, бутил, пентил, гексил, 1,1-диметилэтил, 2,2-диметилпропил и подобные. Примеры замещенного алкила включают гидроксиметил, гидроксиэтил, карбоксиметил, карбоксиэтил, карбоксипропил, этоксикарбонилметил, диметиламинометил, диметиламиноэтил, сульфометил, фосфонметил и подобные.
Алкенил, замещенный в R1, R2 и R5, может иметь линейную или разветвленную структуру и предпочтительно от 2 до 8 атомов углерода. Примеры включают винил, пропенил, изопропенил, бутенил, пентенил, гексенил, гептенил, октенил, 3,3-диметил-2-пропенил и подобные. Примеры замещенного алкенила включают карбоксивинил, карбоксипропенил, гидроксипропенил и подобные.
Z предпочтительно представляет собой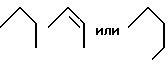
В соединениях настоящего изобретения если один из R1, R2 и R5 является алкилом или алкенилом, замещенным гидрокси, кислотной группой, алкоксикарбонилом или группой формулы -NR9R10, R9 и R10 каждый независимо является атомом водорода или низшим алкилом, и два другие независимо являются атомами водорода, низшим алкилом или низшим алкокси, соединение может быть (а) индолином или производным индола, или (б) производным тетрагидрохинолина.
если один из R1, R2 и R5 является алкилом или алкенилом, замещенным гидрокси, кислотной группой, алкоксикарбонилом или группой формулы -NR9R10, R9 и R10 каждый независимо является атомом водорода или низшим алкилом, и два другие независимо являются атомами водорода, низшим алкилом или низшим алкокси, соединение может быть (а) индолином или производным индола, или (б) производным тетрагидрохинолина.
(А) Когда соединение данного изобретения представляет собой индолин или производное индола, предпочтительным соединением является то, которое имеет представленную выше формулу (I), где один из R1, R2 и R5 является алкилом, замещенным гидрокси, карбокси, алкоксикарбонилом или группой формулы -NR9R10, где R9 и R10 каждый независимо является низшим алкилом, и два другие независимо являются атомом водорода, низшим алкилом или низшим алкокси; либо R3, либо R4 является группой формулы -NHCOR7, где R7 является алкилом, алкоксиалкилом, алкилтиоалкилом, циклоалкилом, циклоалкилалкилом, арилом, арилалкилом или группой формулы -NR8, где R8 является алкилом и другие являются атомом водорода, низшим алкилом или низшим алкокси; и R6 такой, как определен выше.
Более предпочтительным соединением указанной выше формулы (I) является то, где R1 и R3 каждый независимо представляет атом водорода, низший алкил или низший алкокси; или R2, либо R5 является алкилом, замещенным гидрокси, карбокси, алкоксикарбонилом или группой формулы -NR9R10, где R9 и R10 каждый независимо представляет низший алкил, и другой является атомом водорода, низшим алкилом или низшим алкокси; R4 является группой формулы -NHCOR7, где R7 является алкилом, алкоксиалкилом, алкилтиоалкилом, циклоалкилом, циклоалкилалкилом, арилом, арилалкилом или группой формулы -NR8, где R8 является алкилом; и R6 такой, как определен выше.
Еще более предпочтительным является соединение, имеющее упомянутую выше формулу (I), где R1 и R3 каждый независимо является атомом водорода, низшим алкилом или низшим алкокси; или R2, либо R5 является алкилом, замещенным гидрокси, карбокси, алкоксикарбонилом или группой формулы - NR9R10, где R9 и R10 каждый независимо представляет низший алкил, и другой является атомом водорода; R4 является группой формулы -NHCOR7, где R7 является алкилом, алкоксиалкилом, алкилтиоалкилом, циклоалкилом, циклоалкилалкилом, арилом, арилалкилом или группой формулы -NR8, где R8 является алкилом; и R6 такой, как определен выше.
Еще более предпочтительным является соединение, имеющее упомянутую выше формулу (I), где R1 и R3 каждый независимо является атомом водорода или низшим алкилом; или R2, либо R5 является алкилом, замещенным гидрокси, карбокси, алкоксикарбонилом или группой формулы -NR9R10, где R9 и R10 каждый независимо представляет низший алкил, и другой является атомом водорода; R4 является группой формулы -NHCOR7, где R7 является алкилом, циклоалкилом или циклоалкилалкилом; и R6 является алкилом, циклоалкилом или циклоалкилалкилом.
Еще более предпочтительным является соединение, имеющее упомянутую выше формулу (I), где R1 и R2 каждый независимо является атомом водорода или низшим алкилом; R2 является алкилом, замещенным гидрокси, карбокси, алкоксикарбонилом или группой формулы -NR9R10, где R9 и R10 каждый независимо представляет низший алкил, и R5 является атомом водорода; R4 является группой формулы -NHCOR7, где R7 является алкилом, циклоалкилом или циклоалкилалкилом; и R7 является алкилом, циклоалкилом или циклоалкилалкилом.
Еще более предпочтительным соединением является соединение следующей формулы (IIa):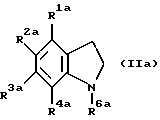
где R1a является атомом водорода или низшим алкилом; R3a является низшим алкилом; R2a является алкилом, замещенным гидрокси или карбокси; R4a является группой формулы -NHCOR7a, где R7a является алкилом, циклоалкилом или циклоалкилалкилом; и R6a является алкилом, циклоалкилом или циклоалкилалкилом.
Еще более предпочтительным соединением является соединение формулы (IIа), где R1a является атомом водорода или низшим алкилом; R3a является низшим алкилом; R2a является алкилом, замещенным гидрокси или карбокси; R4a является группой формулы -NHCOR7a, где R7a является алкилом; и R6a является алкилом.
Примеры наиболее предпочтительных соединений включают N-(1-гексил-5-карбоксиметил- 4,6-диметилиндолин-7-ил)-2,2-диметилпропанамид, N-(1-гептил-5-карбоксиметил-4,6-диметилиндолин-7-ил)-2,2-диметилпропанамид, N-(1-октил-5-карбоксиметил-4,6-диметилиндолин-7-ил)-2,2-диметилпропанамид, N-(1-нонил-5-карбоксиметил-4,6-диметилиндолин-7-ил)-2,2-диметилпропанамид, N-(1-децил-5-карбоксиметил-4,6-диметилиндолин-7-ил)-2,2-диметилпропанамид, N-(1-ундецил-5-карбоксиметил-4,6-диметилиндолин-7-ил)-2,2-диметилпропанамид, N-(1-додецил-5-карбоксиметил-4,6-диметилиндолин-7-ил)-2,2-диметилпропанамид, N-(1-гексил-5-гидроксиметил-6-метилиндолин-7-ил)-2,2-диметилпропанамид, N-(1-гексил-5-гидроксиметил-4,6-диметилиндолин-7-ил)-2,2-диметилпропанамид, N-(1-гептил-5-гидроксиметил-6-метилиндолин-7-ил)-2,2-диметилпропанамид, N-(1-гептил-5-гидроксиметил-4,6-диметилиндолин-7-ил)-2,2-диметилпропанамид, N-(1-октил-5-гидроксиметил-6-метилиндолин-7-ил)-2,2-диметилпропанамид, N-(1-октил-5-гидроксиметил-4,6-диметилиндолин-7-ил)-2,2-диметилпропанамид и подобные, и их фармацевтически приемлемые соли.
(Б) Если соединение данного изобретения представляют собой производное тетрагидрохинолина, предпочтительны соединения формулы (IIb)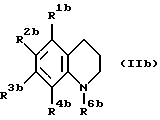
где R1b и R3b каждый независимо является атомом водорода, низшим алкилом или низшим алкокси; R2b является алкилом, замещенным гидрокси, карбокси или алкоксикарбонилом; R4b является группой формулы -NHCOR7b, где R7b является алкилом, алкоксиалкилом, алкилтиоалкилом, циклоалкилом, циклоалкилалкилом, арилом, арилалкилом или группой формулы -NHR8b, где R8b является алкилом, циклоалкилом, циклоалкилалкилом, арилом или арилалкилом; и R6b является алкилом, алкенилом, алкоксиалкилом, алкилтиоалкилом, циклоалкилом, циклоалкилалкилом или арилалкилом.
Еще более предпочтительно соединение формулы (IIb), где R1b и R3b каждый независимо является низшим алкилом или низшим алкокси; R2b является алкилом, замещенным гидрокси, карбокси или алкоксикарбонилом; R4b является группой формулы -NHCOR7b, где R7b является алкилом, циклоалкилалкилом, арилалкилом или группой формулы -NHR8b, где R8b является алкилом; и R6b является алкилом, алкоксиалкилом, алкилтиоалкилом или циклоалкилалкилом.
Еще более предпочтительно соединение формулы (IIb), где R1b и R3b каждый независимо является низшим алкилом; R2b является алкилом, замещенным гидрокси или карбокси; R4b является группой формулы -NHCOR7b, где R7b является алкилом; и R6b является алкилом.
Примеры наиболее предпочтительных соединений включают N-(1-гексил-6-карбоксиметил-5,7-диметил-1,2,3,4-тетрагидрохинолин-8-ил)-2,2- диметилпропанамид, N-(1-гептил-6-карбоксиметил-5,7-диметил-1,2,3,4-тетрагидрохинолин-8-ил)-2,2- диметилпропанамид, N-(1-октил-6-карбоксиметил-5,7-диметил-1,2,3,4-тетрагидрохинолин-8-ил)-2,2- диметилпропанамид, N-(1-нонил-6-карбоксиметил-5,7-диметил-1,2,3,4-тетрагидрохинолин-8-ил)-2,2- диметилпропанамид, N-(1-децил-6-карбоксиметил-5,7-диметил-1,2,3,4-тетрагидрохинолин-8-ил)-2,2- диметилпропанамид, N-(1-гексил-6-гидроксиметил-5,7-диметил-1,2,3,4-тетрагидрохинолин-8-ил)-2,2- диметилпропанамид, N-(1-гептил-6-гидроксиметил-5,7-диметил-1,2,3,4-тетрагидрохинолин-8-ил)-2,2- диметилпропанамид, N-(1-октил-6-гидрокси-метил-5,7-диметил-1,2,3,4-тетрагидрохинолин-8-ил)-2,2- диметилпропанамид, N-(1-нонил-6-гидроксиметил-5,7-диметил-1,2,3,4-тетрагидрохинолин-8-ил)-2,2- диметилпропанамид, N-(1-децил-6-гидроксиметил-5,7-диметил-1,2,3,4-тетрагидрохинолин-8-ил)-2,2- диметилпропанамид и подобные, и их фармацевтически приемлемые соли.
 . Если соединение настоящего изобретения является соединением, в котором один из R1, R2 и R5 является гидрокси, карбокси, алкоксикарбонил или группой формулы -NR9R10, где R9 и R10 каждый независимо является атомом водорода или низшим алкилом, и другие два независимо являются атомом водорода, низшим алкилом или низшим алкокси, предпочтительно соединение следующей формулы (IIc).
. Если соединение настоящего изобретения является соединением, в котором один из R1, R2 и R5 является гидрокси, карбокси, алкоксикарбонил или группой формулы -NR9R10, где R9 и R10 каждый независимо является атомом водорода или низшим алкилом, и другие два независимо являются атомом водорода, низшим алкилом или низшим алкокси, предпочтительно соединение следующей формулы (IIc).
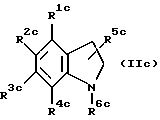
где один из R1c, R2c и R5c является гидрокси, карбокси, алкоксикарбонилом или группой формулы -NR9cR10c, где R9c и R10c каждый независимо является атомом водорода или низшим алкилом, и другие два каждый независимо является атомом водорода, низшим алкилом или низшим алкокси; либо R3c, либо R4c является группой формулы -NHCOR7c, где R7c является алкилом, алкоксиалкилом, алкилтиоалкилом, циклоалкилом, циклоалкилалкилом, арилом, арилалкилом или группой формулы -NHR8c, где R8c является алкилом, циклоалкилом, циклоалкилалкилом, арилом или арилалкилом, и другой является атомом водорода, низшим алкилом или низшим алкокси; и R6c является алкилом, алкенилом, алкоксиалкилом, алкилтиоалкилом, циклоалкилом, циклоалкилалкилом или арилалкилом.
Более предпочтительно соединение указанной выше формулы (IIc), где R1c и R3c каждый независимо является атомом водорода, низшим алкилом или низшим алкокси; R2c является карбокси; R4c является группой формулы -NHCOR7c, где R7c является алкилом, циклоалкилом или циклоалкилалкилом; R5c является атомом водорода; и R6c является алкилом, циклоалкилом или циклоалкилалкилом.
Еще более предпочтительным соединением указанной выше формулы (IIc) является соединение, где R1c является атомом водорода или низшим алкилом; R3c является низшим алкилом; R2c является карбокси; R4c является группой формулы -NHCOR7c, где R7c является алкилом; R5c является атомом водорода; и R6c является алкилом.
Примерами наиболее предпочтительных соединений являются N-(1-гексил-5-карбокси-6- метилиндолин-7-ил)-2,2-диметилпропанамид, N-(1-октил-5-карбокси-6-метилиндолин-7-ил)-2,2-диметилпропанамид, N-(1-децил-5-карбокси-6-метилиндолин-7-ил)-2,2-диметилпропанамид, N-(1-гексил-5-карбокси-4,6-диметилиндолин-7-ил)-2,2-диметилпропанамид, N-(1-октил-5-карбокси-4,6-диметилиндолин-7-ил)-2,2-диметилпропанамид, N-(1-децил-5-карбокси-4,6-диметилиндолин-7-ил)-2,2-диметилпропанамид и подобные, и их фармацевтически приемлемые соли.
Соединение (I) может образовывать фармацевтически приемлемые соли. Если соединение (I) имеет основную группу, оно может образовывать кислотно-аддитивные соли. Природа кислоты, которая может образовывать кислотно-аддитивные соли, не имеет особенных ограничений, если эта кислота может образовывать соли с основным фрагментом и является фармацевтически приемлемой кислотой. Примеры таких кислот включают неорганические кислоты, такие как соляная кислота, серная кислота, фосфорная кислота, азотная кислота и подобные, и органические кислоты, такие как щавелевая кислота, фумаровая кислота, малеиновая кислота, лимонная кислота, винная кислота, метансульфоновая кислота, толуолсульфоновая кислота и подобные.
Если соединение (I) имеет кислотную группу, такую как карбокси, оно может образовывать, например, соли щелочных металлов, такие как соль натрия, соль калия и подобные; соли щелочноземельных металлов, такие как соль кальция, соль магния и подобные; и соли органических оснований, такие как триэтиламиновая соль, дициклогексиламиновая соль, пиридиновая соль и подобные.
Соединение (I) настоящего изобретения и его фармацевтически приемлемые соли могут быть получены по любому из методов 1 - 7, представленных в конце описания.
В каждой из представленных выше формул R6, R7, R8, R9 и R10 принимают как значения, определенные выше; R11 и R12 каждый независимо представляет атом водорода, низший алкил или низший алкокси; R13 является аминозащитной группой; R14 является алкилом, алкоксиалкилом, алкилтиоалкилом, циклоалкилом, циклоалкилалкилом, арилом или арилалкилом; R15 является алкилом или алкенилом, замещенным атомом галогена; R16 является алкилом или алкенилом, замещенным гидрокси, защищенным гидрокси, кислотной группой, защищенной кислотной группой, алкоксикарбонилом или -NR18R19, где R18 и R19 каждый независимо представляет атом водорода, низший алкил или аминозащитная группа; R17 является алкилом или алкенилом, замещенным гидрокси, кислотной группой, алкоксикарбонилом или -NR9R10; R20 является защищенным карбокси; R21 является защищенным гидрокси; и R22 является - NR18R19, где R18 и R19 такие, как определены выше.
Аминозащитная группа у R13, R18 и R19 является, например, формилом, ацетилом, монохлорацетилом, дихлорацетилом, трифторацетилом, метоксикарбонилом, этоксикарбонилом, бензилоксикарбонилом, п-нитробензилоксикарбонилом, дифенилметилоксикарбонилом, метоксиметилоксикарбонилом, 2,2,2-трихлорэтоксикарбонилом, триметилсилилом, 2-метилсульфонилэтилоксикарбонилом, трет-бутоксикарбонилом или тритилом.
Гидроксизащитная группа у R16 и R21 является, например, формилом, ацетилом, монохлорацетилом, дихлорацетилом, трифторацетилом, метоксикарбонилом, этоксикарбонилом, бензилоксикарбонилом, 2,2,2-трихлорэтоксикарбонилом, бензоилом, тритилом, тетрагидропиранилом, триметилсилилом или подобными.
Кислотная защитная группа у R16 и R20 является, если она карбоксизащитная группа, например, метилом, этилом, н-пропилом, изопропилом, н-бутилом, втор-бутилом, трет-бутилом, трет-амилом, бензилом, п-нитробензилом, п-метоксибензилом, бензгидрилом, п-нитрофенилом, метоксиметилом, этоксиметилом, бензилоксиметилом, метилтиометилом, тритилом, 2,2,2-трихлорэтилом, триметилсилилом, дифенилметоксибензолсульфонилметилом, диметиламиноэтилом и подобными.
Упомянутые выше защитные группы могут быть удалены по методике, известной per se, и методика для их удаления может быть определена в зависимости от типа защитной группы. Примерами таких методик является разложение кислотой (например, такой кислотой, как соляная кислота, трифторуксусная кислота и подобные, для формила, трет-бутоксикарбонила, тритила, тетрагидропиранила и подобных); разложение основанием (например, таким основанием, как гидроксид натрия, гидроксид калия, карбонат натрия, бикарбонат натрия и подобные, для ацетила, дихлорацетила, трифторацетила и подобных); и каталитическое восстановление (например, разложение палладием на угле и подобными для бензила, бензилоксикарбонила и подобных). Методики получения целевых соединений данного изобретения и исходных соединений далее описаны подробно.
Способ получения 1
Соединение (IV) может быть получено восстановлением соединения (III) [J. Eric Nordlander, et al., J. Org. Chem., 46, 778-782 (1981), Robin D. Clark, et al., Heterocycle, 22, 195-221 (1984), Vernon H. Brown, et al., J. Heterocycle. Chem., 6(4), 539-543 (1969)] введением индолиновой структуры, защиты аминогруппы, введением нитрогруппы в бензольное кольцо по методике, известной per se, и восстановлением нитрогруппы, используя катализатор, такой как палладий на угле.
Соединение (VII) может быть получено взаимодействием соединения (IV) с соединением (V) или его реакционноспособными производными по карбоксильной группе, или с соединением (VI).
Указанную реакцию обычно проводят в инертном растворителе.
Примерами инертных растворителей являются ацетон, диоксан, ацетонитрил, хлороформ, бензол, метиленхлорид, этиленхлорид, тетрагидрофуран, этилацетат, N,N-диметилформамид, пиридин, вода и смешанные растворители.
Кроме того, могут быть использованы основания, такие как триэтиламин, пиридин, 4-диметиламинопиридин, карбонат калия и подобные.
Температура реакции обычно составляет -10-160oC, предпочтительно 0-60oC, и время реакции обычно составляет от 30 мин до 10 часов.
Соединение (V) может быть использовано в данной реакции в виде свободной карбоновой кислоты или ее реакционноспособного производного, и оба типа включены в объем настоящего изобретения. То есть в данной реакции соединение используют в виде свободной кислоты или соли, такой как натриевая, калиевая, кальциевая, триэтиламиновая, пиридиновая и подобные, или в виде ее реакционноспособного производного, такого как его галогенангидриды (например, хлорангидрид, бромангидрид и подобные), ангидрид кислоты, смешанный ангидрид кислот [например, замещенная фосфорная кислота (диалкилфосфат и подобные) алкилкарбонат (моноэтилкарбонат и подобные)], активный амид (амид с имидазолом и подобные), сложный эфир (цианометиловый эфир, 4-нитрофениловый эфир и т.д.), и подобных.
Если соединение (V) используют в данной реакции в виде свободной кислоты или соли, предпочтительно использовать конденсирующий агент. Примерами конденсирующих агентов являются дегидратирующие агенты, такие как N,N'-дизамещенные карбодиимиды (например, N,N'-дициклогексилкарбодиимид); карбодиимидные соединения (например, 1-этил-3-(3'-диметиламинопропил)карбодиимид, N-циклогексил-N'-морфолинэтил карбодиимид и N-циклогексил-N'-(4-диэтиламиноциклогексил)карбодиимид); соединения азолида (например, N,N'-карбонилдиимидазол и N, N'-тионилдиимидазол); и подобные. Если используют данные конденсирующие агенты, считают, что реакция происходит через образование реакционноспособных производных карбоновой кислоты. Соединение (VIII) может быть получено галогеналкилированием соединения (VII) [r.c.Fuson et al., Org. React., 1, 63, (1969), G.A.OIah et al., "Friedel Crafts and Related Reactions" Vol. 2. 659 (1964)].
Соединение (IX) может быть получено превращением галогеналкила соединения (VIII) в гидрокси, кислотную группу, такую как карбокси или группу формулы -NR9R10, с помощью реакции замещения, известной per se, и, при необходимости, введением соответствующей защитной группы.
Соединение (XII) может быть получено удалением аминозащитной группы у R13 соединения (IX) по методике, известной per se, с получением соединения (X) и N-алкилированием, используя соединение (XI).
Указанное N-алкилирование обычно можно проводить в инертном растворителе.
Примерами инертных растворителей являются ацетон, диоксан, ацетонитрил, хлороформ, бензол, метиленхлорид, этиленхлорид, тетрагидрофуран, этилацетат, N,N-диметилформамид, пиридин, вода и смешанные растворители.
В дополнение, могут быть использованы основания, такие как триэтиламин, пиридин, 4-диметиламинопиридин, карбонат калия и подобные.
Температура реакции обычно составляет -10-100oC, предпочтительно 0-60oC, время реакции обычно составляет от 30 мин до 10 часов.
Соединение (Ia) может быть получено удалением защитной группы у R16 соединения (XII) по методике, известной per se.
Способ получения 2
Соединение (XIII) может быть получено гидроксиалкилированием соединения (III) [Adolf H. Philipp., et al., J. Med. Chem., 19(3), 391-395 (1976)], восстановлением, введением индолиновой структуры, защитной аминогруппы и галогенированием гидрокси.
Соединение (XIV) может быть получено из соединения (XIII) по методике получения соединения (IX) из соединения (VIII), как описано в способе получения 1.
Соединение (XV) может быть получено из соединения (XIV) введением нитрогруппы и восстановлением нитрогруппы по методике, известной per se.
Соединение (XVI) может быть получено из соединения (XV) по способу получения соединения (VII) из соединения (IV), как описано в способе получения 1.
Соединение (Ib) может быть получено из соединения (XVI) через соединение (XVII) и соединение (XIII) по методике получения соединения (Ia) из соединения (IX), как описано в способе получения 1.
Способ получения 3
Соединение (XIX) может быть получено окислением соединения (X) по методике, известной per se (например, окисление с использованием хлоранила, палладия на угле и подобных).
Соединение (Ic) может быть получено из соединения (XIX) через соединение (XX) по методике получения соединения (Ia) из соединения (X), как описано в способе получения 1.
Способ получения 4
Соединение (XXI) может быть получено восстановлением производного 2,3-дигидрохинолин-4-она [J. R Merchant, et al., J. Chem. Soc. Perkin 1, 932-935 (1972)], используя восстанавливающий агент, такой как лития алюмогидрохлорид алюминия и подобные.
Соединение (XXIII) может быть получено из соединения (XXII) защитой аминогруппы соединения (XXI) по методике, известной per se, с получением соединения (XXII) и по методике получения соединения (VIII) из соединения (VII), как описано в способе получения 1.
Соединение (XXV) может быть получено из соединения (XXIII) через соединение (XXIV) по методике получения соединения (XII) из соединения (VIII) через соединение (IX) и соединение (X), как описано в способе получения 1.
Соединение (XXVI) может быть получено из соединения (XXV) введением нитрогруппы и восстановлением нитрогруппы по методике, известной per se.
Соединение (XXVII) может быть получено из соединения (XXVI) по методике получения соединения (VII) из соединения (IV), как описано в способе получения 1.
Соединение (Id) может быть получено из соединения (XXVII) по методике получения соединения (Ia) из соединения (XII), как описано в способе получения 1.
Способ получения 5
Соединение (XXIX) может быть получено из соединения (XXVIII) [W.G. Gall, et. al. , J. Org. Chem., 20, 1538 (1955)] по методике получения соединения (XII) из соединения (X), как описано в способе получения 1.
Соединение (XXX) может быть получено превращением галогена соединения (XXIX) в цианогруппу по методике, известной per se, гидролизом цианогруппы и введением защитной группы в полученную карбоксигруппу.
Соединение (XXXI) может быть получено из соединения (XXX) восстановлением нитрогруппы соединения (XXX) по методике, известной per se, и по методике получения соединения (VII), как описано в способе получения 1.
Соединение (Ie) может быть получено удалением защитной группы у R20 соединения (XXXI) по методике, известной per se.
Способ получения 6
Соединение (XXXII) может быть получено превращением аминогруппы соединения (IV) в гидроксигруппу по методике, известной per se, и введением защитной группы в гидроксигруппу.
Соединение (XXXIII) может быть получено из соединения (XXXII) введением нитрогруппы и восстановлением нитрогруппы по методике, известной per se.
Соединение (XXXIV) может быть получено из соединения (XXXIII) по методике получения соединения (VII) из соединения (IV), как описано в способе получения 1.
Соединение (XXXV) может быть получено из соединения (XXXIV) по методике получения соединения (XII) из соединения (IX) через соединение (X), как описано в способе получения 1.
Соединение (If) может быть получено удалением защитной группы у R21 соединения (XXXV) по методике известной per se.
Способ получения 7
Соединение (XXXVI) может быть получено алкилированием аминогруппы или введением защитной группы аминогруппы соединения (IV) по методике, известной per se.
Соединение (XXXVII) может быть получено из соединения (XXXVI) введением нитрогруппы и восстановлением нитрогруппы по методике, известной per se.
Соединение (XXXVIII) может быть получено из соединения (XXXVII) по методике получения соединения (VII) из соединения (IV), как описано в способе получения 1.
Соединение (XXXIX) может быть получено из соединения (XXXVIII) по методике получения соединения (XII) из соединения (IX) через соединение (X), как описано в способе получения 1.
Соединение (Ig) может быть получено удалением защитной группы у R22 соединения (XXXIX) по методике, известной per se.
Соединение (I) настоящего изобретения, полученное по вышеуказанным методикам, может быть очищено по известной методике, такой как хроматография и перекристаллизация.
Указанное соединение (I) может быть превращено в фармацевтически приемлемую соль по методике известной per se.
Фармацевтическая композиция, содержащая соединение (I) настоящего изобретения или его фармацевтически приемлемую соль, может дополнительно содержать добавки. Примеры добавок включают наполнители (например, крахмал, лактозу, сахар, карбонат кальция и фосфат кальция), связывающие вещества (например, крахмал, аравийскую камедь, карбоксиметилцеллюлозу, гидроксипропилцеллюлозу и кристаллическую целлюлозу), смазывающие агенты (например, стеарат магния и тальк) и разрыхляющие агенты (например, карбоксиметилцеллюлоза кальция и тальк) и подобные.
Указанные выше ингредиенты смешивают и из смеси готовят готовые формы для перорального введения, такие как капсулы, таблетки, мелкие гранулы, гранулы и сухие сиропы, или готовые формы для парентерального введения, такие как препараты для инъекций и суппозитории по методике известной per se.
Хотя доза соединения (I) настоящего изобретения и его фармацевтически приемлемых солей варьируется в зависимости от способа введения, симптомов и других условий при, например, пероральном введении взрослым пациентам с гиперхолестеринемией, она обычно составляет 0.1 мг - 50 мг/кг веса на одну дозу, которую вводят от 1 до 3 раз в день.
Соединение (I) настоящего изобретения и его фармацевтически приемлемая соль проявляет превосходную ACAT-ингибирующую активность и активность, ингибирующую перокисление жиров у млекопитающих (например, человека, коровы, лошади, собаки, кошки, кролика, крысы, мыши, хомяка и т.д.), и могут использоваться в качестве ингибиторов ACAT и ингибиторов перокисления жиров. Другими словами, они полезны для профилактики и лечения атеросклероза, гиперлипемии, атеросклероза у диабетиков, ишемической болезни сосудов головного мозга и сердца и подобных.
Данное изобретение более детально описано в примерах, которыми данное изобретение не ограничивается.
В приведенных ниже примерах используют следующие обозначения:
s - синглет;
t - триплет;
br - широкий;
d - дуплет;
dd - дуплет деплетов;
indoline - индолин;
indole - индол;
m - мультиплет;
Hz - Гц;
IR - ИК;
1H-NMR - 1H-ЯМР
Пример 1
N-(1-октил-5-гидроксиметил-4,6-диметилиндолин-7-ил)-2,2-диметилпропанамид.
(1) N-(1-ацетил-5-хлорметил-4,6-диметилиндолин-7-ил)-2,2-диметилпропанамид (7.0 г) растворяют в смеси растворителей (50 мл) CH3CN/ДМФ = 1/1. Добавляют ацетат калия (12.0 г) и смесь перемешивают при 60oC в течение 1 часа. CH3CN выпаривают при пониженном давлении и добавляют AcOEt (200 мл). После промывания водой смесь сушат над безводным сульфатом натрия и выпаривают AcOEt при пониженном давлении. Остаток очищают с помощью хроматографии на колонке с силикагелем (элюент: CHCl3/MeOH=1/0-10/1) с получением 7.5 г N-(1-ацетил-5-ацетоксиметил-4,6-диметилиндолин-7-ил)-2,2- диметилпропанамида.
1H-NMR (CDCl3) δ :
1.27 (9H, s, -C(CH3)3), 2.04 (3H, s, OCOCH3), 2.23, 2.26, 2.30 (9H, s • 3, -CH3•2, > NCOCH3), 3.00 (2H, br, Indoline C3-H), 4.05 (2H, br, Indoline C2-H), 5.20 (2H, s, -CH2O-), 9.10 (1H, br, > NH).
(2) N-(1-ацетил-5-ацетоксиметил-4,6-диметилиндолин-7-ил)- 2,2-диметилпропанамид (7.5 г) растворяют в EtOH (70 мл) и добавляют раствор NaOH (8.3 г) в воде (20 мл) с последующим нагреванием с обратным холодильником в течение 10 часов. EtOH выпаривают при пониженном давлении и добавляют CHCl3 (200 мл). После промывания водой смесь сушат над безводным сульфатом натрия и выпаривают CHCl3 при пониженном давлении. Остаток очищают с помощью хроматографии на колонке с силикагелем (элюент: CHCl3/MeOH=1/0-10/1) с получением 3.0 г N-(5-гидроксиметил-4,6-диметилиндолин-7-ил)-2,2-диметилпропанамида.
1H-NMR (CDCl3) δ :
1.35 (9H, s, -C(CH3)3), 2.23, 2.26 (6H, s•2, -CH3•2), 2.99 (2H, t, J= 8.5Hz, Indoline C3-H), 3.58 (2H, t, J=8.5Hz, Indcline C2-H), 4.65 (2H, s, 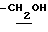 ), 7.10 (2H, br, OH, > NH).
), 7.10 (2H, br, OH, > NH).
(3) N-(5-гидроксиметил-4,6-диметилиндолин-7-ил)-2,2- диметилпропанамид (1.5 г) растворяют в ДМФ (15 мл) и добавляют 1-йодоктан (2.6 г) и K2CO3 (1.5 г) с последующим перемешиванием в атмосфере азота при 50oC в течение 2 часов. Добавляют AcOEt (200 мл) и смесь промывают водой и сушат над безводным сульфатом натрия. AcOEt выпаривают при пониженном давлении. Остаток очищают с помощью хроматографии на колонке с силикагелем (элюент: CHCl3/MeOH=1/0-10/1) с получением 1.0 г целевого соединения.
IR (Nujol) cm-1: 1652, 1600, 1508.
1H-NMR (CDCl3) δ :
0.70~ 1.10 (3H, br,  ), 1.10~1.70 (12H, m,
), 1.10~1.70 (12H, m,  ), 1.37 (9H, s, -C(CH3)3), 2.14, 2.22 (6H, s•2, -CH3•2), 2.87 (2H, t, J=8.5Hz, Indoline C3-H), 3.14 (2H, t, J=7.5Hz, > NCH2-), 3.42 (2H, t, J=8.5Hz, Indoline C2-H), 4.62 (2H, s,
), 1.37 (9H, s, -C(CH3)3), 2.14, 2.22 (6H, s•2, -CH3•2), 2.87 (2H, t, J=8.5Hz, Indoline C3-H), 3.14 (2H, t, J=7.5Hz, > NCH2-), 3.42 (2H, t, J=8.5Hz, Indoline C2-H), 4.62 (2H, s, 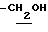 ), 6.86 (2H, br, OH, > NH).
), 6.86 (2H, br, OH, > NH).
Пример 2
N-(1-октил-5-диметиламинометил-4,6-диметилиндолин-7-ил)-2,2- диметилпропанамид.
(1) N-(1-ацетил-5-хлорметил-4,6-диметилиндолин-7-ил)-2,2-диметилпропанамид (2.0 г) растворяют в CHCl3 (40 мл) и добавляют (CH3)2NH•HCl (3.5 г) и K2CO3 (11.8 г) с последующим перемешиванием при комнатной температуре в течение 4 часов. Добавляют CHCl3 (300 мл) и смесь последовательно промывают 2N-соляной кислотой, 2N водным NaOH и насыщенным солевым раствором и сушат над безводным сульфатом натрия. CHCl3 выпаривают при пониженном давлении. Остаток очищают с помощью хроматографии на колонке с силикагелем (элюент: CHCl3/MeOH= 10/1-1/1) с получением 700 мг N-(1-ацетил-5-диметиламинометил-4,6-диметилиндолин-7-ил)-2,2-диметилпропанамида.
1H-NMR (CDCl3) δ :
1.26 (9H, s, -C(CH3)3), 2.12,2.15 (6H, s•2, -CH3•2), 2.24 (6H, s, -N(CH3)2), 2.31 (3H, s, > NCOCH3), 3.00 (2H, br, Indoline C3-H), 3.35 (2H, s, > NCH2-), 4.15 (2H, br, Indoline C2-H), 9.23 (1H, br, > NH).
(2) N-(1-ацетил-5-диметиламинометил-4,6-диметилиндолин-7-ил)-2,2- диметилпропанамид (1.0 г) растворяют в MeOH (10 мл) и добавляют раствор NaOH (580 мг) в воде (3 мл) с последующим перемешиванием при 60oC в течение 2 часов. MeOH выпаривают при пониженном давлении и добавляют CHCl3 (100 мл). Смесь промывают насыщенным солевым раствором и сушат над безводным сульфатом натрия. CHCl3 выпаривают при пониженном давлении с получением 700 мг N-(5-диметиламинометил-4,6-диметилиндолин-7-ил)-2,2-диметилпропанамида.
1H-NMR (CDCl3) δ :
1.30 (9H, s, -C(CH3)3), 2.19 (12H, s, -CH3•2, -N(CH3)2), 3.00 (2H, t, J= 8.5Hz, Indoline C3-H), 3.28 (2H, s, > NCH2-), 3.55 (2H, t, J=8.5Hz, Indoline C2-H), 4.40 (1H, br, > NH), 7.20 (1H, br, > NH).
(3) N-(5-диметиламинометил-4,6-диметилиндолин-7-ил)-2,2-диметилпропанамид (700 мг) растворяют в ДМФ (7 мл) и добавляют NaH (P = 60%, 160 мг) в атмосфере азота при 5oC. После перемешивания при той же температуре в течение 30 минут добавляют 1-йодоктан (240 мг) с последующим перемешиванием при 30oC в течение 3 часов. Добавляют AcOEt (200 мл) и смесь промывают водой и сушат над безводным сульфатом натрия. AcOEt выпаривают при пониженном давлении. Остаток очищают с помощью хроматографии на колонке с силикагелем (элюент: CHCl3/MeOH=10/1-3/1) с получением 500 мг целевого соединения.
IR (Nujol) cm-1: 1654, 1600.
1H-NMR (CDCl3) δ :
0.70~ 1.10 (3H, br, 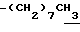 ), 1.10~1.70 (12H, m,
), 1.10~1.70 (12H, m, 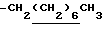 ), 1.33 (9H, s, -C(CH3)3), 2.00, 2.09 (6H, s•2, -CH3•2), 2.23 (6H, s, -N(CH3)2), 2.85 (2H, t, J=8.5Hz, Indoline C3-H), 3.18 (2H, br-t, >NCH2-), 3.31 (2H, s, -CH2N <), 3.38 (2H, t, J=8.5Hz, Indoline C2-H), 6.8 (1H, br, > NH).
), 1.33 (9H, s, -C(CH3)3), 2.00, 2.09 (6H, s•2, -CH3•2), 2.23 (6H, s, -N(CH3)2), 2.85 (2H, t, J=8.5Hz, Indoline C3-H), 3.18 (2H, br-t, >NCH2-), 3.31 (2H, s, -CH2N <), 3.38 (2H, t, J=8.5Hz, Indoline C2-H), 6.8 (1H, br, > NH).
Пример 3
N-(1-октил-5-этоксикарбонилметил-4,6-диметилиндолин-7-ил)-2,2- диметилпропанамид.
(1) 1-ацетил-5-бром-4,6-диметил-7-нитроиндолин (30 г) растворяют в смеси (600 мл) CHCl3/MeOH= 1/1 и добавляют 5% Pd-c (5.0 г) с последующим каталитическим гидрированием при 35oC. Остаток собирают фильтрацией вместе с Pd-c и растворяют в CHCl3 (300 мл). Смесь промывают насыщенным водным раствором гидрокарбоната натрия. Растворитель выпаривают из фильтрата при пониженном давлении и добавляют CHCl3. Смесь промывают насыщенным водным раствором гидрокарбоната натрия и объединяют со слоем упомянутого выше CHCl3. Объединенный слой CHCl3 промывают насыщенным солевым раствором и сушат над безводным сульфатом натрия. CHCl3 выпаривают при пониженном давлении и остаток растворяют в CHCl3 (150 мл). Туда последовательно добавляют пивалоил хлорид (11.7 г) и Et3N (10,8 г) при 10oC. Смесь перемешивают при комнатной температуре в течение 1 часа и добавляют CHCl3 (200 мл). Смесь последовательно промывают 5% водной лимонной кислотой и водой и сушат над безводным сульфатом натрия. CHCl3 выпаривают при пониженном давлении и получают сырой остаток, который промывают холодным Et2O (100 мл) с получением 21 г N-(1-ацетил-4,6-диметилиндолин-7-ил)-2,2-диметилпропанамида.
IR (Nujol) cm-1: 1676, 1639, 1581.
1H-NMR (CDCl3) δ :
1.24 (9H, s, -C(CH3)3), 2.17 (6H, s, -CH3•2), 2.30 (3H, s, > NCOCH3), 2.99 (2H, t, J=8.5Hz, Indoline C3-H), 4.10 (2H, t, J=8.5Hz, Indoline C2-H), 6.87 (1H, s, Indoline C5-H), 9.10 (1H, br, > NH).
(2) N-(1-ацетил-4,6-диметилиндолин-7-ил)-2,2-диметилпропанамид (20.0 г) растворяют в концентрированной соляной кислоте (100 мл) и добавляют 35% формалин (8.5 г) и хлорид цинка (1.8 г). Смесь перемешивают при 40-50oC в течение 2 часов с одновременным барботированием хлороводорода. Реакционную смесь выливают в ледяную воду и экстрагируют CHCl3 (400 мл). Слой CHCl3 дважды промывают насыщенным раствором и сушат над безводным сульфатом натрия. CHCl3 выпаривают при пониженном давлении с получением 21 г N-(1-ацетил-5-хлорметил-4,6-диметилиндолин-7-ил)-2,2-диметилпропанамида.
IR (Nujol) cm-1: 1679, 1645, 1587.
1H-NMR-(CDCl3) δ :
1.27 (9H, s, -C(CH3)3), 2.25 (3H, s, -CH3), 2.30 (6H, s, -CH3, > NCOCH3), 3.00 (2H, br, Indoline C3-H), 4.05 (2H, br, Indoline C2-H), 4.68 (2H, s, -CH2Cl), 9.16 (1H, br, >NH).
(3) N-(1-ацетил-5-хлорметил-4,6-диметилиндолин-7-ил)-2,2- диметилпропанамид (21 г) суспендируют в CH3CN (150 мл) и NaCN (8.1 г) и добавляют 18-краун-6 (870 мг) с последующим нагреванием с обратным холодильником в течение 15 часов. CH3CN выпаривают при пониженном давлении и добавляют CHCl3. Смесь промывают водой и сушат над безводным сульфатом натрия. CHCl3 выпаривают при пониженном давлении. Полученный остаток промывают кипящим MeOH с получением 15.5 г N-(1-ацетил-5-цианометил-4,6-диметилиндолин-7- ил)-2,2-диметилпропанамида.
IR (Nujol) cm-1: 2232, 1678, 1639.
1H-NMR (CDCl3) δ :
1.27 (9H, s, -C(CH3)3), 2.26, 2.30, 2.40 (9H, s•3, -CH3•2, > NCOCH3), 3.00 (2H, br, Indoline C3-H), 3.66 (2H, s, -CH2CN), 4.05 (2H, br, Indoline C3-H), 9.21 (1H, br, >NH).
(4) N-(1-ацетил-5-цианометил-4,6-диметилиндолин-7-ил)- 2,2-диметилпропанамид (5.0 г) суспендируют в н-PrOH (25 мл) и добавляют раствор NaOH (9.6 г) в воде с последующим перемешиванием при 90oC в течение 8 часов в автоклаве в атмосфере азота. Водный слой отделяют и органический слой нейтрализуют 2N-соляной кислотой. Растворитель выпаривают при пониженном давлении. Остаток суспендируют в EtOH (200 мл) и добавляют 1ON HCl-EtOH (7.2 мл) с последующим нагреванием с обратным холодильником в течение 1 часа. EtOH выпаривают при пониженном давлении и смесь нейтрализуют насыщенным водным раствором гидрокарбоната натрия и экстрагируют AcOEt (200 мл). Слой AcOEt промывают водой и сушат над безводным сульфатом натрия. AcOEt выпаривают при пониженном давлении и остаток очищают с помощью хроматографии на колонке с силикагелем (элюент: CHCl3/MeOH= 1/0-20/1) с получением 3.0 г N-(5-этоксикарбонилметил-4,6-диметилиндолин-7-ил)-2,2-диметилпропанамида.
IR (Nujol) cm-1: 1732, 1654.
1H-NMR (CDCl3) δ :
1.34 (9H, s, -C(CH3)3), 2.14, 2.18 (6H, s•2, -CH3•2), 2.99 (2H, t, J= 8.5Hz, Indoline C3-H), 3.56 (2H, t, J=8.5Hz, Indoline C2-H), 3.60 (2H, s, -CH2CO2-), 4.11 (2H, q, J=7.8Hz, 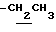 ), 4.20 (1H, br, > NH), 7.00 (1H, br, > NH).
), 4.20 (1H, br, > NH), 7.00 (1H, br, > NH).
(5) N-(5-этоксикарбонилметил-4,6-диметилиндолин-7-ил)-2,2- диметилпpoпaнaмид (3.5 г) растворяют в ДМФ (15 мл) и добавляют 1-йодоктан (5.0 г) и K2CO3 (2.9 г) с последующим перемешиванием в атмосфере азота при 50oC в течение 2 часов. Добавляют AcOEt (200 мл) и смесь промывают водой и сушат над безводным сульфатом натрия. AcOEt выпаривают при пониженном давлении. Остаток очищают с помощью хроматографии на колонке с силикагелем (элюент: CHCl3/MeOH=1/0-50/1) с получением 3.5 г соединения, названного в заголовке.
IR (Neat) cm-1: 1732, 1654, 1600.
1H-NMR (CDCl3) δ : 0.70~1.10 (3H, br, 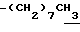 ), 1.10~1.70 (15H, m,
), 1.10~1.70 (15H, m, 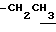 ,
, 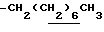 ), 1.33 (9H, s, -C(CH3)3), 2.04, 2.13 (6H, s•2, -CH3•2), 2.87 (2H, t, J=8.5Hz, Indoline C3-H), 3.12 (2H, t, J=7.5Hz, >NCH2-), 3.39 (2H, t, J=8.5Hz, Indoline C2-H), 3.58 (2H, s, -CH2CO2-), 4.12 (2H, q, J=7.5Hz,
), 1.33 (9H, s, -C(CH3)3), 2.04, 2.13 (6H, s•2, -CH3•2), 2.87 (2H, t, J=8.5Hz, Indoline C3-H), 3.12 (2H, t, J=7.5Hz, >NCH2-), 3.39 (2H, t, J=8.5Hz, Indoline C2-H), 3.58 (2H, s, -CH2CO2-), 4.12 (2H, q, J=7.5Hz, 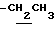 ), 6.79 (1H, br, > NH).
), 6.79 (1H, br, > NH).
Пример 4
N-(1-октил-5-карбоксиметил-4,6-диметилиндолин-7-ил)-2,2-диметилпропанамид.
N-(1-октил-5-этоксикарбонилметил-4,6-диметилиндолин-7-ил)-2,2- диметилпропанамид (3.5 г) растворяют в EtOH (50 мл) и добавляют раствор NaOH (1.6 г) в воде (20 мл) с последующим перемешиванием при 60oC в течение 1 часа. EtOH выпаривают при пониженном давлении. Остаток растворяют в воде (20 мл) и смесь промывают AcOEt (20 мл). Водный слой нейтрализуют 2N-соляной кислотой и экстрагируют AcOEt (50 мл). Слой AcOEt промывают насыщенным солевым раствором и сушат над безводным сульфатом натрия. AcOEt выпаривают при пониженном давлении с получением 2.4 г целевого соединения.
IR (Nujol) cm-1: 1732, 1651, 1600.
1H-NMR(CDCl3) δ :
0.7~1.10 (3H, br, 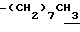 ), 1.10~1.70 (12H, m,
), 1.10~1.70 (12H, m, 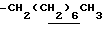 ), 1.33 (9H, s, -C(CH3)3), 2.01, 2.15 (6H, s•2, -CH3•2), 2.70~3.20 (4H, m, Indoline C3-H, > NCH2-), 3.41 (2H, t, J=8.5Hz, Indoline C2-H), 3.56 (2H, s,
), 1.33 (9H, s, -C(CH3)3), 2.01, 2.15 (6H, s•2, -CH3•2), 2.70~3.20 (4H, m, Indoline C3-H, > NCH2-), 3.41 (2H, t, J=8.5Hz, Indoline C2-H), 3.56 (2H, s, 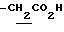 ), 7.60 (1H, br, > NH), 7.90 (1H, br, -CO2H).
), 7.60 (1H, br, > NH), 7.90 (1H, br, -CO2H).
Пример 5
N-(1-октил-5-карбоксиметил-4,6-диметилиндолин-7-ил)-2,2-диметилпропанамид гидрохлорид
N-(1-октил-5-этоксикарбонилметил-4,6-диметилиндолин-7-ил)- 2,2-диметилпропанамид (3.5 г) растворяют в EtOH (50 мл) и добавляют раствор NaOH (1.6 г) в воде (20 мл) с последующим перемешиванием при 60oC в течение 1 часа. EtOH выпаривают при пониженном давлении. Остаток растворяют в воде (20 мл) и смесь промывают AcOEt (20 мл). Водный слой доводят до pH 1-2 соляной кислотой и экстрагируют AcOEt (50 мл). Слой AcOEt промывают насыщенным солевым раствором и сушат над безводным сульфатом натрия. AcOEt выпаривают при пониженном давлении с получением 2.0 г целевого соединения.
IR (Nujol) cm-1: 1722, 1654.
1H-NMR (CDCl3) δ :
0.70~ 1.10 (3H, br, 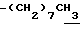 ), 1.10~1.70 (12H, m,
), 1.10~1.70 (12H, m, 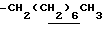 ), 1.39 (9H, s, -C(CH3)3), 2.06, 2.26 (6H, s•2, -CH3•2), 2.90~3.30 (4H, m, Indoline C3-H, >NCH2-), 3.50~ 3.90 (2H, br-t, Indoline C2-H), 2.72 (2H, s.
), 1.39 (9H, s, -C(CH3)3), 2.06, 2.26 (6H, s•2, -CH3•2), 2.90~3.30 (4H, m, Indoline C3-H, >NCH2-), 3.50~ 3.90 (2H, br-t, Indoline C2-H), 2.72 (2H, s. 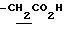 ), 6.00~7.00 (1H, br, HCl), 9.05 (2H, br, >NH, -CO2H).
), 6.00~7.00 (1H, br, HCl), 9.05 (2H, br, >NH, -CO2H).
Пример 6
N-(1-октил-5-карбоксиметил-4,6-диметилиндолин-7-ил)-2,2-диметилпропанамид сульфат
N-(1-октил-5-этоксикарбонилметил-4,6-диметилиндолин-7-ил)-2,2- диметилпропанамид (4.0 г) растворяют в EtOH (57 мл), добавляют раствор NaOH (1.8 г) в воде (23 мл) с последующим перемешиванием при 60oC в течение 1 часа. EtOH выпаривают при пониженном давлении. Остаток растворяют в воде (30 мл) и смесь промывают AcOEt (30 мл). Водный слой доводят до pH 1-2 серной кислотой и экстрагируют AcOEt (50 мл). Слой AcOEt промывают насыщенным солевым раствором и сушат над безводным сульфатом натрия. AcOEt выпаривают при пониженном давлении с получением 2.5 г соединения, названного в заголовке.
IR (Nujol) cm-1: 1718, 1654, 1637.
1H-NMR (CDCl3) δ :
0.70~ 1.10 (3H, br, 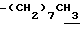 ), 1.10~1.70 (12H, m,
), 1.10~1.70 (12H, m, 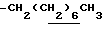 ), 1.33 (9H, s, -C(CH3)3), 2.02, 2.16 (6H, s•2, -CH3•2), 2.80~3.30 (4H, m, Indoline C3-H, >NCH2-), 3.30~3.70 (2H, br-t, Indoline C2-H), 3.59 (2H, s,
), 1.33 (9H, s, -C(CH3)3), 2.02, 2.16 (6H, s•2, -CH3•2), 2.80~3.30 (4H, m, Indoline C3-H, >NCH2-), 3.30~3.70 (2H, br-t, Indoline C2-H), 3.59 (2H, s, 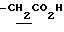 ), 6.00~7.00 (2H, br, H2SO4), 7.20 (1H, br, -CO2H), 8.20 (1H, br, >NH).
), 6.00~7.00 (2H, br, H2SO4), 7.20 (1H, br, -CO2H), 8.20 (1H, br, >NH).
Пример 7
N-(1-октил-5-карбоксиметил-4,6-диметилиндолин-7- ил)-2,2-диметилпропанамид нитрат
N-(1-октил-5-этоксикарбонилметил-4,6-диметилиндолин-7-ил)-2,2- диметилпропанамид (3.0 г) растворяют в EtOH (42 мл) и добавляют раствор NaOH (1.4 г) в воде (17 мл) с последующим перемешиванием при 60oC в течение 1 часа. EtOH выпаривают при пониженном давлении. Остаток растворяют в воде (20 мл) и смесь промывают AcOEt (20 мл). Водный слой доводят до pH 1-2 азотной кислотой и экстрагируют AcOEt (50 мл). Слой AcOEt промывают насыщенным солевым раствором и сушат над безводным сульфатом натрия. AcOEt выпаривают при пониженном давлении с получением 2.0 г соединения, названного в заголовке.
IR (Nujol) cm-1: 1724, 1654
1H-NMR (CDCl3) δ :
0.70~ 1.10 (3H, br, 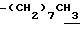 ), 1.10~1.70 (12H, m,
), 1.10~1.70 (12H, m, 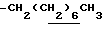 ), 1.33 (9H, s, -C(CH3)3), 2.02, 2.21 (6H, s•2, -CH3•2), 2.80~3.30 (4H, m, lndoline C3-H, > NCH2-), 3.50~3.80 (2H, br-t, Indoline C2-H), 3.64 (2H, s,
), 1.33 (9H, s, -C(CH3)3), 2.02, 2.21 (6H, s•2, -CH3•2), 2.80~3.30 (4H, m, lndoline C3-H, > NCH2-), 3.50~3.80 (2H, br-t, Indoline C2-H), 3.64 (2H, s, 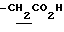 ), 6.00~7.00 (1H, br, HNO3), 9.03 (2H, br, > NH, -CO2H).
), 6.00~7.00 (1H, br, HNO3), 9.03 (2H, br, > NH, -CO2H).
Пример 8
N-(1-октил-5-карбоксиметил-4,6-диметилиндолин-7-ил)-2,2- диметилпропанамид натриевая соль
N-(1-октил-5-этоксикарбонилметил-4,6-диметилиндолин-7-ил)-2,2- диметилпропанамид (3.5 г) растворяют в EtOH (50 мл) и добавляют раствор NaOH (1.6 г) в воде (20 мл) с последующим перемешиванием при 60oC в течение 1 часа. EtOH выпаривают при пониженном давлении. Остаток растворяют в воде (20 мл) и смесь адсорбируют в DIA ION®HP-21 (70 мл). После промывания водой смесь элюируют 50% водным метанолом. Целевую фракцию концентрируют при пониженном давлении. Остаток сушат вымораживанием с получением 1.0 г соединения, названного в заголовке.
IR (Nujol) cm-1: 1630, 1605.
1H-NMR (CDCl3) δ :
0.70~ 1.10 (3H, br, 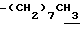 ), 1.10~1.70 (12H, m,
), 1.10~1.70 (12H, m, 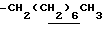 ), 1.38 (9H, s, -C(CH3)3), 1.93, 2.08 (6H, s•2, -CH3•2), 2.70~3.20 (4H, m, Indoline C3-H, > NCH2-), 3.30~ 3.40 (2H, br-t, Indoline C2-H), 3.15 (2H, s,
), 1.38 (9H, s, -C(CH3)3), 1.93, 2.08 (6H, s•2, -CH3•2), 2.70~3.20 (4H, m, Indoline C3-H, > NCH2-), 3.30~ 3.40 (2H, br-t, Indoline C2-H), 3.15 (2H, s, 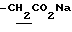 ), 8.54 (1H, br, > NH).
), 8.54 (1H, br, > NH).
Пример 9
N-[(1-октил-3-(2-гидроксиэтил)-4,6-диметилиндолин-7-ил)-2,2- диметилпропанамид
(1) 4,6-диметилиндол (130 г) растворяют в Et2O (130 мл) и по каплям добавляют оксалилхлорид (23.0 г) при 0oC. Смесь перемешивают при комнатной температуре в течение 5 часов и Et2O выпаривают при пониженном давлении. Добавляют EtOH (200 мл) к остатку и смесь перемешивают при комнатной температуре в течение 15 часов. EtOH выпаривают при пониженном давлении. Остаток растворяют в CHCl3 (200 мл). После промывания водой смесь сушат над безводным сульфатом натрия. CHCl3 выпаривают при пониженном давлении. Полученный остаток добавляют к суспензии LiAlH4 (17.0 г) в Et2O (200 мл) с последующим нагреванием с обратным холодильником в течение 2 часов. Реакционную смесь выливают в ледяную воду и экстрагируют AcOEt (200 мл). Слой AcOEt промывают водой и сушат над безводным сульфатом натрия. AcOEt выпаривают при пониженном давлении. Остаток очищают с помощью хроматографии на колонке с силикагелем (элюент: CHCl3/MeOH=50/1-10/1) с получением 13.0 г 3-(2-гидроксиэтил)-4,6-диметилиндола.
IR (Nujol) cm-1: 1456, 1377.
1H-NMR (CDCl3) δ :
2.39, 2.63 (6H, s•2, -CH3•2), 3.13 (2H, t, J=7.0Hz, 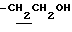 ), 3.86 (2H, t, J=7.0Hz,
), 3.86 (2H, t, J=7.0Hz, 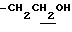 ), 6.69 (1H, s, Indole C5-H), 6.91 (2H, m, Indole C2-H, C7-H), 6.92 (1H, br, -OH), 7.90 (1H, br, > NH).
), 6.69 (1H, s, Indole C5-H), 6.91 (2H, m, Indole C2-H, C7-H), 6.92 (1H, br, -OH), 7.90 (1H, br, > NH).
(2) 3-(2-гидроксиэтил)-4,6-диметилиндол (13.0 г) растворяют в AcOH (100 мл) и порциями добавляют NaBH3CN (8.7 г) при охлаждении льдом. После перемешивания при той же температуре в течение 1 часа реакционную смесь выливают в ледяную воду и нейтрализуют водным NaOH. Смесь экстрагируют CHCl3 (200 мл). Слой CHCl3 промывают водой и сушат над безводным сульфатом натрия. CHCl3 выпаривают при пониженном давлении. Остаток растворяют в бензоле (100 мл) и добавляют Ac2O (15 г) и Et3N (8.3 г) с последующим перемешиванием при комнатной температуре в течение 1 часа. Добавляют AcOEt (200 мл) и смесь промывают последовательно насыщенным водным раствором гидрокарбоната натрия, 5% водной лимонной кислотой и насыщенным солевым раствором и сушат над безводным сульфатом натрия. Растворитель выпаривают при пониженном давлении. Остаток очищают с помощью хроматографии на колонке с силикагелем (элюент: CHCl3/MeOH= 50/1-10/1) с получением 13.0 г 1-ацетил-3-(2-ацетоксиэтил)-4,6-диметилиндолина.
IR (Nujol) cm-1: 1652, 1460.
1H-NMR (CDCl3) δ :
1.60~ 2.20 (2H, m, 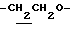 ), 2.04 (3H, s, -OCOCH3), 2.24 (3H, s, > NCOCH3), 2.24, 2.30 (6H, s•2, -CH3•2), 3.34 (1H, m, Indoline C3-H), 3.94 (2H, m, Indoline C2-H), 4.12 (2H, t, J=7.1Hz,
), 2.04 (3H, s, -OCOCH3), 2.24 (3H, s, > NCOCH3), 2.24, 2.30 (6H, s•2, -CH3•2), 3.34 (1H, m, Indoline C3-H), 3.94 (2H, m, Indoline C2-H), 4.12 (2H, t, J=7.1Hz, 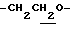 ), 6.67 (1H, s, Indoline C5-H), 7.90 (1H, s, Indoline C7-H).
), 6.67 (1H, s, Indoline C5-H), 7.90 (1H, s, Indoline C7-H).
(3) 1-ацетил-3-(2-ацетоксиэтил)-4,6-диметилиндолин (2.0 г) растворяют в AcOH (40 мл) и добавляют Br2 (1.9 г) с последующим перемешиванием при комнатной температуре в течение 30 минут. Реакционную смесь выливают в ледяную воду и остаток собирают фильтрацией. Остаток растворяют в CHCl3 и смесь промывают водой и сушат над безводным сульфатом натрия. CHCl3 выпаривают при пониженном давлении. Остаток очищают с помощью хроматографии на колонке с силикагелем (элюент: CHCl3/MeOH= 50/1-10/1) с получением 2.7 г неочищенных кристаллов 1-ацетил-3-(2-ацетоксиэтил)-5-бром-4,6-диметилиндолина. Неочищенные кристаллы порциями добавляют в смесь азотной кислоты (0.47 моль/л), AcOH и концентрированной соляной кислоты (10 мл) при охлаждении льдом и смесь перемешивают при той же температуре в течение 4 часов. Реакционную смесь выливают в ледяную воду и остаток собирают фильтрацией. Остаток растворяют в CHCl3. После промывания водой смесь сушат над безводным сульфатом натрия и CHCl3 выпаривают при пониженном давлении. Остаток очищают с помощью хроматографии на колонке с силикагелем (элюент: CHCl3/MeOH=50/1-10/1) с получением 1.4 г 1-ацетил-3- (2-ацетоксиэтил)-5-бром-4,6-диметил-7-нитроиндолина.
1H-NMR (DMSO-d6) δ :
1.60~ 2.20 (2H, m, 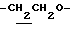 ), 1.99 (3H, s, -OCOCH3), 2.21 (3H, s, > NCOCH3), 2.38 (6H, s, -CH3•2), 3.40 (1H, m, lndoline C3-H), 4.11 (2H, t, J= 7.0Hz,
), 1.99 (3H, s, -OCOCH3), 2.21 (3H, s, > NCOCH3), 2.38 (6H, s, -CH3•2), 3.40 (1H, m, lndoline C3-H), 4.11 (2H, t, J= 7.0Hz, 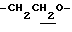 ), 4.14 (2H, d, J=8.5Hz, Indoline C2-H).
), 4.14 (2H, d, J=8.5Hz, Indoline C2-H).
(4) 1-ацетил-3-(2-ацетоксиэтил)-5-бром-4,6-диметил-7- нитроиндолина (1.4 г) растворяют в бензоле и добавляют 5% Pd-C (500 мг) с последующим каталитическим гидрированием при комнатной температуре при атмосферном давлении. Pd-C отфильтровывают и бензол выпаривают при пониженном давлении. Остаток растворяют с CHCl3 (50 мл) и смесь промывают последовательно насыщенным водным раствором гидрокарбоната натрия и насыщенным солевым раствором и сушат над безводным сульфатом натрия. В полученный раствор добавляют пивалоил хлорид (440 мг) и Et3N (448 мг) и смесь перемешивают при комнатной температуре в течение 30 минут. Смесь последовательно промывают 5% водной лимонной кислотой и насыщенным солевым раствором и сушат над безводным сульфатом натрия. CHCl3 выпаривают при пониженном давлении. Остаток очищают с помощью хроматографии на колонке с силикагелем (элюент: CHCl3/MeOH= 50/1-10/1) с получением 1.0 г N-[1-ацетил-3-(2- ацетоксиэтил)-4,6-диметилиндолин-7-ил]-2,2-диметилпропанамида.
IR (Nujol) cm-1: 1730, 1649.
1H-NMR (CDCl3) δ :
1.27 (9H, s, -C(CH3)3), 1.60~2.20 (2H, m, 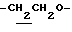 ), 2.06 (3H, s, -OCOCH3), 2.17, 2.22 (6H, s, -CH3•2), 2.30 (3H,s, >NCOCH3), 3.10 (1H, m, Indoline C3-H), 4.03 (2H, d, J=8.5Hz, Indoline C2-H), 4.14 (1H, t, J=7.0Hz,
), 2.06 (3H, s, -OCOCH3), 2.17, 2.22 (6H, s, -CH3•2), 2.30 (3H,s, >NCOCH3), 3.10 (1H, m, Indoline C3-H), 4.03 (2H, d, J=8.5Hz, Indoline C2-H), 4.14 (1H, t, J=7.0Hz, 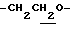 ), 6.88 (1H, s, Indoline C5-H), 9.00 (1H, br, > NH).
), 6.88 (1H, s, Indoline C5-H), 9.00 (1H, br, > NH).
(5) N-[1-ацетил-3-(2-ацетоксиэтил)-4,6-диметилиндолин-7-ил]-2,2- диметилпропанамид (4.0 г) растворяют в EtOH (40 мл) и добавляют раствор NaOH (2.2 г) в воде (10 мл) с последующим перемешиванием при 60oC в течение 10 часов. EtOH выпаривают при пониженном давлении и добавляют CHCl3 (100 мл). После промывания водой смесь сушат над безводным сульфатом натрия и CHCl3 выпаривают при пониженном давлении. Остаток очищают с помощью хроматографии на колонке с силикагелем (элюент: CHCl3/MeOH=50/1-10/1) с получением 1.6 г N-[3-(2-гидроксиэтил)-4,6-диметилиндолин-7-ил]-2,2-диметилпропанамида.
1H-NMR (CDCl3) δ :
1.34 (9H, s, -C(CH3)3), 1.60~2.20 (2H, m. 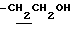 ), 2.17, 2.19 (6H, s•2, -CH3•2), 3.20~3.80 (7H, m, Indoline C2-H, C3-H, > NH,
), 2.17, 2.19 (6H, s•2, -CH3•2), 3.20~3.80 (7H, m, Indoline C2-H, C3-H, > NH, 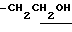 ), 6.45 (1H, s, Indoline C5-H), 7.20 (1H, br, -CONH-).
), 6.45 (1H, s, Indoline C5-H), 7.20 (1H, br, -CONH-).
(6) N-[3-(2-гидроксиэтил)-4,6-диметилиндолин-7-ил] -2,2- диметилпропанамид (1.6 г) растворяют в ДМФ (15 мл) и добавляют 1-йодоктан (3.9 г) и K2CO3 (2.3 г) с последующим перемешиванием при 70oC в течение 10 часов. Добавляют AcOEt (200 мл) и смесь промывают водой и сушат над безводным сульфатом натрия. AcOEt выпаривают при пониженном давлении. Остаток очищают с помощью хроматографии на колонке с силикагелем (элюент: бензол/AcOEt=5/1-1/2) с получением 300 мг целевого соединения.
IR (Nujol) cm-1: 1645, 1600.
1H-NMR (CDCl3) δ :
0.70~ 1.00 (3H, brt, 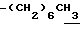 ), 1.33 (9H, s, -C(CH3)3), 1.00~2.00 (14H, m,
), 1.33 (9H, s, -C(CH3)3), 1.00~2.00 (14H, m, 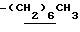 ,
, 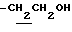 ), 2.07, 2.16 (6H, s•2, -CH3•2), 2.60~3.60 (8H, m, Indoline C2-H, C3-H, >NCH2-,
), 2.07, 2.16 (6H, s•2, -CH3•2), 2.60~3.60 (8H, m, Indoline C2-H, C3-H, >NCH2-, 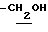 ), 6.44 (1H, s, lndoline C5-H), 6.78 (1H, br, -CONH-).
), 6.44 (1H, s, lndoline C5-H), 6.78 (1H, br, -CONH-).
Пример 10
N-[1-октил-3-(2-метоксикарбонилэтил)-4,6-диметилиндолин-7-ил] -2,2- диметилпропанамид
(1) 1-ацетил-3-(2-ацетоксиэтил)-4,6-диметилиндолин (2.0 г) растворяют в смеси CHCl3/MeOH=1/1 (25 мл) и добавляют раствор NaOH (1.5 г) в воде (5 мл) с последующим перемешиванием при комнатной температуре в течение 1 часа. Растворитель выпаривают при пониженном давлении. Добавляют CHCl3 (100 мл) и смесь промывают водой и сушат над безводным сульфатом натрия. CHCl3 выпаривают при пониженном давлении. Остаток очищают с помощью хроматографии на колонке с силикагелем (элюент: CHCl3/MeOH=50/1-10/1) с получением 1.2 г 1-ацетил-3-(2-гидроксиэтил)-4,6-диметилиндолина.
1H-NMR (CDCl3) δ :
1.60~ 2.00 (3H, m, 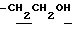 ), 2.26, 2.30, 2.39 (9H, s•3, - CH3•2, > NCOCH3), 3.50 (1H, m, Indoline C3-H), 3.77 (2H, t, J=7.0Hz,
), 2.26, 2.30, 2.39 (9H, s•3, - CH3•2, > NCOCH3), 3.50 (1H, m, Indoline C3-H), 3.77 (2H, t, J=7.0Hz, 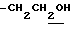 ), 3.97 (2H, m, Indoline C2-H), 6.67 (1H, s, Indoline C5-H), 7.89 (1H, s, Indoline C7-H).
), 3.97 (2H, m, Indoline C2-H), 6.67 (1H, s, Indoline C5-H), 7.89 (1H, s, Indoline C7-H).
(2) 1-ацетил-3-(2-гидроксиэтил)-4,6-диметилиндолин (7.0 г) и CBr4 (9.9 г) растворяют в CH3CN (70 мл) и добавляют Ph3P (9.4 г) с последующим перемешиванием при комнатной температуре в течение 30 минут. CH3CN выпаривают при пониженном давлении. Добавляют AcOEt (100 мл) и смесь промывают водой и сушат над безводным сульфатом натрия. AcOEt выпаривают при пониженном давлении. Остаток очищают с помощью хроматографии на колонке с силикагелем (элюент: бензол/AcOEt= 50/1-10/1) с получением 5.4 г 1-ацетил-3-(2-бромэтил)-4,6-диметилиндолина.
IR (Nujol) cm-1: 1650, 1460.
1H-NMR (CDCl3) δ :
1.80~2.20 (2H, m, 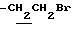 ), 2.23, 2.26, 2.30 (9H, s•3, -CH3•2, > NCOCH3), 3.42 (2H, t, J=7.0Hz,
), 2.23, 2.26, 2.30 (9H, s•3, -CH3•2, > NCOCH3), 3.42 (2H, t, J=7.0Hz, 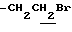 ), 3.20~3.60 (1H, m, Indoline C3-H), 4.00 (2H, m, Indoline C2-H), 6.68 (1H, s, Indoline C5-H), 7.89 (1H, s, Indoline C7-H).
), 3.20~3.60 (1H, m, Indoline C3-H), 4.00 (2H, m, Indoline C2-H), 6.68 (1H, s, Indoline C5-H), 7.89 (1H, s, Indoline C7-H).
(3) 1-ацетил-3-(2-бромэтил)-4,6-диметилиндолин (5.4 г), NaCN (3.7 г) и 18-крон-6 (480 мг) суспендируют в CH3CN (50 мл) и суспензию нагревают с обратным холодильником в течение 15 часов. CH3CN выпаривают при пониженном давлении. Добавляют CHCl3 (100 мл) и смесь промывают водой и сушат над безводным сульфатом натрия. CHCl3 выпаривают при пониженном давлении. Остаток очищают с помощью хроматографии на колонке с силикагелем (элюент: CHCl3/MeOH= 50/1-10/1) с получением 4.5 г 1-ацетил-3-(2-цианоэтил)-4,6-диметилиндолина.
IR (Nujol) cm-1: 2364, 1647.
1H-NMR (CDCl3) δ :
1.70~ 2.20 (2H, m, 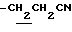 ), 2.26, 2.31 (9H, s•3, -CH3•2, >NCOCH3), 2.20~ 2.40 (2H, m,
), 2.26, 2.31 (9H, s•3, -CH3•2, >NCOCH3), 2.20~ 2.40 (2H, m, 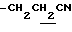 ), 3.44 (1H, m, Indoline C3-H), 3.70~4.20 (2H, m, Indoline C2-H), 6.69 (1H, s, Indoline C5-H), 7.90 (1H, s, Indoline C7-H).
), 3.44 (1H, m, Indoline C3-H), 3.70~4.20 (2H, m, Indoline C2-H), 6.69 (1H, s, Indoline C5-H), 7.90 (1H, s, Indoline C7-H).
(4) 1-ацетил-3-(2-цианоэтил)-4,6-диметилиндолин (4.5 г) растворяют в EtOH (150 мл) и добавляют раствор КОН (10.4 г) в воде (50 мл) с последующим нагреванием с обратным холодильником в течение 15 часов. EtOH выпаривают при пониженном давлении и водный слой доводят до слабокислой реакции 6N соляной кислотой и экстрагируют CHCl3 (100 мл). Слой CHCl3 промывают водой и сушат над безводным сульфатом натрия. Остаток растворяют в CHCl3 (20 мл) и добавляют Ac2O (1.9 г) с последующим перемешиванием при комнатной температуре в течение 1 часа. Добавляют CHCl3 (100 мл) и смесь промывают водой и сушат над безводным сульфатом натрия. CHCl3 выпаривают при пониженном давлении. Остаток очищают с помощью хроматографии на колонке с силикагелем (элюент: CHCl3/MeOH= 50/1-10/1) с получением 3.4 г 1-ацетил-3- (2-карбоксиэтил)-4,6-диметилиндолина.
1H-NMR (CDCl3) δ :
1.60~ 2.20 (2H, m, 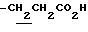 ), 2.26, 2.29 (9H, s•3, -CH3•2, >NCOCH3), 2.20~2.40 (2H, m,
), 2.26, 2.29 (9H, s•3, -CH3•2, >NCOCH3), 2.20~2.40 (2H, m, 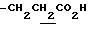 ), 3.37 (1H, m, Indoline C3-H), 3.80~4.10 (2H, m, Indoline C2-H), 6.68 (1H, s, Indoline C5-H), 7.50 (1H, br, -CO2H), 7.88 (1H, s, Indoline C7-H).
), 3.37 (1H, m, Indoline C3-H), 3.80~4.10 (2H, m, Indoline C2-H), 6.68 (1H, s, Indoline C5-H), 7.50 (1H, br, -CO2H), 7.88 (1H, s, Indoline C7-H).
(5) 1-ацетил-3-(2-карбоксиэтил)-4,6-диметилиндолин (3.4 г) растворяют в EtOH (50 мл) и добавляют ION HCI-EtOH (3.9 мл) с последующим нагреванием с обратным холодильником в течение 30 минут. EtOH выпаривают при пониженном давлении и добавляют AcOEt (100 мл). После промывания водой смесь сушат над безводным сульфатом натрия. AcOEt выпаривают при пониженном давлении. Остаток очищают с помощью хроматографии на колонке с силикагелем (элюент: CHCl3/MeOH= 50/1-10/1) с получением 3.3 г 1-ацетил-3-(2-этоксикарбонилэтил)-4,6-диметилиндолина.
1H-NMR(CDCl3) δ :
1.24 (3H, t, J=7.1Hz, 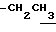 ), 1.60~2.20 (2H, m,
), 1.60~2.20 (2H, m,  ), 2.22, 2.27, 2.30 (9H, s•3, -CH3•2, >NCOCH3), 2.00~2.20 (2H, m,
), 2.22, 2.27, 2.30 (9H, s•3, -CH3•2, >NCOCH3), 2.00~2.20 (2H, m, 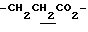 ), 3.10~ 3.30 (1H, m, Indoline C3-H), 3.90 (2H, m, Indoline C2-H), 4.10 (2H, q, J = 7.1Hz,
), 3.10~ 3.30 (1H, m, Indoline C3-H), 3.90 (2H, m, Indoline C2-H), 4.10 (2H, q, J = 7.1Hz, 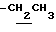 ), 6.76 (1H, s, Indoline C5-H), 7.90 (1H, s, Indoline C7-H).
), 6.76 (1H, s, Indoline C5-H), 7.90 (1H, s, Indoline C7-H).
(6) 1-ацетил-3-(2-этоксикарбонилэтил)-4,6-диметилиндолин (3.3 г) растворяют в AcOH (30 мл) и добавляют Br2 (0.93 мл) с последующим перемешиванием в течение 30 минут. Реакционную смесь вливают в ледяную воду и выпавшие неочищенные кристаллы собирают фильтрацией. Полученные кристаллы
растворяют в CHCl3 (100 мл). После промывания водой смесь сушат над безводным сульфатом натрия. CHCl3 выпаривают при пониженном давлении. Остаток очищают с помощью хроматографии на колонке с силикагелем (элюент: CHCl3/MeOH= 50/1-10/1) с получением 3.0 г 1-ацетил-5-бром-3-(2-этоксикарбонил-этил)-4,6-диметилиндолина.
IR (Nujol) cm-1: 1729, 1641.
1H-NMR(CDCl3) δ :
1.24 (3H, t, J = 7.1Hz, 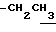 ), 1.60~2.20 (2H, m,
), 1.60~2.20 (2H, m, 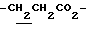 ), 2.00~ 2.20 (2H, m,
), 2.00~ 2.20 (2H, m, 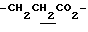 ), 2.21 (3H, s, > NCOCH3), 2.36, 2.36 (6H, s•2, -CH3•2), 3.10~3.60 (1H, m, Indoline C3-H), 3.90 (2H, m, Indoline C2-H), 4.10 (2H, q, J= 7.1 Hz,
), 2.21 (3H, s, > NCOCH3), 2.36, 2.36 (6H, s•2, -CH3•2), 3.10~3.60 (1H, m, Indoline C3-H), 3.90 (2H, m, Indoline C2-H), 4.10 (2H, q, J= 7.1 Hz, 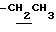 ), 8.08 (1H, s, Indoline C7-H).
), 8.08 (1H, s, Indoline C7-H).
(7) К смеси AcOH (10 мл) концентрированной серной кислоты (10 мл) и азотной кислоты (0.55 мл) добавляют порциями 1-ацетил-5-бром-3-(2-этоксикарбонилэтил)-4,6-диметилиндолин (3.0 г) при 0oC и смесь перемешивают при той же температуре в течение 5 часов. Реакционную смесь выливают в ледяную воду и экстрагируют CHCl3 (100 мл). После промывания водой смесь сушат над безводным сульфатом натрия. CHCl3 выпаривают при пониженном давлении. Остаток очищают с помощью хроматографии на колонке с силикагелем (элюент: CHCl3/MeOH= 50/1-10/1) с получением 2.7 г 1-ацетил-5-бром-3-(2-этоксикарбонилэтил)-4,6-диметил-7-нитроиндолина.
1H-NMR (CDCl3) δ :
1.26 (3H, t, J= 7.1Hz, 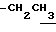 ), 1.60~2.20 (2H, m,
), 1.60~2.20 (2H, m, 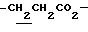 ), 2.00~ 2.20 (2H, m,
), 2.00~ 2.20 (2H, m, 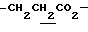 ), 2.23 (3H, s, > NCOCH3), 2.44, 2.47 (6H, s•2, -CH3•2), 3.10~3.60 (1H, m, Indoline C3-H), 4.00 (2H, m, Indoline C2-H), 4.10 (2H, q, J= 7.1 Hz,
), 2.23 (3H, s, > NCOCH3), 2.44, 2.47 (6H, s•2, -CH3•2), 3.10~3.60 (1H, m, Indoline C3-H), 4.00 (2H, m, Indoline C2-H), 4.10 (2H, q, J= 7.1 Hz, 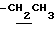 ).
).
(8) 1-ацетил-5-бром-3-(2-этоксикарбонилэтил)-4,6-диметил-7- нитроиндолин (2.7 г) растворяют в бензоле (100 мл) и добавляют 5% Pd-C (500 мг) с последующим каталитическим гидрированием при комнатной температуре и атмосферном давлении. Pd-C отфильтровывают и бензол выпаривают при пониженном давлении. К остатку добавляют CHCl3 (100 мл) и смесь промывают последовательно насыщенным водным раствором гидрокарбоната натрия и насыщенным солевым раствором и сушат над безводным сульфатом натрия. CHCl3 (20 мл) выпаривают при пониженном давлении. Остаток растворяют в CHCl3 (20 мл) и добавляют пивалоилхлорид (790 мг) и Et3N (80 мг) с последующим перемешиванием при комнатной температуре в течение 30 минут. Добавляют CHCl3 (100 мл) и смесь промывают последовательно 5% водной лимонной кислотой и насыщенным солевым раствором и сушат над безводным сульфатом натрия. CHCl3 выпаривают при пониженном давлении. Остаток очищают с помощью хроматографии на колонке с силикагелем (элюент: CHCl3/MeOH= 50/1-10/1) с получением 2.6 г N-[1-ацетил-3-(2-этоксикарбонилэтил)-4,6-диметилиндолин-7-ил]-2,2- диметилпропанамида.
1H-NMR (CDCl3) δ :
1.25 (9H, s, -C(CH3)3), 1.26 (3H, t, J= 7.1 Hz, 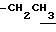 ), 1.60~2.20 (2H, m,
), 1.60~2.20 (2H, m, 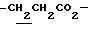 ), 2.00~2.20 (2H, m,
), 2.00~2.20 (2H, m, 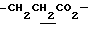 ), 2.17, 2.20, 2.27 (9H, s•3, -CH3•2, >NCOCH3), 3.00~3.20 (1H, m, Indoline C3-H), 3.90 (2H, m, Indoline C2-H), 4.10 (2H, q, J = 7.1Hz,
), 2.17, 2.20, 2.27 (9H, s•3, -CH3•2, >NCOCH3), 3.00~3.20 (1H, m, Indoline C3-H), 3.90 (2H, m, Indoline C2-H), 4.10 (2H, q, J = 7.1Hz, 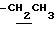 ), 6.88 (1H, s, Indoline C5-H), 9.00 (1H, br, -CONH-).
), 6.88 (1H, s, Indoline C5-H), 9.00 (1H, br, -CONH-).
(9) N-[1-ацетил-3-(2-этоксикарбонилэтил)-4,6-диметилиндолин-7-ил] - 2,2-диметилпропанамид (2.6 г) растворяют в EtOH (40 мл) и добавляют раствор КОН (1.3 г) в воде (10 мл) с последующим нагреванием с обратным холодильником в течение 20 часов. EtOH выпаривают при пониженном давлении и смесь доводят до pH 5 2N соляной кислотой и экстрагируют CHCl3 (100 мл). Слой CHCl3 промывают водой и сушат над безводным сульфатом натрия. CHCl3 выпаривают при пониженном давлении с получением 1.5 г N-[3-(2-карбоксиэтил)-4,6-диметилиндолин-7-ил]-2,2-диметилпропанамида.
1H-NMR (CDCl3) δ :
1.33 (9H, s, -C(CH3)3), 1.60~2.20 (2H, m, 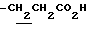 ), 2.14, 2.26 (6H, s•3, -CH3•2), 2.20~ 2.40 (2H, m,
), 2.14, 2.26 (6H, s•3, -CH3•2), 2.20~ 2.40 (2H, m, 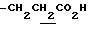 ), 3.10~3.80 (3H, m, Indoline C2-H, C3-H), 6.44 (1H, s, Indoline C5-H), 6.74 (2H, br, -CO2H, >NH).
), 3.10~3.80 (3H, m, Indoline C2-H, C3-H), 6.44 (1H, s, Indoline C5-H), 6.74 (2H, br, -CO2H, >NH).
(10) N-[3-(2-карбоксиэтил)-4,6-диметилиндолин-7-ил]-2,2- диметилпропанамид (1.5 г) растворяют в AcOEt (10 мл) и добавляют раствор CH2N2 в эфире. Добавляют AcOEt (100 мл) и после промывания водой смесь сушат над безводным сульфатом натрия. AcOEt выпаривают при пониженном давлении. Остаток очищают с помощью хроматографии на колонке с силикагелем (элюент: CHCl3/MeOH-50/1-10/1) с получением 1.0 г N-[3-(2- метоксикарбонилэтил)-4,6-диметилиндолин-7-ил]-2,2-диметилпропанамида.
1H-NMR (CDCl3) δ :
1.34 (9H, s, -C(CH3)3), 1.60~2.20 (2H, m, 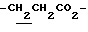 ), 2.15, 2.23 (6H, s•2, -CH3•2), 2.20~2.40 (2H, m,
), 2.15, 2.23 (6H, s•2, -CH3•2), 2.20~2.40 (2H, m, 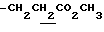 ), 3.10~3.80 (3H, m, Indoline C2-H, C3-H), 3.64 (2H, s, -CO2CH3), 6.40 (1H, s, Indoline C5-H), 7.05 (1H, br, >NH).
), 3.10~3.80 (3H, m, Indoline C2-H, C3-H), 3.64 (2H, s, -CO2CH3), 6.40 (1H, s, Indoline C5-H), 7.05 (1H, br, >NH).
(11) N-[3-(2-метоксикарбонилэтил)-4,6-диметилиндолин-7-ил]-2,2- диметилпропанамид (1.0 г) растворяют в ДМФ (10 мл) и добавляют 1-йодоктан (1.44 г) и K2CO3 (830 мг) с последующим перемешиванием при 40oC в течение 10 часов. Добавляют AcOEt (100 мл) и после промывания водой смесь сушат над безводным сульфатом натрия. AcOEt выпаривают при пониженном давлении. Остаток очищают с помощью хроматографии на колонке с силикагелем (элюент: бензол/ AcOEt= 20/1-5/1) с получением 1.1 г соединения, названного в заголовке.
IR (Nujol) cm-1; 1730, 1620.
1H-NMR (CDCl3) δ :
0.70~ 1.00 (3H, br-t, 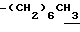 ), 1.32 (9H, s, -C(CH3)3), 1.00~1.60 (12H, m.
), 1.32 (9H, s, -C(CH3)3), 1.00~1.60 (12H, m. 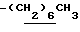 ), 1.60~2.20 (2H, m,
), 1.60~2.20 (2H, m, 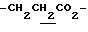 ), 2.05, 2.18 (6H, s•2, -CH3•2), 2.20~2.40 (2H, m,
), 2.05, 2.18 (6H, s•2, -CH3•2), 2.20~2.40 (2H, m, 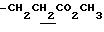 ), 3.10~3.80 (5H, m, Indoline C2-H, C3-H, >NCH2-), 3.64 (3H, s, -CO2CH3), 6.38 (1H, s, Indoline C5-H), 6.70 (1H, br, -CONH-).
), 3.10~3.80 (5H, m, Indoline C2-H, C3-H, >NCH2-), 3.64 (3H, s, -CO2CH3), 6.38 (1H, s, Indoline C5-H), 6.70 (1H, br, -CONH-).
Пример 11
N-[1-октил-3-(2-карбоксиэтил)-4,6-диметилиндолин-7-ил] -2,2- диметилпропанамид
N-[1-октил-3-(2-метоксикарбонилэтил)-4,6-диметилиндолин-7-ил]- 2,2-диметилпропанамид (1.1 г) растворяют в EtOH (10 мл) и добавляют раствор NaOH (494 мг) в воде (3 мл) с последующим перемешиванием при комнатной температуре в течение 30 минут. EtOH выпаривают при пониженном давлении и добавляют CHCl3 (50 мл). После промывания последовательно 5% водной лимонной кислотой и насыщенным солевым раствором смесь сушат над безводным сульфатом натрия. CHCl3 выпаривают при пониженном давлении. Остаток очищают с помощью хроматографии на колонке с силикагелем (элюент: CHCl3/MeOH=50/1-10/1) с получением 800 мг соединения, названного в заголовке.
IR (Nujol) cm-1: 1700, 1680
1H-NMR (CDCl3) δ :
0.70~ 1.00 (3H, br-t, 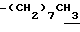 ), 1.38 (9H, s, -C(CH3)3), 1.00~1.60 (12H, m,
), 1.38 (9H, s, -C(CH3)3), 1.00~1.60 (12H, m, 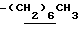 ), 1.60~2.20 (2H, m,
), 1.60~2.20 (2H, m, 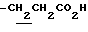 ), 2.07, 2.16 (6H, s•2, -CH3•2), 2.20~ 2.40 (2H, m, -CH2CH2CO2H), 3.10~3.80 (3H, m, Indoline C2-H, C3-H), 3.27 (2H, br-t, >NCH2-), 6.45 (1H, s, Indoline C5-H), 7.20 (1H, br, -CONH-), 7.60 (1H, br, -CO2H).
), 2.07, 2.16 (6H, s•2, -CH3•2), 2.20~ 2.40 (2H, m, -CH2CH2CO2H), 3.10~3.80 (3H, m, Indoline C2-H, C3-H), 3.27 (2H, br-t, >NCH2-), 6.45 (1H, s, Indoline C5-H), 7.20 (1H, br, -CONH-), 7.60 (1H, br, -CO2H).
Пример 12
N-(1-октил-5-карбоксиметил)-4,6-диметилиндол-7-ил] -2,2- диметилпропанамид
(1) N-(5-этоксикарбонилметил-4,6-диметилиндолин-7-ил]-2,2- диметилпропанамид (1.0 г) растворяют в ксилоле (75 мг) и добавляют 10% Pd-C (250 мг) с последующим нагреванием с обратным холодильником в течение 1 часа. Pd-C отфильтровывают и ксилол выпаривают при пониженном давлении. Остаток очищают с помощью хроматографии на колонке с силикагелем (элюент: бензол-CHCl3) с получением 0.9 г N-(5-этоксикарбонилметил-4,6-диметилиндол-7-ил)-2,2-диметилпропанамида.
IR (Nujol) cm-1: 1732, 1629.
1H-NMR (CDCl3) δ :
1.23 (3H, t, J=7.0Hz, 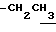 ), 1.40 (9H, s, -C(CH3)3), 2.32 (3H, s, -CH3), 2.52 (3H, s, -CH3), 3.80 (2H, m, -CH2CO2-), 4.13 (2H, q, J=7.0Hz,
), 1.40 (9H, s, -C(CH3)3), 2.32 (3H, s, -CH3), 2.52 (3H, s, -CH3), 3.80 (2H, m, -CH2CO2-), 4.13 (2H, q, J=7.0Hz, 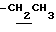 ), 6.50 (1H, t, J=2.0Hz, Indole C3-H), 7.11 (1H, t, J=2.0Hz, Indole C2-H), 7.35 (1H, br, -CONH-), 8.88 (1H, br, >NH).
), 6.50 (1H, t, J=2.0Hz, Indole C3-H), 7.11 (1H, t, J=2.0Hz, Indole C2-H), 7.35 (1H, br, -CONH-), 8.88 (1H, br, >NH).
(2) N-(5-этоксикарбонилметил-4,6-диметилиндол-7-ил)-2,2- диметилпропанамид (1,45 г) растворяют в ДМФ (10 мл) и добавляют NaH (П=60%, 132 мг) в атмосфере азота с последующим перемешиванием при комнатной температуре в течение 1 часа. Затем, добавляют 1-йодоктан (91.06 г) и смесь перемешивают при той же температуре в течение 2 часов. Реакционную смесь выливают в ледяную воду. Смесь экстрагируют AcOEt (100 мл), промывают водой и сушат над безводным сульфатом натрия. AcOEt выпаривают при пониженном давлении. Остаток очищают с помощью хроматографии на колонке с силикагелем (элюент: бензол/ AcOEt= 1/0-1/1) с получением 1.02 г N-(1-октил-5-этоксикарбонилметил-4,6-диметилиндол-7-ил)-2,2- диметилпропанамида.
IR (Nujol) cm-1: 1735, 1651.
1H-NMR (CDCl3) δ :
0.70~ 1.10 (3H, br-t, 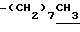 ), 1.10~ 1.70 (15H, m,
), 1.10~ 1.70 (15H, m, 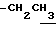 ,
, 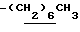 ), 1.38 (9H, s, -C(CH3)3), 2.21 (3H, s, -CH3), 2.47 (3H, s, -CH3), 3.79 (2H, m, -CH2CO2-), 3.90~4.30 (4H, m,
), 1.38 (9H, s, -C(CH3)3), 2.21 (3H, s, -CH3), 2.47 (3H, s, -CH3), 3.79 (2H, m, -CH2CO2-), 3.90~4.30 (4H, m, 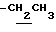 , > NCH2-), 6.42 (1H, t, J=3.5Hz, Indole C3-H), 6.91 (1H, t, J=3.5Hz, Indole C2-H), 7.12 (1H, br, -CONH-).
, > NCH2-), 6.42 (1H, t, J=3.5Hz, Indole C3-H), 6.91 (1H, t, J=3.5Hz, Indole C2-H), 7.12 (1H, br, -CONH-).
(3) N-(1-октил-5-этоксикарбонилметил-4,6-диметилиндол-7-ил)-2,2- диметилпропанамид (3.5 г) растворяют в EtOH (50 мл) и добавляют раствор NaOH (1.6 г) в воде (20 мл) с последующим перемешиванием при 60oC в течение 1 часа. EtOH выпаривают при пониженном давлении и остаток растворяют в воде (20 мл) и промывают AcOEt (10 мл). Водный слой нейтрализуют 2N HCl и экстрагируют AcOEt (50 мл). Слой AcOEt промывают последовательно насыщенным солевым раствором и сушат над безводным сульфатом натрия. AcOEt выпаривают при пониженном давлении с получением 2.0 г целевого соединения.
IR (Nujol) cm-1: 1705, 1647.
1H-NMR (CDCl3) δ :
0.70~ 1.10 (3H, br, 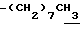 ), 1.10~1.70 (12H, m,
), 1.10~1.70 (12H, m, 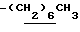 ), 1.33 (9H, s, -C(CH3)3), 2.10 (3H, s, -CH3), 2.39 (3H, s, -CH3), 3.65 (1H, br, -CO2H), 4.07 (2H, br-t, >NCH2-), 4.15 (2H, s, -CH2CO2-), 6.38 (1H, t, J= 3.5Hz, Indole C3-H), 6.89 (1H, t, J=3.5Hz, Indole C2-H), 7.25 (1H, br, -CONH-).
), 1.33 (9H, s, -C(CH3)3), 2.10 (3H, s, -CH3), 2.39 (3H, s, -CH3), 3.65 (1H, br, -CO2H), 4.07 (2H, br-t, >NCH2-), 4.15 (2H, s, -CH2CO2-), 6.38 (1H, t, J= 3.5Hz, Indole C3-H), 6.89 (1H, t, J=3.5Hz, Indole C2-H), 7.25 (1H, br, -CONH-).
Примеры 13-119
По методикам, описанным в любом из представленных выше примеров 1-12, получают соединения из таблиц 1-9.
Значения 1H-ЯМР соединений примеров 13 - 119 показаны ниже.
Пример 13: 0.7~1.1 (3H, br-t), 1.1~1.7 (6H, m), 1.33 (9H, s), 2.01 (3H, s), 2.15 (3H, s), 2.70~3.10 (4H, m), 3.41 (2H, t), 3.56 (2H, s), 7.6~8.1 (2H, br).
Пример 14: 0.70-1.70 (8H, m), 1.1-1.7 (6H, m), 1.33 (9H, s), 2.01 (3H, s), 2.15 (3H, s), 2.70-3.10 (3H, m), 3.41 (2H, t), 3.56 (2H, s), 7.6 -8.1 (2H, br).
Пример 15: 0.87 (6H, d), 1.1-1.8 (3H, m), 1.33 (9H, s), 2.01 (3H, s), 2.15 (3H, s), 2.70-3.10 (4H, m), 3.41 (2H, t), 3.56 (2H, s), 7.6-8.1 (2H, br).
Пример 16: 1.65 (6H, s), 1.33 (9H, s), 2.01 (3H, s), 2.15 (3H, s), 2.70-3.10 (4H, m), 3.41 (2H, t), 3.56 (2H, s), 5.20 (1H, br-t), 7.6-8.1 (2H, br).
Пример 17: 1.59 (3H, t), 1.33 (9H, s), 2.01 (3H, s), 2.15 (3H, s), 2.70-3.10 (4H, m), 3.3-3.6 (6H, m), 3.56 (2H, s), 7.6-8.1 (2H, br).
Пример 18: 0.7-1.1 (3H, br-t), 1.1-1.7 (8H, m), 1.33 (9H, s), 2.01 (3H, s), 2.15 (3H, s), 2.70-3.10 (4H, m), 3.41 (2H, t), 3.56 (2H, s), 7.6-8.1 (2H, br).
Пример 19: 0.7-1.70 (10H, m), 1.33 (9H, s), 2.01 (3H, s), 2.15 (3H, s), 2.70-3.10 (3H, m), 3.41 (2H, t), 3.56 (2H, s), 7.6-8.1 (2H, br).
Пример 20: 0.7-1.70 (9H, m), 1.33 (9H, s), 2.01 (3H, s), 2.15 (3H, s), 2.70-3.10 (4H, m), 3.41 (2H, t), 3.56 (2H, s), 7.6-8.1 (2H, br).
Пример 21: 0.87 (6H, d), 1.1-1.8 (5H, m), 1.33 (9H, s), 2.01 (3H, s), 2.15 (3H, s), 2.70-3.10 (4H, m), 3.41 (2H, t), 3.56 (2H, s), 7.6-8.1 (2H, br).
Пример 22: 0.7-1.0 (6H, br-t), 1.0-1.7 (5H, m), 1.33 (9H, s), 2.01 (3H, s), 2.15 (3H, s), 2.70-3.10 (4H, m), 3.41 (2H, t), 3.56 (2H, s), 7.6-8.1 (2H, br).
Пример 23: 1.59 (3H, br-t), 1.0-1.7 (2H, m), 1.33 (9H, s), -2.01 (3H, s), 2.15 (3H, s), 2.70-3.10 (4H, m), 3.3-3.6 (6H, m), 3.56 (2H, s), 7.6-8.1 (2H, br).
Пример 24: 0.7-1.10 (3H, br-t), 1.1-1.7 (10H, m), 1.33 (9H, s), 2.01 (3H, s), 2.15 (3H, s), 2.70-3.10 (4H, m), 3.41 (2H, t), 3.56 (2H, s), 7.6-8.1 (2H, br).
Пример 25: 0.7-1.70 (11H, m), 1.33 (9H, s), 2.01 (3H, s), 2.15 (3H, s), 2.70-3.10 (4H, m), 3.41 (2H, t), 3.56 (2H, s), 7.6-8.1 (2H, br).
Пример 26: 0.87 (6H, d), 1.1-1.8 (7H, m), 1.33 (9H, s), 2.01 (3H, s), 2.15 (3H, s), 2.70-3.10 (4H, m), 3.41 (2H, t), 3.56 (2H, s), 7.6-8.1 (2H, br).
Пример 27: 1.59 (6H, br-t), 1.1-1.7 (7H, m), 1.33 (9H, s), 2.01 (3H, s), 2.15 (3H, s), 2.70-3.10 (4H, m), 3.41 (2H, t), 3.56 (2H, s), 7.6-8.1 (2H, br).
Пример 28: 1.59 (3H, br-t), 1.0-1.7 (4H, m), 1.33 (9H, s), 2.01 (3H, s), 2.15 (3H, s), 2.70-3.10 (4H, m), 3.3-3.6 (6H, m), 3.56 (2H, s), 7.6-8.1 (2H, br).
Пример 29: 0.79-1.70 (13H, m), 1.33 (9H, s), 2.01 (3H, s), 2.15 (3H, s), 2.70-3.10 (4H, m), 3.41 (2H, t), 3.56 (2H, s), 7.6-8.1 (2H, br).
Пример 30: 0.87 (6H, d), 1.1-1.8 (9H, m), 1.33 (9H, s), 2.01 (3H, s), 2.15 (3H, s), 2.70-3.10 (4H, m), 3.41 (2H, t), 3.56 (2H, s), 7.6-8.1 (2H, br).
Пример 31: 1.59 (6H, br-t), 1.0-1.7 (9H, m), 1.33 (9H, s), 2.01 (3H, s), 2.15 (3H, s), 2.70-3.10 (4H, m), 3.41 (2H, t), 3.56 (2H, s), 7.6-8.1 (2H, br).
Пример 32: 1.59 (3H, br-t), 1.0-1.7 (6H, m), 1.33 (9H, s), 2.01 (3H, s), 2.15 (3H, s), 2.70-3.10 (4H, m), 3.3-3.6 (6H, m), 3.56 (2H, s), 7.6-8.1 (2H, br).
Пример 33: 0.7 - 1.10 (3H, br-t), 1.1-1.7 (14H, m), 1.33 (9H, s), 2.01 (3H, s), 2.15 (3H, s), 2.70-3.10 (4H, m), 3.41 (2H, t), 3.56 (2H, s), 7.6-8.1 (2H, br).
Пример 34: 0.87 (6H, d), 1.1-1.8 (11H, m), 1.33 (9H, s), 2.01 (3H, s), 2.15 (3H, s), 2.70-3.10 (4H, m), 3.41 (2H, t), 3.56 (2H, s), 7.6-8.1 (2H, br).
Пример 35: 1.59 (6H, br-t), 1.0-1.7 (11H, m), 1.33 (9H, s), 2.01 (3H, s), 2.15 (3H, s), 2.70-3.10 (4H, m), 3.41 (2H, t), 3.56 (2H, s), 7.6-8.1 (2H, br).
Пример 36: 0.7-1.10 (3H, br-t), 1.1-1.7 (16H, m), 1.33 (9H, s), 2.01 (3H, s), 2.15 (3H, s), 2.70-3.10 (4H, m), 3.41 (2H, t), 3.56 (2H, s), 7.6-8.1 (2H, br).
Пример 37: 0.87 (6H, d), 1.1-1.8 (13H, m), 1.33 (9H, s), 2.01 (3H, s), 2.15 (3H, s), 2.70-3.10 (4H, m), 3.41 (2H, t), 3.56 (2H, s), 7.6-8.1 (2H, br).
Пример 38: 0.7-1.10 (3H, br-t), 1.1-1.7 (18H, ш), 1.33 (9H, s), 2.01 (3H, s), 2.15 (3H, s), 2.70-3.10 (4H, m), 3.41 (2H, t), 3.56 (2H, s), 7.6-8.1 (2H, br).
Пример 39: 0.87 (6H, d), 1.1-1.8 (15H, m), 1.33 (9H, s), 2.01 (3H, s), 2.15 (3H, s), 2.70-3.10 (4H, m), 3.41 (2H, t), 3.56 (2H, s), 7.6-8.1 (2H, br).
Пример 40: 0.7-1.10 (3H, br-t), 1.1-1.7 (20H, m), 1.33 (9H, s), 2.01 (3H, s), 2.15 (3H, s), 2.70-3.10 (4H, m), 3.41 (2H, t), 3.56 (2H, s), 7.6-8.1 (2H, br).
Пример 41: 0.87 (6H, d), 1.1-1.8 (17H, m), 1.33 (9H, s), 2.01 (3H, s), 2.15 (3H, s), 2.70-3.10 (4H, m), 3.41 (2H, t), 3.56 (2H, s), 7.6-8.1 (2H, br).
Пример 42: 0.7-1.10 (6H br-t), 1.1-2.0 (20H, m), 2.01 (3H, s), 2.15 (3H, s), 2.70-3.10 (4H, m), 3.41 (2H, t), 3.56 (2H, s), 7.6-8.1 (2H, br).
Пример 43: 0.7-1.10 (6H, br-t), 1.0-2.0 (22H, m), 2.01 (3H, s), 2.15 (3H, s), 2.70-3.10 (4H, m), 3.41 (2H, t), 3.56 (2H, s), 7.6-8.1 (2H, br).
Пример 44: 0.7-1.10 (6H, br-t), 1.0-2.0 (24H, т), 2.01 (3H, s), 2.15 (3H, s), 2.70-3.10 (4H, m), 3.41 (2H, t), 3.56 (2H, s), 7.6-8.1 (2H, br).
Пример 45: 0.7-1.10 (6H, br-t), 1.0-2.0 (24H, ш), 2.01 (3H, s), 2.15 (3H, s), 2.70 -3.10 (4H, m), 3.41 (2H, t), 3.56 (2H, s), 7.6-8.1 (2H, br).
Пример 46: 0.7-1.10 (6H, br-t), 1.0-2.0 (26H, m), 2.01 (3H, s), 2.15 (3H, s), 2.70-3.10 (4H, m), 3.41 (2H, t), 3.56 (2H, s), 7.6-8.1 (2H, br).
Пример 47: 0.7-1.10 (6H, br-t), 1.0-2.0 (28H, т), 2.01 (3H, s), 2.15 (3H, s), 2.70 -3.10 (4H, m), 3.41 (2H, t), 3.56 (2H, s), 7.6-8.1 (2H, br).
Пример 48: 0.7-1.10 (6H, br-t), 1.0 -2.0 (28H, m), 2.01 (3H, s), 2.15 (3H, s), 2.70 - 3.10 (4H, m), 3.41 (2H, t), 3.56 (2H, s), 7.6-8.1 (2H, br).
Пример 49: 0.7-1.10 (6H, br-t), 1.0-2.0 (30H, m), 2.01 (3H, s), 2.15 (3H, s), 2.70-3.10 (4H, m), 3.41 (2H, t), 3.56 (2H, s), 7.6-8.1 (2H, br).
Пример 50: 0.7-1.10 (6H, br-t), 1.0-2.0 (32H, m), 2.01 (3H, s), 2.15 (3H, s), 2.70-3.10 (4H, m), 3.41 (2H, t), 3.56 (2H, s), 7.6-8.1 (2H, br).
Пример 51: 0.7-1.1 (3H, br-t), 1.1-1.7 (14H, m), 1.33 (9H, s), 2.42 (2H, q), 2.46 (2H, q), 2.7 -3.1 (4H, m), 3.41 (2H, t), 3.56 (2H, t), 7.6-8.1 (2H, br).
Пример 52: 0.7-1.1 (3H, br-t), 1.0-1.7 (16H, m), 1.33 (9H, s), 2.42 (2H, q), 2.46 (2H, q), 2.7-3.1 (4H, m), 3.41 (2H, t), 3.56 (2H, t), 7.6-8.1 (2H, br).
Пример 53: 0.7-1.1 (3H, br-t), 1.0-1.7 (18H, m), 1.33 (9H, s), 2.42 (2H, q), 2.46 (2H, q), 2.7-3.1 (4H, m), 3.41 (2H, t), 3.56 (2H, t), 7.6-8.1 (2H, br).
Пример 54: 0.7-1.1 (3H, br-t), 1.0-1.7 (20H, m), 1.33 (9H, s), 2.42 (2H, q), 2.46 (2H, q), 2.7-3.1 (4H, m), 3.41 (2H, t), 3.56 (2H, t), 7.6-8.1 (2H, br).
Пример 55: 0.7-1.1 (3H, br-t), 1.0-1.7 (22H, m), 1.33 (9H, s), 2.42 (2H, q), 2.46 (2H, q), 2.7-3.1 (4H, m), 3.41 (2H, t), 3.56 (2H, t), 7.6-8.1 (2H, br).
Пример 56: 0.7-1.1 (3H, br-t), 1.1-1.7 (8H, m), 1.33 (9H, s), 2.50-3.10 (4H, m), 3.32 (2H, t), 3.45 (2H, s), 3.73 (3H, s), 3.77 (3H, s), 7.6-8.1 (2H, br).
Пример 57: 0.7-1.1 (3H, br-t), 1.0-1.7 (10H, m), 1.33 (9H, s), 2.50-3.10 (4H, m), 3.32 (2H, t), 3.45 (2H, s), 3.73 (3H, s), 3.77 (3H, s), 7.6-8.1 (2H, br).
Пример 58: 0.7-1.1 (3H, br-t), 1.0-1.7 (12H, m), 1.33 (9H, s), 2.50-3.10 (4H, m), 3.32 (2H, t), 3.45 (2H, s), 3.73 (3H, s), 3.77 (3H, s), 7.6-8.1 (2H, br).
Пример 59: 0.7-1.1 (3H, br-t), 1.0-1.7 (14H, m), 1.33 (9H, s), 2.50-3.10 (4H, m), 3.32 (2H, t), 3.45 (2H, s), 3.73 (3H, s), 3.77 (3H, s), 7.6-8.1 (2H, br).
Пример 60: 0.7-1.1 (3H, br-t), 1.0-1.7 (16H, m), 1.33 (9H, s), 2.50-3.10 (4H, m), 3.32 (2H, t), 3.45 (2H, s), 3.73 (3H, s), 3.77 (3H, s), 7.6-8.1 (2H, br).
Пример 61: 0.7-1.1 (3H, br-t), 1.1-1.7 (8H, m), 1.33 (9H, s), 2.14 (3H, s), 2.22 (3H, s), 2.70-3.10 (4H, m), 3.41 (2H, t), 4.62 (2H, s), 6.86 (2H, br).
Пример 62: 0.7-1.1 (3H, br-t), 1.1-1.7 (10H, m), 1.33 (9H, s), 2.14 (3H, s), 2.22 (3H, s), 2.70-3.10 (4H, m), 3.41 (2H, t), 4.62 (2H, s), 6.86 (2H, br).
Пример 63: 0.7-1.1 (3H, br-t), 1.1-1.7 (14H, m), 1.33 (9H, s), 2.14 (3H, s), 2.22 (3H, s), 2.70-3.10 (4H, m), 3.41 (2H, t), 4.62 (2H, s), 6.86 (2H, br).
Пример 64: 0.7-1.1 (3H, br-t), 1.1-1.7 (16H, m), 1.33 (9H, s), 2.14 (3H, s), 2.22 (3H, s), 2.70-3.10 (4H, m), 3.41 (2H, t), 4.62 (2H, s), 6.86 (2H, br).
Пример 65: 0.7-1.1 (3H, br-t), 1.1-1.7 (8H, m), 1.33 (9H, s), 2.00 (6H, s), 2.09 (3H, s), 2.23 (3H, s), 2.70-3.20 (4H, m), 3.31 (2H, s), 3.38 (2H, t), 6.84 (1H, br).
Пример 66: 0.7-1.1 (3H, br-t), 1.1-1.7 (10H, m), 1.33 (9H, s), 2.00 (6H, s), 2.09 (3H, s), 2.23 (3H, s), 2.70-3.20 (4H, m), 3.31 (2H, s), 3.38 (2H, t), 6.84 (1H, br).
Пример 67: 0.7-1.1 (3H, br-t), 1.1-1.7 (14H, m), 1.33 (9H, s), 2.00 (6H, s), 2.09 (3H, s), 2.23 (3H, s), 2.70-3.20 (4H, m), 3.31 (2H, s), 3.38 (2H, t), 6.84 (1H, br).
Пример 68: 0.7-1.1 (3H, br-t), 1.1-1.7 (16H, m), 1.33 (9H, s), 2.00 (6H, s), 2.09 (3H, s), 2.23 (3H, s), 2.70-3.20 (4H, m), 3.31 (2H, s), 3.38 (2H, t), 6.84 (1H, br).
Пример 69: 0.7-1.0 (3H, br), 1.0-1.7 (8H, m), 1.33 (9H, s), 1.97 (3H, s), 2.7-3.1 (4H, m), 3.35 (2H, t), 3.47 (2H, s), 6.90 (1H, s), 7.6-8.1 (2H, br).
Пример 70: 0.7-1.0 (3H, br), 1.0-1.7 (10H, m), 1.33 (9H, s), 1.97 (3H, s), 2.7-3.1 (4H, m), 3.35 (2H, t), 3.47 (2H, s), 6.90 (1H, s), 7.6-8.1 (2H, br).
Пример 71: 0.7-1.0 (3H, br), 1.0-1.7 (12H, m), 1.33 (9H, s), 1.97 (3H, s), 2.7-3.1 (4H, m), 3.35 (2H, t), 3.47 (2H, s), 6.90 (1H, s), 7.6-8.1 (2H, br).
Пример 72: 0.7-1.0 (3H, br), 1.0-1.7 (14H, m), 1.33 (9H, s), 1.97 (3H, s), 2.7-3.1 (4H, m), 3.35 (2H, t), 3.47 (2H, s), 6.90 (1H, s), 7.6-8.1 (2H, br).
Пример 73: 0.7-1.0 (3H, br), 1.0-1.7 (16H, m), 1.33 (9H, s), 1.97 (3H, s), 2.7-3.1 (4H, m), 3.35 (2H, t), 3.47 (2H, s), 6.90 (1H, s), 7.6-8.1 (2H, br).
Пример 74: 0.7-1.0 (3H, br), 1.0-1.7 (8H, m), 1.33 (9H, s), 2.07 (3H, s), 2.89 (2H, t), 3.09 (2H, t), 3.40 (2H, t), 4.51 (2H, s), 6.90 (1H, s), 7.0-7.4 (2H, br).
Пример 75: 0.7-1.0 (3H, br), 1.0-1.7 (10H, m), 1.33 (9H, s), 2.07 (3H, s), 2.89 (2H, t), 3.09 (2H, t), 3.40 (2H, t), 4.51 (2H, s), 6.90 (1H, s), 7.0-7.4 (2H, br).
Пример 76: 0.7-1.0 (3H, br), 1.0-1.7 (12H, m), 1.33 (9H, s), 2.07 (3H, s), 2.89 (2H, t), 3.09 (2H, t), 3.40 (2H, t), 4.51 (2H, s), 6.90 (1H, s), 7.0-7.4 (2H, br).
Пример 77: 0.7-1.0 (3H, br), 1.0-1.7 (14H, m), 1.33 (9H, s), 2.07 (3H, s), 2.89 (2H, t), 3.09 (2H, t), 3.40 (2H, t), 4.51 (2H, s), 6.90 (1H, s), 7.0-7.4 (2H, br).
Пример 78: 0.7-1.0 (3H, br), 1.0-1.7 (16H, m), 1.33 (9H, s), 2.07 (3H, s), 2.89 (2H, t), 3.09 (2H, t), 3.40 (2H, t), 4.51 (2H, s), 6.90 (1H, s), 7.0-7.4 (2H, br).
Пример 79: 0.7-1.0 (3H, br), 1.0-1.7 (8H, m), 1.33 (9H, s), 2.08 (3H, s), 2.23 (6H, s), 2.89 (2H, t), 3.14 (2H, t), 3.30 (2H, s), 3.38 (2H, t), 6.84 (1H, s), 6.90 (1H, br).
Пример 80: 0.7-1.0 (3H, br), 1.0-1.7 (10H, m), 1.33 (9H, s), 2.08 (3H, s), 2.23 (6H, s), 2.89 (2H, t), 3.14 (2H, t), 3.30 (2H, s), 3.38 (2H, t), 6.84 (1H, s), 6.90 (1H, br).
Пример 81: 0.7-1.0 (3H, br), 1.0-1.7 (12H, m), 1.33 (9H, s), 2.08 (3H, s), 2.23 (6H, s), 2.89 (2H, t), 3.14 (2H, t), 3.30 (2H, s), 3.38 (2H, t), 6.84 (1H, s), 6.90 (1H, br).
Пример 82: 0.7-1.0 (3H, br), 1.0-1.7 (14H, m), 1.33 (9H, s), 2.08 (3H, s), 2.23 (6H, s), 2.89 (2H, t), 3.14 (2H, t), 3.30 (2H, s), 3.38 (2H, t), 6.84 (1H, s), 6.90 (1H, br).
Пример 83: 0.7-1.0 (3H, br), 1.0-1.7 (16H, m), 1.33 (9H, s), 2.08 (3H, s), 2.23 (6H, s), 2.89 (2H, t), 3.14 (2H, t), 3.30 (2H, s), 3.38 (2H, t), 6.84 (1H, s), 6.90 (1H, br).
Пример 84: 0.7-1.0 (3H, br-t), 1.00-1.60 (8H, m), 1.38 (9H, s), 1.60-2.20 (2H, m), 2.07 (3H, s), 2.16 (3H, s), 2.20-2.40 (2H, m), 3.10-3.80 (3H, m), 3.27 (2H, br-t), 6.45 (1H, s), 7.20-7.60 (2H, br).
Пример 85: 0.7-1.0 (3H, br-t), 1.00-1.60 (10H, m), 1.38 (9H, s), 1.60-2.20 (2H, m), 2.07 (3H, s), 2.16 (3H, s), 2.20-2.40 (2H, m), 3.10-3.80 (3H, m), 3.27 (2H, br-t), 6.45 (1H, s), 7.20-7.60 (2H, br).
Пример 86: 0.7-1.0 (3H, br-t), 1.0-2.0 (10H, m), 1.33 (9H, s), 2.07 (3H, s), 2.16 (3H, s), 2.60-3.60 (7H, m), 6.44 (1H, s), 6.78 (2H, br).
Пример 87: 0.7-1.0 (3H, br-t), 1.0-2.0 (12H, m), 1.33 (9H, s), 2.07 (3H, s), 2.16 (3H, s), 2.60-3.60 (7H, m), 6.44 (1H, s), 6.78 (2H, br).
Пример 88: 0.7-1.0 (3H, br-t), 1.0-2.0 (10H, m), 1.35 (9H, s), 2.07 (3H, s), 2.16 (3H, s), 2.19 (6H, s), 2.21 (2H, t), 2.6-3.6 (5H, m), 6.45 (1H, s), 7.2 (1H, br).
Пример 89: 0.7-1.0 (3H, br-t), 1.0-2.0 (12H, m), 1.35 (9H, s), 2.07 (3H, s), 2.16 (3H, s), 2.19 (6H, s), 2.21 (2H, t), 2.6-3.6 (5H, m), 6.45 (1H, s), 7.2 (1H, br).
Пример 90: 0.7-1.0 (3H, br-t), 1.0-2.0 (14H, m), 1.35 (9H, s), 2.07 (3H, s), 2.16 (3H, s), 2.19 (6H, s), 2.21 (2H, t), 2.6-3.6 (5H, m), 6.45 (1H, s), 7.2 (1H, br).
Пример 91: 0.70-1.10 (6H, m), 1.10-1.90 (16H, m), 2.10 (6H, s), 1.80-2.00 (2H, br-t), 2.00-4.00 (6H, m), 3.55 (2H, s), 4.80 (1H, br), 5.50 (1H, br), 6.40 (1H, br).
Пример 92: 0.70-1.10 (6H, m), 1.10-1.90 (18H, m), 2.10 (6H, s), 1.80-2.00 (2H, br-t), 2.00-4.00 (6H, m), 3.55 (2H, s), 4.80 (1H, br), 5.50 (1H, br), 6.40 (1H, br).
Пример 93: 0.70-1.10 (6H, m), 1.10-1.90 (20H, m), 2.10 (6H, s), 1.80-2.00 (2H, br-t), 2.00-4.00 (6H, m), 3.55 (2H, s), 4.80 (1H, br), 5.50 (1H, br), 6.40 (1H, br).
Пример 94: 0.70-1.10 (6H, m), 1.10-1.90 (22H, m), 2.09 (4H, br-t), 1.80-2.00 (2H, br-t), 2.00-4.00 (6H, m), 3.55 (2H, s), 4.80 (1H, br), 5.50 (1H, br), 6.40 (1H, br).
Пример 95: 0.70-1.10 (6H, m), 1.10-1.90 (24H, m), 2.09 (4H, br-t), 1.80-2.00 (2H, br-t), 2.00-4.00 (6H, m), 3.55 (2H, s), 4.80 (1H, br), 5.50 (1H, br), 6.40 (1 H, br).
Пример 96: 0.70-1.10 (6H, m), 1.10-1.90 (26H, m), 2.09 (4H, br-t), 1.80-2.00 (2H, br-t), 2.00-4.00 (6H, m), 3.55 (2H, s), 4.80 (1H, br), 5.50 (1H, br), 6.40 (1H, br).
Пример 97: 0.70-1.10 (6H, m), 1.10-1.90 (16H, m), 1.80-2.00 (2H, br-t), 2.00-4.00 (6H, m), 3.35 (2H, s), 3.74 (3H, s), 3.78 (3H, s), 4.80 (1H, br), 5.50 (1H, br), 6.40 (1H, br).
Пример 98: 0.70-1.10 (6H, m), 1.10-1.90 (18H, m), 1.80-2.00 (2H, br-t), 2.00-4.00 (6H, m), 3.35 (2H, s), 3.74 (3H, s), 3.78 (3H, s), 4.80 (1H, br), 5.50 (1H, br), 6.40 (1H, br).
Пример 99: 0.70-1.10 (6H, m), 1.10-1.90 (20H, m), 1.80-2.00 (2H, br-t), 2.00-4.00 (6H, m), 3.35 (2H, s), 3.74 (3H, s), 3.78 (3H, s), 4.80 (1H, br), 5.50 (1H, br), 6.40 (1H, br).
Пример 100: 0.70-1.10 (3H, br-t), 1.10-1.70 (14H, m), 1.33 (9H, s), 2.10 (3H, s), 2.39 (3H, s), 3.71 (2H, br), 3.99 (2H, br-t), 4.15 (2H, s), 6.38 (1H, d), 6.89 (1H, d).
Пример 101: 0.70-1.10 (3H, br-t), 1.10-1.70 (10H, m), 1.33 (9H, s), 2.10 (3H, s), 2.39 (3H, s), 3.71 (2H, br), 3.99 (2H, br-t), 4.15 (2H, s), 6.38 (1H, d), 6.89 (1H, d).
Пример 102: 0.70-1.10 (3H, br-t), 1.10-1.70 (18H, m), 1.33 (9H, s), 2.08 (2H, q), 2.46 (2H, q), 3.71 (2H, br), 3.99 (2H, br-t), 4.15 (2H, s), 6.38 (1H, d), 6.89 (1H, d).
Пример 103: 0.70-1.10 (3H, br-t), 1.10-1.70 (20H, m), 1.33 (9H, s), 2.08 (2H, q), 2.46 (2H, q), 3.71 (2H, br), 3.99 (2H, br-t), 4.15 (2H, s), 6.38 (1H, d), 6.89 (1H, d).
Пример 104: 0.70-1.10-(3H, br-t), 1.10-1.70 (22H, m), 1.33 (9H, s), 2.42 (2H, q), 2.46 (2H, q), 3.71 (2H, br), 3.99 (2H, br-t), 4.15 (2H, s), 6.38 (1H, d), 6.89 (1H, d).
Пример 105: 0.70-1.10 (3H, br-t), 1.10-1.70 (12H, m), 1.33 (9H, s), 3.60 (3H, s), 3.65 (3H, s), 3.71 (2H, br), 3.99 (2H, br-t), 4.15 (2H, s), 6.15 (1H, d), 6.70 (1H, d).
Пример 106: 0.70-1.10 (3H, br-t), 1.10-1.70 (14H, m), 1.33 (9H, s), 3.60 (3H, s), 3.65 (3H, s), 3.71 (2H, br), 3.99 (2H, br-t), 4.15 (2H, s), 6.15 (1H, d), 6.70 (1H, d).
Пример 107: 0.70-1.10 (3H, br-t), 1.10-1.70 (16H, m), 1.33 (9H, s), 3.60 (3H, s), 3.65 (3H, s), 3.71 (2H, br), 3.99 (2H, br-t), 4.15 (2H, s), 6.15 (1H, d), 6.70 (1H, d):
Пример 108: 0.70-1.10 (3H, br-t), 1.10-2.00 (15H, m), 2.01 (3H, s), 2.15 (3H, s), 2.70-3.10 (4H, m), 3.37 (3H, s), 3.40 (2H, t), 3.41 (2H, t), 3.56 (2H, s), 7.60-8.10 (2H, br).
Пример 109: 0.70-1.10 (3H, br-t), 1.10-2.00 (15H, m), 2.01 (3H, s), 2.15 (3H, s), 2.17 (3H, s), 2.45 (2H, s), 2.70-3.10 (4H, m), 3.41 (2H, t), 3.56 (2H, s), 7.60-8.10 (2H, br).
Пример 110: 0.70-1.10 (3H, br-t), 1.10-2.00 (23H, m), 2.01 (3H, s), 2.70-3.10 (4H, m), 3.41 (2H, t), 3.56 (2H, s), 7.60-8.10 (2H, br).
Пример 111: 0.70-1.10 (3H, br-t), 1.10-2.00 (25H, m), 2.01 (3H, s), 2.15 (3H, s), 2.70-3.10 (4H, m), 3.41 (2H, t), 3.56 (2H, s), 7.60-8.10 (2H, br).
Пример 112: 0.70-1.10 (3H, br-t), 1.10-1.70 (12H, m), 2.01 (3H, s), 2.15 (3H, s), 2.70-3.10 (4H, m), 3.41 (2H, t), 3.56 (2H, s), 7.30-7.80 (3H, m), 7.60-8.10 (2H, br), 8.12 (2H, d).
Пример 113: 0.70-1.10 (3H, br-t), 1.10-1.70 (12H, m), 2.01 (3H, s), 2.15 (3H, s), 2.70-3.10 (4H, m), 3.41 (2H, t), 3.53 (2H, s), 3.56 (2H, s), 7.30 (5H, s), 7.60-8.10 (2H, br).
Пример 114: 1.59 (3H, br-t), 1.10-1.70 (4H, m), 1.33 (9H, s), 2.01 (3H, s), 2.15 (3H, s), 2.10-2.50 (4H, m), 2.70-3.10 (4H, m), 3.41 (2H, t), 3.56 (2H, s), 7.60-8.10 (2H, br).
Пример 115: 1.33 (9H, s), 2.01 (3H, s), 2.15 (3H, s), 3.02 (2H, t), 3.41 (2H, t), 3.56 (2H, s), 4.30 (2H, s), 7.30 (5H, s) 7.60-8.10 (2H, br).
Пример 116: 0.70-1.10 (3H, br-t), 1.10-1.60 (15H, m), 1.34 (9H, s), 2.02 (3H, s), 2.90 (2H, t), 3.13 (2H, t), 3.38 (2H, t), 3.50 (2H, s), 4.12 (2H, q), 6.80 (1H, br), 6.85 (1H, s).
Пример 117: 0.70-1.10 (3H, br-t), 1.10-2.00 (8H, m), 1.23 (9H, s), 2.07 (3H, s), 2.24 (3H, s), 2.70-3.10 (4H, m), 3.39 (2H, t), 3.35 (2H, s), 6.60-7.50 (2H, br).
Пример 118: 0.70-1.10 (3H, br-t), 1.10-2.00 (12H, m), 1.23 (9H, s), 2.07 (3H, s), 2.24 (3H, s), 2.70-3.10 (4H, m), 3.39 (2H, t), 3.35 (2H, s), 6.60-7.50 (2H, br).
Пример 119: 70-1.10 (3H, br-t), 1.10-2.00 (16H, m), 1.23 (9H, s), 2.07 (3H, s), 2.24 (3H, s), 2.70-3.10 (4H, m), 3.39 (2H, t), 3.35 (2H, s), 6.60-7.50 (2H, br).
Пример 120
N-(1-октил-5-карбоксиэтил-4,6-диметилиндолин-7- ил)-2,2-диметилпропанамид
(1) N-(1-октил-5-хлорэтил-4,6-диметилиндолин-7-ил)-2,2-диметилпропанамид (3.0 г) растворяют в CH3CN (30 мл) и добавляют NaCH (3.7 г) и 18-краун-6 (0.1 г) с последующим нагреванием с обратным холодильником в течение 17 часов в атмосфере азота. CH3CN выпаривают при пониженном давлении и в полученный остаток добавляют воду (100 мл). Смесь экстрагируют дважды AcOEt (100 мл). Слой AcOEt промывают насыщенным солевым раствором (100 мл) и сушат над безводным сульфатом натрия и AcOEt выпаривают при пониженном давлении. Полученный остаток очищают с помощью хроматографии на колонке с силикагелем (элюент: AcOEt/бензол= 1/10-1/5) с получением 1.14 г N-(1-октил-5-цианоэтил-4,6-диметилиндолин-7-ил)-2,2-диметилпропанамида.
IR (Nujol) cm-1: 2243, 1647, 1601.
1H-NMR (CDCl3) δ :
0.88 (3H, br-t, J=6.0Hz, 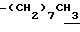 ), 1.10~1.90 (12H, m,
), 1.10~1.90 (12H, m, 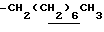 ), 1,33 (9H, s, -C(CH3)3), 2.05, 2.15 (3H•2, s•2, indoline C4,6-CH3), 2.38 (2H, t, J=7Hz, -CH2CN), 2.70~3.30 (6H, m, indoline C3-H2, >NCH2-,
), 1,33 (9H, s, -C(CH3)3), 2.05, 2.15 (3H•2, s•2, indoline C4,6-CH3), 2.38 (2H, t, J=7Hz, -CH2CN), 2.70~3.30 (6H, m, indoline C3-H2, >NCH2-, 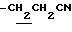 ), 3.41 (2H, t, J=9Hz, indoline C2-H2), 6.81 (1H, br, -CONH-).
), 3.41 (2H, t, J=9Hz, indoline C2-H2), 6.81 (1H, br, -CONH-).
(2) N-(1-октил-5-цианоэтил-4,6-диметилиндолин-7-ил)-2,2- диметилпропанамид (1.14 г) растворяют в EtOH (26 мл) и добавляют раствор NaOH (1.1 г) в воде (7.5 мл) с последующим нагреванием с обратным холодильником в течение 14 часов в атмосфере азота. EtOH выпаривают при пониженном давлении. Полученный остаток растворяют в теплой воде (30 мл) и промывают AcOEt (30 мл). Водный слой нейтрализуют 2N HCl и экстрагируют CHCl3 (50 мл). Слой CHCl3 выпаривают при пониженном давлении с получением 830 мг соединения, названного в заголовке.
IR (Nujol) cm-1: 1724, 1655, 1618.
1H-NMR (CDCl3) σ :
0.86 (3H, br-t, J=5.0Hz, 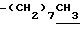 ), 1.10~2.10 (12H, m,
), 1.10~2.10 (12H, m, 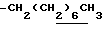 ), 1.42 (9H, s, -C(CH3)3), 2.12, 2.26 (3H•2, s•2, indoline C4,6-CH3), 2.30~ 2.60 (2H, m, -CH2CO2-), 2.90~3.40 (6H, m, indoline C3-H2, >NCH2-,
), 1.42 (9H, s, -C(CH3)3), 2.12, 2.26 (3H•2, s•2, indoline C4,6-CH3), 2.30~ 2.60 (2H, m, -CH2CO2-), 2.90~3.40 (6H, m, indoline C3-H2, >NCH2-, 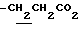 ), 3.78 (1H, br, indoline C2-H2), 7.70 (1H, br -CO2H), 9.91 (1H, br, -CONH-).
), 3.78 (1H, br, indoline C2-H2), 7.70 (1H, br -CO2H), 9.91 (1H, br, -CONH-).
Примеры 121-123
Соединения таблицы 10 получают по методике указанного выше примера 120.
Значения 1H-ЯМР соединений указанных выше примеров 121-123 показаны ниже
Пример 121: 0.91 (3H, br-t), 1.00~1.80 (12H, m), 1.37 (9H, s), 1.93 (3H, s), 2.06 (3H, s), 2.47 (4H, br-t), 3.00 (4H, br), 3.30~3.90 (4H, m), 8.60~ 9.90 (2H, br).
Пример 122: 0.90 (3H, br-t), 1.00~1.80 (6H, m), 2.08 (3H, s), 2.21 (3H, s), 2.48 (4H, br-t), 2.90~3.40 (4H, m), 3.40~3.80 (2H, m), 3.61 (2H, s), 7.34 (1H, br), 8.48 (1H, br).
Пример 123: 0.86 (3H, br-t), 1.00~1.50 (12H, m), 1.42 (9H, s), 2.00~2.90 (6H, m), 2.11 (3H, s), 2.23 (3H, s), 2.90~3.30 (4H, m), 3.70 (2H, br), 6.10 (1H, br), 9.21 (1H, br).
Пример 124
N-(1-октил-6-этоксикарбонилметил-5,7-диметил-1,2,3,4- тетрагидрохинолин-8-ил)-2,2-диметилпропанамид
(1) 3,5-ксилидин (5.0 г) и акрилонитрил (2.3 г) растворяют в уксусной кислоте (2 мл) и смесь перемешивают при 60oC в течение 20 часов. К реакционной смеси добавляют этилацетат (200 мл) и нейтрализуют насыщенным водным раствором гидрокарбоната натрия. Смесь промывают водой и сушат над безводным сульфатом натрия. Растворитель выпаривают при пониженном давлении. Остаток очищают с помощью хроматографии на колонке с силикагелем (элюент: этилацетат/бензол= 1/10- -1/3) с получением 4.5 г маслянистого β- (3,5-диметиланилин)пропионитрила.
IR (Nujol) cm-1; 2248, 1602.
1H-NMR (CDCl3) δ :
2.24 (6H, s, C3,5-CH3), 2.60 (2H, t, J=7.5Hz, 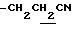 ), 3.48 (2H, t, J=7.5Hz,
), 3.48 (2H, t, J=7.5Hz, 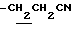 ), 3.90 (1H, br, >NH), 6.24 (2H, s, C2,6-H), 6.43 (1H, s, C4-H).
), 3.90 (1H, br, >NH), 6.24 (2H, s, C2,6-H), 6.43 (1H, s, C4-H).
(2)β- (3,5-диметиланилин)пропионитрил (4.5 г) растворяют в этаноле (50 мл) и добавляют раствор NaOH (5.1 г) в воде (25 мл) с последующим нагреванием с обратным холодильником в течение 4 часов. Растворитель выпаривают при пониженном давлении. Добавляют 2N соляной кислоты для подкисления осадка и смесь промывают хлороформом (100 мл). Водный слой концентрируют до примерно 20 мл и выстаивают. Выпавшие кристаллы собирают фильтрованием и сушат с получением 4.0 г β- (3,5-диметиланилин)пропионовой кислоты.
IR (Nujol) cm-1; 1560.
1H-NMR (DMSO-d6) δ :
2.29 (6H, s, C3,5-CH3), 2.73 (2H, t, J=7.5Hz, 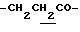 ), 3.44 (2H, t, J=7.5Hz,
), 3.44 (2H, t, J=7.5Hz, 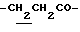 ), 7.0 (3H, s, C2,4,6-H), 9.80 (2H, br, -CO2H, >NH).
), 7.0 (3H, s, C2,4,6-H), 9.80 (2H, br, -CO2H, >NH).
(3) β- (3,5-диметиланилин)пропионовую кислоту (1.2 г) порциями добавляют к серной кислоте (60oC, 12 мл) и смесь перемешивают при той же температуре в течение 0.5 часов. Реакционную смесь выливают в ледяную воду (100 мл) и экстрагируют хлороформом (100 мл). После промывания водой слой хлороформа сушат над безводным сульфатом натрия. Растворитель выпаривают при пониженном давлении. Остаток очищают с помощью хроматографии на колонке с силикагелем (элюент: этилацетат/бензол=1/5-1/1) с получением 750 мг 5,7-диметилхинолона в виде кристаллов.
IR (Nujol) cm-1; 1645, 1614.
1H-NMR (CDCl3) δ ;
2.19 (3H, s, C5-CH3), 2.57 (3H, s, C7-CH3), 2.63 (2H, t, J=7.5H2, C3-H2), 3.49 (2H, t, J= 7.5Hz, C2-H2), 4.39 (1H, br, >NH), 6.32 (2H, s, C6,8-H).
(4) Алюмогидрид лития (687 мг) суспендируют в эфире (16 мл) и добавляют хлорид алюминия (4.2 г). Раствор 5.7-диметилхинолона (1.6 г) в эфире (16 мл) по каплям добавляют и смесь нагревают с обратным холодильником в течение 0.5 часа. Реакционную смесь выливают в ледяную воду (100 мл) и экстрагируют хлороформом (100 мл). После промывания водой слой хлороформа сушат над безводным сульфатом натрия. Растворитель выпаривают при пониженном давлении. Полученный 5,7-диметил-1,2,3,4-тетрагидрохинолин растворяют в хлороформе (30 мл) и добавляют уксусный ангидрид (929 мг) с последующим перемешиванием при комнатной температуре в течение 1 часа. К реакционной смеси добавляют хлороформ (100 мл) и смесь промывают последовательно насыщенным водным раствором гидрокарбоната натрия и водой и сушат над безводным сульфатом натрия. Растворитель выпаривают при пониженном давлении. Остаток очищают с помощью хроматографии на колонке с силикагелем (элюент: этилацетат/бензол=1/5-1/1) с получением 1.5 г маслянистого 1-ацетил-5,7-диметил-1,2,3,4-тетрагидрохинолина.
IR (Nujol) cm-1: 1625, 1614.
1H-NMR (CDCl3) δ :
1.70-2.10 (2H, m, C3-H2), 2.21 (6H, s•2, -COCH3, Ar-CH3), 2.29 (3H, s, Ar-CH3), 2.54 (2H, t, J=7.1Hz, C4-H2), 3.77 (2H, t, J=7.1Hz, C2-H2), 6.83 (2H, s, C6,8-H).
(5) 1-ацетил-5,7-диметил-1,2,3,4-тетрагидрохинолин (3.0 г) растворяют в концентрированной соляной кислоте (6 мл) и добавляют 35% раствор формальдегида (3.5 г) и хлорид цинка (400 мг). Смесь перемешивают при 40-50oC в течение 2 часов при продувании хлороводорода. Реакционную смесь выливают в ледяную воду (100 мл) и экстрагируют хлороформом (100 мл). После промывания водой слой хлороформа сушат над безводным сульфатом натрия. Растворитель выпаривают при пониженном давлении. Полученный 1-ацетил-6-хлорметил-5,7-ди-метил-1,2,3,4- тетрагидрохинолин растворяют в ацетонитриле (30 мл) и добавляют цианид натрия (3.6 г) и 18-краун-6 (780 мг) с последующим нагреванием с обратным холодильником в течение 5 часов. Растворитель выпаривают при пониженном давлении и остаток экстрагируют хлороформом (100 мл). После промывания водой слой хлороформа сушат над безводным сульфатом натрия. Растворитель выпаривают при пониженном давлении. Остаток очищают с помощью хроматографии на колонке с силикагелем (элюент: хлороформ-хлороформ/метанол=10/1) с получением 2.4 г маслянистого 1-ацетил-6-цианометил-5,7-диметил-1,2,3,4-тетрагидрохинолина.
IR (Nujol) cm-1; 2248, 1650.
1H-NMR (CDCl3) δ ;
1.80-2.20 (2H, m, C3-H2), 2.21, 2.29 (3H•2, s•2, C5,7-CH3), 2.37 (3H, s, -COCH3), 2.68 (2H, t, J=7.5Hz, C4-H2), 3.66 (2H, s, -CH2CN), 3.76 (2H, t, J= 7.5Hz, C2-H2), 7.00 (1H, s, C8-H).
(6) 1-ацетил-6-цианометил-5,7-диметил-1,2,3,4-тетрагидрохинолин (2.7 г) растворяют в этаноле (30 мл) и добавляют раствор NaOH (4.4 г) в воде (10 мл) с последующим нагреванием с обратным холодильником в течение 10 часов в азоте. Растворитель выпаривают при пониженном давлении и остаток экстрагируют хлороформом (100 мл). После промывания водой слой хлороформа сушат над безводным сульфатом натрия. Растворитель выпаривают при пониженном давлении. Полученный 6-карбамоилметил-5,7-диметил-1,2,3,4- тетрагидрохинолин растворяют в N,N-диметилформамиде (10 мл) и добавляют октилбромид (1.6 г), карбонат калия (1.2 г) и йодид калия (166 мг) с последующим перемешиванием при 40oC в течение 10 часов в атмосфере азота. Реакционную смесь экстрагируют этилацетатом (100 мл). После промывания водой слой этилацетата сушат над безводным сульфатом натрия. Растворитель выпаривают при пониженном давлении. Остаток очищают с помощью хроматографии на колонке с силикагелем (элюент: хлороформ/метанол= 50/1-10/1) с получением 600 мг 1-октил-6-карбамоилметил-5,7-диметил-1,2,3,4- тетрагидрохинолина в виде кристаллов.
IR (Nujol) cm-1; 1654, 1624.
1H-NMR (CDCl3) δ ;
0.60-1.10 (3H, br-t, 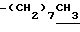 ), 1.10-1.80 (12H, m,
), 1.10-1.80 (12H, m, 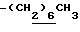 ), 1.80-2.10 (2H, m, C3-H2), 2.16, 2.24 (3H•2, s•2, C5,7-CH3), 2.63 (2H, t, J= 7.5Hz, C4-H2), 3.00-3.50 (4H, m, C2-H2, >NCH2), 3.57 (2H, s, -CH2CO-), 3.44 (2H, br, -CONH2), 6.35 (1H, s, C8-H).
), 1.80-2.10 (2H, m, C3-H2), 2.16, 2.24 (3H•2, s•2, C5,7-CH3), 2.63 (2H, t, J= 7.5Hz, C4-H2), 3.00-3.50 (4H, m, C2-H2, >NCH2), 3.57 (2H, s, -CH2CO-), 3.44 (2H, br, -CONH2), 6.35 (1H, s, C8-H).
(7) 1-октил-6-карбамоилметил-5,7-диметил-1,2,3,4-тетрагидрохинолин (2.5 г) растворяют в н-пропаноле (50 мл) и добавляют раствор NaOH (3.0 г) в воде (30 мл) с последующим перемешиванием при 130oC в течение 20 часов в атмосфере азота. Органический слой реакционной смеси отделяют и растворитель выпаривают при пониженном давлении. Остаток растворяют в воде (300 мл) и промывают этилацетатом (100 мл). Водный слой доводят до pH 1-2 6N соляной кислотой и экстрагируют хлороформом (200 мл). Слой хлороформа сушат над безводным сульфатом натрия. Растворитель выпаривают при пониженном давлении. Полученный 1-октил-6-карбоксиметил-5,7-диметил-1,2,3,4-тетрагидрохинолин растворяют в этаноле (50 мл) и добавляют концентрированную соляную кислоту (4 мл) с последующим перемешиванием при 70oC в течение 1 часа. Растворитель выпаривают при пониженном давлении. Остаток нейтрализуют насыщенным водным раствором гидрокарбоната натрия и экстрагируют хлороформом (100 мл). После промывания водой слой хлороформа сушат над безводным сульфатом натрия. Растворитель выпаривают при пониженном давлении. Остаток очищают с помощью хроматографии на колонке с силикагелем (элюент: бензол) с получением 1.0 г маслянистого 1-октил-6-этоксикарбонилметил-5,7-диметил-1,2,3,4-тетрагидрохинолина.
IR (Nujol) cm-1; 1732, 1599.
1H-NMR (CDCl3) δ ;
0.70-1.00 (3H, br-t, 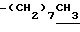 ), 1.10-1.80 (15H, m,
), 1.10-1.80 (15H, m, 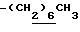 ,
, 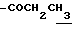 ), 1.80-2.10 (2H, m, C3-H2), 2.12, 2.26 (3H•2, s•2, C5,7-CH3), 2.62 (2H, t, J=7.5Hz, C4-H2), 3.00-3.30 (4H, m, C2-H2, >NCH2-), 3.59 (2H, s, -CH2CO-), 4.13 (2H, q, J=7.0Hz, -COCH2-), 6.33 (1H, s, C3-H).
), 1.80-2.10 (2H, m, C3-H2), 2.12, 2.26 (3H•2, s•2, C5,7-CH3), 2.62 (2H, t, J=7.5Hz, C4-H2), 3.00-3.30 (4H, m, C2-H2, >NCH2-), 3.59 (2H, s, -CH2CO-), 4.13 (2H, q, J=7.0Hz, -COCH2-), 6.33 (1H, s, C3-H).
(8) 1-октил-6-этоксикарбонилметил-5,7-диметил-1,2,3,4-тетрагидрохинолин (1.0 г) растворяют в уксусном ангидриде (5 мл) и добавляют раствор 70% азотной кислоты (517 мг) в уксусном ангидриде (3 мл) по каплям с последующим перемешиванием при той же температуре в течение 0.5 часа. Реакционную смесь выливают в ледяную воду (50 мл), нейтрализуют насыщенным водным раствором гидрокарбоната натрия и экстрагируют хлороформом (50 мл). После промывания водой слой хлороформа сушат над безводным сульфатом натрия. Растворитель выпаривают при пониженном давлении. Остаток очищают с помощью хроматографии на колонке с силикагелем (элюент: н-гексан-этилацетат/н-гексан=1/5) с получением 700 мг маслянистого 1-октил-6-этоксикарбонилметил-5,7-диметил-8-нитро-1,2,3,4- тетрагидрохинолина.
IR (Nujol) cm-1; 1732, 1527.
1H-NMR (CDCl3) δ ;
0.70-1.00 (3H, br-t, 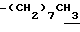 ), 1.1.0-1.70 (15H, m,
), 1.1.0-1.70 (15H, m, 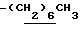 ,
, 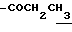 ), 1.80-2.10 (2H, m, C3-H2), 2.16 (6H, s, C5,7-CH3), 2.64 (2H, t, J= 7.5Hz, C4-H2), 2.70-3.20 (4H, m, C2-H2, >NCH2-), 3.65 (2H, s, -CH2CO-), 4.13 (2H, q, J=7.0Hz, -COCH2-).
), 1.80-2.10 (2H, m, C3-H2), 2.16 (6H, s, C5,7-CH3), 2.64 (2H, t, J= 7.5Hz, C4-H2), 2.70-3.20 (4H, m, C2-H2, >NCH2-), 3.65 (2H, s, -CH2CO-), 4.13 (2H, q, J=7.0Hz, -COCH2-).
(9) 1-октил-6-этоксикарбонилметил-5,7-диметил-8-нитро-1,2,3,4- тетрагидрохинолин (700 мг) растворяют в этаноле (500 мл) и добавляют 10% палладий на угле (200 мг). Смесь подвергают гидрированию при комнатной температуре и атмосферном давлении. 10% палладий на угле отфильтровывают и растворитель выпаривают при пониженном давлении. Полученный 1-октил-6-этоксикарбонилметил-5,7-диметил-8-нитро-1,2,3,4-тетрагидрохинолин растворяют в хлороформе (50 мл). Добавляют пивалоилхлорид (207 мг) и триэтиламин (192 мг) при охлаждении льдом и смесь перемешивают при той же температуре в течение 1 часа. Реакционную смесь промывают последовательно 5% водной лимонной кислотой и водой и сушат над безводным сульфатом натрия. Растворитель выпаривают при пониженном давлении. Остаток очищают с помощью хроматографии на колонке с силикагелем (элюент: хлороформ-хлороформ/метанол=10/1) с получением 230 мг маслянистого соединения, указанного в заголовке.
IR (Nujol) cm-1; 1732, 1483.
1H-NMR (CDCl3) δ ;
0.70-1.00 (3H, br-t, 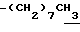 ), 1.10- 1.70 (15H, m,
), 1.10- 1.70 (15H, m, 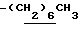 ,
, 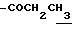 ), 1.35 (9H, s, -C(CH3)3), 1.80-2.10 (2H, m, C3-H2), 2.05, 2.11 (3H•2, s•2, C5,7-CH3), 2.40-2.70 (4H, m, C4-H2, >NCH2-),
), 1.35 (9H, s, -C(CH3)3), 1.80-2.10 (2H, m, C3-H2), 2.05, 2.11 (3H•2, s•2, C5,7-CH3), 2.40-2.70 (4H, m, C4-H2, >NCH2-),
2.80-2.90 (2H, m, C2-H2), 3.68 (2H, s, -CH2CO-), 4.14 (2H, q, J=7.0Hz, -COCH2-), 7.35 (1H, br, -CONH-).
Пример 125
N-(1-октил-6-карбоксиметил-5,7-диметил-1,2,3,4-тетрагидрохинолин- 8-ил)-2,2-диметилпропанамид
N-(1-октил-6-этоксикарбонилметил-5,7-диметил-1,2,3,4-тетрагидрохинолин- 8-ил)-2,2-диметилпропанамид (230 мг) растворяют в этаноле (5 мл) и добавляют раствор NaOH (100 мг) в воде (2 мл) с последующим перемешиванием при 50oC в течение 1 часа. Растворитель реакционной смеси выпаривают при пониженном давлении. Остаток растворяют в воде (50 мл) и промывают этилацетатом (20 мл). Водный слой доводят до pH 1-2 2N серной кислотой и экстрагируют хлороформом. Слой хлороформа сушат над безводным сульфатом натрия. Растворитель выпаривают при пониженном давлении с получением 130 мг порошкообразного целевого соединения.
ТСХ: силикагель 60F254 Арт. 5714 (Merck)
CHCl3-MeOH (10:1), Rf 0.5
IR (Nujol) cm-1; 1732, 1722.
1H-NMR (CDCl3) δ :
0.70-1.00 (3H, br-t, 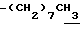 ), 1.10-1.70 (12H, m,
), 1.10-1.70 (12H, m, 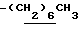 ), 1.35 (9H, s, -C(CH3)3), 1.80-2.10 (2H, m, C3-H2), 2.10 (6H, s, C5,7-CH3), 2.40-2.70 (4H, m, C4-H2, >NCH2-), 2.80-2.90 (2H, m, C2-H2), 3.68 (2H, s, -CH2CO-), 7.35 (1H, br, -CONH-), 9.50 (2H, br, 1/2H2SO4, -CO2H).
), 1.35 (9H, s, -C(CH3)3), 1.80-2.10 (2H, m, C3-H2), 2.10 (6H, s, C5,7-CH3), 2.40-2.70 (4H, m, C4-H2, >NCH2-), 2.80-2.90 (2H, m, C2-H2), 3.68 (2H, s, -CH2CO-), 7.35 (1H, br, -CONH-), 9.50 (2H, br, 1/2H2SO4, -CO2H).
Примеры 126-154
Соединения из таблиц 11 и 12 получают по методике примера 124.
Пример 126: 0.70-1.00 (3H, br-t), 1.10-1.70 (8H, m), 1.35 (9H, s), 1.80-2.10 (2H, m), 2.10 (6H, s), 2.40-2.70 (4H, m), 2.80-2.90 (2H, m), 3.68 (2H, s), 7.35 (1H, br), 9.50 (2H, br).
Пример 127: 0.70-1.00 (6H, br-t), 1.10-1.70 (5H, m), 1.35 (9H, s), 1.80-2.10 (2H, m), 2.10 (6H, s), 2.40-2.70 (4H, m), 2.80-2.90 (2H, m), 3.68 (2H, s), 7.35 (1H, br), 9.50 (2H, br).
Пример 128: 0.70-1.00 (3H, br-t), 1.10-1.70 (10H, m), 1.35 (9H, s), 1.80-2.10 (2H, m), 2.10 (6H, s), 2.40-2.70 (4H, m), 2.80-2.90 (2H, m), 3.68 (2H, s), 7.35 (1H, br), 9.50 (2H, br).
Пример 129: 0.80-1.70 (11H, m), 1.35 (9H, s), 1.80-2.10 (2H, m), 2.10 (6H, s), 2.40-2.70 (4H, m), 2.80-2.90 (2H, m), 3.68 (2H, s), 7.35 (1H, br), 9.50 (2H, br).
Пример 130: 0.70-1.00 (6H, br-t), 1.10-1.70 (7H, m), 1.35 (9H, s), 1.80-2.10 (2H, m), 2.10 (6H, s), 2.40-2.70 (4H, m), 2.80-2.90 (2H, m), 3.68 (2H, s), 7.35 (1H, br), 9.50 (2H, br).
Пример 131: 0.70-1.10 (3H, br-t), 1.10-1.70 (4H, m), 1.35 (9H, s), 1.80-2.10 (2H, m), 2.10 (6H, s), 2.40-2.70 (4H, m), 2.80-2.90 (2H, m), 3.30-3.60 (4H, m), 3.68 (2H, s), 7.35 (1H, br), 9.50 (2H, br).
Пример 132: 0.70-1.10 (3H, br-t), 1.10-1.70 (4H, m), 1.35 (9H, s), 1.80-2.10 (2H, m), 2.10 (6H, s), 2.40-2.70 (4H, m), 2.80-2.90 (2H, m), 3.20-3.50 (4H, m), 3.68 (2H, s), 7.35 (1H, br), 9.50 (2H, br).
Пример 133: 0.80-1.70 (13H, m), 1.35 (9H, s), 1.80-2.10 (2H, m), 2.10 (6H, s), 2.40-2.70 (4H, m), 2.80-2.90 (2H, m), 3.68 (2H, s), 7.35 (1H, br), 9.50 (2H, br).
Пример 134: 0.70-1.00 (6H, br-t), 1.10-1.70 (9H, m), 1.35 (9H, s), 1.80-2.10 (2H, m), 2.10 (6H, s), 2.40-2.70 (4H, m), 2.80-2.90 (2H, m), 3.68 (2H, s), 7.35 (1H, br), 9.50 (2H, br).
Пример 135: 0.70-1.10 (3H, br-t), 1.10-1.70 (6H, m), 1.35 (9H, s), 1.80-2.10 (2H, m), 2.10 (6H, s), 2.40-2.70 (4H, m), 2.80-2.90 (2H, m), 3.30-3.60 (4H, m), 3.68 (2H, s), 7.35 (1H, br), 9.50 (2H, br).
Пример 136: 0.70-1.10 (3H, br-t), 1.10-1.70 (6H, m), 1.35 (9H, s), 1.80-2.10 (2H, m), 2.10 (6H, s), 2.40-2.70 (4H, m), 2.80-2.90 (2H, m), 3.20-3.50 (4H, m), 3.68 (2H, s), 7.35 (1H, br), 9.50 (2H, br).
Пример 137: 0.70-1.10 (3H, br-t), 1.10-1.70 (14H, m), 1.35 (9H, s), 1.80-2.10 (2H, m), 2.10 (6H, s), 2.40-2.70 (4H, m), 2.80-2.90 (2H, m), 3.68 (2H, s), 7.35 (1H, br), 9.50 (2H, br).
Пример 138: 0.70-1.10 (3H, br-t), 1.10-1.70 (16H, m), 1.35 (9H, s), 1.80-2.10 (2H, m), 2.10 (6H, s), 2.40-2.70 (4H, m), 2.80-2.90 (2H, m), 3.68 (2H, s), 7.35 (1H, br), 9.50 (2H, br).
Пример 139: 0.70-1.10 (3H, br-t), 1.10-1.70 (14H, m), 1.35 (9H, s), 1.80-2.10 (2H, m), 2.40 (2H, q), 2.43 (2H, q), 2.40-2.70 (4H, m), 2.80-2.90 (2H, m), 3.68 (2H, s), 7.35 (1H, br), 9.50 (2H, br).
Пример 140: 0.70-1.10 (3H, br-t), 1.10-1.70 (18H, m), 1.35 (9H, s), 1.80-2.10 (2H, m), 2.40 (2H, q), 2.43 (2H, q), 2.40-2.70 (4H, m), 2.80-2.90 (2H, m), 3.68 (2H, s), 7.35 (1H, br), 9.50 (2H, br).
Пример 141: 0.70-1.10 (3H, br-t), 1.10-1.70 (22H, m), 1.35 (9H, s), 1.80-2.10 (2H, m), 2.40 (2H, q), 2.43 (2H, q), 2.40-2.70 (4H, m), 2.80-2.90 (2H, m), 3.68 (2H, s), 7.35 (1H, br), 9.50 (2H, br).
Пример 142: 0.70-1.10 (3H, br-t), 1.10-1.70 (8H, m), 1.35 (9H, s), 1.80-2.10 (2H, m), 2.40-2.70 (4H, m), 2.80-2.90 (2H, m), 3.52 (2H, s), 3.73 (3H, s), 3.77 (3H, s), 7.35 (1H, br), 9.50 (2H, br).
Пример 143: 0.70-1.10 (3H, br-t), 1.10-1.70 (12H, m), 1.35 (9H, s), 1.80-2.10 (2H, m), 2.40-2.70 (4H, m), 2.80-2.90 (2H, m), 3.52 (2H, s), 3.73 (3H, s), 3.77 (3H, s), 7.35 (1H, br), 9.50 (2H, br).
Пример 144: 0.70-1.10 (3H, br-t), 1.10-1.70 (16H, m), 1.35 (9H, s), 1.80-2.10 (2H, m), 2.40-2.70 (4H, m), 2.80-2.90 (2H, m), 3.52 (2H, s), 3.73 (3H, s), 3.77 (3H, s), 7.35 (1H, br), 9.50 (2H, br).
Пример 145: 0.70-1.10 (3H, br-t), 1.10-1.70 (8H, m), 1.35 (9H, s), 1.80-2.10 (2H, m), 2.17 (3H, s), 2.23 (3H, s), 2.40-2.70 (4H, m), 2.80-2.90 (2H, m), 4.65 (2H, s), 7.35 (1H, br), 9.50 (2H, br).
Пример 146: 0.70-1.10 (3H, br-t), 1.10-1.70 (12H, m), 1.35 (9H, s), 1.80-2.10 (2H, m), 2.17 (3H, s), 2.23 (3H, s), 2.40-2.70 (4H, m), 2.80-2.90 (2H, m), 4.65 (2H, s), 7.35 (1H, br), 9.50 (2H, br).
Пример 147: 0.70-1.10 (3H, br-t), 1.10-1.70 (16H, m), 1.35 (9H, s), 1.80-2.10 (2H, m), 2.17 (3H, s), 2.23 (3H, s), 2.40-2.70 (4H, m), 2.80-2.90 (2H, m), 4.65 (2H, s), 7.35 (1H, br), 9.50 (2H, br).
Пример 148: 0.70-1.00 (6H, br-t), 1.10-1.70 (18H, m), 1.35 (6H, s), 1.80-2.10 (2H, m), 2.10 (6H, s), 2.40-2.70 (4H, ш), 2.80-2.90 (2H, m), 3.68 (2H, s), 7.35 (1H, br), 9.50 (2H, br).
Пример 149: 0.70-1.00 (6H, br-t), 1.10-1.70 (22H, m), 1.35 (6H, s), 1.80-2.10 (2H, m), 2.10 (6H, s), 2.40-2.70 (4H, m), 2.80-2.90 (2H, m), 3.68 (2H, s), 7.35 (1H, br), 9.50 (2H, br).
Пример 150: 0.70-1.10 (3H, br-t), 1.10-2.00 (27H, m), 2.10 (6H, s), 2.40-2.70 (4H, m), 2.80-2.90 (2H, m), 3.68 (2H, s), 7.35 (1H, br), 9.50 (2H, br).
Пример 151: 0.70-1.10 (3H, br-t), 1.10-1.70 (12H, m), 1.80-2.10 (2H, m), 2.10 (6H, s), 2.40-2.70 (4H, m), 2.80-2.90 (2H, m), 3.53 (2H, s), 3.68 (2H, s), 7.30 (5H, s), 7.35 (1H, br), 9.50 (2H, br).
Пример 152: 0.70-1.10 (6H, br-t), 1.10-1.70 (12H, m), 1.80-2.10 (2H, m), 2.10 (6H, s), 2.40-2.90 (8H, m), 3.68 (2H, s), 7.35 (1H, br), 9.50 (2H, br).
Пример 153: 0.70-1.10 (6H, br-t), 1.10-1.70 (16H, m), 1.80-2.10 (2H, m), 2.10 (6H, s), 2.40-2.90 (8H, m), 3.68 (2H, s), 7.35 (1H, br), 9.50 (2H, br).
Пример 154: 0.70-1.10 (6H, br-t), 1.10-1.70 (20H, m), 1.80-2.10 (2H, m), 2.10 (6H, s), 2.40-2.90 (8H, m), 3.68 (2H, s), 7.35 (1 H, br), 9.50 (2H, br).
Пример 155
N-(1-октил-5-карбокси-6-метилиндолин-7-ил)-2,2-диметилпропанамид
(1) 5-бром-7-метил-7-нитроиндолин (3.6 г) растворяют в N,N-диметилформамиде (36 мл) и добавляют гидрид натрия (677 мг) с последующим перемешиванием при комнатной температуре в течение 0.5 часа. К реакционной смеси добавляют 1-йодоктан (3.4 г) и смесь перемешивают при той же температуре в течение 24 часов. К реакционной смеси добавляют этилацетат (200 мл) и смесь промывают водой и сушат над безводным сульфатом натрия. Этилацетат выпаривают при пониженном давлении. Остаток очищают с помощью хроматографии на колонке с силикагелем (элюент: этилацетат/н-гексан=1/100-1/50) с получением 4.0 г маслянистого 1-октил-5-бром-6-метил-7-нитроиндолина.
IR (Nujol) cm-1; 1610, 1568.
1H-NMR (CDCl3) δ ;
0,88 (3H, br-t, J=7Hz, 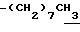 ), 1.00~1.70 (12H, m,
), 1.00~1.70 (12H, m, 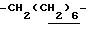 ), 2.25 (3H, s, indoline C6-CH3), 2.93 (2H, t, J=8Hz, indoline C3-H2), 2.94 (2H, t, J= 7Hz, >NCH2-), 3.57 (2H, t, J=8Hz, indoline C2-H2), 7.19 (1H, s, indoline C4-H).
), 2.25 (3H, s, indoline C6-CH3), 2.93 (2H, t, J=8Hz, indoline C3-H2), 2.94 (2H, t, J= 7Hz, >NCH2-), 3.57 (2H, t, J=8Hz, indoline C2-H2), 7.19 (1H, s, indoline C4-H).
(2) 1-октил-5-бром-6-метил-7-нитроиндолин (4.0 г) растворяют в N-метилпирролидоне (40 мл) и добавляют цианид меди (1.9 г) с последующим перемешиванием при 190oC в течение 1 часа. К реакционной смеси добавляют этилацетат (100 мл) и воду (100 мл). Нерастворимое вещество отфильтровывают. Слой этилацетата промывают водой и сушат над безводным сульфатом натрия. Этилацетат выпаривают при пониженном давлении. Остаток очищают с помощью хроматографии на колонке с силикагелем (элюент: этилацетат/н-гексан=1/5-1/3) с получением 2.4 г маслянистого 1-октил-5-циано-6-метил-7-нитроиндолина.
IR (Nujol) cm-1; 2214, 1620.
1H-NMR (CDCl3) δ :
0.88 (3H, br-t, J=7Hz, 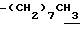 ), 1.00~1.70 (12H, m,
), 1.00~1.70 (12H, m, 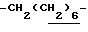 ), 2.38 (3H, s, indoline C6-CH3), 3.03 (2H, t, J=8Hz, indoline C3-H2), 3.04 (2H, t, J= 7Hz, >NCH2-), 3.73 (2H, t, J=8Hz, indoline C2-H2), 7.15 (1H, s, indoline C4-H).
), 2.38 (3H, s, indoline C6-CH3), 3.03 (2H, t, J=8Hz, indoline C3-H2), 3.04 (2H, t, J= 7Hz, >NCH2-), 3.73 (2H, t, J=8Hz, indoline C2-H2), 7.15 (1H, s, indoline C4-H).
(3) 1-октил-5-циано-6-метил-7-нитроиндолин (2.4 г) растворяют в н-пропаноле и добавляют раствор NaOH (3.0 г) в воде (10 мл) с последующим нагреванием с обратным холодильником в течение 20 часов. H-пропанол выпаривают при пониженном давлении и к остатку добавляют этилацетат (100 мл). Смесь промывают водой и сушат над безводным сульфатом натрия. Этилацетат выпаривают при пониженном давлении. Остаток очищают с помощью хроматографии на колонке с силикагелем (элюент: этилацетат/бензол=1/5-1/1) с получением 1.4 г 1-октил-5-карбокси-6-метил-7-нитроиндолин в виде кристаллов.
IR (Nujol) cm-1; 1679, 1620.
1H-NMR (CDCl3) δ :
0.88 (3H, br-t, J=7Hz, 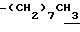 ), 1.00~1.70 (12H, m,
), 1.00~1.70 (12H, m, 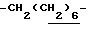 ), 2.47 (3H, s, indoline C6-CH3), 3.02 (2H, t, J=8Hz, indoline C3-H2), 3.03 (2H, t, J=7Hz, >NCH2-), 3.69 (2H, t, J=8Hz, indoline C2-H2), 5.00 (1H, br, -CO2H), 7.73 (1H, s, indoline C4-H).
), 2.47 (3H, s, indoline C6-CH3), 3.02 (2H, t, J=8Hz, indoline C3-H2), 3.03 (2H, t, J=7Hz, >NCH2-), 3.69 (2H, t, J=8Hz, indoline C2-H2), 5.00 (1H, br, -CO2H), 7.73 (1H, s, indoline C4-H).
(4) 1-октил-5-карбокси-6-метил-7-нитроиндолин (1.4 г) растворяют в метаноле (30 мл) и добавляют концентрированную серную кислоту (4.1 г) с последующим нагреванием с обратным холодильником в течение 4 часов. Метанол выпаривают при пониженном давлении. К остатку добавляют этилацетат (100 мл). Смесь промывают водой и сушат над безводным сульфатом натрия. Этилацетат выпаривают при пониженном давлении. Остаток очищают с помощью хроматографии на колонке с силикагелем (элюент: хлороформ/метанол=1/0-10/1) с получением 750 мг 1-октил-5-метоксикарбонил-6-метил-7-нитроиндолин в виде кристаллов.
IR (Nujol) cm-1; 1679, 1620.
1H-NMR (CDCl3) δ :
0.88 (3H, br-t, J=7Hz,  ), 1.00~1.70 (12H, m,
), 1.00~1.70 (12H, m,  ), 2.43 (3H, s, indoline C6-CH3), 3.00 (2H, t, J=8Hz, indoline C3-H2), 3.02 (2H, t, J= 7Hz, >NCH2-), 3.66 (2H, t, J=8Hz, indoline C2-H2), 3.82 (3H, s, -CO2CH3), 7.62 (1H, s, indoline C4-H).
), 2.43 (3H, s, indoline C6-CH3), 3.00 (2H, t, J=8Hz, indoline C3-H2), 3.02 (2H, t, J= 7Hz, >NCH2-), 3.66 (2H, t, J=8Hz, indoline C2-H2), 3.82 (3H, s, -CO2CH3), 7.62 (1H, s, indoline C4-H).
(5) 1-октил-5-метоксикарбонил-6-метил-7-нитроиндолин (750 мг) растворяют в этаноле (50 мл) и добавляют 10% палладий на угле (150 мг) с последующим гидрированием при 40oC в течение 15 часов. 10% палладий на угле отфильтровывают и этанол выпаривают при пониженном давлении. К остатку добавляют хлороформ (100 мл). Смесь промывают водой и сушат над безводным сульфатом натрия. Хлороформ выпаривают при пониженном давлении. Полученный 1-октил-7-амино-5-метоксикарбонил-6- метилиндолин растворяют в хлороформе (10 мл). Добавляют пивалоил хлорид (310 мг) и триэтиламин (286 мг) при охлаждении льдом с последующим перемешиванием при комнатной температуре в течение 1 часа. К реакционной смеси добавляют хлороформ (50 мл). Смесь промывают последовательно 5% водной лимонной кислотой и водой и сушат над безводным сульфатом натрия. Хлороформ выпаривают при пониженном давлении. Остаток очищают с помощью хроматографии на колонке с силикагелем (элюент: хлороформ/метанол= 1/0-20/1) с получением 580 мг маслянистого N-(1-октил-5-метоксикарбонил-6-метил-индолин-7-ил)-2,2-диметилпропанамида.
IR (Nujol) cm-1; 1708, 1651.
1H-NMR (CDCl3) δ ;
0.87 (3H, br-t, J=7Hz,  ), 1.00~1.70 (12H, m,
), 1.00~1.70 (12H, m,  ), 1.34 (9H, s, -C(CH3)3), 2.39 (3H, s, indoline C6-CH3), 2.93 (2H, t, J=8Hz, indoline C3-H2), 3.25 (2H, t, J=7Hz, > NCH2-), 3.51 (2H, t, J=8Hz, indoline C2-H2), 3.79 (3H, s, -CO2CH3), 6.76 (1H, br, -CONH-), 7.55 (1H, s, indoline C4-H).
), 1.34 (9H, s, -C(CH3)3), 2.39 (3H, s, indoline C6-CH3), 2.93 (2H, t, J=8Hz, indoline C3-H2), 3.25 (2H, t, J=7Hz, > NCH2-), 3.51 (2H, t, J=8Hz, indoline C2-H2), 3.79 (3H, s, -CO2CH3), 6.76 (1H, br, -CONH-), 7.55 (1H, s, indoline C4-H).
(6) N-(1-октил-5-метоксикарбонил-6-метилиндолин-7-ил)-2,2- диметилпропанамид (580 мг) растворяют в метаноле (10 мл) и добавляют раствор NaOH (290 мг) в воде (5 мл) с последующим перемешиванием при 60oC в течение 4 часов. Метанол выпаривают при пониженном давлении. К остатку добавляют воду (50 мл) и смесь промывают этилацетатом (20 мл). Водный слой доводят до pH 6-7 2N серной кислотой и экстрагируют хлороформом (100 мл). Слой хлороформа промывают водой и сушат над безводным сульфатом натрия. Хлороформ выпаривают при пониженном давлении с получением 380 мг соединения, указанного в заголовке.
IR (Nujol) cm-1; 1668, 1645, 1615.
1H-NMR (CDCl3) δ ;
0.79 (3H, br, 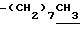 ), 0.80~1.80 (12H, m,
), 0.80~1.80 (12H, m, 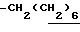 ), 1.34 (9H, s, -C(CH3)3), 2.38 (3H, s, indoline C6-CH3), 2.94 (2H, t, J=8Hz, indoline C3-H2), 3.27 (2H, t, J=7Hz, >HCH2-), 3.54 (2H, t, J=8Hz, indoline C2-H2), 6.80 (2H, br, -CONH-, -CO2H), 7.67 (1H, s, indoline C4-H).
), 1.34 (9H, s, -C(CH3)3), 2.38 (3H, s, indoline C6-CH3), 2.94 (2H, t, J=8Hz, indoline C3-H2), 3.27 (2H, t, J=7Hz, >HCH2-), 3.54 (2H, t, J=8Hz, indoline C2-H2), 6.80 (2H, br, -CONH-, -CO2H), 7.67 (1H, s, indoline C4-H).
Примеры 156-160
Соединения таблицы 13 получают по методике примера 155.
Значения 1H-ЯМР соединений указанных выше примеров 156 - 160 показаны ниже
Пример 156: 0.79 (3H, br-t), 0.80~1.80 (8H, m), 1.34 (9H, s), 2.38 (3H, s), 2.94 (2H, t), 3.27 (2H, t), 3.54 (2H, t), 6.80 (2H, br), 7.67 (1H, s).
Пример 157: 0.79 (3H, br-t), 0.80~1.80 (16H, m), 1.34 (9H, s), 2.38 (3H, s), 2.94 (2H, t), 3.27 (2H, t), 3.54 (2H, t), 6.80 (2H, br), 7.67 (1H, s).
Пример 158: 0.79 (3H, br-t), 0.80~1.80 (8H, m), 1.33 (9H, s), 2.40 (3H, s), 2.45 (3H, s), 2.95 (2H, t), 3.26 (2H, t), 3.54 (2H, t), 6.80 (2H, br).
Пример 159: 0.79 (3H, br-t), 0.80~1.80 (12H, m), 1.33 (9H, s), 2.40 (3H, s), 2.45 (3H, s), 2.95 (2H, t), 3.26 (2H, t), 3.54 (2H, 1), 6.80 (2H, br).
Пример 160: 0.79 (3H, br-t), 0.80~1.80 (16H, m), 1.33 (9H, s), 2.40 (3H, s), 2.45 (3H, s), 2.95 (2H, t), 3.26 (2H, t), 3.54 (2H, t), 6.80 (2H, br).
Для иллюстрации превосходных свойств соединений настоящего изобретения определяют ACAT-ингибирующую активность, эффект снижения общего холестерина в сыворотке, in vitro-ингибирующую активность перокисления жиров в плазме, ex vivo-ингибирующую активность перокисления жиров в плазме, растворимость в воде при pH 6.8 и концентрацию в плазме при пероральном введении.
Экспериментальный пример 1: ACAT-ингибирующая активность
Пищей с высоким содержанием холестерина [пища с добавками холестерина - (1%), Clea Japan, Inc] откармливали самцов белых японских кроликов с массой 2-2,5 кг в количестве 100 г/день и кроликов выращивали в течение 4 недель. Кроликов умерщвляли обескровливанием под анестезией и удаляли тонкую кишку. Слизистую мембрану тонкой кишки отслаивали, собирали и гомогенизировали. Гомогенат центрифугировали при 4oC и скорости 10000 об/мин в течение 15 минут. Полученную надсадочную жидкость дополнительно центрифугировали при 4oC и 41000 об/мин в течение 30 минут с получением микросомных фракций. Микросомная суспензия в качестве образца фермента, диметилсульфоксид (ДМСО, 5 мкл) или тестируемое соединение, растворенное в ДМСО (раствор тестируемого соединения 5 мкл), и реакционный субстрат [1-14C]-олеоил CoA добавляли к 0.15 М фосфатному буферу до общего объема 500 мкл. После инкубирования при 37oC в течение 7 минут добавляли смесь хлороформ-метанол для остановки реакции. Туда же добавляли воду, перемешивали и отделяли слой хлороформа. Растворитель выпаривали до сухого состояния и остаток повторно растворяли в н-гексане. Смесь анализировали с помощью тонкослойной хроматографии, используя пластину силикагеля. Пятна холестерилолеата на пластине силикагеля соскабливали и количественно исследовали на жидкостном стинцилляционном счетчике. ACAT-ингибирующую активность тестируемого соединения выражают как отношение (%) ингибирования холестерилолеата, то есть отношение ингибирования образования холестерилолеата по сравнению с контролем, результаты показаны в таблице 14.
Экспериментальный пример 2: эффект снижения общего холестерина в сыворотке
Самцов крысы Wister массой 180-200 г выращивали в условиях свободного доступа к богатой холестерином пище [дополненную холестерином (1%), холевой кислотой (0.5%) и кокосовым маслом (10%), Clea Japan, Inc] в течение 3 дней, в течение которых тестируемое соединение (3 мг/кг и 10 мг/кг), суспендированное в 5% растворе аравийской камеди, насильственно вводили один раз в день перорально в течение 3 дней. Контрольным животным вводили только 5% раствор аравийской камеди. После последнего введения тестируемых животных подвергали голоданию и брали у них кровь через 5 часов. Общий уровень холестерина в сыворотке определяли, используя коммерчески доступный набор для анализа (холестерин-CII-Test Wako, Wako Pure Chemical Industries, Ltd). Активность тестируемых соединений выражали как отношение (%) снижения общего уровня холестерина в сыворотке, то есть отношение снижения общего холестерина в сыворотке по сравнению с контролем, результаты показаны в таблице 15.
Экспериментальный пример 3: in vitro-активность ингибирования перокисления жиров в плазме
Под анестезией эфиром брали кровь у самцов крыс Wister массой 160-190 г, которых выдерживали без пищи в течение 16 часов, и гепаринизированную плазму отделяли общепринятым методом. ДМСО (10 мкл) или тестируемое соединение (конечная концентрация 10-5 М), растворенное в ДМСО (раствор тестируемого соединения 10 мкл), добавляли в плазму (1.0 мл) и смесь инкубируют при 37oC в течение 5 минут. Добавляют дистиллированную воду (10 мкл) или водный раствор сульфата меди (10 мкл) (конечная концентрация 1М) с последующим инкубированием при 37oC в течение 4 минут. После инкубирования определяют концентрацию перекиси жиров в образце, используя коммерчески доступный набор для анализа (Lipoperoxide-Test Wako, Wako Pure Chemical Industries, Ltd). В частности, перекись жиров в образцах проявляли в цвете с помощью тиобарбитуратного метода и исследовали как малондиальдегид. Активность тестируемых соединений выражали как отношение (%) ингибирования образования малональдегида, то есть соотношение ингибирования образования малональдегида по сравнению с контролем, результаты показаны в таблице 16.
Экспериментальный пример 4: ex vivo-активность ингибирования перокисления жиров в плазме
Тестируемое соединение, суспендированное в 5% растворе аравийской камеди, насильственно перорально вводили самцам крысы Wister с массой 160-190 г, которых выдерживали без пищи в течение 16 часов. Контрольным животным вводили только 5% раствор аравийской камеди. Через 1 час после введения под эфирным наркозом отбирали кровь и отделяли гепаринизированную плазму общепринятым методом. Плазму (1.0 мл) обрабатывали тем же способом, как в экспериментальном примере 3 и определяли количество образовавшегося малондиальдегида. Активность тестируемого соединения выражали в отношении (%) ингибирования образования малондиальдегида, то есть отношение ингибирования образования малондиальдегида по сравнению с контролем, результаты показаны в таблице 17.
Экспериментальный пример 5: растворимость
Мелкодисперсное тестируемое соединение (10 мг) добавляли к буферу (1 мл, pH 6.8) и смесь встряхивали в течение 1 часа при 25oC. Смесь пропускали через мембранный фильтр и определяли концентрацию тестируемого соединения в фильтрате с помощью жидкостной хроматографии высокого разрешения, результаты представлены в таблице 18.
Экспериментальный пример 6: пероральное введение
Тестируемое соединение (30 мг/кг), суспендированное в 5% растворе аравийской камеди, насильственно вводили перорально самцам крысы Wister с массой 200-250 г, которых выдерживали без пищи в течение 16 часов. По истечении 0.5, 1, 2, 4 и 6 часов после введения отбирали кровь и отделяли гепаринизированную плазму обычным методом. Концентрацию тестируемого соединения в плазме определяли с помощью жидкостной хроматографии высокого разрешения, результаты представлены в таблице 19.
Экспериментальный пример 7: пероральное введение
Тестируемое соединение (30 мг/кг), суспендированное в 5% растворе аравийской камеди, насильственно вводили перорально самцам крысы SD, весящим 200-250 г, которых выдерживали без пищи в течение 16 часов. По истечении 0.5, 1, 2, 4 и 6 часов после введения отбирали кровь и отделяли гепаринизированную плазму общепринятым методом. Концентрацию тестируемого соединения в плазме определяли с помощью жидкостной хроматографии высокого разрешения, результаты представлены в таблице 20.
Тест на токсичность (при однократном введении крысам)
Соединение примера 6 (1000 мг/кг) суспендировали в 5% растворе аравийской камеди и однократно перорально вводили самцам крысы линии SD (возраст 6 недель, 5 крыс), причем крыс наблюдали в течение 8 дней. У крыс не регистрировали аномального поведения или состояния. Для контроля на токсичность крыс умерщвляли и вскрывали. Результаты вскрытия не выявили каких-либо аномалий.
Примеры композиций
(1) Капсулы
Соединение примера 6 - 10 г
Лактоза - 110 г
Кукурузный крахмал - 58 г
Стеарат магния - 2 г
Всего - 180 г
Вышеперечисленные ингредиенты в виде порошка тщательно смешивали и вводили в желатиновые капсулы (N 3) по 180 мг так, чтобы каждая капсула содержала 10 мг соединения примера 6.
(2) Таблетки
Соединение примера 6 - 10 г
Лактоза - 85 г
Кукурузный крахмал - 34 г
Кристаллическая целлюлоза - 20 г
Стеарат магния - 1 г
Всего - 150 г
Вышеперечисленные ингредиенты в виде порошка тщательно смешивали и прессовали в форме таблеток по 150 мг так, чтобы каждая таблетка содержала 10 мг соединения примера 6.6
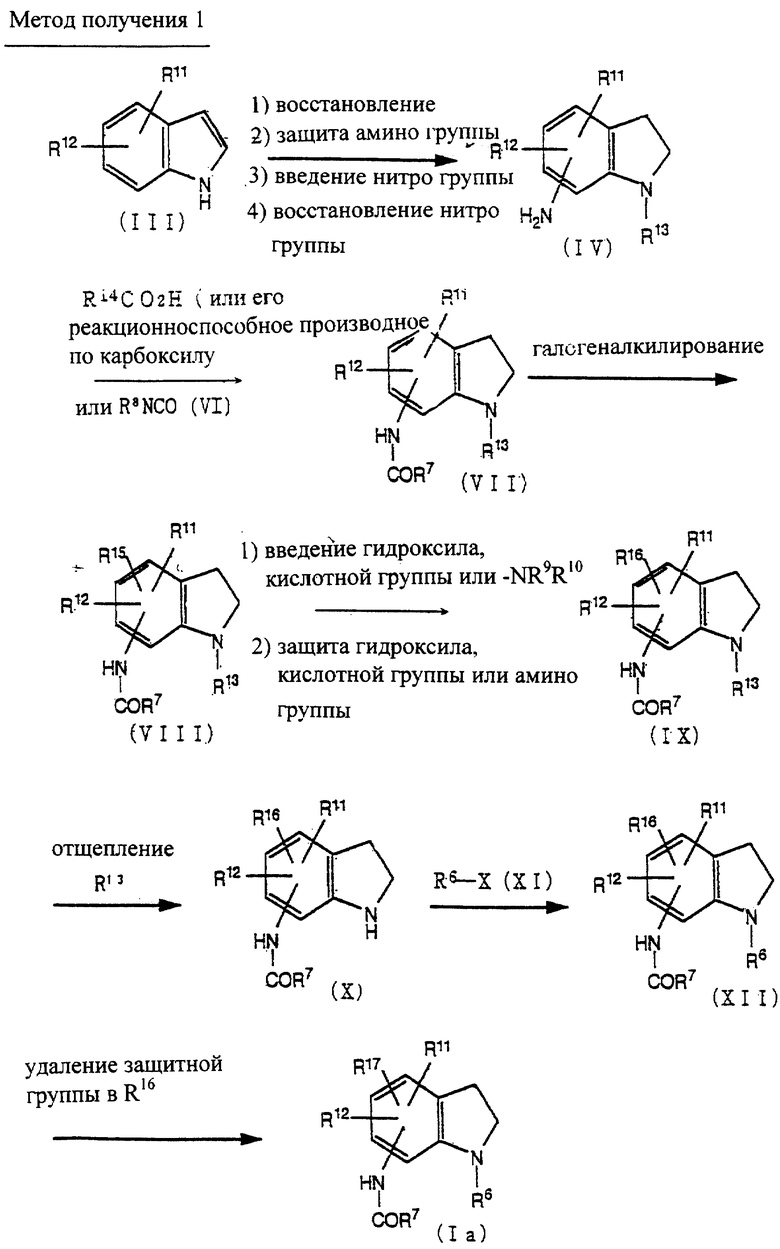
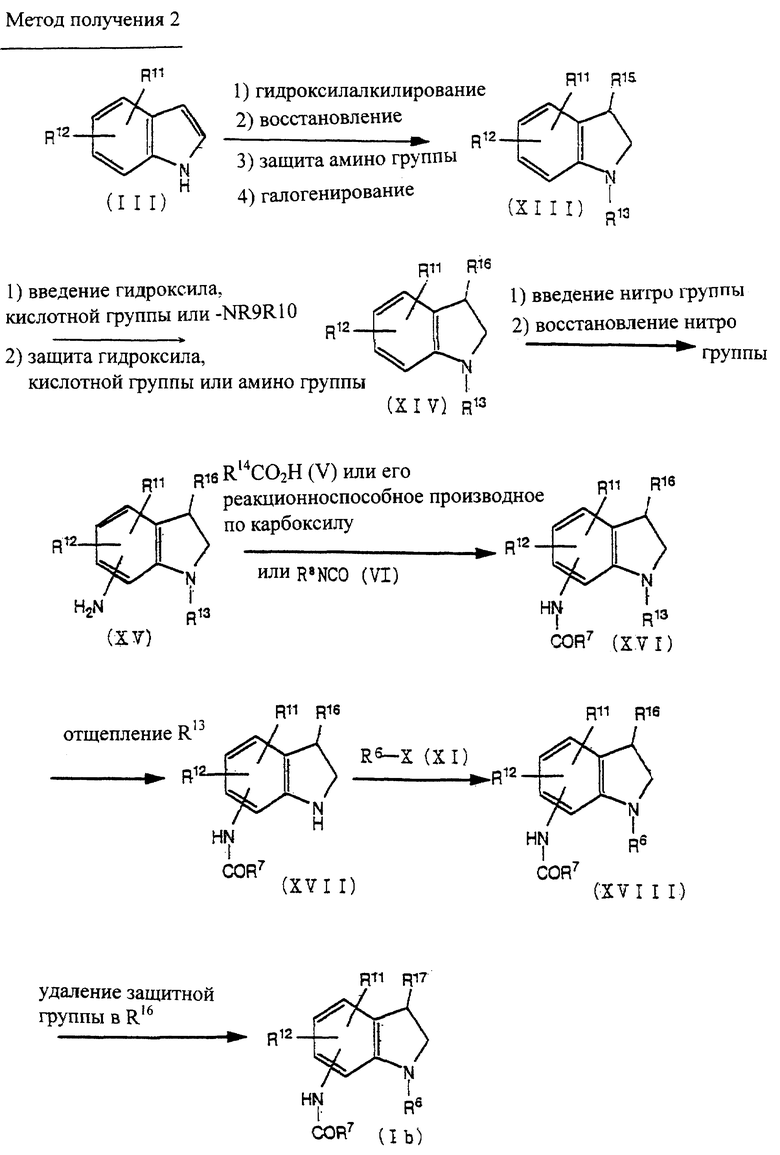
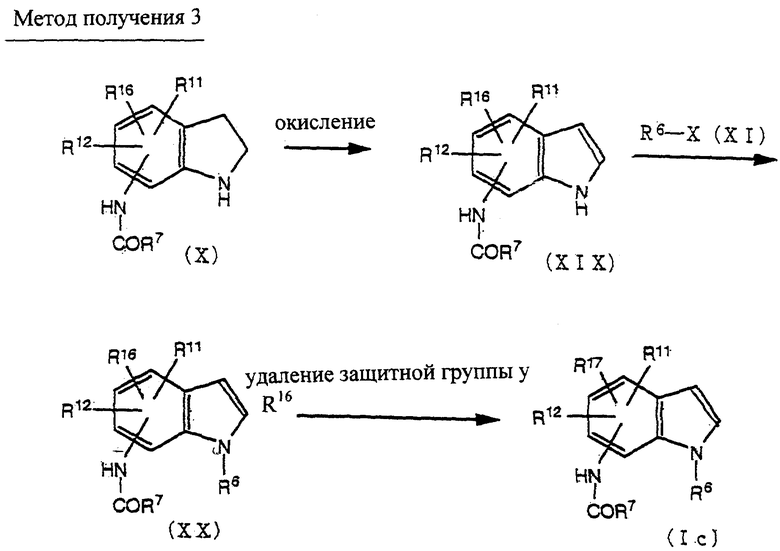
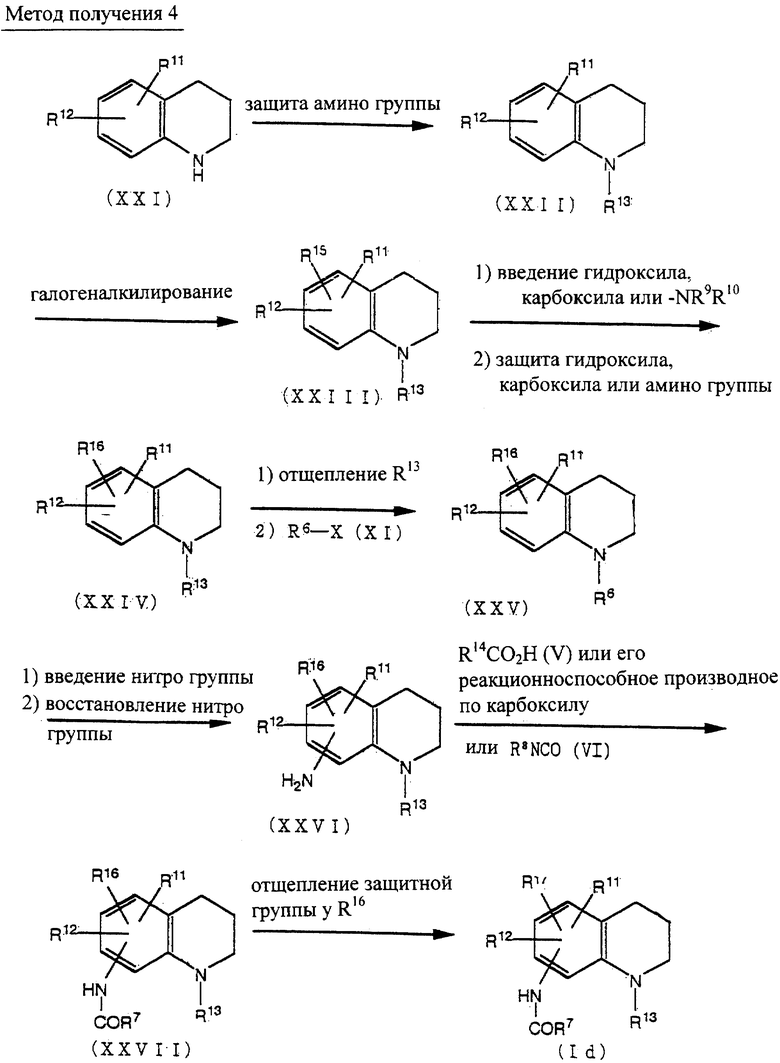
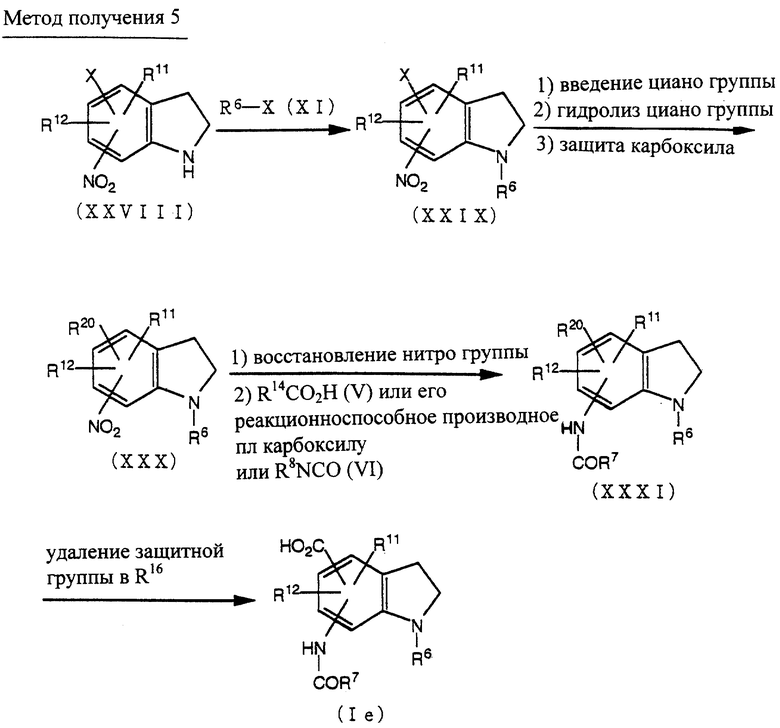
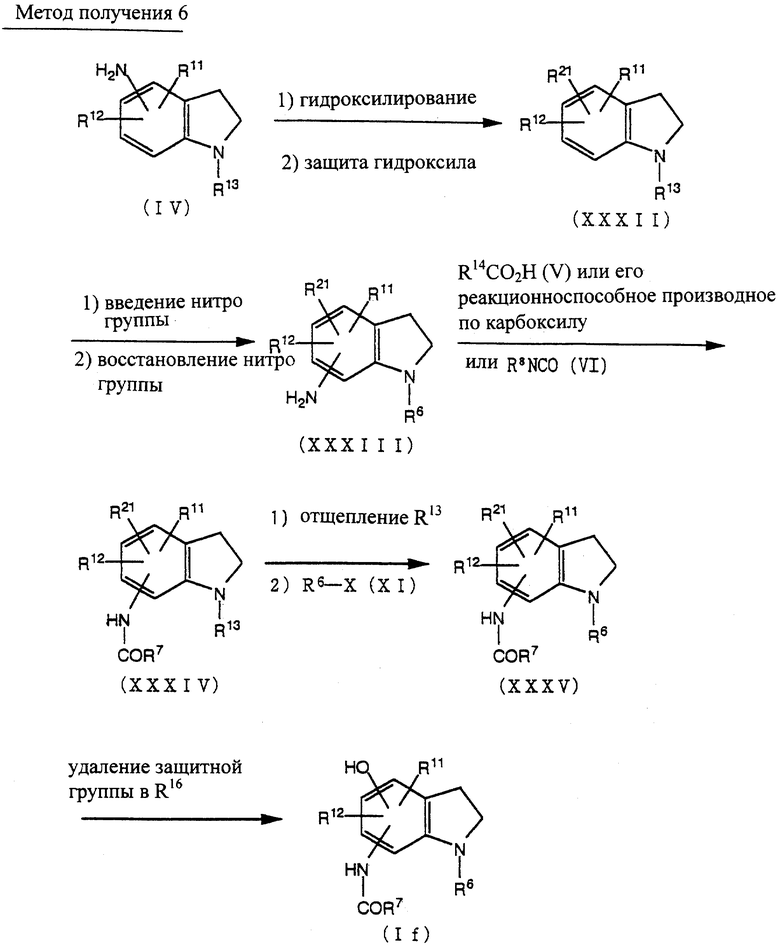
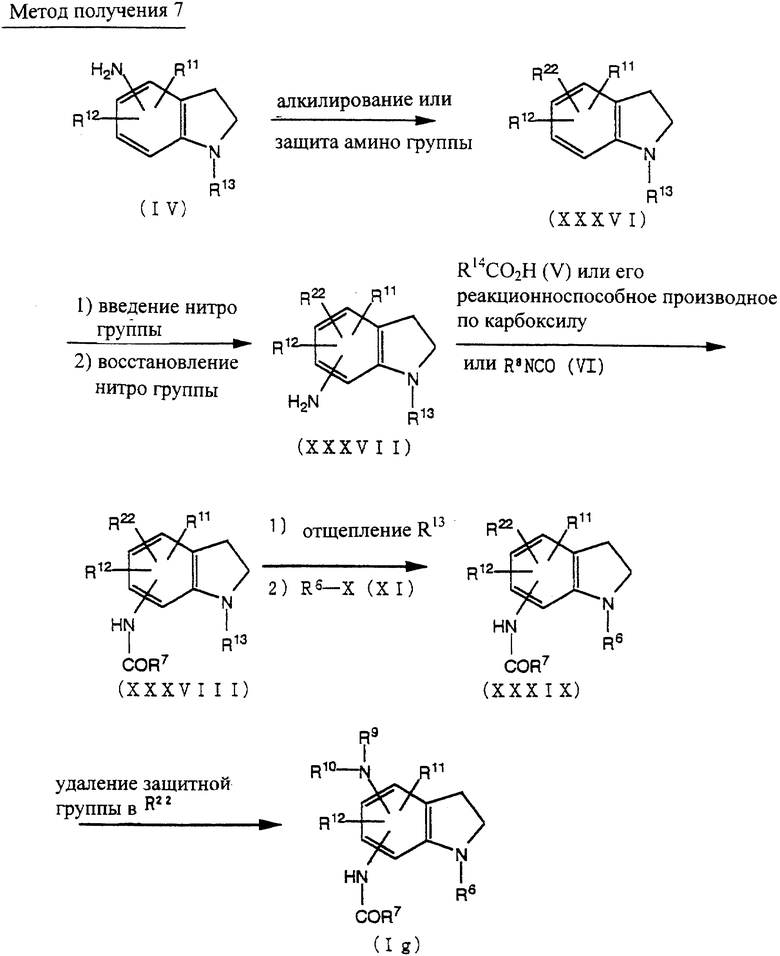
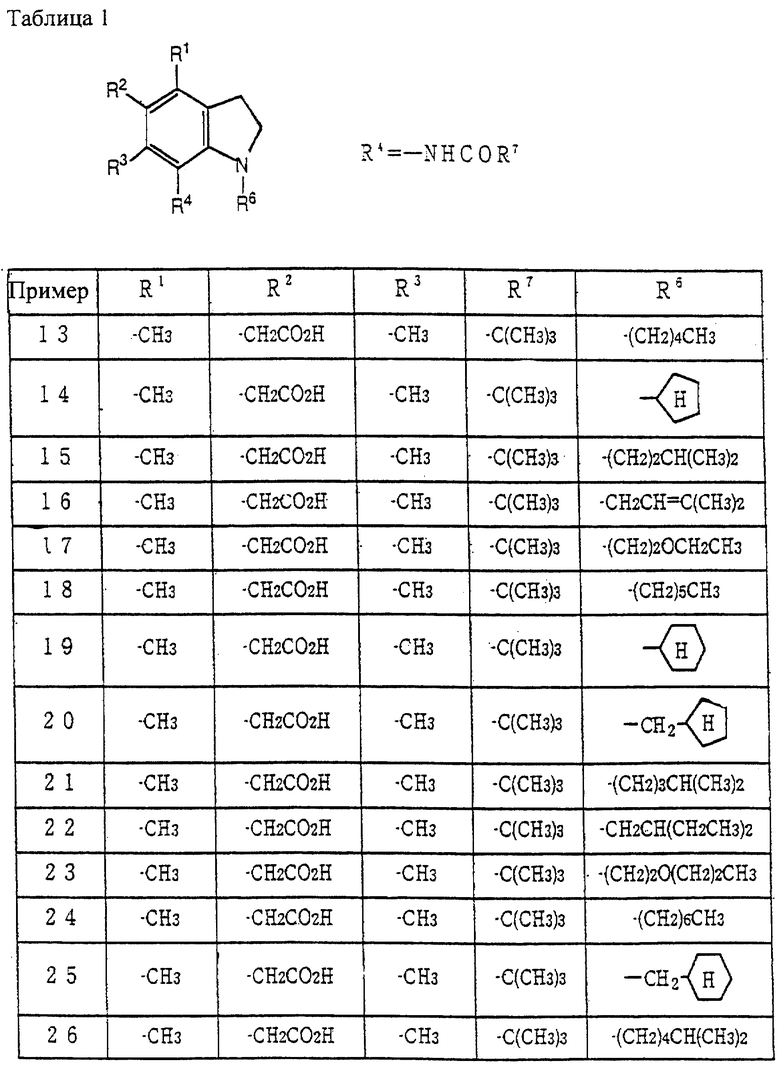
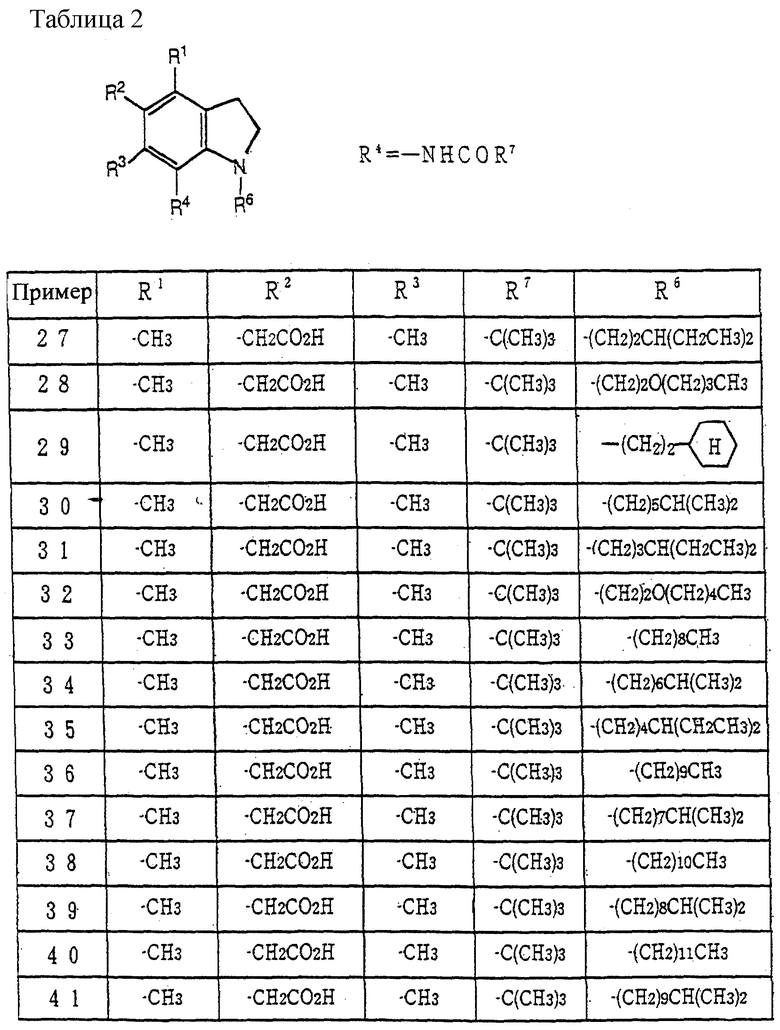
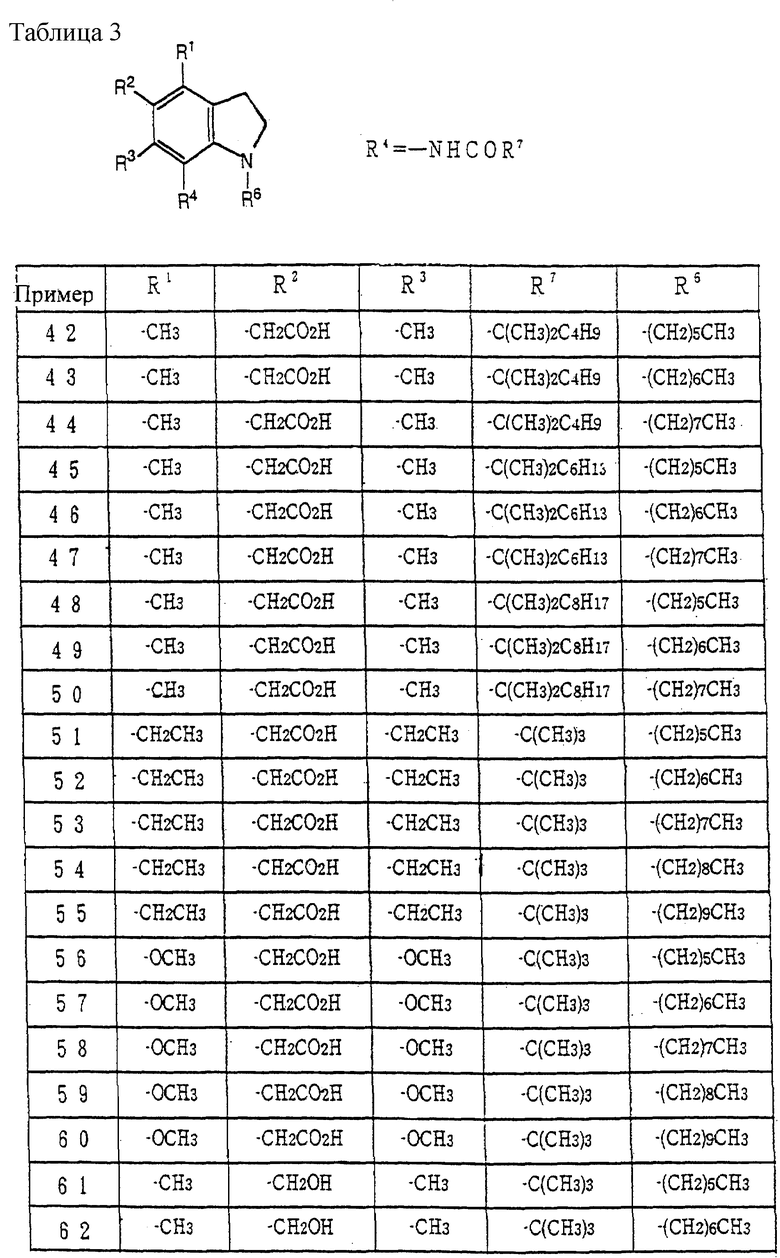
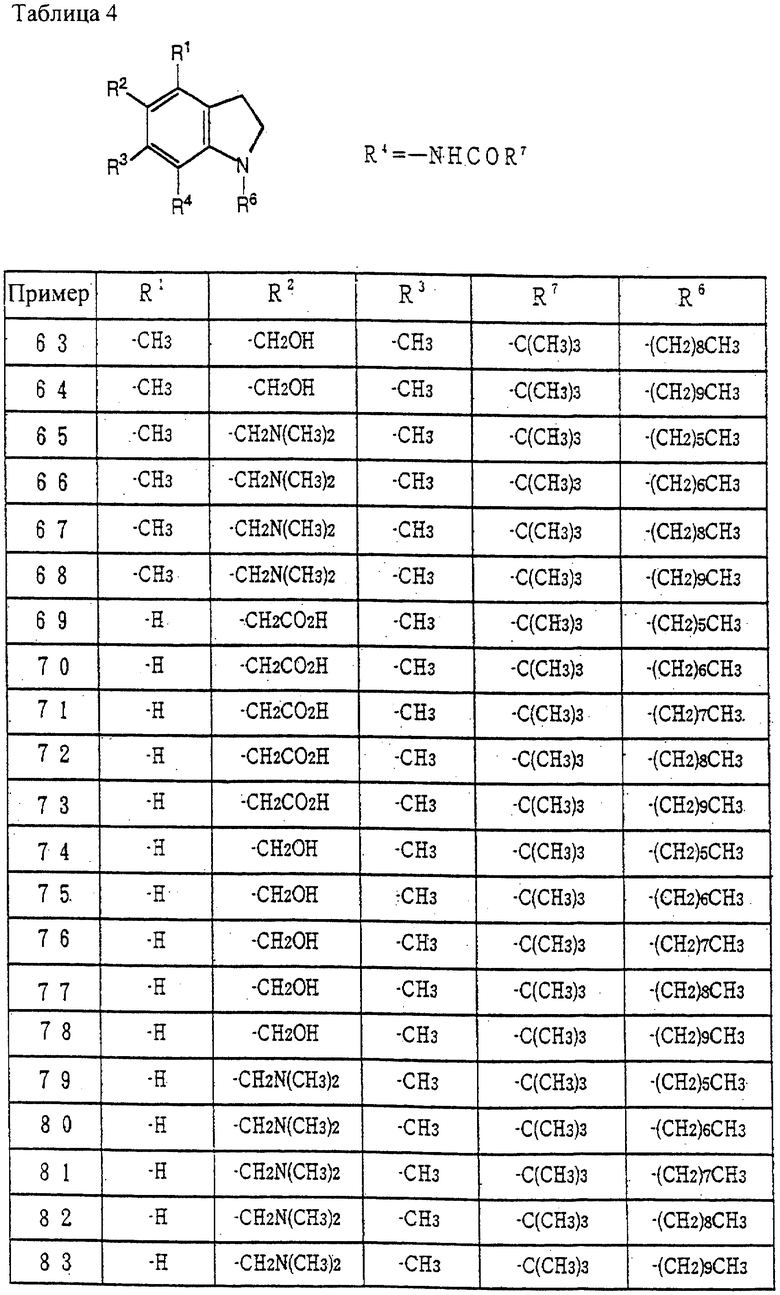
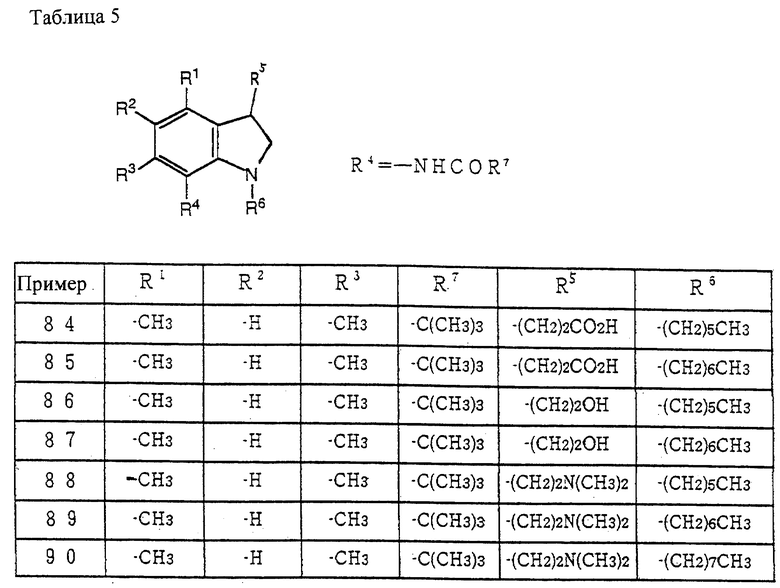
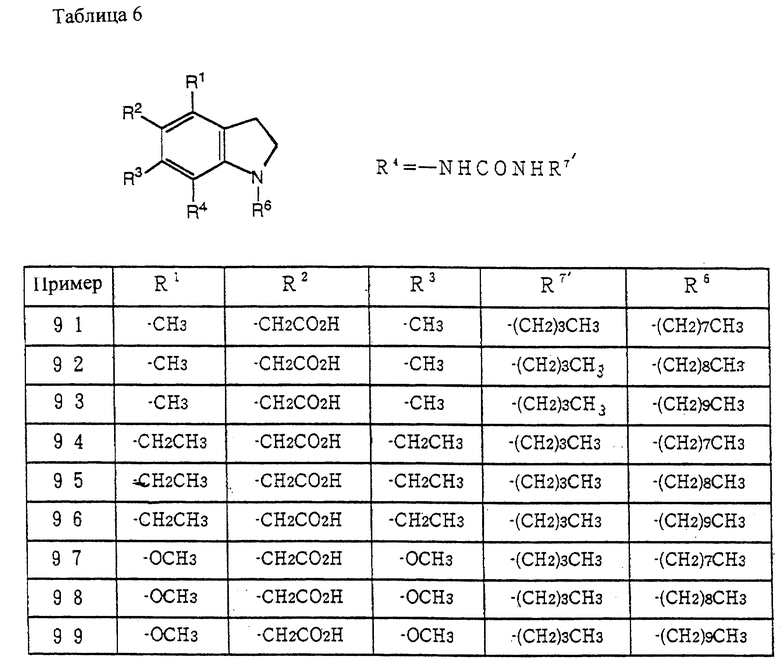
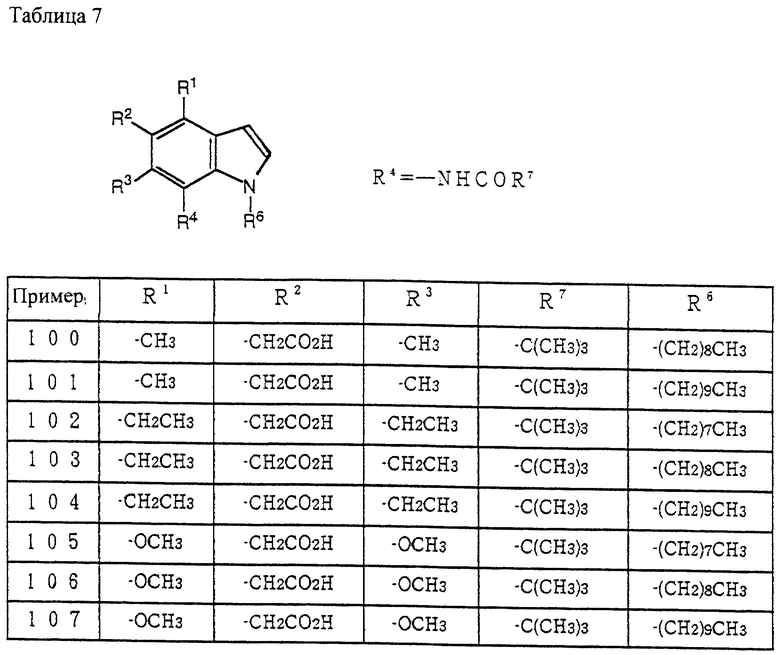
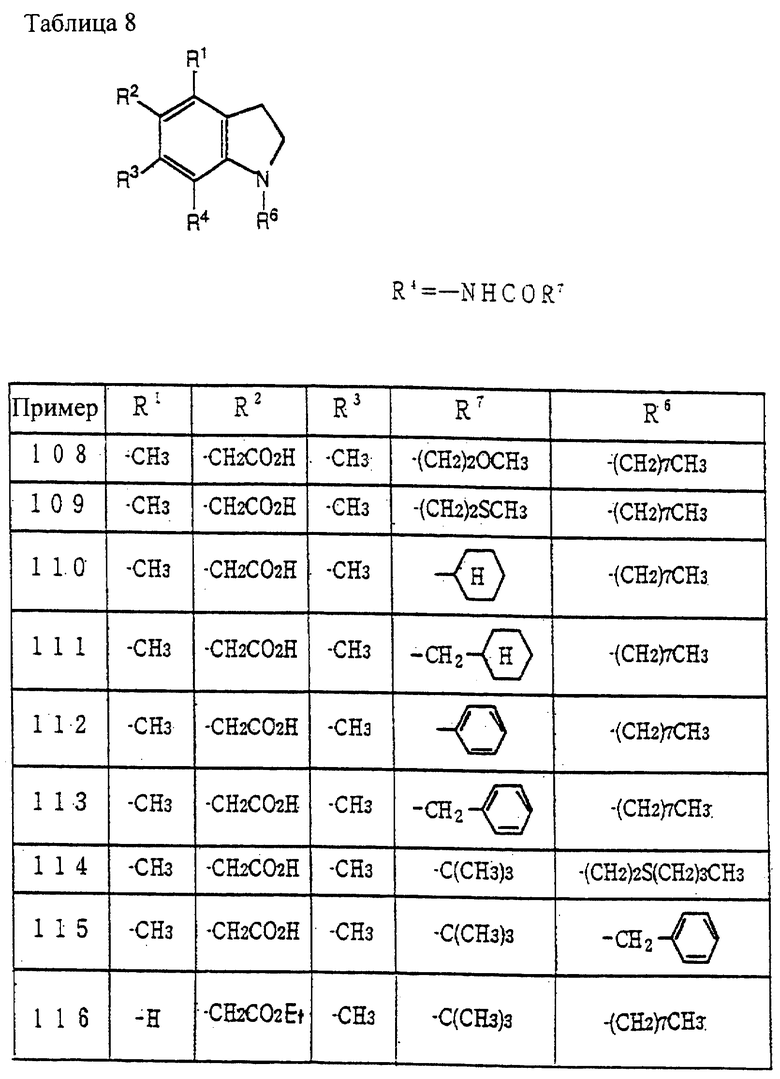
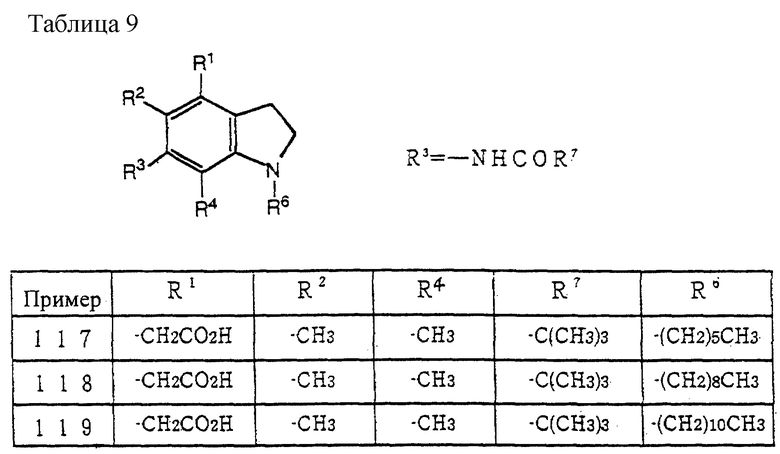
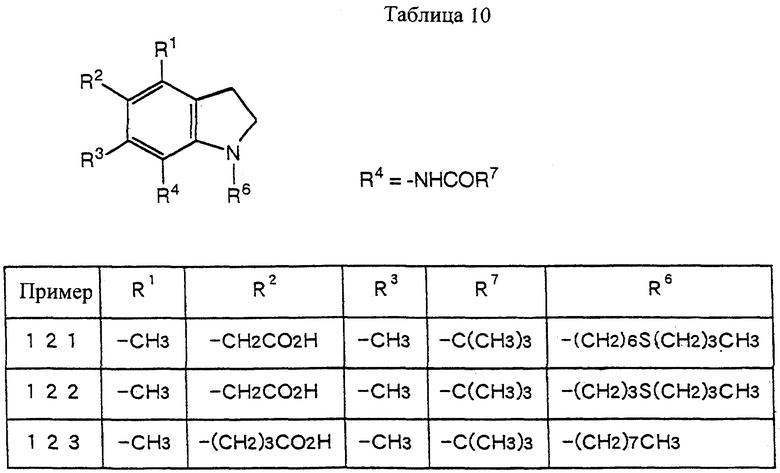
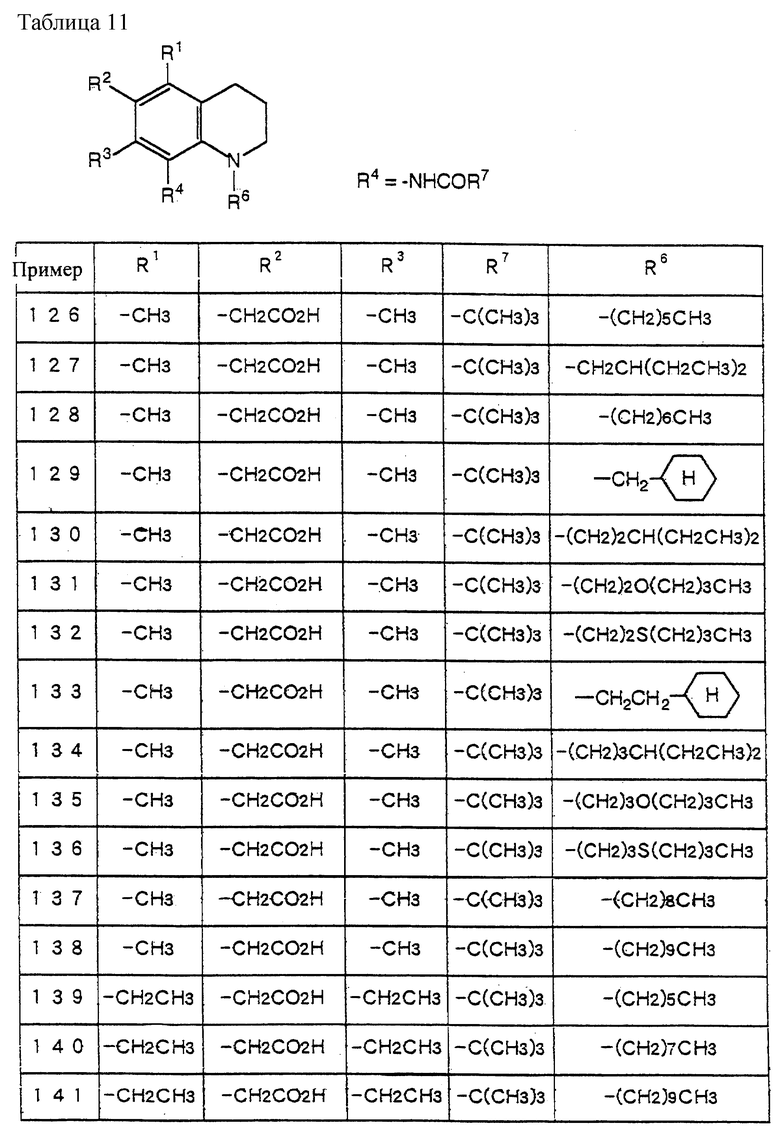
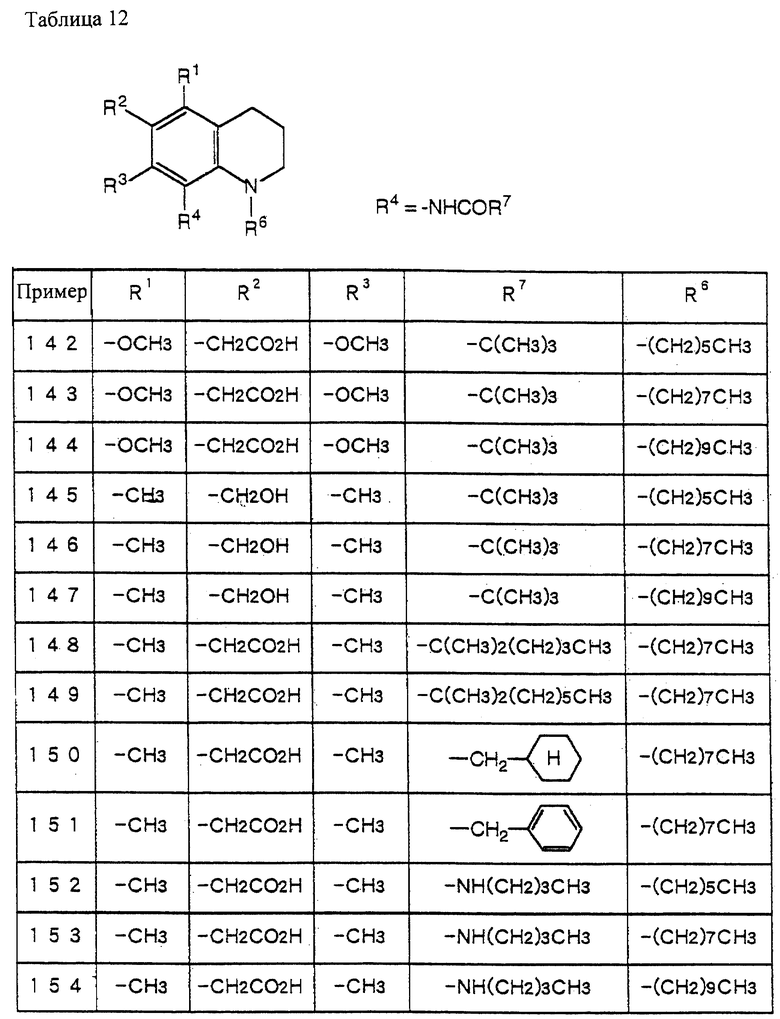
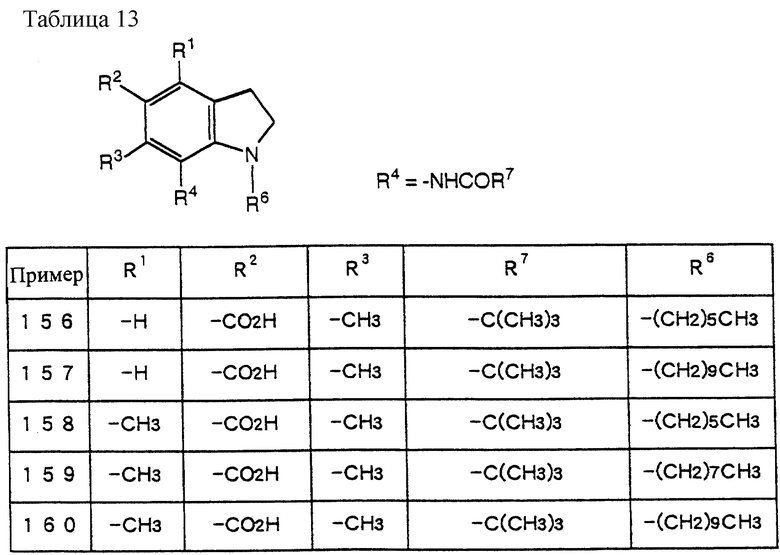

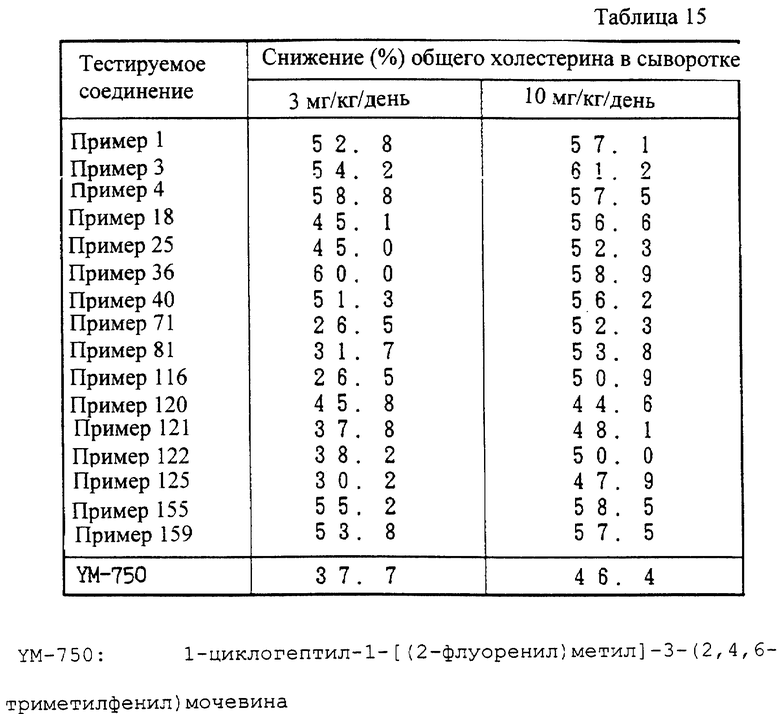
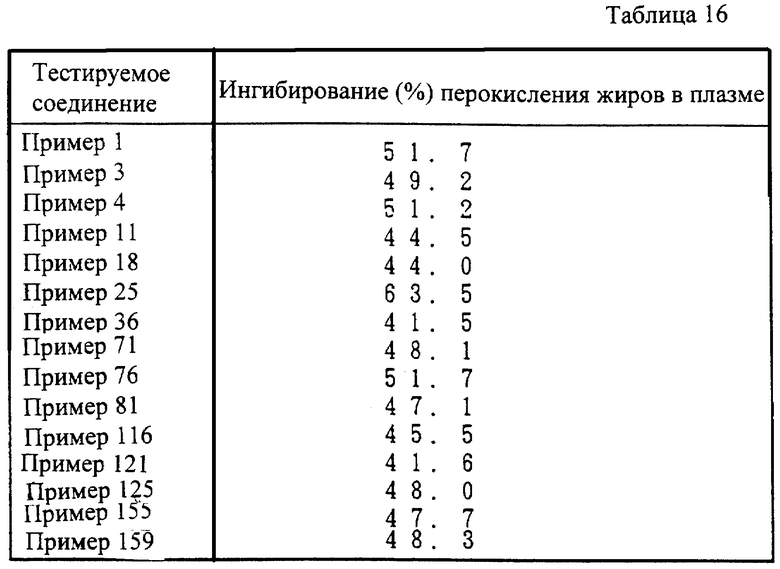

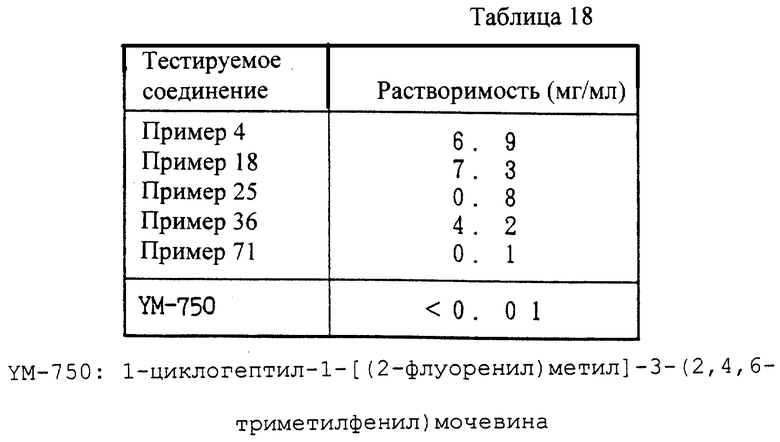


Изобретение относится к новым гетероциклическим производным формулы I, где один из R1, R2, R5 являются карбокси, C2-C5-алкоксикарбонилом, C1-C8 алкилом, замещенным гидрокси, карбокси, C2-С5-алкоксикарбонилом или группой формулы - NR9R10, где R9, R10 каждый независимо является C1-C6 алкилом, а два других каждый независимо является атомом водорода, C1-C6 алкилом или C1-C6 алкокси; R3 либо R4 группа - NHCOR7, где R7-C1-C20 алкил, C1-6 алкокси, - C1-C6 алкил, C1-C6 алкилтио- C1-C6 алкил, C3-C8- циклоалкил, C3-C8 циклоалкил -C1-С3 алкил, фенил, фенил -C1-C4 алкил, группа -NHR8, где R8-C1-C20 алкил, а другие являются атомом водорода, C1-C6 алкилом или C1-C6 алкокси; R6-C1-C20 алкил, C3-C12 алкенил, C1-C6 алкокси C1-C6 алкил, C1-C6 алкилтио C1-C6 алкил, C3-C8 циклоалкил, C3-C8 циклоалкил, C3-C8 циклоалкил -C1-С3 алкил, фенил C1-C4 алкил; Z является структурой формулы  и является связующей группой с атомом азота при условии, что когда один из R1, R2, R5 является карбокси или C2-C5 алкоксикарбонилом, Z является группой
и является связующей группой с атомом азота при условии, что когда один из R1, R2, R5 является карбокси или C2-C5 алкоксикарбонилом, Z является группой 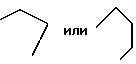 . Соединения 1 являются ингибиторами ацил-СоА: холестерин ацинтрансферазы и переокисления жиров и могут быть использованы в фармацевтической композиции. 2 с. и 21 з.п.ф-лы, 20 табл.
. Соединения 1 являются ингибиторами ацил-СоА: холестерин ацинтрансферазы и переокисления жиров и могут быть использованы в фармацевтической композиции. 2 с. и 21 з.п.ф-лы, 20 табл.
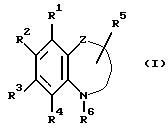
где один из R1, R2 и R5 является карбокси, C2-C5 алкоксикарбонилом или C1-C8 алкилом, замещенным гидрокси, карбокси, C2-C5 алкоксикарбонилом или группой формулы -NR9R10, где R9 и R10 каждый независимо является C1-C6 алкилом, а два другие каждый независимо являются атомом водорода, C1-C6 алкилом или C1-C6 алкокси;
R3 либо R4 являются группой формулы -NHCOR7, где R7 является C1-C20 алкилом, C1-C6 алкокси C1-C6 алкилом, C1-C6 алкилтио C1-C6 алкилом, C3-C8 циклоалкилом, C3-C8 циклоалкил C1-C3 алкилом, фенилом, фенил C1-C4 алкилом или группой формулы -NHR8, где R8 является C1-C20 алкилом, а другие являются атомом водорода, C1-C6 алкилом или C1-C6 алкокси;
R6 является C1-C20 алкилом, C3-C12 алкенилом, C1-C6 алкокси C1-C6 алкилом, C1-C6 алкилтио C1-C6 алкилом, C3-C8 циклоалкилом, C3-C8 циклоалкил C1-C3 алкилом или фенил C1-C4 алкилом; и
Z является структурой формулы
и является связующей группой с атомом азота при условии, что когда один из R1, R2 и R5 является карбокси или C2-C5 алкоксикарбонилом, Z является группой формулы
или его фармацевтически приемлемая соль.
или его фармацевтически приемлемая соль.
C3-C8 циклоалкилом, C3-C8 циклоалкил C1-C3 алкилом, фенилом, фенил C1-C4 алкилом или группой формулы -NHR8, где R8 является C1-C20 алкилом или его фармацевтически приемлемая соль.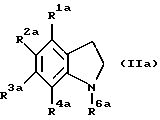
где R1a является атомом водорода или C1-C6 алкилом;
R3a является C1-C6 алкилом;
R2a является C1-C8 алкилом, замещенным гидрокси или карбокси;
R4a является группой формулы -NHCOR7a, где R7a является C1-C20 алкилом, C3-C8 циклоалкилом или C3-C8 циклоалкил C1-C3 алкилом;
R6a является C1-C20 алкилом, C3-C8 циклоалкилом или C3-C8 циклоалкил C1-C3 алкилом или его фармацевтически приемлемая соль.
(1) N-(1-гексил-5-карбоксиметил-4,6-диметилиндолин-7-ил)-2,2-диметилпропанамида,
(2) N-(l-гeптил-5-кapбoкcиметил-4,6-димeтилиндoлин-7-ил)-2,2-диметилпропанамида,
(3) N-(1-октил-5-карбоксиметил-4,6-диметилиндолин-7-ил)-2,2-диметилпропанамида,
(4) N-(1-нонил-5-карбоксиметил-4,6-диметилиндолин-7-ил)-2,2-диметилпропанамида,
(5) N-(1-децил-5-карбоксиметил-4,6-диметилиндолин-7-ил)-2,2-диметилпропанамида,
(6) N-(1-ундецил-5-карбоксиметил-4,6-диметилиндолин-7-ил)-2,2-диметилпропанамида,
(7) N-(1-додецил-5-карбоксиметил-4,6-диметилиндолин-7-ил)-2,2-диметилпропанамида,
(8) N-(1-гeкcил-5-гидpoкcиметил-6-мeтилиндoлин-7-ил)-2,2-диметилпропанамида,
(9) N-(1-гексил-5-гидроксиметил-4,6-диметилиндолин-7-ил)-2,2-диметилпропанамида,
(10) N-(1-гептил-5-гидроксиметил-6-метилиндолин-7-ил)-2,2-диметилпропанамида,
(11) N-(1-гептил-5-гидроксиметил-4,6-димeтилиндoлин-7-ил)-2,2-диметилпpoпaнaмидa,
(12) N-(1-октил-5-гидроксиметил-6-метилиндолин-7-ил)-2,2-диметилпропанамида,
(13) N-(1-октил-5-гидроксиметил-4,6-диметилиндолин-7-ил)-2,2-диметилпропанамида,
или его фармацевтически приемлемая соль.
или его фармацевтически приемлемая соль.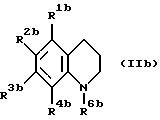
где R1b и R3b каждый независимо является атомом водорода, C1-C6 алкилом или C1-C6 алкокси;
R2b является C1-C8 алкилом, замещенным гидрокси, карбокси или C2-C5 алкоксикарбонилом;
R4b является группой формулы -NHCOR7b, где R7b является C1-C20 алкилом, C1-C6 алкокси C1-C6 алкилом, C1-C6 алкилтио C1-C6 алкилом, C3-C8 циклоалкилом, C3-C8 циклоалкил C1-C3 алкилом, фенилом, фенил C1-C4 алкилом или группой формулы -NHR8b, где R8b является C1-C20 алкилом;
R6b является C1-C20 алкилом, C3-C12 алкенилом, C1-C6 алкокси C1-C6 алкилом, C1-C6 алкилтио C1-C6 алкилом, C3-C8 циклоалкилом, C3-C8 циклоалкил C1-C3 алкилом или фенил C1-C4 алкилом,
или его фармацевтически приемлемая соль.
(1) N-(1-гексил-6-карбоксиметил-5,7-диметил-1,2,3,4-тетрагидрохинолин-8-ил)-2,2-диметилпропанамида,
(2) N-(1-гептил-6-карбоксиметил-5,7-диметил-1,2,3,4-тетрагидрохинолин-8-ил)-2,2-димeтилпpoпaнaмидa,
(3) N-(1-октил-6-карбоксиметил-5,7-диметил-1,2,3,4-тетрагидрохинолин-8-ил)-2,2-диметилпропанамида,
(4) N-(1-нонил-6-карбоксиметил-5,7-диметил-1,2,3,4-тетрагидрохинолин-8-ил)-2,2-диметилпропанамида,
(5) N-(1-децил-6-карбоксиметил-5,7-диметил-1,2,3,4-тетрагидрохинолин-8-ил)-2,2-диметилпропанамида,
(6) N-(1-гексил-6-гидроксиметил-5,7-диметил-1,2,3,4-тетрагидрохинолин-8-ил)-2,2-димeтилпропанамида,
(7) N-(1-гептил-6-гидроксиметил-5,7-диметил-1,2,3,4-тетрагидрохинолин-8-ил)-2,2-диметилпропанамида,
(8) N-(1-октил-6-гидроксиметил-5,7-диметил-1,2,3,4-тетрагидрохинолин-8-ил)-2,2-диметилпропанамида,
(9) N-(1-нонил-6-гидроксиметил-5,7-диметил-1,2,3,4-тетрагидрохинолин-8-ил)-2,2-димeтилпpoпaнaмидa, и
(10) N-(l-дeцил-6-гидpoкcимeтил-5,7-димeтил-1,2,3,4-тетрагидрохинолин-8-ил)-2,2-диметилпропанамида,
или его фармацевтически приемлемая соль.
или его фармацевтически приемлемая соль.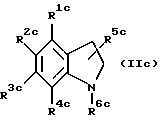
где один из R1c, R2c и R5c является карбокси или C2-C5 алкоксикарбонилом, а два другие каждый независимо являются атомом водорода, C1-C6 алкилом или C1-C6 алкокси;
R3c либо R4c являются группой формулы -NHCOR7c, где R7c является C1-C20 алкилом, C1-C6 алкокси C1-C6 алкилом, C1-C6 алкилтио C1-C6 алкилом, C3-C8 циклоалкилом, C3-C8 циклоалкил C1-C3 алкилом, фенилом, фенил C1-C4 алкилом или группой формулы -NHR8c, где R8c является C1-C20 алкилом, а другой является атомом водорода, C1-C6 алкилом или C1-C6 алкокси;
R6c является C1-C20 алкилом, C3-C12 алкенилом, C1-C6 алкокси C1-C6 алкилом, C1-C6 алкилтио C1-C6 алкилом, C3-C8 циклоалкилом, C3-C8 циклоалкил C1-C3 алкилом или фенил C1-C4 алкилом,
или его фармацевтически приемлемая соль.
(1) N-(1-гексил-5-карбокси-6-метилиндолин-7-ил)-2,2-диметилпропанамида,
(2) N-(1-октил-5-карбокси-6-метилиндолин-7-ил)-2,2-диметилпропанамида,
(3) N-(1-децил-5-карбокси-6-метилиндолин-7-ил)-2,2-диметилпропанамида,
(4) N-(1-гексил-5-карбокси-4,6-диметилиндолин-7-ил)-2,2-диметилпропанамида,
(5) N-(1-октил-5-карбокси-4,6-диметилиндолин-7-ил)-2,2-диметилпропанамида, и
(6) N-(1-децил-5-карбокси-4,6-диметилиндолин-7-ил)-2,2-диметилпропанамида,
или его фармацевтически приемлемая соль.
Приоритет по пунктам:
05.10.1995 по пп.1, 3 - 10, 21 - 23;
14.03.1996 по пп.3 - 10, 16 - 23;
24.07.1996 по пп.2 - 15, 21 - 23.
| EP 0622356 A1, 02.11.1994 | |||
| US 4448785, 15.05.1984 | |||
| Способ получения производных индолил-2-уксусной кислоты | 1972 |
|
SU457698A1 |
Авторы
Даты
2001-09-10—Публикация
1996-09-30—Подача