Изобретение относится к производным 3/5-диоксо-3/4/5/6-тетрагидрооксазинов и к химическому способу борьбы с сорняками с их использованием.
Уже известно использование 1/3-дикарбониловых соединений в качестве гербицидов. Однако активность их недостаточна.
Целью изобретения является повышение гербицидной активности.
Указанная цель достигается использованием производных 3/5-диоксо-3/4/5/6-тетрагидрооксазинов формулы.
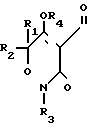
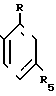 где каждый R1, R3-C1-C4-алкил; R2- водород или С1-С4-алкил; R4- водород; R- галоген/ нитро/ трифторметил; R5- водород/ галоген/ С1-С4- алкил или С1-С4- алкокси/ замещенные 1-3 атомами галогена/ SС1-С4- алкил/ SO2-C1-C4-алкил или OSO2-C1-C4-алкил и способу борьбы с сорняками с использованием соединения формулы (I) в количестве 0/05 кг/га - 11 кг/га.
где каждый R1, R3-C1-C4-алкил; R2- водород или С1-С4-алкил; R4- водород; R- галоген/ нитро/ трифторметил; R5- водород/ галоген/ С1-С4- алкил или С1-С4- алкокси/ замещенные 1-3 атомами галогена/ SС1-С4- алкил/ SO2-C1-C4-алкил или OSO2-C1-C4-алкил и способу борьбы с сорняками с использованием соединения формулы (I) в количестве 0/05 кг/га - 11 кг/га.
Изобретение иллюстрируется следующими примерами.
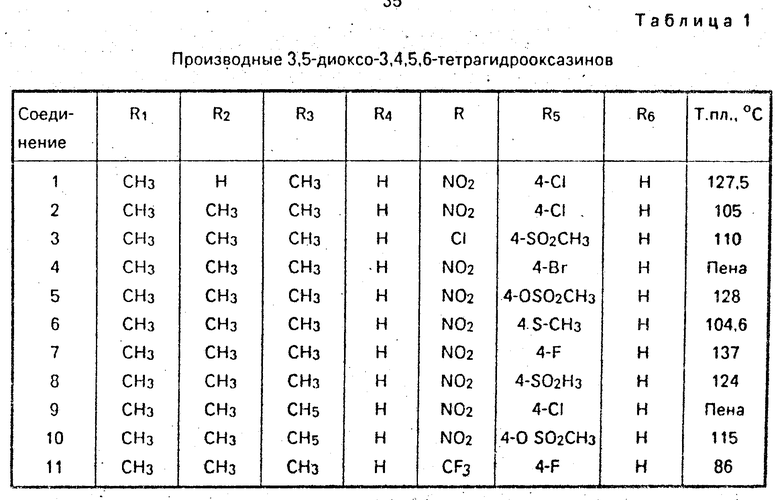
Пример 1. Получение 2/6-диметил-4-(4-хлоро-2-нитробензоил)-2Н-1/2-оксазин-3/ 5-(4H/6H)-дион (формула 1а/ где R1 и R3- CH3; R2/R4 и R6-H; R-NO2; R5-Cl; соединение N 1 в табл.1).
3/65 г 2/6-диметил-5-(4-хлоро-2-нитробензоилокси)-6Н-1/2-оксазин-3-он обрабатывали триэтиламином (3/06 мл) и ацетоновым цианогидрином (0/3мл) в 20 мл ацетонитрила. После чего смесь перемешивали в течение ночи и полученный раствор концентрировали до небольшого объема и растворяли в дихлорметане в воде. Объединенные экстракты промывали разбавленной HCl/ и солевым раствором/ а затем высушивали и выпаривали до получения маслянистого остатка. Сырой продукт перекристаллизовали из эфира и получали кристаллическое соединение 2/6-диметил-4-(4-хлоро-2-нитробензоил)-2Н-1/2-оксазин-3/5(4Н/6Н)-дин; т.пл 125/5°С.
Соединения/ представленные в табл.1/ были получены способом/ аналогичным описанному в примере 1. ЯМР-спектр. Соединение 4 ЯМР(CDCl3): δ 1,30, 1,53 (c. c. 6H, C(CH3)2), 3,08, 3,38 (c.c.3H, NCH3), 7.21 (д. 1H, 8H), 7,83(дд. 1H, 8Гц)/ 8/33 (д.1Н/2Гц)-фенил Н). Соединение 9 ЯМР(CDCl3): δ 1,33, 1,53 (c. c. 6H, C(CH3)2), 1,20 (м. 3Н/ NCH2CH3)/ 3,66 (м. 2H, NCH2CH3), 7,28 (д/ 1Н/ 8 Гц/ 7/66 дд/ 1Н/ 8 Гц)/ 8/18)д/ 1Н/ 2 Гц)-фенил Н).
Пример 2. Получение 2/6-диметил-5-(4-хлоро-2-нитробензоилокси)-6Н-1/2-оксазин-3-он (формула IIa, R1-R3-CH3, R2R6-H, R-O2, P5-Cl).
К раствору 1/77 г 2/6-диметил-2Н-1/2-оксазин-3/4(4Н/6Н)-диона в 15 мл дихлорметана/ содержащего 2/4 мл триэтиламина/ по капле добавляли при 0°C раствор 2/72 г 4-хлоро-2-нитробензоилхлорида в 10 мл дихлорметана. После завершения добавления реакционную смесь размешивали при комнатной температуре в течение 1 ч/ а затем разбавляли дихлорметаном/ промывали/ высушивали и выпаривали досуха/ в результате чего получали целевое соединение.
Пример 3. Получение 2/6-диметил-2H-1,2-оксазин-3/5(4H/ 6Н)-диона (формула III, R1= R3=CH3; R2=H).
4,9 г маслянистой смеси/ 2/6-диметил-4-карбометокси-2Н-1/2-оксазин-3/5(4Н/6Н)-диона и 2/6-диметил-4-карбоэтокси-2Н-1/2-оксазин-3/5(4Н/6Н)-диона/ полученной способом/ описанным ниже/ нагревали при 79°С в 25 мл ДМСО и 0/9 мл воды в течение 3 ч. Реакционную смесь разбавляли в простом эфире/ выливали воду и экстрагировали эфиром. Объединенные экстракты высушивали и выпаривали/ в результате чего получали целевое соединение.
Следующие два диона могут быть получены аналогичным способом. 2/6/6-триметил-2Н/ 1/2-оксазин-3/5(4Н/6Н)-дион (формула III, R1= R2=R3=СH3).
2-Этил-6/6-диметил-2Н-1/2-оксазин-3/5(4Н/6Н)-дион(формула III, R1=R2= CH3; R3=C2H5).
Пример 4. Получение 2/6-диметил-4-карбометокси-2Н-1/2-оксазин-3/5(4Н/6Н)-дион и 2/6-диметил-4-карбоэтокси-2Н/ 1/2-оксазин 3/5(4Н/6Н)-дион в виде смеси.
К свежеприготовленному из 694 мг металлического натрия и метанола и суспендированному раствору метоксида натрия в 45 мл толуола добавляли по капле при комнатной температуре раствор 7/1 г метил-N-этоксикарбонилацетил-2-метиламинокси-пропионата в 10 мл толуола. После завершения добавления полученную в результате смесь перемешивали при комнатной температуре в течение 24 ч. Затем реакционную смесь выливали в ледяную воду и экстрагировали эфиром (отбрасывается). Затем водный раствор подкисляли 10 %-ной водной HCl и экстрагировали дихлорметаном. Объединенные экстракты высушивали и выпаривали досуха/ в результате чего получали маслянистую смесь целевых соединений.
Пример 5. Получение метил-N-этоксикарбонилцетил-2-метиламинооксипропионата.
К раствору 5/32 г метил-2-метиламинооксипропионата в 50 мл дихлорметана по капле добавляли (при 0°С) раствор 6/62 г этилмалонилхлорида в 15 мл дихлорметана. После завершения добавления полученный в результате раствор перемешивали при 0°С в течение 1 ч. Затем реакционную смесь выливали в воду и экстрагировали эфиром. Объединенные экстракты промывали разбавленной HCl и солевым раствором/ высушивали и выпаривали/ в результате чего получали маслянистый остаток/ который хроматографивали на силикагеле/ и наконец получали маслянистое соединение метил-N-этоксикарбонилацетил-2-метиламинооксипропионата.
ЯМР-спектры для соединений примеров 2-5.
Пример 2. 1H ЯМР(ОDCl3): δ 1,47 (д. 3H, OCH(CH3)),3,20 (c, 3H, NСH3), 4,81 (кв. 1Н/ OCH(CH3)) 6,15(c, 1H, = CHCO) и 7,77, 7,97 (c.дд. 3H, фенил Н).
Пример 3. 1H ЯМР(CDCl3): δ 1,43 (д. 3H, OCH(CH3)),3,30 (c, 1H, NCH3), 3,53 (кв. 2Н/ OСCH2CО) и 4,40 (кв. 1Н/ ОСН3).
Пример 4. 2/6-Метил-4-карбометокси-2Н-1/2-оксазин-3/5(4Н/6Н)-дион. 1H ЯМР(CDCl3): δ 1,50 (д.3H, OCH(CH3)),3,21 (c, 3H, NCH3), 3,93 (2/3Н/ OСH3) и 4,73 (кв. 1Н/ ОСН(CH3)). 2/6-Диметил-4-карбоэтокси-2Н-1/2-оксазин-3/5(4Н/6Н)-дион. 1H ЯМР(CDCl3): δ 1,40 (т. 3H, OCH2CH3),1,48 (д, 3H, OCH(CH3)), 3,21(с, 3H, CH3), 4,41(кв. 2Н/ ОСН3CH3) и 4/73 (кв. 1Н/ ОСН(CH3)). Пример 5. Метил-N-этоксикарбонилацетил-2-метиламинооксипропионат 1H ЯМР(CDCl3): δ 1,28 (т. 3H, OCH2CH3), 3,23 (с.3H,NCH3), 3,70(кв. 2Н, OCCH2CO), 3.77 (c. 2H, OCH3), 4,21(кв. 2H, OCH2CH3) и 4.57 (кв. 1H, OCH(CH3)).
Пример 6. Метод испытания.
Соединения по изобретению испытывали на послевсходовую гербицидную активность по следующей методике: ростки некоторых сорняков
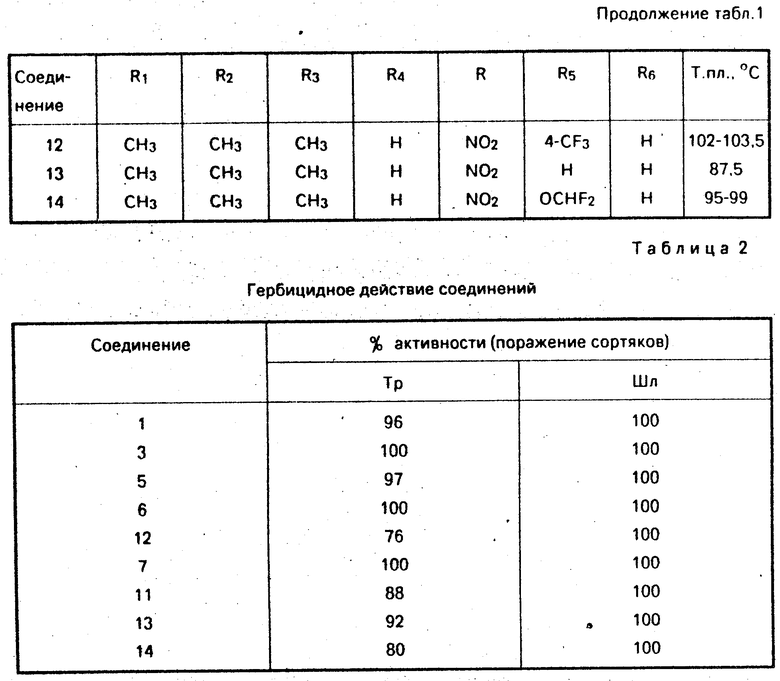
опрыскивали раствором вода/ацетон (1:1) поверхностно-активного вещества (0/5 % ) и испытуемого соединения при норме расхода 5 кг/га. Оценивали действие через две недели после опрыскивания. Были обработаны травы (тр.): Sctaria viridis, Echinochloa crusgalli, Bromus tectorum, Avena fatua, а также широколиственные травы (Шл): Sinapis alba, Amaranthus retraflexus, Solanum nigrum, Abutllon theophrasti.
Ниже представлены усредненные данные по активности соединений по изобретению в послевсходовой обработке. Результаты приведены в табл.2.
Использование: сельское хозяйство, химический способ борьбы с сорняками. Сущность изобретения: замещенные 3,5-диоксо- 3,4,5,6-тетрагидроксизинов ф - лы I, где R1, R3-C1-C4 -алкил; R2 -водород или C1-C4 -алкил; R4 -водород; R - галоген, нитро, трифторметил, R5 -водород, галоген, C1-C4 -алкил или C1-C4 -алкокси, замещенные 1 - 3 атомами галогена, SC1-C4 -алкил, SO2-C1-C4 -алкил или OSO2-C1-C4 -алкил, и обработка сорняков или очагов их распространения соединением ф - лы I в количестве 0,05-11 кг/га. 2 с., 3 з. п. ф - лы, 2 табл. Структура соединения формулы I: 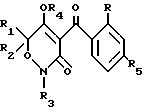 .
.
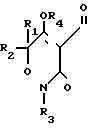
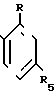
где R - галоген, нитро или трифторметил;
R1 и R3 каждый - C1 - C4-алкил;
R2 - водород или C1 - C4-алкил;
R4 - водород;
R5 - водород, галоген, C1 - C4-алкил или C1 - C4-алкокси, замещенные 1 - 3 атомами галогена, SC1 - C4-алкил, SO2 - C1 - C4-алкил или OSO2-C1 - C4-алкил.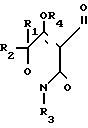
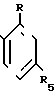
где R - галоген, нитро, трифторметил;
R1 и R3 - каждый C1 - C4-алкил;
R2 - водород или C1 - C4-алкил;
R4 - водород;
R5 - водород, галоген, C1 - C4-алкил или C1 - C4-алкокси, замещенные 1 - 3 атомами галогена, SC1 - C4-алкил, SO2-C1 - C4-алкил или OSO2-C1 - C4-алкил,
в количестве 0,05 - 11,0 кг/га.
Авторы
Даты
1994-06-15—Публикация
1991-10-02—Подача