Изобретение относится к способу получения новых производных 1-арил-2-арилоксиэтана общей формулы
Ar-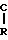 H-
H-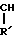 -O-Ar′
-O-Ar′
(I) в которой
Ar1 ароматическое кольцо формулы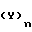 _
_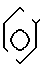 и Ar ароматическое кольцо формулы
и Ar ароматическое кольцо формулы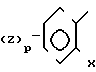 в которых p, n 1 или 2;
в которых p, n 1 или 2;
Z водород, низший алкил, низший алкоксил, атом галогена, гидроксил, низший ацилокси, низший алкенилокси, фенокси, фенил или (низший алкил) оксикарбонилрадикал или цепь О(СН2)2О или СН СН-СН= СН, образующая с бензольным кольцом дополнительной конденсированный цикл;
Y Н, низший алкил, низший алкоксил или низший ацилокси;
Х гидроксил, низший алкоксил, низший ацилокси, группа в которой Ar' имеет вышеуказанные значения, в присутствии кислотного катализатора для получения диарилэтанона общей формулы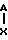 r-
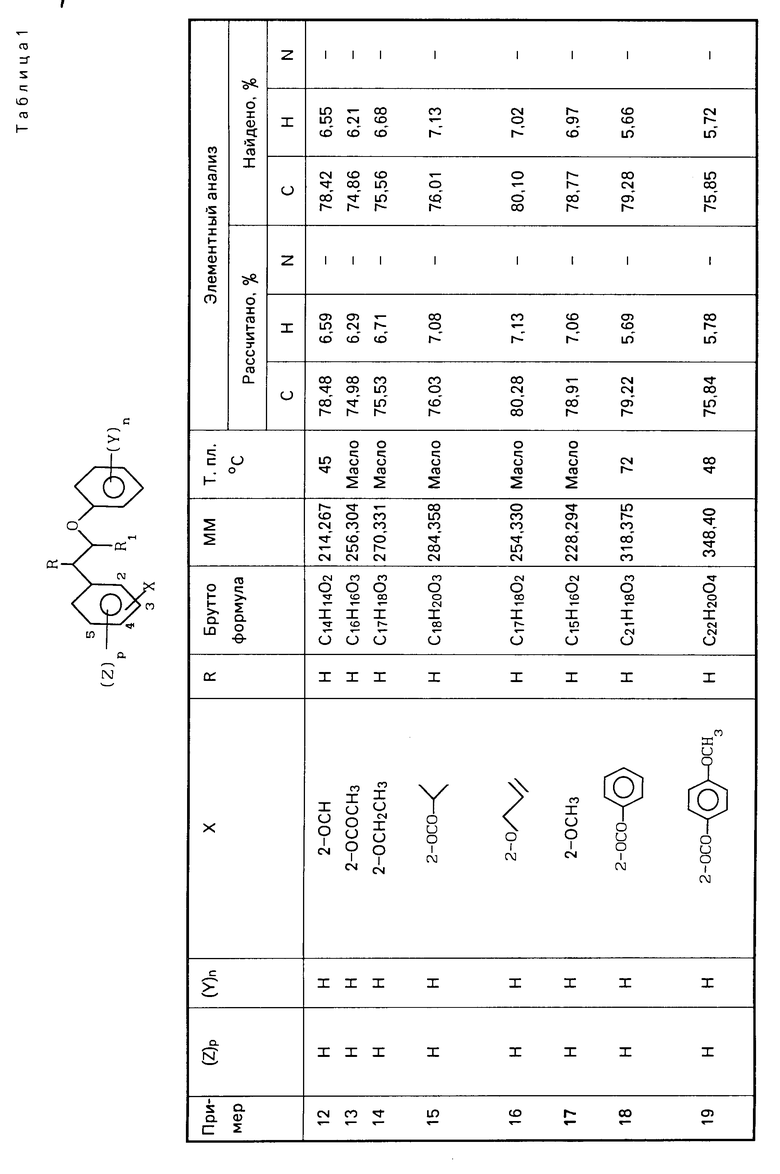
r-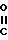 -CH2-O-Ar′
-CH2-O-Ar′
(IV) в которой Ar и Ar' имеют вышеуказанные значения, а Х группа ОН, последний вводят во взаимодействие с низшим алкилхлорофермиатом, затем подвергают восстановлению с помощью боргидрида щелочного металла для получения диарилэтанола общей формулы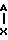 r-CHOH-CH2O-Ar′
r-CHOH-CH2O-Ar′
(V) в которой Ar, Ar' имеют вышеуказанные значения, Х гидроксил, который подвергают алкилированию с помощью алкилирующего агента в основной среде или подвергают ацилированию с помощью производного карбоновой или фосфоновой, или серной, или сульфоновой кислоты.
В этом способе в качестве кислотного катализатора может быть кислота Льюиса, напpимеp трифторид бора или хлорид алюминия.
Восстановление соединения IV осуществляется после реакции с алкилхлорформиатом с последующим прямым восстановлением боргидридом щелочного металла.
Ацилирование фенольной группы осуществляется преимущественно при использовании хлорангидрида в присутствии органического основания, такого как триэтиламин. Алкилирование
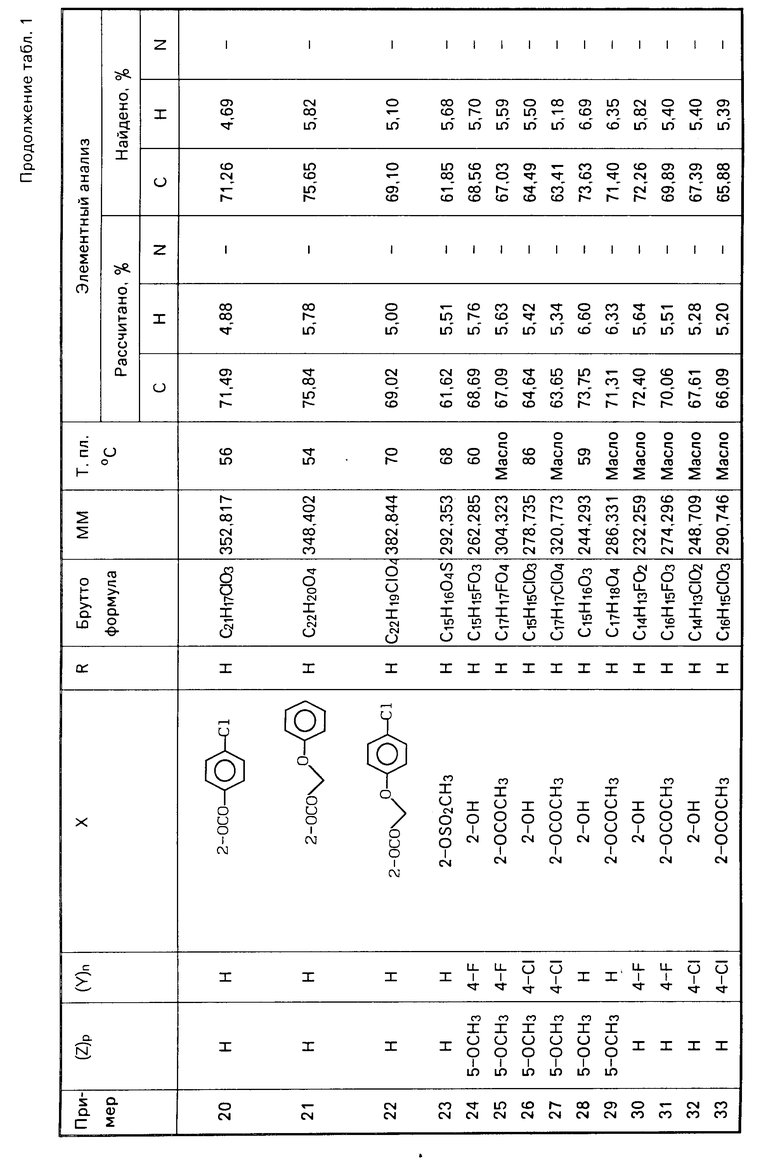
O-P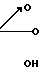 H ациламино(низший алкил) оксикарбонил, группа
H ациламино(низший алкил) оксикарбонил, группа
-O-SO алкилсульфонилокси или аминосульфонилокси
алкилсульфонилокси или аминосульфонилокси
R и R' водород, обладающих фармакологической активностью, в частности диуретической, противогипертонической, антиагрегантной против тромбоцитов, и свойствами антилипоксигеназы.
Известны соединения тиазидового или фенилсульфонамидного типа, такие как фуросемид или гидрохлортиазид (I), обладающие диуретическими свойствами.
Задача данного изобретения состоит в изыскании новых групп соединений с широким спектром действия, обладающие повышенным диуретическим действием.
Поставленная задача достигается способом получения производных 1-арил-2-арилоксиэтана общей формулы I, отличительная особенность которого состоит в том, что фенольные соединения общей формулы
Ar
(II) в которой Ar и Х имеют вышеуказанное значение, вводят во взаимодействие с арилацетонитридом общей формулы
Ar'- О СН2СN (III) соединения формулы V осуществляется в ацетонитриле в качестве инертного растворителя.
Алкилирующим агентом является преимущественно сульфат или алкилгалогенид. Сульфатацию соединения V осуществляют при использовании комплекса серный ангидрид-триэтиламин или серный ангидрид пиридин. Реакцию проводят в присутствии основного агента, как, например, карбонат или гидроксид щелочного металла. Фосфатацию соединения V проводят, как правило, за две стадии: хлорфосфорилирование при помощи оксихлорида, а затем гидролиз фосфоридихлорсодержащего соединения, которое образуется в качестве промежуточного.
П р и м е р 1. 1-(2-гидрокси-5-метоксифенил)-2-феноксиэтан.
Стадия А. 1-(2-гидрокси-5-метоксифенил)-2-феноксиэтанон.
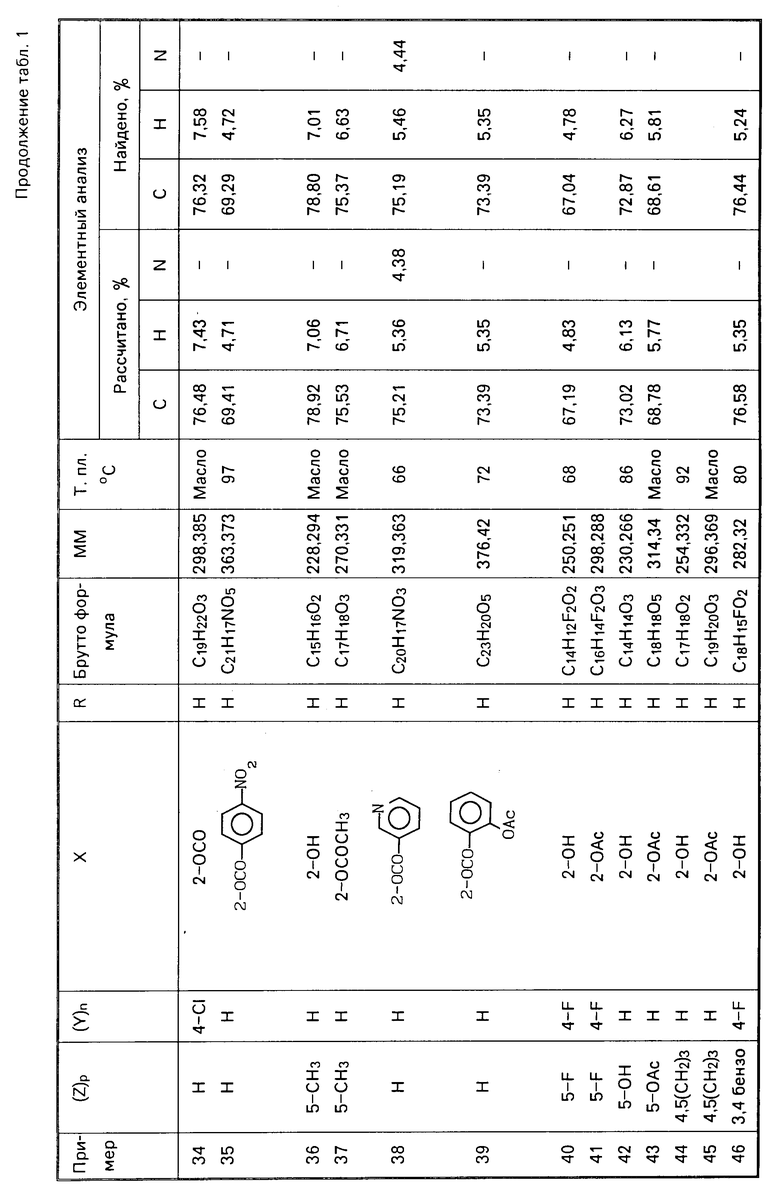
К раствору 32,2 г (0,27 моль) трихлорида бора в дихлорэтане (200 мл), доведенному до 0оС, прибавляют последовательно раствор, образованный 28,4 г (0,23 моль) 4-метоксифенола в 100 мл дихлорэтана, 36,6 г (0,24 моль) феноксиацетонитрила, затем 15,2 г (0,11 моль) хлорида алюминия при перемешивании.
Смесь выдерживают при перемешивании в течение 20 ч при обычной температуре. После гидролиза в кислой среде в течение 30 мин и экстракции получают в результате кристаллизации в метаноле 26 г, т.е. с выходом 44% феноксиацетофенона. Чистый продукт плавится при 128оС.
Стадия В. 1-(2-гидрокси-5-метоксифенил)-2-феноксиэтан.
При 0оС прибавляют 6,4 г (0,058 моль) этилхлорформиата к раствору 12,8 г 1-(2-гидрокси-5-метоксифенил)-2-феноксиэтанона, полученного на стадии А, в 100 мл тетрагидрофурана в присутствии 6 н (0,058 моль) триэтиламина. После контактирования в течение 1 ч при перемешивании и при комнатной температуре отфильтровывают образованный хлоргидрат триэтиламина и вводят фильтрат по капле в раствор 5,6 г (0,15 моль) боргидрата натрия в 50 мл воды при 5оС в течение 45 мин. После перемешивания при обычной температуре в течение 1,5 ч выливают реакционную среду на лед, подвергают кислотному гидролизу с хлороводородной кислотой, затем экстрагируют эфиром. После перегонки растворителя получают 8,4 г очищенного дистилляцией при пониженном давлении продукта (выход 69%). Температура плавления (Т.пл.) 170оС.
П р и м е р 2. 1-(2-метоксифенил)-2-феноксиэтан.
Прибавляют 4,9 г (0,039 моль) метилсульфата к 4 г 1-(2-гидроксифенил)-2-феноксиэтана (0,032 моль) и 16 г карбоната калия (0,117 моль) в 100 мл ацетонитрила и нагревают смесь с рефлюксом в течение 5 ч. После выпаривания и экстракции выделяют 5,6 г (выход 80%) 2-метоксилированного производного в виде маслянистого продукта.
П р и м е р 3. 1-(2-ацетокси-5-метоксифенил)-2-феноксиэтан.
К 4 г (0,016 моль) 1-(2-гидрокси-5-метоксифенил)-2-феноксиэтана прибавляют 1,5 г (0,019 моль) ацетилхлорида и 2 г (0,019 моль) триэтиламина с целью проведения ацетилирования. После перемешивания в течение 1 ч при обычной температуре среда экстрагируется, в результате чего получают 4 г, т.е. 85% 2-ацетоксилированного производного.
П р и м е р 4. Калийная соль -(2-сульфитоксифенил)-2-(4-фторфенокси)-этана.
В трехгорлую колбу в атмосфере аргона вводят 6,53 г (0,47 моль) карбоната калия и 10 г (0,43 моль) 1-(2-гидроксифенил)-2-(4-фторфенокси)-этана и 100 мл ацетонитрила. Перемешивают в течение 30 мин при 40оС, затем прибавляют 8,97 г (0,645 моль) комплекса [SO3-триметиламин] После перемешивания смесь охлаждают, образованный сульфат выпадает в осадок. После фильтрования выделяют 6,5 г твердого вещества белого цвета.
Т.пл. 163оС. Выход 42%
П р и м е р 5. 1-(2-фосфонилоксифенил)-2-(4-фторфенокси)-этан.
Стадия А. 2-[(4-фторфенокси)-этил]-фенилфосфордихлоридат.
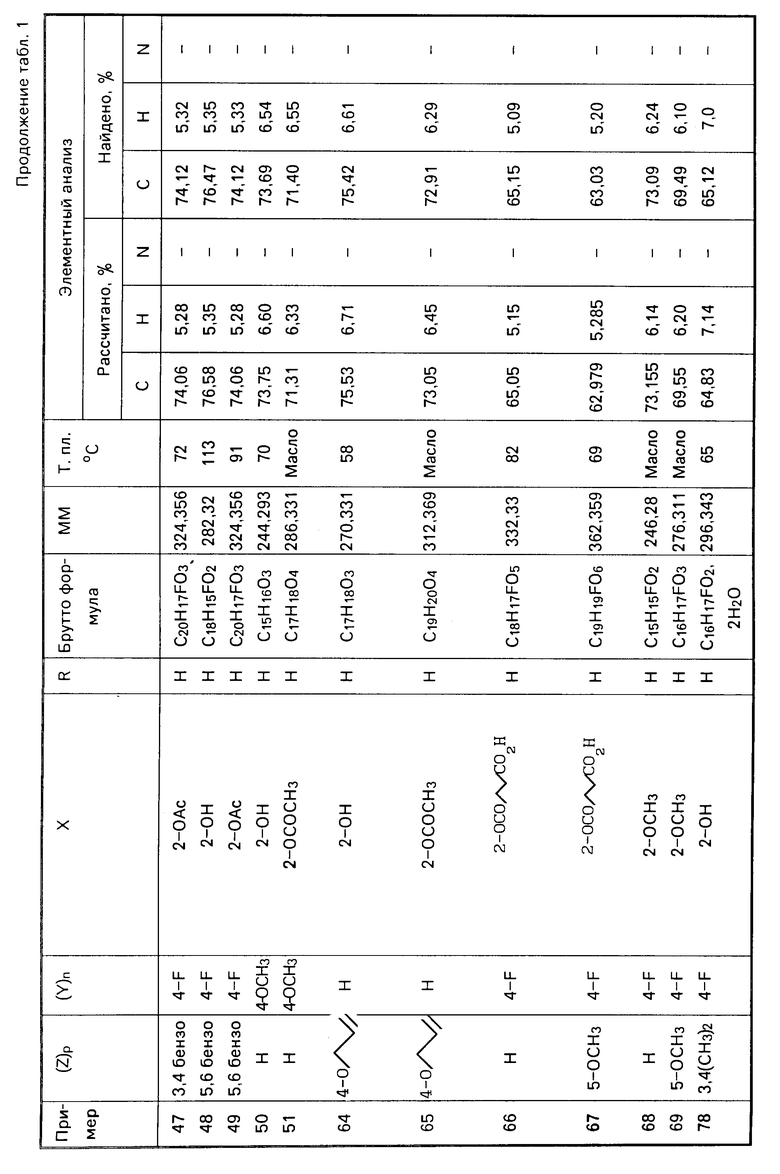
Растворяют 10 г (0,043 моль) 1-(2-гидроксифенил)-2-(4-фторфенокси)-этана в 36 г РОСl3 (0,235 моль) и нагревают с рефлюксом в течение 2,5 ч в присутствии 0,1 г хлорида алюминия. Реакционную среду концентрируют, затем перегоняют. Образованный фосфат перегоняются при т.кип. (0,25) 210-220оС. Получают 9,71 г маслянистого продукта (выход 64%).
Стадия В.
Гидролиз фосфордихлоридата.
Подвергают гидролизу 4 г (0,11 моль) фосфордихлоридата в 10 мл воды при перемешивании и при 80оС. Смесь выдерживают при перемешивании в течение 3 ч. Затем концентрируют под вакуумом досуха. Путем растирания в порошок в петролейном эфире получают 3,1 г твердого вещества белого цвета. Т.пл. 80-82оС. Выход 86%
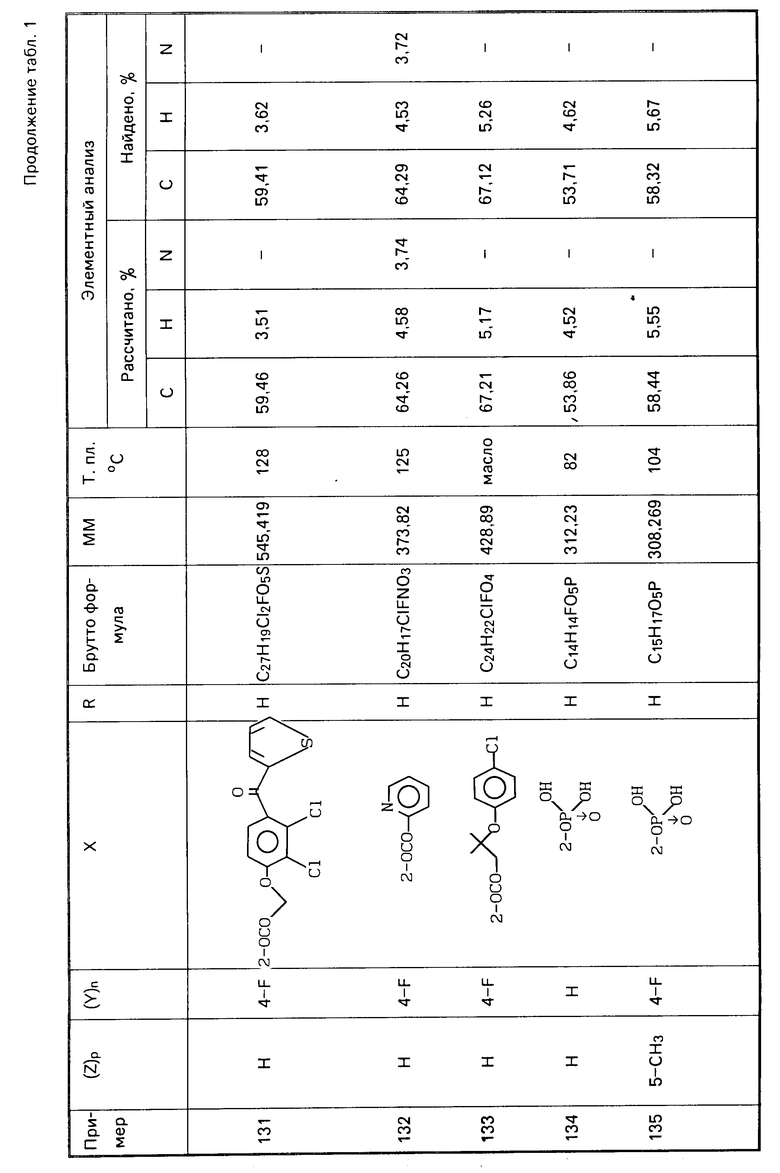
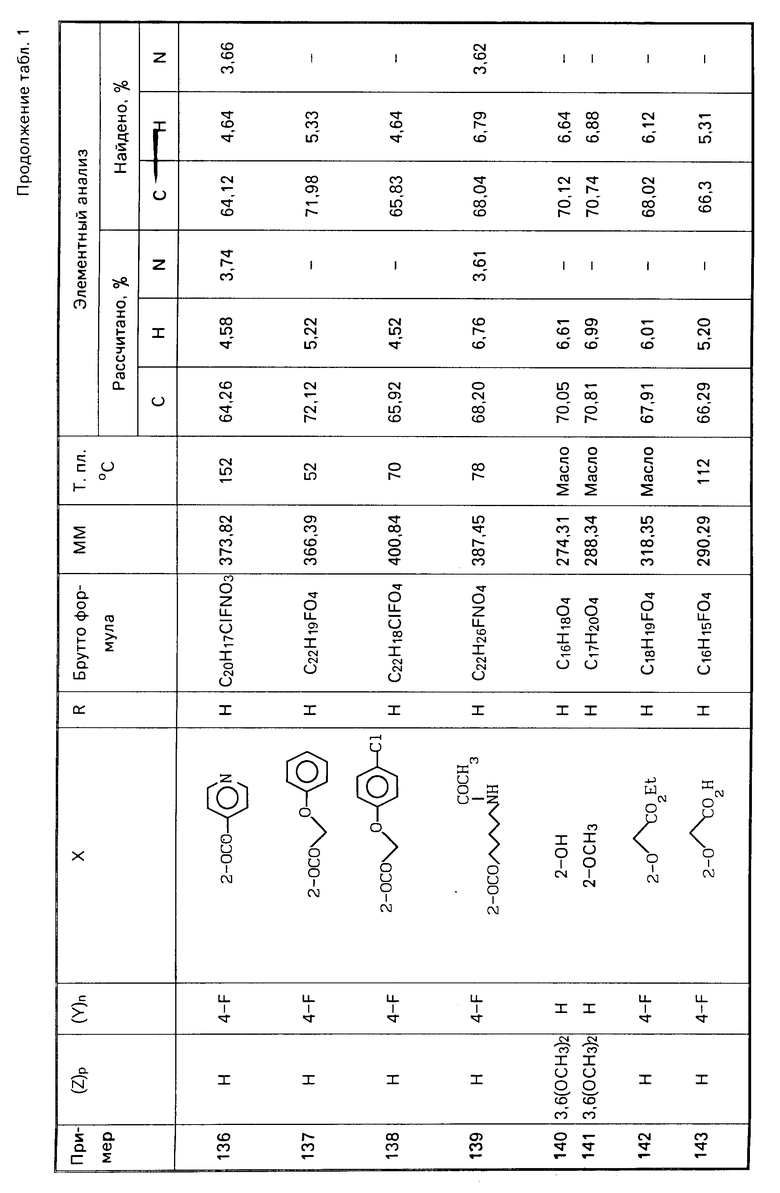
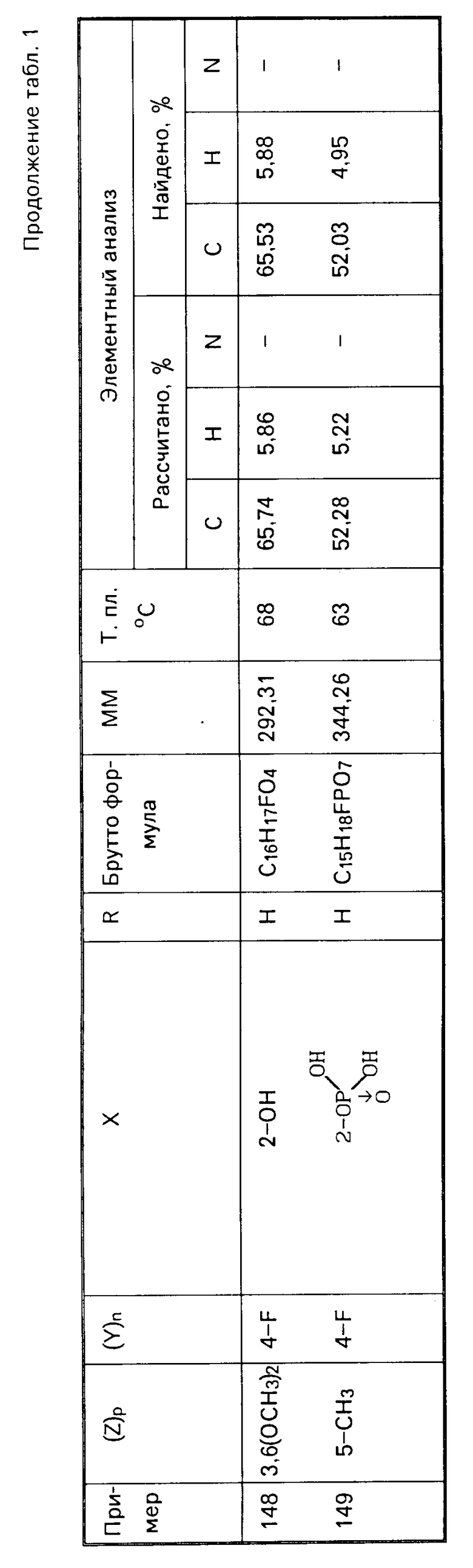
Аналогичным методом, но используя соответствующие исходные, получают следующие соединения, указанные в табл. 1.
Фармакологическое изучение соединений по изобретению.
А Диуретическое действие
1. У мышей.
Продукты вводили партиями из 12 мышей-самцов, массой 25-30 г, мышам, распределенным на пары, предварительно вводили жидкий носитель, содержащий исследуемый продукт в объеме 25 мл/кг, а затем вводили 9%-ную физиологическую сыворотку, причем общий вводимый объем составил 1 мг на одну мышь.
Диурез изучался в течение 4 ч. Объем мочи измерялся каждый час. Натрий и калий количественно определяли спектрофотометрически в собранной моче.
2. У крыс.
Крысам-самцам, массой 200-250 г, вводят натощак за 18 ч до испытания жидкий носитель. Животных помещают по одному в диурезные камеры и вводят через рот дозу объемом 20 мг/кг 0,9%-ного хлорида натрия, содержащую исследуемое соединение формулы I. Диурез измеряли в течение 5 ч, объемы мочи каждый час. Содержание натрия и калия определяли спектрофотометрическим методом.
Полученные результаты приведены в табл. 2.
В Противогипертоническое действие на неанестезированной крысе
Изучение проводили на партии крыс-самцов SHR (производитель ОКАМОТО) в возрасте 16 нед. Систолическое артериальное давление определяли сфигмоманометрическим методом (электросфигмограф NARCO для биосистем типа РЕ 300). Измерения давления проводят через 24 ч после введения соединения с общей формулой I, систолическое артериальное давление рассчитывают как среднее по 6-8 измерениям.
Полученные результаты приведены в табл. 3.
Кинетика противогипертонического действия отличается от кинетики диуретического эффекта.
С-Действие в качестве антиагрегантов тромбоцитов
Исследования проводили с обогащенной тромбоцитами плазмой, полученной из крови крыс, причем агрегация вызывается добавлением аденозиндифосфорной кислоты (АДФК). Нефелометрические кривые агрегации получают, используя агрегометр типа ВОRN, причем плазма инкубируется при 37оС при постоянном перемешивании со скоростью 1100 об/мин (Воrn G.V.R. Cross J. J.Physiol. 169 (1962), 178).
В табл. 4 приведены результаты, полученные для исследованных соединений с общей формулой I.
Результаты ин витро были подтверждены результатами, полученными экс виво на крысах, которым вводили в течение 3 дней соединение с общей формулой I оральным путем
Констатируют замедление агрегации тромбоцитов, которое выражается в удвоении дозы АДФК по отношению к контрольному опыту, чтобы получить 50%-ную агрегацию.
Тиклопидин, взятый в качестве сравнения, при идентичной дозе дает похожие результаты.
Д Действие на системы переноса натрия и калия и эритроцитов человека
Этот эффект был изучен в соответствии с методикой, описанной G.Caray et coll. b Naunyn-Schmidberg's Arch. Pharmacol. 334(1986), 202-209 и в Bioch. Рharm. 33(1984), 2013-2020.
Полученные результаты приведены в табл. 5. Они превосходят результаты, полученные при помощи фуросемида и ксипамида.
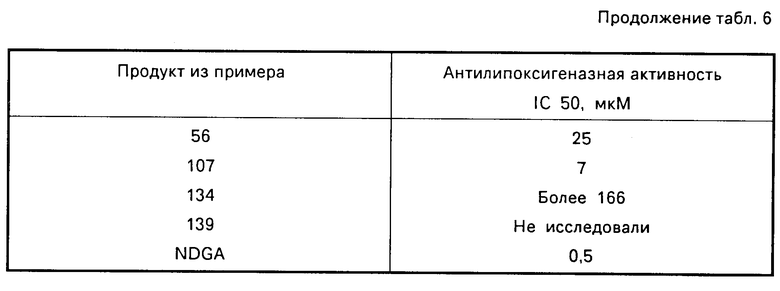
Е Антилипоксигеназное действие
Антилипоксигеназное действие было изучено на липоксигеназе сои в соответствии с методом, описанным W.L.Smith, W.E.Lands, J.Biol. Chem. 247 (1972), 1038-1047.
Полученные результаты приведены в табл. 6.



Использование: в медицине, так как продукт обладает фармакологическим действием. Сущность изобретения: способ получения новых производных 1-арил-2-арилоксиэтана ф-лы Ar-CH(R)-CH(R′)-O-Ar′, где Ar′ кольцо ф-лы 1, Ar кольцо ф-лы 2, где p и n 1, 2; Z Н, низший алкил и др. Y водород, низший алкил и др. X гидроксил и др. Условия реакции: соединения ф-лы Ar (OH) (X), где Ar, X имеют вышеуказанные значения, вводят во взаимодействие с арилацетонитрилом в присутствии кислотного катализатора. Полученное соединение обрабатывают низшим алкилхлорформиатом с последующим восстановлением до диарилэтанола, который подвергают алкилированию в основной среде с помошью производных карбоновой кислоты или фосфорной или серной или сульфоновой. Структура колец 1 и 2 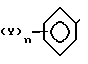
 6 табл.
6 табл.
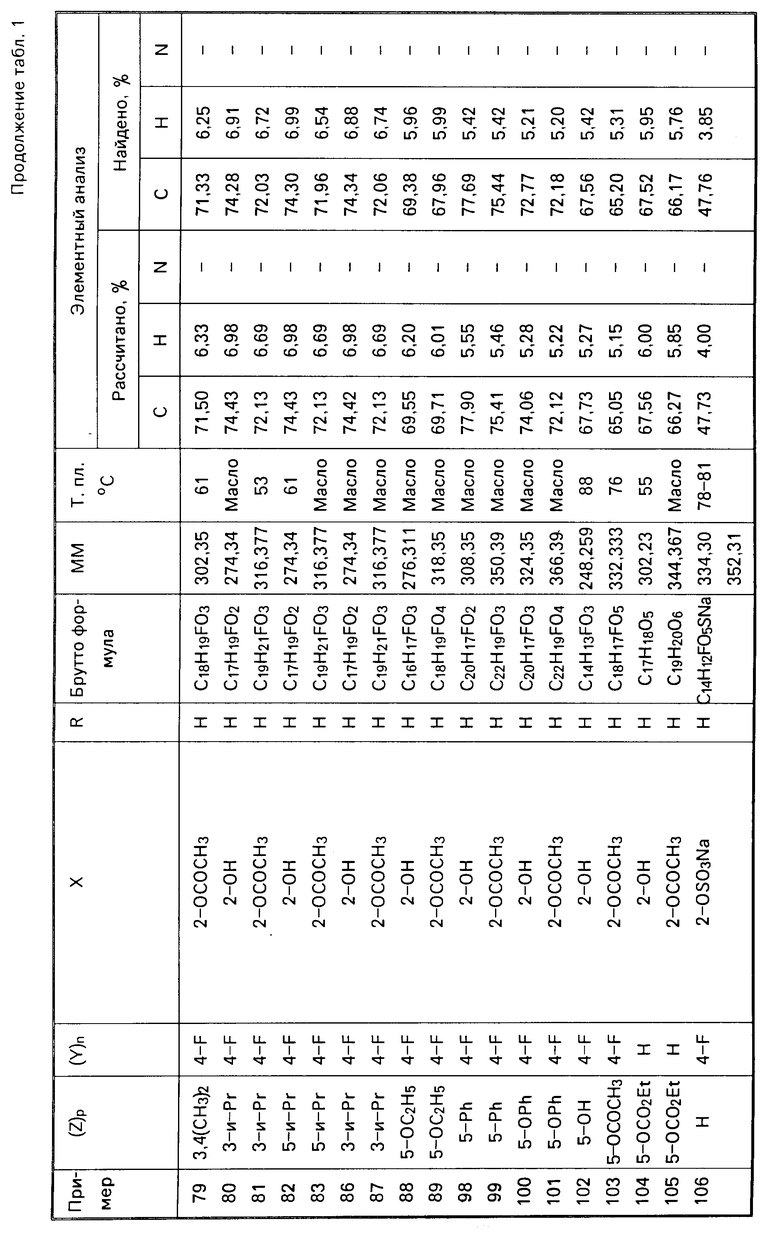
СПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОДНЫХ 1-АРИЛ-2-АРИЛОКСИЭТАНА общей формулы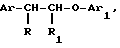
где Ar1 ароматическое кольцо формулы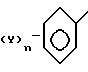
Ar ароматическое кольцо формулы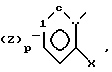
где p и n 1 или 2;
Z водород, низший алкил, низший алкоксил, галоген, гидроксил, низший ацилокси, низший алкенилокси, фенокси, фенил или (низший алкил)-оксикарбонил или Z цепь O(CH2)2O или CH=CH CH CH, образующая с бензольным кольцом дополнительный конденсированный цикл;
Y водород, низший алкил, низший алкоксил или низший ацилокси;
X гидроксил, низший алкоксил, низший ацилоксил, группа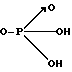
ациламино (низший алкил)-оксикарбонил, группа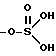
алкилсульфонилокси или аминосульфонилокси;
R и R1 водород,
отличающийся тем, что фенольное соединение общей формулы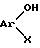
где Ar и X имеют указанное значение,
вводят во взаимодействие с арилацетонитрилом общей формулы
Ar1O-CH2CN,
где Ar1 имеет указанное значение,
в присутствии кислотного катализатора для получения диарилэтанона общей формулы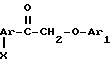
где Ar и Ar1 имеют указанные значения;
X группа OH,
последний вводят во взаимодействие с низшим алкилхлорформиатом, затем подвергают восстановлению с помощью боргидрида щелочного металла для получения диарилэтанола общей формулы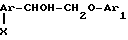
где Ar и Ar1 имеют указанные значения;
X гидроксил,
который подвергают алкилированию с помощью алкилирующего агента в основной среде или подвергают ацилированию с помощью производного карбоновой, или фосфорной, или серной, или сульфоновой кислоты.
| Машковский М.Д | |||
| Лекарственные средства | |||
| М.: Медицина, 1984, т.1, с.487. |
Авторы
Даты
1995-08-27—Публикация
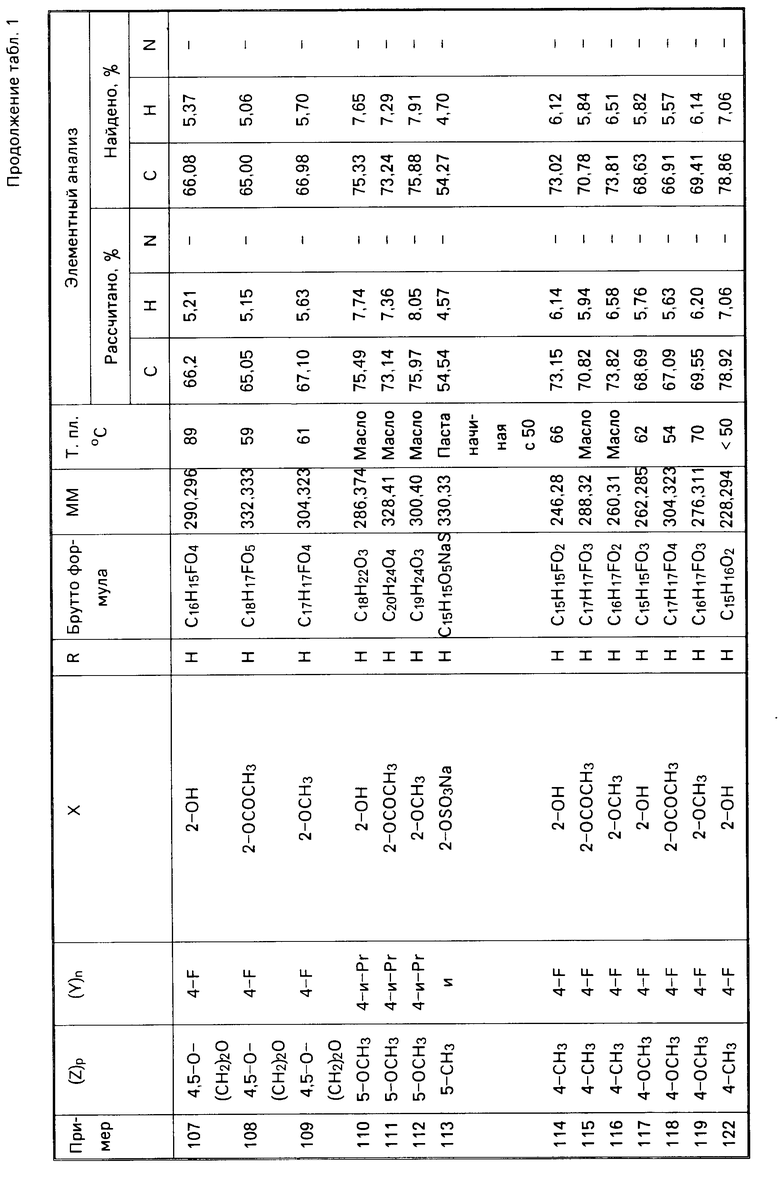
1990-10-18—Подача