Изобретение относится к способу получения веществ, тормозящих действие ретровирусных протеаз. Этиологической причиной синдрома приобретенного иммунного дефицита (СПИД) является вирус иммунодефицита человека (ВИЧ).
Единственно допущенное для применения вещество цидовудин позволяет во многих случаях продлить жизнь пациентов, однако оказывает сильное побочное токсическое действие.
Заявителем обнаружен новый класс соединений, тормозящих с высокой эффективностью ВИЧ-протеазу.
Настоящее изобретение относится к способу получения производных пептидов формулы (I)
R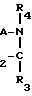 -
-  -
- 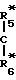 -
-  R
R
D-(Е)n-(F)q-(G)p, (II)
где А* означает остаток формулы II*
D*-(E*)n*-(F*)q*-(G*)p*- (II*) где D означает R1 или остаток формулы III, IV, V
D* означает R1* или остаток формулы III*, IV*, V*
R1-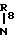 -
-  CO- (III); R1-
CO- (III); R1- -
- 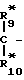 CO- (III*)
CO- (III*)
R1-O- -CO- (IV) R
-CO- (IV) R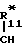 -
-  -CO- (IV*)
-CO- (IV*)
R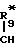 -CO- (V) R
-CO- (V) R -CO- (V*)
-CO- (V*)
причем n, m*, q, q*, p и p* независимо друг от друга означают 0 или 1,
Е, Е*, F, F*, G и G* независимо друг от друга означают аминокислоту из ряда
VaI, Lys, Lys(z), Phe, Chg, Ser, Asn, GIy, IIe, Tbg, Nva или Npg,
R1 и R1* независимо друг от друга означают водород, карбоксил, метилсульфонил, трет- бутилсульфонил, трет-бутоксикарбонил, 2-гидроксиэтилсульфонил, 1,2,3-тригидроксипропил, 1,2,3-триацетоксипропил, бензилоксикарбонил, 4-метилфенилсульфонил, 4-хлорбензилтио, бензилсульфонил, 4-хлорбензилсульфонил, гексадецилсульфонил, 4-амино-1-пиперидилсульфонил, N-трет-бутоксикарбонил-4-амино-1-пипери- дилсульфонил, 4-амино-1-пиперидилкарбонил, N-трет-бутоксикарбонил-4-амино-1-пиперидилкарбонил, 2-амино-3-фенилпропил, N-трет-бутоксикарбонил-2-амино-3-фенилпро- пил, 2-амино-1-гидрокси-4-метилпентил, дезоксифруктоз-1-ил, маннофуранозил, 4-аминоциклогексилкарбонил-2-(или 4)-пиридилацетил, 2-хинолилкарбонил, 1-нафтилацетил, 1-нафтилоксиацетил, 1-(4-пиридил)-этилсульфонил, 12-аминододеканоил, 4-(N-оксидопиридил)трет-бутилтио, 4-Z-н-трет-бутоксикарбониламиноциклогек-силкарбонил, 4-пиридил, тетрадеканоил, фенил, амино, трет-бутоксикарбониламино,
R2 и R2* независимо от друга означают водород, 2-(4-пиридил)-этил, алкил (С1-С6), бензил, 3,4-метилендиоксибензил, 2,4-диметоксибензил, 4-трет-бутилбензил, 2-фенилэтил, циклогексилметил,
R3, R3*, R4, R4*, R6, R6*, R7, R7*, R10 и R10* означает водород,
R5 и R5* означают водород или гидроксил,
R8 и R8* водород или вместе с R9 или R9* и несущим их атомом образуют 1,2,3,4-тетрагидрохинолин-3,4-диил систему,
R9 и R9* независимо друг от друга означают водород, гидроксил, алкил (С1-С6); ацетокси, аминоалкил (С1-С4), гидроксиметил, трет-бутоксиметил, аминокарбонилметил, 2-бензилоксикарбонилэтил, трет-бутоксикарбониламинометил, 2-нафтилметил, трет-бутилтиометил, 4-бензилоксикарбониламинобутил, N, N1-ди-(бензилоксикарбонил)-гуанидинопропил, циклогексил, циклогексилметил, бензил, 2-фенилэтил, -4-гидроксибензил, 4-метоксибензил, 4-трет-бутоксибензил, 1-нафтилметил, 2-тиенилметил, 1-имидазолилметил, 3-индолилметил, 4-пиридилметил, 4(N-оксидопиридил)-метил, 2-метилтиоэтил, 2-метилсульфонилэтил, трет-бутилсульфонилметил, 2-карбоксиэтил,
R11 R11* независимо друг от друга означают водород, гидроксил, ацетокси, причем в вышеуказанных соединениях одна или несколько амидных групп (-CONH) главной цепи может быть заменена на -CH2NH- или -CH(OH)CH2- или их физиологически приемлемых солей.
Предлагаемый способ состоит в том, что фрагмент с концевой карбоксильной группой или его реакционноспособное производное сочетают с соответствующим фрагментом со свободной аминогруппой, при желании отщепляют временно введенные для защиты других функциональных групп защитные группы и полученное в результате соединение при желании переводят в его физиологически приемлемую соль.
Известны необходимые для получения соединений формулы I предварительные и заключительные операции например введение и отщепление защитных групп. Соли соединений формулы I, имеющих солеобразующие группы, получают известным образом, например путем взаимодействия соединения формулы I с основной группой со стехиометрическим количеством подходящей кислоты или путем взаимодействия соединения формулы I с кислой группой со стехиометрическим количеством подходящего основания.
Смесь стереоизомеров, в частности смеси диастереомеров, которые могут образовываться при синтезе соединений формулы I, могут быть разделены известными способами путем фракционной кристаллизации или с помощью хроматографии.
Соединения формулы (I) в соответствии с настоящим изобретением оказывают тормозящее действие на ферменты. В частности, они тормозят действие ретровирусных аспартилпротеаз, например ВИЧ-протеаз. Их ингибирующую активность, проявляющуюся в пределах концентраций от милли до наномолярных, можно определить следующим образом.
Целевой пептид получали ступенчато по Fmoc методу, с использованием этерифицированной Fmoc-llе-ОН n-бензилоксибензиловоспиртовой смолы фирмы Novabiochem (загрузка около 0,5 ммол/г cмолы). Загрузка смолы составляла 1 г. Синтез проводили по программе синтеза, модифицированной для Fmoc-метода.
Использовали следующие производные аминокислоты Fmoc-Glu-OH, Fmoc-Opr-OH, Fmoc-Phe-OObt, Fmoc-Asn-OH и Fmoc-Ser/трет-бут/-OObt. Для синтеза Fmoc-Opr-OH синтезировали Н-Opr-Otbu по методу Vasella и др. (J.C.S. Chem. Comm. 1981, 97-98) и подвергали его затем взаимдействию с Fmoc-Osu в смеси диокcана и воды в соотношении 1:1 в присутствии NaHCO3. При последующем расщеплении трет-бутилового эфира трифторуксусной кислотой образуется Fmoc-Opr-OH.
В патроны реактора загружены по 1 ммоль производного аминокислоты со свободной карбоксильной группой и 0,95 ммоль НOObt. Предварительная активация этих аминокислот осуществлялась непосредственно в патронах путем растворения в 4 мл ДМФ и добавлением 2 мл 0,55-молярного раствора диизопропилкарбодиимида в диметил. HOObt-эфиры других аминокислот растворяли в 6 мл N-метилпиридина и затем так же, как и в случае предварительно активированных in situ аминокислот, осуществляли сочетание с предварительно деблокированной 20% -ным раствором пиперидина в диметилформамиде смолой. После окончания синтеза проводили отщепление пептида (при одновременном удалении защитных групп боковых цепей) путем обработки трифторуксусной кислотой с использованием тиоанизола и этандитиола для связывания катионов. Остаток после отгонки трифторуксусной кислоты многократно настаивали с уксусным эфиром и центрифугировали.
Остаток после центрифугирования подвергали хроматографическому разделению на декстрановом геле с использованием в качестве подвижной фазы 10%-ной уксусной кислоты. Содержащую чистый пептид фракцию упаривали и высушивали с помощью сублимационной сушки. Масс-спектр (FAB):854 (M+H+).
Аминокислотный анализ: Asp: 0,98 Ser: 0,80, Glu: 1,00, Ile: 1,05, Phe: 2,10, NH3: 1,76.
Сокращения, использующиеся для обеспечения аминокислот, соответствуют принятому в химии пептидов трехбуквенного кода (описанному, например, в Еur. J. Biochem. 138, (1984), 9-37). Если это не оговорено, упоминаемые аминокислоты имеют L-конфигурацию.
Другие сокращения:
FAB бомбардировка быстрыми атомами;
М молекулярный пик;
БОК трет-бутоксикарбонил.
П р и м е р 1. N,Nl-бис-/трет-бутоксикарбонил-L-фенилаланил-L-валил/-2S, 5S-диамино-1,6-дифенилгексан-3R, 4R-диол.
100 мг N,Nl-бис-/L-валил/-2S, 5S-диамино-1,6-дифенилгексан-3R, 4R-диол дигидрохлорида, 111 мг N-трет-бутоксикарбонил-L-фенилалани- на, 0,57 мл N-этилморфолина и 60 мг оксибензотриазола растворяли в 1,5 мл диметилформамида. После добавления к раствору 85 мг ЕDAC при 0оС перемешивание продолжали в течение еще 1 ч при 0оС и затем в течение ночи при комнатной температуре. После этого растворитель отгоняли в вакууме, остаток растворяли в ЕЕ и проводили экстракцию насыщенным раствором КНСO3, 10%-ным раствором КНSO4 и водой. Органическую фазу высушивали безводным Na2SO4 и упаривали. Остаток перекристаллизовывали из смеси этанола и воды. Выход составлял 92 мг.
MS/FAB/: 993 (M+H)+, 975, 893, 793
ЯМР (270 мГц, ДМСО<D 6>): 0,72 (д, 6Гц, 6Н), 0,75 (д, 6Гц, 6Н), 1,29 (с, 18Н), 1,86 (м, 2Н), 2,60-2,96 (м, 8Н), 3,30 (м, 2Н), 4,17 (м, 2Н), 4,45 (м, 2Н), 4,68 (м, 2Н), 7,03 (д, 9Гц, 2Н), 7,05-7,30 (м, 22Н), 7,53 (д, 9Гц, 2Н).
П р и м е р 2. N,Nl-бис-/L-валил/-2S, 5S-диамино-1,6-дифенилгексан-3R, 4R-диолдигидрохлорид
220 мг N,Nl-бис-/трет-бутоксикарбонил-L-валил/-2S, 5S-диамино-1,6-дифенил-3,4-0-изопропилиденгексан-3R, 4R-диола растворяли в 10 мл примерно 3 н. раствора HCl в смеси диоксана и метанола в соотношении 1:1 и перемешивали раствор в течение 1 ч при комнатной температуре. Летучие компоненты раствора отгоняли в вакууме и высушивали остаток в глубоком вакууме. Полученный материал использовали без дополнительной очистки на последующей стадии. Выход: 184 мг.
Масс-спектр (FAB): 499 (M+H)+, 481, 463
П р и м е р 2А. N,Nl-бис-/трет-бутоксикарбонил-L-валил/-2S, 5S-диамино-1,6-дифенил-3,4-0-изопропилиденгексан-3R, 4R-диол.
136 мг 2S, 5S-диамино-1,6-дифенил-3,4-0-изопропилиденгексан-3R, 4R-диола, 0,54 мг NEM и 260 мг N-трет-бутоксикарбонил-L-валила растворяли в 2 мл сухого этилацетата. При -10оС к приготовленному раствору добавляли 0,97 мл 50% -ного раствора ангидрида н.пропилфосфоновой кислоты и этилацетата. Смесь перемешивали в течение 1 ч при 0оС и затем в течение ночи при комнатной температуре. После этого раствор разбавляли этилацетатом и последовательно экстрагировали насыщенным раствором NaHCO3, 10%-ным раствором КНSO4 и водой. Органическую фазу высушили над безводным MgSO4, упаривали в остаток, подвергали очистке с помощью хроматографии на силикагеле (подвижная фаза: смесь дихлорметана и метанола в соотношении 97:3). Выход целевого соединения 230 мг.
Масс-спектр (FAB): 739 (M+H)+, 681, 639, 569, 539
П р и м е р 2Б. 2S, 5S-диамино-1,6-дифенил-3,4-о-изопропилиденгексан-3R, 4R-диол.
2,3 г 2S, 5S-диазидо-1,6-дифенил-1,6-0-изопропилиденгексан-3R, 4R-диола растворяли в 50 мл метанола и приготовленный раствор подвергали гидрированию в течение 2 ч при нормальном давлении в присутствии примерно 0,2 г палладия на угле (10%). Катализатор затем отфильтровывали и после упаривания раствора остаток подвергали хроматографическому разделению на силикагеле (подвижная фаза: смесь дихлорметана и метанола в соотношении 99:1). Выход: 1,33 г.
Масс-спектр (FAB): 341 (М+Н)+
ЯМР (270 мГц, ДМСО< D6>): 1,29 (м, 4Н), 1,37 (с, 6Н), 2,71 (двойной д, 12 Гц, 5 Гц, 2Н), 2,870 (м, 2Н), 3,32 (м, 2Н), 3,95 (с, 2Н), 7,12-7,33 (м, 10Н).
П р и м е р 2С. 2S, 5S-диазидо-1,6-дифенил-3,4-0-изопропилиденгексан-3R, 4R-диол
8,5 г 2R, 5R-ди-/4-нитрофенилсульфонилокси/-1,6-дифенил- 3,4-о-изопропилиденгексан-3S, 4S-диола растворяли в 300 мл ДМФ и приготовленный раствор нагревали в течение 4 ч при 50оС примерно 9,2 г NaN3 и 6,3 г 18-крон-6. Большую часть растворителя отгоняли затем в вакууме, остаток растворяли в эфире и проводили экстракцию водным раствором NaHCO3. После промывки водой органическую фазу высушивали и упаривали. Остаток подвергали хроматографическому разделению на силикагеле (подвижная фаза: смесь толуола и н-гептана в соотношении 2:5-2:3). В результате получали 2,37 г целевого соединения.
ЯМР (270 мГц, ДМСО <D6>): 1,48 (c, 6Н), 2,92-3,12 (м, 4Н), 3,74 (двойной д, 10 Гц, 5 Гц, 2Н), 4,15 (с, 2Н), 7,21-7,30 (м, 10Н).
П р и м е р 2D. 2R, 5R-ди/4-нитрофенилсульфонилокси/-1,6-дифенил-3,4-о- изопропилиденгексан-3S, 4S-диол
5,6 г, 2R, 5R-диокси-1,6-дифенил-3,4-о-изопропилиденгексан-3R, 4R-диола, 7,9 г 4-диметиламинопиридина растворяли в 300 мл хлороформа. К приготовленному раствору добавляли при комнатной температуре 14,5 г п-нитробензолсульфонилхлорида и перемешивали смесь в течение 3 ч при 50оС. После этого ее разбавляли метиленхлоридом и экстрагировали последовательно растворами бикарбоната, КНSO4 и NaCl. После высушивания органической фазы ее упаривали. Выход: 11,8 г.
Масс-спетр (FAB): 713 (М+Н)+, 697, 510.
ЯМР (270 мГц, ДМСО <D6>): 1,42 (c, 6H), 2,87 (двойной д, 15 Гц, 9 Гц, 2Н), 3,11 (двойной д, 15 Гц, 3 Гц, 2Н), 4,41 (с, 2Н), 5,07 (дм, 9 Гц, 2Н), 6,95-7,11 (м, 10Н), 7,73 (д, 9Гц, 4Н), 8,18 (д, 9 Гц, 4Н).
П р и м е р 2E. 2R, 5R-дигидрокси-1,6-дифенил-3,4-о-изопропилиден-3R, 4R-диол. 1,12 г 1,2R-5R, 6-диэпокси-3,4-о-изопропилиден-3R-4R-диола добавляли в атмосфере аргона при -78оС к раствору 36 ммоль (С6Р5)CuLi в 60 мл сухого эфира. После этого удаляли охлаждающую баню и при перемешивании нагревали смесь до комнатной температуры. Затем ее смешивали с 250 мл этилацетата и трижды экстрагировали смесью 25%-ного аммиака и хлорида аммония. Фазу этилацетата промывали раствором NaCl, высушивали и упаривали. Остаток подвергали очистке с помощью хроматографии на силикагеле (подвижная фаза: смесь дихлорметана и этилацетата при соотношении от 97:3 до 90:10). В результате получали 1,86 г целевого соединения.
Масс-спектр (FAB): 343 (М+Н)+, 327,285, 267.
ЯМР (270 мГц, ДМСО <D6>): 1,39 (с, 6Н), 2,58 (двойной д, 13 Гц, 9 Гц, 2Н), 3,43 (двойной д, 13 Гц, 3 Гц, 2Н), 3,68 (м, 2Н), 3,83 (м, 2Н), 5,05 (д, 6Гц, 2Н), 7,14-7,32 (м, 10Н)
П р и м е р ы 3-5.
3. N,Nl-бис-/трет-бутоксикарбонил/-2S, 5S-диамино-1,6-дифенилгексан-3R, 4R-диол.
4. N,Nl-бис-/трет-бутоксикарбонил/-2S, 5S-диамино-1,6-дифенилгексан-3R, 4R-диол.
5. N,Nl-бис-/трет-бутоксикарбонил/-2S, 5S-диамино-1,6-дифенилгексан-3R, 4R-диол.
17 г трет-бутоксикарбонил-L-фенилаланинала растворяли в 500 мл сухого тетрагидрофурана и охлаждали раствор до 0оС в атмосфере аргона. Затем к нему добавляли в течение примерно 20 мин 1 л 0,1-молярного раствора SmI2 в тетрагидрофуране и перемешивали смесь в течение 30 мин при комнатной температуре, подкисляли 0,1 н.водным раствором НСl до pH 1-2, разбавляли ЕЕ, отделяли органическую фазу и экстрагировали ее 0,1 и НСl дважды раствором Na2S2O3 и дважды водой. После высушивания над MgSO4, ее упаривали и подвергали хроматографии на силикагеле (подвижная фаза: смесь этилацетата и петролейного эфира в соотношении 1:2).
Фракцию, содержащую 3R, 4R-изомер, перекристаллизовывали из смеси этанола и воды.
Из фракции, содержащей 3S, 4S и 3R,4S-изомеры, 3S,4S изомер можно было получать путем кристаллизации из смеси дихлорметана, изопропилового эфира и гептана. Для получения 3R, 4S-изомера маточный раствор подвергали хроматографическому разделению на силикагеле RP18 (подвижная фаза; смесь ацетонитрила и воды в соотношении 4:6). Выход: 3R, 4R-изомер 1,61 г; 3S, 4S-изомер 1,00 г, 3R, 4S-изомер 0,71 г.
Rf: силикагель, смесь ЕЕ и гексана в соотношении 1:2, 3R, 4R-изомер 0,18: 3S, 4S-изормер 0,41, 3R, 4S-изомер 0,39.
Масс-спектр (FAB): 501 (М+Н)+, 401,345, 327, 301-3R, 4R изомер; 501 (М+Н)+, 401, 345, 327, 301 3S, 4S-изомер; 501 (М+Н)+, 401; 345, 327 3R, 4S-изомер.
1Н-ЯМР (270 мГц, ДМСО <D6>): 3R, 4R-изомер 3S,4S-изомер 3R, 4S-изомер
N-H 6,16 (д, 2Н) 6,60 (д, 2Н) 6,31 (д, 1Н),
6,28 (д, 1Н) O-Н 4,43 (м, 2Н) 4,57 (д, 7Гц, 2Н) 4,62 (д, 4Гц, 1Н)
4,94 (д, 6Гц, 1Н) Н3, Н44,12 (м, 2Н) 3,71 (м, 2Н) 3,91-4,12 (м, 2Н) Н2, Н5 3,24 (м, 2Н) 3,42 (м, 2Н) 3,27-3,46 (м, 2Н) СН2 2,54-2,80 (м, 2Н) 3,04 (дв.д,14Ц) 2,62-2,83 (м, 2Н)
4 Гц, 1Н)
2,63 (дд, 14 Гц,
9 Гц, 1Н) С(СН3)3 1,30 (с,18Н) 1,30 (с, 18Н) 1,32 (с, 9Н)
1,24 (с, 9Н Ar-H 7,08-7,27 (м, 10Н) 7,11-7,29 (м, 10Н) 7,08-7,32 (м, 10Н)
Идентификацию 3R, 3S-изомера осуществляли по двойному набору сигналов, 3R, 4R- и 3S, 3S-изомеры различали путем сравнения с синтетическими образцами, полученных из D-маннита (пример 3.1). Определение констант сочетания после отщепления трет-бутоксикарбонильных групп и перевода изомеров с помощью фосгена в двойную 2-оксазолидиновую систему давало согласующие результаты.
П р и м е р 3.1. Определение стереоконфигурации изомеров в соответствии с примерами 3-5. N,Nl-бис-/трет-бутоксикарбонил/-2S, 5S-диамино-1,6-дифенил-гексан-3R, 4R-диол
140 мл 2S, 5S-диамино-1,8-дифенил-3,4-о-изопропилиденгексан-3R, 4R-диола растворяли в смеси 5 мл 1 н.НСl в метаноле и 5 мл 5 н.НСl в диоксане и перемешивали раствор в течение 4 ч при комнатной температуре. Летучие компоненты отгоняли в вакууме. Остаток высушивали в глубоком вакууме и полученный 2S, 5S-диамино-1,6-дифенилгексан-3R, 4R-диолдигидрохлорид (масс-спектр/FAB): 301 (М+ Н)+ свободного основания) без дополнительной очистки использовали на последующей стадии.
45 мг 2S, 5S-диамино-1,6-дифенилгексан-3R, 4R-диол-дигидрохлорида растворяли в 5 мл сухого дихлорметана и перемешивали в течение 3 ч при комнатной температуре с 40 мкл триэтиламина и 75 мг дитретбутилового эфира пироугольной кислоты. Смесь затем разбавляли дихлорметаном и подвергали ее экстракции растворами КНSO4, NaHCO3 и NaCl. После высушивания над безводным Na2SO4 органическую фазу, упаривали и остаток очищали с помощью хроматографии на силикагеле, используя в качестве подвижной фазы смесь ацетонитрила в DCM в соотношении 1:8. Выход: 23 мг.
Масс-спектр (FAB): 501 (М+Н)+, 401, 345, 327, 301.
Полученное соединение было идентичным наиболее полярному из изомеров в соответствии с примерами 3-5.
П р и м е р 6. N,Nl-бис-/трет-бутоксикарбонил-L-фенилаланил-L-валил/-2S, 5S-диамино-1,6-дифенилгексан-3S, 4S-диол.
38 мг N,Nl-бис-/трет-бутоксикарбонил-L-валил/-2S, 5S-диамино-1,6-дифенилгексан-3S, 4S-диола обрабатывали в течение 30 мин 5 н.НСl в диоксане. Летучие компоненты удаляли в вакууме и остаток высушивали. Полученный таким образом N, Nl-бис-/L-валил/-2S, 5S-диамино-1,6-дифенилгексан-3S, 4S-диолдигидрохлорид вместе с 40 мг трет-бутоксикарбонилфенилаланина, 22 мг гидроксибензотриазола и 51 мг тетрафторбората 2-(1Н-бензотриазолил-1)-1,1,3,3-тетраметилуронил (ТБТУ) растворяли в 1 мл сухого диметилформамида. К раствору добавляли 60 мкл этилдиизопропиламина и перемешивали смесь в течение 15 мин при комнатной температуре. Диметилформамид отгоняли, остаток растворяли в этилацетате и экстрагировали последовательно растворами КНSO4, NaHCO3 и водой. После высушивания над MgSO4, органическую фазу концентрировали, причем при этом осаждался кристаллический осадок, который отфильтровывали, промывали эфиром и получали в результате 30 мг целевого соединения.
Масс-спектр (FAB): 1015 (M+ Na)+, 993 (M+H)+, 893, 793.
ЯМР (270 мГц, ДМСО < D6>): 0,79 (м, 12Н), 1,28 (с, 18Н), 1,85 (м, 2Н), 2,68-2,82 (м, 4Н), 2,85-3,03 (м, 4Н), 3,37 (м, 2Н), 4,00-4,13 (м, 4Н) 4,21 (м, 2Н), 4,66 (д, 7 Гц, 2Н), 7,03 (д, 7Гц, 2Н), 7,05-7,34 (м, 20Н), 7,62 (д, 7Гц, 2Н), 7,68 (д, 8Гц, 2Н).
П р и м е р 7. N,Nl-бис-/трет-бутоксикарбонил-L-фенилаланил-L-валил/-2S, 5S-диамино-1,6-дифенилгексан-3R, 4S-диол.
Целевое соединение синтезировали по способу, аналогичному описанному в примере 6, используя в качестве исходного соединения N,Nl-бис-/трет-бутоксикарбонил-L-валил/-2S, 5S-диамино-1,6-дифенилгексан-3R, 4S-диол.
Масс-спектр (FAB), 105 (М+Na)+, 993 (М+Н)+, 893, 793
ЯМР (270 мГц, ДМСО <D6>): 0,68-0,85 (м, 12Н), 1,28 (с, 9Н), 1,30 (с, 9Н), 1,75-2,03 (м, 2Н), примерно 2,5-3,30 (м, 8Н), примерно 3,3-3,51 (м, 2Н), 4,05-4,30 (м, 5Н), 4,43 (м, 1Н), 4,74 (д, 4 Гц, 1Н), 5,32 (д, 7Гц, 1Н), 6,93-7,35 (м, 22Н), 7,61 (д, 8Гц, 1Н), 7,67 (д, 7 Гц, 1Н), 7,85 (д, 8Гц, 1Н), 7,92 (д, 7 Гц, 1Н).
П р и м е р 8. N,Nl-бис-/трет-бутоксикарбонил-L-валил/-2S, 5S-диамино-1,6-дифенилгексан-3S, 4S-диол.
164 мг, N,Nl-бис-/трет-бутоксикарбонил/-2S, 5S-диамино-1,6-дифенилгексан-3S, 4S-диола обрабатывали в течение 1,5 ч при комнатной температуре 10 мл 5 н. НСl в диоксане. Летучие компоненты затем удаляли в вакууме и остаток высушивали. Полученный таким образом 2S, 5S-диамиро-1,6-дифенилгексан-3S, 4S-диол- дигидрохлорид растворяли вместе с 178 мл трет-бутоксикарбонил-L-валила и 0,56 мл NEM в 15 мл сухого диметилформамида. К полученному раствору добавляли при -5оС 0,53 мл 50%-ного раствора ангидрида н.пропилфосфоновой кислоты в этилацетате, перемешивали смесь в течение 1 ч при 0оС и затем в течение ночи при комнатной температуре, растворитель отгоняли, в ротационном испарителе, остаток растворяли в этилацетате и подвергали экстракции водой, растворами NaHCO3 и КНSO4 и снова водой. После высушивания над безводным Na2SO4 органическую фазу упаривали в вакууме. При обработке остатка диэтиловым эфиром выпадал кристаллический осадок продукта, который перекристаллизовывали из смеси этанола и воды. Выход: 59 мг.
Масс-спектр (FAB): 699 (М+Н)+, 599, 499.
П р и м е р 9. N,Nl-бис-/трет-бутоксикарбонил-L-валил/-2S, 5S-диамино-1,6-дифенилгексан-3R, 4S-диол.
Синтез осуществляли таким же образом, как и в примере 8, используя в качестве исходного соединения N,Nl-бис-/трет-бутоксикарбонил/-2S, 5S-диамино-1,6-дифенилгексан-3R, 4S-диол.
Масс-спектр (FAB): 699 (М+Н)+, 599, 499.
П р и м е р 10. N,Nl-бис-/L-лизил-L-валил/-2S, 5S-диамино-1,6-дифенилгексан-3R, 4R-диол-тетрагидрохлорид.
Синтез осуществляли таким же образом, как и в примере 2, из соединения в соответствии с примером 11.
Масс-спектр (FAB LiI), 761 (М+Li)+, 755 (М+Н)+, 737.
П р и м е р 11.
N, Nl-бис-[Nα-(трет-бутоксикарбонил)-L-лизил-L-валил] 2S, 5S-диамино-1,6-дифенилгексан-3R, 4R-диол-дигидрохлорид.
36 мг N,Nl-бис[(Nω -бензилоксикарбонил-Nα -трет-бутоксикарбонил)-L-лизил-L-валил] 2S, 5S-диамино-1,6-дифенилгексан-3R, 4R-диола, синтезированного таким же образом, как и в случае примера 1, из Nω-бензилоксикарбонил-Nα -трет-бутокси-карбонил-L-лизина и N,Nl-бис-/L-валил/-2S, 5S-диамино-1,56-дифенилгексан-3R, 4R-диол дигидрохлорида/ гидрировали в присутствии палладиевого катализатора на активированном угле в среде метанола. pH растворяли при этом с помощью раствора HCl в метаноле поддерживали равным примерам 3-4. После отфильтровывания катализатора и концентрирования получали 26 мг целевого продукта.
Масс-спектр /FAB, LiI/: 961 (М+Li)+.
ЯМР (270 мГц, ДМСО <D6>): 0,75 (д, 5 Гц, 6Н), 0,78 (д, 5 Гц, 6Н), примерно 1,13-1,60 (м, примерно 12Н), 1,38 (с, 18Н), 1,88 (м, 2Н), примерно 2,50-2,68 (м, 2Н), 2,72-2,94 (м, 6Н), 3,72 (м, 2Н), 4,22 (м, 2Н), 4,37 (м, 2Н), 4,41- 4,55 (м, 4Н), 4,72 (м, 2Н), 6,76 (м, 2Н), 7,05-7,23 (м, 16Н), 7,66 (д, 8 Гц, 2Н), 8,15 (д, 9 Гц, 2Н).
П р и м е р 12. N,Nl-бис-[N α(трет-бутоксикарбонил-L-фенилаланил)-L-лизил]-2S, 5S-диамино-1,6-дифенилгексан-3R, 4R-диол-дигидрохлорид.
Синтез осуществляли таким же образом, как и в примере 11.
Масс-спектр (FAB): 1051 (М+Н)+, 951.
П р и м е р 13. N,Nl-бис-{[2S-(1,1-диметилэтилсульфонилметил)-3-(1- нафтил)-пропионил]-L-валил}-2S, 5S-диамино-1,6-дифенилгексан-3R, 4R-диод.
57 мг N,Nl-бис-/L-валил/-2 S, 5S-диамино-1,6-дифенилгексан-3R, 4R, диол дигидрохлорид, 95 мг 2S-(1,1-диметилэтилсульфонилметил)-3-(1-нафтил)-пропионовой кислоты, 41 мг гидроксибензотриазола, и 96 мг ТБТУ мг растворяли в 1 мл сухого диметилформамида. При комнатной температуре к раствору добавляли 0,11N-этилдиизопопиламина и смесь перемешивали в течение 1 ч. Растворитель затем отгоняли в ротационном испарителе, остаток растворяли в 30 мг этилацетата и подвергали экстракции растворами бисульфата, бикарбоната и водой. После высушивания над Na2SO4 и концентрирования полученный продукт подвергали очистке с помощью хроматографии на силикагеле (подвижная фаза: смесь дихлорметана и метанола в соотношении 97:3). В результате получали 31 мг целевого соединения.
Масс-спектр (FAB), 1153 (М+Na)+, 1131 (М+Н)+, 716.
ЯМР (270 мГц, ДМСО<D 6>): 0,69 (д, 7 Гц, 6Н), 0,76 (д, 7 Гц, 6Н), 1,10 (с, 18Н), 1,86 (м, 2Н), 2,63-2,87 (м, 6Н), 3,08 (м, 2Н), примерно 3,25-3,44 (м, примерно 2Н), 3,52-3,63 (м, 2Н), 4,08 (м, 2Н), 7,32 (д, 8 Гц, 2Н), 7,38-7,48 (м, 4Н), 7,47-7,62 (м, 4Н), 7,81 (м, 2Н), 7,92 (м, 2Н), 8,12-8,25 (м, 4H).
П р и м е р 14. N,Nl-бис-(L-серил-L-фенилаланил-L-валил)-2S, 5S-диамино-1,6-дифенилгексан-3R, 4R-диол дигидрохлорид.
Синтез осуществляют таким же образом, как это описано в примере 16. Масс-спектр (FAB, LiI): 973 (M+Li)+, 967 (M+H)+
П р и м е р 15. N,Nl-бис(третбутоксикарбонил-L-(o-трет-бутилсерил)-L-фенилаланил- L-валил)-2S, 5S-диамино-1,6-дифенил-гексан-3R, 4R-дион.
52 мг N, N-бис-(L-фенилаланил-L-валин)-2S, 5S-диамино-1,6-дифенилгексан-3R, 4R, диол дигидрохлорида. 18 мг гидроксибензотриазола, 15,3 мкл N-этилморфолина и 35 мг o-трет-бутил-N-трет-бутиксикарбонил-L-серила растворяли в 1 мл сухого ДМФ и смешивали полученный раствор при 0оС с 25,3 мг гидрохлорида 1-(3-диметиламинопропил)-3-этилкарбодиимида. Смесь перемешивали в течение 1 ч при 0оС и затем в течение ночи при комнатной температуре. Растворитель затем отгоняли в ротационном испарителе, остаток растворяли в этилацетате и подвергали экстракции растворами бисульфата, бикарбоната и водой. Органическую фазу высушивали над безводным сульфатом натрия и концентрировали. Остаток подвергали очистке с помощью хроматографии на силикагеле. В результате получали 28 мг целевого соединения.
Масс-спектр (FAB): 1311 (M+Na)+, 1279 (M+H)+, 1261, 1179, 1079.
ЯМР (270 мГц, ДМСО <Д6>): 0,78 (д, 7 Гц, 6H), 0,81 (д, 7 Гц, 6Н), 1,06 (с, 18Н), 1,38 (с, 18Н), 1,82 (м, 2Н), 2,61 2,98 (м, 8Н), примерно 3,15 3,45 (м, примерно 6Н), 3,92 (м, 2Н), 4,11 (двойной д, 8 Гц, 6 Гц, 2Н), 4,47 (м, 2Н), 4,63 (м, 4Н), 6,58 (д, 8 Гц, 2Н), 7,04 7,25 (м, 2OH), 7,46 (д, 9 Гц, 2Н), 7,77 (д, 8 Гц, 2Н), 7,83 (д, 8 Гц, 2Н).
П р и м е р 16. N,Nl-бис-(L-фенилаланил-L-валил)-2S, 5S-диамино-1,6-дифенилгексан-3R, 4R-диол дигидрохлорид
100 мг N,Nl-бис-(третбутоксикарбонил-L-фенилаланил-L-валил)-2S, 5S-диамино-1,6-дифенилгексан-3R, 4R-диол (пример 1) обрабатывали в течение 30 мин при комнатной температуре смесью 2 мл 5 н HCl диоксана и 1 мл HCl в метаноле. Летучие компоненты удаляли в вакууме, остаток промывали эфиром и высушивали в глубоком вакууме. Выход: 59 мг.
Масс-спектр (FAB): 793 (M+H)+, 775.
П р и м е р 17. N,N'-бис-(L-фенилаланил-L-валил)-2S, 5S-диамино-1,6-дифенилгексан-3S, 4S-диол дигидрохлорид
Синтез осуществляли с помощью способа, аналогичного описанному в примере 16. Масс-спектр (FAB): 793 (М+Н)+, 775.
П р и м е р 18. N,Nl-бис-/L-фенилаланил-L-валил/-2S, 5S-диамино-1,6-дифенилгексан-3R, 4R-диол дигидрохлорид.
Синтез осуществляли с помощью способа, аналогичного описанному в примере 16.
Масс-спектр (FAB): 793 (М+Н)+, 775.
П р и м е р 19. N,Nl-бис-/L-серил-L-фенилаланил-L-валил/-2S, 5S-диамино-1,6-дифенилгексан-3S, 4S-диол-дигидрохлорид.
Синтез осуществляли по способу, аналогичному описанному в примере 14.
Масс-спектр (FAB): 967 (М+Н)+.
П р и м е р 20. N,Nl-бис-/L-серил-L-фенилаланил-L-валил/-2S, 5S-диамино-1,6-дифенилгексан-3R, 4S-диод дигидрохлорид.
Синтез осуществляли по способу, аналогичному описанному в примере 14.
Масс-спектр (FAB): 967 (М+Н)+.
П р и м е р 21. Бис-[N-(L-фенилаланил-L-валил)-2S-амино-3-фенилпропил] -амин тригидрохлорид.
Синтез осуществляли по способу, аналогичному описанному в примере 16, из соединения в соответствии с примером 22.
Масс-спектр (FAB): 776 (М+Н)+.
П р и м е р 22. Бис-[N-трет-бутоксикарбонил-(L-фенилаланил-L-валил)-2S- амино-3-фенилпропил]-амин.
Синтез осуществляли по способу, аналогичному описанному в примере 6, из соединения в соответствии с примером 23.
Масс-спектр (FAB, LiI): 982 (М+Li)+, 976 (M+H)+.
ЯМР (270 мГц, ДМСО < D6>): 0,81 (м, 12Н), 1,29 (с, 18Н), 1,89 (м, 2Н), примерно 2,45-2,98 (м, примерно 12Н), 3,97 (м, 2Н), 4,05-4,25 (м, 4Н), 7,03 (д, 9 Гц, 2Н), 7,10-7,31 (м, 20Н), 7,65 (д, 8 Гц, 2Н), 7,84 (д, 8 Гц, 2Н).
П р и м е р 23. Бис-[N-(L-валил)2S-амино-3-фенилпропил]-амин тригидрохлорид.
Синтез осуществляли способом, аналогичным описанному в примере 16, из соединения в соответствии с примером 24.
Масс-спектр (FAB): 482 (М+Н)+.
П р и м е р 24. Бис-N-(трибутоксикарбонил-L-валил)-2S-амино-3-фенил-пропилам- ин.
Синтез осуществляли с помощью способа, аналогичного описанному в примере 16 из примера 25.
Масс-спектр (FAB): 682 (М+Н)+.
ЯМР (270 МГц, ДМСО <D6>): 0,73 (д, 6 Гц, 6Н), 0,77 (д. 6 Гц, 6Н), 1,38 (с, 18Н), 1,65 (м, 1Н), 1,82 (м, 2Н), 2,42 примерно 2,53 (м, примерно 4Н), 2,64 (двойной д, 14 Гц, 8 Гц, 2Н), 2,84 (двойной д, 14 Гц, 6 Гц, 2Н), 3,68 (м, 2Н), 3,93 (м, 2Н), 6,50 (д, 9 Гц, 2Н), 7,12-7,28 (м, 10Н), 7,62 (д, 8 Гц, 2Н).
П р и м е р 25. Бис-/N-третбутоксикарбонил-2S-амино-3-фенилпропил/-амин-гид- рохлорид.
9,6 трет-бутоксикарбонил-L-фенилаланинала, 30,5 г NH4OAc и 1,7 г NaBH3CN растворяли в 300 мл метанола и перемешивали раствор в течение 6 ч при комнатной температуре. С помощью концентрированной HCl раствор подкисляли до pH<2. При этом продукт выпадал в осадок, его извлекали с диэтиловым эфиром и водой и высушивали в глубоком вакууме. В результате получали 3,1 г целевого соединения.
Масс-спектр (FAB): 484 (М+Н)+, 428, 372.
ЯМР (270 мГц, ДМСО <D6>): 1,33 (с, 18Н), 2,55-2,90 (м, 8Н), 3,82 (м, 2Н), 6,75 (м, 2Н), 7,12-7,325 (м, 20Н).
П р и м е р 26. N,Nl-бис-/5S-амино-4S-гидрокси-7-метилоктаноил/-2S, 5S-диамино-1,6-дифенилгексан-3S,4S-диолдигидро- хлорид.
Синтез осуществляли по способу, аналогичному описанному в примере 16.
Масс-спектр (FAB): 643 (М+Н)+, 625.
ЯМР (270 мГц, ДМСО <D6>): 0,92 (М, 12Н), 1,43 (м, 4Н), 1,60 (м, 4Н), 1,74 (м, 2Н), 2,15 (м, 2Н), 2,26 (м, 2Н), 2,72 (двойной д, 14 Гц, 11 Гц, 2Н), 2,93 (м, 2Н), 3,12 (дм, 2Н), 3,44 (м, 2Н), 4,03 (м, 2Н), примерно 4,85 (м, примерно 4Н), 7,13-7,38 (м, 20Н), 7,82 (м, 6Н), 8,13 (д, 9 Гц, 2Н).
П р и м е р 26а. N,Nl-бис/N-трет-бутоксикарбонил-5S-амино-7-метил-4S-/ третбутилдиметилсилил/окси-октаноил/-2S, 5S-диамино-1,6-дифенилгексан-3S, 4S-диол.
88,5 г N,Nl-бис-трет-бутоксикарбонил-2S, 5S-диамино-1,6-дифенилгексан-3S, 4S-диола обрабатывали в течение 30 мин при комнатной температуре 2 мл 5 н. HCl в диоксане. Летучие компоненты отгоняли в вакууме, а остаток высушивали в глубоком вакууме. Полученный 2S, 5S-диамино-1,6-дифенилгексан-3S, 5S-диол дигидрохлорид растворяли вместе с 211 мг N-трет-бутоксикарбонил-5S-амино-7-метил-4S-/трет-бутил- диметилсилил/-оксиоктановой кислоты, синтезированной из (5S)-5-(1S)-1-(N-ВОС-амино)-3-метилбутил-дигидрофуран-2-(3H)-она, 72 мг гидроксибензотриазола и 28,5 мкл N-этилморфолина в 5 мл сухого диметилформамида. При 0оС к полученному раствору добавляли 101 мг ЕDAC, раствор перемешивали при этой температуре в течение 1 ч и затем в течение ночи при комнатной температуре. Растворитель затем отгоняли в ротационном испарителе, остаток растворяли в этилацетате и подвергали экстракции раствоpами КНSO4, NaHCO3 и NaCl. После высушивания органическую фазу концентрировали и остаток подвергали очистке с помощью хроматографии на силикагеле (подвижная фаза: смесь дихлорметана и ацетонитрила в соотношении 5:1).
Выход: 129 мг.
Масс-спектр (FAB): 1093 (М+Н)+, 1971 (М+Н)+, 971,871.
ЯМР (270 мГц, ДМСО <D6>): 0,02 (с, 6Н), 0,08 (с, 6Н), 0,77-0,93 (м, 30Н), примерно 1,1-1,4-(м, примерно 6Н), 1,45-1,63 (м, 4Н), 1,91 (м, 2Н), 2,02-2,16 (м, 2Н), 2,67 (двойной д, 11 Гц, 14 Гц, 2Н), 3,36 (м, 2Н), 3,42-3,56 (м, 4Н), 3,95 (м, 2Н), 4,81 (д, 6 Гц, 2Н), 6,44 (м, 8 Гц, 2Н), 7,08-7,30 (м, 10Н), 7,79 (д, 9 Гц, 1Н).
П р и м е р 27. N,Nl-бис-(трет-бутоксикарбонил-L-фенилаланил-L-валил)-3S, 6S-диамино-1,8-ди-(4-пиридил)-октан-4R, 5R-диол.
Синтез осуществляли по способу, аналогичному описанному в примере 6, и используя в качестве исходного соединения 3S, 6S-диамино-1,8-ди-(4-пиридил)-октан-4R, 5R-диол тетрагидрохлорид.
ЯМР (270 мГц, ДМСО <D6>): 0,85 (д, 6 Гц, 12Н), 1,20 (с, 18 н), 1,66 (с, 2Н), 1,78 (м, 2Н), 2,00 (м, 2Н), примерно 2,48 (м, 4Н), 2,74 (м, 2Н), 2,98 (м, 2Н), примерно 3,31 (м, 2Н), 4,08 (м, 2Н), 4,19 (м, 2Н), 4,30 (м, 2Н), 4,68 (м, 2Н), 7,01 (д, 8 Гц, 2Н), 7,10-7,30 (м, 14 Н), 7,62 (д, 8 Гц, 2Н), 7,74 (д, 8 Гц, 2Н), 8,43 (д, 4,8 Гц, 4Н).
Масс-спектр (FAB): 1023 (М+Н)+, 923, 823.
П р и м е р 27а. 3S, 6S-диамино-1,8-ди-/4-пиридил/-октан-4R, 5R-диол тетрагидрохлорид.
Синтез осуществляют аналогичным описанному в примере 2, 2B, 2C и 2E способом, используя в качестве исходных соединений 1,2R-5R,6-диэпокси-3,4-о-изопропилиден-3R,4R-диол и 4-пиколиллитий.
ЯМР (270 мГц, ДМСО <D6>): 1,87-2,20 (м, 4Н), 3,10 (м, 4Н), 3,29 (м, 2Н), 3,34 (д, 6 Гц, 2Н), примерно 3,3-4,5 (широкая, примерно 4Н), 8,07 (д, 7Гц, 4Н), 8,18 (м, 6Н), 8,88 (д, 7 Гц, 4Н).
Масс-спектр (FAB): 331 (М+Н)+.
П р и м е р 28. N,Nl-бис-[2S-(2S-амино-3-фенил-пропил)-амино-3-метилбутаноил]-2S, 5S-диамино-1,6-дифенилгексан-3S, 4S-диол тетрагидрохлорид.
Синтез осуществляли способом, аналогичным описанному в примере 16.
Масс-спектр (FAB): 765 (М+Н)+.
П р и м е р 29. N,Nl-бис[2S-(2S-третбутоксикарбониламино-3-фенил-пропил)-амино-3- метилбутаноил]-2S, 5S-диамнио-1,6-дифенилгексан-3S, 4S-диол.
Во взятом в количестве 50 мг N,Nl-бис-/трет-бутоксикарбонил/-2S, 5S-диамино-1,6-дифенилгексан-3S, 5S-диола отщепляли защитные группы аналогичным описанному в примере 8 способом. Образующийся в результате 2S, 5S-диамино-1,6-дифенилгексан-3S, 5S-диол дигидрохлорид вместе с 70 мл 2S-/2S-трет-бутоксикарбониламино-3-фенилпропил/-амино-3-метилбутановой кислоты, синтезированной путем восстановительного сочетания трет-бутоксикарбонил-L-фенилаланинала и гидрохлорида L-валинметилового эфира с NaBH3CN и последующего обычного расщепления метилового эфира, 41 мг гидроксибензотриазола и 12,6 мкг NEM растворяли в 5 мл сухого диметилформамида. При 0оС к полученному раствору добавляли 57 мг ЕDAC и перемешивали смесь в течение 1 ч при 0оС и затем в течение ночи при комнатной температуре. После этого диметилформамид отгоняли в вакууме, остаток растворяли в дихлоpметане и промывали растворами КНSO4, NaHCO3 и NaCl. После высушивания органической фазы и концентрирования остаток растирали с диэтиловым эфиром.
Выход: 33 мг.
Масс-спектр (FAB): 965 (М+Н)+, 865, 765.
ЯМР (270 мГц, ДМСО <D6>): 0,74 (д, 7 Гц, 6Н), 0,78 (д, 6 Гц, 6Н), 1,33 (с, 18Н), 1,63 (м, 2Н), 1,94-2,16 (м, 4Н), примерно 2,5 (м, примерно 4Н), 2,64 (м, 2Н), 2,81 (двойной д, 14 Гц, 5 Гц, 2Н), 3,13 (дв, м, 14 Гц, 2Н), 3,42 (м, 2Н), 3,56 (м, 2Н), 4,10 (м, 2Н), 4,90 (м, 2Н), 6,59 (д, 9Гц, 2Н), 7,05-7,30 (м, 20Н), 7,85 (д, 8 Гц, 2Н).
П р и м е р 30. N,Nl-бис-/L-фенилаланил-L-валил/-2R-5R-диамино-1,6- дифенилгексан-3R, 4R-диол-дигидрохлорид.
Синтез осуществляли способом, аналогичным описанному в примере 16.
Масс-спектр (FAB): 793 (М+Н)+.
П р и м е р 31. N,Nl-бис-/L-фенилаланил-L-валил/-2R, 5R-диамино-1,6-дифенилгексан-3S, 4S-диол дигидрохлорид.
Синтез осуществляли способом, аналогичным описанному в примере 16.
Масс-спектр (FAB): 793 (М+Н)+.
П р и м е р 32. N,Nl-бис-/L-фенилаланил-L-валил/-2R, 5R-диамино-1,6-дифенилгексан-3R, 4S-диол дигидрохлорид.
Синтез осуществляли аналогичным описанному в примере 16 способом.
Масс-спектр (FAB): 793 (М+Н)+.
П р и м е р 33. N,Nl-бис-/трет-бутоксикарбонил-L-фенилаланил-L-валил/-2R, 5R-диамино-1,6-дифенилгексан-3R, 4R-диол.
Масс-спектр (FAB): 993 (М+Н)+, 893, 793.
ЯМР (270 мГц, ДМСО <D6>): 0,48 (д, 7 Гц, 6Н), 0,54 (д, 6 Гц, 6Н), 1,51 (с, 18Н), 1,70 (м, 2Н), 2,60 (т, 13 Гц, 2Н), 2,74 (двойной д, 14 Гц, 11 Гц, 2Н), 2,96 (двойной д, 13 Гц, 4 Гц, 2Н), 3,13 (двойной м, 14 Гц, 2Н), 3,39 (м, 2Н), 4,02- 4,25 (м, 6H), 4,88 (д, 4 Гц, 2H), 7,02 (д, 9 Гц, 2Н), 7,07-7,33 (м, 20Н), 7,60 (д, 9 Гц, 2Н), 8,24 (д, 9 Гц, 2Н).
П р и м е р 34. N,Nl-бис-/трет-бутоксикарбонил-L-фенилаланил-L-валил/-2R, 5R-диамино-2,6-дифенилгексан-3S, 4S-диол.
Синтез осуществляли аналогичным описанному в примере 6 способом.
Масс-спектр (FAB): 993 (M+Н)+, 893, 793.
П р и м е р 35. N,Nl-бис-/трет-бутоксикарбонил-L-фенилаланил-L-валил/-2R, 5R-диамино-1,6-дифенилгексан-3R, 4S-диол.
Синтез осуществляли аналогичным описанному в примере 6 способом.
Масс-спектр (FAB): 993 (М+Н)+, 893, 793.
П р и м е р ы 36-38. 36. N,Nl-бис-/трет-бутоксикарбонил/-2R, 5R-диамино-1,6-дифенилгексан-3R, 4R-диол.
37. N,Nl-бис-/трет-бутоксикарбонил/-2R, 5R-диамино-1,6-дифенилгексан-3S, 4S-диол.
38. N,Nl-бис-/трет-бутоксикарбонил/-2R, 5R-диамино-1,6-дифенилгексан-3R, 4S-диол.
Синтез осуществляли аналогичным описанному в примерах 3-5 способом, используя в качестве исходного соединения трет-бутоксикарбонил-D-фенилаланинал. Масс-спектры и характеристики ЯМР соответствуют аналогичным характеристикам их энантиомеров в соответствии с примерами 3-5.
П р и м е р 39. N,Nl-бис-/L-/1-нафтил/аланил-L-валил/-2S, 5S-диамино-1,6-дифенилгексан-3R, 4R-диол дигидрохлорид.
Синтез осуществляли аналогичным описанному в примере 16 способом.
Масс-спектр (FAB, LiI): 899 (М+Li)+, 893 (М+Н)+, 875.
П р и м е р 40. N,Nl-бис-/трет-бутоксикарбонил-L-/1-нафтил/аланил -L-валил/2S, 5S-диамино-1,6-дифенилгексан-3R, 4R-диол.
Синтез осуществляли аналогичным описанному в примере 6 способом.
Масс-спектр (FAB): 1093 (М+Н)+, 993.
ЯМР (270 мГц, ДМСО < D6>): 0,76 (м, 12Н), 1,23 (с, 18Н), 1,89 (м, 2Н), 2,60-2,87 (м, 4Н), 3,12 (двойной д, 14 Гц, 10 Гц, 2Н), примерно 3,33 (м, 2Н), 3,52 (двойной м, 4 Гц, 2Н), 4,16-4,35 (м, 4ГН), 4,44 (м, 2Н), 4,70 (с, 2Н), 7,00-7,27 (м, 12Н), 7,37-7,44 (м, 4Н), 7,46-7,68 (м, 8Н), 7,79 (м, 2Н), 7,92 (д, 8 Гц, 2Н), 8,13 (д, 8 Гц, 2Н).
П р и м е р 41. N,Nl-бис{[2-(2-оксиэтилсульфонилметил)-3-фенилпропионил] -L- валил}-2S, 5S-диамино-1,6-дифенилгексан-3S, 4S-диол.
Синтез осуществляли аналогичным описанному в примере 13 способом.
Масс-спектр (FAB): 1007 (М+Н)+.
П р и м е р 42. N,Nl-бис-/L-фенилаланил-L-валил/-2S, 5S-диамино-1,6-дициклогексилгексан-3R, 4R-диол-дигидрохлорид.
Синтез осуществляли аналогичным описанному в примере 16 способом.
Масс-спектр (FAB): 805 (М+Н)+, 787.
П р и м е р 43. N,Nl-бис-/L-фенилаланил-L-валил/-2S, 5S-диамино-1,6-дициклогексилгексан-3S, 4S-диол-дигидрохлорид.
Синтез осуществляли аналогичным описанному в примере 16 способом.
Масс-спектр (FAB): (М+Н)+, 787.
П р и м е р 44. N,Nl-бис-/трет-бутоксикарбонил-L-фенилаланил-L-валил/-2S, 5S- диамино-1,6-дициклогексилгексан-3R- 4R-диол.
Синтез осуществляли аналогичным описанному в примере 6 способом.
Масс-спектр (FAB): 1005 (М+Н)+, 987, 905, 805.
П р и м е р 45. N,Nl-бис-/трет-бутоксикарбонил-L-фенилаланил-L-валил/-2S, 5S-диамино-1,6-дициклогексилгексан-3S, 4S-диол.
Синтез осуществляли аналогичным описанному в примере 6 способом.
Масс-спектр (FAB): 1005 (М+Н)+, 987, 905, 805.
ЯМР (270 мГц, ДМСО <D6>): 0,86 (м, 12Н), 0,99-1,67 (м, примерно 24Н), 1,28 (с, 18Н), 1,74 (м, 2Н), 1,98 (м, 2Н), 2,75 (двойной д, 14 Гц, 11 Гц, 2Н), 2,96 (двойной д, 14 Гц, 4 Гц; 2Н), 3,23 (м, 2Н), 3,89 (м, 2Н), 4,13-4,25 (м, 2Н), 4,42 (д, 5 Гц, 2Н), 7,02 (д, 8 Гц, 2Н), 7,13-7,32 (м, 10Н), 7,6-7,81 (м, 4Н).
П р и м е р 46. N,Nl-бис-/трет-бутоксикарбонил/-2S, 5S-диамино-1,6-дициклогексилгексан-3S, 4S-диол.
200 мг N,Nl-бис-/трет-бутоксикарбонил/-2S, 5S-диамино-1,6-дифенилгексан-3S, 4S-диола растворяли в 25 мл ледяной уксусной кислоты и осуществляли гидрирование в течение 18 ч при 60оС и 120 бар в присутствии 100 мг диоксида платины в качестве катализатора. Катализатор затем отфильтровывали, растворитель отгоняли в вакууме и остаток перекристаллизовывали из смеси этанола и воды.
Выход: 150 мг.
Масс-спектр (FAB): 535 (М+Na)+, 513 (М+Н)+, 413.
ЯМР (270 МГц, ДМСО <D6>): 0,75 (м, 2Н), 0,94 (м, 2Н), 1,03-1,32 (м, 10Н), 1,38 (с, 18Н), 1,44 (м, 2Н), 1,50-1,73 (м, 8Н), 1,80 (м, 2Н), 3,22 (м, 2Н), 3,53 (м, 2Н), 4,28 (д, 6 Гц, 2Н), 6,48 (д, 9 Гц, 2Н).
П р и м е р 47. N,Nl-бис-/трет-бутоксикарбонил/-2S, 5S-диамино-1,6-дициклогексилксан-3R, 4R-диол.
Синтез осуществляли аналогичным описанному в примере 46 способом.
Масс-спектр (FAB): 513 (М+Н)+, 413.
ЯМР (270 мГц, ДМСО<D6>): 0,65-0,96 (м, 4Н), 1,03-1,28 (м, 10Н), 1,30-1,45 (м, 20Н), 1,54-1,70 (м, 8Н), 1,82 (м, 2Н), 3,11 (м, 2Н), 3,89 (м, 2Н), 4,22 (м, 2Н), 5,88 (д, 9 Гц, 2Н).
П р и м е р 48. N,Nl-бис-/трет-бутоксикарбонил/-2S, 5S-диамино-1,6-дициклогексилгексан-3R, 4S-диол.
Синтез осуществляли аналогичным описанному в примере 46 способом.
Масс-спектр (FAB): 513 (М+Н)+, 413.
П р и м е р 49. N,Nl-бис-/4Z-аминоциклогексанкарбонил/-L-фенилаланил-L-валил- 2S, 5S-диамино-1,6-дифенил-3S, 5S-диол дигидрохлорид.
Синтез осуществляли аналогичным описанному в примере 16, соответственно 6, способом.
Масс-спектр (FAB): 1043 (М+Н)+, 1025.
П р и м е р 50. N,Nl-бис/4Z-N-трет-бутоксикарбониламино/-циклогексанкарбонил-L- фенилаланил-L-валил-2S, 5S-диамино-1,6-дифенил-3S, 5S-диол дигидрохлорид.
Синтез осуществляли аналогичным описанному в примере 6 способом.
Масс-спектр (FAB): 1243 (М+Н)+, 1143, 1043.
П р и м е р 51. N,Nl-бис-{[2S-(1,1-диметилэтилсульфонилметил)-3-(1- нафтил)-пропионил]-L-валил/}-2S,5S-диамино-1,6-дифенилгексан-3S, 4S-диол.
Синтез осуществляли аналогичным описанному в примере 13 способом.
Масс-спектр (FAB): 1131 (М+Н)+, 716.
ЯМР (270 мГц, ДМСО <D6>): 0,77 (д, Гц, 6Н), 0,80 (д, 7 Гц, 6Н), 1,12 (с, 18Н), 1,87 (м, 2Н), 2,75 (м, 2Н), 2,83 (мм, 2Н), 2,92-3,03 (м, 2Н), 3,10-3,22 (м, 2Н), примерно 3,27-3,49 (м, 6H), 3,54-3,67 (м, 2H), 4,02-4,15 (м, 4Н), 4,66 (д, 6 Гц, 2Н), 7,01-7,09 (м, 2Н), 7,10-7,25 (м, 8Н), 7,28-7,43 (м, 4Н), 7,48-7,68 (м, 6Н), 7,79 (д, 8 Гц, 2Н), 7,88-7,95 (м, 2Н), 8,15-8,25 (м, 4Н).
П р и м е р 52. N,Nl-бис-{[2S-(1,1-диметилэтилсульфонилметил)-3-фенил- пропионил]-L-валил}-2S, 5S-диамино-1,6-дифенилгексан-3R, 4R-диол.
Синтез осуществляли аналогичным описанному в примере 13 способом.
Масс-спектр (FAB)L 1053 (М+Na)+, 1031, (М+Н)+.
ЯМР (270 мГц, ДМСО<D6>): 0,72 (д, 7 Гц, 6Н), 0,78 (д, 7 Гц, 6Н), 1,14 (с, 18Н), 1,85 (м, 2Н), 2,62-2,94 (м, 8Н), примерно 3,20- 3,35 (м, примерно 4Н), 3,53 (двойной д, 10 Гц, 14 Гц, 2Н), 4,02-4,13 (м, 2Н), 4,50 (м, 2Н), 4,64 (м, 2Н), 7,01-7,10 (м, 2Н), 7,12-7,39 (м, 22Н), 8,05 (д, 8 Гц, 2Н).
П р и м е р 53. N,Nl-бис-{[3-(1,1-диметилэтилсульфонил)-пропил]-L-валил} -2S, 5S-диамино-1,6-дифенилгексан-3R, 4R-диол.
Синтез осуществляли аналогичным описанному в примере 13 способом.
Масс-спектр (FAB): 873 (М+Na)+, 851 (М+Н)+.
ЯМР (270 мГц, ДМСО<D6>): 0,69 (д, 6 Гц, 6Н), 0,73 (д, 6 Гц, 6Н), 1,33 (с, 18 Н), 1,84 (м, 2Н), 2,54-2,59 (м, 6Н), 2,67 (м, 2Н), примерно 3,15-3,30 (м, 6Н), 4,05 (двойной д, 7 Гц, 9 Гц, 2Н), 4,47 (м, 2Н), 4,63 (м, 2Н), 7,06-7,21 (м, 10Н), 7,30 (д, 9 Гц, 2Н), 7,94 (д, 8 Гц, 2Н).
П р и м е р 54. N,Nl-бис-{[2R-(1,1-диметилэтилсульфонилметил)-3- (2-тионил)-пропионил]-L-валил}-2S,5S-диами- но-1,6-дифенилгексан-3R, 4R-диол.
Синтез осуществляли аналогичным описанному в примере 13 способом.
Масс-спектр (FAB): 1065 (М+Na)+, 1049 (М+Li)+.
ЯМР (270 мГц, ДМСО<D6>): 0,51 (д, 7 Гц, 6Н), 0,56 (д, 7 Гц, 6Н), 1,28 (с, 18Н), 1,85 (м, 2Н), 2,95-3,19 (м, 8Н), 3,30-3,60 (м, 8Н), 3,95 (двойной д, 8 Гц, 5,2 Гц, 2Н) 4,06 (м, 2Н), 4,62 (д, 7 Гц, 2Н), 6,93 (д, 3,2 Гц, 4Н), 7,08-7,25 (м, 10Н), 7,34 (м, 2Н), 7,43 (д, 8,4 Гц, 2Н), 8,14 (д, 8 Гц, Н2Н).
П р и м е р 55. N,Nl-бис-/L-фенилаланил-L-валил/-4S, 7S-диамино-2,9-диметил-декан-5,6-диол дигидрохлорид.
Синтез осуществляли аналогичным описанному в примере 56 способом.
Масс-спектр (FAB): 725 (М+Н)+.
П р и м е р 56. N,Nl-бис-/третбутоксикарбонил-L-фенилаланил-L-валил/-4S, 7S-диамино-2,9-диметилдекан-5,6-диол дигидрохлорид.
Синтез осуществляли аналогичным описанному в примере 6, соответственно примерах 3-5 способу.
Масс-спектр (FAB): 925 (М+Н)+, 826, 725.
ЯМР (270 мГц, ДМСО <D6>): 0,75-0,95 (м, 24Н), 1,29 (с, 18Н), 1,35-1,45 (м, 4Н), 1,56 (м, 2Н), 1,99 (м, 2Н), 2,74 (двойной д, 10 Гц, 13 Гц, 2Н), 2,95 (двойной д, 4 Гц, 13 Гц, 2Н), 3,23 (м, 2Н), 3,88 (м, 2Н), 4,13-4,28 (м, 4Н), 4,45 (д, 5 Гц, 2Н), 7,02 (8Д, 8 Гц, 2Н), 7,13-7,33 (м, 10Н), 7,76 (д, 8 Гц, 2Н), 7,80 (д, 8 Гц, 2Н).
П р и м е р 57. N,Nl-бис-{[2S-(1,1-диметилэтилсульфонилметил)-3-фенил- пропионил]-L-валил}-4S,7S-диамино-2,9-диметил-декан-3,4-диол.
Синтез осуществляли аналогичным описанному в примере 13, соответственно примерах 3-5 способом.
Масс-спектр (FAB): 985 (М+Na)+, 963 (М+Н)+.
ЯМР (270 мГц, ДМСО <D6>): 0,78 (д, 7 Гц, 6Н), 0,80-0,93 (м, 18Н, 1,15 (с, 18Н), 1,20-1,68 (м, 6Н), 1,98 (м, 2Н), 2,58 (двойной д, 10 Гц, 14 Гц, 2Н), 2,73 (двойной д, 14 Гц, 3 Гц, 2Н), 2,98 (двойной д, 14 Гц, 4 Гц, 2Н), 3,23 (м, 2Н), примерно 3,33 (м, 2Н), 3,47-3,61 (м, 2Н), 3,85 (м, 2Н), 4,14 (м, 2Н), 4,44 (д, 5 Гц, 2Н), 7,15-7,33 (м, 10Н), 7,69 (м, 9 Гц, 2Н), 8,22 (д: 9 Гц, 2Н).
П р и м е р 58. N,Nl-бис-[/2-пиридил/-ацетил-L-валил]-2S, 5S-диамино-1,6-дифенилгексан-3R, 4R-диол.
74 мг 2S, 5S-диамино-1,6-дифенилгексан-3R, 4R-диол дигидрохлорида и 68 мг гидрохлорида 2-пиридилуксусной кислоты растворяли в 2 мл диметилформамида и затем смешивали приготовленный раствор с 53 мг гидроксибензотриазола, 125 мг ТВТИ с 0,221 мл диизопропилэтиламина. Смесь перемешивали в течение 2 ч при комнатной температуре и затем перерабатывали обычным образом. После хроматографии на силикагеле (подвижная фаза: смесь DCM и МеОН в соотношении 95: 5-90:10) получали 68 мг целевого соединения.
Масс-спектр (FAB): 759 (M+Na)+, 737 (М+Н).
ЯМР (270 МГц, ДМСО <D6>): 0,70 (2д, 12Н), 1,88 (м, 2Н), 2,62 (двойной д, 14 Гц, 5 Гц, 2Н), 2,77 (двойной д, 14 Гц, 10 Гц, 2Н), 3,72 (м, 4Н), 4,13 (двойной д, 6 Гц, 9 Гц, 2Н), 4,46 (м, 2Н), 7,05-7,23 (м, 10Н), 7,28-7,40 (м, 4Н), 7,48 (д, 9 Гц, 2Н), 7,82 (двойной т, 8 Гц, 2 Гц, 2Н), 7,97 (д, 9 Гц, 2Н), 8,54 (м, 2Н).
П р и м е р 59. N,Nl-бис-[/4-пиридилтио/ацетил-L-валил]-2S, 5S-диамино-1,6-дифенилгексан-3R, 4R-диол.
74 мг 2S, 5S-диамино-1,6-дифенилгексан-3R, 4R-дигидрохлорида и 66 мл 4-пиридилмеркаптоуксусной кислоты растворяли в 2 мл диметилформамида и смешивали приготовленный раствор с 53 мг ОН-бензотриазола, 125 ТВТИ 0,177 мл диизопропиламина. Смесь перемешивали в течение 2 часов при комнатной температуре, отгоняли растворитель в вакууме и смешивали остаток в течение 30 мин с эталацетатом и раствором NaHCO3. Нерастворившуюся часть отфильтровывали и промывали этилацетатом и водой. Сырой продукт растворяли в теплом диметилформамиде, раствор фильтровали и смешивали с этилацетатом. Осадок отсасывали и высушивали.
Выход: 76 мг.
Масс-спектр (FAB): 801 (М+Н)+.
ЯМР (270 мГц, ДМСО <D6>): 0,68 (2д, 12Н), 1,84 (м, 2Н), 2,62 (двойной д, 14 Гц, 5 Гц, 2Н), 2,78 (двойной д, 14 Гц, 9 Гц, 2Н), 3,28 (м, 2Н), 3,73 (д, 15 Гц, 2Н), 3,90 (д, 15 Гц, 2Н), 4,17 (двойной д, 6 Гц, 9 Гц, 2Н), 4,43 (м, 2Н), 4,70 (м, 2Н), 7,05-7,20 (м, 10Н), 7,30 (м, 4Н), 7,58 (д, 9 Гц, 2Н), 8,03 (д, 9Гц, 2Н), 8,03 (д, 9Гц, 2Н), 8,34 (м, 4Н).
П р и м е р 60. N,Nl-бис-/L-фенилаланил-D-валил]-2S, 5S-диамино-1,6-дифенилгексан-3S, 4S-диол-дигидрохлорид.
Синтез осуществляли аналогичным описанному в примере 18 способом.
Масс-спектр (FAB): 793 (М+Н)+.
П р и м е р 61. N,Nl-бис-[D-фенилаланил-L-валил]-2S, 5S-диамино-1,6-дифенилгексан-3S, 4S-диол дигидрохлорид.
Синтез осуществляли аналогичным описанному в примере 16 способом.
Масс-спектр (FAB): 793 (М+Н)+.
П р и м е р 62. N,Nl-бис-(трет-бутоксикарбонил-L-фенилаланил-D-валил) 2S, 5S-диамино-1,6-дифенилгексан-3S, 4S-диол.
Синтез осуществляли аналогичным описанному в примере 6 способом.
Масс-спектр (FAB): 993 (М+Н)+, 893, 793.
ЯМР (270 мГц, ДМСО <D6>): 0,42 (д, 7 Гц, 6Н), 0,47 (д, 7 Гц, 6Н), 1,26 (с, 18 Н), 2,58 (м, 2Н), 2,73 (м, 2Н), 2,98 (двойной д, 13 Гц, 5 Гц, 2Н), 3,16 (м, 2Н), 3,40 (м, 2Н), 4,00-4,32 (м, 6Н), 4,85 (д, 5 Гц, 2Н), 6,86 (д, 9Гц, 2Н), 7,07-7,30 (м, 20Н), 7,74 (д, 9 Гц, 2Н), 8,19 (д, 9 Гц, 2Н).
П р и м е р 63. N,Nl-бис-(трет-бутоксикарбонил-D-фенилаланил-L-валил)-2S, 5S-диамино-1,6-дифенилгексан-3S, 4S-диол.
Синтез осуществляли аналогичным описанному в примере 6 способом.
Масс-спектр (FAB): 105 (М+Na)+, 893, 793.
ЯМР (270 мГц, ДМСО <D6>): 0,72 (д, 7Гц, 12 Гц), 1,30 (с, 18Н), 1,84 (с, 2Н), 2,65-2,82 (м, 4Н), 2,88-3,02 (м, 4Н), 3,37 (м, 2Н), 4,00-4,13 (м, 4Н), 4,28 (м, 2Н), 4,63 (д, 7 Гц, 2Н), 6,96 (д, 8Гц, 2Н), 7,05-7,35 (м, 20Н), 7,59 (д, 8 Гц, 2Н), 7,82 (д, 9 Гц, 2Н).
П р и м е р 64. N,Nl-бис-(L-фенилаланилглицил)-2S, 5S-диамино-1,6-дифенилгексан-3S, 4S-диол дигидрохлорид.
Синтез осуществляли аналогичным описанному в примере 16 способом.
Масс-спектр (FAB): 709 (М+Н)+.
П р и м е р 65. N,Nl-бис-(L-фенилаланил-L-изолейцил)-2S, 5S-диамино-1,6-дифенилгексан-3S, 4S-диол дигидрохлорид.
Синтез осуществляли аналогичным описанному в примере 16 способом.
Масс-спектр (FAB): 821 (М+Н)+.
П р и м е р 66. N,Nl-бис-(L-лейцилглицил)-2S, 5S-диамино-1,6-дифенил-гексан-3S, 4S-диол дигидрохлорид.
Синтез осуществляли аналогичным описанному в примере 20 способом.
Масс-спектр (FAB): 641 (М+Н)+.
П р и м е р 67. N,Nl-бис-(трет-бутоксикарбонил-L-фенилаланилглицин)-2S, 5S-диамино-1,6-дифенилгексан-3S, 4S-диол.
Синтез осуществляли аналогичным описанному в примере 6 способом.
Масс-спектр (FAB): 931 (М+Na)+, 909 (М+Н)+, 809, 709.
ЯМР (270 мГц, ДМСО <D6>): 1,48 (с, 18Н), 2,58-2078 (м, 4Н), 2,92-3,09 (м, 4Н), 3,43-3,62 (м, 4Н), 3,78 (двойной д, 16 Гц, 5 Гц, 2Н), 4,05 (м, 2Н), 4,19 (м, 2Н), 4,83 (д, 5Гц, 2Н), 6,92 (д, 9Гц, 2Н), 7,10-7,29 (м, 10Н), 7,90 (д, 9 Гц, 2Н), 8,01 (м, 2Н).
П р и м е р 68. N,Nl-бис-(трет-бутоксикарбонил-L-фенилаланил-L-изолейцил)-2S, 5S-диамино-1,6-дифенилгексан-3S, 4S-диол.
Синтез осуществляли аналогичным описанному в примере 6 способом.
Масс-спектр (FAB): 1021 (М+Н)+, 921, 821.
ЯМР (170 мГц, ДМСО <D6>): 0,70-0,85 (м, 12Н), 1,03 (м, 2Н), 1,29 (с, 18Н), 1,37 (м, 2Н), 1,65 (м, 2Н), 2,68-2,80 (м, 4Н), 2,84-3,04 (м, 4Н), 3,39 (м, 2Н), 4,00-4,13 (м, 4Н), 4,20 (м, 2Н), 4,64 (д, 7 Гц, 2Н), 7,02 (д, 9Гц, 2Н), 7,05-7,33 (м, 20Н), 7,62-7,73 (м, 4Н).
П р и м е р 69. N,Nl-бис-(трет-бутоксикарбонил-L-лейцилглицил)-2S, 5S-диамино-1,6-дифенилгексан-3S, 4S-диол.
Синтез осуществляли аналогичным описанному в примере 6 способом.
Масс-спектр (FAB): 863 (М+Na)+, 841 (M+H)+, 741, 641.
ЯМР (270 мГц, ДМСО <D6>): 0,83 (д, 6Гц, 6Н), 0,87 (д, 6 Гц, 6Н), 1,38 (с, 18Н), примерно 1,42 (м, 4Н), 1,60 (м, 2Н), 2,62 (двойной д, 14Гц, 10Гц, 2Н), 3,03 (двойной м, 14 Гц, 2Н), 3,44 (м, 2Н), 3,52 (двойной д, 16 Гц, 5 Гц, 2Н), 3,72 (двойной д, 16 Гц, 5 Гц, 2Н), 3,90-4,08 (м, 4Н), 4,79 (Д, 5 Гц, 2Н), 6,93 (д, 9 Гц, 2Н), 7,10-7,28 (м, 10Н), 7,78-7,90 (м, 4Н).
П р и м е р N,Nl-бис-(L-фенилаланил-L-серил)-2S, 5S-диамино-1,6-дифенилгексан-3S, 4S-диол дигидрохлорид.
Синтез осуществляли аналогичным описанному в примере 16 способом.
Масс-спектр (FAB): 769 (М+Н)+.
П р и м е р 71. N,Nl-бис-(5S-амино-4S-окси-7-метил-2R-пропилоктаноил)-2S, 5S-диамино-1,6-дифенилгексан-3S, 4S-диол дигидрохлорид.
56 мг дигидрохлорида 2S, 5S-диамино-1,6-дифенилгексан-3S, 4S-диола и 134 мг N-третбутоксикарбонил-5S-амино-7-метил- 2R-пропил-4S- /трет-бутилдиметилсилилокси/-октановой кислоты растворяли в 3 мл диметилформамида и приготовленный раствор смешивали с 43 мг НОВЕ, 101мг ТВТИ и 155 мг диизопропилэтиламина. Смесь перемешивали в течение 4 ч при комнатной температуре, удаляли растворитель в вакууме и помещали остаток в дихлорметан и воду. Органическую фазу подвергали экстракции растворами КНSO4, NaHCO3 и водой. После высушивания над безводным сульфатом натрия органическую фазу концентрировали и остаток подвергали хроматографии на силикагеле (подвижная фаза: смесь циклогексана и этилацетата в соотношении 3:1). В результате получали 157 мг N, Nl-бис-[N-трет-бутоксикарбонил-5S- амино-7-метил-2R- пропил-4S-/трет-бутилдиметилсилилокси/октаноил]-2S, 5S-диамино-1,6-дифенилгексан-3S, 4S-диол дигидрохлорида. Обработкой его НCl в диоксане таким же образом, как это описано в примере 16, получали целевое соединение.
N-трет-бутоксикарбонил-5S-амино-7- метил-2R-пропил-4S-/ трет-бутилдиметилсилилокси/-октановую кислоту, второй компонент реакции сочетания получали аналогичным описанному в примере 27 способом.
Для этой цели исходное соединение /5S/-5-[/1S/-1/N-Вос-амино/-3-метилбут-ил] дигидрофуран-2/3Н/-он дополнительно алкилировали аллилбромидом и затем гидрировали (таким же образом, как при получении соединения II, описанного Fr ау и др.).
Масс-спектр (FAB): 727 (M+H)+.
ЯМР (270 мГц, ДМСО <D6>): 0,80-0,88 (м, 18 Н), 1,08-1,74 (м, 18Н), примерно 2,55 (м, 2Н), 2,72-2,88 (м, 4Н), 3,02-3,18 (м, 4Н), 3,48 (д, 7 Гц, 2Н), 3,99 (м, 2Н), 7,10-7,19 (м, 2Н), 7,20-7,32 (м, 10Н), 7,74 (м, 6Н), 8,16 (д, 9 Гц, 2Н).
П р и м е р 72. N,Nl-бис-(L-фенилаланил-L-циклогексилглицин)-2S, 5S-диамино-1,6-дифенилгексан-3R, 4R-диол дигидрохлорид.
Синтез осуществляли аналогичным описанному в примере 16 способом.
Масс-спектр (FAB): 873 (М+Н)+.
П р и м е р 73. N,Nl-бис-(трет-бутоксикарбонил-L-фенилаланил-L-циклогексилглицил)- 2S, 5S-диамино-1,6-дифенилгексан-3R, 4R-диол.
Синтез осуществляли аналогичным описанному в примере 6 способом.
Масс-спектр (FAB): 1073 (М+Н)+, 973, 873.
ЯМР (270 мГц, ДМСО <D6>): 0,82-1,66 (м, примерно 22Н), 1,29 (с, 18Н), 2,56-2,97 (м, 8Г), примерно 3,30 (м, 2Н), 4,08-4,22 (м, 4Н), 4,50 (м, 2Н), 4,63 (м, 2Н), 7,02 (д, 9 Гц, 2Н), 7,04-7,32 (М, 20Н), 7,47 (д, 9 Гц, 2Н), 7,56 (д, 9 Гц, 2Н).
П р и м е р 74. N,Nl-бис-(L-метионил-L-валил)-2S, 5S-диамино-1,6-дифенилгексан-3S, 4S-диол дигидрохлорид.
Синтез осуществляли аналогичным описанному в примере 16 способом.
Масс-спектр (FAB): 761 (М+Н)+.
П р и м е р 75. N,Nl-бис-(трет-бутоксикарбонил-L-метионил-L-валил)-2S, 5S-диамино-1,6-дифенилгексан-3S, 4S-диол.
Синтез осуществляли аналогичным описанному в примере 6 способом.
Масс-спектр (FAB): (М+Н)+, 861, 761.
ЯМР (270 мГц, ДМСО <D6>): 0,75 (д, 6 Гц, 12Н), 1,38 (с, 18Н), 1,70-1,90 (м, 6Н), 2,02 (с, 6Н), примерно 2,37-2,5 (м, 4Н), примерно 3,32 (м, 2Н), 3,94-4,10 (м, 6Н), 4,63 (д, 7 Гц, 2Н), 7,04-7,20 (м, 12Н), 7,49-7,59 (м, 4Н).
П р и м е р 76. N,Nl-бис-[/o-метилтирозил/-L-валил]-2S, 5S-диамино-1,6-дифенилгексан-3S, 4S-диол дигидрохлорид.
Синтез осуществляли аналогичным описанному в примере 16 способом.
Масс-спектр (FAB): 853 (М+Н)+.
П р и м е р 77. N,Nl-бис-[трет-бутоксикарбонил-/о-метилтирозил/-L-валил] -2S, 5S-диамино-1,6-дифенилгексан-3S, 4S-диол.
Синтез осуществляли аналогично описанному в примере 16 способом.
Масс-спектр (FAB): 1053 (М+Н)+, 953, 853.
ЯМР (270 мГц, ДМСО <D6>): 0,73-0,83 (м, 12Н), 1,29 (м, 12Н), 1,84 (м, 2Н), 2,60-3,02 (м, 8Н), 3,36 (м, 2Н), 3,70 (с, 6Н), 3,99-4,18 (м, 6Н), 4,64 (д, 6Н, 2Н), 6,82 (д, 9 Гц, 4Н), 6,98 (д, 9Гц, 2Н), 7,05-7,22 (м, 14Н), 7,59 (д, 9 Гц, 2Н), 7,65 (д, 9Гц, 2Н).
П р и м е р 78. N,Nl-бис-(L-тирозил-L-валил)-2S, 5S-диамино-1,6-дифенилгексан-3S, 4S-диол дигидрохлорид.
Синтез осуществляли аналогичным описанному в примере 16 способом.
Масс-спектр (FAB): 825 (М+Н)+.
П р и м е р 79. N,Nl-бис-[/N-третбутоксикарбонил-о-трет-бутил-L-тирозил/-L-валил]-2S, 5S-диамино-1,6-дифенилгексан-3S, 4S-диол.
Синтез осуществляли по способу описанному в примере 6.
Масс-спектр (FAB): 1137 (М+Н)+, 1037, 937.
ЯМР (270 мГц, ДМСО <D6>): 0,72-0,85 (м, 12Н), 1,25 (с, 18Н), 1,28 (с, 18Н), 1,85 (м, 2Н), 2,62-2,82 (м, 4Н), 2,84-3,01 (м, 4Н), 3,36 (м, 2Н), 3,98-4,12 (м, 4Н), 4,19 (м, 2Н), 4,64 (м, 7 Гц, 2Н), 6,85 (д, 8Гц, 4Н), 7,02 (д, 9 Гц, 2Н), 7,05-7,21 (м, 18Н), 7,60 (д, 8 Гц, 2Н), 7,66 (д, 9 Гц, 2Н).
П р и м е р 80. N,Nl-бис-[N6-бензилоксикарбонил-N2(трет-бутоксикарбо- нил-L -лизил)-L-валил]-2S, 5S-диамино-1,6-дифенилгексан-3R, 4R-диол.
Синтез осуществляли по способу описанному в примере 6.
Масс-спектр (FAB)/LiI): 1229: (М+Н)+.
П р и м е р 81. N,Nl-бис-[N6-бензилоксикарбонил-N2-/трет-бутоксикарбонил- L-фенилаланил/-L-лизил]-2S, 5S-диамино-1,6-дифенилгексан-3R, 4R-диол.
Синтез осуществляли аналогичным описанному в примере 6 способом.
Масс-спектр (FAB): 1319 (М+Н)+, 1219, 1185.
ЯМР (270 мГц, ДМСО <D6>): 1,08-1,47 (м, 30Н), 2,60-2,82 (м, 6Н), 2,87-3,99 (м, 6Н), 3,23 (м, 2Н), 4,08-4,23 (м, 4Н), 4,36 (м, 2Н), 4,69 (м, 2Н), 4,99 (с, 4Н), 6,94 (д, 9 Гц, 2Н), 7,04-7,40 (м, 32Н), 7,46 (д, 8 Гц, 2Н), 7,69 (д, 9 Гц, 2Н).
П р и м е р 82. N,Nl-бис-(L-глютамил-L-валил)-2S, 5S-диамино-1,6-дифенилгексан-3S, 4S-диол дигидрохлорид.
Синтез осуществляли аналогичным описанному в примере 16 способом.
Масс-спектр (FAB/LiI): 763 (М+Li)+, 757 (М+Н)+.
ЯМР (270 мГц, ДМСО <D6>): 0,81 (д, 6 Гц, 6Н), 0,85 (д, 6Гц, 6Н), 0,78-1,98 (м, 6Н), 2,20-2,38 (м, 4Н), 2,76 (м, 2Н), 2,97 (м, 2Н) примерно 3,35 (м, примерно 2Н), 3,89 (м, 2Н), 4,01-4,14 (м, 4Н), 4,68 (д, 7 Гц, 2Н), 7,06-7,21 (м, 10Н), 7,68 (д, 8 Гц, 2Н), 8,22 (м, 6Н), 8,46 (д, 9 Гц, 2Н).
П р и м е р 83. N,Nl-бис-(трет-бутоксикарбонил-L-глютамил-L-валил)-2S, 5S-диамино-1,6-дифенилгексан-3S, 4S-диол.
Синтез осуществляли, используя в качестве исходного материала соединение в соответствии с примером 84, путем каталитического гидрирования на палладиевом катализаторе на угле в смеси ледяной уксусной кислоты и воды в соотношении 9:1.
Масс-спектр (FAB): 979 (М+Na)+, 958 (М+Н)+.
ЯМР (270 мГц, ДМСО <D6>): 0,70-0,82 (м, 12Н), 1,38 (с, 18Н), 1,62-1,93 (м, 6Н), 2,17-2,29 (м, 4Н), 2,74 (м, 2Н), 2,95 (двойной м, 13 Гц, 2Н), примерно 3,35 (м, 2Н), 3,90-4,09 (м, 6Н), 4,12 (м, 2Н), 7,00-7,20 (м, 12Н), 7,48-7,62 (м, 4Н).
П р и м е р 84. N,Nl-бис-[(N-трет-бутоксикарбонил-о-бензил-L-глютамил/-L- валил]-2S, 5S-диамино1,6-дифенилгексан-3S, 4S-диол.
Синтез осуществляли аналогичным описанному в примере 6 способом.
Масс-спектр (FAB): 1159 (М+Na)+, 1137 (М+Н)+, 1037.
ЯМР (270 мГц, ДМСО <D6>): 0,75 (д, 6 Гц, 12Н), 1,37 (с, 18Н), 1,70-1,98 (м, 6Н), 2,33-2,45 (м, 2Н), 2,76 (м, 2Н), 2,93 (м, 2Н), примерно 3,3 (м, 2Н), 3,94-4,08 (м, 6Н), 4,60 (с, 7 Гц, 2Н), 5,08 (с, 4Н), 7,03-7,17 (м, 12Н), 7,30-7,48 (м, 10Н), 7,50 (д, 8 Гц, 2Н), 7,58 (д, 9 Гц, 2Н).
П р и м е р 85. N,Nl-бис-(глицил-L-валил)-2S, 5S-диамино-1,6-дифенил-гексан-3R, 4R-диол дигидрохлорид.
Синтез осуществляли аналогичным описанному в примере 16 способом.
Масс-спектр (FAB): 635 (М+Na)+, 613 (М+Н)+.
П р и м е р 86. N,Nl-бис-(трет-бутоксикарбонилглицин-L-валил)-2S, 5S-диамино-1,6-дифенилгексан-3R, 4R-диол.
Синтез осуществляли аналогичным описанному в примере 6 способом.
Масс-спектр (FAB): 835 (М+Na)+, 813 (М+Н)+.
ЯМР (270 мГц, ДМСО <D6>): 0,70 (д, 7Гц, 12Н), 1,38 (с, 18Н), 1,84 (м, 2Н), 2,62 (двойной д, 14 Гц, 4 Гц, 2Н), 2,87 (двойной д, 14 Гц, 10 Гц, 2Н), 3,26 (м, 2Н), 3,52 (д, 6Гц, 4Н), 4,13 (м, 2Н), 4,42 (м, 2Н), 4,69 (м, 2Н), 7,03 (м, 2Н), 7,08-7,21 (м, 10Н), 7,38 (д, 9Гц, 2Н), 7,50 (д, 9 Гц, 2Н).
П р и м е р 87. N,Nl-бис-(L-лейцил-L-валил)-2S, 5S-диамино-1,6-дифенил-гексан-3S, 4S-диол дигидрохлорид.
Синтез осуществляли аналогичным описанному в примере 16 способом.
Масс-спектр (FAB): 747 (М+Na)+, 725 (М+Н)+.
П р и м е р 88. N,Nl-бис-(трет-бутоксикарбонил-L-лейцил-L-валил)-2S, 5S-диамино-1,6-дифенилгексан-3S, 4S-диол.
Синтез осуществляли аналогичным описанному в примере 6 способом.
Масс-спектр (FAB): 947 (М+Na)+, 925 (М+Н)+, 825, 725.
ЯМР (270 мГц, ДМСО<D6>): 0,72-0,80 (м, 12Н), 0,85 (д, 7 Гц, 6Н), 0,89 (д, 7 Гц, 6Н), 1,28-1,54 (м, 22Н), 1,60, (м, 2Н), 1,81 (м, 2Н), 2,76 (двойной д, 13Гц, 9 Гц, 2Н), 2,93 (двойной д, 13Гц, 4 Гц, 2Н), примерно 3,33 (м, 2Н), 3,92-4,09 (д, 7 Гц, 2Н), 7,04 (д, 8 Гц, 2Н), 7,05-7,20 (м, 10Н), 7,48 (д, 9 Гц, 9Н).
П р и м е р 89, N,Nl-бис-[L-/S-диоксо/-метионил-L-валил]-2S, 5S-дифенилгексан-3R, 4R-диол дигидрохлорид.
Синтез осуществляли аналогичным описанному в примере 16 способом.
Масс-спектр (FAB): 847 (М+Na)+, 825 (М+Н)+.
П р и м е р 90. N,Nl-бис-[трет-бутоксикарбонил-L-/S-диоксо/метионил-L-валил]-2S, 5S-диамино-1,6-дифенилгексан-3R, 4R-диол.
Синтез осуществляли аналогичным описанному в примере 6 способом.
Масс-спектр (FAB): 1074 (N+Na)+.
ЯМР (270 мГц, ДМСО <D6>): 0,65-0,78 (м, 12Н), 1,39 (с, 18Н), 1,74-2,07 (м, 6Н), 2,63 (м, 2Н), 3,07 (м, 4Н), 2,78 (м, 2Н), 3,26 (м, 2Н), 3,98-4,17 (м, 4Н), 4,44 (м, 2Н), 4,67 (м, 2Н), 7,07-7,23 (м, 12Н), 7,49 (д, 9 Гц, 2Н), 7,53 (д, 9 Гц, 2Н).
П р и м е р 91. N,Nl-бис-[/2S-/1,1-диметилэтилсульфонилметил/-3-фенил-пропио- нил/ -L-третбутилглицил]-2S, 5S-диамино-1,6-дифенил-гексан-3R, 4R-диол.
Синтез осуществляли аналогичным описанному в примере 13 способом.
Масс-спектр (FAB): 1081 (М+Na)+, 1059 (М+Н)+.
ЯМР (270 мГц, ДМСО <D6>): 0,83 (с, 18Н), 1,12 (с, 18Н), 2,39 (двойной д, 11 Гц, 14 Гц, 2Н), 2,56-2,72 (м, 4Н), 2,73-2,90 (м, 4Н), примерно 3,25-3,40 (м, примерно 4Н), 3,53 (двойной д, 10 Гц, 14 Гц, 2Н), 4,20 (д, 9 Гц, 2Н), 4,54 (м, 2Н), 4,62 (м, 2Н), 6,98 (м, 2Н), 7,07-7,36 (м, 18Н), 7,47 (д, 9 Гц, 2Н), 7,96 (д, 9 Гц, 2Н).
П р и м е р 92. N,Nl-бис-[/2S-/1,1-диметилэтилсульфонилметил/-3- фенил-пропионил/-L-неопентилглицил] -2S, 5S-диамино-1,6-дифенилгексан-3R, 5R-диол.
Синтез осуществляли аналогичным описанному в примере 13 способом.
Масс-спектр (FAB): 1109 (М+Na)+, 1087 (М+Н)+.
ЯМР (270 мГц, CDCl3), 0,86 (с. 18Н) 1,08 (двойной д, 8 Гц, 14Гц, 2Н), 1,35 (с, 18Н), 1,58 (двойной д, 14 Гц, 2Н), 2,75-3,45 (м, примерно 8Н), 3,80 (м, 2Н), 4,12 (м, 2Н), 5,80 (д, 8 Гц, 2Н), 6,27 (д, 8 Гц, 2Н), 7,10-7,36 (м, примерно 10Н).
П р и м е р 93. N,Nl-бис-[/2-S-окси-3-фенилпропионил/-L-валил]-2S, 5S-диамино-1,6-дифенилгексан-3S, 4S-диол.
К 0,065 ммоль N,Nl-бис-(-L-валил)-2S, 3S-диамино-1,6-дифенилгексан-3S, 4S-диол гидрохлорида и 33 мг S-фенилмолочной кислоты в 4 мл диметилформамида добавляли 27 мг НОВТ, 64 мг ТВТИ и затем медленно 0,088 мл диизопропилэтилена. Через 15 мин удаляли в вакууме при комнатной температуре диметилформамид, растворяли остаток в этилацетате и осуществляли экстракцию раствором КНSO4 и NaHCO3и водой. Органическую фазу высушивали MgSO4 и концентрировали, остаток растирали с эфиром и отсасывали. Выход: 43 мг.
Масс-спектр (FAB): 795 (М+Н)+.
ЯМР(270 мГц, ДМСО <D6>): 0,63 (д, 7 Гц, 6Н), 0,67 (д, 7 Гц, 6Н), 1,82 (м, 2Н), 2,64-2,79 (м, 4Н), 2,91-3,04 (м, 4Н), 3,38 (м, 2Н), 3,97-4,17 (м, 6Н), 4,72 (д, 6Гц, 2Н), 5,77 (д, 6Гц, 2Н), 7,08-7,23 (м, 20Н), 7,38 (д, 9 Гц, 2Н), 7,85 (д, 8 Гц, 2Н).
П р и м е р 94. N,Nl-бис-[/2S-окси-4-фенилбутирил/-L-валил]-2S, 5S-диамино-1,6-дифенилгексан-3S, 4S-диол.
Синтез осуществляли аналогичным описанному в примере 93 способом.
Масс-спектр (FAB): 345 (М+Na)+, 323 (M+H)+.
ЯМР (270 МГц, ДМСО <D6>): 0,73 (д, 5 Гц, 6Н), 0,76 (д, 5Гц, 6Н), 1,76-2,00 (м, 6Н), 2,55-2,78 (м, 6Н), 2,98 (двойной м, 14 Гц, 2Н), 3,39 (м, 2Н), 3,89 (м, 2Н), 4,00-4,18 (м, 4Н), 4,75 (д, 6 Гц, 2Н), 5,88 (д, 6 Гц, 2Н), 7,05-7,32 (м,20Н), 7,45 (д, 9 Гц, 2Н), 7,88 (д, 8 Гц, 2Н).
П р и м е р 95. N,Nl-бис-[/2-/1-имидазолилметил/-3-фенилпропионил/-L-валил] 2S, 5S-диамино-1,6-дифенилгексан-3S, 4S-диол (исходя из "диастереомера 1").
35,8 мг 2S, 5S-диамино-1,6-дифенилгексан-3S, 4S-диол дигидрохлорида и 90 мг 2-/1-имидазолилметил/-3-фенилпропионил-валила ("диастереомер 1") растворяли в 2 мл диметилформамида и смешивали приготовленный раствор при комнатной температуре с 32 мг ОНВt, 77 мг ТВТИ и затем с 0,163 мл диизопропилэтиламина. Смесь перемешивали в течение 3 ч, растворитель удаляли в вакууме и остаток распределяли между этилацетатом и раствором NaHCO3. Органическую фазу промывали полуконцентрированным раствором NaCl, высушивали и концентрировали. Остаток растирали с диэтиловым эфиром, отсасывали и подвергали хроматографии на силикагеле (подвижная фаза: смесь ЕЕ и МеОН в соотношении 85: 15). В результате получали 57 мг целевого соединения.
Масс-спектр (FAB): 923 (М+Н)+.
2/1-имидазолилметил/-3-фенилпропи-онил-L-валил получали следующим образом. 1,53 г эфира бензилакриловой кислоты и 550 мг имидазола растворяли в 30 мл этанола и смешивали полученный раствор в атмосфере аргона при комнатной температуре с 40 мг NaH. Через 7 дней реакционный раствор выливали в 50 мл раствора КН2PO4 и трижды проводили экстракцию 50 мл метилтретбутилового эфира. Органическую фазу дважды экстрагировали NaHSO4, водную фазу подщелачивали К2CO3 и снова дважды подвергали экстракции 50 мл метилбутилового эфира. В результате после концентрирования получали 390 мг этилового эфира 2-бензол-3-/1-имидазолил/пропионовой кислоты, который омыляли NaOH и затем подвергали сочетанию с валилметиловым эфиром через РРА. Диастереомеры разделяли с помощью смеси этилацетата и МеОН в соотношении 10:1:
0,34 диастереомер 1; 0,18 диастереомер 2.
При омылении NaOH в смеси диоксана и воды получали компоненты для реакции сочетания, использующиеся в примерах 95 и 98.
П р и м е р 96. N,Nl-бис[/2-/1-имидазолилметил/-3-фенилпропионил/-L-валил] 2S, 5S-диамино-1,6-дифенилгексан-3S- 4S-диол (исходя из "диастереомера 2").
Получение см. в примере 95.
Масс-спектр (FAB): 923 (М+Н)+.
П р и м е р 97. N,Nl-бис-[3-/4-амино-1-пиперидилсульфонил/-2-бензилпропионил-L- валил]-2S, 5S-диамино-1,6-дифенилгексан-3R, 4R-диол.
Синтез осуществляли аналогичным описанному в примере 16 способом.
Масс-спектр (FAB): 1115 (М+Н)+.
П р и м е р 98. N,Nl-бис-[2-бензил-4-трет-бутоксикарбониламино-1- пиперидилсульфонил/-пропионил-L-валил] -2S, 5S-диамино-1,6-дифенил-гексан-3R, 4R-диол.
57 мг N,Nl-бис-(L-валил)-2S, 5S-диамино-1,6-дифенил-гексан-3R, 4R-диол дигидрохлорида и 129 мг 2-бензил-3-/4-трет-бутоксикарбониламино-1- пиперидилсульфонил/-пропионовой кислоты растворяли в 1 мл диметилформамида и смешивали полученный раствор с 41 мг НОВt, 96 мг ТВТИ и 135 мкл диизопропилэтиламина. Через 20 мин растворитель удаляли в вакууме, остаток растворяли в DCM и проводили экстракцию растворами КHSO4 и КНCO3 и водой. После высушивания и концентрирования органические фазы и вязкий остаток растворяли в небольшом количестве смеси DCM и метанола и высаживали продукт из раствора диэтиловым эфиром. Выход: 64 мг.
Масс-спектр (FAB): 1337 (М+Na)+, 1315 (М+Н)+, 1237, 1215, 1137, 1115.
2-Бензил-3/4-трет-бутоксикарбонила-мино-1-пиперидилсульфонил/- пропионовую кислоту синтезировали аналогичным описанному в примере 13 способом. На промежуточной стадии путем взаимодействия эфира бензилакриловой кислоты тиоуксусной кислоты получали бензиловый эфир 3-ацетил-тио-2-бензилпропионовой кислоты. Последующее окисление его хлором приводило к образованию бензилового эфира 2-бензил-3-хлорсульфонилпропионовой кислоты, который путем сочетания с 4-трет-бутоксикарбониламинопиперидином и последующего гидрирования переводили в вышеуказанный компонент для реакции сочетания.
П р и м е р 99. N,Nl-бис-[3-/4-амино-1-пиперидилкарбонил/-2R- бензилпропионил-L-валил] -2S,5S-диамино-1,6-дифе- нилгексан-3R, 4R-диол дигидрохлорид.
Синтез осуществляли аналогичным описанному в примере 16 способом.
Масс-спектр (FAB): 1043 (М+Н)+.
П р и м е р 100. N,Nl-бис-[2R-бензил-3-/4-трет-бутоксикарбониламино-1- пиперидилкарбонил/-пропионил-L-валил] -2S, 5S-диамино-1,6-дифенилгексан-3R, 4R-диол дигидрохлорид.
57 мг N,Nl-бис-(L-валил)-2S, 5S-диамино-1,6-дифенил-гексан-3R, 4R-диол дигидрохлорида и 129 мг 2R-бензил-3/4-трет-бутоксикарбониламино-1-пиперидил- карбонил/- пропионовой кислоты, синтезированной путем сочетания 4-трет-бутоксикарбониламинопиперидина и бензилового эфира 2-R-бензил-3-карбоксипропионовой кислоты растворяли в 1 мл диметилформамида и смешивали полученный раствор с 41 мг ОНВt мг ТВТИ и затем медленно добавляемого 0,135 мл диэтилизопропиламина. Через 20 мин растворитель удаляли в вакууме, остаток растворяли в ЕЕ и проводили экстракцию растворами КНSO4 и NaHCO3 и водой. Органическую фазу высушивали над MgSO4 и концентрировали. Остаток растворяли в небольшом количестве DCM, высаживали продукт диэтиловым эфиром и отфильтровывали. Выход: 64 мг.
Масс-спектр (FAB): 1265 (М+Na)+, 1243 (М+Н)+.
П р и м е р 101. N,Nl-бис-[/2R-бензил-3-карбоксил/-пропионил-L-валил] -2S, 5S-диамино-1,6-дифенилгексан-3R, 4R-диол.
Синтез осуществляли исходя из соединения в соответствии с примером 102, путем обработки его трифторуксусной кислотой.
Масс-спектр (FAB): 901 (М+Na)+, 879 (М+Н)+.
П р и м е р 102. N,Nl-бис-[/2R-бензил-3-третбутоксикарбонил/-пропионил-L-валил]-2S, 5S-диамино-1,6-дифенилгексан-3R, 4R-диол.
45 мг N,Nl-бис-(L-валил)-2S, 5S-диамино-1,6-дифенил-гексан-3R, 4R-диол дигидрохлорида и 75 мг 2R-бензил-3-третбутоксикарбонилпропионовой кислоты растворяли в 2 мл диметилформамида и смешивали полученный раствор с 37 мг ОН-Вt, 87 мг ТБТИ и 112 мкл этилдиизопропиламина. Смесь перемешивали в течение 15 мин при комнатной температуре, удаляли диметилформамид в вакууме, остаток растворяли в этилацетате и проводили экстракцию растворами КНSO4, NaHCO3и водой. Органическую фазу высушивали над MgSO4 и концентрировали. Остаток растирали с диэтиловым эфиром и отфильтровывали. Выход 44 мг.
Масс-спектр (FAB): 1013 (М+Na)+, 981 (М+Н)+.
ЯМР (270 мГц, ДМСО <D6>): 0,69 (d, 6 Гц, 6Н), 0,74 (д, 6Гц, 6Н), 1,31 (с, 18Н), 1,83 (м, 2Н), 1,95 (м, 2Н), 2,32-2,47 (м, 4Н), 2,60-2,87 (м, 6Н), 2,98 (м, 2Н), 3,29 (м, 2Н), 4,09 (двойной д, 8Гц, 7 Гц, 2Н), 4,46 (м, 2Н), 4,64 (м, 2Н), 7,02-7,31 (м, 10Н), 7,38 (д, 9 Гц, 2Н), 7,80 (д, 8Гц, 2Н).
П р и м е р 103. N,Nl-бис-[/3-амино-2-бензил-/-пропионил-L-валил]-2S, 5S-диамино-1,6-дифенилгексан-3R, 4R-диол дигидрохлорид (исходя из "диастереомера 1").
Синтез осуществляли аналогичным описанному в примере 16 способом из соединения в соответствии с примером 105.
Масс-спектр (FAB): 843 (M+Na)+, 821 (М+Н)+.
П р и м е р 104. N,Nl-бис-[/3-амино-2-бензил/-пропионил-L-валил]-2S, 5S-диамино-1,6-дифенилгексан-3R, 4R-диол дигидрохлорид (исходя из "стереомера 2").
Синтез осуществляли аналогичным описанному в примере 16 способом из соединения в соответствии с примером 106.
Масс-спектр (FAB): 843 (M+Na)+, 821 (М+Н)+.
П р и м е р 105. N,Nl-бис-[/2-бензил-3-третбутоксикарбониламино/- пропионил-L-валил] -2S, 5S-диамино-1,6-дифенилгексан-3R, 4R-диол (исходя из "диастереомера 1").
37 мг 2S, 5S-диамино-1,6-дифенилгексан-3R, 4R-диол дигидрохлорида сочетали с 98 мг N,Nl-бис-/2-бензил-3-трет-бутокси-карбониламино/-пропионил -L-валила по ТВТИ-методу. После обычной обработки и хроматографии (подвижная фаза: смесь DCM и метанола в соотношении 98:2-95:5) получали 28 мг целевого соединения.
Масс-спектр (FAB): 1043 (М+Na)+, 1021, (М+Н)+, 921, 821.
Компонент N,Nl-бис-/2-бензил-3-третбутоксикарбониламино/-пропионил-L-вал- ил получали следующим образом. 2,3 г натрия растворяли в 170 мг этанола и смешивали образующийся раствор в 32 мг этилового эфира циануксусной кислоты. При перемешивании добавляли к смеси по каплям 11,5 мл бензилхлорида. Раствор оставляли стоять на ночь при комнатной температуре, после чего отфильтровывали осадок NaCl и отгоняли растворитель. Остаток растворяли в этилацетате и подвергали его экстракции водой. Органическую фазу концентрировали и остаток перегоняли в вакууме (0,5 мм рт.ст. 120-125оС). Выход 8,1 г.
Полученный этиловый эфир бензилциануксусной кислоты растворяли в 200 мл этанола и гидрировали в присутствии никеля Ренея. После отсасывания катализатора и концентрирования получали 8,2 г маслянистой жидкости и после хроматографии на силикагеле (этилацетат после смеси этилацетата и метанола в соотношении 5:1) 5,5 г этилового эфира 3-амино-2-бензилпропионовой кислоты. Полученное соединение подвергали взаимодействию с Вос2О с образованием в результате этилового эфира 2-бензил-3-/трет-бутоксикарбониламино/-пропионовой кислоты, который омыляли и подвергали сочетанию с Н-Va1-OMe по АПФ-методу. Полученные диастереомеры разделили с помощью хроматографии (подвижная фаза: смесь толуола и диизопропилового эфира в соотношении 1:1).
Rf=0,140= диастереомер 1
Rf=0,097= диастереомер 2
Омыление NaOH в смеси диоксана и воды приводит к получению компонентов для реакции сочетания, использовавшихся в качестве исходных соединений в примерах 105 и 106.
П р и м е р 106. N,Nl-[/2R-бензил-3-трет-бутоксикарбониламино/- пропионил-L-валил]-2S, 5S-диамино-1,6-дифенилгексан-3R, 4R-диол (исходя из диастереомера 2).
Синтез осуществляли аналогичным описанному в примере 105 способом.
Масс-спектр (FAB): 1043 (М+Na)+, 1021 (М+Н)+, 921, 821.
П р и м е р 107. N,Nl-бис-[o-/D-маннофуранозил/-2S-гидрокси-3- фенил-пропионил-L-валил]-2S,5S-диамино-1,6-дифенилгексан-3R, 4R-диол.
20 мг соединения в соответствии с примером 108 перемешивали в течение 30 мин при комнатной температуре с метанольным раствором соляной кислоты. Летучие компоненты затем отгоняли в вакууме, остаток настаивали с диэтиловым эфиром, отсасывали и высушивали.
Выход: 13 мг.
ЯМР (270 МГц, ДСМО<D6>): 0,58 (д, 6Гц, 6Н), 0,62 (д, 6Гц, 6Н), 1,82 (м, 2Н), 2,60 (двойной д, 4Гц, 14 Гц, 2Н), 2,71-2,81 (м, 4Н), 2,98 (двойной д, 14 Гц, 3 Гц, 2Н), примерно 3,25 (м, 2Н), 3,30-3,49 (м, 6Н), 3,58 (м, 2Н), 3,67 (двойной д, 11 Гц, 3Гц, 2Н), примерно 3,70-4,30 (м, примерно 16Н), 4,43 (м, 2Н), 4,49 (д, 2Гц, 2Н), 7,05-7,29 (м, 20Н), 7,35 (д, 9 Гц, 2Н), 7,67 (д, 9 Гц, 2Н).
П р и м е р 107а. N, Nl-бис-[o-/2,3-5,6-диизопропилиден-D-маннофуранозил-2S-окси-3- фенилпропионил-L-валил] -2S, 5S-диамино-1,6-дифенил-гексан-3R, 4R-диол.
57 мг N,Nl-бис-(L-валил)-2S, 5S-диамино-1,6-дифенил-гексан-3R, 4R-диол дигидрохлорида и 90 мг <0-/2,3-5,6-диизопропиллен-D-манно- фуранозил/-2S-гидрокси-3- фенилпроптионовой кислоты растворяли в 1 мл диметилформамида и проводили реакцию сочетания по ТВТИ-методу. Выход: 60 мг.
Масс-спектр (FAB): 1279 (М+Н)+, 1261, 1221.
ЯМР (270 мГц, ДМСО <D6>): 0,63 (д, 6 Гц, 6Н), 0,69 (д, 6 Гц, 6Н), 1,19 (с, 6Н), 1,21 (с, 6Н), 1,30 (с, 12Н), 1,79 (м, 2Н), 2,60-2,82 (м, 8H), 3,29 (м, 2Н), 3,73 (двойной д, 8 Гц, 6 Гц, 2Н), 3,85-3,98 (м, 4Н), 4,01-4,18 (м, 4Н), 4,23 (двойной д, 8 Гц, 3 Гц, 2Н), 4,40 (д, 6 Гц, 2Н), 4,45 (м, 2Н), 4,62-4,72 (м, 4Н), 7,03-7,32 (м, примерно 22Н), 7,40 (д, 9 Гц, 2Н), 7,59 (д, 9 Гц, 2Н).
405 мг /о-/2,3-5,6-диизопропилиден-D-маннофуранозил-трихлорацетимидата и 194 мг этилового эфира фенилмасляной кислоты растворяли в 15 мл абсолютного СН2Сl2. Раствор охлаждали до 0оС и добавляли к нему 100 мкл 1М раствора ВF3 эфирата в СН2Сl2. Раствор перемешивали в течение 1 ч при 0оС, выливали его в 100 мл раствора NaHCO3 и экстрагировали СН2Сl2. Органическую фазу высушивали Na2SO4 и концентрировали. После хроматографии на силикагеле "подвижная фаза" (смесь метилтретбутилового эфира и гептана в соотношении 1:1) получали 195 мг целевого соединения.
П р и м е р 108. N,Nl-бис-/L-фенилаланил-L-валил-3S, 6S-диамино-1,8-ди-4-пиридил/-октан-4R, 5R-диол тетрагидрохлорид.
Синтез осуществляли аналогичным описанному в примере 16 способом из соединения в соответствии с примером 27.
Масс-спектр (FAB): 823 (М+Н)+.
П р и м е р 109. N,Nl-бис-[N- β -Д-1-дезоксифруктоз-1-ил-L-фенилаланил-L-валил]-2S, 5S-диамино-1,6-дифенилгексан-3S, 4S-диол диацетат.
69 мг N,Nl-бис-(L-фенилаланил-L-валил)-2S, 5S-диамино-1,6-дифенилгексан-3S, 4S-диол дигидрохлорида и 79 мг D-глюкозы суспензировали в 6 мл метанола и 2 мл пиридина и кипятили суспензию в течение 4,5 ч. Растворитель затем удаляли в вакууме, а остаток подвергали хроматографическому разделению на ®Sephadex LH20 с помощью 10%-ной уксусной кислоты.
Выход: 71 мг.
Масс-спектр (FAB): 1138 (М+Na)+, 1117 (М+Н)+.
П р и м е р 110. N,Nl-бис-(D-глюконил-L-фенилаланил-L- валил)-2S, 5S-диамино-1,6-дифенилгексан-3R- 4R-диол.
Синтез: соединение в соответствии с примером 111 обрабатывали насыщенным раствором аммиака в метаноле.
Масс-спектр (FAB): 1171 (M+Na)+.
П р и м е р 111. N,Nl-бис-(2,3,4,5,6-пента-о-ацетил-D-глюконил-L-фенилаланил-L- валил)-2S, 5S-диамино-1,6-дифенилгексан-3R, 4R-диол.
Синтез осуществляли путем сочетания 2,3,4,5,6-пента-о-ацетил-D-глюконовой кислоты с N,Nl-бис-(L-фенилаланил-L-валил)-2S, 5S-диамино-1,6-дифенилгексан-3R, 4R-диол дигидрохлоридом по ТВТИ-методу.
Масс-спектр (FAB): 1569 (М+Н)+.
П р и м е р 112. N,Nl-бис-(трет-бутоксикарбонил-L-фенилаланил-L- валил)-1,4-диаминобутан-2R, 3R-диол.
Синтез осуществляли аналогичным описанному в примере 6 способом, исходя из 1,4-диаминобутан-2R, 3R-диол дигидрохлорида.
ЯМР (270 мГц, ДМСО <D6>): 0,83 (д, 6Гц, 12Н), 1,31 (с, 18Н), 1,93 (м, 2Н), 2,73 (м, 2Н), 2,91-3,07 (м, 4Н), 3,28 (м, 2Н), 3,42 (м, 2Н), 4,18 (м, 4Н), 4,57 (м, 2Н), 7,02 (д, 8 Гц, 2Н), 7,13-7,32 (м, 10Н), 7,66 (д, 8,4 Гц, 2Н), 8,04 (м, 2Н).
Масс-спектр (FAB): 835 (М+Na)+, 813 (М+Н)+, 713, 613.
П р и м е р 112а. 1,4-диаминобутан-2R- 3R-диол дигидрохлорид.
Синтез осуществляли аналогичным описанному в примерах 2, 2в, и 2с, способом, исходя из (+)-1,4-ди-О-тозил-2,3,-о-изопропилиден-D-трейтола.
ЯМР (60 мГц, ДМСО <D6>): 2,9 (м, 4Н), 3,73 (м, 2Н), примерно 5,7-4,5 (широкая, примерно 2Н), 8,1 (м, примерно 6Н).
Масс-спектр (DCl): 121 (М+Н)+, 104.
П р и м е р 113. N,Nl-бис-(L-фенилаланил-L-валил)-1,4-диаминобутан-2R, 3R-диол дигидрохлорид.
Синтез осуществляли аналогичным описанному в примере 16 способом, исходя из соединения в соответствии с примером 112.
Масс-спектр (FAB): 635 (М+Na)+, 613 (М+Н)+.
П р и м е р 114. N,Nl-бис-(трибензилоксикарбонил-L-органил-L-валил)-2S, 5S-диамино-1,6-дифенилгексан-3R, 4R-диол.
Синтез осуществляли аналогичным описанному в примере 6 способом.
Масс-спектр (FAB): 1637 (М+Na)+, 1615 (М+Н)+.
ЯМР (270 мГц, ДМСО <D6>): 0,71 (д, 7Гц, 12Н), 1,57 (м, 8Н), 1,80 (м, 2Н), 2,73 (м, 2Н), 2,94 (м, 2Н), 3,30 (м, 2Н), 3,30 (м, 2Н), 3,70-4,12 (м, 10Н), 4,58 (д, 7Гц, 2Н), 4,92-5,18 (м, 8Н), 5,19 (с, 4Н), 7,00-7,42 (м, 40Н), 7,49 (д, 8 Гц, 4Н), 7,64 (д, 8,4 Гц, 2Н), 9,13 (широкий с, 4Н).
П р и м е р 115. N,Nl-бис-(трет-бутоксикарбонил-L-циклогексилаланил-L-валил) -2S, 5S-диамино-1,6-дифенилгексан-3R, 4R-диол.
Синтез осуществляли аналогичным описанному в примере 6 способом.
Масс-спектр (FAB): 1005 (M+H)+, 905.
ЯМР (270 мГц, ДМСО <D6>): 0,67 (д, 7 Гц, 6Н), 0,80 (д, 7Гц, 6Н), 0,80-1,84 (м, 26Н), 1,42 (с, 18Н), 2,13 (септ. 7 Гц, 6Н), 2,80 (двойной д, 15 Гц, 9 Гц, 2Н), 3,35 (м, 4Н), 4,03 (м, 4Н), 4,30 (кв.д, 9 Гц, 4 Гц, 2Н), 4,96 (д, 4 Гц, 2Н), 6,57 (д, 8 Гц, 4Н), 7,10-7,30 (м, 12Н).
П р и м е р 116. N,Nl-бис-(L-циклогексилаланил-L-валил)-2S, 5S-диамино-1,6-дифенилгексан-3R, 4R-диол дигидрохлорид.
Синтез осуществляли аналогичным описанному в примере 16 способом.
Масс-спектр (FAB): 805 (М+Н)+, 553, 531.
ЯМР (270 мГц, ДМСО <D6>): 0,79 (д, 7 Гц, 6Н), 0,85 (д, 7 Гц, 6Н), 1,00-1,95 (м, 28Н), 2,77 (двойной д, 1Н Гц, 7Гц, 2Н), 2,93 (м, 2Н), 3,37 (м, 2Н), 3,89 (м, 2Н), 4,09 (м, 4Н), 4,70 (д, 7Гц, 2Н), 7,16 (м, 10Н), 7,66 (д, 8 Гц, 2Н), 8,17 (с, 6Н), 8,47 (д, 9 Гц, 2Н).
П р и м е р 117. N,Nl-бис-(бензилоксикарбонил-L-триптофил-L-валил)-2S, 5S-диамино-1,6-дифенилгексан-3R, 4R-диод.
Синтез осуществляли аналогичным описанному в примере 6 способом.
Масс-спектр (FAB): 1139 (М+Н)+, 720.
ЯМР (270 мГц, ДМСО < D6>): 0,75 (м, 12Н), 1,96 (м, 2Н), 2,76 (двойной д, 13 Гц, 7 Гц, 2Н), 2,90-3,13 (м, 6Н), 3,40 (м, 2Н), 4,07 (м, 4Н), 4,38 (м, 2Н), 4,65 (д, 7Гц, 2Н), 4,98 (д, 14Гц, 2Н), 4,87 (д, 14 Гц, 2Н), 6,90-7,35 (м, 28Н), 7,47 (д, 8 Гц, 2Н), 7,48 (д, 8 Гц, 2Н), 7,65 (д, 8 Гц, 2Н), 7,83 (д, 8Гц, 2Н), 10,80 (мс, 2Н).
П р и м е р 118. N,Nl-бис-(L-триптофил-L-валил)-2S, 5S-диамино-1,6-дифенилгексан-3R, 4R-диол дигидрохлорид.
Синтез осуществляли аналогичным описанному в примере 11 способом.
Масс-спектр (FAB): 871 (М+Н)+.
ЯМР (270 мГц, ДМСО < D6>): 0,75 (м, 12Н), 1,88 (м, 2Н), 2,75 (м, 4Н), 2,98 (двойной д, 14 Гц, 2 Гц, 2Н), 3,13 (двойной д, 14 Гц, 3 Гц, 2Н), 3,42 (м, 2Н), 3,73 (м, 2Н), 4,10 (м, 4Н), 4,73 (д, 6 Гц, 2Н), 6,09-7,24 (м, 18Н), 7,35 (д, 8 Гц, 2Н), 7,63 (д, 8 Гц, 2Н), 7,80 (д, 8 Гц, 2Н), 8,22 (с, 6Н), 10,90 (с, 2Н).
П р и м е р 119. N,Nl-бис-(бензилоксикарбонил-L-1,2,3,4-тетрагидроизозинолин-3- ил-карбонил-L-валил)-2S, 5S-диамино-1,6-дифенилгексан-3R, 4R-диол.
Синтез осуществляли аналогичным описанному в примере 6 способом.
Масс-спектр (FAB): 1107 (М+Na)+, 1085 (М+Н)+.
ЯМР (270 мГц, ДМСО < D6>): 0,55 (м, 12Н), 1,70 (м, 2Н), 2,60-3,81 (м, 10Н), 3,00 (м, 2Н), 4,03 (м, 2Н), 4,38-4,80 (м, 8Н), 4,91-5,20 (м, 4Н), 7,00-7,53 (м, 28Н), 7,58 (д, 8Гц, 2Н), 7,72 (д, 8 Гц, 2Н).
П р и м е р 120. N,Nl-бис-(L-1,2,3,4-тетрагидроизоинолин-3-ил- карбонил-L-валил)-2S, 5S-диамино-1,6-дифенилгексан-3R, 4R-диол диацетат.
Синтез осуществляли аналогичным описанному в примере 11 способом.
Масс-спектр (FAB): 839 (М+Na)+, 817 (М+Н)+.
ЯМР (270 мГц, ДМСО <D6>): 0,70 (д, 7 Гц, 12Н), 1,86 (м, 2Н), 1,92 (с, 6Н), 2,64-2,89 (м, 4Н), 2,92 (двойной д, 16 Гц, 5 Гц, 2Н), 3,02 (двойной д, 13 Гц, 3Гц, 2Н), 3,39 (м, 2Н), 3,47 (двойной д, 9 Гц, 5 Гц, 2Н), 3,90 (с, 4Н), 4,03 (м, 2Н), 4,10 (двойной д, 9 Гц, 5 Гц, 2Н), 4,74 (широкий с, 2Н), 7,02-7,26 (м, 18Н), 7,77 (д, 9 Гц, 2Н), 7,85 (д, 8 Гц, 2Н).
П р и м е р 121. N, Nl-бис-[/2-бензилсульфинилметил/-3-фенилпропионил/-L-валил] 2S, 5S-диамино-1,6-дифенилгексан-3R, 4R-диол.
Синтез осуществляли аналогичным описанному в примере 13 способом.
Синтез исходной 2-/-бензилсульфонилметил/-3-фенилпропионовой кислоты осуществляли аналогичным описанному в литературе (J. Med. Chem. 31, 1839 (1988)) способом.
Масс-спектр (FAB): 1089 (М+Na)+, 1067 (М+Н)+.
ЯМР (270 мГц, ДМСО <D6>): 0,45 (м, 6Н), 0,72 (м, 6Н), 1,80 (м, 2Н), 2,53-2,95 (м, 12Н), 3,22-3,36 (м, 4Н), 3,55 (м, 2H); 3,73-4,26 (м, 6Н), 4,48 (м, 2Н), 7,00-7,40 (м, 30Н), 7,85-8,07 (м, 4Н).
П р и м е р 122. N,Nl-бис-{[2-(n-хлорбензилтиометил)-3-фенилпропионил] -L-валил} 3S, 5S-диамино-1,6-дифенилгексан-3R, 4R-диол.
Синтез осуществляли аналогичным описанном в примере 13 способом.
Синтез исходной 2-/n-хлорбензилтиометил/-3-фенилпропионовой кислоты осуществлялся аналогичным описанному в литературе (J. Med. Chem. 31, 1839, (1988)) способом.
Масс-спектр (FAB): 1125 (М+Na)+.
ЯМР (270 мГц, ДМСО <D6>): 0,49 (м, 6Н), 0,57 (м, 6Н), 1,80 (м, 2Н), 2,10-2,33 (м, 2Н), 2,38-2,60 (м, 4Н), 2,62-2,83 (м, 6Н), 2,95 (м, 2Н), 3,28 (м, 2Н), 3,65 (с, 4Н), 4,03-4,17 (с, 2Н), 4,45 (м, 2Н), 4,54-4,67 (м, 2Н), 7,00-7,50 (м, 28Н), 7,64 (м, 2Н), 7,88 (м, 2Н).
П р и м е р 123. N,Nl-бис-{[2-(n-хлорбензилсульфонилметил)-3-фенил- пропионил]-L-валил}-2S, 5S-диамино-1,6-дифенилгексан-3R, 4R-диол.
Синтез осуществляли аналогичным описанному в примере 13 способом.
Синтез исходной -2-/n-хлорбензилсульфонилметил/-3-фенилпропионовой кислоты осуществляли аналогично описанному в литературе (J. Med. Chem, 31, 1839 (1988)) способом.
Масс-спектр (FAB): 1191 (М+2Н+Na)+, 1189 (М+Na)+.
ЯМР (270 мГц, ДМСО <D6>): 0,52 (м, 6Н), 0,74 (м, 6Н), 1,83 (м, 2Н), 2,42-2,95 (м, 10Н), 3,28-3,54 (м, 6Н), 3,90-4,70 (м, 10Н), 6,98-7,47 (м, 30Н), 8,03 (м, 2Н).
П р и м е р 124. N,Nl-бис-[N-тозил- β -нафтил-аланил-L-валил]-2S, 5S-диамино-1,6-дифенилгексан-3R, 4R-диол.
Синтез осуществляли аналогичным описанному в примере 6 способом.
Масс-спектр (FAB): 1223 (M+Na)+.
ЯМР (270 мГц, ДМСО < D6>): 0,66 (м, 12Н), 1,80 (м, 2Н), 2,13 (с, 6Н), 2,50-2,90 (м, 8Н), 3,30 (м, 2Н), 3,98-4,67 (м, 8Н), 6,70-8,00 (м, 38Н).
П р и м е р 125. N,Nl-бис-(N-мезил- β -нафтил-аланил-L-валил)-2S, 5S-диамино-1,6-дифенилгексан-3R, 4R-диол.
Синтез осуществляли аналогичным описанному в примере 6 способом.
Масс-спектр (FAB): 1072 (M+Na)+, 838.
ЯМР (270 мГц, ДМСО 6): 0,74(м, 12Н), 1,82 (м, 6Н), 1,87 (м, 2Н), 2,55-3,08 (м, 8Н), 3,25 (м, 2Н), 4,02 (м, 2H), 4,22 (м, 2Н), 4,47 (м, 2Н), 4,70 (м, 2Н), 7,00-8,00 (м, 30Н).
П р и м е р 126. N-{[2R-(1,1-диметилэтилсульфонилметил)-3-фенилпропионил] -L- валил}-Nl-[(2-(1,1-диметилэтилсульфонилметил)-3-фенил-пропионил)-L- валил]-2S, 5S-диамино-1,6-дифенилгексан-3R, 4R-диол.
Указанное соединение является побочным продуктом синтеза в соответствии с примером 52.
Rf=0,17 (ЕЕ), в примере 52 Rf=0,35 (ЕЕ).
Масс-спектр (FAB): 1053 (М+Na)+.
ЯМР (270 мГц, ДМСО <D6>): 0,47 (д, 7 Гц, 3Н), 0,48 (д, 7 Гц, 3Н), 0,70 (д, 7 Гц, 3Н), 0,75 (д, 7 Гц, 3Н), 1,14 (с, 9Н), 1,27 (с, 9Н), 1,82 (м, 2Н), 2,60-3,00 (м, примерно 10Н), 3,08-3,35 (м, примерно 3Н), 3,38-3,58 (м, 3Н), 3,91 (двойной д, 8 Гц, 6 Гц, 1Н), 4,06 (м, 1Н), 4,27 (д, 5 Гц, 1Н), 4,35- 4,54 (м, 3Н), 7,00-7,38 (м, 22Н), 7,93 (д, 8 Гц, 2Н), 8,04 (д, 8 Гц, 2Н).
Нижеследующие соединения примеров 127-134 получали аналогичными описанными в примерах 6 или 16 способами.
П р и м е р 127. N,Nl-бис-[трет-бутоксикарбонил-L-валил]-2R, 5R-диамино-1,6-дифенилгексан-3R, 4R-диол.
Масс-спектр (FAB), 699 (М+Н)+, 599, 499.
П р и м е р 128. N,Nl-бис-[трет-бутоксикарбонил-L-валил]-2S, 5S-диамино-1,6-дициклогексилгексан-3S, 4S-диол.
Масс-спектр (FAB)/LiI) 717 (M+Li)+.
П р и м е р 129. N,Nl-бис-[трет-бутоксикарбонил-L-циклогексилглицин]-2S, 5S-диамино-1,6-дифенилгексан-3R, 4R-диол.
Масс-спектр (FAB): 801 (М+Na)+, 779, (М+Н)+ 679.
П р и м е р 130. N,Nl-бис-[трет-бутоксикарбонил-L-аспарагинил]-2S, 5S-диамино-1,6-дифенилгексан-3R, 4R-диол.
Масс-спектр (FAB): 729 (М+Н)+, 629.
П р и м е р 131. N,Nl-бис-(L-валил)-2S, 5S-диамино-1,6-дициклогексил-гексан-3S, 4S-диол дигидрохлорид.
П р и м е р 132. N,Nl-бис-(N6-бензоксикарбонил-L-лизил)-2S, 5S-диамино-1,6-дифенилгексан-3R, 4R-диол дигидрохлорид.
П р и м е р 133. N,Nl-бис-(глицил)-2S, 5S-диамино-1,6-дифенилгексан-3S, 4S-диол дигидрохлорид.
Масс-спектр (FAB): 415 (М+Н)+.
П р и м е р 134. N,Nl-бис-(трет-бутоксикарбонилглицил)-2S, 5S-диамино-1,6-дифенилгексан-3S, 4S-диол.
Масс-спектр (FAB): 615 (М+Н)+.
Следующие соединения примеров 135-140 получали аналогичными описанными в примерах 23 и 24 способами.
П р и м е р 135. бис-[N-((N2-трет-бутоксикарбонил-L-лизил)- L-лейцил)-2S-амино-3-фенилпропил]-амин тригидрохлорид.
Масс-спектр (FAB): 966 (М+Н)+.
П р и м е р 136. бис-[N-(трет-бутоксикарбонил-2S-амино-3-циклогексил-пропил] амин гидрохлорид.
Масс-спектр (FAB): 496 (М+Н)+.
П р и м е р 137. бис-[N-(L-лейцил)-2S-амино-3-фенилпропил]-амин тригидрохлорид.
Масс-спектр (FAB): 510 (М+Н)+.
П р и м е р 138. бис-N-(трет-бутоксикарбонил-L-лейцил)-2S-амино-3-фенил-пропил-амин.
Масс-спектр (FAB): 710 (М+Н)+.
П р и м е р 139. бис-[2S-амино-3-фенилпропил]-амин тригидрохлорид.
Масс-спектр (FAB): 284 (М+Н)+.
П р и м е р 140. бис-[N-(бензилоксикарбонил-L-валил)-2-S-амино-3- фенилпропил]-амин.
Масс-спектр (FAB): 750 (М+Н)+.
П р и м е р 141. бис-[N-трет-бутоксикарбонил-2S-амино-3-метилбутил]-амин гидрохлорид.
Синтез осуществляли аналогичным описанному в примере 25 способом.
Масс-спектр (FAB): 338 (М+Н)+.
П р и м е р 142. N,Nl-бис-[(2S-(1,1-диметилэтилсульфонилметил)-3- (1-нафтил)- пропионил)-L-валил] -3S, 6S-диамино-1,8-ди)-(4-пиридил)-октан-4R, 5R-диол.
Синтез осуществляли аналогичным описанному в примере 13 способом, используя в качестве исходного материала соединение в соответствии с примером 27а.
ЯМР (270 мГц, ДМСО <D6>): 0,83, (м, 12Н), 1,14 (с, 18Н), 1,66 (м, 2Н), 1,82 (м, 2Н), 2,00 (м, 2Н), 2,50-2,78 (м, 4Н), 2,86 (м, 2Н), 3,06-3,63 (м, 10Н), 4,02 (м, 2Н), 4,14 (м, 2Н), 4,69 (м, 2Н), 7,30-7,60 (м, 14 Н), 7,74 (м, 8Гц, 2Н), 7,87 (м, 2Н), 8,16 (м, 2Н), 8,32 (д, 8 Гц, 2Н), 8,58 (м, 4Н).
Масс-спектр (FAB): 1161 (М+Н)+.
П р и м е р 143. N,Nl-бис-[(2-(1,1-диметилэтилсульфонилметил)-3-(1-нафтил -пропионил)-L-валил]-1,4-диаминобутан-2R, 3R-диол.
Синтез осуществляли аналогичным описанному в примере 13 способом, используя в качестве исходного материала соединение в соответствии с примером 112а.
ЯМР (270 мГц, ДМСО <D6>): 0,82 (д, 6 Гц, 12Н), 1,17 (с, 18Н), 1,92 (м, 2Н), 2,92-3,08 (м, 4Н), 3,16-3,53 (м, 10Н), 3,53 (двойной д, 12,8 Гц, 2Н), 4,11 (двойной д, 8,0 Гц, 7,2 Гц, 2Н), 4,55 (д, 4,8 Гц, 2Н), 7,38-7,67 (м, 10Н), 7,80 (м, 2Н), 7,92 (м, 2Н), 8,12 (д, 8,4 Гц, 2Н), 8,20 (д, 8 Гц, 2Н).
Масс-спектр (FAB): 973 (М+Na)+, 951 (N+H)+.
П р и м е р 144. N,Nl-бис-[трет-бутоксикарбонил-L-фенилаланил -L-валил] -1,4-диаминобутан.
Синтез осуществляли аналогичным описанному в примере 6 способом.
ЯМР (270 мГц, <D6>): 0,83 (д, 6 Гц, 12Н), 1,28 (с, 18Н), 1,39 (м, 4Н), 1,91 (м, 2Н), 2,74 (двойной д, 12,8 Гц,9,6 Гц, 2Н), 2,89-3,16 (м, 6Н), 4,08-4,23 (м, 4Н), 7,02 (д, 8 Гц, 2Н), 7,14-7,30 (м, 10Н), 7,63 (д, 8,4 Гц, 2Н), 7,95 (м, 2Н).
Масс-спектр (FAB): 781 (М+Н)+, 681, 581.
П р и м е р 145. N,Nl-бис-[L-фенилаланил-L-валил]-1,4-диаминобутан-дигидро- хлорид.
Синтез осуществляли аналогичным описанному в примере 16 способом, используя в качестве исходного материала соединение в соответствии с примером 144.
Масс-спектр (FAB): 581 (М+Н)+.
П р и м е р 146. N,Nl-бис-[(2S-(1,1-диметилэтилсульфонилметил)-3- (1-нафтил-пропионил)-L-валил]-1,4-диаминобутан.
Синтез осуществляли аналогичным описанному в примере 13 способом.
ЯМР (270 мГц, ДМСО <D6>): 0,82 (д, 6 Гц, 12Н), 1,19 (с, 18Н), 1,32 (м, 4Н), 1,89 (м, 2Н), 2,98 (м, 4Н), 3,32 (м, 2Н), 3,42 (м, 6Н), 3,54 (двойной д, 12,8Гц, 8 Гц, 2Н), 4,04 (т, J=8 Гц, 2Н), 7,38 (м, 4Н), 7,53 (м, 6Н), 7,79 (м, 2Н), 7,92 (м, 2Н), 8,08 (д, 8 Гц, 2Н), 8,21 (м, 2Н).
Масс-спектр (FAB)L 941 (М+Na)+, 919 (М+Н)+.
П р и м е р 147. N,Nl-бис-(трет-бутоксикарбонил-L-фенилаланил-L-валил)-3,6- диамино-1,8-дифенилоктан-4R, 5R-диол.
Синтез осуществляли аналогичным описанному в примере 6 способом, используя в качестве исходного материала 3S, 6S-диамино-1,8-дифенилоктан-4R, 5R-диол дигидрохлорид. Этот последний получали аналогичным описанному в примере 2, 2в, 2с и 2е способом из 1,2R-5R-, 6,3,4-O-изопропилиден-3R, 4R-диола и бензиллития.
Масс-спектр (FAB)LiI): 1027 (М+Li)+, 927, 827.
ЯМР (270 мГц, ДМСО <D6>): 0,88 (м, 12Н), 1,28 (с, 18Н), 1,57-1,86 (м, 4Н), 2,01 (м, 2Н), примерно 2,4-2,6 (м, примерно 4Н), 2,75 (двойной д, 11 Гц, 14 Гц, 2Н), 2,98 (двойной д, 14 Гц, 4 Гц, 2Н), примерно 3,32 (м, примерно 2Н), 4,06-4,26 (м, 4Н), 4,32 (двойной д, 6 Гц, 8 Гц, 2Н), 4,62 (м, 2Н), 7,00 (д, 8 Гц, 2Н), 7,10-7,32 (м, 20Н), 7,62 (д, 10 Гц, 2Н), 7,75 (д, 8 Гц, 2Н).
П р и м е р 148. N,Nl-бис-(L-фенилаланил-L-валил)-3S, 6S-диамино-1,8-дифенил-окран-4R, 5R-диол дигидрохлорид.
Синтез осуществляли аналогичным описанному в примере 16 способом из соединения в соответствии с примером 147.
Масс-спектр (FAB): 821 (М+Н)+, 843 (М+Na)+.
П р и м е р 149. N,Nl-бис-([2S-(1,1-диметилэтилсульфонилметил)-3-(1-нафтил)- пропионил]-L-валил)-3S, 6S-диамино-1,8-дифенилоктан-4R, 5R-диол.
Синтез осуществляли аналогичным описанному в примере 13 способом из соединения в соответствии с примером 147.
Масс-спектр (FAB LiI): 1165 (М+Li)+.
ЯМР (270 мГц, ДМСО <D6>): 0,92 (д, 7 Гц, 12Н), 1,13 (с, 18Н), 1,6-1,85 (м, 4Н), 2,04 (м, 2Н), 2,40-2,64 (м, 4Н), 2,82 (двойной м, 14 Гц, 2Н), 3,18 (м, 2Н), 3,32-3,52 (м, 6Н), 3,58 (м, 2Н), 4,08 (м, 2Н), 4,22 (т, 8 Гц, 2H), 7,1-7,56 (м, 20Н), 7,72 (двойной д, 4 Гц, 2Н), 7,88 (м, 2Н), 8,32 (д, 8 Гц, 2Н).
П р и м е р 150. N,Nl-бис-(трет-бутоксикарбонил-L- фенилаланил-L-валил)-6S, 9S-диаминотетрадекан-7R, 8R-диол.
Синтез осуществляли аналогичным описанному в примере 6 способом, используя в качестве исходного соединения 6S, 9S-диамино-тетрадекан-7R, 8R-диол дигидрохлорид. Последний получали аналогичным описанному в примере 2, 2в, 2с и 2е способом из 1,2R-5R, 6-диэпокси-3,4-О-изопропилиден-3R, 4R-диола и н-бутиллития.
Масс-спектр (FAB(Li)): 959 (М+Li)+.
ЯМР (270 мГц, ДМСО <D6>): 0,76-0,91 (м, 18Н), 1,12-1,54 (м, 16Н), 1,28 (с, 18Н), 1,98 (м, 2Н), 2,74 (двойной д, 12Гц, 14Гц, 2Н), 2,87 (двойной д, 14 Гц, 4 Гц, 2Н), 3,22 (м, 2Н), 3,98 (м, 2Н), 4,14-4,32 (м, 4Н), 4,46 (с, 2Н), 7,0 (д, 8 Гц, 2Н), 7,14-7,31 (д, 4Гц, 10Н), 7,38 (д, 9 Гц, 2Н), 7,70 (д, 9 Гц, 2Н).
П р и м е р 151. N,Nl-бис-(L-фенилаланил-L-валил)-6S, 9S-диамино-тетрадекан-7R, 8R-диол дигидрохлорид.
Синтез осуществляли аналогичным описанному в примере 16 способом, используя в качестве исходного материала соединение в соответствии с примером 150.
Масс-спектр (FAB): 753 (М+Н)+, 775 (M+Na)+, 735.
П р и м е р 152. N,Nl-бис-(<2S-(1,1-диметилэтилсульфонилметил)-3-(1-нафтил)- пропионил-L-валил)-6S, 9S-диаминотетрадекан-7R, 9R-диол.
Синтез осуществляли аналогичным описанному в примере 13 способом, используя в качестве исходного материала соединение в соответствии с примером 150.
Масс-спектр (FAB(Li):1097 (М+Li)+.
ЯМР (270 мГц, ДМСО <D6>): 0,76 (м, 6Н), 0,88 (д, 7 Гц, 12Н), 1,12 (с, 18Н), примерно 1,10-1,54 (м, 16Н), 2,02 (м, 2Н), 2,82 (двойной д, 12 Гц, 2 Гц, 2Н), 3,16 (двойной д, 12 Гц, 16 Гц, 2Н), 3,24 (м, 2Н), 3,36-3,52 (м, 4Н), 3,58 (двойной д, 8 Гц, 13 Гц, 13 Гц, 2Н), 3,98 (м, 2Н), 4,16 (т, 6Гц, 2Н), 4,44 (с, 2Н), 7,18 (д, 10 Гц, 2Н), 7,42-7,48 (м, 4Н), 7,49-7,62 (м, 4Н), 7,81 (м, 2Н), 7,92 (м, 2Н), 8,20 (д, 8Гц, 2Н), 8,30 (д, 8,4 Гц, 2Н).
П р и м е р 153. N,Nl-бис-(трет-бутоксикарбонил-L-фенилаланил-L- валил)-2S, 5S-диамино-1,6-бис-(3,4-метилендиоксифенил)- гексан)-3R, 4R-диол.
Синтез осуществляли аналогичным описанному в примере 6 способом, используя в качестве исходного соединения 2S, 5S-диамино-1,6-бис-(3,4-метилендиоксифенил)-ге- ксан-3R, 4R-диол дигидрохлорид (последний получали аналогичным описанному в примере 2, 2в, 2с и 2в способом из 1,2R-5R,6-диэпокси-3,4-О-изопропилиден-3R, 4R-диола и 3,4-метилендиоксифениллития).
Масс-спектр (FAB): 1103 (М+Na)+, 1081 (М+Н)+.
ЯМР (270 мГц, ДМСО <D6>): 0,73 (д, 6 Гц, 6Н), 0,76 (д, 6 Гц, 6Н), 1,28 (с, 18Н), 1,87 (м, 2Н), 2,52-2,78 (м, 6Н), 2,91 (двойной д, 14 Гц, 4 Гц, 2Н), 3,26 (м, 2Н), 4,11-4,22 (м, 4Н), 4,35 (м, 2Н), 4,66 (м, 2Н), 5,84 (с, 2Н), 5,86 (с, 2Н), 6,63 (д, 8 Гц, 2Н), 6,69 (д, 8 Гц, 2Н), 6,75 (с, 2Н), 6,99 (д, 9 Гц, 2Н), 7,13-7,33 (м, 10Н), 7,45 (д, 9 Гц, 2Н), 7,59 (д, 9 Гц, 2Н).
П р и м е р 154. N,Nl-бис-(L-фенилаланил-L-валил)-2S, 5S-диамино-1,6-бис-(3,4-метилендиоксифенил)-гексан-3R, 4R-диол дигидрохлорид.
Синтез осуществляли аналогичным описанному в примере 16 способом, используя в качестве исходного материала соединение в соответствии с примером 153.
Масс-спектр (FAB): 881 (М+Н)+, 863.
П р и м е р 155. N,Nl-бис-(< 2S-(1,1-диметилэтилсульфонилметил)-3-(1-нафтил)- пропионил-L-валил)-2S, 5S-диамино-1,6-бис-(3,4-метилендиоксифенил)-гексан-3R, 4R-диол.
Синтез осуществляли аналогичным описанному в примере 13 способом, используя в качестве исходного материала соединение в соответствии с примером 153.
Масс-спектр (FAB): 1241 (М+Na)+, 1219 (М+Н)+.
ЯМР (270 мГц, ДМСО <D6>): 0,73 (д, 7 Гц, 6 Н), 0,78 (д, 7 Гц, 6Н), 1,10 (с, 18Н), 1,89 (м, 2Н), 2,55-2,72 (м, 4Н), 2,79 (дм, 14 Гц, 2Н), 3,08 (двойной д, 14 Гц, 10Гц, 2Н), примерно 3,22-3,43 (м, примерно 6Н), 3,58 (двойной д, 14 Гц, 10Гц, 2Н), 4,07 (м, 2Н), 4,45 (м, 2Н), 4,49 (м, 2Н), 5,75 (с, 2Н), 5,78 (с, 2Н), 6,68 (с, 2Н), 6,80 (с, 2Н), 7,25 (д, 9 Гц, 2Н), 7,39-7,45 (м, 4Н), 7,54 (м, 6Н), 7,80 (м, 2Н), 7,92 (м, 2Н), 8,15-8,25 (м, 4Н).
П р и м е р 156. N,Nl-бис-(< 2S-(1,1-диметилэтилсульфонилметил)-3- (1-нафтил)-пропионил-L-изолейцил)-2S, 5S-диамино-1,6-дифенилгексан-3R, 4R-диол.
Синтез осуществляли аналогичным описанному в примере 13 способом.
Масс-спектр (FAB): 1181 (М+Na)+.
ЯМР (270 мГц, ДМСО <D6>): 0,63 (д, 7Гц, 6Н), 0,78 (т, 7Гц, 6Н), 0,99 (м, 2Н), 1,11 (с, 18Н), 1,32 (м, 2Н), 1,64 (м, 2Н), 2,63-2,88 (м, 6Н), 3,07 (двойной д, 15 Гц, 11 Гц, 2Н), примерно 3,28-3,43 (м, примерно 6Н), 3,58 (двойной д, 14 Гц, 8 Гц, 2Н), 4,09 (т, 8 Гц, 2Н), 4,48-4,62 (м, 4Н), 7,03 (м, 2Н), 7,12-7,31 (м, 10Н), 7,43 (м, 4Н), 7,54 (м, 4Н), 7,81 (м, 2Н), 7,92 (м, 2Н), 8,15-8,25 (м, 4Н).
П р и м е р 157. N,Nl-бис-(N2-гексадецилсульфонил>-L-лизил-L-валил)-2S, 5S-диамино-1,6-дифенилгексан-3R, 4R-диол.
Синтез осуществляли аналогичным описанному в примерах 11 и 53 способом.
Масс-спектр (FAB): 1330 (М+Н)+.
П р и м е р 158. N,Nl-бис-(N2-<тетрадеканоил> L-лизил-L-валил)-2S, 5S-диамино-1,6-дифенилгексан-3R, 4R-диол.
Синтез осуществляли аналогичным описанному в примерах 11 и 58 способом.
ЯМР (FAB): 1174 (М+Н)+.
П р и м е р 159. N,Nl-бис-(трет-бутоксикарбонил-L-фенилаланил-L-аспарагинил)-2S, 5S-диамино-1,6-дифенилгексан-3R, 4R-диол.
Синтез осуществляли аналогичным описанному в примере 6 способом.
Масс-спектр (FAB): 1054 (М+Na)+.
ЯМР (270 мГц, ДМСО < D6>): 1,27 (с, 18Н), 2,20-2,78 (м, 10Н), 2,90 (м, 2Н), 3,30 (м, 2Н), 4,14 (м, 2Н), 4,28 (м, 2Н), 4,45 (м, 2Н), 4,64 (с, 2Н), 6,88 (с, 4Н), 7,02-7,37 (м, 2Н), 8,04 (м, 8Гц, 2Н).
П р и м е р 160. N,Nl-бис-(L-фенилаланил-L-аспарагинил)-2S, 5S-диамино-1,6-дифенилгексан-3R, 4R-диол.
Синтез осуществляли аналогичным описанному в примере 16 способом, используя в качестве исходного материала соединение в соответствии с примером 159.
Масс-спектр (FAB): 823 (М+Н)+.
П р и м е р 161. N,Nl-бис-(<2S-(1,1-диметилэтилсульфонилметил)-3-(1-нафтил)- пропионил>-аспарагинил)-2S, 5S-диамино-1,6-дифенилгексан-3R, 4R-диол.
Синтез осуществляли аналогичным описанному в примере 13 способом.
Масс-спектр (FAB): 1183 (M+Na)+.
ЯМР (270 мГц, ДМСО <D6>): 1,17 (с, 18Н), 2,22 (м, 2Н), 2,37-2,76 (м, 10Н), 2,90 (м, 2Н), 3,25 (м, 4Н), 3,58 (м, 2Н), 4,25 (м, 2Н), 4,40 (м, 2Н), 4,62 (м, 2Н), 6,93-7,60 (м, 24Н), 7,77 (м, 2Н), 7,90 (м, 2Н), 8,22 (м, 8 Гц, 2Н), 8,33 (д, 8Гц, 2Н).
П р и м е р 162. N,Nl-бис-[<2-(1,1-диметилэтилсульфонилметил(-3-(4-пиридил)- пропионил>L-валил] -2S- 5S-диамино-1,6-дифенилгексан-3R, 4R-диол дигидрохлорид.
Синтез осуществляли аналогично описанному в примере 13 способом. В качестве рацемата для сочетания использовали 2-(1,1-диметилэтилсульфонилметил)-3-(4-пиридил)-пропионовую кислоту. Диастереомерные продукты разделяли с помощью хроматографии. Подвижная фаза: смесь уксусного этила, метанола и ледяной уксусной кислоты в соотношении 60:40:1.
Значения Rf: a) Rf=0,50, b) Rf=0,44, c) Rf=0,33.
Масс-спектр (FAB):
а) изомер 1: 1055 (M+Na)+, 1033 (M+H)+;
b) изомер 2: 1055 (M+Na)+, 1033 (M+H)+;
c) изомер 3: 1055 (M+Na)+.
ЯМР (270 мГц, ДМСО <D6>):
a) изомер 1: 0,68 (д, 7 Гц, 6Н), 0,74 (д, 7Н Гц, 6Н), 1,19 (с, 18Н), 1,83 (м, 2Н), 2,53-2,94 (м, 10Н), примерно 3,2-3,45 (м, примерно 10Н), 3,53 (двойной д, 14 Гц, 9 Гц, 2Н), 4,06 (двойной д, 9 Гц, 7 Гц, 2Н), 4,52 (м, 2Н), 7,05 (м, 2Н), 7,10-7,25 (м, 8Н), 7,28 (д, 6Гц, 4Н), 7,53 (д, 9 Гц, 2Н), 7,53 (д, 9Гц, 2Н), 8,19 (д, 9 Гц, 2Н), 8,46 (д, 6 Гц, 4Н).
b) изомер 2: 0,38 0,44, 0,65, 0,73 (4 д. все 7 Гц, все 3Н), 1,18, 1,28 (2с, каждый 9Н), 1,70-1,83 (м, 2Н), 2,54-3,05 (м, примерно 11Н), 3,15-3,60 (м, примерно 10Н), 3,87 (двойной д, 8 Гц, 6 Гц, 1Н), 4,03 (двойной д, 9 Гц, 7 Гц, 1Н), 4,36-4,52 (м, 2Н), примерно 4,4-5,0 (1Н), 7,00-7,30 (м, 14Н), 7,41, 7,58, 8,18, 8,27 (4 д, каждый 9 Гц, каждый 1Н), 8,43, 8,46 (2д, каждый 6 Гц, каждый 1Н).
с) изомер 3: 0,34 (д 7Гц, 6Н), 0,40 (д, 7 Гц, 6Н), 1,31 (с, 18Н), 1,73 (м, 2Н), 2,60-3,07 (м, 12Н), 3,26 (м, 2Н), 3,38-3,58 (м, 4Н), 3,81 (двойной д, 8 Гц, 6 Гц, 2Н), 4,42 (м, 2Н), примерно 4,3-5,3 (2Н), 7,03-7,30 (м, 14Н), 7,43 (д, 9 Гц, 2Н), 8,28 (д, 9 Гц, 2Н), 8,43 (д, 6 Гц, 4Н).
П р и м е р 163. N,Nl-бис-(<2-(1,1-диметилэтилсульфонилметил)-3-(N-оксидо-4- пиридил)-пропионил>L-валил)-2S, 5S-диамино-1,6-дифенилгексан-3R, 4R-диол.
Синтез осуществляли аналогичным описанному в примере 162 способом. 2-(1,1-диметилэтилсульфониметил)-3-(N-оксидо-4-пиридил)- пропионовая кислота образуется на предшествующей стадии при окислении 2-(1,1-диметилэтилтиометил)-3-(4-пиридил)-пропионовой кислоты не двумя, как в случае примера 162, а тремя эквивалентами калийпропоксимоносульфата (оксон® ).
Масс-спектр (FAB): 1065 (М+Н)+.
П р и м е р 164. N,Nl-бис-(бис-(1,1-диметилэтилтиометил)-ацетил >L-валил-2S, 5S-диамино-1,6-дифенилгексан-3R, 4R-диол.
Синтез осуществляли аналогичным описанному в примере 13 способом. Синтез бис-(1,1-диметилэтилтиометил)-уксусной кислоты, осуществляли путем взаимодействия диэтилового эфира бис-(оксиметил)-малоновой кислоты с бромистым водородом и последующего замещения полученной, β,βl-дибромизомасляной кислоты трет-бутсульфидом калия.
Масс-спектр (FAB): 990 (М+Н)+.
ЯМР (270 мГц, CDCl3): 0,59 (д, 7Гц, 6Н), 0,85 (д, 7Гц, 6Н), 1,29 (с, 18Н), 1,33 (с, 18Н), 2,16 (м, 2Н), 2,42 (м, 2Н), 2,70-3,02 (м, 14Н), 3,48 (широкий с, 2Н), 4,13 (м, 2Н), 4,28 (м, 2Н), 5,33 (д, 8 Гц, 2Н), 6,47 (д, 8Гц, 2Н), 7,20-7,28 (м, 10Н).
П р и м е р 165. N,Nl-бис-(<бис-(1,1-диметилэтилсульфонилметил)-ацетил>L-валил)-2S, 5S-диамино-1,6-дифенилгексан-3R, 4R-диол.
Синтез осуществляли аналогично описанному в примерах 164 и 13 способом.
Масс-спектр (FAB): 1118 (М+Н)+.
П р и м е р 166. N,Nl-бис-(<1-нафтил>-ацетил-L-валил)-2S, 5S-диамино-1,6-дифенилгексан-3R, 4R-диол.
Синтез осуществляли аналогичным описанному в примере 58 способом.
Масс-спектр (FAB): 834 (М+Н)+.
П р и м е р 167. N,Nl-бис(<1-нафтилокси>-ацетил-L-валил)-2S, 5S-диамино-1,6-дифенилгексан-3R, 4R-диол.
Синтез осуществляли аналогичным описанному в примере 58 способом.
Масс-спектр (FAB): 866 (М+Н)+.
П р и м е р 168. N,Nl-бис-(<2S-(1,1-диметилэтилсульфонилметил)-3- (1-нафтилпропионил>L-валил)-2S, 5S-диамино-1,6-бис-(4-трет-бутилфенил)- гексан-3R, 4R-диол.
Синтез осуществляли аналогичным описанному в примере 6 способом из 2S, 5S-диамино-1,6-бис-(4-трет-бутоксифенил)-гекс-ан-3R, 4R-диол дигидрохлорида, который получали аналогично описанному в примере 2, 2в, 2с и 2е способом из 1,2R-5R, 6-диэпокси-3,4-О-изопропилиден-3R, 4R-диола и 4-трет-бутилфениллития.
Масс-спектр (FAB): 1265 (М+Н)+.
ЯМР (270 мГц, ДМСО <D6>): 0,67 (д, 7 Гц, 6Н), 0,76 (д, 7 Гц, 6Н), 1,09 (с, 18Н), 1,11 (с, 18Н), 1,87 (м, 2Н), 2,60-2,85 (м, 6Н), 3,08 (двойной д, 14 Гц, 12 Гц, 2Н), 3,25-3,50 (м, 8Н), 3,60 (двойной д, 14 Гц, 9 Гц, 2Н), 4,06 (м, 2Н), 4,52 (м, 2Н), 7,10-7,22 (м, 8Н), 7,27 (д, 9 Гц, 2Н), 7,34-7,62 (м, 8Н), 7,80 (м, 2Н), 7,92 (м, 2Н), 8,22 (д, 8 Гц, 4Н).
П р и м е р 169. N,Nl-бис-(<2S-(1,1-диметилэтилсульфонилметил(-3- (1-нафтил)-пропионил>L-валил)-2S, 5S-диамино-1,6-бис-(2,4-диметоксифенил)-гексан-3R, 4R-диол.
Синтез осуществляли аналогичным описанному в примере 6 способом, используя в качестве исходного материала 2S, 5S-диамино-1,6-бис-(2,4-диметоксифенил)-гексан-3R, 4R-диол дигидрохлорид. Последний получали аналогичным описанному в примере 2, 2в, 2с и 2е способом из 1,2R-5R,6-диэпокси-3,4-О-изопопилиден-3R, 4R-диола и 2,4-диметоксифениллития.
Масс-спектр (FAB): 1250 (М+Н)+.
П р и м е р 170. N,Nl-бис-(2-<4-пиридил> этилсульфонил-L-валил)-2S, 5S-диамино-1,6-дифенилгексан-3R, 4R-диол.
Синтез осуществляли аналогичным описанному в примере 58 способом.
Масс-спектр (FAB): 836 (М+Н)+.
П р и м е р 171. N,Nl-бис-(12-аминододеканоил-L-валил)-2S, 5S-диамино-1,6-дифенилгексан-3R, 4R-диол.
Синтез осуществляли аналогичным описанному в примере 58 способом.
Масс-спектр (FAB): 892 (М+Н)+.
П р и м е р 172. N,Nl-бис-(<2-хинолилкарбонил> -L-валил)-2S, 5S-диамино-1,6-дифенилгексан-3R, 4R-диол.
Синтез осуществляли аналогичным описанному в примере 58 способом.
Масс-спектр (FAB): 831 (М+Na)+, 809 (М+Н)+.
ЯМР (270 мГц, ДМСО <D6>): 0,80 (д, 7 Гц, 6Н), 0,84 (д, 7 Гц, 6Н), 2,65 (двойной д, 14 Гц, 2Н), 2,83 (двойной д, 14 Гц, 10 Гц, 2Н), 3,34 (м, 2Н), 4,43 (двойной д, 6 Гц, 9 Гц, 2Н), 4,55 (м, 2Н), 4,80 (м, 2Н), 6,86 (м, 2Н), 7,07 (т, 8 Гц, 4Н), 7,22 (д, 8 Гц, 4Н), 7,74 (м, 2Н), 7,89 (м, 4Н), 7,89 (м, 4Н), 8,12 (д, 8 Гц, 2Н), 8,19 (м, 4Н), 8,57 (д, 9 Гц, 2Н), 8,61 (д, 9 Гц, 2Н).
П р и м е р 173. N,Nl-бис-(<2-хинолилкарбонил>-L-аспарагинил)-2S, 5S-диамино-1,6-дифенилгексан-3R, 4R-диол.
Синтез осуществляли аналогичным описанному в примере 58 способом.
Масс-спектр (FAB): 861 (М+Na)+.
ЯМР (270 мГц, ДМСО <D6>): 2,33-2,78 (м, 8Н), 3,30 (м, 2Н), 4,33 (м, 2Н), 4,70 (м, 4Н), 4,70 (м, 4Н), 6,80-8,22 (м, 26Н), 8,59 (д, 8 Гц, 2Н), 8,92 (д, 8 Гц, 2Н).
П р и м е р 174. N,Nl-бис-(трет-бутоксикарбонил)-2S, 4S-диамино-1,5-дифенил-пептан-3-ол.
2,3 г трет-бутоксикарбонил-L-фенилаланила растворяли в 10 мл этанола. После добавления при 0оС 0,05 мг тетраметилгуинидина и раствора 2,42 г 2-нитро-1-фенилэтана в 2 мл этанола смесь нагревали до комнатной температуры и перемешивали в течение ночи. Раствор затем упаривали, а остаток в виде светлой маслянистой жидкости (4,8 г) использовали непосредственно на последующей стадии.
4,7 г полученной маслянистой жидкости растворяли в 70 мл этанола и после добавления 0,1 мл ледяной уксусной кислоты и 1 г никеля Ренеля раствор встряхивали в течение 16 часов при 50оС и 25 ат в стеклянной емкости в автоклаве. Катализатор затем отфильтровывали и элюат упаривали до получения маслянистой жидкости. Остаток растворяли в смеси воды и 1 н. HCl и четырежды экстрагировали уксусным эфиром. Эфирный экстракт упаривали (2,6 г) и непосредственно использовали на последующей стадии.
2,57 г полученного амино-производного растворяли в 25 мл диоксана при комнатной температуре. После добавления 0,86 мл триэтиламина и 1,7 г дитретбутилдикарбоната раствор перемешивали в течение еще 30 мин и затем концентрировали, а остаток смешивали с ледяной водой, уксусным эфиром и раствором КНSO4 до pH 2. Уксусноэфирную фазу промывали водным раствором NaCl, высушивали над безводным Na2SO4 и упаривали. В результате получали 3,3 г маслянистой жидкости, которую подвергали очистке с помощью хроматографии на силикагеле (подвижная фаза: смесь CH2Cl2, метанола и ледяной уксусной кислоты при соотношении 100:3:0,3). В результате получали 2,2 г целевого продукта в виде смеси диастереомеров.
Масс-спектр (FAB): 471 (М+Н)+, 371, 315.
П р и м е р 175. N,Nl-бис-(трет-бутоксикарбонил)-1,3-диаминопропан.
Масс-спектр (FAB): 495 (М+Na)+, 473 (М+Н)+.
ЯМР (270 мГц, CDCl3): 0,97 (д, 6 Гц, 12Н), 1,45 (с, 18Н), 1,70 (т, 6 Гц, 2Н), 2,03 (м, 2Н), 3,08 (м, 2Н), 3,58 (м, 2Н), 3,88 (двойной д, 2Н), 5,09 )д, 2Н), 7,21 (с, 2Н).
П р и м е р 176. N,Nl-бис-(трет-бутоксикарбонил)-1,3-диаминопропил-2-ол.
Масс-спектр (FAB): ( LiCl): 495 (M+Li)+.
ЯМР (270 мГц, CDCl3): 0,97 (двойной д, 12Н), 1,45 (с, 18Н), 2,04 (м, 2Н), 3,20 (м, 2Н), 3,61 (м, 2Н), 3,90 (двойной д, 2Н), 3,95 (м, 1Н), 5,16 (двойной д, 2Н), 7,18 (с, 1Н), 7,49 (с, 1Н).
П р и м е р 177. N,Nl-бис-(трет-бутоксикарбонил)-1,3-диаминоацетон.
Масс-спектр (FAB/LiCl): 493 (М+Li)+.
ЯМР (270 мГц, CDCl3): 0,98 (двойной д, 12Н), 1,45 (с, 18Н), 2,09 (м, 2Н), 3,94 (двойной д, 2Н), 4,10 (с, 2Н), 4,18 (с, 2Н), 5,20 (д, 2Н), 7,50 (с, 2Н).
П р и м е р 178. N,Nl-бис-(трет-бутоксикарбонил)-1,4-диаминобутан-2-он.
Масс-спектр (FAB): 523 (М+Na)+, 501 (М+Н)+.
ЯМР (270 мГц, CDCl3): 0,95 (м, 12Н), 1,43 (д, 18Н), 2,09 (м, 2Н), 2,69 (м, 2Н), 3,45 (м, 1Н), 3,86 (м, 1Н), 3,90 (м, 1Н), 3,99 (м, 1Н), 4,18 (м, 1Н), 5,23 (д, 2Н), 6,91 (с, 1Н), 7,17 (с, 1Н).
В примерах 175-178 целевое соединение получали аналогично описанному в примере 174 способом (введение Вос-защитной группы).
П р и м е р 179. N,Nl-бис-(ди-(1-нафтилметил)-ацетил-L-валил)-2S, 5S-диамино-1,6-дифенил-гексан-3R, 4R-диол.
Синтез проводили аналогично примеру 58.
Масс-спектр (FAB): 1165 (М+Na)+, 1143 (М+Н)+.
ЯМР (270 мГц, ДМСО <D6>): 0,36 (д, 7 Гц, 6Н), 0,42 (д, 7 Гц, 6Н), 1,62 (м, 2Н), 2,57-2,80 (м, 4Н), 2,90-3,42 (м, са, 12Н), 3,96 (т, 8 Гц, 2Н), 4,38 (м, 2Н), 4,63 (м, 2Н), 6,98-7,54 (м, 30Н), 7,67-7,96 (м, 12Н).
П р и м е р 180. N,Nl-бис-[12-(трет-бутоксикарбониламино)-додеканоил-L-валил)] -2S, 5S-диамино-1,6-дифенил-гексан-3R, 4R-диол.
Синтез проводили аналогично примеру 58.
Масс-спектр (FAB): 1115 (М+Na)+, 1093 (М+Н)+, 993.
ЯМР (270 мГц, ДМСО <D6>): 0,68 (д, 7 Гц, 6Н), 0,72 (д, 7 Гц, 6Н), 1,10-1,54 (м, 54Н), 1,82 (м, 2Н), 2,08 (м, 4Н), 2,55-2,82 (м, 4Н), 2,88 (м, 4Н), 3,35 (м, 2Н), 4,04 (м, 2Н), 4,42 (м, 2Н).
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ТОРМОЖЕНИЯ РЕТРОВИРУСНЫХ ПРОТЕАЗ | 1991 |
|
RU2028155C1 |
| ПРОИЗВОДНЫЕ ЭТИЛЕНДИАМИНА И СОДЕРЖАЩИЕ ИХ ИНГИБИТОР FXa И АНТИКОАГУЛЯНТ | 2001 |
|
RU2268259C2 |
| КОНЪЮГАТ ЛИГАНДА С ЦИТОТОКСИЧЕСКИМ ЛЕКАРСТВЕННЫМ СРЕДСТВОМ, СПОСОБ ЕГО ПОЛУЧЕНИЯ И ПРИМЕНЕНИЕ | 2016 |
|
RU2708461C2 |
| СОЕДИНЕНИЯ - ПРОИЗВОДНЫЕ СУЛЬФАМАТА ДЛЯ ПРИМЕНЕНИЯ ПРИ ЛЕЧЕНИИ ИЛИ СМЯГЧЕНИИ БОЛИ | 2014 |
|
RU2699025C1 |
| ПРОИЗВОДНЫЕ ЦИКЛОГЕКСАНА ИЛИ ТЕТРАГИДРОПИРАНА, ИЛИ ИХ ФАРМАЦЕВТИЧЕСКИ ПРИЕМЛЕМЫЕ СОЛИ, ИЛИ ГИДРАТЫ, ИЛИ СОЛЬВАТЫ ЭТИХ СОЕДИНЕНИЙ, ИЛИ ИХ СОЛЕЙ, ПРОМЕЖУТОЧНЫЕ СОЕДИНЕНИЯ ДЛЯ ИХ ПОЛУЧЕНИЯ И ФУНГИЦИДНОЕ СРЕДСТВО | 1992 |
|
RU2084439C1 |
| КОМБИНИРОВАННОЕ ЛЕЧЕНИЕ АГОНИСТОМ ТОЛЛ-ПОДОБНОГО РЕЦЕПТОРА (TLR7) И ИНГИБИТОРОМ СБОРКИ КАПСИДА ВИРУСА ГЕПАТИТА В | 2016 |
|
RU2718917C2 |
| ПРОИЗВОДНЫЕ ДИАМИНОВ | 2002 |
|
RU2319699C2 |
| ГИПОГЛИКЕМИЧЕСКОЕ ЛЕКАРСТВЕННОЕ СРЕДСТВО, СОДЕРЖАЩЕЕ ПОЛИГИДРОКСИБУТИЛПИРАЗИНЫ, НОВЫЕ ПОЛИГИДРОКСИБУТИЛПИРАЗИНЫ И СПОСОБЫ ИХ ПОЛУЧЕНИЯ | 1998 |
|
RU2186773C2 |
| ПРОИЗВОДНЫЕ ДИАМИНА | 2002 |
|
RU2314303C2 |
| ПРЕДШЕСТВЕННИКИ ВИТАМИНА D, СПОСОБ ИХ ПОЛУЧЕНИЯ И ПРОМЕЖУТОЧНЫЕ ПРОДУКТЫ | 2000 |
|
RU2247710C2 |
Назначение: в медицине для получения производных пептидов, обладающих способностью тормозить действие ретровирусных протеаз. Сущность изобретения: способ получения производных пептидов ф-лы, содержащих природные, синтетические аминокислоты, изоаминокислоты, иминокислоты, заместители такие как: тетрагидрохинолин, пиридил, индолил, бензил, замещенный и незамещенный, нафтил, циклогенсил, а также их физиологически приемлемых солей. Реагент 1: фрагмент с концевой карбоксильной группой или его реакционноспособное производное. Реагент 2: соответствующий фрагмент со свободной аминогруппой. Синтез ведут в растворе в присутствии конденсирующего агента и при использовании защитных групп с последующим в случае необходимости деблокированием и превращением свободного основания в его физиологически приемлемую соль. 2 з. п. ф-лы.
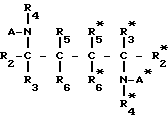
где А остаток общей формулы II
D (En (F)q (G)p
где D R1 или остаток формулы III
формулы (IV)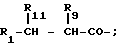
формулы V
A* остаток общей формулы II*
D*-(E*)n* -(F*)q* -(G*)p* -,
где D*=R
формулы IV*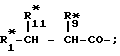
формулы V*
где n, n*, q, q*, p и p* независимо друг от друга означают 0 или 1,
E, E*, F, F*, G и G* независимо друг от друга аминокислота из ряда Val, Lys, Lys (Z), Phe, Chg, Ser, Asn, Gly, Jle, Tbg, Nva или Npq;
R1 и R
R2 и R
R3, R
R5 и R
R8 и R
R9 и R
R11 и R
причем в указанных соединениях одна или несколько амидных групп (-CONH-)- главной цепи могут быть заменены на -CH2NH- или -CH(OH)CH2-
или их физиологически приемлемых солей, отличающийся тем, что фрагмент с концевой карбоксильной группой или его реакционноспособное производное сочетают с соответствующим фрагментом со свободной аминогруппой, при желании отщепляют временно введенные для защиты других функциональных групп защитную группу или группы и полученное в результате соединение при желании переводят в его физиологически приемлемую соль.
| Пневматический водоподъемный аппарат-двигатель | 1917 |
|
SU1986A1 |
| Шредер Э., Любке К., Пептиды | |||
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
Авторы
Даты
1995-11-10—Публикация
1990-09-26—Подача