Изобретение относится к лакокрасочной промышленности, в частности к получению гидроксида титана для производства пигментной двуокиси титана, и может быть использовано при получении блочных катализаторов для обезвреживания отходящих промышленных газов.
Известен способ получения гидроксида титана из тетрахлорида титана путем гидролиза его в подкисленной воде при нагревании, последующего отделения образовавшегося осадка, его промывки. Перед промывкой осадок обрабатывают многоосновной неорганической кислотой, органической кислотой, содержащей несколько карбоксильных и/или оксигрупп, фенолом или их солью и высокомолекулярным органическим флокулирующим агентом [1]
Образование гидроксида титана при гидролизе тетрахлорида титана в подкисленной воде при нагревании идет по реакции:
TiCl4 + 3H2O TiO2 ˙H2O + 4HCl
Недостатком известного способа получения гидроксида титана является низкое качество получаемого продукта за счет высокого содержания в нем примеси хлор-иона. Это обусловлено образованием в процессе гидролиза тетрахлорида титана малорастворимых гидроксихлоридов титана. Кроме того, недостатком известного способа является получение в качестве отходов разбавленной соляной кислоты, которую необходимо обезвреживать или утилизировать, для осуществления способа необходима дорогостоящая коррозионностойкая аппаратура.
Наиболее близким по технической сущности и достигаемому техническому результату к заявляемому является способ получения гидроксида титана. Согласно известному способу тетрахлорид титана растворяют в воде, а затем проводят осаждение гидроксида титана щелочными реагентами при нагревании. Полученный осадок отделяют и промывают. В качестве оснований осадителей гидроксида титана используют гидроксиды натрия и калия, водные растворы аммиака, растворы поташа и соды. При этом получают белый кристаллоподобный гидроксид титана анатазной модификации [2]
Недостатком известного способа является то, что полученный гидроксид титана характеризуется высоким содержанием примеси хлор-ионов за счет образования при гидролизе тетрахлорида титана малорастворимых гидроксихлоридов и оксихлоридов титана. Недостатком известного способа является также его низкая технологичность:
для осуществления способа необходима коррозионностойкая аппаратура, поскольку при гидролизе тетрахлорида титана образуется соляная кислота;
в качестве осадителей используются дорогостоящие реагенты;
на промывку образовавшегося осадка тетрахлорида титана расходуются большие объемы промывной воды за счет относительно низкой растворимости хлоридов натрия, калия, аммония, образующихся при нейтрализации соляной кислоты гидроксидами натрия, калия, растворами аммиака, поташа, соды;
для отвода излишнего количества тепла, выделяющегося при растворении тетрахлорида титана в воде, необходима установка теплообменников.
Техническим результатом, на достижение которого направлено заявляемое изобретение, является снижение примеси хлор-ионов в целевом продукте, повышение технологичности способа при обеспечении безотходности процесса.
Технический результат достигается тем, что в известном способе получения гидроксида титана из тетрахлорида титана путем осаждения щелочным реагентом при нагревании, последующего отделения образовавшегося осадка и его промывки, является то, что тетрахлорид титана непосредственно вводят в щелочной реагент, в качестве которого используют известковое молоко, а процесс ведут до рН среды 6,5-7,5 со скоростью изменения рН среды 0,05-0,1 единиц рН/мин.
В качестве тетрахлорида титана может быть использован тетрахлорид титана технический.
Сущность заявляемого способа заключается в следующем.
При непосредственном введении тетрахлорида титана в известковое молоко до рН среды 6,5-7,5, минуя стадию растворения тетрахлорида титана в воде, образование гидроксида титана идет по реакции:
TiCl4 + 2Ca(OH)2
TiO2 ˙H2O + 2CaCl2 + H2O
При этом исключается образование соляной кислоты и, следовательно, необходимость осуществления способа с использованием дорогостоящей коррозионностойкой аппаратуры и обезвреживание или утилизация соляной кислоты.
В начальный момент введения тетрахлорида титана в известковое молоко образование гидроксида титана идет при многократном избытке щелочного реагента. Образовавшиеся в этот момент частицы гидроксида титана выполняют роль зародышей, что способствует образованию кристаллического осадка, обеспечивает высокую скорость его отстаивания и фильтрации.
Экспериментально установлено, что при непосредственном введении тетрахлорида титана в щелочной реагент, в качестве которого используют известковое молоко, со скоростью изменения рН среды 0,05-0,1 ед. рН/мин образуется гидроксид титана, характеризующийся низким содержанием гидроксихлоридов и оксихлоридов титана и кристаллоподобной структурой.
При более высокой скорости изменения рН среды (выше заявляемого предела) содержание оксихлоридов титана в образовавшемся осадке увеличивается.
При скорости изменения рН среды ниже заявляемого предела существенного уменьшения содержания гидроксихлоридов и оксихлоридов титана в образовавшемся гидроксиде титана не происходит, и, следовательно, производительность неоправданно снижается.
Использование в качестве щелочного реагента известкового молока в совокупности с заявляемой скоростью изменения рН среды обеспечивает поддержание температуры реакционной смеси на уровне 40-80оС, исключает необходимость принудительного теплообмена за счет высокой теплопроводности раствора хлорида кальция.
Кроме того, растворимость хлорида кальция выше, чем растворимость хлоридов натрия, калия и аммония.
Следовательно, на отмывку хлорида кальция расходуется меньше промывочной воды. Хлорид кальция товарный продукт, его можно получить выпариванием с меньшими энергозатратами.
В качестве тетрахлорида титана может быть использован как тетрахлорид титана очищенный, содержащий, мас. ванадий 0,0002-0,0006; кремний 0,0002-0,001, так и тетрахлорид титана технический, содержащий, мас. ванадий 0,1-0,15; кремний 0,001-0,02 или тетрахлорид титана, содержащий, мас. тантал не более 0,01; ниобий 0,02; кремний 0,02.
Присутствующие в тетрахлориде титана техническом примеси ванадия, тантала и ниобия играют роль катализаторов процесса образования гидроксида титана, а для устранения отрицательного влияния примеси кремния процесс введения тетрахлорида титана в известковое молоко ведут до рН среды не ниже 6,5, поскольку при более низком рН образуется гель кремниевой кислоты, что затрудняет процесс фильтрации осадка гидроксида титана.
Введение тетрахлорида титана в известковое молоко до рН среды выше 7,5 нецелесообразно, т.к. в этом случае в растворе остается свободная известь.
Заявляемый способ осуществляется следующим образом.
В емкость с известковым молоком, содержащим 50-180 г/л активной извести, при температуре 40-80оС вводят тетрахлорид титана при интенсивном перемешивании со скоростью изменения рН среды 0,05-0,1 рН/мин. Процесс заканчивают при достижении рН среды 6,5-7,5. Получают белый кристаллический осадок гидроксида титана, который затем отстаивают, отфильтровывают и промывают на вакуумном фильтре. Осадок подвергают затем 3-6-кратной противоточной промывке.
Полученный гидроксид титана используют как товарный продукт или направляют на получение пигментного диоксида титана, блочных катализаторов и др. А фильтрат и промывные воды противоточной промывки смешивают и подвергают упариванию с получением товарного хлорида кальция.
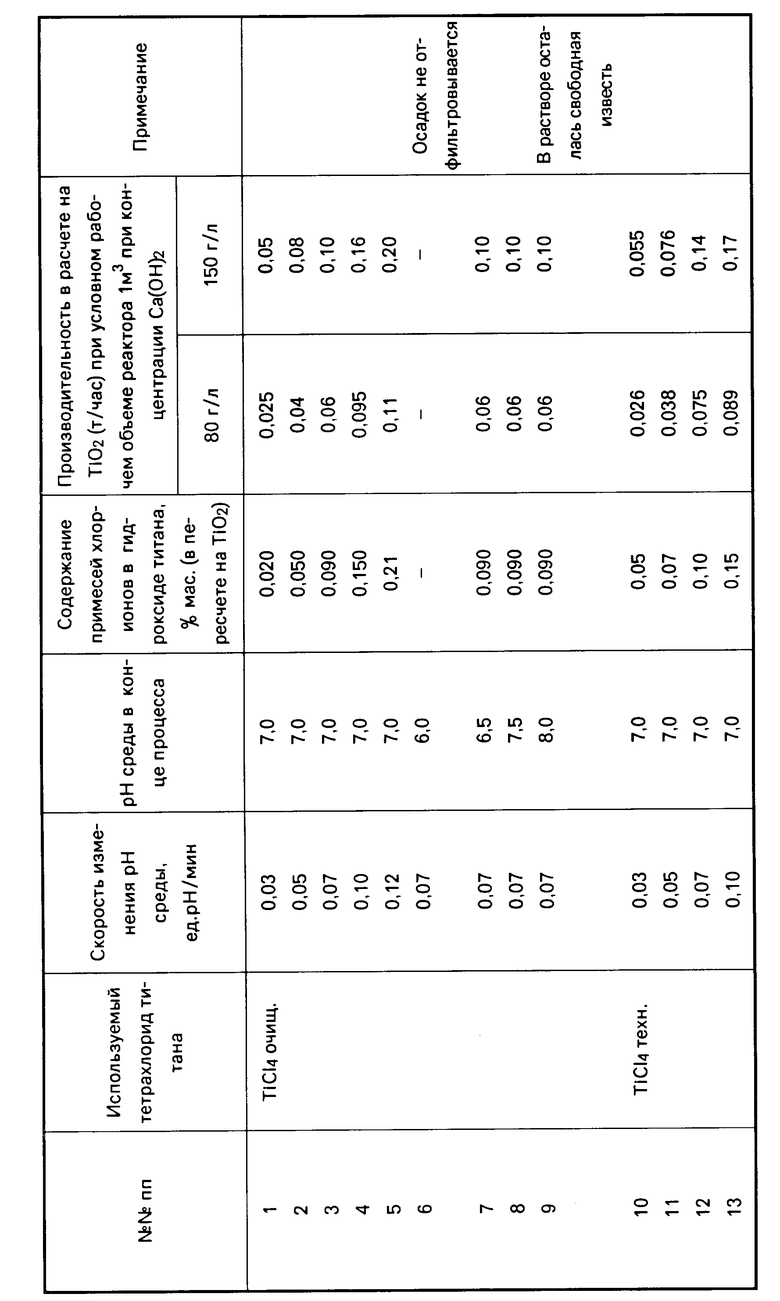
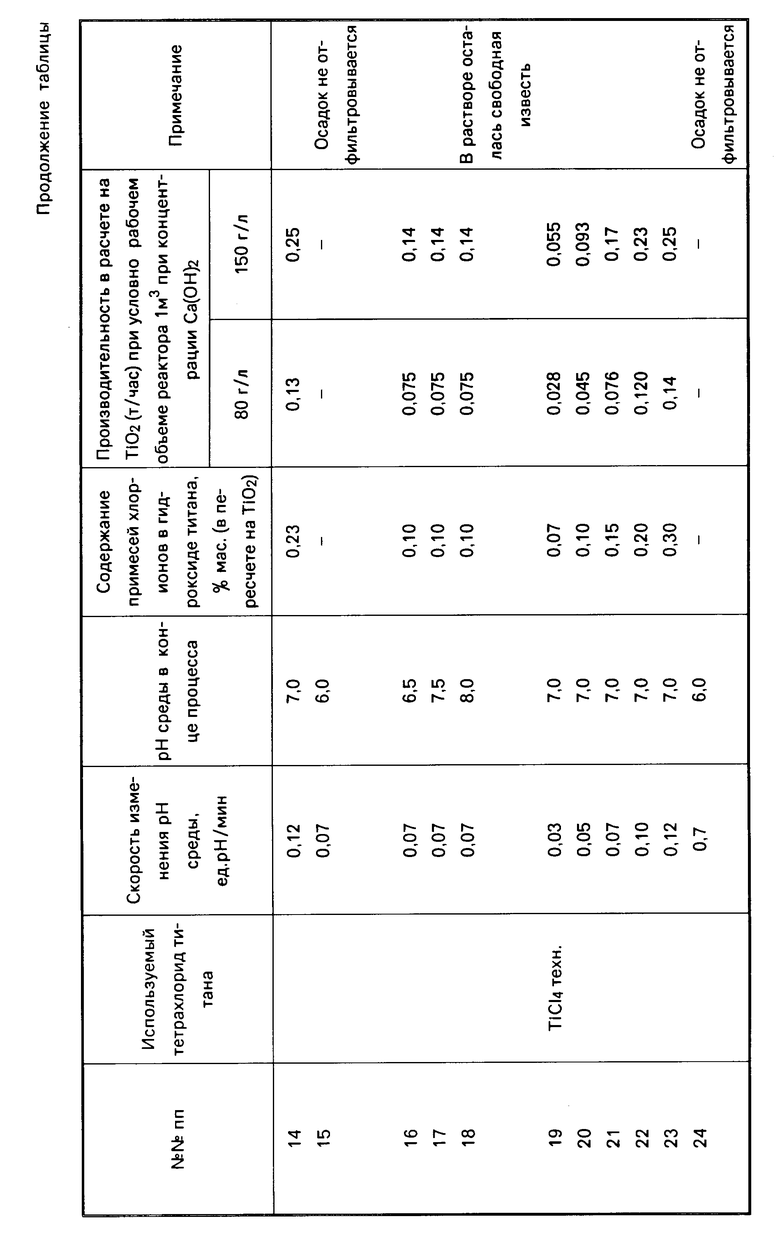
В лабораторных условиях были проведены сравнительные испытания заявляемого способа получения гидроксида титана и способа по прототипу. В качестве тетрахлорида титана использовали тетрахлорид титана очищенный (см. табл. опыты NN 1-9), тетрахлорид титана технический опыты NN 10-18, тетрахлорид технический опыты NN 19-27, который вводили непосредственно в известковое молоко, содержащее 80 г/л и 150 г/л активной извести. Скорость изменения рН среды изменяли от 0,3 до 0,12 единиц рН/мин (cм. опыты NN 1-5, 10-14, 19-23). При этом процесс вели до рН среды 7. В опытах NN 6-9, 15-18, 24-27 процесс вели до рН среды 6,0-8,0 при скорости изменения рН среды 0,07 ед. рН/мин.
В полученном после фильтрации и промывки осадке гидроксида титана титримитрическим методом определяли содержание хлор-ионов. Контролировалась также производительность процесса.
В таблице приведены данные по производительности процесса в зависимости от скорости измерения рН среды в пересчете на TiO2 (т/час) при условном рабочем объеме реактора 1 м3 и разных концентрациях известкового молока.
Был также осуществлен способ по прототипу, согласно которому тетрахлорид титана предварительно растворяли (гидролизовали) в воде, а затем полученную соляную кислоту нейтрализовали гидроксидом натрия (см. опыт N 16).
Результаты опытов представлены в таблице.
Из таблицы видно, что оптимальной скоростью изменения рН среды является скорость в 0,05-0,1 ед. рН/мин, обеспечивающая получение гидроксида титана с низким содержанием примеси хлор-ионов и приемлемую производительность процесса (см. опыты NN 2-4, 11-13, 20-22).
Снижение скорости изменения рН среды ниже заявляемого предела (опыты NN 1, 10, 19) нецелесообразно, т.к. хотя и наблюдается некоторое снижение содержания примеси хлор-ионов в гидроксиде титана, однако производительность процесса мала.
При увеличении скорости изменения рН среды выше заявляемого предела содержание примеси хлор-ионов в гидроксиде титана увеличивается (см. опыты NN 5, 14, 23).
Процесс введения тетрахлорида титана в известковое молоко целесообразно вести до рН среды 6,5-7,5. В этом случае получается кристаллоподобный хорошо отфильтровываемый осадок гидроксида титана анатазной модификации. В случае окончания процесса при рН среды 6,0 образуется гель кремниевой кислоты, затрудняющий процесс фильтрации (см. опыты NN 6, 15, 24). Вести процесс до рН среды 8,0 нецелесообразно вследствие неэффективного расходования известкового молока, т.к. в этом случае в растворе остается свободная известь (см. опыты NN 9, 18, 27).
Из таблицы также видно, что использование тетрахлорида титана технического обеспечивает более высокую производительность процесса по сравнению с тетрахлоридом титана очищенным вследствие каталитического воздействия примесей, содержащихся в TiCl4 техническом. Содержание примеси хлор-ионов в гидроксиде титана в этом случае несколько выше, но в 4-10 раз ниже по сравнению с прототипом (см. опыт N 16).
Использование в качестве осадителя гидроксида титана известкового молока позволило вести процесс без принудительного охлаждения, снизить объем промывочных вод на 30% по сравнению с прототипом, и, следовательно с меньшими энергозатратами получить еще один товарный продукт хлорид кальция.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ ИЗВЕСТКОВОЙ ПАСТЫ | 1992 |
|
RU2064904C1 |
| СПОСОБ ИЗВЛЕЧЕНИЯ СКАНДИЯ ИЗ ОТХОДОВ ПРОИЗВОДСТВА ТЕТРАХЛОРИДА ТИТАНА | 1993 |
|
RU2068392C1 |
| СПОСОБ ПЕРЕРАБОТКИ ВАНАДИЕВОГО ПРОМПРОДУКТА | 2000 |
|
RU2175358C1 |
| СПОСОБ ПОЛУЧЕНИЯ ГИДРОКСИДА ХРОМА ИЗ ОТРАБОТАННОГО РАСПЛАВА ПРОИЗВОДСТВА ТЕТРАХЛОРИДА ТИТАНА | 1993 |
|
RU2062809C1 |
| СПОСОБ ДЕЗАКТИВАЦИИ РАДИОАКТИВНЫХ СОЛЕВЫХ ОТХОДОВ ПРОЦЕССА ХЛОРИРОВАНИЯ ТИТАНО-НИАБАТОВ РЗЭ | 2006 |
|
RU2331124C1 |
| СПОСОБ КОМПЛЕКСНОЙ ПЕРЕРАБОТКИ И ДЕЗАКТИВАЦИИ РАДИОАКТИВНЫХ ОТХОДОВ РЕДКОМЕТАЛЬНОГО ПРОИЗВОДСТВА | 2006 |
|
RU2334801C1 |
| СПОСОБ КОМПЛЕКСНОЙ ПЕРЕРАБОТКИ ТЕХНОГЕННОГО ВАНАДИЕВОГО СЫРЬЯ | 2001 |
|
RU2192489C2 |
| СПОСОБ ПОВЕРХНОСТНОЙ ОБРАБОТКИ ДИОКСИДА ТИТАНА | 1999 |
|
RU2162869C2 |
| СПОСОБ ПЕРЕРАБОТКИ ВОЗГОНОВ ТИТАНОВЫХ ХЛОРАТОРОВ | 1996 |
|
RU2112059C1 |
| СПОСОБ ПЕРЕРАБОТКИ МАРГАНЕЦСОДЕРЖАЩИХ МАТЕРИАЛОВ | 2003 |
|
RU2280089C2 |

Использование: лакокрасочная промышленность для получения диоксида титана. Сущность способа: тетрахлорид титана очищенный или технический вводят непосредственно в известковое молоко со скоростью изменения рН среды 0,05 0,1 ед/рН в минуту. Нагревают. Процесс ведут до рН среды 6,5 7,5. Осадок гидроксида титана отделяют, промывают. 1 з. п. ф-лы, 1 табл.
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| Горощенко Я.Г | |||
| Химия титана | |||
| - Киев: Наукова думка, 1970, с.107-108. | |||
Авторы
Даты
1995-11-27—Публикация
1992-11-16—Подача