Изобретение относится к фармакологии, к изысканию принципиально новых противораковых лекарственных средств направленного действия.
Транспорт активных молекул к особым биологическим центрам был предложен еще в трудах Эрлиха более 100 лет назад. Такой принцип должен приводить к наибольшей эффективности и наименьшим побочным действиям лекарственных средств. Этот принцип особенно важен для онкологии, где в качестве лекарственной основы используются токсические вещества.
Осуществление этого принципа для онкологии стало возможным путем создания искусственных макромолекул, состоящих из векторной, специфической к раковым клеткам части, и неспецифической части, содержащей цитотоксическое средство. В этом случае поглощение лекарства клетками происходит не диффузионным, статистическим образом, как в случае низкомолекулярных веществ, а путем эндоцитоза и только теми клетками, которые имеют средство к векторной части. Даже если векторная макромолекула распадается на составные части не внутри, а на поверхности клеток-мишеней и лекарство попадает в клетку не в результате эндоцитоза, а обычным образом, то оно будет проявлять в результате осуществленной доставки к клеткам-мишеням избирательную токсичность в отношении этих клеток.
Прежде всего эти принципиально новые лекарственные средства направленного действия были созданы на основе моноклональных и поликлональных антител (векторная часть). В результате были получены различные иммуноконъюгаты с противоопухолевыми антибиотиками, растительными и бактериальными токсинами и др. противоопухолевыми веществами.
Такая простая схема создания новых противораковых средств на практике столкнулась со множеством реальных трудностей. Укажем на некоторые из них.
Проблемы, связанные с поверхностным раковым антигеном:
специфичность ракового антигена. Он должен присутствовать на раковых клетках и отсутствовать на нормальных клетках. Ситуация осложняется тем, что многие антигенные маркеры, находящиеся на поверхности клеток, секретируются во внеклеточную среду, приводя к конкуренции между антигеном на поверхности и секретируемым АГ.
способность специфического ракового АГ подвергаться эндоцитозу.
Проблемы, связанные с конструкцией векторной макромолекулы.
Конъюгация двух частей макромолекулы с помощью ковалентной связи зачастую приводила:
к уменьшению эффективности неспецифической части;
к ухудшению свойств векторной части уменьшению сродства АГ к АТ, уменьшению способности к эндоцитозу;
получению мало- или нерастворимых в традиционных растворителях продуктов.
При этом могут одновременно ухудшаться и любые сочетания указанных свойств.
Эти проблемы привели к созданию целого ряда изобретений, посвященных исключительно принципам конструирования векторных макромолекул, причем особое место в них уделялось, принципам связи двух частей. Предпочтение при этом отдавалось лабильным связям типа гидролизуемых ковалентных химических связей, образующихся в т.ч. с помощью специальных "спейсеров" (пат. США N 4485093, кл. А 61 К 39/00, 1984), разрушаемым связям под действием облучения светом (ЕВР. пат. N 129434) и нековалентным типам связей, типа АГ-АТ, причем в последнем случае используются довольно сложные конструкции (например, ЕВР пат. N 129434, кл. А 61 К 39/44 и др.). По идее, заключенной в этих изобретениях, такие типы лабильного связывания должны одновременно обеспечивать стабильность макромолекулы в процессе транспорта и, если необходимо, эндоцитоза, и функциональную независимость в процессе цитотоксического действия лекарственного вещества.
Таким образом, исходные свойства конъюгируемых частей, характер и способы конъюгации в большинстве случаев непредсказуемо влияют на конечный результат, и собственно составляют предметы изобретений.
Проблема создания векторных молекул на основе АТ являются общими и для предлагаемого нового подхода к созданию векторных лекарственных средств.
Общим недостатком иммуноконъюгатов является то, что их повторное введение может спровоцировать иммунные реакции организма. Поэтому все большее внимание привлекает возможность создания для БАВ векторов на основе онкофетальных белков и факторов роста, являющихся физиологическими лигандами соответствующих рецепторов, плотность которых особенно высока на опухолевых клетках.
Среди онкофетальных белков, к которым относятся раковоэмбриональный антиген, плацентарная щелочная фосфатаза, альфа, бета, гамма и основной фетопротеины, панкреатический фетальный белок и др. наиболее перспективным в качестве вектора для цитотоксических препаратов представляется альфа-фетопротеин (АФП), т.к. он специфически связывается и эндоцитируется опухолевыми клетками, в то время как уровень его рецепторов на нормальных клетках человека очень низок.
АФП белок, структура и свойства которого хорошо изучены. Он состоит из одной полипептидной субъединицы. Его молекулярная масса 74 кД. АФП содержит углеводный компонент, составляющий от 3 до 4,3% В состав углеводов, связанных с АФП, входит глюкоза, галактоза, манноза, N-ацетилглюкозамин и сиаловая кислота. АФП состоит из 590 аминокислотных остатков, содержит 32 цистеиновых остатка, но не содержит свободных SH- групп, содержит 1 N-связанный с аспарагином гликан в положении 232. Считают,что микрогетерогенность АФП связана с составом гликана. В первичной структуре выделяют 3 домена, причем первый гомологичен аналогичному домену мышей и и крыс. Специфические функции АФП, касающиеся связывания эстрогенов, определяются 1-ым доменом. Гомология АФП с альбумином составляет 35-40% но с 38 по 119 остаток у АФП гомологии с другими белками нет.
Накопление АФП в клетках происходит в результате рецептор-опосредованного эндоцитоза этого белка. С помощью электронной микроскопии было показано, что ковалентносвязанные конъюгаты АФП с пероксидазой хрена (последняя использована для визуализации АФП) в процессе эндоцитоза сначала обнаруживаются в клатриновых везикулах, затем в эндосомах и в складчатых мембранах центральной области аппарата Гольджи, в то время как яичный альбумин после интернализации (степень его интернализации очень низка) обнаруживался в лизосомах. После интернализации основная часть АФП не подвергается деградации, вновь выделяется в экстра-клеточную среду, т.е. АФП подвергается рециклированию. Показано исключительно высокое содержание рецептора АФП в опухолях.
Наиболее близким к предлагаемому (прототип) является техническое решение, представляющее собой конъюгаты БАВ с АФП, обладающие избирательным действием по отношению к раковым клеткам-мишеням (заявка РСТ N 94/19021, нац. патенты в указанных странах получены), в котором конъюгированные части соединены лабильной пептидной связью.
В заявке подробно описан способ выделения, очистки и дана характеристика АФП человека, а также описаны способы получения конъюгатов как по белковой, так и углеводной части АФП, причем в обоих случаях создаются лабильные пептидные связи.
Способ получения конъюгатов БАВ с АФП путем модификации белковой части АФП (принят за прототип для предлагаемых способов) состоит во взаимодействии амино- или карбоксильных групп БАВ соответственно со свободными карбоксильными или амино-группами белка с помощью карбодиимида, либо его производных.
В известном техническом решении притязания распространяются и на фармацевтические композиции на основе указанных выше конъюгатов в эффективном количестве и приемлемых с точки зрения фармацевтики носителей (прототип для композиции).
В приведенных к заявке примерах на соответствующих моделях была показана возможность эффективного лечения лейкозов, лимфом, гепатом, нейробластом, меланом и астроцитом, причем на культурах клеток цитотоксический эффект конъюгатов был всегда выше (определялся по числу погибших клеток) действия исходных цитотоксических веществ.
Механизм цитотоксического действия конъюгатов не полностью изучен, однако предполагалось, что благодаря тому, что наиболее широкий набор гидролитических ферментов локализован в лизосомах, конъюгат может быть стабилен вплоть до процесса эндоцитоза, который приводит к эффективному проникновению конъюгированного лекарства внутрь клеток-мишеней. Затем действующее начало высвобождается и проявляет свою исходную функциональную активность, за счет чего и происходит нарастание общей активности конъюгата по сравнению с неконъюгированным лекарством.
Однако в дальнейшем было обнаружено, что эффективность воздействия существенным образом зависит от способа введения конъюгатов животным-опухоленосителями: они были высокоэффективны при подкожном введении и оказывали лишь незначительный эффект при внутренном способе введения.
Такое уменьшение активности связано прежде всего с возможностью расщепления пептидной связи ферментами, содержащимися в биологических жидкостях организма.
Указанный недостаток является существенным ограничением в применении известных конъюгатов, так как в клинической практике необходим прежде всего внутривенный способ введения препаратов.
Дальнейшие исследования были направлены на устранение указанного недостатка.
Изобретение стало возможным в результате обнаружения нетривиального с научной точки зрения факта сохранения в полном объеме функциональных свойств исходных частей в конъюгате при их соединении химической связью, высокоустойчивой к действию протеаз и др. ферментов биологических жидкостей (сыворотки крови, лимфы, внутриклеточного содержимого), так как цитотоксический эффект в полной мере проявляется и без высвобождения действующего начала из конъюгата.
Это позволяет рассчитывать на возможность для предлагаемых конъюгатов применения внутривенного способа введения, пролонгированного характера фармакологического действия конъюгатов и просто расширяет ассортимент средств известного назначения.
Таким образом, предметом настоящего изобретения являются конъюгаты БАВ с АФП, обладающие избирательным действием по отношению к раковым клеткам-мишеням, в которых конъюгированные части соединены высокоустойчивой к действию протеаз и др. ферментов биологических жидкостей химической связью.
К таким связям относят тиоэфирные (простой эфир), альдиминные связи, амидные (типа амидной связи в капроне) и др.
В настоящий момент в качестве наиболее оптимальных способов получения заявленных конъюгатов предлагаются два способа.
Предлагается способ получения конъюгатов БАВ с АФП путем модификации белковой части молекулы АФП, отличительной особенностью которого является то, что белок или БАВ, содержащие аминогруппу, вводят во взаимодействие с сукцинимидил транс-4-(N-малеимидилметил)циклогексан-1-карбоксилатом (SMCC) или N-гидроксисукцинимидным эфиром 3-малеимидобензоной кислоты (МВS), после чего осуществляют сшивку полученного производного с БАВ или белковой частью АФП, соответственно, по SH-группам, которые присутствуют исходно или вводятся дополнительно с помощью сукцинимидного эфира 3-(2-пиридилдитио)пропионовой кислоты (SPDP).
Также предлагается способ получения конъюгатов БАВ с АФП путем модификации белковой части молекулы АФП, отличительной особенностью которого является то, что осуществляют конденсацию аминогрупп белка с альдегидной группой, исходно содержащейся в БАВ или дополнительно в него введенной после активации периодатом, и последующего восстановления полупродукта боргидридом.
Предметом настоящего изобретения являются также фармацевтические композиции на основе конъюгатов БАВ с АФП в эффективном количестве и приемлемых носителей, отличительной особенностью которых является то, что в качестве конъюгатов они содержат конъюгаты, описанные выше, и носители,пригодные для внутривенного введения.
При этом носителем может быть физиологический раствор, фосфатно-солевой раствор, обезболивающие препараты, например новокаин, противомикробные,противовирусные и противопаразитарные средства; средства, регулирующие метаболические процессы, другие препараты, применяемые для лечения онкологических больных (за исключением алкилирующих препаратов).
Ниже приведены примеры, доказывающие возможность использования предлагаемых конъюгатов по указанному назначению.
Пример 1-2. Конъюгаты АФП-БАВ, получаемые с образованием простой тиоэфирной связи.
Способ получения основан на введении в молекулу БАВ и белка-носителя дополнительных молекул, последующее взаимодействие между которыми приводит к образованию негидролизуемой тиоэфирной связи между БАВ и АФП. Введение дополнительных молекул происходит по свободным NH и SH-группам белканосителя или БАВ. В качестве дополнительных молекул, вводимых для последующего образования тиоэфирной связи, использованы SMCC и SPDP.
и SH-группам белканосителя или БАВ. В качестве дополнительных молекул, вводимых для последующего образования тиоэфирной связи, использованы SMCC и SPDP.
Пример 1. Если БАВ содержит свободную NH2-группу, то синтез конъюгата происходит следующим образом.
На 1-ом этапе в молекулу белка-носителя АФП с помощью SPDP вводят SH-группы, образующиеся после восстановления -S-S- связи в SPDP с помощью дитиотреитола или меркаптоэтанола. SPDP присоединяется к белку по свободным NH2-группам. Пептидоподобная связь, образующаяся между белком и SPDP, подобна той, что образуется при синтезе капрона, и также устойчива к действию протеаз.
На 2-ом этапе происходит введение SMCC в молекулу БАВ. При этом в качестве БАВ могут быть использованы соединения самых разных классов: белки, антибиотики, антиметаболиты, алкалоиды, если она содержат свободную NH2-группу. Связь, образующаяся между SMCC и БАВ, устойчива к действию протеаз благодаря присутствию циклогексила.
На 3-м этапе происходит собственно синтез конъюгата АФП с БАВ, в котором БАВ присоединен к АФП с помощью тиоэфирной связи.
По этому методу могут быть получены конъюгаты с дифтерийным токсином, рицином, рибонуклеазой, аспарагиназой, метотрексатом, дауномицином, рубомицином, доксорубицином, карминомицином и другими NH2-содержащими БАВ.
Получение конъюгатов с использованием негидролизуемой сшивки (SMCC).
Ниже приведена конкретная методика получения конъюгата АФП с доксорубицином (ДР).
1. Модификация АФП с помощью SPDP.
2
Методика. АФП растворяли в деионизованной воде и измеряли концентрацию белка по методу Lowry. 1 мл раствора АФП в деионизованной воде (концентрация АФП 1 мг/мл) диализовали против 0,01 М фосфатного солевого буфера (рН 7,4) и добавляли (при постоянном перемешивании) 4 мкл раствора 2,5 мг SPDP в 1 мл метанола (Fluka). Смесь инкубировали при комнатной температуре в течение 2 ч, после чего добавляли сухой DТТ до конечной концентрации 20 мМ (3,1 мг DТТ), а затем трехкратно диализовали против 0,01 М фосфатного солевого буфера (рН 7,4) в течение суток при +4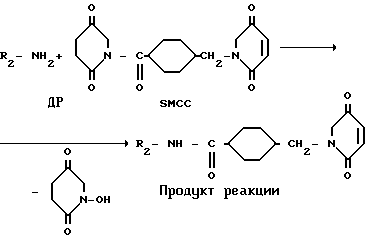 С.
С.
2. Определение степени модификации АФП. Титрование аликвоты с 5,5-дитио-бис-2-нитробензойной кислотой показало, что одна молекула модифицированного АФП содержала в среднем две свободные сульфогидрильные группы.
3. Модификация молекулы ДР.
o
Методика. К 26 мкл раствора 1 мг ДР в 1 мл 0,01 М фосфатного буфера добавляли 4 мкл раствора 2,6 мг SMCC в 1 мл ДМСО (Sigma). Смесь инкубировали при комнатной температуре в течение 1,5 ч.
4. Синтез конъюгатов АФП-ДР.

Методика. К ДР, обработанному с помощью SMCC, добавляли 1 мг модифицированного АФП, инкубировали в течение 12-18 ч при +4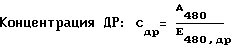 С и трехкратно диализовали против 0,01 М фосфатного солевого буфера (рН 7,4) в течение суток при +4oС.
С и трехкратно диализовали против 0,01 М фосфатного солевого буфера (рН 7,4) в течение суток при +4oС.
Полученный конъюгат идентифицировали с помощью методов гельфильтрации и электрофореза.
5. Определение соотношения АФП:ДР в полученном конъюгате:
а) измеряли оптическую плотность полученных конъюгатов на спектрофотометре (Hitachi) при длинах волн 280 и 480 нм и рассчитывали концентрацию ДР (Co) по формуле:
ДР
б) в 96-луночную плату вносили по 200 мкл исследуемого конъюгата ДР с концентрацией по доксорубицину от 10 до 50 мкМ и измеряли поглощение раствора на многоканальном спектрофотометре "Multiscan" при длине волны 450 нм. Для каждого определения строили калибровочную кривую, измеряя поглощение смесей АФП с известными количествами ДР. Измерение можно было проводить до истечения 1 ч хранения при комнатной температуре.
Молярное отношение АФП:ДР в конъюгате оказалось равным 1:2.
С целью оптимизации общей методики готовили также конъюгаты, добавляя к 1 мг АФП в 1 мл 0,01 М фосфатного солевого буфера (рН 7,4) 8, 12 и 16 мкл раствора 2,5 мг SPDP в 1 мл метанола. Смесь инкубировали как при комнатной температуре (2 ч), так и 12 ч при +4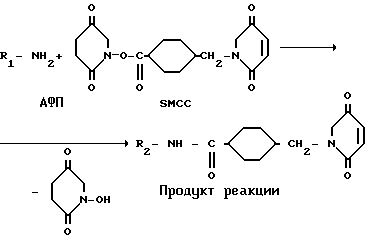 С.
С.
Для конъюгирования брали 26; 52,5 и 105 мкл раствора 1 мг ДР в 1 мл 0,01 М фосфатного солевого буфера, рН 7,4.
В результате были получены конъюгаты с молярным отношением АФП:ДР от 1:2 до 1:6.
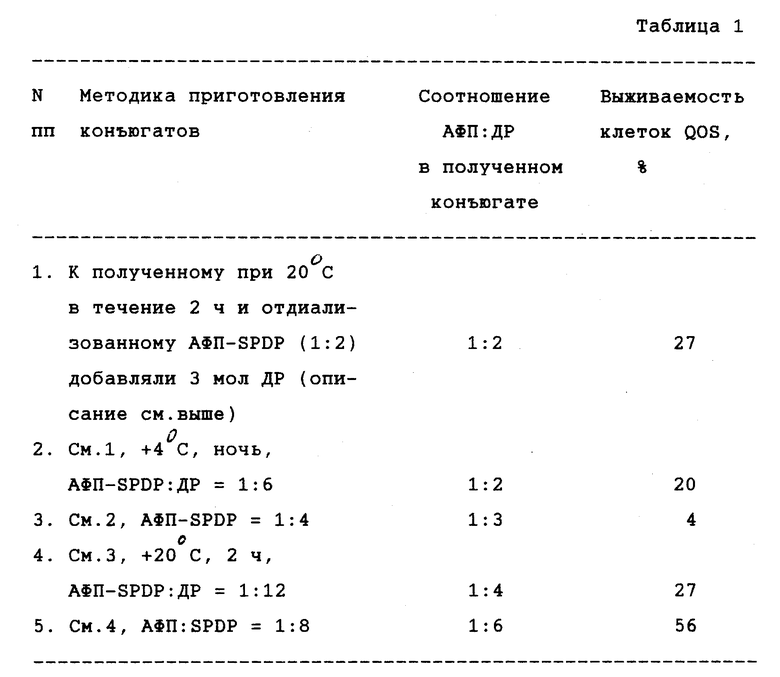
Токсичность полученных конъюгатов тестировали на линии клеток человеческой лимфобластомы QOS. Наиболее активным оказался конъюгат с молярным отношением АФП: ДР 1:3, при модификации АФП с помощью SPDP в течение 12 ч при +4oС.
Данные по свойствам конъюгатов приведены в табл.1.
Пример 2. Конъюгаты АФП с БАВ, содержащими SH- группу или -S-СН (например, с калихемицином), могут быть получены следующим образом.
На 1-ом этапе происходит восстановление S S- связи калихемицина с помощью дитиотреитола или меркаптоэтанола. Если молекула БАВ уже содержит свободную SH-группу, такое восстановление не требуется.
На 2-ом этапе происходит введение SMCC в молекулу АФП.
На 3-м этапе происходит синтез конъюгата АФП с БАВ с образованием тиоэфирной связи.
Пример получения конъюгата АФП с калихемицином (КХ).
1. Модификация АФП с помощью SMCC.
o
Методика. АФП растворяли в деионизованной воде и измеряли концентрацию белка по методу Lowry. 1 мл раствора АФП в деионизованной воде (концентрация АФП 1 мг/мл) диализовали против 0,01 М фосфатного солевого буфера (рН 7,4) и добавляли (при постоянном перемешивании) 4 мкл раствора 2,6 мг SMCC в 1 мл ДМСО (Sigma). Смесь инкубировали при комнатной температуре в течение 1,5 ч, после чего трехкратно диализовали против 0,01 М фосфатного солевого буфера (рН 7,4) в течение суток при +4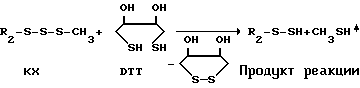 С.
С.
2. Модификация молекулы КХ.
o
Методика. К 57 мкл раствора 1 мг КХ в 1 мл этилового спирта добавляли 1 мл раствора 3 мг дитиотрептола (DТТ) в 1 мл 0,01 М фосфатного солевого буфера (рН 7,4), инкубировали смесь при комнатной температуре в течение 1 ч, замораживали в жидком азоте и лиофилизировали.
3. Синтез конъюгатов АФП-КХ.

Методика. К обработанному с помощью DТТ и лиофилизированному КХ добавляли 1 мг модифицированного АФП, инкубировали в течение 12013 ч при +4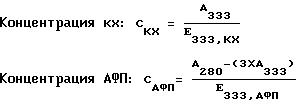 С и трехкратно диализовали против 0,01 М фосфатного солевого буфера (рН 7,4) в течение суток при +4 С.
С и трехкратно диализовали против 0,01 М фосфатного солевого буфера (рН 7,4) в течение суток при +4 С.
Полученный конъюгат идентифицировали с помощью методов гельфильтрации и электрофореза.
4. Определение соотношения АФП:КХ в полученном конъюгате:
а) измеряли оптическую плотность полученных конъюгатов на спектрофотометре (Hitachi) при длинах волн 280 и 333 нм и рассчитывали концентрации по формулам:
o
б) В 96-луночную плату вносили по 200 мкл 0,00025 н раствора KMnO в деионизованной воде и при перемешивании по 50 мкл исследуемого раствора КХ (конъюгата КХ) с концентрацией по калихемицину от 100 до 400 нМ. Делали также контрольную раститровку КХ. После перемешивания инкубировали в течение 1 ч при 404С (до заметного обесцвечивания 400 нМ раствора КХ) и измеряли поглощение раствора на многоканальном спектрофотометре "Multiscan" при длине волны 540 нм. Измерение можно было проводить до истечения 1 ч хранения при комнатной температуре.
в деионизованной воде и при перемешивании по 50 мкл исследуемого раствора КХ (конъюгата КХ) с концентрацией по калихемицину от 100 до 400 нМ. Делали также контрольную раститровку КХ. После перемешивания инкубировали в течение 1 ч при 404С (до заметного обесцвечивания 400 нМ раствора КХ) и измеряли поглощение раствора на многоканальном спектрофотометре "Multiscan" при длине волны 540 нм. Измерение можно было проводить до истечения 1 ч хранения при комнатной температуре.
Примечание: раствор КМnОo хранится при комнатной температуре не более 1 недели.
Молярное отношение АФП:КХ в конъюгате оказалось равным 1:2.
С целью оптимизации общей методики готовили также конъюгаты, добавляя к 1 мг АФП в 1 мл 0,01 М фосфатного солевого буфера (рН 7,4) 8, 12 и 16 мкл раствора 2,6 мг SMCC в 1 мл ДМСО (Sigma). Смесь инкубировали как при комнатной температуре (2 ч), так и 12 ч при +44.
Для конъюгирования брали 57; 114 и 228 мкл раствора 1 мг КХ в 1 мл этилового спирта.
В результате были получены конъюгаты с молярным отношением АФП:КХ от 1:2 до 1:8.
Токсичность полученных конъюгатов тестировали на линии клеток человеческой лимфобластомы QOS. Наиболее активным оказался конъюгат с молярным отношением АФП: КХ 1:4, при модификации АФП с помощью SMCC в течение 12 ч при +4oС.
Данные по свойствам конъюгатов приведены в табл. 2.
Пример 3. Конъюгаты АФП-БАВ, получаемые с образованием азометиновой связи.
Негидролизуемая азометиновая связь АФП с БАВ может быть получена при непосредственном взаимодействии альдегидной группы БАВ с NH -группой АФП. По этому методу могут быть получены конъюгаты АФП с винкристином (ВК). Поскольку молекула винкристина уже содержит альдегидную группу, конъюгат АФП с ВК может быть получен при непосредственном взаимодействии растворов указанных веществ в 0,1 М карбонатном буфере (рН 9,0) по схеме:
o
R1 БАВ
R2 белок-носитель (АФП).
Методика. АФП растворяли в дистиллированной воде и измеряли концентрацию белка по методу Lowry 1 мл раствора АФП в дистиллированной воде (концентрация АФП 1 мг/мл) диализовали против 0,1 М карбонатного буфера (рН 9,0) и добавляли (при постоянном перемешивании) 41 мкл раствора, содержащего 1 мг винкристина в 1 мл того же буфера. Смесь инкубировали при комнатной температуре в течение 2 ч, после чего трехкратно диализовали против 0,01 М (рН 7,4) в течение суток при +4oС. Полученный конъюгат идентифицировали с помощью методов гельфильтрации и электрофореза.
Пример 4. Эффективность конъюгатов АФП, содержащих негидролизуемую связь с доксорубицином, в отношении опухолевых клеток различных линий, оцениваемая по их выживаемости.
Действие полученных по примеру 1 конъюгатов было исследовано на следующих линиях клеток: Т-клеточная лимфома человека линии QOS, карцинома яичника человека линии SROVЗ и резистентная линия карциномы яичника человека,экспрессирующая ген множественной устойчивости, SKVLB.
Протокол испытаний был общим для всех проведенных испытаний и состоял в следующем. Клетки Т-клеточной лимфомы человека линии QOS, карциномы яичника человека SKOVЗ и SKVLB культивировали в пластиковых флаконах (Costar) в среде RPMI 1640 с добавлением 10%-ной фетальной сыворотки крупного рогатого скота (Gibco), 100 ед/мл пенициллина и 100 мкг/мл стрептомицина (Gibco) при 37oС в увлажненной атмосфере, содержащей 5% СО2.
Для количественной оценки выживаемости клеток при действии различных препаратов их инкубировали в 96-луночных планшетах с различными концентрациями исследуемых веществ (по три параллельных измерения для каждой концентрации) в течение 3 суток, затем на 2-4 ч добавляли 50 мкл раствора (1 мг/мл) МТТ 3-(4,5-диметилтиазол-2-ил)-2,5-дифенилтетразолия бромида) в среде к 200 мкл среды с клетками. После развития окраски среду удаляли, кристаллы формазана растворяли в 150 мкл диметилсульфоксида и измеряли интенсивность окраски при 540 нм на многоканальном спектрофотометре. Выживаемость клеток оценивали в процентах от соответствующего контроля.
На фиг. 1 представлены данные о выживаемости клеток карциномы яичника человека линии SKOVЗ при инкубации с доксорубицином (ДР) или с конъюгатами АФП-ДР с гидролизуемой (Г) или негидролизуемой (НГ) связью. Из этих данных следует, что оба конъюгата значительно более токсичны, чем свободный ДР в отношении клеток SKOVЗ, а токсичность конъюгатов АФП-ДР с Г и НГ связью близка.
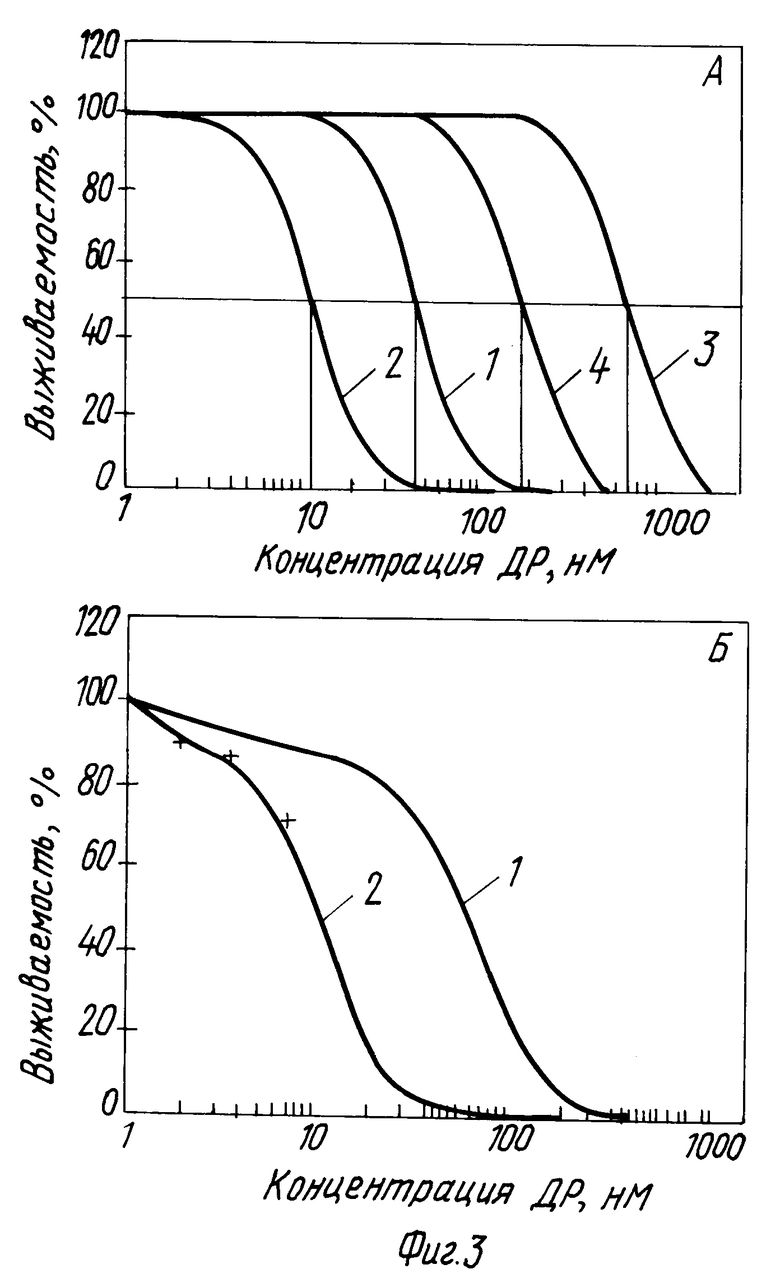
На фиг. 2 представлены данные о выживаемости клеток карциномы яичника человека линии SKVLB, устойчивых к действию ДРК, при инкубации с конъюгатами АФП:ДР с Г и НГ связью соответственно. Эти данные демонстрируют высокую цитотоксическую активность конъюгатов АФП:ДР с НГ связью и в отношении линии клеток, обладающих множественной лекарственной устойчивостью, обусловленной экспрессией гена mdrl.
При использовании схемы эксперимента с отмыванием препарата через 1 ч инкубации и без отмывания конъюгатов с НГ (А) и Г (В) связью, оказалось, что при использовании НГ связи IC50 при инкубации без отмывания возрастает в 20 раз по сравнению с IC50 для варианта с отмыванием препарата спустя 1 ч от начала инкубации (фиг.3А). В то же время при той же схеме эксперимента при Г связи АФП-ДР IC50 при инкубации без отмывания возрастает лишь в 7-8 раз (фиг. 3В), что свидетельствует о меньшей степени деградации конъюгата с НГ связью, т.е. при использовании конъюгата, полученного в соответствии с данным изобретением.
Из представленных результатов следует, что конъюгаты, полученные по примеру 1, обладают таким же уровнем цитотоксической активности, как конъюгаты, полученные по прототипу и, они сохраняют свои свойства и в композициях, т.к. эксперименты на культурах клеток проводили с использованием культуральной среды, как без антибиотиков, так и с добавлением пенициллина и стрептомицина.
Пример 5. Противоопухолевая эффективность полученного по примеру 1 конъюгата АФП с доксорубицином в композиции с физиологическим раствором на модели перевиваемых опухолей мышей.
Для исследования противоопухолевого действия конъюгатов АФП с ДР,полученных как описано в примере 1 (НГ-связь) и в прототипе (Г-связь), вводили в суточной дозе 140 или 280 мкг/кг препарата.
Для оценки терапевтической активности препаратов в отношении солидных опухолей, полученных при п/к введении мышам опухолевых клеток линии Р388 использовали в/в способ введения препаратов. Полученные результаты представлены в табл.3 и на фиг.4. Препараты введены в/в в дозе 140 или 280 мкг/кг по ДР по схеме 3 раза по 1 инъекции раз в три дня.
Из данных, представленных в табл.3, следует, что заявляемый конъюгат позволяет получить терапевтический эффект при в/в способе введения препарата, который оценивался по УСПЖ животных, частоте образования опухолей и частоте случаев излечения.
Из фиг. 4 следует, что полученный по примеру 1 конъюгат АФП:ДР с НГ связью замедлял время появления опухолей и скорость их роста. Торможение роста опухоли при дозе 140 мкг/кг и 280 мкг/кг составило 68,2 и 88,5% соответственно.
Таким образом, показано, что при использовании НГ сшивки ДР с АФП удается получить эффективный при в/в введении конъюгат. Для оптимизации действия таких конъюгатов с ДР и КХ будет отработана специальная схема и выбраны дозы в/в введения препаратов.
Фармацевтические композиции для инъекций получают растворением конъюгата в физрастворе или фосфато-солевом растворе. РН растворов около 7,4. Концентрация конъюгата в растворе составляет 15-35 мг/мл.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ АКТИВНОГО ФРАГМЕНТА АЛЬФА-ФЕТОПРОТЕИНА ЧЕЛОВЕКА | 2010 |
|
RU2448116C2 |
| ПОЛИПЕПТИД, ЯВЛЯЮЩИЙСЯ АНАЛОГОМ РЕЦЕПТОРСВЯЗЫВАЮЩЕГО ФРАГМЕНТА ЭПИДЕРМАЛЬНОГО ФАКТОРА РОСТА С 21-Й ПО 31-Ю АМИНОКИСЛОТУ, ЕГО КОНЪЮГАТ С ДОКСОРУБИЦИНОМ И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ЕГО ОСНОВЕ | 2001 |
|
RU2196604C1 |
| ПРОТИВООПУХОЛЕВЫЙ ПЕПТИДНЫЙ ПРЕПАРАТ НА ОСНОВЕ ФРАГМЕНТА АЛЬФА-ФЕТОПРОТЕИНА, ЕГО КОНЪЮГАТ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ И СПОСОБ ЛЕЧЕНИЯ ГОРМОНЗАВИСИМЫХ ОПУХОЛЕЙ | 2005 |
|
RU2285537C1 |
| КОНЪЮГАТ ПРОТИВООПУХОЛЕВЫХ ПРЕПАРАТОВ С РЕКОМБИНАНТНЫМ АЛЬФА-ФЕТОПРОТЕИНОМ И ЕГО ФУНКЦИОНАЛЬНЫМИ ФРАГМЕНТАМИ И СПОСОБ ИХ ПОЛУЧЕНИЯ | 2016 |
|
RU2630974C1 |
| СПОСОБ ПОЛУЧЕНИЯ ПРЕПАРАТА ДЛЯ НАПРАВЛЕННОЙ ДОСТАВКИ ПРОТИВООПУХОЛЕВОГО ЛЕКАРСТВА В РАКОВУЮ КЛЕТКУ | 1998 |
|
RU2139083C1 |
| ПРОТИВООПУХОЛЕВЫЙ ПРЕПАРАТ | 2011 |
|
RU2451509C1 |
| ПЕПТИД, ЯВЛЯЮЩИЙСЯ АНАЛОГОМ ФРАГМЕНТА АЛЬФА-ФЕТОПРОТЕИНА, КОНЪЮГАТ ПЕПТИДА С ДОКСОРУБИЦИНОМ И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ЕГО ОСНОВЕ ДЛЯ ЛЕЧЕНИЯ ОНКОЛОГИЧЕСКИХ ЗАБОЛЕВАНИЙ | 2006 |
|
RU2317102C1 |
| 2,2,6,6-ТЕТРАКИС(ТРИФТОРМЕТИЛ)-4-ЭТИЛАМИНО-5,6-ДИГИДРО-1,3,5-ОКСАДИАЗИН ("СИНТАЗИН"), СПОСОБ ЕГО ПОЛУЧЕНИЯ И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ИХ ОСНОВЕ | 2001 |
|
RU2203892C1 |
| СПОСОБ ПОЛУЧЕНИЯ КОНЪЮГАТА ФРАГМЕНТА АЛЬФА-ФЕТОПРОТЕИНА ЧЕЛОВЕКА С ЦИПРОФЛОКСАЦИНОМ | 2010 |
|
RU2431639C1 |
| СПОСОБ ПОЛУЧЕНИЯ РАДИОАКТИВНО МЕЧЕННОГО РАДИОНУКЛИДАМИ ЙОДА АЛЬФА-ФЕТОПРОТЕИНА И СПОСОБ ЕГО ПРИМЕНЕНИЯ ДЛЯ ДИАГНОСТИКИ ЗЛОКАЧЕСТВЕННЫХ НОВООБРАЗОВАНИЙ | 2009 |
|
RU2404812C1 |




Использование: в медицине для лечения онкологических больных. Сущность изобретения: предложены конъюгаты биологически активных веществ с альфа-фетопротеином, обладающие избирательным действием по отношению к раковым клеткам-мишеням, в которых конъюгированные части соединены химической связью, устойчивой к действию протеаз и других ферментов биологических жидкостей. Для получения конъюгата белок или биологически активное вещество, содержащие аминогруппу, вводят во взаимодействие с сукцинилимидил-транс-4-(N-малеимидил-метил)циклогексан-1-карбоксилатом и осуществляют сшивку полученного производного с биологически активным веществом или белковой частью альфа-фетопротеина соответственно по SH-группам, которые присутствуют исходно или вводятся дополнительно с помощью сукцинимидного эфира 3-(2-пиридилдитио)пропионовой кислоты. Вариант способа: осуществляют конденсацию аминогрупп указанного белка с альдегидной группой, исходно содержащейся в биологически активном веществе или дополнительно в него введенной после активации периодатом, и затем восстанавливают полупродукт боргидридом. Фармацевтическая композиция содержит эффективное количество конъюгата и носитель, пригодный для внутривенного введения. Биологически активным веществом в конъюгате предпочтительно является калихемицин. 4 с. и 1 з. п. ф-лы, 3 табл. 4 ил.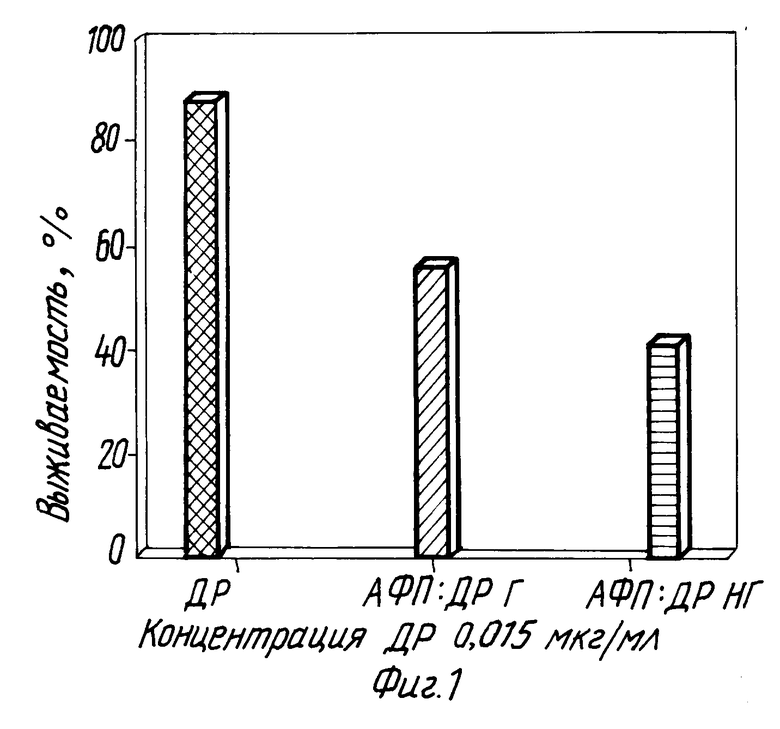
| Экономайзер | 0 |
|
SU94A1 |
| Устройство для сортировки каменного угля | 1921 |
|
SU61A1 |
Авторы
Даты
1997-01-10—Публикация
1996-07-23—Подача