Изобретение относится к медицине и может быть использовано для выделения и очистки активного фрагмента альфа-фетопротеина человека, экспрессированного в виде рекомбинантных телец включения, из биомассы штамма-продуцента, который может быть использован при приготовлении противоопухолевых препаратов направленного действия для избирательного поражения опухолевых клеток.
Известен способ, включающий обработку исходной ткани бутиловым спиртом, центрифугирование при 6000 об/мин в течение 30 минут, диализ водно-белковой фазы против 0.9% раствора хлористого натрия, аффинную хроматографию отдиализованной водно-белковой фазы на иммобилизованных эстрогенах с последующим элюированием альфа-фетопротеина бутиловым спиртом или смесью бутилового спирта с буферным раствором, при этом выход целевого продукта составляет 60-70%, а чистота - 90-95% [SU 583536, A61K 37/02, 05.10.1979].
Недостатком способа является недостаточный выход и чистота целевого продукта.
Известен также способ, включающий измельчение и гомогенизацию эмбриональной ткани зародышей человека 8-12 недель, полученных при медицинских абортах, центрифугирование гомогената при 5000 об/мин, сбор супернатанта, осветление супернатанта центрифугированием при 12000 об/мин, очистку целевого продукта хроматографией на DE-целлюлозе, очистку целевого продукта хроматографией на сефадексе G-100 с иммобилизованным на нем красителем Цибакрон-голубой F36A, очистку целевого продукта рехроматографией на сефадексе G-100 с иммобилизованным на нем красителем Цибакрон-голубой F36A и доочистку целевого продукта хроматографией на DE-целлюлозе [K.Hause et al. Clinica Chemica Acta, 133, 1983, 335-340].
Недостатками этого технического решения являются длительность и трудоемкость процесса выделения альфа-фетопротеина, значительные изменения состава пула альфа-фетопротеина и денатурация части молекул, приводящие к низкому выходу конечного продукта (25-30%) и к снижению его качества (чистота препарата 85-90%), а также низкая стабильность при хранении, а также возможная контаминация вирусами, например вирусом иммунодефицита человека.
Наиболее близким по технической сущности к предложенному является способ, включающий осветление исходного сырья центрифугированием и хроматографическую очистку целевого продукта на аффинном сорбенте, причем перед центрифугированием в сырье добавляют хлорид натрия до конечной концентрации 0,5 М, а хроматографическую очистку проводят последовательно в три стадии, сначала на иммуноаффинном сорбенте, содержащем поликлональные антитела к альфа-фетопротеину, при этом элюцию альфа-фетопротеина с сорбента осуществляют 4 М раствором хлорида магния, полученную фракцию альфа-фетопротеина дополнительно очищают ультрафильтрацией и гельфильтрацией, а затем проводят хроматографическую очистку элюата на иммуноаффинном сорбенте, содержащем комплекс поликлональных антител против белков сыворотки крови человека и против иммуноглобулинов сыворотки крови животного, далее в целевой продукт вводят хлорид натрия и полисахарид, стерилизуют фильтрацией и лиофильно высушивают или хранят в виде раствора.
Кроме того, для приготовления аффинного сорбента используют BrCN-сефарозу или BrCN-агарозу, иммуноаффинная смола на стадии первой хроматографии содержит 5-10 мг/мл поликлональных антител к альфа-фетопротеину, истощенных против белков сыворотки крови человека, а на стадии второй иммуноаффинной хроматографии содержит 5-10 мг/мл комплекса антител против белков сыворотки крови человека и против иммуноглобулинов сыворотки крови животного, использованного для получения антител к альфа-фетопротеину, в качестве полисахарида используют полисахарид типа декстрана, выбранный из группы: полиглюкин, реополиглюкин, реомакродекс, лиофильное высушивание целевого продукта осуществляют в присутствии 5-50 мг/мл хлорида натрия и 2-30 мг/мл полисахарида, а в жидкую форму препарата альфа-фетопротеина вводят хлорид натрия в концентрации 9-50 мг/мл и полисахарид в концентрации 10-50 мг/мл [RU 2123009, C1, A61K 35/14, 10.12.1998].
Недостатком способа является относительно низкая частота целевого продукта, обусловленная высокой возможностью контаминации вирусами, например вирусами иммунодефицита человека.
Требуемый результат заключается в уменьшении возможности контаминации вирусами.
Требуемый результат достигается тем, что в способе выделения и очистки активного фрагмента альфа-фетопротеина человека, экспрессированного в виде рекомбинантных телец включения, из биомассы штамма-продуцента, включающем выделение телец включения, содержащих целевой белок, осуществляют солюбилизацию телец включения, содержащих целевой белок, с последующими ренатурацией и очисткой активного фрагмента альфа-фетопротеина человека.
Кроме того, требуемый технический результат достигается тем, что выделение телец включения, содержащих целевой белок, из биомассы штамма-продуцента осуществляют путем ресуспендирования в фосфатно-солевом буфере (PBS), рН 7.4, NaCl 0.1 M, AEBSF (4-(2-Aminoethyl) benzenesulfonyl fluoride hydrochloride) 1 mM, полученную суспензию подвергают двукратной обработке ультразвуком в течение 2 мин импульсом 0,3 сек при 0° с последующим добавлением к суспензии Triton Х-100 до концентрации 1% и проводят обработку ультразвуком в том же режиме, после чего суспензию центрифугируют при 10000 g в течение 10 мин и полученный осадок суспендируют в фосфатно-солевом буфере (PBS), рН 7.4, NaCl 0.1 M, Na-дезоксихолат 0.1%, после чего суспензию подвергают обработке ультразвуком в том же режиме, вновь центрифугируют при 10000 g в течение 10 мин, ресуспендируют осадок в фосфатно-солевом буфере, рН 7.4 и окончательно центрифугирируют при 10000 g в течение 10 мин.
Кроме того, требуемый технический результат достигается тем, что солюбилизацию телец включения, содержащих целевой белок, осуществляют путем суспендирования в денатурирующем буфере 0.05 М Na2BO3 (рН 8.6), 8 М мочевина, 0.1 М NaCl, 50 мМ В-меркаптоэтанол, инкубируют полученный раствор в течение 2-х часов при комнатной температуре при постоянном перемешивании до полного растворения осадка, после чего его центрифугирируют в течение 15 мин при 13400 g и 7°С.
Кроме того, требуемый технический результат достигается тем, что ренатурацию и очистку фрагмента альфа-фетопротеина человека проводят путем быстрого разведения солюбилизированного белка в буфер для ренатурации, содержащий фосфатно-солевой буфер (PBS), рН 8.0, 5 мМ, глутатион восстановленный (Fluka), 1 мМ глутатион окисленный (Fluka).
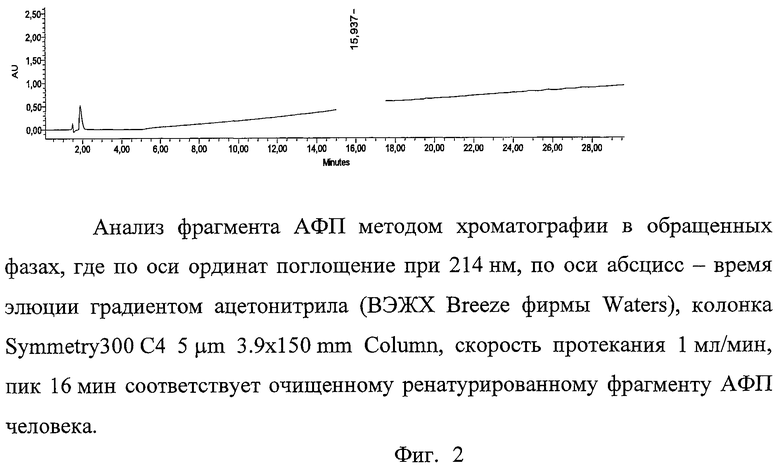
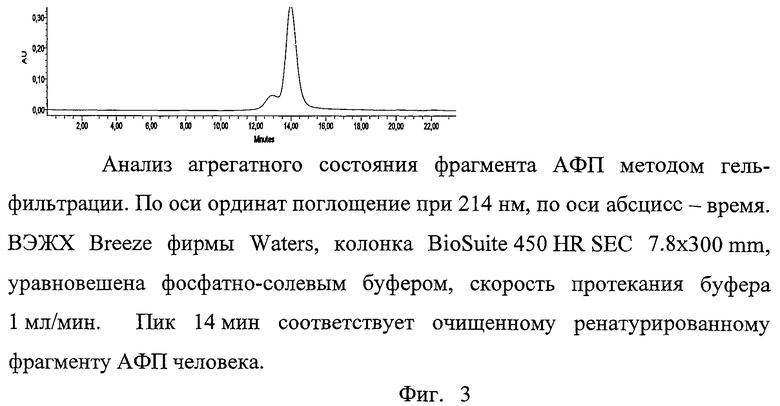
На фиг.1 представлен очищенный рекомбинантный фрагмент АФП человека, где 1 - стандарты молекулярных масс, 2, 3 - весовой стандарт (BSA 0.5 и 1.0 мкг, соответственно), 4, 5, 6, 7 - очищенный ренатурированный фрагмент АФП человека, на фиг.2 - анализ фрагмента АФП методом хроматографии в обращенных фазах, где по оси ординат поглощение при 214 нм, по оси абсцисс - время элюции градиентом ацетонитрила (ВЭЖХ Breeze фирмы Waters), колонка Symmetry300 C4 5 µm 3.9×150 mm Column, скорость протекания 1 мл/мин, пик 16 мин соответствует очищенному ренатурированному фрагменту АФП человека, на фиг.3 - анализ агрегатного состояния фрагмента АФП методом гель-фильтрации, где по оси ординат поглощение при 214 нм, по оси абсцисс - время (ВЭЖХ Breeze фирмы Waters, колонка BioSuite 450 HR SEC 7.8×300 mm, уравновешена фосфатно-солевым буфером, скорость протекания буфера 1 мл/мин, пик 14 мин соответствует очищенному ренатурированному фрагменту АФП человека), на фиг.4 - связывание ФИТЦ-меченного фрагмента АФП человека с клетками аденокарциномы яичника человека SCOV3 и лимфоцитами периферической крови человека, на фиг.5 - аминокислотная последовательность клонированного генного конструкта АФП, где жирным шрифтом выделен тандем аргининов (RR).
Реализуется способ выделения и очистки активного фрагмента альфа-фетопротеина человека, экспрессированного в виде рекомбинантных телец включения, из биомассы штамма-продуцента следующим образом.
Предварительно приведем теоретическое обоснование предложенного способа.
Одним из основных направлений современной фармакологии является направленный транспорт лекарственных препаратов к специфическим локусам организма человека. Преимуществом данного подхода является возможность снижения эффективной дозы лекарственного препарата, так как вместо пассивной диффузии лекарственный препарат направленно доставляется к клеткам-мишеням.
Принципиальным для данного подхода является создание химически или биологически сконструированных макромолекул, состоящих из векторной части и неспецифической части, являющейся лекарственным препаратом. В качестве векторной части должны использоваться молекулы, обладающие специфическим сродством к клеткам-мишеням. В качестве такой векторной части могут быть использованы моноклональные антитела (так же как и поликлональные), специфические к тому или иному антигену на поверхности клетки-мишени (1). Для применения при онкологических заболеваниях векторная часть должна специфически связываться с компонентами (рецепторами) на поверхности раковых клеток. Необходимым условием является практически полное отсутствие данных компонентов (рецепторов) на поверхности нормальных клеток. Применение антител в качестве векторной части столкнулось с целым рядом проблем. Не останавливаясь на них, можно указать, что, несмотря на многолетние работы в течение примерно 30 лет, ни один подобный лекарственный препарат не прошел полностью клинические испытания (1). Неизбежным недостатком иммуноконъюгатов является возможность провоцирования иммунного ответа.
Существует другой класс биологических макромолекул, специфических для раковых клеток, так называемые онкофетальные белки (2). Эти белки не являются чужеродными для данного организма, и рецепторы к ним присутствуют преимущественно в раковых клетках. К этой группе белков относятся альфа-фетапротеин (АФП) (3), раково-эмбриональный антиген, плацентарная щелочная фосфатаза, основной фетапротеин, а также его альфа-, бета- и гамма-формы, панкреатический фетальный белок. Выраженным преимуществом АФП является то, что он специфически связывается и эндоцитируется опухолевыми клетками; в то же время количество рецепторов к нему на нормальных клетках человека очень низко (4-6). В нормальных условиях АФП синтезируется во время эмбрионального развития. Основными местами синтеза являются печень плода и висцеральная энтодерма желточного мешка. Максимальная концентрация АФП достигается в сыворотке плода человека (до 10 мг/мл) (7). Основной функцией АФП является транспорт жирных кислот, тяжелых металлов, билирубина и ряда других компонентов (8). В крови человека в постнатальный период уровень АФП не превышает 10 нг/мл (7). В этот период основную транспортную функцию в крови выполняет сывороточный альбумин. Повышение уровня АФП в крови чаще всего свидетельствует о появлении раковых клеток (опухоли печени, тератокарциномы, опухоли кишечника) (4-6, 9).
АФП является достаточно хорошо изученным белком. Он состоит из одной полипептидной цепи молекулярной массы 74 кДа (10). Белок является гликозилированным, углеводы составляют от 3% до 4.3%. В их состав входят глюкоза, галактоза, манноза, н-ацетилглюкозамин и сиаловая кислота. Экспериментально показана микрогетерогенность АФП, связанная с составом гликозидной части. В пространственной структуре белка методом гомологичного компьютерного моделирования выделяют три домена. Наибольшую гомологию АФП имеет с сывороточным альбумином, пространственная структура которого была определена и используется для моделирования пространственной структуры АФП.
Накопление АФП в клетках происходит в результате рецептор-опосредованного эндоцитоза этого белка. В процессе эндоцитоза АФП сначала обнаруживается в клотриновых везикулах, а затем в эндосомах и складчатых мембранах центральной области аппарата Гольджи (5). При этом основная часть АФП не подвергается деградации, а вновь уходит во внеклеточную среду.
Был идентифицирован рецептор к АФП. Рецепторы были обнаружены в опухолевых клетках рака печени, легких, желудка, молочной железы и др. (5, 6). Иммунологическими методами рецептор был обнаружен на поверхности клеток указанных типов опухолей; при этом содержание рецептора коррелировало со злокачественностью опухоли. В клетках нормальных тканей рецептор АФП не детектировался (4). Указанные обстоятельства полностью отвечают требованиям к векторной молекуле для направленной доставки лекарственных препаратов. Действительно, использование АФП в качестве векторной части для направленного транспорта противоопухолевых антибиотиков в раковые клетки обеспечило высокую эффективность и избирательность. Выраженный позитивный эффект конъюгатов АФП с такими цитостатиками, как доксорубицин, эсперамицин и винбластин, был показан при терапии животных с экспериментальными опухолями АФП (11-13).
Существуют различные методы соединения векторной части и лекарственного препарата. Иногда используются нековалентные связи, но, как правило, предпочтение отдается ковалентному соединению частей получаемого конъюгата. Ковалентное соединение частей конъюгата может быть достигнуто с помощью различных химических связей. С одной стороны, ковалентное соединение должно быть достаточно стабильным, чтобы обеспечить доставку конъюгата к месту действия, при этом следует учитывать не только химическую стабильность данной связи, но и возможность ее разрушения под действием ферментов. С другой стороны, ковалентная связь не должна препятствовать функционированию лекарственного средства, а в оптимальном случае должна разрушаться при попадании конъюгата в клетку. Были использованы способы конъюгирования АФП с лекарственными препаратами, отличительной особенностью одного из которых является то, что аминогруппу АФП модифицируют сукцинимидил-транс-4-(N-малеимидилметил) циклогексан-1-карбоксилатом (SMCC) или N-гидроксисукцинимидным эфиром 3-малеимидбензойной кислоты (MBS), после чего осуществляют сшивку полученного производного с лекарственным препаратом по SH-группам, которые присутствуют исходно или вводятся дополнительно с помощью сукцинимидного эфира 3-(2-пиридилдитио)пропионовой кислоты (SPDP) (14). Другой способ получения конъюгата включает конденсацию аминогрупп АФП с альдегидной группой, исходно содержащейся в лекарственном средстве или дополнительно в него введенной после активации периодатом, и последующего восстановления полупродукта боргидридом.
Полученные указанными способами конъюгаты АФП с несколькими различными цитостатиками, например доксорубицином и калихемицином, обладали избирательным действием по отношению к раковым клеткам-мишеням (14).
Использование природного АФП человека связано с рядом технических, медицинских и этических ограничений. Природный АФП выделяется из абортивного материала. Такой метод выделения запрещен или ограничен в большинстве стран из-за возможной контаминации вирусами, а также в силу несоответствия современным этическим требованиям. Вследствие этого привлекательным является использование рекомбинантного АФП. Более того, имеется возможность использовать не полноразмерный АФП, а его фрагменты, определенные исходя из результатов компьютерного моделирования. Это следует из того, что определенные фрагменты АФП сохраняли способность природного АФП накапливаться в опухолях (15, 16).
Рассмотрим пример реализации предложенного способа выделения и очистки активного фрагмента альфа-фетопротеина человека, экспрессированного в виде рекомбинантных телец включения, из биомассы штамма-продуцента.
Выделение и очистка активного фрагмента альфа-фетопротеина человека из биомассы штамма-продуцента проведено с учетом оптимизации стадий предложенного способа с целью повышения выхода конечного продукта.
Стадия А. Выделение телец включения, содержащих целевой белок, из биомассы штамма-продуцента.
Биомассу штамма-продуцента ресуспендировали в буфере следующего состава: фосфатно-солевой буфер (PBS), рН 7.4, NaCl 0.1 M, AEBSF (4-(2-Aminoethyl) benzenesulfonyl fluoride hydrochloride) 1 mM.
Суспензию подвергали обработке ультразвуком в течение 2 мин (импульс 0,3 сек) при 0°С. Процедуру повторяли дважды. Затем к суспензии добавляли Triton Х-100 до концентрации 1% и еще раз подвергали обработке ультразвуком в том же режиме. Затем суспензию центрифугировали при 10000 g (центрифуга Beckman, ротор JA-14) в течение 10 мин, осадок суспендировали в буфере следующего состава: фосфатно-солевой буфер (PBS), pH 7.4, NaCl 0.1 M, Na-дезоксихолат 0.1%. Суспензию подвергали обработке ультразвуком в том же режиме, затем снова центрифугировали при 10000 g в течение 10 мин. Осадок ресуспендировали в фосфатно-солевом буфере, рН 7.4 и снова центрифугировали. Полученные тельца включения или сразу использовали в дальнейших этапах, или замораживали при -70°С.
Контроль наличия целевого белка в тельцах включения в ходе их очистки, а также возможных потерь осуществлялся с помощью электрофореза в денатурирующих условиях по Леммли. На данном этапе чистота целевого белка по белковому компоненту составляла 70-80%.
Стадия Б. Солюбилизация телец включения, содержащих целевой белок.
Осадок телец включения суспендировали в денатурирующем буфере следующего состава: 0.05 М Na2BO3 (рН 8.6), 8 М мочевина, 0.1 M NaCl, 50 мМ В-меркаптоэтанол. Раствор инкубировали в течение 2-х часов при комнатной температуре при постоянном перемешивании до полного растворения осадка. Затем центрифугировали 15 мин при 13400 g и 7°С (центрифуга Beckman, ротор JA-14).
Стадия В. Ренатурация и очистка фрагмента АФП человека.
Ренатурацию фрагмента рекомбинантного человеческого альфа-фетопротеина проводили с помощью быстрого разведения солюбилизированного белка в буфер для ренатурации, содержащий фосфатно-солевой буфер (PBS), рН 8.0, 5 мМ глутатион восстановленный (Fluka), 1 мМ глутатион окисленный (Fluka). Конечная концентрация рекомбинантного белка составляла 0.01-0.02 мг/мл. Ренатурацию проводили при +4°С в течение 2 суток. Для определения степени ренатурации фрагмента АФП человека использовали хроматографию в обращенных фазах.
На последующей стадии проводили очистку белка методом металлохелатной хроматографии на сорбенте Chelating Sepharose FF (Amersham, Великобритания). Процесс состоял из подготовки хроматографической смолы, нанесения раствора белка со стадии ренатурации, промывки и элюции. Все процедуры производят при 4°С.
Сорбент, заряженный Ni2+, и уравновешенный буфером для ренатурации вносили в раствор разбавленного белка и инкубировали в течение 1 часа. Затем сорбент со связанным белком переносили в хроматографическую колонку и промывали буфером, содержащим фосфатно-солевой буфер (PBS), рН 8.0, 15 мМ имидазол в объеме, превышающем объем сорбента в 20-50 раз. Качество отмывки проверяли спектрофотометрическим методом, измеряя величину светопоглощения при длине волны 280 нм (белковые примеси) и 260 нм (примеси ДНК и РНК), принимая за нулевой уровень поглощения вышеуказанный буфер для промывки.
Элюцию белка с сорбента проводили буфером, содержащим фосфатно-солевой буфер (PBS), рН 8.0, 300 мМ имидазол.
Полученный раствор целевого белка затем диализовали дважды против 500 объемов фосфатно-солевого буфера (PBS), рН 8.0. Для диализа использовали диализный мешок Spectrum Lab., Inc., US & Canada, MWCO: 6-8.000. Каждый цикл диализа проводили при 4°С и постоянном перемешивании в течение суток. Затем раствор белка переносили в стерильную емкость, замораживали и хранили при -70°С.
Наличие целевого белка контролировали после электрофоретического разделения белков в полиакриламидном геле.
Определение физико-химических и биологических свойств фрагмента АФП человека.
Определение концентрации фрагмента АФП человека.
Концентрацию белка в аналитической пробе препарата после диализа определяли, используя стандартный набор ВСА (Bicinchoninic acid protein assay kit, Sigma).
Определение количества несвязанных сульфгидрильных групп в молекуле полученного фрагмента АФП человека.
Определение количества несвязанных сульфгидрильных групп в молекуле белка определяли с помощью 5,5'-дитио-бис-(2-нитробензойной кислоты) - реагента Эллмана (ДТНБ) [Ellman G.L. Tissue sulfhydryl groups. // Arch. Biochem. Biophys. - 1959. - №82 [1]. - P.70-77.]. В результате реакции реагента Эллмана с сульфгидрильными группами образуется окрашенный анион, концентрацию которого определяют по поглощению в видимой области спектра (412 нм).
Анализ фрагмента АФП методом хроматографии в обращенных фазах.
Для определения степени ренатурации фрагмента АФП человека использовали высокоэффективную хроматографию в обращенных фазах. Для этого отбирали пробы из разведенного в буфере для ренатурации белка в начальный момент времени, через 1 час, через сутки и через двое суток. Для анализа применялась ВЭЖХ Breeze фирмы Waters, колонка Symmetry300 C4 5 µm 3.9×150 mm Column. Перед началом хроматографии колонка уравновешивалась 20 объемами раствора 0.1% ТФУ (трифторуксусной кислоты) в воде. Затем вносили аликвоту белка, содержащую 0.1% ТФУ в воде, и вновь уравновешивали колонку 20 объемами раствора 0.1% ТФУ в воде. Элюцию белка вели линейным градиентом буферов А и В.
А:0.1% ТФУ в воде. В:0.1% ТФУ в ацетонитриле.
Скорость протекания буфера 1 мл/мин, общее время 100 мин. Детекция белков проходила по оптическому поглощению при 280 и 214 нм. Было показано, что на конечной стадии ренатурации появляется пик с максимумом выхода около 48% ацетонитрила, в то время как на начальной стадии существует ряд пиков с максимумами выхода от 50 до 70% ацетонитрила. Данный пик соответствует ренатурированному состоянию белка (Фиг.2).
Анализ агрегатного состояния фрагмента АФП человека.
Анализ агрегатного состояния белка в препарате проводили с помощью метода гель-фильтрации. Для анализа применялась ВЭЖХ Breeze фирмы Waters, колонка BioSuite 450 HR SEC 7.8×300 mm. Колонка уравновешивалась фосфатно-солевым буфером (10 объемов), образец (30 мкг) вносился в объеме 40 мкл, скорость протекания буфера 1 мл/мин. Белок детектировался по поглощению при 280 нм и 214 нм. В качестве стандартов использовались белки и соединения известных молекулярных масс: ферритин (440 кДа), бычий сывороточный альбумин (134 и 67 кДа для димера и мономера, соответственно), белок CD81 (30 кДа), лизоцим (14 кДа), раствор NaN3.
Хроматография фрагмента АФП человека выявила один основной пик белка с подвижностью между CD81 (30 кДа) и лизоцимом (14 кДа) (Фиг.4) с центром пика на 14.0 мин и добавочный пик 11.0 мин, соответствующий димеру фрагмента АФП человека. Рассчитанный по времени выхода молекулярный вес фрагмента АФП человека, используя калибровку со стандартами, дает 25 кДа, что близко к теоретическому молекулярному весу этого полипептида. Высокомолекулярные формы и агрегаты отсутствовали в детектируемых количествах.
Определение вторичной структуры в препарате фрагмента АФП человека методом кругового дихроизма.
Исследование вторичной структуры белка проводилось с использованием спектроскопии кругового дихроизма (КД) на спектрополяриметре JASCO-600 (Япония) в диапазонах длин волн от 200 нм до 250 нм. Значения молярной эллиптичности рассчитывались из уравнения:
[θ]=[θ]измМост/(LC),
в котором С - концентрация белка (мг/мл), L - длина оптического пути кюветы (мм), [θ]изм - измеренная эллиптичность (градусы) и Мост - средняя молекулярная масса остатка пептида (Да), рассчитанная из его аминокислотной последовательности. Измерения проводились в 0.1 мм кювете при концентрации белка 0.41 мг/мл.
Полученные результаты показывают, что белок имеет ярко выраженные пики поглощения на 190, 208 и 222 нм. Это согласуется с преимущественно альфа-спиральной структурой (Woody RW, 1994. Circular dichroism of peptide and proteins. In: circular dichroism: principles and applications). Интенсивности сигналов говорят о том, что белок очень хорошо структурирован.
Пространственная структура альфа-фетопротеина не определена. В работах исходят из того, что белок имеет пространственную и вторичную структуру, близкую к своему гомологу - сывороточному альбумину, пространственная структура которого исследована. Исходя из этих данных, считается, что альфа-фетопротеин является белком с вторичной структурой преимущественно из альфа-спиралей. В литературе описан анализ вторичной структуры альфа-фетопротеина методом кругового дихроизма (S.Leong & А.Middelberg, 2006). Как для нативного белка, так и его рекомбинантной формы, после ренатурации были получены схожие профили кругового дихроизма с выраженными пиками поглощения на 190, 208 и 222 нм, соответствующие, как указывают авторы, преимущественно альфа-спиральной структуре. Общий профиль эллиптичности, распределение основных пиков и их интенсивности, представленные для полноразмерного альфа-фетопротеина в указанной работе, соответствуют полученным нами данным для рекомбинантного третьего домена АФП человека. Хотя сравнивать данные для полноразмерного белка и его части, одного из доменов, следует с осторожностью, можно заключить, что полученный нами целевой белок, фрагмент АФП человека, имеет структуру, близкую к таковой в нативном белке.
Подтверждение идентичности полученного фрагмента АФП человека методом масс-спектрометрии.
Подтверждение идентичности полученного препарата фрагмента АФП человека проводили методом масс-спектрометрического анализа. Суть анализа состоит в расщеплении исходного белка на фрагменты под действием трипсина с последующей идентификацией полученных фрагментов методом MALDI, одного из видов масс-спектрометрического анализа. Данный подход является одним из основных для идентификации белков.
В ходе анализа были идентифицированы 9 пептидов альфа-фетопротеина. В соответствии с принятыми критериями анализируемый белок идентифицирован как фрагмент альфа-фетопротеина человека.
Анализ N-концевой последовательности препарата фрагмента АФП человека.
Образец, 200 мкл препарата целевого белка после хроматографии в обращенных фазах (см. выше), концентрировали в 4 раза на приборе SpeedVac. Для определения N-концевой последовательности белка использовался белковый секвенатор Prosice 492 (Applied Biosystems) с программой и реактивами производителя.
Ожидаемая последовательность полученного нами целевого белка, начиная с инициаторного метионина, в однобуквенном виде - MYIQES. Наличие инициаторного метионина необходимо для синтеза на рибосоме практически любого белка. В большинстве белков инициаторный метионин частично или полностью отщепляется, это верно и для белков, экспрессированных в Е.coli.
Полученная в ходе анализа последовательность препарата белка - YIQES, т.е. она соответствует ожидаемой без инициаторного метионина. Необходимо напомнить, что в С-конец белка была вставлена последовательность из 7 остатков гистидина для аффинного выделения белка методом металл-хелатной хроматографии. Полная аминокислотная последовательность клонированного конструкта представлена на фиг.5.
Анализ эффективности очистки фрагмента АФП человека от эндотоксина.
Предложенная нами методика выделения биологически активного рекомбинантного фрагмента АФП человека позволяет эффективно отделять белковый препарат от эндотоксина.
Для анализа содержания липополисахаридов клеточной стенки (ЛПС), или эндотоксина, в препарате фрагмента АФП человека проводили ЛАЛ тест использованием стандартного протокола, прилагаемого к набору для определения ЛПС. Был использован набор фирмы Associates of Cape Cod Incorporated (США) с заявленной чувствительностью 0.03 ЕЭ/мл, где ЕЭ - единицы эндотоксина.
Анализ содержания липополисахаридов клеточной стенки (ЛПС) в препарате фрагмента АФП человека показал, что количество эндотоксина не превышает ≈1500 ЕЭ на 1 мг белкового продукта.
Проверка функциональности фрагмента АФП человека: специфическое связывание и эндоцитоз в клетки, несущие рецептор к альфа-фетопротеину.
Накопление АФП в клетках происходит в результате рецептор-опосредованного эндоцитоза этого белка. Был идентифицирован рецептор к АФП. Рецепторы были обнаружены в опухолевых клетках рака печени, легких, желудка, молочной железы и др. (Villacampa MJ et al (1984) Alpha-fetoprotein receptor in a human breast cancer cell line Biochem. Biophys. Res. Commun., 122: 1322-1327; Moro R. et al (1993) Monoclonal antibodies directed against a widespread oncofetal antigen: The alpha-fetoprotein receptor. Tumor Biol., 14: 116-130). Иммунными методами рецептор был обнаружен на поверхности клеток указанных типов опухолей; при этом содержание рецептора коррелировало со злокачественностью опухоли. В клетках нормальных тканей рецептор АФП не детектируется (Ницветов М.Б. и др. (2005) изучение экспрессии рецептора AFP в опухолевых и нормальных тканях человека с помощью иммуногистохимического метода. Иммунология. 26: 122-125).
Проверку специфичности связывания и проникновения в клетки полученного рекомбинантного фрагмента АФП человека осуществляли с использованием клеток аденокарциномы яичника человека линии SKOV3. Контролем служили лимфоциты периферической крови, не несущие рецепторов к АФП. Для анализа использовали конъюгат фрагмента АФП человека с флюоресцентной меткой - флюоресцеином (FITC). FITC меченный белок получали по стандартной методике [Horisberger, М. (1984). In Immunolabeling for Electron Microscopy. Polak, J., Vamdel, I. Ed. Elsevier: Amsterdam, p.98].
Общепринято, что при температуре +4°С белки связываются с соответствующими рецепторами на поверхности клеток, при их наличии, но не проникают внутрь. При физиологической температуре белки, связавшиеся с рецепторами, подвергаются эндоцитозу, т.е. проникают в клетки. Конъюгат фрагмента АФП человека с FITC (АФП3д-FITC) эффективно связывается при +4°С с клетками аденокарциномы яичника человека линии SKOV3, имеющими рецепторы к АФП, но не с лимфоцитами, не имеющими соответствующих рецепторов. Очевидно, данный результат говорит о специфическом связывании АФП3д-FITC со специфическим рецептором к АФП на поверхности клеток SKOV3. При +37°С наблюдается высокий уровень эндоцитоза АФП3д-FITC в клетки SKOV3, в сравнении с этим эндоцитоз АФП3д-FITC в лимфоциты идет на очень низком уровне. Уровень флюоресценции в клетках SKOV3 при +37°С существенно выше, что соответствует данным по эндоцитозу полноразмерного АФП в этих клетках. Это свидетельствует о том, что при эндоцитозе рецептор АФП может рециклировать, обеспечивая проникновение нескольких молекул фрагмента АФП человека.
Таким образом, благодаря усовершенствованию известного способа выделения и очистки активного фрагмента альфа-фетопротеина человека получено более высокое качество целевого продукта, поскольку практически исключается возможности контаминации вирусами, например вирусами иммунодефицита человека.
Литература
1. Pastan I. et al. (2007) Immunotoxin treatment of cancer.
Annu Rev Med, 58: 221-237.
2. Coggin JH et al. (2005) Contemporary definitions of tumor specific antigens, immunogens and markers as related to the adaptive responses of the cancer-bearing host.
Anticancer Res., 25: 2345-2355.
3. Bergstrand G. and Czar B. (1956) Demonstration of a new protein fraction in serum from the human fetus.
Scan. J. Clin. Lab. Invest., 8: 174-179.
4. Ницветов М.Б.и др. (2005) Изучение экспрессии рецептора AFP в опухолевых и нормальных тканях человека с помощью иммуногистохимического метода.
Иммунология, 26: 122-125.
5. Villacampa MJ et al. (1984) Alpha-fetoprotein receptor in a human breast cancer cell line
Biochem. Biophvs. Res. Commun., 122: 1322-1327.
6. Moro R. et al. (1993) Monoclonal antibodies directed against a widespread ancofetal antigen: The alpha-fetoprotein receptor.
Tumor Biol., 14: 116-130.
7. Mizejewski G. (2003) Levels of alpha-fetoprotein during pregnancy and early infancy in normal and disease states.
Obsterical and Ginecological Survey, 58: 804-826.
8. Mizejewski G. (2001) Alpha-fetoprotein structure and function: relevance to isoforms, epitopes and conformational variants.
Exp. Biol. Med., 226: 377-408.
9. Moro R et al. (1995) A new broad-spectrum cancer marker IVD technology.
www.devicelink.com/ivdt
10. Beattie, W.G. and Dugaiczyk, A (1982) Structure and evolution of human alpha-fetoprotein deduced from partial sequence of cloned cDNA.
Gene, 20:415-420.
11. Северин С.Е. и др. (1999) Противоопухолевая активность ковалентного конъюгата ендиинового антибиотика эсперамицина Al с α-фетопротеином человека.
Докл. Акад. Наук. 366: 561-564.
12. Moskaleva Е.Yu. et al. (1996) In vivo antitumor activity of cytotoxic drugs conjugated with human alpha-fetoprotein.
Tumor Targeting, 2: 299-306.
13. Severin S.E. et al. (1997) Antitumor activity of conjugates of the oncofetal protein alpha-fetoprotein and phthalocyanines in vitro.
Biochem.Mol. Biol.43: 1081-1089.
14. Лужков Ю.М. и др.(1997) Конъюгаты биологически активных веществ с α-фетопротеином, обладающие избирательным действием по отношению к раковым опухолям, способ их получения (варианты) и фармацевтическая композиция на их основе.
Патент РФ №2071351.
15. Line В.R. et al. (1999) Scintigraphic detection of breast cancer xenografts with Tc-99m natural and recombinant human alpha-fetoprotein.
Cancer Biother Rediopharm., 14: 485-494.
16. Festin SM et al. (1999) The recombinant third domain of human alpha-fetoprotein retains the antiestrotrophic activity found in the full-length molecule.
Biochim. Biophys. Acta. 19: 307-314.
| название | год | авторы | номер документа |
|---|---|---|---|
| ПРОТИВООПУХОЛЕВЫЙ ПЕПТИДНЫЙ ПРЕПАРАТ НА ОСНОВЕ ФРАГМЕНТА АЛЬФА-ФЕТОПРОТЕИНА, ЕГО КОНЪЮГАТ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ И СПОСОБ ЛЕЧЕНИЯ ГОРМОНЗАВИСИМЫХ ОПУХОЛЕЙ | 2005 |
|
RU2285537C1 |
| СПОСОБ ПОЛУЧЕНИЯ РАДИОАКТИВНО МЕЧЕННОГО РАДИОНУКЛИДАМИ ЙОДА АЛЬФА-ФЕТОПРОТЕИНА И СПОСОБ ЕГО ПРИМЕНЕНИЯ ДЛЯ ДИАГНОСТИКИ ЗЛОКАЧЕСТВЕННЫХ НОВООБРАЗОВАНИЙ | 2009 |
|
RU2404812C1 |
| ПРОТИВООПУХОЛЕВЫЙ ПРЕПАРАТ | 2011 |
|
RU2451509C1 |
| ШТАММ Escherichia coli BL21(DE3)/pAFP11D3 - ПРОДУЦЕНТ ФРАГМЕНТА С 404 ПО 609 АМИНОКИСЛОТУ АЛЬФА-ФЕТОПРОТЕИНА ЧЕЛОВЕКА | 2010 |
|
RU2422512C1 |
| КОНЪЮГАТ ПРОТИВООПУХОЛЕВЫХ ПРЕПАРАТОВ С РЕКОМБИНАНТНЫМ АЛЬФА-ФЕТОПРОТЕИНОМ И ЕГО ФУНКЦИОНАЛЬНЫМИ ФРАГМЕНТАМИ И СПОСОБ ИХ ПОЛУЧЕНИЯ | 2016 |
|
RU2630974C1 |
| СПОСОБ ПОЛУЧЕНИЯ КОНЪЮГАТА ФРАГМЕНТА АЛЬФА-ФЕТОПРОТЕИНА ЧЕЛОВЕКА С ЦИПРОФЛОКСАЦИНОМ | 2010 |
|
RU2431639C1 |
| СПОСОБ ПОЛУЧЕНИЯ ПРЕПАРАТА ДЛЯ НАПРАВЛЕННОЙ ДОСТАВКИ ПРОТИВООПУХОЛЕВОГО ЛЕКАРСТВА В РАКОВУЮ КЛЕТКУ | 1998 |
|
RU2139083C1 |
| СПОСОБ ПОЛУЧЕНИЯ ПРЕПАРАТА БЕЛКА ИЗ СЕМЕЙСТВА СТРЕССОВЫХ И ПРЕПАРАТ БЕЛКА HSP70, ПОЛУЧЕННЫЙ ЭТИМ СПОСОБОМ | 2005 |
|
RU2283128C1 |
| Фотосенсибилизатор на основе карбоцианинового красителя для фотодинамической терапии опухолей | 2016 |
|
RU2638131C1 |
| КОНЪЮГАТЫ БИОЛОГИЧЕСКИ АКТИВНЫХ ВЕЩЕСТВ С α -ФЕТОПРОТЕИНОМ, ОБЛАДАЮЩИЕ ИЗБИРАТЕЛЬНЫМ ДЕЙСТВИЕМ ПО ОТНОШЕНИЮ К РАКОВЫМ ОПУХОЛЯМ, СПОСОБ ИХ ПОЛУЧЕНИЯ (ВАРИАНТЫ) И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ИХ ОСНОВЕ | 1996 |
|
RU2071351C1 |



Изобретение относится к медицине. Предложен способ выделения и очистки активного фрагмента альфа-фетопротеина человека. Способ включает выделение телец включения, содержащих целевой белок, из биомассы штамма-продуцента, их солюбилизацию с последующими ренатурацией и очисткой активного фрагмента альфа-фетопротеина человека. Изобретение может быть использовано для получения активного фрагмента альфа-фетопротеина человека в целях приготовления противоопухолевых препаратов направленного действия для избирательного поражения опухолевых клеток. 5 ил.
Способ выделения и очистки активного фрагмента альфа-фетопротеина человека, экспрессированного в виде рекомбинантных телец включения, из биомассы штамма-продуцента, состоящий из выделения телец включения, содержащих целевой белок, из биомассы штамма-продуцента, отличающийся тем, что осуществляют солюбилизацию телец включения, содержащих целевой белок, с последующими ренатурацией и очисткой активного фрагмента альфафетопротеина человека, при этом выделение телец включения, содержащих целевой белок, из биомассы штамма-продуцента осуществляют путем ресуспендирования в фосфатно-солевом буфере (PBS), pH 7,4, NaCl 0,1 M, AEBSF (4-(2-Aminoethyl) benzenesulfonyl fluoride hydrochloride) 1 mM, полученную суспензию подвергают двукратной обработке ультразвуком в течение 2 мин импульсом 0,3 с при 0° с последующим добавлением к суспензии Triton Х-100 до концентрации 1% и проводят обработку ультразвуком в том же режиме, после чего суспензию центрифугируют при 10000 g в течение 10 мин и полученный осадок суспендируют в фосфатно-солевом буфере (PBS), pH 7,4, NaCl 0,1 M, Na-дезоксихолат 0,1%, после чего суспензию подвергают обработке ультразвуком в том же режиме, вновь центрифугируют при 10000 g в течение 10 мин, ресуспендируют осадок в фосфатно-солевом буфере, pH 7,4 и окончательно центрифугирируют при 10000 g в течение 10 мин, при этом солюбилизацию телец включения, содержащих целевой белок, осуществляют путем суспендирования в денатурирующем буфере 0,05 М Na3BO3 (рН 8,6), 8 М мочевина, 0,1М NaCl, 50 мМ В-меркаптоэтанол, инкубируют полученный раствор в течение 2-х ч при комнатной температуре при постоянном перемешивании до полного растворения осадка, после чего его центрифугирируют в течение 15 мин при 13400 g и 7°С, при этом ренатурацию проводят путем быстрого разведения солюбилизированного белка в буфер для ренатурации, содержащий фосфатно-солевой буфер (PBS), рН 8,0, 5 мМ, глутатион восстановленный (Fluka), 1 мМ глутатион окисленный (Fluka).
| POSYPANOVA G.A | |||
| et al | |||
| "Recombinant alpha-fetoprotein C-terminal fragment: the naw recombinant vector fog targeted delivery" | |||
| Journal of drug targeting, 2008, v.16, n.4, p.321-328 | |||
| ПРОТИВООПУХОЛЕВЫЙ ПЕПТИДНЫЙ ПРЕПАРАТ НА ОСНОВЕ ФРАГМЕНТА АЛЬФА-ФЕТОПРОТЕИНА, ЕГО КОНЪЮГАТ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ И СПОСОБ ЛЕЧЕНИЯ ГОРМОНЗАВИСИМЫХ ОПУХОЛЕЙ | 2005 |
|
RU2285537C1 |
| BENETT J.A | |||
| et al | |||
| "Similarity between natural and recombinant alpha-fetoproteins as inhibitors of cancer growth", Breast | |||
Авторы
Даты
2012-04-20—Публикация
2010-02-01—Подача