Изобретение относится к способу синхронизации роста клостридий, которые применяют для получения клеток, продуцирующих растворители, ферменты, антибиотики, полезные токсичные белки или рефрактильные эндоспоры. Вегетативные клетки бактерий рода Clostridium могут быть массово преобразованы в синхронизированные, продуцирующие растворители клетки одинаковой критической длины, или же это преобразование можно проводить таким образом, чтобы селективно индуцировать образование рефрактильных эндоспор. Более конкретно, бактерии синхронизируются по числу клеток в массе с помощью селективного субкультивирования в среде, содержащей медленно преобразующие в ходе обмена веществ источники углерода для того, чтобы избежать произвольного роста клеток. Синхронизированные клетки удлиняются как минимум в три раза по сравнению с длиной вегетативных клеток, и на этой стадии они начинают продуцировать растворители. Синхронность массы и числа клеток стабилизируется при добавлении в среду как минимум 0,01 М двухвалентных катионов. Если желательно сохранить продуцирование растворителя, рост следует затормозить химическим или физическим путем. В тех случаях, когда желательно получить клетки, продуцирующие ферменты, антибиотики или токсичные белки, рост клеток может остановить на избранных стадиях, находящихся за рамками стадии продуцирования растворителей, путем торможения деления клеток или репликации ДНК.
Некоторые анаэробные, термофильные, образующие эндоспоры бактерии рода Clostridium способны только на ограниченное метаболическое продуцирование ферментов, антибиотиков, токсичных белков или на образование растворителей в результате ацетонобутилоэтилового брожения (АВЕ). Особые свойства этого рода в основном объясняются их расширенной генетической многосторонностью, при которой значительное продуцирование эндоспор происходит только при определенных физиологических условиях. Эндоспоры отличаются способностью выдерживать экстремальные условия, которые бы разрушили клетки в вегетативном состоянии. Морфологические изменения, проявляемые клетками клостридий, связаны с изменениями активности клеточного фермента. В зависимости от условий культуры эти бактерии могут в процессе роста вступать на стадию продуцирования кислоты или продуцирования растворителя. Поэтому необходимым условием для коммерческого производства клеточных металобитов является регулирование всего процесса споруляции.
Некоторые виды бактерий рода Clostridium способны прямо преобразовывать недорогие отходы биомассы, такие как ксилан или другие полимеры пентозы, в растворители без предварительной деполимеризации субстрата. Благодаря тому, что некоторые клостридии анаэробные и термофильные, процессы промышленного брожения с использованием этого рода могут осуществляться при относительно высоких температурах. Поэтому выделение продуктов брожения требует меньше энергии, так как оно может осуществляться с помощью перегонки в вакууме непосредственно из ферментационного сосуда. При выделении в вакууме также уменьшаются проблемы, связанные с токсичностью растворителя для сбраживающихся клеток. Клостридии обладают высокой скоростью метаболизма, а это уменьшает необходимое время нахождения в биореакторе, дает высокое соотношение конечных продуктов с клетками и максимальный общий выход биореакции. Кроме того, использование термофильной системы наряду с упрощенной культуральной средой, а также определенное большое число инокулированных клеток обеспечивают меньшую подверженность этой системы загрязнению. Следовательно, можно исключить стерилизацию сырья.
Лигноцеллюлозная биомасса, самое дешевое и наиболее изобильное сырье для процессов бактериального брожения, состоит из следующих трех фракций: кристаллической целлюлозы, гемицеллюлозы и лигнина, каждую из которых необходимо обрабатывать отдельно. Целлюлозу можно гидролизовать в глюкозу с помощью кислотных или ферментативных катализаторов. Но кислотные катализаторы продолжают разрушать полученную глюкозу. Ферментативные процессы еще не достаточно хорошо развиты и, следовательно, не экономичны. Гемицеллюлоза в основном состоит из ксилана, который легко гидролизируется в ксилозу, но его трудно сбраживать в этанол при помощи существующих технологий сбраживания. Лигнин не относится к сахарным полимерам и, следовательно, его нельзя сбраживать для получения этанола, но можно преобразовывать термохимическим путем для использования в качестве добавки к жидкому топливу.
Анаэробный Clostridium acetobutylium стали применять для промышленного производства растворителей еще в 1920-х годах, используя в качестве сырья мелассу. Но самый высокий выход, который смогли получить, составил около 1,8% и даже такой выход не был надежным и стабильным из-за восприимчивости C. acetobutylicum к инфекциям фагами (бактериальными вирусами). Способ, предлагаемый в данном изобретении, позволяет контролировать скорости образования продукта и его выход, а также использовать более дешевое лигноцеллюлозное сырье. В предпочтительных вариантах изобретения используются термофильные организмы рода Clostridium, которые благодаря своей способности расти при повышенных температурах делают этот процесс более эффективным с точки зрения энергозатрат. Кроме того, термофильные клостридии не восприимчивы к фаговым инфекциям.
Одну из форм синхронного удлинения Clostridium thermosaccharolyticum описал Эдвард Су, один из авторов изобретения в "Store Research", опубликованном издательством Академии Пресс (Лондон, 1976, с.223-242), но в этой работе нет ссылки на синхронный рост клеток в присутствии двухвалентного катиона, способного стабилизировать клетки во время как минимум их окончательного размножения.
Продуцирующие этанол мутанты Clostridium thermosaccharolyticum описаны в патенте США N 4652526, выданном на имя Эдварда Су, одного из авторов изобретения. В этом патенте также не упоминается синхронный рост клеток в питательной среде при условиях, когда двухвалентный катион добавляется для стабилизации клеток.
Повторяющееся субкультирование Clostridium acetobutylicum в питательной среде, содержащей определенное количество двухвалентных катионов описал - Hartmanis et al, (Applied Microbiology and Biotechnology), т. 23 1986, с. 369-371). В исходную культуру для предотвращения дегенерации клеток после только трех переносов включали небольшое количество кальция. Добавление СаCO3 позволяло провести до десяти переносов без дегенерации клеток. Таким образом, добавление кальция исключает необходимость многократной обработки температурным шоком для приготовления исходной культуры. Но синхронизация роста клеток относительно их числа и эффективной массы для получения достаточно однородной клеточной популяции не проводилась. Процесс, в котором каждой субкультуре позволяют развиваться в течение как минимум 24 части для того, чтобы образовались термостойкие споры. Сообщается, что минимальное количество кальция в питательной среде делает споры более термоустойчивыми.
В патенте США N 4778760 на имя Ишида и др. описывается эффект небольшого количества кальция (4 части на тысячу) для стабилизации термостабильных термофильных анаэробных бактерий класса Clostridium, продуцирующих амилазу. Но кальций не используется как компонент питательной среды для бактериальных клеток.
Изобретение позволяет получать бактерии рода Clostridium, которое можно использовать для селективного продуцирования растворителей, таких как этанол и бутанол с гораздо более высокой производительностью, чем получали до настоящего времени. Кроме того, можно селективно продуцировать фермент или антибиотики. Важен также тот факт, что в то время как выделение растворителей при известных технологиях не превышало 1 2% данный способ позволяет достичь выделения около 11% растворителей. При уровне выделения растворителей 11% бутанол и этанол могут выделяться в соотношении 2:1. При уровнях выделения растворителей в районе 6,5% выделение этанола возрастает до соотношения 1:1. В качестве питательной среды для специально подготовленных клеток может использоваться дешевое сырье. Факультативно можно позволить процессу подготовки клеток достичь стадии полного образования спор, чтобы также осуществляться более эффективно, чем с помощью известных технологий.
Предпочтительный способ включает синхронизированный рост количества и массы анаэробных клеток клостридий до критической длины. Клетки выращивают в периодических культурах на питательной среде с дешевым источником углерода. Полученные клетки синхронизированной культуры находятся точно на той же самой стадии цикла цитокинеза, и отдельные клетки находятся "в фазе" со своими соответствующими процессами. В зависимости от желательного конечного продукта клетки можно собирать и хранить, или же можно продолжать процедуру до стабилизации клеток с помощью добавления источника двухвалентных катионов, после чего наступает торможение роста клеток. Полученные бактерии обладают способностью продолжать метаболизм в течение продолжительного времени. Конечные продукты метаболизма, которые могут быть выделены из таких клеток, включают растворители, деградирующие углеводы, ферменты, протеазы, липазы, нуклеазы, антибиотики, кристаллические параспороподобные белки и другие токсичные белки, такие, как, например, белки, использующиеся в качестве органических инсектицидов.
Предпочтительной питательной средой является базальная среда для конкретного вида, содержащая 0,1 15% объемного веса медленно преобразующегося в ходе обмена веществ источника углерода. Скорость роста бактерий в такой среде должна быть на 10 30% меньше максимальной скорости роста Km для бактерий в оптимальной питательной среде. Наиболее предпочтительно, в качестве источника углерода использовать полимер пентозы, такой как ксилан, который экономично получают из пшеничной соломы, рисовой соломы, рисовой шелухи, стеблей кукурузы, сердцевин кукурузных початков, фруктовой кожуры, гемицеллюлозы и остатков целлюлозы из отходов бумажных фабрик или других подходящих органических сельскохозяйственных, промышленных или муниципальных отходов.
Клетки синхронизируют при помощи одного или нескольких предпочтительных способов повторяющегося разбавления, центрифугирования или мембранной фильтрации, за которыми следует повторяющееся субкультивирование. Клетки выращивают при температуре от -20o до +10oC, которая является оптимальной температурой роста для конкретной среды. Период роста ограничен 1,0 1,5 поколениями или составляет 1,0 1,5 времени "удвоения", т.е. времени, необходимого для размножения культуры в два три раза по сравнению с исходной концентрацией. Для синхронизации клеток требуется как минимум три - четыре отдельных периода роста, между которыми проводится два три разбавления, центрифугирования или мембранные фильтрации для удаления отходов клеточного метаболизма. В предпочтительных вариантах синхронизированные клетки все имеют одинаковую критическую длину, которая составляет от трех, предпочтительно четырех, до двадцати длин нормальных вегетативных клеток. Но можно удлинять клетки и в 100 раз по сравнению с их вегетативной длиной.
Удлиненные синхронизированные клетки субкультивируются, чтобы позволить им размножаться дальше от 1,0 до 12,0 поколений, т.е. в течение времени, необходимого для размножения культуры в 2 4,096 раз по сравнению с исходной концентрацией. Клетки субкультивируются в питательной среде, содержащей двухвалентные катионы, такие как кальций, магний, марганец, железо или цинк для стабилизации клеток и предотвращения их гибели, лизиса или агрегации. Хорошие результаты получаются при добавлении как минимум 0,01 М двухвалентных катионов в питательную среду. Можно использовать такое количество двухвалентных катионов, которое превышает их растворимость в питательной среде, с тем, чтобы избыток двухвалентного соединения, растворяющегося как двухвалентные катионы, ассимилировался в размножающиеся клетки. Лучшие результаты получаются, если концентрация двухвалентных катионов поддерживается на уровне от минимум 0,01 М до приблизительно 0,2 М, причем предпочтительная концентрация двухвалентных катионов составляет как минимум 0,1 М. Можно использовать среду трех видов: среду, в которой единственным источником углерода является ксилан, и это ксилан дополняется дополнительным источником углерода, т.е. двухвалентной солью органической кислоты; и среду, в которой, двухвалентная соль органической кислоты является единственным источником углерода. Предпочтительны органические соединения кальция, например, глюконат, лактат, бутират или формат кальция.
Синхронизированные клетки, стабилизированные глюконатом кальция, могут сохранять устойчивость даже в присутствии ингибиторов роста в течение шести месяцев. Глюконат кальция наиболее предпочтительный источник двухвалентных катионов, поскольку он не только обеспечивает необходимые двухвалентные ионы кальция, но и служит отличным источником углерода, который метаболизируется так же, как глюкоза, но гораздо медленнее.
Культуры, которые синхронизируются в результате последовательного переноса (как минимум двух субкультур) в среде, содержащей медленно преобразующий в ходе обмена веществ источник углерода, в результате проявляют такое модифицированное деление клеток, о котором не сообщалось ранее ни для какого вида бактерий, включая виды Clostridium. Согласно изобретению клетки, удлиняются, например, в 16 20 раз и образуют единую перегородку, которая делит клетку необычным образом, при котором нить делится на две равные клетки, которые остаются удлиненными. Если на вновь образованных клетках, удлиненные в 8 10 раз, наблюдается перегородка, это значит что либо клетка разделиться на равные части еще раз, либо образуется перегородка споры. Таким образом клетка удлиняется, например, в 16 раз, делится на две равные клетки, удлиненные в 8 раз, а затем делится, образуя четыре клетки, которые остаются удлиненными в четыре раза (критическая длина).
Подходящие источники углерода, медленно преобразующиеся в ходе обмена веществ, включают амигдалин, арабинонозу, целлобиозу, галактозу, гликоген, мелибиозу, α -метилглюкозид, b -метилглюкозид, раффинозу, салицин, крахмал, трегалозу, ксилан, Са-ацетат, Са-бутират, Са-цитрат, Са-фомат, Са-глюконат и Са-лактат.
Предыдущие попытки продуцировать относительно однородные популяции свободных рефрактильных спор C.thermosaccharolyticum не принесли успеха. Способ согласно изобретению включает создание таких условий культуры, которые допускают полную дифференциацию вегетативных клеток до уровня, при котором можно продуцировать 100% свободных рефрактильных спор.
Если желательным конечным продуктом являются клетки, которые можно было бы продавать как товар, их можно собирать, промывать при помощи многократного центрифугирования и ресуспензирования или фильтрации и хранить при 4oC. С другой стороны, если желательно в качестве конечного продукта иметь споры, температуру стабилизированной культуры предпочтительно повышают или понижают относительно диапазона температур роста культуры, например, от -20oC до приблизительно +10oC по сравнению с оптимальной температурой роста. Деление клеток при такой температуре прекращается, но дифференциация клеток, образование спор и метаболизм будут продолжаться. Если желательно получить конечный продукт, который можно продуцировать с помощью удлиненных спорулирующих клеток, например, растворители, рост полученных синхронизированных стабилизированных клеток предпочтительно затормозить с помощью изменения температуры или использования антимикробных химических агентов, таких как антибиотики и красители. Образование спор, так же как и деление клеток прекращается после добавления таких агентов, но метаболические процессы, такие как продуцирование растворителя, продолжаются.
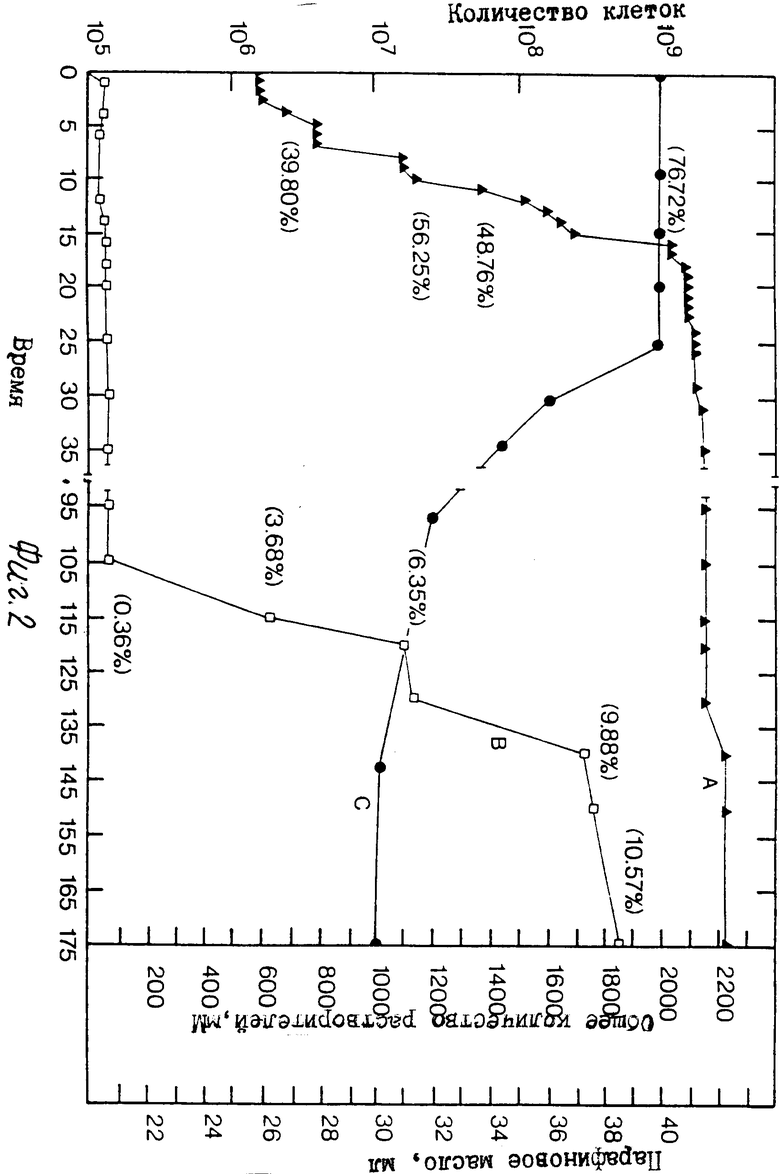
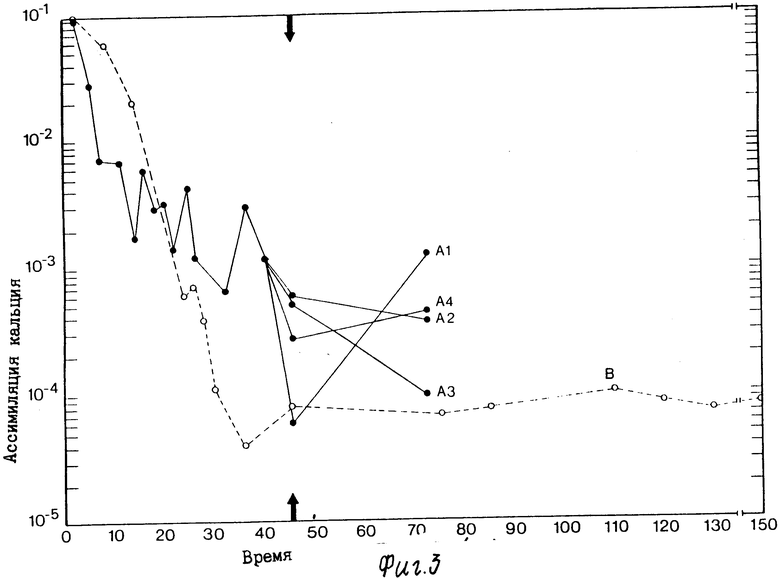
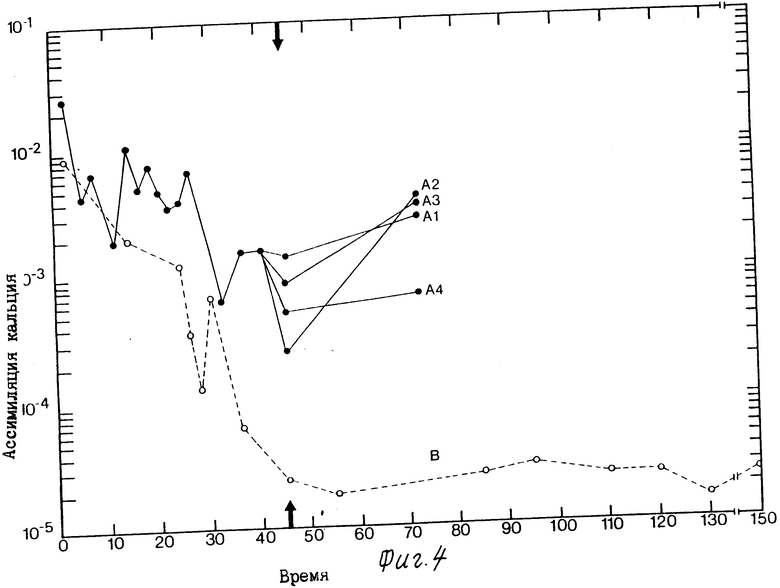
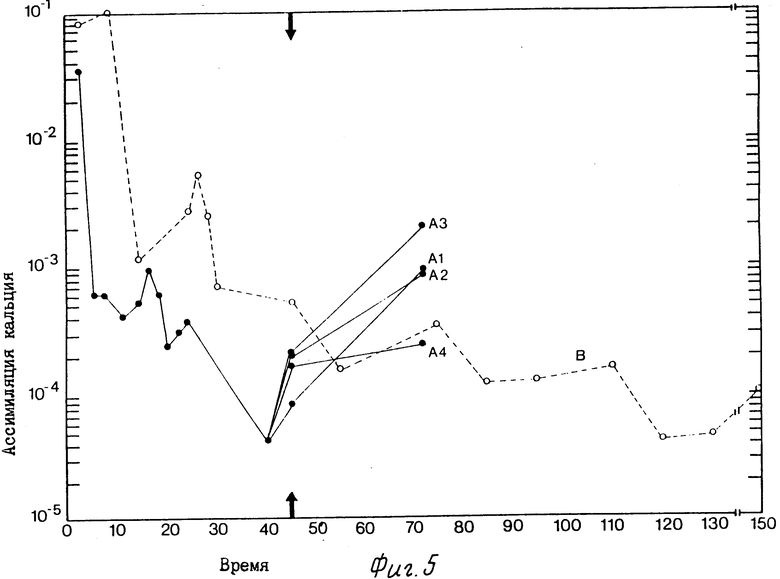
На фиг. 1 приведена схема альтернативных путей продуцирования только спор, спор и продуцирующих растворители клеток, и только продуцирующих растворители клеток; на фиг. 2 график соотношения синхронного роста, продуцирования растворителей и утилизации парафинового масла культурной, инкубированной в ксилановой базальной среде, обогащенной глюконатом кальция (кривые А. В. и С соответственно); на фиг. 3 графическое изображение ассимиляции кальция отдельной клеткой в синхронной культуре, инкубированной в ксиланевой базальной среде, обогащенной глюконатом кальция; на фиг. 4 - графическое изображение ассимиляции кальция отдельной клеткой в синхронной культуре, инкубированной в ксилановой базальной среде, обогащенной карбонатом кальция, и на фиг. 5 графическое изображение ассимиляции кальция отдельной клеткой в синхронной культуре, инкубированной в среде глюконата кальция.
Как видно, из схемы, показанной на фиг. 1, клетки, которые подвергались регулируемому синхронизированному выращиванию, индуцирующему удлинение, могут использоваться селективно для осуществления отдельных метаболических процессов, обозначенных соответственно путями I, II и III. Если клетки используются в процессе, представленном путем 1, удлиненные клетки продуцируют растворители, и это может продолжаться в течение длительного времени, когда деление клеток остановлено. Если деление клеток тормозится физически, например, с помощью сдвига температуры и инкубация не останавливается, тогда начинается образование спор и споры в конце концов становятся доминирующим продуктом. Если рост тормозится антимикробными агентами, даже при увеличении времени инкубации доминирующим продуктом остаются споры. Если клетки используются в процессе, представленном путем II, образуются в первую очередь споры. Если клетки используются в процессе, показанном путем метаболизма III, продуцируются в основном споры.
В соответствии с предпочтительной процедурой базальную питательную среду готовят, дополняя жидкий пептон-дрожжевой экстракт или другую среду обычного состава медленно преобразующиеся в ходе обмена веществ источником углерода. Предпочтительная среда ограничивает рост бактерий как минимум на 10% по сравнения с максимальной скоростью роста Кm в оптимальной питательной среде, предназначенной для конкретного вида. В этом отношении предпочтителен пентозный материал, такой как ксилан. Необходимо добавить достаточное количество ксилана, чтобы обеспечить 0,5% объемного веса пентозана.
Ксилан, соединение пентозана, которое обычно присутствует в в оболочках растительных клеток и древесной ткани, можно получить путем измельчения пшеничной соломы или любых сельскохозяйственных, промышленных или муниципальных органических отходов. Ксилан можно добавлять к базальной среде в необработанном виде и в виде порошка. В качестве альтернативы ксилан можно гидролизировать горячей разбавленной соляной или другой кислотой, чтобы получить ксилозу, кристаллический альдозный сахар, обычно называемый древесный сахар, имеющий формулу C5H10O5. Ксилозу можно также получить при совместном культивировании целлюлолитного организма, такого как C.thermocellum вместе с C. thermosaccharolyticum согласно изобретению на целлюлозной базальной среде.
Исходную культуру готовят путем введения клеток экспоненциально растущей среды рода Clostridium в подходящую жидкую среду, такую как гороховый бульон. Особенно предпочтительными формами бактерий клостридий являются виды thermosaccharolyticum штаммов Американской коллекции типовых культур (АТСС) 7956, Национальной ассоциации Кеннера (NCA), 3814. Но могут также использоваться виды perfringens АТСС 13124, thermocellum АТСС 27405, thermohydrosulfuricum АТСС 35045, acetobutylicum АТСС 824, thermosulfurigenes АТСС 33743, thermoaceticum Германской коллекции микроорганизмов (DSM) 521, thermoautotrophicum DSM 1974, beijerinekii АТСС 25752, и butylicum АТСС 19398.
Синхронизация роста клетки может достигаться либо с помощью обычного последовательного разбавления, либо фильтрацией, либо центрифугированием. После инкубации при температуре, оптимальной для роста, и в течение времени, за которое конкретный вид клостридии достигает плотности клеток как минимум 1х106, один объем исходной культуры инокулируют на каждые десять объемов ксилановой базальной среды, чтобы инкубировать ее как периодическую культуру, обозначенную на фиг. 1 как базальная среда 1.
Базальная среда 1, содержащая периодическую культуру, Clostridium инкубируется в течение времени и при температуре, специфичных для предпочтительных видов Clostridium с тем, чтобы умножить исходную концентрацию в два-три раза или на 1,0 1,5 поколения.
Затем готовится базальная питательная среда 2, которая идентична по составу базальной среде 1. Приблизительно один объем периодической культуры Clostridium в среде 1 переносится в базальную среду 2 на каждые 10 объемов базальной среды 2 с тем, чтобы вновь инкубировать ее как периодическую культуру. Эту культуру также держат при оптимальной температуре роста для этих конкретных видов до тех пор, пока культура в среде 2 не размножится в два-три раза или на 1,0 1,5 поколения, или до тех пор, пока клетки не достигнут концентрации как минимум 2 3х105.
Питательная среда для поддержки метаболизма клеток, происходящему по одному из путей метаболизма I или II, готовится путем дополнения ксилановой базальной среды, описанной выше, органическим или неорганическим источником двухвалентных катионов. Питательная среда для метаболического пути III содержит в качестве базальной среды пептон-дрожжевой экстракт, дополненный двухвалентной солью органической кислоты в качестве единственного источника углерода. Катионы служат для стабилизации клеток от гибели, лизиса или агрегации. Предпочтительно в качестве двухвалентных катионов использовать магний, марганец, железо, цинк и кальций. Наиболее предпочтительны как источники катионов органические соединения кальция.
Если желательно получить и продуцирующие растворители клетки и споры, используется метаболический путь 1, и предпочтительной стабилизирующей добавкой в этом случае служит глюконат кальция. Питательную среду 3 готовят путем дополнения ксилановой базальной среды как минимум 4,3% объемного веса глюконата кальция (0,1 М).
Инокулянт приблизительно одного объема периодической среды в базальной культуре 2 переносится в питательную среду 3 для каждых 100 объемов питательной среды. Инокулянт, разбавленный в соотношении 1:100, инкубируют как периодическую культуру до увеличения на 1 12 поколения или в течение времени, составляющего 1 12 периодов "удвоения", или до тех пор, пока концентрация клеток не возрастет до 2х1010 или не увеличится в 2 - 4,096 раз по сравнению с исходной концентрацией, и в это время клетки проявляют высокую синхронность в отношении их массы и числа. Приблизительно 90% этих клеток удлиняется как минимум в четыре раза и проявляет модифицированное деление клеток, при котором они остаются удлиненными до критического размера, предпочтительно в четыре раза превышающего их вегетативную длину. Синхронные продуцирующие растворитель клетки собирают по истечении этого периода, при этом количество спор незначительно.
В качестве альтернативы синхронные растворитель-продуцирующие клетки можно подвергнуть таким условиям обработки, которые тормозят их рост, с тем, чтобы можно было собирать продукты их продолжающего процесса метаболизма. Репликацию ДНК и деление клеток можно тормозить физическим путем, например, повышая или понижая температуру клеток питательной среды на +10oC или на -20oC по сравнению с оптимальной температурой роста для конкретного вида. В других вариантах рост можно тормозить с помощью сублетальной дозы антимикробного средства. Особенно предпочтительны такие антимикробные средства как хлорамфеникол, митомицин, налидиксиновая кислота и акридиновой оранжевый краситель.
Если поставлена цель получить растворитель с помощью пути метаболизма 1, деление удлиненных растворитель-продуцирующих клеток тормозится, и продуцирование растворителя продолжается во время дальнейшей инкубации при незначительном одновременном образовании спор и при использовании парафинового масла как дополнительного источника углерода. Как показано на фиг. 2, торможение специально приготовленных синхронизированных клеток вызывает усиленное продуцирование растворителя. По истечении определенного периода времени, который колеблется в зависимости от избранного вида бактерий, продуцирование растворителя сокращается до низкого уровня, что свидетельствует о продолжении последних стадий споруляции.
Если позволить инкубации продолжаться, продуцируются антибиотики такие, как полимиксин, бацитрацин, карбогидразы, такие как амилаза, протеаза, липаза, нуклеаза, параспороподобные белковые кристаллы и, наконец, рефрактильные зрелые свободные споры.
Если желательным конечным продуктом являются споры и их родственные продукты, тогда предпочтителен путь метаболизма, показанный процессом II на фиг. 1, в котором предпочтительной добавкой двухвалентных катионов служит карбонат кальция. Питательная среда 4 приготавливалась при дополнении ксилановой базальной среды 1,1% объемного веса (0,1 М) карбоната кальция.
Инокулянт приблизительно одного объема периодической культуры в базальной среде 2 переносили в питательную среду 4 на каждые 100 объемов питательной среды. Разбавленный в соотношении 1:100 инокулянт 4 инкубировали как периодическую культуру до тех пор, пока клетки вновь не проявляли синхронность по массе и числу и не удлинялись в четыре раза по сравнению с их вегетативной длиной. Они демонстрировали такое модифицированное деление, при котором дочерние клетки оставались удлиненными до критического размера. Деление синхронных клеток надвое тормозили физическим путем, например, повышая или понижая температуру. При продолжении инкубации этой заторможенной синхронизированной культуры продуцируют антибиотики, ферменты, параспоро-подобные кристаллы и, наконец, рефрактильные зрелые свободные споры с относительно низким процентом растворителей.
Если желательно в качестве конечного продукта получить только клетки, продуцирующие растворители, предпочтительным путем метаболизма является путь III на фиг. 1, при котором в качестве питательной среды готовится среда 5, для чего жидкий пептон-дрожжевой экстракт обычного состава дополняют органическим источником кальция как единственным медленно преобразующимся в ходе обмена веществ источником углерода. Предпочтительным органическим источником кальция служит глюконат кальция, присутствующий на уровне как минимум 4,3% объемного веса (0,1 М).
Инокулянт приблизительно одного объема периодической культуры в базальной среде 2 переносили в питательную среду 5 на каждые 100 объемов питательной среды. Разбавленный в соотношении 1:100 инокулянт инкубировали как периодическую культуру до тех пор, пока клетки не проявляли синхронность по массе и числу, а удлинение не достигало критического размера, превышающего вегетативную длину в четыре раза при модифицированном делении клеток. Синхронные клетки, продуцирующие растворители, собирали в конце этого периода, при этом наблюдался низкий процент образования спор. Если целью является получение растворителей при использовании пути метаболизма III, репликацию ДНК и деление клеток можно затормозить физическим путем, например, сдвигом температуры, или с помощью антимикробных средств, а затем культуру инкубируют дальше, пока продуцируются растворители, до тех пор, пока этот процесс не сократится значительно.
Продукты путем метаболизма I, II и III можно выделять при помощи целого ряда обычных технологий. Например, если продуктом является растворитель, продуцируемый при высоких температурах, т.е. температурах порядка 50oC, выделение можно проводить с помощью вакуум-брожения, описанного D.L.Pavio et al. "Введение в органические лабораторные методы" с.548-552, (W.B.Saunders, 1976) и Cysewski and Wilke "Быстрое сбраживание этанола с помощью вакуума и кругооборота клеток" т. XIX, Biotechnology and Engineering 1125-1143, 1977. Если продуктом является растворитель, продуцируемый при температурах ниже 50oC, его можно выделять с помощью стандартных технологий дистилляции. Ферменты, такие как карбогидразы, представляют собой внеклеточные продукты, которые выделяются путем удаления клеточных остатков фильтрацией или центрифугированием. Если желательно дальнейшее очищение ферментов из сырого экстракта, выделение можно проводить по методу, описанному D.I.C.Wang, et al. Fermentation and Enzyme Technology с. 238-310 (John Wiley and Sons 1979). Параспороподобные белковые кристаллы и полезные токсичные белки содержатся внутри спор, и их можно собирать путем многократного центрифугирования или фильтрации. Клетки центрифугируют или фильтруют, вновь суспендируют, опять центрифугируют или фильтруют, суспендируют и еще раз центрифугируют или фильтруют. После этого выделяют сухие чистые споры. Если продуктом являются антибиотики, выделение осуществляют путем обычной экстракции с помощью растворителя, такого как пропанол или бутил ацетат по методу, описанному Crueger and Crueger в издании "Биотехнология: Учебник по промышленной микробиологии", с.99-103, Sinauer, Science Tech.1982.
В описанных выше процедурах можно заменить ксилановую базальную среду1 или2 питательной средой5. В других отношениях процедуры не меняются, включая окончательное разбавление в соотношении 1:100 в питательной среде5. Разбавленный инокулянт инкубируют как периодическую культуру до тех пор, пока клетки проявляют удлинение, синхронность и модифицированное деление, как это уже описывалось ранее. Синхронные клетки, продуцирующие растворители, собирают в конце этого периода, при этом количество спор незначительно.
В качестве другой альтернативной процедуры рост синхронных клеток, продуцирующих растворители, можно тормозить таким образом, чтобы направить энергию клеток на метаболизм, а не на деление, и позволить собирать продукты продолжающихся процессов метаболизма. Температуру клеток и питательной среды можно повышать на 10oC или понижать на 20oC по сравнению с оптимальной температурой роста конкретного вида, или же можно вводить сублетальную дозу антимикробного вещества. Культура с заторможенным ростом инкубируется дальше, и растворители продуцируются при незначительном одновременном образовании спор. После истечения определенного периода времени, который зависит от вида бактерий, процент продуцируемых растворителей колеблется в пределах порядка 6 12% а отношение бутанола к этанолу от 1:1 до 2:1.
В других вариантах субкультивирование во второй базальной среде повторяется, а первоначальное разбавление в свежей среде повторяют до переноса в третью питательную среду. Первоначальное разбавление в свежей базальной среде может быть в пропорции от 1:2 до 1:100, его можно повторять, и последнее разбавление может быть в соотношении от 1:2 до 1:500. Повторяющееся центрифугирование или мембранную фильтрацию можно заменить последовательным разбавлением, как способом синхронизации культур.
Во всех испытанных вариантах было обнаружено, что для сохранения продуцирования растворителей в течение продолжительного времени удлиненным синхронным клеткам требуется медленно преобразующийся в ходе обмена веществ источник углерода, нормальное деление клеток необходимо остановить с помощью сдвига температуры или добавления химических ингибиторов роста, и эти клетки должны ассимилировать кальций. На фиг. 3 6 сравниваются результаты ассимиляции кальция отдельными синхронизированными клетками Clostridium thermosaccharolyticum с результатами ассимиляции кальция типичными асинхронными короткими вегетативными клетками. Как показывают кривые А1-А4 на всех фигурах ассимиляция кальция стабилизировала продуцирующие растворители клетки и защитила их от действия высоких концентраций растворителей, которые были продуцированы впоследствии. И наоборот, клетки, показанные кривой В на фигурах, которые не были синхронизированы перед добавлением избыточного количества кальция, остались остались типичными короткими вегетативными клетками, не ассимилирующими большого количества кальция и в основном кислотопродуцирующими. Но даже в этих кислотопродуцирующих клетках, если остановить деление клеток через 45 ч. путем сдвига температуры на 35oC, наблюдается удлинение клеток и продуцирование растворителей, а также усиление ассимиляции кальция.
Пример 1. В данном примере раскрыты предпочтительные процедуры синхронизации роста числа и массы клеток и изменения деления клеток в культурах дикого типа Clostridium thermosuccharolyticum (АТСС) 7956.
Гороховый бульон. Шесть высушенных семенных горошин сорта "Alaskan" в 100 мл 2%-ного пентонного раствора автоклавировали в течение 15 мин, немедленно накрыв сверху 2 мл стерильного васпара.
Исходные культуры. За инокуляцией горохового бульона экспоненциально растущей культурой C.thermosaccharolyticum следовала инкубация в течение 8 ч при 56oC. После этого исходную культуру хранили при 4oC. Исходные культуры переносили через интервалы, продолжительность 3 6 мес. Их активировали путем инкубации в течение 12 ч. при 50 oC.
Периодические культуры. Один мл активированной культуры переносили в 10 мл свежей базальной среды для использования в качестве периодической культуры.
Базальная среда,
Пентон 0,2
Дрожжевой экстракт 0,5
CaCl•2H2O 0,01
(NH2)4SO4 0,1
MgSO4 0,01
MnSO4•H2O 0,01
ZnSO4•7H2O 0,0005
CuSO4•5H2O 0,0005
(NH4)6Mo7O24•4H2O 0,0001
FeSO4•7H2O 0,00005
р-Аминобензойная кислота 0,000002
Тиамин хлоргидрат 0,0001
Биотин 0,000001
в 1 л воды. Хлоргидрат тиамина и биотин фильтровали, стерилизовали и добавляли в среду после автоклавирования. 0,5% (объемного веса) ксилана добавляли в качестве источника углерода. рН среды регулировали до 7,0 с помощью I M NaOH, а затем стерилизовали. Эту среду предварительно инкубировали до 56oC и использовали в течение одного дня.
Процедура.
Все процедуры проводили в анаэробных условиях по методу Hungate. Исходную культуру активировали, переносили в предварительно инкубированную базальную среду, содержащую 0,5% ксилана в качестве источника углерода, и инкубировали при 56oC в течение 6 ч, за которые плотность клеток достигала приблизительно 3•108 клеток на 1 мл. Аликвот этой культуры (1 мл) асептически переносили в 10 мл свежей предварительно инкубированной базальной ксилановой среды и вновь выращивали как периодическую культуру при 56oC. Через 4 ч плотность клеток этой культуры достигала приблизительно 1•108 клеток/мл. 1 мл аликвота этой культуры асептически переносили в 100 мл свежей предварительно инкубированной коплановой базальной среды, которую дополняли как минимум 4,3% (0,1 М) глюконата кальция. Культуру хранили в бутылке для последовательного разбавления и сверху накрывали 40 мл стерильного парафинового масла для обеспечения анаэробных условий. Инкубацию культуры проводили в ротационном шейкере на водяной бане при 56oC и 150 об/мин. Через 45 ч плотность культуры достигала 2•109 клеток на 1 мл.
Эти продуцирующие растворитель клетки собирали с помощью центрифугирования при 22000•g в течение 30 мин, вновь суспензировали в стерильной дистиллированной воде, центрифугировали при 22000•g в течение 30 мин, после чего клетки были готовы для иммобилизации и хранения при 4oC.
Клетки дифференциально подсчитывали под микроскопом с помощью счетной камеры Петрова-Гауссера и определяли общее число клеток, длину отдельных клеток, количество спорангий и количество рефрактальных спор. Использовали фазово-контрастный микроскоп "Олимпус" с увеличением в 400 раз. Морфология подтверждалась при увеличении в 100 раз.
Надосадочную жидкость культуры анализировали с помощью газово-жидкостной хроматографии (GLC) на оборудовании фирмы "Hewlett Packard GLC", модель 5700, снабженном пламенно-ионизационным детектором и ленточным самописцем. Первичные метаболиты выделяли на колонке из нержавеющей стали (0,31 см • 1,82 м), наполненной Хромосорбом WAW (100/120), покрытым 10% SP 1000/1% H3PO4 (Supelco, Inc.). Колонку кондиционировали в течение течение 48 ч при 200oC. Для анализа использовали температуру входного отверстия 200oC и температуру детектора 250oC. Предварительно очищенный азот использовали как газ-носитель при скорости потока 400 мл/мин. Скорости потока водорода и сжатого воздуха составляли соответственно 30 и 300 мл/мин. Электрометр устанавливали на 10-11 А/мв ослаблении равном 16 и диапазоне, равном 10. Температура в печи поддерживалась на уровне 80oC в течение 2 мин после введения образца размером 10 мл, а затем переводилась на 170oC со скоростью 8oC/мин, после чего следовала выдержка в течение 2 мин. Процентное содержание метаболитов рассчитывали, исходя из области стандартных эталонных максимумов, и преобразовывали в концентрации, выраженной в мМ.
Образцы, предназначенные для подсчета, и анализа GLC, центрифугировали при 2200•g в течение 30 мин, чтобы отделить клетки от культуры. Эти клетки вновь суспензировали в стерильной дистиллированной воде, и процедуру повторяли трижды, после чего осадок после центрифугирования опять суспензировали в 5 мл стерильной дистиллированной воды и обрабатывали ультразвуком до 90% разрушения, о чем подтверждали наблюдения под фазово-контрастным микроскопом. Для ионной хроматографии использовали ионный хроматограф "Dionex" модели 400, снабженный компьютером "Hewlett Packard" 9000. Катионы отделяли на колонке CS-1. Элюентом для натрия, аммония и калия служили 8 мМ HCl плюс 1 мМ 2,3-диаминопропионовой кислоты при 2,0 мл/мин. В качестве элюента для магния, марганца и кальция использовали 48 мМ HCl плюс 8 мМ 2,3 диаминопропионовой кислоты при скорости потока 0,8 мл/мин-1. Анионы отделяли на колонке As4A при использовании в качестве элюента 1,92 мМ карбоната натрия плюс 2,4 мМ бикарбоната натрия при скорости потока 2,0 мл/мин.
Результаты.
Культуры, синхронизированные путем многократного переноса в ксилановую среду в течение 6 ч, а затем выращенные в течение 45 ч в присутствии ксилана, обогащенного избыточным количеством глюконата кальция, обнаружили высокую степень синхронности как по клеточной массе, так и по числу клеток. Дифференциальный подсчет клеток показал, что синхронность по массе составила 69,3% а синхронность по числу клеток 76,7% Более 90% этих синхронных клеток, продуцирующих растворители, было удлинено как минимум в четыре раза и проявляло модифицированное деление клеток, при котором они оставались удлиненными до критической длины, превышающей как минимум в четыре раза вегетативную длину. Количество рефрактильных спор было незначительным.
Пример 2. Повторялась процедура, описанная в примере 1, за исключением того, что за первой инкубацией разбавленной в пропорции 1:10 исходной культуры следовала вторая инкубация разбавленной в пропорции 1:10 культуры в свежей предварительно инкубированной ксилановой базальной среде. Этому разбавлению опять позволяли расти как периодической культуре при 56oC. Через 4 ч плотность клеток культуры достигала приблизительно 1•108, после чего завершали остальную часть процедуры согласно примеру 1. Более 90% полученных таким образом синхронных клеток было удлинено минимум в четыре раза и проявляло модифицированное деление, при котором клетки оставались удлиненными до критической длины, превышающей по меньшей мере в четыре раза вегетативную длину. Количество рефрактильных спор было незначительным.
Пример 3. Повторялась процедура, описанная в примере 1, за исключением того, что через 45 ч температуру понижали до 35oC путем погружения культуры в ледяную ванну и переноса в ротационный инкубатор при 35oC. Культуру инкубировали дополнительно еще 135 ч (суммарное время инкубации 180 ч) при 35oC. Через 180 ч плотность клеток в культуре достигала приблизительно 2•109 клеток/мл. Приготовленные таким образом клетки продуцировали 10,6% растворителей при соотношении бутанола к этанолу 2:1.
На фиг. 5 показана корреляция синхронности по числу клеток и соответствующие концентрации растворителей. Кривая А показывает общее число клеток, а степень синхронности показана в скобках как процент. Кривая В показывает абсолютную концентрацию продуцируемых растворителей, причем в скобках показан процент объемного веса спирта. Общая миллимолярная концентрация растворителя равна сумме концентраций отдельных растворителей: ацетона, бутанола, этанола, изопропанола и метанола.
Хотя растворители продуцируются с самого начала сбраживания, общие миллимолярные концентрации, показанные кривой В, относительно низки во время синхронного роста, показанного кривой А. Когда температура сдвигается до 35oC через 45 ч инкубации, задержанные удлиненные клетки вступают на стадию усиления продуцирования растворителей, так через 115 ч общая концентрация составляет 3,6% через 130 ч возрастает до 6,3% а через 145 ч концентрация возрастает еще до 9,8% Через 175 ч наблюдалась самая высокая концентрация растворителей 10,6%
Пример 4. Повторяли процедуру, описанную в примере 3, за исключением того, что после снижения температуры культуру инкубировали еще в течение 155 ч (суммарное время инкубации 200 ч) при 35oC. Через 200 ч плотность клеток в культуре достигала приблизительно 2•109 клеток/мл. Подготовленные таким образом клетки продуцировали 6,5% растворителей при отношении бутанола к этанолу 1:1.
Пример 5. Повторяли процедуру, описанную в примере 2, за исключением того, что после понижения температуры культуру инкубировали еще в течение 200 ч (суммарное время инкубации 245 ч) при 35oC. Через 245 ч плотность клеток в культуре достигала 2•109 клеток/мл. Приготовленные таким образом клетки продуцировали значительные количества антибиотиков, таких как полимексин, бацитрацин, карбогидраз, таких как амилаза, протеаза, липаза, нуклеаза, параспоро-подобных белковых кристаллов и рефрактильных зрелых свободных спор.
Пример 6. Повторяли процедуру, описанную в примере 1, за исключением того, что через 45 ч температуру повышали до 70oC, для чего культуру переносили в ротационный инкубатор при 70oC. Культуру инкубировали еще в течение 135 ч (суммарное время инкубации 180 ч) при 70oC. Через 180 ч плотность клеток в культуре достигала 2•109 клеток/мл. Подготовленные таким образом клетки продуцировали 10,6% растворителей при соотношении бутанола к этанолу 2:1.
Пример 7. Повторяли процедуру, описанную в примере 6, за исключением того, что после повышения температуры до 70oC, культуру инкубировали дополнительно еще в течение 155 ч (суммарное время инкубации 200 ч) при 70oC. Через 200 ч культура достигала плотности клеток приблизительно 2•109 клеток/мл. Подготовленные образом клетки продуцировали 6,5% растворителей при соотношении бутанола к этанолу 1:1.
Пример 8. Повторяли процедуру, описанную в примере 6, за исключением того, что после сдвига температуры до 70oC культуру инкубировали дополнительно еще в течение 200 ч (суммарное время инкубации 245 ч) при 70oC. Через 245 ч плотность клеток в культуре достигала приблизительно 2•109 клеток/мл. Подготовленные таким образом клетки продуцировали антибиотики, карбогидразы, параспоро-подобные белковые кристаллы и рефрактильные зрелые свободные споры.
Пример 9. Повторяли процедуру, описанную в примере 1, за исключением того, что через 45 ч добавляли хлорамфеникол, чтобы получить 20-ти микромолярную концентрацию для предотвращения дальнейшего деления клеток. Эту культуру инкубировали дополнительно еще в течение 27 ч (суммарное время инкубации 72 ч). Через 27 ч плотность клеток в культуре достигала приблизительно 2•109 клеток/мл. Подготовленные таким образом клетки продуцировали 10,6% растворителей при соотношении бутанола к этанолу 2:1.
Пример 10. Повторяли процедуру, описанную в примере 9, за исключением того, что после добавления хлорамфеникола культуру инкубировали дополнительно еще в течение 42 ч (суммарное время инкубации 87 ч). Через 87 ч плотность клеток в культуре достигала приблизительно 2•109 клеток/мл. Подготовленные таким образом клетки продуцировали 6,5% растворителей при соотношении бутанола к этанолу 1:1.
Ассимиляция кальция отдельными клетками в синхронной культуре, инкубированной в ксилановой базальной среде, обогащенной глюконатом кальция, показана на фиг. 3. Как показывают кривые А1-А4, самое высокое продуцирование растворителей коррелирует с самой высокой ассимиляцией кальция. Деление клеток останавливали через 45 ч путем добавления хлорамфеникола (кривая А1), налидиксиновой кислоты (кривая А2), митомицина (кривая А3) и акридинового оранжевого красителя (кривая А4). Клетки, обработанные налидиксиновой кислотой (кривая А2), продуцировала 7,1% растворителей за 72 ч, что коррелирует с самой высокой ассимилицией кальция, 3162 нмоль. Когда к синхронизированным в той же среде клеткам добавлялся акридиновый оранжевый краситель (кривая А4) концентрация растворителей достигала 8,1% при ассимиляции кальция 1163 нмоль. Кривая В показывает ассимиляцию кальция отдельными клетками в асинхронной культуре, инкубированной в той же среде.
Пример 11. Повторяли процедуру, описанную в примере 1, за исключением того, что использовалась ксилановая среда для споруляции с 1,1% (0,1 М) карбоната кальция. Через 45 ч клетки проявляли высокую степень синхронности как по массе, так и по количеству. Дифференциальный подсчет клеток продемонстрировал 48,8% синхронности по массе и 56,3% по числу клеток. Более 90% этих синхронных продуцирующих растворителя клеток было удлинено как минимум в четыре раза и проявляло модифицированное деление, при котором клетки оставались удлиненными до критической длины, превышающей по меньшей мере в четыре раза вегетативную длину. Количество рефрактильных зрелых свободных спор было незначительным.
Пример 12. Повторяли процедуру по примеру 11, за исключением того, что через 45 ч температуру понижали до 35oC путем погружения культуры в ледяную ванну и переноса ее в ротационный инкубатор при 35oC. Культуру инкубировали дополнительно еще в течение 200 ч (суммарное время инкубации 245 ч) при 35oC. Через 245 ч плотность клеток в культуре достигала приблизительно 2•109 клеток/мл. Подготовленные таким образом клетки продуцировали антибиотики, карбогидразы, параспоро-подобные белковые кристаллы и рефрактильные зрелые свободные споры.
Пример 13. Повторяли процедуру, описанную в примере 12, за исключением того, что через 45 ч температуру повышали до 70oC путем переноса культуры в ротационный инкубатор при 70oC. Культуру инкубировали дополнительно еще в течение 200 ч (суммарное время инкубации 245 ч) при 70oC. Через 245 ч плотность клеток в культуре достигала приблизительно 2•109 клеток/мл. Подготовленные таким образом клетки продуцировали антибиотики, карбогидразы, пароспоро-подобные белковые кристаллы и рефрактиальные зрелые свободные споры.
Пример 14. Повторяли процедуру, описанную в примере 11, за исключением того, что через 45 ч добавляли налидиксиновую кислоту, чтобы получить 20-ти микромолярную окончательную концентрацию для предотвращения дальнейшего деления клеток. Эту культуру инкубировали дополнительно еще в течение 27 ч (суммарное время инкубации 72 ч). Через 27 ч плотность клеток в культуре достигала приблизительно 2•109 клеток/мл. Подготовленные таким образом клетки продуцировали незначительное количество растворителей и могли продуцировать антибиотики, карбогидразы, параспоро-подобные белковые кристаллы и рефрактильные зрелые свободные споры.
Ассимиляция кальция отдельной клеткой в синхронной культуре, инкубированной в ксилановой базальной среде, обогащенной карбонитом кальция, показана на фиг. 4. Хотя эти клетки не продуцируют высоких концентраций растворителей, самое высокое продуцирование растворителей (0,2 0,4%) коррелирует с самой высокой ассимиляцией кальция, как показывают кривые А1-А4. Деление клеток останавливали через 45 ч путем добавления хлорамфеникола (кривая А1), налидиксиновой кислоты (кривая А2), митомицина (кривая А3) и акридинового оранжевого красителя (кривая А4). Синхронные клетки, заторможенные налидиксиновой кислотой (кривая А2), ассимилировали 12492 нмоль кальция за 72 ч, и 40 50% клеток обнаруживало признаки конечного набухания, характерного для стадий IV-V спорулирования. Что касается синхронных клеток в той же среде, заторможенных акридиновым оранжевым красителем (кривая А4), они ассимилировали 754 нмоль кальция и продуцировали 0,4% растворителей. Кривая В показывает ассимиляцию кальция отдельной клеткой в асинхронной культуре, инкубированной в той же культуре.
Пример 15. Повторяли процедуру, описанную в примере 1, за исключением того, что использовалась среда для споруляции, содержащая как минимум 4,3% глюконата кальция в качестве единственного источника углерода. Через 45 ч плотность культуры достигала приблизительно 2•109 клеток/мл. Подготовленные таким образом клетки были сильно удлинены и продуцировали растворители. Значительного количества рефрактильных зрелых свободных спор или рефрактильных спорангиев не продуцировалось.
Пример 16. Повторяли процедуру, описанную в примере 15, за исключением того, что через 45 ч температуру понижали до 35oC путем погружения культуры в ледяную ванну и переноса ее в ротационный инкубатор при 35oC. Эту культуру инкубировали в течение 135 ч (суммарное время инкубации 180 ч) при 35oC. Через 180 ч плотность клеток в культуре достигала приблизительно 2•109 клеток/мл. Подготовленные таким образом клетки продуцировали 10,6% растворителей при соотношении бутанола и этанола 2:1.
Пример 17. Повторяли процедуру, описанную в примере 15, за исключением того, что после понижения температуры клетки инкубировали дополнительно еще в продолжение 155 ч (суммарное время инкубации 195 ч). Через 195 ч плотность клеток в культуре достигала приблизительно 2o109 клеток/мл. Подготовленные таким образом клетки продуцировали 6,5% растворителей при соотношении бутанола к этанолу 1:1.
Пример 18. Повторяли процедуру, описанную в примере 15, за исключением того, что температуру повышали до 70oC. Эту культуру инкубировали дополнительно еще в течение 135 ч (суммарное время инкубации 180 ч) при 35oC. Через 180 ч плотность культуры достигала приблизительно 2•109 клеток/мл. Подготовленные таким образом клетки продуцировали 10,6% растворителей при соотношении бутанола к этанолу 2:1.
Пример 19. Повторяли процедуру, описанную в примере 18, за исключением того, что после повышения температуры культуру инкубировали дополнительно еще в течение 155 ч (суммарное время инкубации 195 ч) при 70oC. Через 195 ч плотность культуры достигала приблизительно 2•109 клеток/мл. Подготовленные таким образом клетки продуцировали 6,5% растворителей при соотношении бутинола к этанолу 1:1.
Пример 20. Процедуру, описанную в примере 15, повторяли, за исключением того, что через 45 ч добавляли хлорамфеникол для получения 20-ти микромолярной окончательной концентрации, чтобы предотвратить дальнейшее деление клеток. Эту культуру инкубировали еще дополнительно в течение 27 ч (суммарное время инкубации 72 ч). Через 27 ч плотность культуры достигала приблизительно 2•109 клеток/мл. Подготовленные таким образом клетки продуцировали 10,6% растворителей при соотношении бутанола к этанолу 2:1.
Пример 21. Повторяли процедуру, описанную в примере 15, за исключением того, что после добавления хлорамфеникола культуру инкубировали дополнительно еще в течение 42 ч (суммарное время инкубации 87 ч). Через 87 ч плотность клеток в культуре достигала приблизительно 2•109 клеток/мл. Подготовленные таким образом клетки продуцировали 6,5% растворителей при соотношении бутанола к этанолу 1:1.
На фиг. 5 показана ассимиляция кальция отдельной клеткой в синхронной культуре, инкубированной в среде с глюконатом кальция. Кривые А1-А4 показывают корреляцию между максимумами продуцирования растворителей и ассимиляции кальция. Деление клеток останавливали через 26 ч путем добавления хлорамфеникола (кривая А1), налидиксиновой кислоты (кривая А2), митомицина (кривая А3) и акридинового оранжевого красителя (кривая А4). Синхронные клетки, обработанные налидиксиновой кислотой (кривая А2), продуцировали 9,1% растворителей через 72 ч, коррелирует с ассимиляцией 1940 нмоль кальция. Кривая В показывает ассимиляцию кальция отдельной клеткой в асинхронной культуре, инкубированной в той же среде.
Пример 22. Повторяли процедуру, описанную в примере 1, за исключением того, что использовалась базальная среда, содержащая как минимум 4,3% глюконата кальция как единственного источника углерода. Через 26 ч плотность культуры достигала приблизительно 2•109 клеток/мл. Подготовленные таким образом клетки были сильно удлинены и продуцировали растворители. Значительного количества рефрактильных зрелых свободных спор не продуцировалось.
Пример 23. Повторяли процедуру, описанную в примере 12, за исключением того, что через 26 ч температуру понижали до 35oC путем погружения культуры в ледяную ванну и переноса ее в ротационный инкубатор при 35oC. Культуру инкубировали в течение 135 ч (суммарное время инкубации 180 ч) при 35oC. Через 180 ч плотность культуры достигала приблизительно 2•109 клеток/мл. Подготовленные таким образом клетки продуцировали 10,6% растворителей при соотношении бутанола к этанолу 2:1.
Пример 24. Повторяли процедуру, описанную в примере 24, за исключением того, что после понижения температуры клетки инкубировали дополнительно еще в течение 155 ч (суммарное время инкубации 195 ч). Через 195 ч плотность культуры достигала приблизительно 2•109 клеток/мл. Подготовленные таким образом клетки продуцировали 6,5% растворителей при соотношении бутанола к этанолу 1:1.
Пример 25. Повторяли процедуру, описанную в примере 22, за исключением того, что через 26 ч температуру повышали до 70oC путем переноса культуры в ротационный инкубатор при 70oC. Эту культуру инкубировали дополнительно еще в течение 135 ч (суммарное время инкубации 180 ч) при 35oC. Через 180 ч плотность культуры достигала приблизительно 2•109 клеток/мл. Подготовленные таким образом клетки продуцировали 10,6% растворителей при соотношении бутанола к этанолу 2:1.
Пример 26. Повторяли процедуру, описанную в примере 25, за исключением того, что после повышения температуры культуру инкубировали дополнительно еще в течение 155 ч (суммарное время инкубации 196 ч) при 70oC. Через 195 ч плотность культуры достигала приблизительно 1•109 клеток/мл. Подготовленные таким образом клетки продуцировали 6,5% растворителей при соотношении бутанола к этанолу 1:1.
Пример 27. Повторяли процедуру, описанную в примере 22, за исключением того, что через 26 ч добавляли хлорамфеникол, чтобы получить 20-ти микромолярную окончательную концентрацию, способную предотвратить дальнейшее деление клеток. Эту культуру инкубировали дополнительно еще в течение 27 ч (суммарное время инкубации 72 ч). Через 72 ч плотность культуры достигала приблизительно 2•109 клеток/мл. Подготовленные таким образом клетки продуцировали 10,6% растворителей при соотношении бутанола к этанолу 2:1.
Пример 28. Повторяли процедуру, описанную в примере 22, за исключением того, что после добавления хлорамфеникола культуру инкубировали дополнительно еще в течение 42 ч (суммарное время инкубации 87 ч). Через 87 ч плотность культуры достигала приблизительно 2•109 клеток/мл. Подготовленные таким образом клетки продуцировали 6,5% растворителей при соотношении бутанола к этинолу 1:1.
Использование маслянистого материала в качестве верхнего слоя для питательной среды во время размножения клеток имеет двойное назначение: сохраняет анаэробную среду для роста клеток и в то же время служит вторичным источником углерода. Предпочтительным маслянистым материалом является парафиновое масло, в основном благодаря его доступности и умеренной цене. Кроме того, использование парафинового масла в качестве верхнего слоя для питательной среды позволяет использовать стандартный сосуд для ферментации, а значит исключает необходимость применения дорогого оборудования для сбраживания, которое обычно включает средства для охлаждения, аэрации и перемешивания. В предлагаемом процессе достаточно проводить медленное механическое перемешивание питательной среды при условиях, которые не нарушают свойства маслянистого слоя препятствовать допуску кислорода. В этом отношении подходит бетонный, металлический или деревянный резервуар с открытым верхом, который позволяет использовать имеющиеся конструкции.
Подобным образом, учитывая тот факт, что внешняя энергия требуется только для повышения температуры питательной среды до заданного уровня, например, 56oC для C.thermosaccharolyticum во многих случаях достаточно солнечной энергии особенно, если питательная среда вводится в сосуд с металлическими стенками, открытый для солнечного света. В том случае, когда источником углерода служит отработанный щелок от целлюлозного завода, этот щелок обычно поступает с завода при температуре как минимум 90oC и поэтому необходимо только охладить его до заданного уровня перед тем, как приступить к описанным выше процессам сбраживания.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ ТИЛОЗИНА | 1987 |
|
RU2043416C1 |
| СПОСОБ ПОЛУЧЕНИЯ АВЕРМЕКТИНА И ШТАММЫ STREPTOMYCES AVERMITILIS - ПРОДУЦЕНТЫ АВЕРМЕКТИНА | 1988 |
|
RU2096462C1 |
| КОНЪЮГАТ НА ОСНОВЕ АНТИ-JGM-АНТИТЕЛА (ВАРИАНТЫ) И СПОСОБ СНИЖЕНИЯ СЕКРЕЦИИ JGM АНТИТЕЛА ЛИМФОЦИТАМИ (ВАРИАНТЫ) | 1991 |
|
RU2105062C1 |
| СПОСОБ ПОЛУЧЕНИЯ РАСТЕНИЙ, УСТОЙЧИВЫХ К НАСЕКОМЫМ | 1988 |
|
RU2025486C1 |
| ЛЕЙСТРОДУКСИН, СПОСОБ ПОЛУЧЕНИЯ ЛЕЙСТРОДУКСИНА ШТАММ STREPTOMYCES PLATENSIS - ПРОДУЦЕНТ ЛЕЙСТРОДУКСИНА, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, ОБЛАДАЮЩАЯ КРОВЕТВОРНОЙ И ПРОТИВОГРИБКОВОЙ АКТИВНОСТЬЮ, ЛЕЧЕБНО-ПРОФИЛАКТИЧЕСКОЕ СРЕДСТВО | 1992 |
|
RU2082760C1 |
| БАКТЕРИЦИДНАЯ КОМПОЗИЦИЯ ДЛЯ КОНСЕРВИРОВАНИЯ ПИЩЕВЫХ ПРОДУКТОВ | 1990 |
|
RU2048151C1 |
| ШТАММ БАКТЕРИЙ Burkholderia cepacia - АВИРУЛЕНТНЫЙ ПРОДУЦЕНТ БАКТЕРИОФАГА, ЛИЗИРУЮЩЕГО ВОЗБУДИТЕЛЯ САПА | 2007 |
|
RU2339690C1 |
| СРЕДСТВО И СПОСОБ ОЧИСТКИ ТЕКСТИЛЬНЫХ ТКАНЕЙ | 2003 |
|
RU2352623C2 |
| МИКРООРГАНИЗМЫ ДЛЯ ПОВЫШЕННОГО ПРОДУЦИРОВАНИЯ АМИНОКИСЛОТ И СВЯЗАННЫЕ С НИМИ СПОСОБЫ | 2015 |
|
RU2688486C2 |
| СПОСОБ КУЛЬТИВИРОВАНИЯ, БЛАГОПРИЯТСТВУЮЩИЙ ПРОДУЦИРОВАНИЮ К-ВИТАМИНА МОЛОЧНОКИСЛЫМИ БАКТЕРИЯМИ, И ЕГО ПРИМЕНЕНИЕ В ПРОИЗВОДСТВЕ ПИЩЕВЫХ ПРОДУКТОВ | 2007 |
|
RU2447144C2 |
Использование: микробиология. Сущность изобретения: для получения бактериальных клеток рода Clostridium, способных продуцировать споры и продукты метаболизма, проводят периодическое субкультивирование бактерий в питательной среде, содержащей источник углерода и минеральные соли в анаэробных условиях, при этом выращивают исходную культуру до концентрации бактериальных клеток в среде 1•106 кл/мл, осуществляют приготовление периодической субкультуры внесением в питательную среду, содержащую медленно метаболизируемый источник углерода, бактериальных клеток исходной культуры с плотностью не выше 1/2 плотности их в исходной культуре и проводят инкубацию при температуре минус 20 - +10oC в течение времени, достаточного для размножения клеток на 1 - 1,5 генерации, далее проводят пересев полученной субкультуры и осуществляют второе субкультивирование в тех же условиях, полученные после этого клетки засевают на питательную среду, содержащую двухвалентные катионы в концентрации не менее 0,01 М и медленно метаболизируемый источник углерода, выбранный таким образом, чтобы обеспечить рост бактерий в среде со скоростью на 10 - 90% ниже максимальной скорости роста Кm для бактерий в оптимальной питательной среде, инкубируют, ингибируют деление клеток, после чего продолжают инкубацию клеток до продуцирования ими спор и продуктов метаболизма. 11 з. п. ф-лы, 5 ил.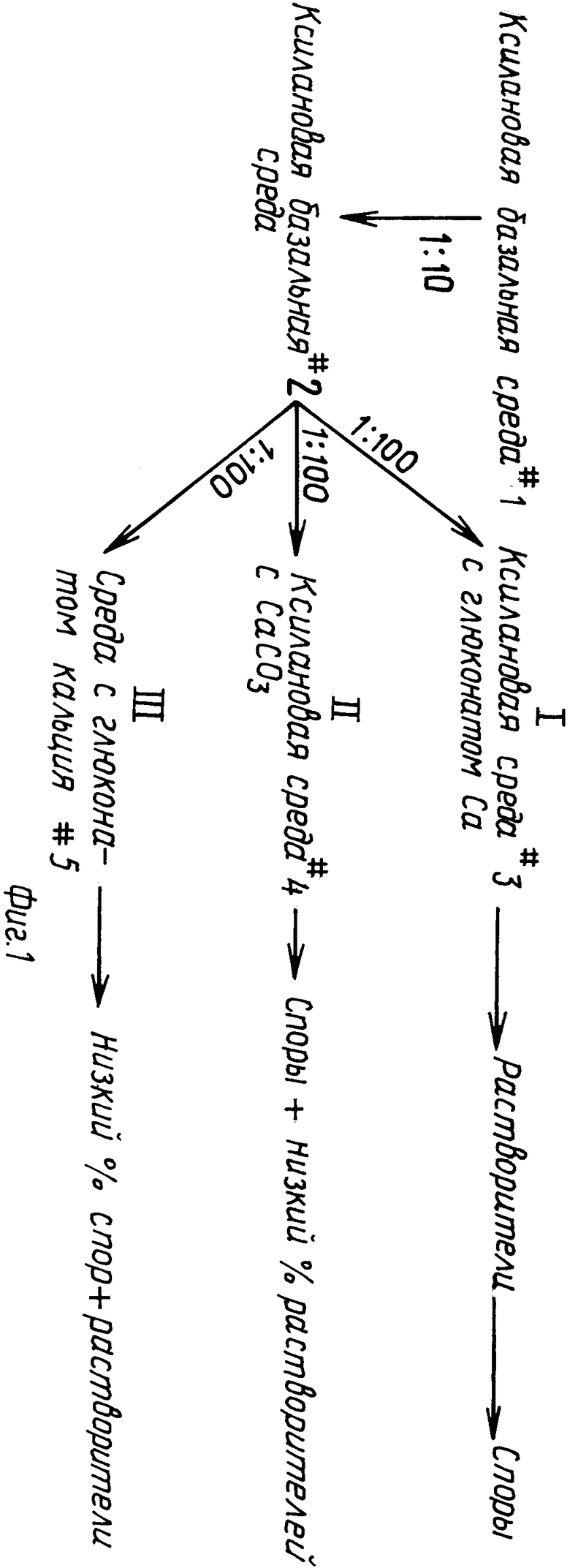
| Applied Microbiology and Biotechnology, t | |||
| Прибор для равномерного смешения зерна и одновременного отбирания нескольких одинаковых по объему проб | 1921 |
|
SU23A1 |
| Прибор для сжигания нефти | 1921 |
|
SU369A1 |
Авторы
Даты
1997-09-27—Публикация
1991-11-13—Подача