Изобретение относится к замещенным органическими радикалами 3,9-дифосфаспироундеканам и к усовершенствованному способу их получения.
Известно много способов получения замещенных органическими радикалами 3,9-дифосфаспироундеканов. Например, в патенте Японии N 1986-225,191 с приоритетом от 9 октября 1986 описан способ синтеза стерически затрудненных диарилдифосфаспироундеканов взаимодействием трихлорида фосфора, пентаэритрита и ортоалкилфенола в присутствии аминокатализатора, такого как пропил-, н-бутил-, трет-бутил, триэтил- или трибутиламин. Этот катализатор присутствует в количестве около 0,005-10 мас. от пентаэритрита. Этот способ осуществляют в таком инертном растворителе, как ксилол.
В патентах США N 4094855 и 4207229 описан синтез замещенных органическими радикалами дифосфаспироундеканов взаимодействием 3,9-дихлор-2,4,8,10-тетраокса-3,9-дифосфаспироундекана (дихлорпентита) с фенолом в присутствии акцептора протонов, такого как третичный амин, например триэтиламин.
В патенте США N 3271481 описано образование первичных арилфосфитов в третичном амине, например в триэтиламине или трибутиламине.
В патенте США N 4305866 описано получение замещенных дифосфаспироундеканов взаимодействием алкилфенола с дифенокси- или низшим диалкоксидифосфаспироундеканом с удалением образующегося фенола или спирта отгонкой.
В патенте США N 4371647 описано получение замещенных дифосфаспироундеканов реакцией фенола с трихлоридом фосфора в хлороформе в присутствии триэтиламина с последующей реакцией с пентаэритом в присутствии добавочного количества триэтиламина.
Известно большое количество алкилфеноксидифосфаспироундеканов. В указанном выше патенте Японии N 1986-225191 с приоритетом от 9 октября 1986 описано большое число бис-(алкилфенокси)дифосфаспироундеканов, таких как бис-(2-трет-бутил-4,6-диметилфенокси)дифосфаспироундекан и бис-(2,4-ди-трет-октилфенокси)дифосфаспироундекан. Бис-(алкилфенокси)дифосфаспироундеканы описаны также в патентах США N 4066611, 4094855 и 4207229, 4305866, 4520149, 4585818 и в патентной заявке Японии N 52/1997-110829. Другие известные дифосфаспироундеканы включают в себя бис- (2,6-ди-трет-бутил-4-метилфенокси)дифосфаспироундекан и бис (2,6-ди-трет-бутил-4-этилфенокси)дифосфаспироундекан.
Практически все коммерческие полимеры содержат один или больше стабилизатор для защиты от ухудшения свойств при разрывах цепи или нежелательной сшивке, которые происходят при переработке и эксплуатации. Проблема ухудшения свойств особенно важна для термопластов, обычно подвергающихся крайне высокому разогреву при обработке. Разложение влияет не только на физические свойства полимера, но может приводить к обесцвечиванию, делая полимер эстетически неприемлемым, при этом продукт направляется в брак.
Однако полимерные стабилизаторы могут подвергаться различным вредным воздействиям при их получении, перевозке, хранении и использовании. Примером такого воздействия, могущего вредно влиять на стабилизаторы, является влага в форме влажности воздуха или смачивания. Хотя многие стабилизаторы используются в форме порошка или гранул, однако поглощение влаги может вызывать комкование или слеживание стабилизатора, затрудняя работу с ним при подаче и смешении. Последствием воздействия влаги может быть гидролиз, часто ухудшающий стабилизирующие свойства и приводящий к разложению полимера.
При правильном хранении до или после введения в полимер многие фосфиты, включая упомянутые выше дифосфаспироундеканы, могут проявлять отличные стабилизирующие свойства. Несколько фосфитов, например трис-/2,4-ди-трет-бутилфенол/фосфит (ТВРР), могут проявлять хорошую стабильность при хранении во влажных условиях, но не проявляют стабилизирующей эффективности, присущей многим членам класса дифосфаспироундеканов.
Хотя многие из вышеуказанных дифосфаспироундеканов способны действовать как стабилизаторы полимеров, однако их комплексные свойства могли бы быть улучшены, если бы удалось сочетать высокую устойчивость к влаге с высокой стабилизирующей активностью. Действительно, стабилизатор, придающий высокую физическую и цветовую стабильность полимеру при повышенной устойчивости к влаге и гидролизу, обладает значительными практическими преимуществами по сравнению со многими известными стабилизаторами.
Известные способы получения дифосфаспироундеканов также имеют несколько недостатков. Во многих способах, например в патенте Японии N 1986-225191 и в патентах США N 4207229 и 4094855, получение проводят в реакционной среде и получают продукт в виде раствора. В этих способах выделение продукта требует первоначального удаления гидрохлорида амина отфильтровыванием и затем удаления растворителя отгонкой. Затем продукт очищают перекристаллизацией из второго растворителя. С практической точки зрения способ слишком сложен и энергоемок по сравнению со способом, в котором продукт кристаллизуется прямо из реакционной среды, а гидрохлорид амина остается в растворе. Это могло бы дать и то практическое преимущество, что амин можно регенерировать без выделения гидрохлоридной соли, простой промывкой водным основанием.
Предпочтительно также иметь выход продукта, максимально близкий к 100% от теоретического, т.к. более высокий выход, как правило, приводит к более эффективному использованию исходных соединений и снижению количества побочных продуктов, от которых необходимо отделять целевой продукт и которые могут вступать в нежелательные побочные реакции. Поэтому способ получения дифосфоспироундеканов, в котором целевой продукт получают в виде твердого соединения, будет иметь существенные практические преимущества по сравнению со многими известными способами.
Данное изобретение относится к композиции, включающей в себя дифосфаспироундекан следующей общей формулы: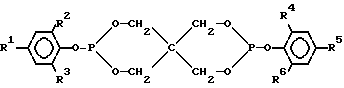
где каждый из R2, R3, R4 и R6 является третичным алкильным остатком, а каждый из R1 и R5 представляет собой вторичный алкил. В предпочтительном варианте R2, R3, R4 и R6 выбирают из третичных алкильных остатков, имеющих от 4 до приблизительно 12 атомов углерода, причем трет-бутил наиболее предпочтителен. Предпочтительно также, чтобы R1 и R5 были втор-бутилами.
Данное изобретение включает стабилизированную полимерную композицию, содержащую полимер и эффективное количество дифосфаспироундекана по данному изобретению. Предпочтительны термопластины, особенно предпочтительны полиэтилен, полипропилен, полиэтилентерефталат, полипропиленоксид, полистирол, ударопрочный полистирол и привитые полимеры типа ABS.
Данное изобретение включает также способ получения замещенных органическими радикалами дифосфаспироундеканов, включающий в себя взаимодействие оксизамещенного органического соединения, треххлористого фосфора и пентаэритрита с образованием указанных замещенных дифосфаспироундеканов, где образование указанных замещенных органическими радикалами дифосфаспироундеканов происходит в присутствии три-н-алкиламина с н-алкильными остатками, каждый из которых имеет не менее 3 атомов углерода. Предпочтительное количество три-н-алкиламина не менее чем эквимолярно по отношению к получаемой кислоте.
Данное изобретение включает в себя также продукт, получаемый по варианту способа по данному изобретению, где используется дихлорпентит и полимерную композицию, содержащую этот продукт.
Данное изобретение включает в себя 3,9-бис-/2,6-ди-трет-алкил-4-втор-алкилфенокси/-2,4,8,10- тетраокса-3,9-дифосфаспиро[5,5] ундеканы. Эти соединения, известные также как бис-/2,6-ди-трет-алкилфенил/пентаэритритдифосфиты, можно представить следующей общей формулой:
где каждый из R2, R3, R4 и R6 является третичным ("трет" или "т") алкильным остатком, и где каждый из R1 и R5 является вторичным ("втор" или "в") алкильным остатком.
Примерами третичных остатков являются т-бутил, т-пентил, 1,1,4,4-тетраметилбутил, т-октил, I-метилциклогексил, т-додецил и 2-фенил-2-пропил. Однако предпочтительны остатки, имеющие от 4 до приблизительно 12 атомов углерода, такие как т-бутил, т-пентил, т-октил и т-додецил. Более предпочтительны относительно более короткие группы, такие как т-бутил, т-пентил, I-метилциклогексил и 1,1,4,4-тетраметилбутил. Наиболее предпочтителен т-бутил. Хотя все или любой из R2, R3, R4 и R6 могут быть различны, например 2-т-бутил-4-н-бутил-6-т-пентилфенокси, однако предпочтительно, чтобы все они были одинаковы.
Примерами втор-алкилов являются в-бутил, в-пентил, изопропил, в-гексил, в-децил, циклопентил, циклогексил и циклооктил. Однако предпочтительны остатки, имеющие от 3 до приблизительно 6 атомов углерода, например в-бутил, в-пентил, изопропил и циклогексил. Более предпочтительны более короткие группы, такие как в-бутил и в-пентил, причем особенно предпочтителен в-бутил. Хотя R1 и R5 могут быть различны, например, в случае, где R1 в-бутил, а R5 в-пентил, однако предпочтительно, чтобы они были одинаковы.
Дифосфаспироундеканы по данному изобретению можно получать известными способами, например взаимодействием до-т-алкил-в-алкилфенола с 3,9-дихлор-2,4,8,10-тетраокса-3,9-дифосфаспиро[5,5] ундеканом (который можно получать реакцией пентаэритрита с трихлористым фосфором с помощью известных средств). Например, 3,9-бис-/2,6-ди-т-бутил-4-в-бутилфенокси/-2,4,8,10- тетраокса-3,9-дифосфаспиро [5,5] ундекан можно получить реакцией 2,6-ди-т-бутил-4-в-бутилфенола с 3,9-дихлор-бис /2,6-ди-т-пентил-4-в-бутилфенокси/-2,4,8,10-тетраокса-3,9-дифосфаспиро [5,5] ундеканом (дихлорпентитом). Аналогично 3,9-бис-/2,6-ди-т-пентил-4-в-бутилфенокси/-2,4,8,10- тетраокса-3,9-дифосфаспиро[5,5]ундекан можно получить взаимодействием 2,6-ди-т-пентил-4-в-бутилфенола с дихлор-пентитом. Другие 3,9-бис-/три-т-алкилфенокси/-2,4,8,10-тетраокса-3,9- дифосфаспироундеканы можно получить реакцией ди-т-алкил-в-алкилфенола, соответствующего нужной ди-т-алкил-в-алкилфеноксигруппе, с дихлорпентитом.
Дифосфаспироундеканы по данному изобретению можно также получать взаимодействием фенола, соответствующего нужному ди-т-алкил-в-алкилфеноксилу, с трихлористым фосфором с образованием ди-т-алкил-в-алкилфеноксифосфородихлоридита с последующей реакцией фосфородихлоридита с пентаэритритом с образованием 3,9-бис-/ди-т-алкил-в-алкилфенокси/-2,4,8,10-тетраокса-3,9- дифосфаспироундакана. Например, 2,6-ди-т-бутил-4-в-бутилфенол можно ввести в реакцию с треххлористым фосфором и затем с пентаэритритом с образованием 3,9-бис-/2,6-ди-т-бутил-4-в-бутилфенокси/-2,4,8,10-тетраокса-3,9- дифосфаспироундекана. Аналогично 2,6-ди-т-додецил-4-в-пентилфенол можно ввести в реакцию с треххлористым фосфором и затем с пентаэритритом с получением 3,9-бис-/2,6-ди-т-додецил-4-в-пентилфенокси/-2,4,8,10- тетраокса-3,9-дифосфаспироундекана.
Методики синтеза дифосфаспироундеканов через дихлорпентит и фосфородихлоридит известны. Однако в известных способах дифосфаспироундекан получают в растворе в присутствии амина, например триэтиламина, служащего акцептором кислоты за счет образования нерастворимой соли, и предпочтительно получать дифосфаспироундеканы описываемым ниже способом по данному изобретению.
Данное изобретение включает усовершенствованный способ получения замещенных органическими радикалами дифосфаспироундеканов, включая описанные выше бис-/2,6-ди-т-алкил-4-в-алкилфенокси/дифосфаспироундеканы. Способ включает в себя взаимодействие оксизамещенного органического соединения, треххлористого фосфора и пентаэритрита с образованием замещенного органическими остатками дифосфаспироундекана, и усовершенствование включает образование органозамещенного дифосфаспироундекана в присутствии три-н-алкиламина.
В изобретении важно, что три-н-алкиламин имеет н-алкилы, имеющие минимум 3 атома углерода, например н-пропил, н-бутил, н-пентил и н-гексил и предпочтительно менее чем 10 атомов углерода. Предпочтительны н-бутил и н-пропил, т. е. например три-н-бутиламин, три-н-пентиламин и ди-н-бутил-н-пентиламин. Особенно предпочтителен три-н-бутиламин.
Реакцию обычно проводят по одному из двух путей. В первом ("дихлорпентитовый" путь) треххлористый фосфор взаимодействует с пентаэритритом с получением 3,9-дихлор-2,4,8,10-тетраокса-3,9-дифосфаспироундекана (известного как "дихлорпентит" или "дихлорпентаэритритдифосфит") с последующей реакцией дихлорпентита с оксизамещенным органическим соединением в присутствии три-н-алкиламина с образованием органозамещенного дифосфаспироундекана. В другом подходе ("дихлоридитовый" путь) треххлорстый фосфор и окси-замещенное органическое соединение взаимодействуют с образованием фосфородихлоридита с его последующей реакцией с пентаэритритом в присутствии три-н-алкиламина с образованием органозамещенного дифосфаспироундекана.
Три-н-алкиламин обычно присутствует в количестве, по крайней мере, достаточном для практической нейтрализации кислоты, образующейся при получении дифосфаспироундекана. Например, если дифосфаспироуедекан образуется по реакции оксизамещенного органического соединения с дихлорпентитом, где освобождается 2 моль HCl, то три-н-алкиламин должен присутствовать в количестве, по крайней мере, равном 2 моль три-н-алкиламина на 1 моль дихлорпентита. Аналогично, если дифосфаспироундекан получают реакцией пентаэритрита с органическим фосфородихлоридитом, то три-н-алкиламин будет присутствовать в количестве, по крайнем мере, приблизительно равном 2 моль три-н-алкиламина на 1 моль фосфородихлоридита. Однако предпочтительно использовать молярный избыток три-н-алкиламина.
В способе по данному изобретению образование дифосфаспироундекана происходит в реакционной среде, включающей три-н-алкиламин. Реакционная среда может также включать растворитель, например ксилол, хлорбензол, тоулол, этилбензол и т.п. Отношение количества сорастворителя к количеству три-н-алкиламина ограничено только требованиями присутствия амина в количестве, нужном для нейтрализации теоретического количества выделяющегося HCl, и соображениями, связанными с растворимостью. Можно также включить небольшое количество других реагентов, например катализаторов. В данном изобретении реакционную среду выбирают так, чтобы целевой дифосфаспироундекан был в ней практически нерастворим, что облегчает его выделение. Предпочтительно также так выбирать три-н-алкиламин и реакционную среду, чтобы гидрохлорид три-н-алкиламина был достаточно растворим в реакционной среде и существенное количество хлористоводородной соли не выпадало в осадок в ходе реакции и при выделении продукта.
В данном изобретении оксизамещенное органическое соединение может быть любым из множества оксизамещенных органических соединений, включая спирты, фенолы, оксизамещенные циклоалканы и оксизамещенные арилалкилы, такие как октадеканоил, алкилированные фенолы, циклогексанол и фенилэтанол. Однако предпочтительны фенолы, например 2,4,6-триметилфенол, 2,6-ди-т-бутилфенол, 2,4,6-три-т-бутилфенол, 2,4-ди-т-пентилфенол и 2,4-ди-т-бутил-6-метилфенол. При использовании дихлорпентитового пути фенол предпочтительно выбирают из 2,4,6-триалкилфенолов и 2,4-диалкилфенолов, таких как 2,4,6-три-т-бутилфенол, 2,4-ди-т-бутилфенол, 2,4,6-три-т-пентилфенол, 2,6-ди-т-бутил-4-втор-бутилфенол, 2,4-ди-т-бутилфенол и 2-т-бутил-4-метилфенол. Однако предпочтительны 2,4-ди-т-алкилфенолы, например 2,4-ди-т-бутилфенол и 2,6-ди-т-алкил-4-алкилфенолы, такие как 2,4,6-три-т-бутилфенол, 2,6-ди-т-бутил-4-метилфенол, 2,6-ди-т-бутил-4-этилфенол, 2,4-ди-т-бутилфенол и 2,6-ди-т-бутил-4-в-бутилфенол. Наиболее предпочтительны 2,4,6-три-т-алкилфенолы, 2,6-ди-т-алкил-4-н-алкилфенолы, 2,6-ди-т-алкил-4-в-алкилфенолы и 2,4-ди-т-алкилфенолы.
Если используют фосфородихлоридитовый путь, то предпочтительное оксизамещенное органическое соединение также является фенолом, более предпочтительно 2,4,6-три-алкилфенолом. Однако, в отличие от дихлорпентитового пути, ди-алкилфенолы, отличные от 2,6-диалкилфенолов, не предпочтительны, поскольку они имеют, как правило, более высокую реакционную способность, что может приводить к осложнениям при получении фосфородихлоридита. Как отмечалось выше, более предпочтительны 2,4,6-три-т-алкифенолы, 2,6-ди-т-алкил-4-метилфенолы, 2,6-ди-т-алкил-4-этилфенолы и 2,6-ди-т-алкил-4-в-алкилфенолы. Особенно предпочтительны 2,4,6-три-т-бутилфенол, 2,6-ди-т-бутил--4-метилфенол, 2,6-ди-т-бутил-4-этилфенол и 2,6-ди-т-4-в-бутилфенол.
В способе по данному изобретению при использовании дихлорпентитового пути предпочтительно, чтобы молярное отношение оксизамещенного органического соединения к дихлорпентиту (3,9-дихлор-2,4,8,10-тетраокса-3,9-дифосфаспироундекану) было равно приблизительно от 2:1 до 3:1. В фосфородихлоридитовом способе предпочтительно, чтобы молярное отношение фосфородихлоридита к пентаэритриту было равно приблизительно 2:1 за исключением случая, когда нужны олигомерные продукты.
Данное изобретение включает в себя также усовершенствование способа получения фосфородихлоридитов, например пригодных для описанного выше фосфородихлоридитового способа. В то время как известные способы получение этого соединения могут требовать очистки путем перегонки целевого продукта, в данном изобретении продукт получают без энергоемкой стадии перегонки. Этот усовершенствованный способ получения фосфородихлоридитов включает в себя введение в контакт оксизамещенного органического соединения с треххлористым фосфором в реакционной среде, содержащей триэтиламин. Триэтиламин должен присутствовать в количестве, по крайней мере, достаточном для существенной нейтрализации выделяющегося HCl. Хотя треххлористый фосфор служит реакционной средой, однако она может необязательно включать сорастворители, например толуол или другие углеводороды.
В усовершенствованном способе получения фосфородихлоридитов необходимо также, чтобы молярное отношение треххлористого фосфора к оксизамещенному органическому соединению было больше 3:1, предпочтительно было равно приблизительно 3,5:1 и больше. Предпочтительно также молярное отношение около 4,5: 1 и меньше. В усовершенствованном способе просто проводить выделение и очистку. Продукт выделяют из реакционной среды, сначала удаляя гидрохлорид амина фильтрованием с последующим концентрированием фильтрата и получением относительно чистого фосфородихлоридита.
Хотя в усовершенствованном способе получения фосфородихлоридитов можно использовать множество оксизамещенных органических соединений, например алифатические спирты и фенолы, однако особенно пригодны алкилированные фенолы.
Данное изобретение включает в себя также продукт дихлорпентитового способа, одного из предпочтительных вариантов данного изобретения. Предпочтительный продукт по данному изобретению получают предпочтительным вариантом способа по данному изобретению, как это описано выше. В наиболее предпочтительном варианте продукт по данному изобретению получают дихлорпентитовым способом, где три-н-алкиламин является три-н-бутиламином и присутствует в количестве, достаточной для нейтрализации практически всего HCl, выделяющегося при реакции дихлорпентита с оксизамещенным органическим соединением. Предпочтительный продукт получают с использованием фенола, более предпочтительно 2,4,6-триалкил- и 2,4-диалкилфенолов в качестве оксизамещенного органического соединения. Особенно предпочтительны 2,4-ди-т-алкилфенолы, например 2,4-ди-т-алкилфенолы, например 2,4-ди-т-бутилфенол и 2,6-ди-т-алкилфенолы, например 2,4,6-три-т-бутилфенол.
В примере 1 иллюстрируется получение 3,9-бис-/2,4,6-три-т-бутилфенокси)-2,4,8,10-тетраокса-3,9-дифосфаспиро[5,5]ундекана.
Пример 1. Суспензию 210,1 г (800 ммоль) 2,4,6-три-т-бутилфенола, 105,9 г (400 ммоль) 3,9-дихлор-2,4,8,10-тетраокса-3,9-дифосфаспиро[5,5] ундекана и 118 мл (847 ммоль) триэтиламина растворяют в 200 мл хлорбензола и кипятят с обратным холодильником при перемешивании в атмосфере азота 46 час. Результирующую темно-коричневую суспензию разбавляют 500 мл хлорбензола и фильтруют для удаления гидрохлорида триэтиламина, образовавшегося в ходе реакции. При охлаждении фильтрата получают 214 г влажных кристаллов. Кристаллы, перекристаллизованные из толуола, содержат небольшое количество (менее 5 об. ) триэтиламина. Продукт выделяют фильтрованием и получают 76,2 г (выход 26%) бис-/2,4,6-три-т-бутилфенокси/ тетраоксадифосфаспироундекана в форме кристаллов с т.пл. 253,5-256oC и кислотным числом 3,0 (описанный выше способ с KOH-метанолом). Дополнительной перекристаллизацией из толуола, содержащего небольшое количество триэтиламина, получают 48,8 г (выход 17%) целевого продукта в виде белых кристаллов, т.пл. 250-255oC, кислотное число 0,99.
ИК- и ЯМР-спектроскопия подтверждают структуру продукта.
В примере 2 показано получение бис- /2,4,6-три-т-бутил-фенокси/тетраоксадифосфаспироундекана вариантом дихлорпентитового способа по данному изобретению.
Пример 2. К перемешиваемому раствору 120,3 г (458 ммоль) 2,4,6-три-т-бутилфенола в 382 мл три-н-бутиламина в атмосфере аргона прибавляют 60,7 г (229 ммоль) 3,9-дихлор-2,4,8,10-тетраокса-3,9-дифосфаспиро[5,5] ундекана. Затем суспензию нагревают при перемешивании в атмосфере аргона при температуре 110oC 8 час. Результирующую суспензию оставляют охлаждаться до комнатной температуры и прибавляют 400 мл изопропилового спирта. Твердые соединения фильтруют под вакуумом и промывают на воронке 1 л изопропилового спирта затем 1 л н-гептана и получают 145,5 г (выход 89%) целевого дифосфаспироундекана в виде белого порошка с т.пл. 253-254oC и кислотным числом 0,92. Структуру продукта подтверждают стандартными способами. Очевидно, что вышеописанный способ по данному изобретению дает лучший выход продукта, чем известный способ, описанный в примере 1.
В примере 3 показано получение бис- /2,4,6-три-т-бутилфенокси/ тетраоксадифосфаспироундекана вариантом дихлоридитового способа, т.е. другим вариантом способа по данному изобретению.
Пример 3. К 73,0 г (530 ммоль) треххлористого фосфора на ледяной бане медленно прибавляют 16,9 г (170 ммоль) триэтиламина. Смесь перемешивают 10 мин и затем порциями по 7,0 г при охлаждении в течение 20 мин прибавляют 35,0 г (130 ммоль) 2,4,6-три-т-бутилфенола. После прибавления 2,4,6-три-т-бутилфенола реакционную смесь кипятят с обратным холодильником 3,5 час и оставляют охлаждаться до комнатной температуры.
Реакционную смесь разбавляют 200 мл гептана, охлаждают и фильтруют. Осадок дважды промывают 80 мл (2 х 80) гептана. Соединенные органические фильтраты концентрируют под вакуумом и получают 48,2 г (выход 99%) дихлоридита в виде твердого продукта с т.пл. 81-86oC. Аналогичные результаты получают с использованием толуола как растворителя в реакции.
На следующей стадии смесь 47,0 г (130 ммоль) 2,4,6-три-т-бутил-фенилфосфородихлоридита и 80 мл толуола прибавляют к 48,8 г (260 ммоль) пентаэритрита. Экзотермическая реакция (разогрев до 55oC) сопровождается образованием белого осадка. После перемешивания в течение 1 час и возвращения температуры смеси комнатной, смесь фильтруют под вакуумом и осадок промывают 50 мл (4 х 50) изопропилового спирта. Результирующий осадок сушат и получают 33,2 г (выход 71% ) целевого дифосфаспироундекана в виде белого твердого соединения с т. пл. 253-257oC и кислотным числом 0,31. Структуру продукта подтверждают стандартными способами. Ясно, что способ по примеру 3, являющийся способом по данному изобретению, приводит к более высокому выход продукта по сравнению со сравнению со способом по примеру 1.
Примеры 4-13 Другие спироциклические соединения (примеры 4-8) синтезируют, заменяя 2,4,6-три-т-бутилфенол по примеру 2 эквимолярными количествами других фенолов. Другие спироциклические соединения (примеры 9-12) синтезируют, заменяя 2,4,6-три-т-бутилфенол по примеру 2 на эквимолярные количества других фенолов. Эти фенолы являются следующими:
Пример Фенол
4 2,6-ди-т-бутилфенол
5, 9 2,6-ди-т-бутил-4-метилфенол
6, 10 2,6-ди-т-бутил-4-этилфенол
7, 11 2,6-ди-т-бутил-4-в-бутилфенол
8, 12 2,4-ди-т-бутилфенол
Синтез аналогичных дифосфаспироундеканов, показанных в табл.1, подтверждается одним или больше стандартным способом, например т.пл. ИК-спектроскопией, ЯМР- и масс-спектроскопией. Полученные соединения испытывают так, как описано в последующих примерах.
Для удобства дифосфаспироундекановые продукты по примерам 1, 4-12 обозначены так, как указано ниже (все они представляют собой 3,9-бис-/ди-или триалкилфенокси/-2,4,8,10-тетраокса-3,9-дифосфаспиро[5,5] ундеканы. Однако для удобства все цифры, за исключением алкильных заместителей в феноксигруппе, удалены.
Чувствительность к влаге замещенных 3,9-бис-/2,6-ди-т-бутил-4-алкилфенокси/-2,4,8,10-тетраокса-3,9- дифосфаспиро[5,5]ундеканов.
Влагочувствительность спироциклических дифосфитов по табл. 1 и ТВРР (известного нециклического фосфитного стабилизатора, трис (2,4-ди-т-бутилфенил)фосфита) испытывают, помещая соединения в климатическую камеру, отрегулированную на относительную влажность около 80% при комнатной лабораторной температуре (около 70oF). Образцы выдерживают в камере и регистрируют их привес и возрастание кислотного числа во времени (привес отражает гигроскопичность соединения и возможный гидролиз образца, а увеличение кислотного числа свидетельствует о гидролизе образца). Время, необходимое для достижения привеса 1 мас. при выдерживании во влажных условиях, обозначают как конечную точку. Результаты представлены в табл.2. Кислотное число измеряют способом с использованием бутилата натрия и метиленхлорида до помещения образца в климатическую камеру ("Первоначальное КЧ") и после достижения привеса в 1 мас. ("Конечное КЧ"). Данные табл.2 показывают, что дифосфаспироундекановые композиции, полученные способом по данному изобретению, могут проявлять более хорошие влагоустойчивые свойства, чем композиции, полученные известным способом.
Пример 14.
Воспроизводят методику по примеру 2 11 раз с небольшими вариациями относительного количества 2,4,6-три-т-бутилфенола (2,0-2,2 моль на моль хлорпентита) и/или н-бутиламина (3,0-6,0 моль на 1 моль хлорпентита). Полученные по этим реакциям продукты подвергают затем старению во влажных условиях описанных выше, 2000 час для оценки способа по влагоустойчивости продукта. Для 11 испытанных образцов среднее исходное КЧ равно 1,6 (верхнее 5,08, нижнее 0,37). Эти образцы обнаруживают привес (средний) 0,7 мас. (нижний 0,2, верхний 1,13) в ходе старения. Среднее конечное КЧ для этих образцов равно 5 (нижнее 1,6, верхнее 24,4). Старению подвергали также дополнительно полученное соединение Е, полученное из 2,6-ди-т-бутил-4-втор-бутилфенола. Образец имеет исходное КЧ 0,34, привес 1,7 мас. за 2000 час и конечное КЧ 18,3.
Примеры 15-21. Соединения А и Е получают по методикам соответственно примеров 1 и 7. Испытания соединения Е, являющегося дифосфаспироундеканом по данному изобретению и ТВРР и соединения А, не соответствующих данному изобретению, испытывают в LLDPE, содержащем 300 ч/млн. октадецил-3,5-ди-т-бутил-4-оксигидроциннамата и 500 ч/млн. стеарата кальция. Результаты испытаний представлены ниже в табл.3.
В этих и последующих примерах порошкообразные стеарат кальция и дифосфаспироундекан (и другие присутствующие добавки) вводят в полимер сухим смешением в течение 45 мин в смесителе Turbula. Полученную сухим смешением полимерную смесь экструдируют при температуре полимера 525oC через 2,5 см одношнековый экструдер, снабженный 2-стадийным шнеком со смесителем Maddox. Экструдат режут на гранулы и снова экструдируют, всего 7 раз. Отбирают продукт после первой, третьей, пятой и седьмой экструзий. Показатель текучести расплава этих образцов измеряют по ASTM-методике D-1238, условия Е.
Показатель текучести расплава LLDPE обычно снижается с каждой экструзией, так как полимер подвергается деструкции за счет общей снивки, снижающей текучесть. Поэтому эффективность стабилизатора можно оценить измерением показателя текучести расплава в ходе последовательных экструзий и определяя насколько близок показатель текучести расплава после очередной экструзии показателю текучести расплава после предыдущей экструзии. Цвет образцов измеряют на колориметре Hunter по стандартной методике, описанной для этого оборудования, и сравнивают изменение индекса желтизны (YI), произошедшее между каждыми экструзиями, от первой до седьмой. Измерение окраски проводят на 0,33 см диска диаметром 3,75 см, полученного формованием под давлением при 330oF из гранул образца. Более высокое значение соответствует более сильной окраске.
Результаты определения показателя текучести расплава и цвета полимеров, содержащих эти соединения, приведены ниже в табл.3. Количество введенного дифосфаспироундекана указано в частях на 100 частей полимера. Колонки "первая, третья, пятая, седьмая" обозначают номер экструзии, которой подвергалась композиция, из которой отобрали образец.
Примеры 22-28. Дополнительные испытания ТВРР и соединений А и Е, полученных по примерам 1 и 7, проводят с использованием полипропилена Profax 6501 производства Hercules. Испытуемые композиции содержат 0,025 phr пентаэритриттетракис-(3-(3,5-ди-т-бутил-4-оксифенил)пропионата) и 0,05 phr стеарата кальция. Количества добавок и результаты представлены в табл. 4-5.
Вышеописанные примеры иллюстрируют различные аспекты данного изобретения. Изобретение органичено только представленной ниже формулой изобретения и не ограничено описанными конкретными вариантами или параметрами, поскольку для специалиста в данной области после ознакомления с данным описанием станут ясны модификации этих методик.







В изобретении предлагается усовершенствованный способ получения дифосфаспироундеканов и получаемый этим способом продукт, где способ включает в себя взаимодействие оксизамещенного органического соединения, треххлористого фосфора и пентаэритрита с образованием замещенного органическими радикалами дифосфаспироундекана и где образование указанного замещенного органическими радикалами дифосфаспироундекана происходит в присутствии три-н-алкиламина, имеющего н-алкильные остатки, каждый из которых имеет не менее трех атомов углерода. В данном изобретении предлагаются также бис-3,9-/2,6-ди-трет-алкил-4-алкилфенокси/-2,4,8,10-тетраокса-3,9-дифосфаспиро[5,5] ундеканы и содержащая их эффективное количество полимерная композиция. 2 с.п. ф-лы, 5 табл.
| Патент США N 4094855, кл | |||
| Способ восстановления хромовой кислоты, в частности для получения хромовых квасцов | 1921 |
|
SU7A1 |
| Патент США N 4371647, кл | |||
| Способ восстановления хромовой кислоты, в частности для получения хромовых квасцов | 1921 |
|
SU7A1 |
Авторы
Даты
1997-10-20—Публикация
1989-07-24—Подача