Настоящее изобретение касается способа удаления вирусов и определения степени их удаления из органических веществ.
Фармацевтические препараты, получаемые из клеток, органов или крови человека или животных, могут быть загрязнены патогенными вирусами человека или животных. Рассматривая широкий спектр вирусов, которые могут иметь любое указанное происхождение, невозможно проанализировать вещества, являющиеся источником всех существующих вирусов. Кроме того, не существует точного и чувствительного метода для идентификации всех групп вирусов. Ввиду этого чрезвычайно важно осуществлять операции очистки или инактивации, которые снижают число присутствующих патогенных вирусов, так, чтобы не возникало никаких проблем, даже если материалы или промежуточные продукты, являющиеся источником этих вирусов, сильно заражены. Эти способы удаления вирусов или очистки должны быть настолько эффективны, чтобы концентрация вирусов снижалась во много раз (вплоть до 1012).
Для того, чтобы проверить степень удаления вирусов, необходимо проанализировать образцы материала, подвергаемого инокулированию вирусами чрезвычайно высоких концентраций (пиковых концентраций), и определить титр вирусов. Поскольку вирусы чрезвычайно сильно различаются в отношении их физико-химических характеристик, то материал, выбранный для осуществления данного анализа, должен быть подвергнут инокулированию по меньшей мере четырьмя различными группами вирусов, и это связано с большими затратами капитальных средств и затратой времени, поскольку должны использоваться также вирусы, которые могут быть патогенными для подвергаемых испытанию людей. Описание сложных процедур получения факторов коагуляции из сыворотки человека было опубликовано в работах: Heimburger, Schwinn, Gratz, Luben. Kumpe Herchenhahn, Faktor VIII Konzentrat, hochgereinigt und in Losung erhitzt, Arzneimittelforschung 31 (1981), 612 622, Mauler u Hilfenhaus: Inaktivierung von Viren in Faktor VIII Konzentrat durch Erhitzen in Losung, Arzneimittelforschung 34 (1984), 1524 1527, Hilfenhaus Mauler, Friis и Bauer.
Безопасность продуктов из человеческой крови. Инактивация ретровирусов путем термообработки при 60oC, Proc, Soc. Exp. Biol. Med 178 (1985), 580 - 584.
При приготовлении фармацевтических препаратов осуществляется длительная по времени стандартная процедура удаления бактерий посредством фильтрации в стерильных условиях, и эта процедура должна обеспечивать надежную защиту от возможных патогенных организмов. Ввиду этого стерильные фильтры в некоторых случаях инокулируются непосредственно изготовителем минитестовым бактериями Pseudomonas diminuta, не входящими в группу микроплазмовых бактерий или бактерий L-формы. Если "Тест с бактериальным контрольным заражением" показывает предварительно установленную степень удаления бактерий, то приготавливаемая серия препаратов считается безопасной. Такая процедура описывается в работе Wallhauper. Практика стерилизации Thieme Verlag, Stuttgart 1988, Seiten 324 стр.
Для удаления вирусов известны способы, включающие процедуры фильтрации; для этой цели используют фильтры с настолько небольшими размерами пор, чтобы они успешно задержали молекулы и частицы более чем 1 млн. Дальтон. Эти ультрафильтры выпускаются в различных формах. Однако в противоположность стерильным фильтрам они не образуют абсолютного барьера, то есть молекулы и частицы более чем 1 млн. Дальтон не полностью удаляются и могут в очень большой степени оставаться. Степень сохранения этих молекул и частиц зависит не только от типа фильтра, и может меняться от партии к партии. Это является причиной того, что до настоящего времени ультрафильтры не могли использоваться для удаления вирусов, а могли в лучшем случае использоваться в процессах удаления вирусов в многоэтапных процессах (Werner и Langlins-Gane. Конференция по созданию необходимых условий для получения продуктов на основе рекомбинантной ДНК фармацевтического назначения Arzneimittelforschung. Том 39, 1989, 108 111). Такая ненадежность ультрафильтров обусловлена непосредственно процессом изготовления. В ультрафильтрах, предназначенных для отсева определенных молекул, всегда могут быть образованы более широкие поры, допускающие, например, возможность прохождения через них вирусов. Другая проблема заключается в том, что ультрафильтры не могут быть испытаны на их плотность посредством так называемого "пузырьково-точечного" метода, как могут быть испытаны микрофильтры.
Таким образом, объектом настоящего изобретения является способ удаления вирусов, позволяющий достигать степень этого удаления не менее чем 1012. Следующим объектом данного изобретения является способ, согласно которому может быть определена с большой точностью и простотой степень удаления вирусов, и который позволяет получить информацию о том, каким образом осуществляется фильтрация и сколько требуется этапов фильтрации для получения степени удаления вирусов, обеспечивающей указанную безопасность.
Данный объект изобретения достигается благодаря способу удаления вирусов в растворах, отличающемуся тем, что раствор, который должен быть очищен, пропускается через фильтр или фильтрованную систему, в которых степень удаления вирусов была предварительно определена, таким образом, что раствор, содержащий вирусы семейства leviviridae, проходит через данный фильтр, и определяется титр вируса до и после фильтрации, и на основании этого определяется степень удаления вируса. Согласно настоящему изобретению в равной мере могут быть использованы и другие бактериофаги такого же размера. Эти бактериофаги наилучшим образом могут быть обнаружены по бляшкам на газонах бактерии.
Согласно изобретению возможно также использование лишь способа ультрафильтрации, который гарантирует безопасное удаление вирусов без дополнительной очистки или инактивации, путем последовательного контроля степени удаления вирусов в ходе процесса. Если степень удаления вируса определяется до и после фильтрации, и разница составляет величину более чем 1012, то загрязнение вирусом получаемого продукта можно считать с полной определенностью исключенным. До настоящего времени проверочные испытания осуществлялись лишь на патогенных вирусах человека и животных, и это означает, что с целью безопасности подвергнутые проверочному испытанию фильтры должны быть удалены и вместо них должны использоваться новые фильтры, которые обеспечивают по возможности другие степени удаления вирусов. Ввиду этого такое проверочное испытание может осуществляться лишь для одного единственного фильтра, и ввиду сложности данного приема такое проверочное испытание должно осуществляться лишь до или после удаления вирусов лишь с целью иллюстрации. В противоположность этому согласно настоящему изобретению возможно наблюдать и прослеживать путь удаляемых вирусов в ходе процесса, то есть осуществлять контроль вирусов в ходе процесса.
На основе этих открытий раствор пропускают через фильтр или фильтровальную систему, где была предварительно определена степень удаления вирусов. Используя вирусы группы leviviridae, можно легко и безопасно определить степень удаления вирусов.
Вирусы leviviridae размером в диаметре 23 нм и молекулярным весом 1,4 млн. Дальтон меньше, чем патогенные вирусы человека и животных (H. Fraenkel
Contrat. Вирусы. Каталог. Определение характеристик и классификация. Plenum Press, 1982). Они лишь заражают специфические P+ штаммы безвредных кишечных бактерий Escherichia coli и как вирусы РНК могут гидролизоваться уже в 10 мМ NaOH в течение короткого периода времени, разлагаясь при этом на их молекулярные составляющие. Самые маленькие патогенные вирусы человека и/или животного принадлежат к группе вируса picorna, имеющего диаметр 27 нм и молекулярный вес 2,5 млн. Дальтон. Ввиду этого вирусы leviviridae пригодны также для проверочного испытания ультрафильтров избирательной по размеру вирусов фильтрации. Последующая промывка фильтров 0,1 M NaOH также гарантирует удаление пирогенных продуктов, образующихся под действием бактерий Escherichia coli. После этого фильтры готовы для повторного использования в данных процессах. Таким образом, выполняются все условия, необходимые для контроля осуществления процесса, а именно
простое и точное проверочное испытание, которое может быть осуществлено в течение короткого периода времени,
возможность повторного использования испытываемых фильтров без дополнительного риска загрязнения продукта.
Следующим преимуществом является то, что leviviridae могут быть выращены до чрезвычайно высоких титров вплоть до 1014 бляшкообразующих единиц/мл и выделены простым чашечным методом даже в концентрациях 1 бляшкообразующая единица/мл.
Для осуществления данного измерения фильтр инокулируют с раствором или суспензией вируса титром более чем 1010 бляшкообразующих единиц/мл. Определяют концентрацию фагов в фильтрате и в сохраняемой суспензии, это может быть осуществлено общеизвестными способами (такими как метод диффузии в верхнем агаре, разработанный, например, Adams N. H. (1969 г.), Бактриофаги, Interscience Publishers, Нью-Йорк). Фаги смешивают с подходящими бактериями хозяевами (такими как E. coli 3300 АТСС N 19853) и применяют в слое 0,6% агар-агара на поверхности питательной среды (такой как 1% бактотриптона, 0,5% дрожжевого экстракта, 0,5% NaCl, 0,1 мM CaCl2, 1,5% агар-агара). В каждую чашку наносят 107 108 бактерий и менее чем 100 фагов. Чашки термостатируются при 37oC и в результате после 10 ч выращивают газон бактерий. Бляшки на газоне бактерий являются показателем присутствия вирусов, и число бляшек является показателем титра вирусов в бляшкообразующих единицах (pfu). Поскольку один вирус может дать одну бляшку, то в стандартной агаровой чашке может быть обнаружен 1 вирус/мл. Таким путем могут быть охвачены концентрации вируса в пределах более чем 1014 и вплоть до 1 бляшкообразующая единица/мл.
Определение концентрации вируса в фильтрате и в суспензии до фильтрации показывает, что удаление вируса может быть вполне явным. Путем определения титра вируса в концентрате (то есть в суспензии, удерживаемой фильтром) можно установить, происходит ли потеря вирусов на фильтре за счет абсорбции или за счет инактивации, что обеспечивает еще более высокую степень безопасности при осуществлении проверочного испытания.
Поскольку поведение фильтровальных мембран может быть различным не только у различных изготовителей, но в различных партиях, то очень важно определить степень удаления вируса для каждого отдельного фильтра.
Выбранные фильтры или системы фильтрации для очистки органического материала должны исследоваться в точно заданных условиях давления, которые непосредственно связаны с последующим процессом очистки.
После определения степени удаления вируса данные фильтры могут просто промываться каустической содой для удаления бактериофагов и других остаточных продуктов, таких как пирогены, и далее они могут использоваться для очистки органических материалов. Это является еще одним преимуществом способа данного изобретения, поскольку это невозможно осуществить, когда для определения степени удаления вируса используют патогенные вирусы человека или животного ввиду опасности загрязнения данными вирусами.
Было доказано, что наилучшими для выбора из группы leviviridae являются вирусы MS52, f2, f4, Qβ Vk, ST, R17 или эквивалентные им штаммы (как описано H. Fraenkel, Conrat, The viruses-Catalogue. Определение характеристик и классификация, Plenum Press, Нью-Йорк, 1982). Особенно предпочтительным является бактериофаг fr как тестовый вирус, который хранится в АТСС под номером 15767-В1- и описан в публикации Knolle и Hoffmann-Berling Virology, том 123, 271 273, 1964. Этот фаг состоит из круглого белкового РНК-комплекса в форме полигедрона размером 23 нм в диаметре и имеет молекулярный вес 1,4 млн. Дальтон.
Согласно предпочтительному варианту осуществления данного способа органический материал очищают путем ультрафильтрации в спиральных патронных фильтрах, где заполнение фильтра осуществляется насосом. Перед вводом патронных фильтров в работу устанавливают фактор удаления вируса с помощью тестового вируса. Тестовый раствор, содержащий известное количество тестового вируса, пропускается через данный патронный фильтр в форме тангенциального потока так, чтобы была гарантия, что сохраняются точно заданные условия давления. Затем устанавливается титр вируса в фильтрате с помощью любого существующего метода. После этого органический материал очищается в том же патронном фильтре при тех же условиях.
Тестовые вирусы до их использования при осуществлении способа настоящего изобретения могут быть выращены любым существующим в настоящее время способом до титра вплоть до 1014. Что касается бактерий-хозяев для бактериофагов, то предпочтительными являются, например Escherichia coli 3300, АТСС-19853. Обычно это известные питательные среды для выращивания фагов. Подходящая для этой цели среда описывается, например, в работе huria и Bertani, эта среда содержит 10 г бактотриптона, 5 г дрожжевого экстракта и 5 г NaCl в 1 л дистиллированной воды с pH 7,6, которая легко регулируется посредством NaOH, если это необходимо. С помощью осаждающего агента (например полиэтиленгликоля PEG6000) желаемые вирусы выпадают в осадок в питательной среде разведения. Затем эти вирусы снова суспензируются в буферном растворе, и этот раствор доводится до желаемого титра. Подходящим для этой цели является, например, буферный раствор трис-HCl с величиной pH 7,5, содержащий 100 мM NaCl и 3 мM CaCl2. Титр раствора может быть определен методом верхнего агара. После этого разбавленная суспензия фага подвергается фильтрации, необходимой для органического материала. После этой фильтрации определяется титр вируса, по которому можно определить фактор удаления вируса. Титр вируса определяется как pfu (бляшкообразующие единицы), и он означает число бляшек на газоне бактерий, которые возникают в результате вирусного инфекционного заражения. Фильтрация осуществляется после промывки патронного фильтра каустической содой и нейтрализации его дистиллированной водой, и если необходимо, это может осуществляться до тех пор, пока не достигается желаемая степень удаления. Кроме того, можно устанавливать ряд фильтров один за другим, что обеспечивает непрерывный ход фильтрации. После определения фактора удаления, пирогены, введенные фагами, удаляются промывкой патронного фильтра каустической содой и нейтрализацией его дистиллированной водой. Такой патронный фильтр готов для повторного использования в данном процессе.
Было найдено, что способ данного изобретения особенно пригоден для удаления вирусов в ходе получения стерильных экстрактов из биологического материала, так называемый контроль в ходе процесса. Установлено, что степень удаления веществ, являющихся маркерами, из подвергаемого очистке образца непосредственно связано с удалением вирусов. Это дает возможность правильно оценить степень удаления вирусов путем простого определения удаления вещества, являющегося маркером.
Согласно настоящему изобретению определяют степень удаления вируса в зависимости от маркера, и оценивается соотношение обоих факторов удаления, что позволяет построить калибровочную кривую и проследить в ходе процесса уменьшение концентрации вируса по показателю удаления маркера с помощью данной калибровочной кривой.
В качестве маркеров обычно предпочтительны те легко идентифицируемые вещества, которые уже присутствуют в подвергаемой очистке системе. Однако можно также вводить в эту систему другие маркеры. Предпочтительными веществами, служащими в качестве маркеров, являются белки, пептиды, и/или нуклеиновые кислоты. Пригодны также синтезированные продукты, особенно олигомеры и полимеры. Специалисты, работающие в лабораторных условиях, обычно знают, как выбрать полимер, необходимый для данной системы. Это осуществляется путем простых испытаний. Согласно данному изобретению предпочтителен бычий сывороточный альбумин (BSA). Предпочтительными препаратами, подвергаемыми очистке, являются биологические материалы, особенно материалы, образуемые из растительных и животных организмов. Они извлекаются предпочтительно из органов, тканей и/или клеток. Предпочтительными органами являются селезенка, вилочковая железа и/или костный мозг. Однако описанный в настоящей патентной заявке способ пригоден также для очистки биологического материала, извлекаемого из жидкостей организма, или из бактериального или вирусного материала, особенно из патогенного материала. Согласно наиболее предпочтительному аспекту данного изобретения фактор удаления определяется с использованием четырех различных вирусов.
Далее настоящее изобретение поясняется иллюстрацией фиг. 1 и 2 и описанных ниже примеров.
Фиг. 1. Схематическое изображение системы фильтрации, которая выпускается под названием Амикон S1.
Фиг. 2. Патронный фильтр, используемый в системе фильтрации, показанной на фиг. 1.
На фиг. 1 показана система фильтрации для ультрафильтрации органических суспензий. Из бака-хранилища (не показан) суспензия направляется по трубопроводу 3, снабженному ротационным насосом 5, дроссельным клапаном 7, манометром 9, отсечным клапаном 1 и спускным устройством 13, входя в этот трубопровод через впускное отверстие 15 и проходя в фильтрующее устройство 17. Фильтрующее устройство 17, снабженное впускным отверстием 15 и выпускным отверстием 18 и имеющее зажимные приспособления 21, включает в себе спиральный патронный фильтр 23. Из фильтрующего устройства 17 фильтрат проходит через трубопровод 25, снабженный отсечным клапаном 27, выпускным отверстием 29, манометром 21 и контрольным клапаном 33, в другую емкость-хранилище (не показано).
На фиг. 2 показано фильтрующее устройство 117. Это устройство 117 имеет впускное отверстие 115, которое снабжено манометром 116 и зажимным приспособлением 121. Трубка 126 сообщается с впускным отверстием. Фильтрующее устройство 117 включает в себя патронный фильтр 123. В верхней части этого фильтрующего устройства 117 имеется выпускное отверстие 119, которое снабжено контрольным клапаном 120 и зажимным приспособлением 121.
Пример 1.
Испытание полисульфоновой мембраны Сарториуса с задержкой фракций молекулярным весом 100000 Дальтон для удаления вирусов
Патронный фильтр из полисульфона (Гетинген, Германия), изготовленный согласно Сарториусу, инокулировали фаговой суспензией в форме тангенциального потока точно в соответствии с условиями, описанными в прототипе данной заявки. В табл. 1 даны результаты этих испытаний с тремя различными парциальными давлениями. При всех трех режимах давления порядок величины степени удаления фага составлял 10. Для того, чтобы был достигнут фактор удаления 1010, процессы фильтрации повторяют не менее чем 10 раз, и каждый раз их проверяют путем ввода фага fr.
Пример 2.
В данном примере проводили анализ на удаление вируса фильтрующей системы Амикон S1, снабженной ультрафильтрующей мембраной с задержкой фракций молекулярным весом 30000 Дальтон. Технический принцип данной фильтрующей системы иллюстрируется на фиг. 1, и патронный фильтр данного устройства иллюстрируется на фиг. 2. Подвергаемая фильтрации суспензия проходит в форме тангенциального потока через мембрану. Часть суспензии фильтруют при трансмембранном давлении (Pt) над мембраной. Давление у впускного отверстия 15 (Pa) и выпускного отверстия 19 (Pв) данной системы измеряют с помощью манометров. Давление прохождения через мембрану рассчитывают по формуле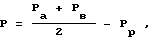
где Pp означает давление фильтрата, которое обычно является нулевым и ≠ Pa. Образцы нагнетаются перистальтическим насосом 31 в патронный фильтр 23 при скорости оборотов 130 об/мин и с внутренним диаметром трубки 8 мм. Давление прохождения образца регулируют посредством сливного клапана в пределах до значений 0,2; 0,4 и 0,7 Бара.
Для проведения испытания патронного фильтра через данную мембрану нагнетают фаговые суспензии с титром 7,8•109 pfu (бляшкообразующих единиц) на мл (в буферном растворе 10 мM трис-Cl, pH 7,5, разбавленном в 100 мM NaCl с 1 мг бычьего сывороточного альбумина на мл). В каждом испытании фильтруют 1,5 г фаговой суспензии. Между операциями фильтрации патронный фильтр промывают 0,1 M NaOH и затем промывают фосфатно-буферным NaCl раствором до тех пор, пока элюат не нейтрализуют. Такие промывки гарантируют полную инактивацию любых фагов, которые могут остаться в системе. Патронный фильтр хранится в растворе 10 мM NaOH.
В табл. 2 суммированы результаты данного испытания, проводимого с использованием патронного фильтра SIV30, серии N 8864. Факторы удаления 4,53 log10 достигают непосредственно после начала процедуры, и 4,4 log10 достигнут после хранения в 10 мM NaOH в течение нескольких месяцев после фильтрации.
Пример 3.
Определение степени удаления в системе фильтрации с использованием бактериофага fr
В данном примере проводилось исследование спирального патронного фильтра SIV30 серии N 8864, изготовленного фирмой Амикон. С помощью указанного патронного фильтра осуществлялась фильтрация 600 мл каждой фаговой суспензии с начальным титром 3•1010 в виде пяти параллельных циклов по три раза. Между каждыми этапами фильтрации патронный фильтр промывали 2 л воды RO (воды, очищенной путем обратного осмоса). Из табл. 3 видно, что во всех пяти параллельных циклах фильтрации через патронный фильтр никакого зараженного фага fr в 1 мл фильтрата не обнаруживалось.
Пример 4.
Удаление испытываемого вируса с фактором 12
В данном примере испытывали патронный фильтр SIV30 серии N 10330. Фаговая суспензия состояла из 600 мл фагового буферного раствора с 600 мг бычьего сывороточного альбумина и 50 мл фагового концентрата (титр 1,3•1012 pfu (бляшкообразующих единиц)/мл). Проводили три фильтрации в цикле. Объем фильтрата снижался с 600 до 400 мл, и в дальнейшем снижался до 380 мл. Каждый этап фильтрации продолжался примерно 20 мин. Между отдельными фильтрациями патронный фильтр промывали 1 л 10 мM каустической соды для инактивации фаговых осадков и затем промывали дистиллированной водой до их нейтрализации (измеряется с помощью pH-электрода).
Определяли содержание вируса в каждом отдельном фильтрате, и полученные значения приводятся в табл. 4.
После того как фильтрат (1 мл) был уже свободен от бактериофага fr после второй фильтрации, последний фильтрат (380 мл) инокулировали еще раз 40 миллилитрами вирусного концентрата (титр: 5,2•1012 pfu/мл) и фильтровали три раза подряд. Как видно из табл. 1, после второй фильтрации никакого фага не обнаруживается в 1 мл фильтрата.
Из данных удаления вируса, приведенных в табл. 4, ясно, что титр вируса снижается на величину порядка 6,92 log10 и 7,22 log10 после первой фильтрации с использованием ультрафильтровального патрона. В обоих случаях после второй фильтрации никаких фагов уже больше не обнаруживается. Это говорит о том, что число вирусов после первых двух фильтраций снижается в общей сложности в 10 в степени 11 и после еще двух фильтраций в 10 в степени 11,7, то есть общее снижение числа вирусов после четырех фильтраций составляет 10 в 22,7 степени. Таким образом, рекомендуемая степень удаления вируса, составляющая 10 в степени 12 16, как описано в литературе, превышает 10 в степени 18,22 лишь после трех фильтраций, как видно из проведенных экспериментов. В случае снижения, составляющего 7 log10, удаление вируса в данном цикле процесса более эффективно, чем в процессах согласно примерам 2 и 3, в которых степень удаления составляет примерно 4,5 log10 (табл. 3 и 4). Значительные различия степени удаления вируса наблюдаются для различных партий, что говорит лишь о необходимости тщательного проверочного испытания для различных тестовых вирусов.
Пример 5.
Оценка удаления вируса из экстракта вилочной железы по определению бычьего сывороточного альбумина (BSA)
Осуществляли гомогенизацию вилочных желез телят и приготавливали из них экстракт общеизвестными способами. В этот экстракт вводили бактериофаг fr (АТСС N 15767-В1), Knolle и Hoffmann Verlag, Virology. Том 123, с. 271 273, 1964, как тестовый вирус. Содержание бычьего сывороточного альбумина, а также содержание пуринового и пиримидинового оснований определяли методом жидкостной хроматографии высокого разрешения общеизвестным способом.
Затем образец, инокулированный испытываемым фагом, фильтровали, как описано в примерах 3 и 4, через патронный фильтр IV30, серии N 10330 (Amicon Div, W. R. Grace and Co. Danner, Ma. США). Определяли удаление вируса, а также степень снижения ВSА. Существует связь между уменьшением числа вирусов и снижением ВSА.
Бактериофаг fr (АТСС 15767-В1) был депонирован 19 ноября 1964 года в коллекцию культур американского типа, 12301, Parklawn Drive, Rockville, Maryland, 20852-1776, США, и с этого времени это легко доступный продукт.
3300 (АТСС 19853) был депонирован 12 января 1967 года в Коллекцию культур американского типа, 12301, Parklawn Drive, Rockville, Maryland 20852-1776, США, и теперь это легко доступный продукт.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ ШТАММА БАКТЕРИОФАГА, СПЕЦИФИЧЕСКИХ ШТАММОВ БАКТЕРИОФАГОВ И ИХ ПРИМЕНЕНИЕ | 2012 |
|
RU2573934C2 |
| СПОСОБ И УСТРОЙСТВО ДЛЯ ОБНАРУЖЕНИЯ БАКТЕРИЙ | 2016 |
|
RU2704245C1 |
| АНТИБАКТЕРИАЛЬНАЯ КОМПОЗИЦИЯ В ВИДЕ СУППОЗИТОРИЯ И СПОСОБ ЕЕ ПРИГОТОВЛЕНИЯ | 2016 |
|
RU2622762C1 |
| НЕЙРОТОКСИНЫ, ПРОЯВЛЯЮЩИЕ СОКРАЩЕННУЮ БИОЛОГИЧЕСКУЮ АКТИВНОСТЬ | 2010 |
|
RU2582266C2 |
| Способ оценки эффективности фаготерапии при лечении инфекционных заболеваний | 2016 |
|
RU2624511C1 |
| СПОСОБ ОЧИСТКИ БАКТЕРИОФАГОВ | 2011 |
|
RU2590609C2 |
| ВИДОСПЕЦИФИЧЕСКИЙ ВИРУЛЕНТНЫЙ ШТАММ БАКТЕРИОФАГА, ОБЛАДАЮЩИЙ ЛИТИЧЕСКОЙ АКТИВНОСТЬЮ В ОТНОШЕНИИ Staphylococcus aureus, ВКЛЮЧАЯ МУЛЬТИРЕЗИСТЕНТНЫЕ ШТАММЫ | 2012 |
|
RU2503716C1 |
| ПРЕПАРАТ ПОЛИВАЛЕНТНОГО БАКТЕРИОФАГА ПРОТИВ СИНЕГНОЙНОЙ ПАЛОЧКИ, ШТАММЫ БАКТЕРИОФАГА BACTERIOPHAGUM PSEUDOMONAS AERUGINOSA СПБГМА ИМ. И.И. МЕЧНИКОВА №05, №03, №06 И №07, ИСПОЛЬЗУЕМЫЕ ПРИ ПРИГОТОВЛЕНИИ ПОЛИВАЛЕНТНОГО ПРЕПАРАТА ПРОТИВ СИНЕГНОЙНОЙ ПАЛОЧКИ | 2001 |
|
RU2186574C1 |
| КОМПОЗИЦИЯ ДЛЯ БЕЛКОВОГО ФАРМАЦЕВТИЧЕСКОГО ПРЕПАРАТА БЕЗ ДОБАВЛЕНИЯ ЧЕЛОВЕЧЕСКОГО СЫВОРОТОЧНОГО АЛЬБУМИНА (HSA) | 2004 |
|
RU2491927C2 |
| СРЕДСТВО ДЛЯ НЕЙТРАЛИЗАЦИИ ВИРУСА НАТУРАЛЬНОЙ ОСПЫ | 2013 |
|
RU2515905C1 |



Использование: изобретение относится к области биотехнологии, в частности к вирусологии, и касается способа удаления вирусов и определения степени их удаления из биологического материала. Сущность: для удаления вирусов и/или патогенного материала из биологического материала его подвергают очистке путем пропускания через фильтр или фильтровальную систему, у которых степень удаления была предварительно определена так, что эта фильтровальная система инокулируется вирусом семейства Leviviridae. До и после фильтрации определяется титр вируса, показывающий степень его удаления. По прослеживанию удаления вещества, являющегося маркером, можно контролировать удаление вируса и/или патогенного материала в ходе процесса. 2 с. и 8 з.п. ф-лы, 2 ил., 4 табл.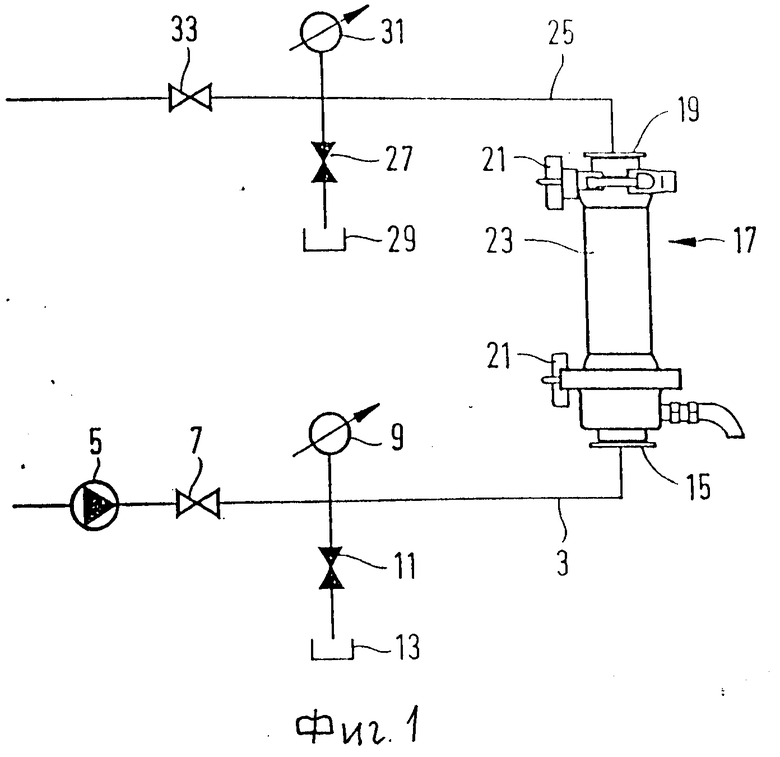
| Werner und Langlins-Gane, Meeting The Regulatory Raquirements for Pharmaceutical Production of Recombinant DNA Derived Products, Arzneimittel-Forschung, B.d | |||
| Машина для изготовления проволочных гвоздей | 1922 |
|
SU39A1 |
Авторы
Даты
1997-10-20—Публикация
1991-02-06—Подача