Изобретение относится к медицине, а именно к фармацевтической промышленности и касается лекарственных форм в виде суппозиториев, содержащих бактериофаги, и способа их получения.
Впервые возможность использования бактериофагов в профилактике и лечении инфекционных заболеваний была продемонстрирована в 1917 г., когда среди ученых-микробиологов распространилась сенсационная новость, что Феликс д'Эрелль открыл вирусы, «пожирающие бактерии», и на их основе ему удалось разработать препараты для лечения солдат, заразившихся дизентерией.
Бактериофаги - это вирусы, характеризующиеся специфической способностью к избирательному инфицированию бактериальных клеток, с последующим лизисом клетки-хозяина (вирулентные фаги) или образованием лизогенов (умеренные фаги).
Развитие новых представлений в конце XX - начале XXI века как о молекулярной биологии, так и об экологических взаимоотношениях бактериофагов и их хозяев, а также все более широкое распространение в биосфере антибиотикорезистентных микроорганизмов, актуализировали своего рода второе рождение вирусов бактерий. Существенно возросшее количество персистирующих антибиотикорезистентных патогенных и условно-патогенных штаммов бактерий, утяжеляющих клиническое течение патологических состояний и существенно ухудшающих показатели инфекционной заболеваемости во многих странах мира, связано как с бесконтрольным использованием антибиотиков при самолечении и профилактики нозокомиальных инфекций, так и с массовым применением консервантов и бактерицидных препаратов в пищевой промышленности и сельском хозяйстве. Улучшение качества медицинской помощи инфекционным больным, а также переход на потребление экологически чистых не обработанных антибактериальными средствами продуктов питания подразумевает поиск новых и возрождение известных ранее форм и методов лечения инфекционных заболеваний, способов деконтаминации инструментария и помещений ЛПУ, а также консервации пищевой продукции.
Учитывая остроту проблемы распространения антибиотикоустойчивых возбудителей инфекций, решением Ученого Совета Роспотребнадзора от 21 июня 2011 года, а также в соответствии с протоколом совещания у руководителя Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека от 02 декабря 2015 года «О вопросах антимикробной резистентности» рекомендовано научно-исследовательским организациям совместно с фармпроизводителями направить усилия на разработку препаратов на основе бактериофагов, эффективных при осуществлении мероприятий по обеспечению санитарно-эпидемиологического благополучия населения Российской Федерации.
Многочисленные исследования, проведенные отечественными и зарубежными учеными, подтверждают возможность использования бактериофагов в качестве природных антимикробных агентов для борьбы с бактериальными инфекциями у людей, животных и сельскохозяйственных культур, в том числе вызванных антибиотикорезистентными штаммами.
Преимущества бактериофагов перед антибиотиками достаточно очевидны и заключаются в следующем:
- способны уничтожать бактерии, устойчивые к антибиотикам;
- в титре, не превышающем в готовой лекарственной форме 1010 БОЕ/мл, не вызывают побочных эффектов (реакция Яриша - Герксгеймера);
- благодаря узкой видовой специфичности, не подавляют рост нормофлоры;
- сочетаются с другими лекарственными препаратами;
- оказывают иммуностимулирующее действие.
Более восьмидесяти лет в бывшем Советском Союзе, а позднее и в Российской Федерации на филиалах НПО «Микроген» производятся свыше десятка наименований пероральных лекарственных средств как на основе отдельных видов бактериофагов, так и их комбинаций для лечения и профилактики острых кишечных инфекций и декомпенсированных форм дисбактериоза, а также гнойно-воспалительных заболеваний бактериального генеза.
Известен поливалентный дизентерийный бактериофаг в свечах, используемый для лечения дизентерии, вызванной Shigella flexneri разных серотипов или Shigella sonne (Чушков Ю.В. Издание: Фарматека Год издания: 2011 Объем: 8 с. - N 6. - С. 34-41).
Известны ректальные свечи, содержащие фильтрат фаголизатов наиболее распространенных сальмонелл групп А, В, С, Д, Е., а также свечи со стафилококковым бактериофагом в виде лиофилизированного концентрата (Чушков Ю.В. Издание: Фарматека Год издания: 2011 Объем: 8 с. - N 6. - С.34-41).
Недостатком данных препаратов является узкая сфера их применения и использование активного начала - бактериофага в виде лиофилизированного концентрата, который в процессе сублимационной сушки снижает литическую активность.
Известен препарат "Секстафаг" в виде ректальных суппозиториев, содержащий стафилококковый бактериофаг, стрептококковый бактериофаг, протейный бактериофаг, клебсиеллезный бактериофаг, синегнойный бактериофаг, коли бактериофаг со специфической активностью каждого концентрированного монофага не ниже 10-7 (патент РФ №2366708).
Под очищенным концентрированным фаголизатом бактерий в этом патенте подразумевают несколько высокоактивных фаговых рас или штаммов совместно и одновременно культивируемых на нескольких же штаммах бактерий одного вида. Реальная концентрация каждого штамма при таком культивировании как в фаголизате, так и в готовой лекарственной форме - суппозиториях, в том числе после хранения остается неизвестной. При использовании данного метода получения очищенного концентрированного фаголизата бактерий и отсутствии полногеномного секвенирования каждого нового штамма бактериофага, а также проверки на лизогенность исходных культур бактериальных штаммов-хозяев, повышается вероятность попадания в коктейль бактериофагов умеренных штаммов, что не только потенциально снижает терапевтические свойства препарата, но и является недопустимым с точки зрения безопасности использования бактериофагов в качестве лекарственных средств.
Защищен иммунобиологический бактерицидный препарат в виде суппозитория на основе бактериофага (патент №2366708), который содержит видоспецифические вирулентные бактериофаги и бактериофаги с индуцированной вирулентностью с литической активностью не ниже 10-4 по Аппельману в отношении тест-штаммов и выделенных из организма человека изолятов бактерий в фильтрате фаголизата (или в фильтрате концентрата фаголизата) нелизогенных бактерий, и фармацевтически приемлемые целевые добавки в количестве 50,0-95,0 мас. % от массы препарата.
Недостатком предлагаемых суппозиториев является сочетание вирулентных - разрешенных к применению в медицинских целях, бактериофагов и бактериофагов с индуцированной вирулентностью - исходно умеренных, которые не только не будут оказывать терапевтического эффекта, но и не допускаются к использованию в лекарственных средств, а также то, что специфическую активность препарата бактериофагов, обозначаемую отрицательной степенью, определяли титрованием в жидкой питательной среде по методу Аппельмана. Данный параметр сложно интерпретировать в случае, когда в препарате используется несколько штаммов против одного вида бактерий, т.е невозможно стандартизировать препарат по содержанию фаговых частиц каждого штамма отдельно в 1 мл. Фармакокинетические исследования и возможный уровень патогенетического терапевтического эффекта - местный или системный данных свечей отсутствует, также не описана технология получения суппозиторий.
Наиболее близким аналогом изобретения (прототипом) является способ изготовления свечей с бактериофагом путем соединения очищенного концентрированного фаголизата бактерий с основой, отличающийся тем, что в основу непосредственно вводят жидкий фаголизат с титром не ниже 10-7 по Аппельману в количестве не более 20% от общей массы композиции (патент RU №2188629).
Для получения свечей прототипа используется жидкая питательная среда. Сырьем для производства свечей служат фильтраты фаголизатов микробных культур, концентрированные методом ультрафильтрации и подвергнутые стерилизующей фильтрации. Надо отметить, что ультрафильтрация усложняет технологический процесс не меньше, чем лиофилизация. В качестве активного начала суппозиториев используются бактериофаги клебсиелл и комплексный бактериофаг (пентафаг), при этом количество штаммов не определено, указаны только виды бактериофагов. Хотя в патенте это не указано, следует уточнить, что отрицательной степенью обозначают специфическую активность препарата бактриофагов, определяемую титрованием в жидкой питательной среде по методу Аппельмана (Appelmans R. Le dosage du bacteriophage. C.R. Soc Biol. 1921; 85:1098-99) на посевных бактериальных штаммах. Данный параметр сложно интерпретировать в случае, когда в препарате используется несколько штаммов против одного вида бактерий, т.е. невозможно стандартизировать препарат по содержанию фаговых частиц каждого штамма отдельно в 1 мл, которое определяется методом агаровых слоев по Грациа (Gratia, A. Des relations numeriques entre bacteries lysogene set particules de bacterophage /A.Gratia//Annales de l'Institut Pasteur. - 1936. - Vol. 57. - P. 652-676). Таким образом, под очищенным концентрированным фаголизатом бактерий в этом патенте подразумевают несколько высокоактивных фаговых рас или штаммов совместно и одновременно культивируемых на нескольких же штаммах бактерий одного вида. Реальная концентрация каждого штамма как в фаголизате, так и в суппозитории, в том числе, после хранения остается неизвестной.
Чрезмерным усложнением процесса изготовления суппозиториев в патенте RU №2188629 является также введение этапа стерилизации свечной основы перед внесением в нее АФС (активная фармацевтическая субстанция). Данная лекарственная форма не относится к стерильным и не требует стерилизации вспомогательных компонентов (проводится только стерилизующая фильтрация субстанции бактериофагов для избавления от патогенных культур бактериальных штаммов-хозяев).
Задачей настоящего изобретения является разработка суппозиторной лекарственной формы на основе комбинированной жидкой субстанции по меньшей мере трех бактериофагов с исходно высоким титром фаголизата от 2×108 БОЕ/суппозиторий каждого штамма, снижающимся на конец срока годности препарата до уровня не ниже 1×108 БОЕ/суппозиторий. Для достижения поставленной задачи по запатентованной технологии с выращиванием фаголизата на плотной питательной среде были получены высокоактивные стерильные фильтраты фаголизатов, подобраны вспомогательные компоненты и сконструирована готовая лекарственная форма - суппозитории, обладающие исходной высокой специфической антибактериальной активностью, сохраняющейся после всасывания фаговых частиц через слизистую кишечника, что было подтверждено в ходе фармакокинетических испытаний на кроликах.
При разработке суппозиториев на основе бактериофагов использовались микробиологические, молекулярно-генетические, биотехнологические методы и процедуры доклинических испытаний.
Техническим результатом заявленного изобретения является тот факт, что впервые в мире был разработан состав суппозиториев для ректального применения в отношении антибиотикоустойчивых микроорганизмов на основе коктейля из трех и более бактериофагов, обладающий необходимой специфической антибактериальной активностью (титром, измеряемым в БОЕ/мл по Грация и спектром литического действия - процент лизируемых штаммов внутри гомологичного вида бактерий) и системным механизмом действия при лечении инфекционных заболеваний за счет всасывания через слизистую кишечника в системный кровоток. Это в дальнейшем послужит основой для создания нового метода индивидуализированной антибактериальной терапии для лечения инфекций, вызванных лекарственно-устойчивыми штаммами возбудителей.
Таким образом, технический результат, достигаемый при осуществлении предлагаемой группы изобретений заключается в обеспечении системного антибактериального действия композиции путем всасывая активного начала через слизистую кишечника в кровь, а также в сохранении исходного высокого титра фаголизата (не менее 2×108 БОЕ/суппозиторий каждого штамма), снижающегося на конец срока годности препарата до уровня не ниже 1×108 БОЕ/суппозиторий.
Сущность заявляемой группы изобретений заключается в следующем. Предлагается антибактериальная композиция в виде суппозитория, которая содержит жидкую субстанцию бактериофагов, включающую, по меньшей мере, три бактериофага с титром не менее 2×108 БОЕ/суппозиторий, суппозиторную основу, включающую витепсол или твердый жир типа А, а также твин (полисорбат)-80 при следующем соотношении компонентов на 1 суппозиторий, масс. %:
Предлагается также способ приготовления приведенной выше антибактериальной композиции, в котором сначала в расплавленный при температуре 43-50°С витепсол или твердый жир типа А вводят твин (полисорбат)-80. Затем полученную основу охлаждают до температуры 40-42°С и при перемешивании вводят в нее жидкую субстанцию бактериофагов. В связи с поставленной задачей был разработан алгоритм по созданию нового препарата на основе бактериофагов, включающий следующие этапы:

Согласно разработанного алгоритма, на первом этапе наших исследований были выделены и идентифицированы штаммы бактерий-мишеней. Для этого был использован комплекс инновационных лабораторных методов исследования, включающий классические микробиологические методы с посевом патологического материала на несколько видов питательных сред и использованием отечественных и импортных коммерческих биохимических тест-систем. Видовую идентификацию труднокультивируемых микроорганизмов проводили масс-спектрометрическим методом с использованием времяпролетного масс-спектрометра MALDI-TOF MS. Чувствительность микроорганизмов исходно определяли диско-диффузным методом. Микроорганизмы с МЛУ (множественная лекарственная устойчивость) тестировали иммуноферментным методом для идентификации фактора, обеспечивающего резистентность. Известные локусы антибиотикорезистентности регистрировали с помощью амплификации со специфическими праймерами в ПЦР-реакции. Далее проводили выделение из объектов окружающей среды и селекцию вирулентных штаммов бактериофагов по спектру их специфической литической активности против идентифицированных бактерий-мишеней. Выделение бактериофагов и изучение их биологических свойств проводили методами, предложенными М. Адамсом (1959) и Д.М. Гольдфарбом (1961). Для определения титра фаговых частиц и морфологии негативных колоний использовали метод Грациа (1936). Обязательным этапом при выборе индикаторной бактериальной культуры, на которой в дальнейшем будет культивироваться бактериофаг, являлась ее проверка на лизогенность в тесте по индукции профага в клетке с помощью митомицина С или УФО (ультрафиолетовое облучение). Морфологическую структуру бактериофагов исследовали с помощью электронной микроскопии нативных фаговых частиц. Уникальность и вирулентную природу бактериофагов подтверждали в процессе биоинформационного анализа, представляющего из себя следующую процедуру: на основе данных высокопроизводительного секвенирования второго поколения Ion Torrent Sequencing проводилась сборка генома бактериофага в режиме de-novo с использованием пакета программного обеспечения NEWBLER. Собранный геном имел точность прочтения каждого нуклеотида не ниже 99,9%. Далее проводился поиск открытых рамок считывания с целью аннотирования генома - определения возможных генов. Потенциальные продукты этих генов анализировались при помощи программного обеспечения PHACTS. Данное программное обеспечение позволяло предсказать тип жизненного цикла бактериофага (умеренный или вирулентный). Подтверждение вирулентности бактериофага проводилось также в ходе выявления генов, кодирующих известные интегразы, репрессоры транскрипции или их гомологи. Такой поиск проводился с использованием собранной нами из различных открытых ресурсов базы данных аминокислотных последовательностей умеренных бактериофагов и алгоритма blastp. Высокоактивные стерильные фаголизаты получали способом, защищенным патентом RU №2525141 «Способ получения бактериофага». Оценку безопасности производственно-перспективных штаммов фагов, включающую микробиологические, биохимические и молекулярно-генетические тесты, а также испытания на лабораторных животных проводили в соответствии с собственными разработанными процедурами (Киселева И.А. Специализированный продукт диетического профилактического питания на основе коктейля бактериофагов: конструирование, технология производства, оценка безопасности и эффективности применения: автореферат диссертации кандидата биологических наук: 03.01.06, 03.02.03 - Москва, 2015. - 26 с).
В качестве АФС для разработки суппозиториев использовали высокоактивные стерильные фаголизаты в жидкой форме. Свечную основу подбирали исходя из максимального сохранения специфической активности АФС (титра бактериофагов) в готовой лекарственной форме, которую проверяли по методу Грациа, используя разработанную, в рамках данных исследований, процедуру пробоподготовки. Для подтверждения универсальности подобранной суппозиторной основы в качестве комбинированной намеренно АФС использовали бактериофаги разных видов, отобранные не по принципу нозологической общности, а на основании существенных различий их биологических и генетических характеристик.
Пробоподготовка суппозиториев для определения подлиности и количественного содержания бактериофагов
Помещали три суппозитория в стерильный контейнер, добавляли необходимое количество изотонического раствора хлорида натрия, контейнер закрывали крышкой и помещали для растворения на водяную баню, предварительно нагретую до 45°С, на 10 минут, периодически встряхивая емкость с суппозиторием до полного растворения и перехода в эмульсионное состояние. Далее отобрали 0,5 мл в пробирку с мясопептонным бульоном (МПБ) для определения титра бактериофагов по методу Грациа. В ходе фармакокинетических исследований, для подтверждения наличия в клиническом материале фаговых частиц, кровь, мочу и кал кроликов до и после однократного назначения бактериофагов последовательно исследовали микробиологическими: спот-тестом, методом Грация, и молекулярно-генетическими: двойной вложенной ПЦР (полимеразной цепной реакция), методами. Морфологическую полноценность фаговых частиц в крови кроликов подтверждали путем определения специфических антител к одному из бактериофагов, входящих в суппозитории. Для этого в рамках данного исследования была специально сконструирована иммуноферментная тест-система.
I. Микробиологические методы выделения бактериофагов из клинического материала
Прямой метод выделения бактериофагов
Исследуемые жидкости (кровь, мочу) фильтровали через бактериальный фильтр (0,22 мкм, «Millipore»). Твердый исследуемый материал (оформленные испражнения - кал) предварительно измельчали, эмульгировали, фильтровали через бумажный фильтр, а затем через бактериальный. Наличие фага в полученном фильтрате определяли по методу спот-теста и Грациа.
Выделение бактериофагов методом обогащения с «подсевом»
Жидкий исследуемый материал (кровь) засевали в МПБ. Одновременно с исследуемым материалом в питательную среду вносили 0,2 мл суточной культуры бактерий, чувствительных к выделяемому бактериофагу. Инкубировали в термостате при 37°С 18-20 часов. После инкубации содержимое фильтровали через бактериальный фильтр. Полученный фильтрат исследовали на наличие бактериофага к бактериальным культурам, взятым для обогащения.
II. Обнаружение бактериофага в исследуемых образцах
- методом нанесения фага (spot-тест) на газон бактериальной культуры. В чашки Петри разливали 1,5% мясопептонный агар (ΜΠΑ). После застывания и подсушивания агара на чашки Петри наносили по 0,1 мл 16-18 часовой бульонной культуры микроорганизмов, чувствительных к бактериофагам, находящимся в исследуемом фильтрате, растирали шпателем по всей поверхности чашки, чтобы получить равномерный сплошной рост культуры. После того, как культура впиталась и чашки подсохли, на них каплями (spot-тест) наносили исследуемый фильтрат. После подсушивания, чашки перевертывали вверх дном и ставили в термостат при 37°С на 18-24 часа. На следующие сутки производили учет результатов - наличие или отсутствие «пятна лизиса».
- с учетом эффективности фаговой инфекции: по 10 мкл из последовательных десятикратных разведений исследуемого фильтрата наносили на газон бактериальной культуры, чувствительной к искомым бактериофагам, в полужидком (0,7%) агаре. Учет производили после инкубации чашек при 37°С в течение 18-20 часов - наличие или отсутствие «пятна лизиса» или подсчет количества негативных колоний в «пятне лизиса».
III. Метод определения литической активности (титра) бактериофагов
Метод Грациа (метод агаровых слоев)
Этот метод основан на внесении различных разведений титруемого бактериофага в соответствующую культуру бактерий и посеве на плотную питательную среду с целью получения негативных колоний бактериофага. Накануне опыта готовили стерильные питательные среды: 1,5% ΜΠΑ на чашках Петри по 25 мл; пробирки MПБ по 4,5 мл в каждой; 0,7% ΜΠΑ в пробирках по 2,5 мл. В день постановки опыта из пробы, содержащей титруемый бактериофаг, готовили в пробирках ряд десятикратных последовательных разведений. Затем в пробирку с 0,7% ΜΠΑ, расплавленным и охлажденным до 50-52°С, вносили 1 мл образца соответствующего разведения исследуемого бактериофага, перемешивали, добавляли 0,1-0,2 мл 109 микробных клеток в 1 мл по ОСО (отраслевому стандартном образцу мутности бактериальной взвеси) 42-28-85-2015 (10 ME), чувствительных к бактериофагу, опять слегка перемешивали и содержимое пробирки выливали в чашку с ΜΠΑ (вторым слоем). После остывания среды чашки инкубировали в термостате при 37°С в течение 18-20 ч. Титр фага определяли путем подсчета количества негативных колоний на параллельных чашках и умножением среднего арифметического на показатель разведения.
IV. Метод двойной вложенной ПЦР (double-nested PCR)
Выделение ДНК бактериофагов из крови проводили с помощью набора для выделения К-сорб (ООО «НПФ Синтол», Москва). В реакцию брали 1 мкл выделенной ДНК. Высокочувствительное выявление фрагментов ДНК фагов осуществляли с помощью двойной вложенной ПЦР (double-nested PCR). Реакционные смеси готовили с использованием реагентов, входящих в комплект рекомбинантной Taq ДНК-полимеразы (Fermentas, Литва). Для проведения реакций использовали олигонуклеотидные последовательности, приведенные в таблице 1. Детекцию результата амплификации проводили путем постановки горизонтального электрофореза в 1% агарозном геле.
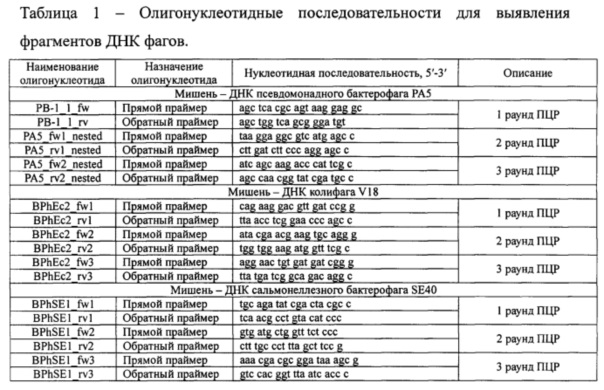
V. Методика определения антител к бактериофагу РА-5 с помощью иммуноферментного анализа
А. Получение кроличьей антисыворотки к бактериофагу РА-5
Для получения антисыворотки проводили внутримышечную иммунизацию кролика.
Схема иммунизации:
1. 0,5 мл полного адьюванта Фрейнда + 0,5 мл раствора фага (концентрация 1010БОЕ/мл).
2. через 10 дней 0,25 мл неполного адьюванта + 0,25 мл раствора фага.
3. через 20 дней 0,1 мл неполного адьюванта + 0,1 мл раствора фага.
4. через 30 дней 0,5 мл неполного адьюванта + 0,5 мл раствора фага.
Б. Конструирование иммуноферментной тест-системы
1. Сорбируем антиген на пластиковый планшет. В лунки планшета вносим по 100 мкл бактериофага РА-5 в концентрации 1010 БОЕ/мл, закрываем пленкой и оставляем на ночь в холодильнике. В последние лунки рядов антиген не вносим - данные лунки являются отрицательным контролем в отсутствии антигена.
2. Через 18-20 часов инкубации удаляем содержимое лунок (резко вытряхиваем). Промываем 5-6 раз в моющем растворе (BSM Diagnostics, США). После промывки тщательно удаляем промывочный раствор, постукивая планшетом по фильтровальной бумаге, сложенной в несколько раз, для полного удаления жидкости из лунок.
3. Разводим исследуемую сыворотку в физиологическом растворе.
4. Вносим исследуемые образцы по 100 мкл в лунки планшета.
5. В качестве положительного контроля вносим сыворотку иммунизированного одноименным бактериофагом кролика в дубле или триплете.
6. В качестве дополнительного отрицательного контроля вносим в дубле физ. раствор.
7. Инкубируем 60 мин при 37°С.
8. После инкубации промываем планшет, как описано выше.
9. Для выявления связавшегося с сорбированным антигеном иммуноглобулина G, используем конъюгат Protein A-Peroxidase, Staphylococcus aureus/horseradish (Lot 084K132, Sigma, США). Данный конъюгат был выбран на том основании, что содержащийся в нем реагент Protein А стафилококка имеет сродство к иммуноглобулинам G разных видов млекопитающих, в том числе человека и кролика.
10. Для разведения конъюгата используем PBS-T (забуференный фосфатами физиологический раствор, содержащий твин-20 в концентрации 0,1%).
11. Рабочее разведение конъюгата - 1:64000 (подобрано в результате предварительных экспериментов).
12. Во все лунки планшета вносим по 100 мкл конъюгата в рабочем разведении.
13. Инкубируем 60 мин при 37°С.
14. Промываем планшет как описано ранее.
15. Во все лунки планшета вносим по 100 мкл субстратного раствора, содержащего ТМБ (ВСМ Diagnostics).
16. Инкубируем 15 мин в темноте при комнатной температуре.
17. Для прекращения реакции в каждую лунку вносим по 100 мкл стоп-реагента (ВСМ Diagnostics).
18. Проводим измерение оптической плотности при 450 нм на планшетном фотометре Infinite (Tecan, Австрия).
VI. Метод определения антифагового иммунного ответа in vitro в реакции нейтрализации
Вирусная природа бактериофага подразумевает, при системном действии последнего, инициацию иммунного ответа млекопитающих. Оценить иммунный ответ in vitro можно в реакция нейтрализации, заключающейся в падении силы литической активности (титра) бактериофага при его добавлении в сыворотку крови животного. Ниже представлена отработанная методика:
Сыворотку крови кролика разводили в 1500 раз в стандартном фосфатном буфере (PBS), затем к 450 мкл разведенной сыворотки добавляли 50 мкл фаголизата исследуемого бактериофага в титре 106 БОЕ/мл. Полученную смесь инкубировали в термостате в течение 30 минут при температуре 37°С. После инкубации смесь разводили в 100 раз МПБ и титровали по методу Грациа (подраздел III). Падение титра бактериофага в сыворотке крови интактного кролика свидетельствовало о наличие неспецифического иммунного ответа, достоверное отличие в величине титра бактериофага у иммунизированного и интактного животного свидетельствовало о выработке специфических антифаговых антител.
Получение жидкой субстанции бактериофагов в титре, достаточном для определения терапевтической дозы в готовой лекарственной форме
С целью подготовки АФС для суппозиториев на основе коктейля бактериофагов были отобраны следующие штаммы P. aeruginosa РА5, Е. coli V18, S. Enteritidis SE40.
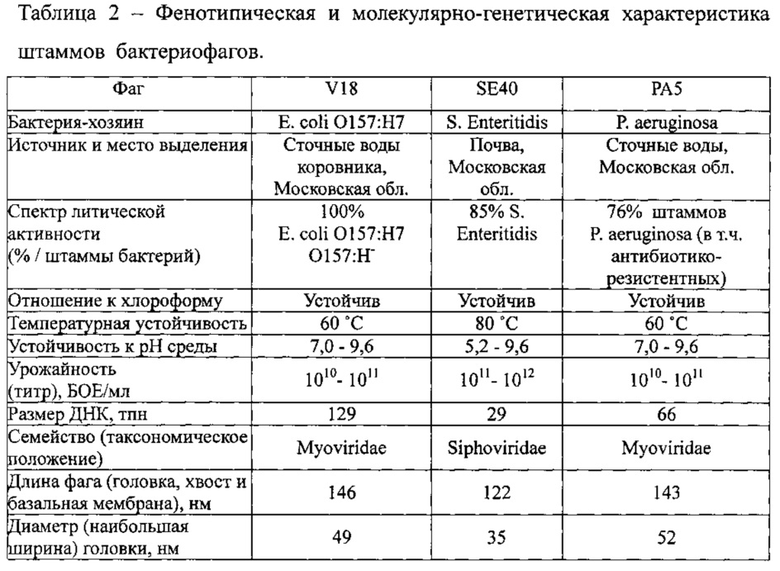
Сравнительная фенотипическая и молекулярно-генетическая характеристика отобранных для суппозиториев штаммов бактериофагов представлены в таблице 2.
Штаммы бактериофагов P. aeruginosa РА5, Е. coli V18, S. Enteritidis SE40 различаются как по длине ДНК, так и по размеру фаговых частиц, что в дальнейшем позволит сформировать полное представление о фармакокинетике бактериофагов разных видов, введенных с помощью суппозиториев per rectum лабораторным животным.
Получение жидкой субстанции бактериофагов
Культивирование бактериофагов на плотных питательных средах с высоким титром вирусных частиц и предельно низкими значениями эндотоксина согласно патенту RU на изобретение №2525141 включает следующие этапы:
1 этап - получение 18-ти часовой культуры штамма-хозяина на плотной питательной среде. Бактериальные культуры микробиологической петлей засевают в МПБ, разлитый по 4,5 мл из расчета одна пробирка на одну матрасную колбу. Посеянные таким образом индикаторные штаммы культивируют в термостате 18 часов при 37°С, через 18 часов экспозиции достигая 108-109 КОЕ/мл.
2 этап - нанесение штамма-хозяина на поверхность плотной питательной среды.
Раскатывают культуру по всей поверхности питательной среды, создавая монослой. Культивируют в течение 3,5 часов при оптимальной температуре для роста культуры штамма-хозяина.
3 этап - нанесение маточного штамма бактериофага.
В образовавшийся таким образом газон культуры вносят шприцем или стерильной микробиологической пипеткой 2 мл одноименного (маточного) бактериофага в титре 105-106 БОЕ/мл. Покачивающим движением распределяют бактериофаг так, чтобы он тонким слоем покрыл всю поверхность газона бактериальной культуры. Инкубируют в термостате 13-15 часов при оптимальной температуре для роста культуры штамма-хозяина и одноименного бактериофага.
4 этап - сбор бактериофага.
В матрас в асептических условиях вносят физиологический раствор с рН 7,0-7,2 в количестве 0,04-0,045 мл на 1 см2 (9 мл на один матрас). Плавным покачивающим движением производят смыв фага с поверхности питательного агара. Стерильной микробиологической пипеткой собирают жидкую фракцию и переносят в стерильные центрифужные пробирки. Для освобождения фаголизата от нелизированных бактерий в пробирки добавляют хлороформ из расчета 1/10. Экспонируют полученную суспензию 30 минут при непрерывном шуттелировании, центрифугируют 30 мин при 5000-6000 об/мин. Собирают полученный супернатант в стерильную емкость.
5 этап - очистка и контроль фаголизата.
Полученные раздельно фаголизаты сводят в коктейль бактериофагов, включая в него виды фагов, отобранные для изготовления суппозиториев, стерилизуют фильтрацией через фильтр с диаметром пор 0,22 мкм и затем очищают от эндотоксинов на хроматографической колонке типа Endo Trap Blue или Endo Trap HD (Hyglos GmbH, Германия) согласно инструкции производителя с использованием буфера поставляемого в комплекте с колонкой.

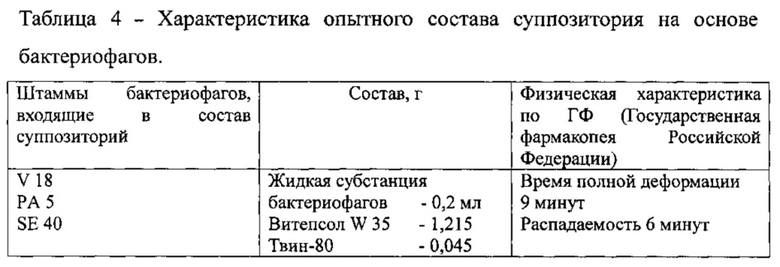
Технология изготовления суппозиториев заключается в следующем: в расплавленный при температуре 43-47 градусов витепсол, вводят твин (полисорбат)-80, перемешивают, основу охлаждают до температуры 40 градусов и постепенно при перемешивании вводят жидкую субстанцию бактериофагов, затем суппозиторную массу выливают в ячейки для суппозиториев, охлаждают, запаивают, нарезают и готовые суппозитории упаковывают. Возможно применение заявленной технологии с использованием специализированных технологических линий.
Технология изготовления суппозиториев при использовании твердого жира типа А заключается в следующем: в расплавленный при температуре 45-50 градусов твердый жир типа А, вводят твин (полисорбат)-80, перемешивают, основу охлаждают до температуры 40-42 градусов и постепенно при перемешивании вводят жидкую субстанцию бактериофагов, затем суппозиторную массу выливают в ячейки для суппозиториев, охлаждают, запаивают, нарезают и готовые суппозитории упаковывают. Возможно применение заявленной технологии с использованием специализированных технологических линий.
Определение титра бактериофагов в готовой лекарственной форме
Пробы образцов суппозиториев опытных серий на основе жидкой субстанции бактериофагов по схеме пробоподготовки, приведенной в разделе «Пробоподготовка суппозиториев для определения подлинности и количественного содержания бактериофагов», были исследованы по методу Грациа с целью определения титра фаговых частиц в готовой лекарственной форме, а также сравнение данного показателя с исходными значениями определенными для субстанций. В таблице 5 приведены средние значения титров бактериофагов, определенные в суппозиториях заявленного.

Фармакокинетические испытания суппозиторной лекарственной формы на основе коктейля бактериофагов на лабораторных животных (кроликах), подтверждающие достижение терапевтического уровня бактериофагов в крови, моче и фекалиях животных
В эксперимент были включены 6 кроликов обоего пола с весом от 2,5 до 3 кг. Кроликам вводили ректально суппозитории на основе заявляемой жидкой субстанции бактериофагов. У кроликов исследовали образцы крови (с ЭДТА), мочи, кала с помощью качественного - спот-теста и количественного метода Грациа до и после введения суппозиториев.
На фигуре 1 представлена динамика средних значений титров бактериофагов в моче (а) и кале (б) кроликов, получавших суппозитории заявляемого состава. Максимальные значения титров бактериофагов в исследованных образцах достигаются через 4,5-6 часов после однократного введения суппозиториев и через 24 часа их концентрации снижаются до минимума. В процессе исследования выявлены определенные закономерности в изменении уровня бактериофагов в моче, крови и кале, которые могут быть связаны с размером вирусных частиц, влияющим на их способность преодолевать слизистую оболочку кишечника и проникать в кровь. В таблице 2 приведены приблизительные размеры фагов и их ДНК, позволяющие выстроить их в порядке убывания этих размеров следующим образом: V18>PA5>SE40. Логично, что фаги, обладающие меньшим размером, (SE40 и РА5) должны быстрее, чем бактериофаги большего размера (V18), проникать из просвета прямой кишки кроликов в кровь и далее в мочу. На фигуре 1а первый пик концентраций фагов меньшего размера приходится на 3 часа после введения суппозиториев в прямую кишку. Более высокие, относительно первых, вторые (6-тичасовые) пики концентраций бактериофагов SE40 и РА5 при определении их в кале (фиг. 1б) свидетельствуют о выведении фаговых частиц, поступивших в кровь, с желчью обратно в кишечник животных. Фаги, обладающие большим размером (V18), медленнее (или с большим трудом) преодолевают слизистый барьер кишечника - пиковые значения их титров, фиксируемые в моче, соответствуют 4,5 часам после введения суппозиториев в прямую кишку кроликов (фиг. 1а). Отсутствие второго пика у фага V18 на фигуре 16 свидетельствуют о нейтрализации фаговых частиц, вторично всосавшихся в кровь, иммунной системой кролика (иллюстрация данного процесса представлена в таблице 6). Вторично выводящиеся через кишечник фаговые частицы (V18) не обладают исходной литической активностью в отношении бактерий-хозяев, что и не позволяет определить их исходно высокие титры в кале спустя 4,5 часа после введения суппозиториев в прямую кишку животных.
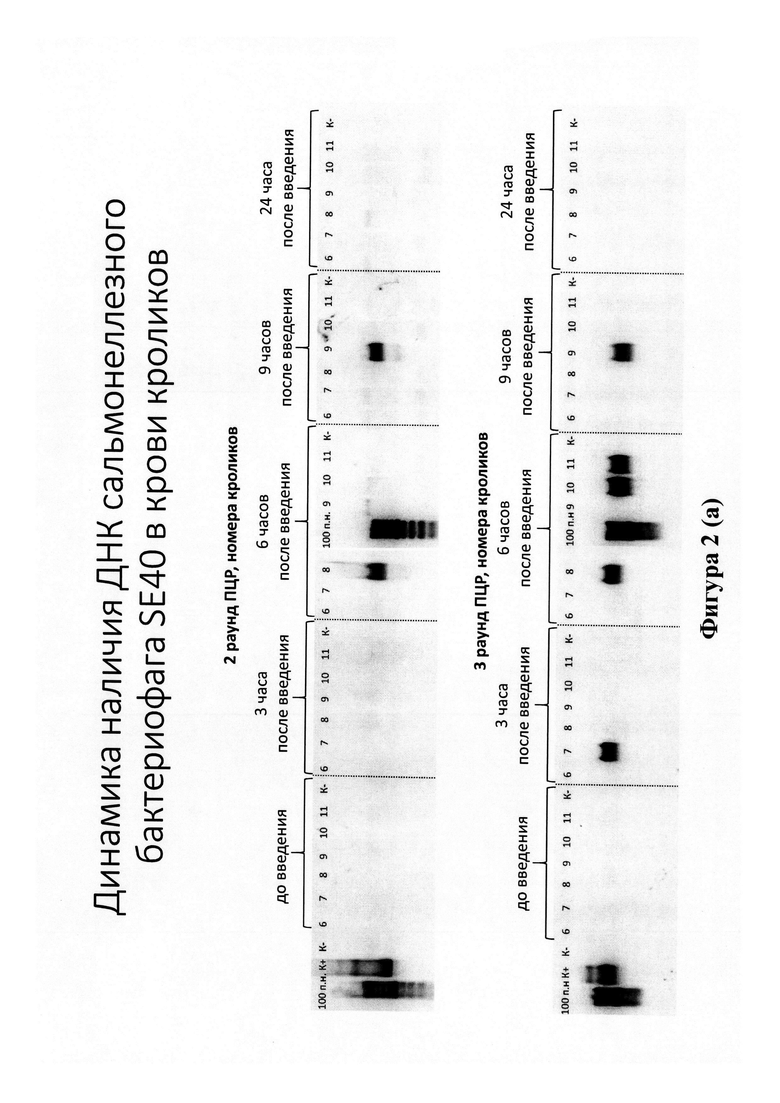
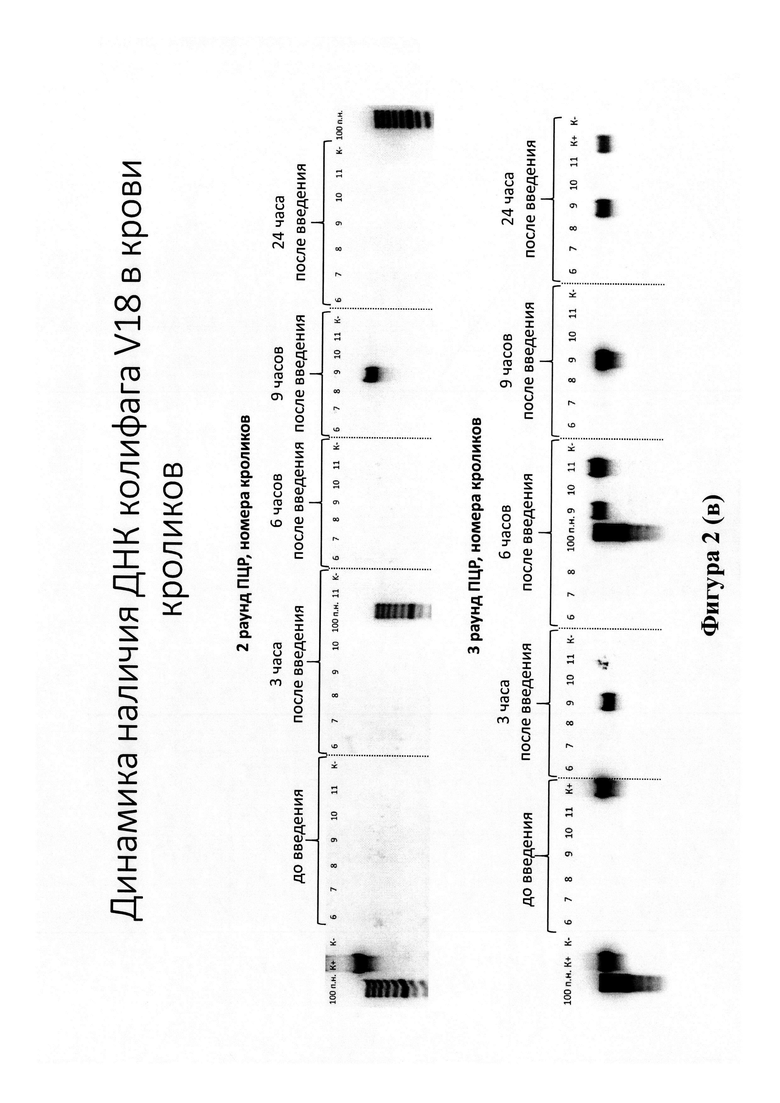
Высокочувствительное выявление фрагментов ДНК фагов в крови животных осуществляли с помощью метода двойной вложенной ПЦР. На фигуре 2 представлен горизонтальный электрофорез продуктов (ампликонов) 2 и 3 раундов ПЦР, подтверждающий наличие в крови кроликов ДНК бактериофагов от 100-200 копий (3 раунд ПЦР) до 1000-10000 копий (2 раунд ПЦР). Вероятность выявления фаговых ДНК (максимальные количества копий различных штаммов фагов) увеличивается к 6 часам после введения суппозиториев кроликам.
На фигуре 2 представлена динамика наличия ДНК сальмонеллезного (а), синегнойного (б) и эширихиозного (в) бактериофагов в крови кроликов. Номерами 6-11 обозначены кролики, 100 п. н. - маркер длин ДНК, К- - отрицательный контроль (реакционная смесь), К+ - положительный контроль (ДНК определяемых бактериофагов)
Косвенным подтверждением наличия небольшого количества полноценных фаговых частиц (а не только ДНК бактериофагов), всосавшихся в кровь подопытных кроликов, может служить наличие IgG-антител к бактериофагу РА-5, определенных методом иммуноферментного анализа (ИФА); причем схема иммунизация животного соответствовала методу, используемому для белковой структуры антигена (в нашем случае - белковый капсид фаговой частицы).
Определение IgG-антител к бактериофагу РА-5 методом иммуноферментного анализа (ИФА).
1. В сыворотке крови иммунизированного кролика методом ИФА обнаружены IgG-антитела к бактериофагу РА-5, причем в высоком титре, что показано при двукратном титровании сыворотки от неразведенной до разведения 1/524280. Даже в лунке с сывороткой в разведении 1/32768 регистрировалась достаточно высокая оптическая плотность (1,013). Оптическая плотность в контрольных лунках (без антигена) не превышала 0,100.
2. В качестве дополнительной контрольной точки исследована сыворотка неиммунизированного кролика. Антитела к бактериофагу РА-5 у данного кролика не обнаружены (оптическая плотность в лунках с неразведенной сывороткой - около 0,200).
3. Была проанализирована сыворотка кролика до и после приема ректальной свечи с бактериофагом РА-5. До однократного введения суппозитория антител к бактериофагу в сыворотке животного обнаружено не было. Спустя 23 дня после однократного введения суппозитория с бактериофагом обнаружены антитела к бактериофагу РА-5 в невысоком титре (оптическая плотность - около 0,600).
Дополнительно было проведено определение антител к бактериофагу РА-5 в реакции преципитации:
Спустя 10 дней после иммунизации кролика (четыре цикла внутримышечных инъекций с интервалом в 10 дней, в качестве антигена использовали бактериофаг РА-5 в концентрации 1010 БОЕ/мл) была поставлена реакция преципитации в геле по Оухтерлони. Используемые реагенты: в качестве антигена - бактериофаг РА-5 в максимальном титре 1010 БОЕ/мл, в качестве антитела - сыворотка иммунизированного кролика, раститрованная от неразведенной до разведения 1/32. Были обнаружены линии преципитации между лунками с антигеном и неразведенной сывороткой кролика свидетельствующие о наличии в сыворотке антител к бактериофагу РА-5.
Даже однократное введение суппозиториев, из-за всасывания фаговых частиц в кровь животного, запускает у млекопитающих иммунный ответ. Наличие механизмов неспецифического антифагового иммунитета было продемонстрировано в опытах in vitro на примере т.н. реакции нейтрализации. Неспецифические факторы защиты снижают исходный титр фаголизата на 102-104 БОЕ/мл, в то время как сыворотка иммунизированного животного, содержащая IgG-антитела к бактериофагу РА-5, в неразведенном образце полностью блокирует литическую активность фаговых частиц (табл.6).

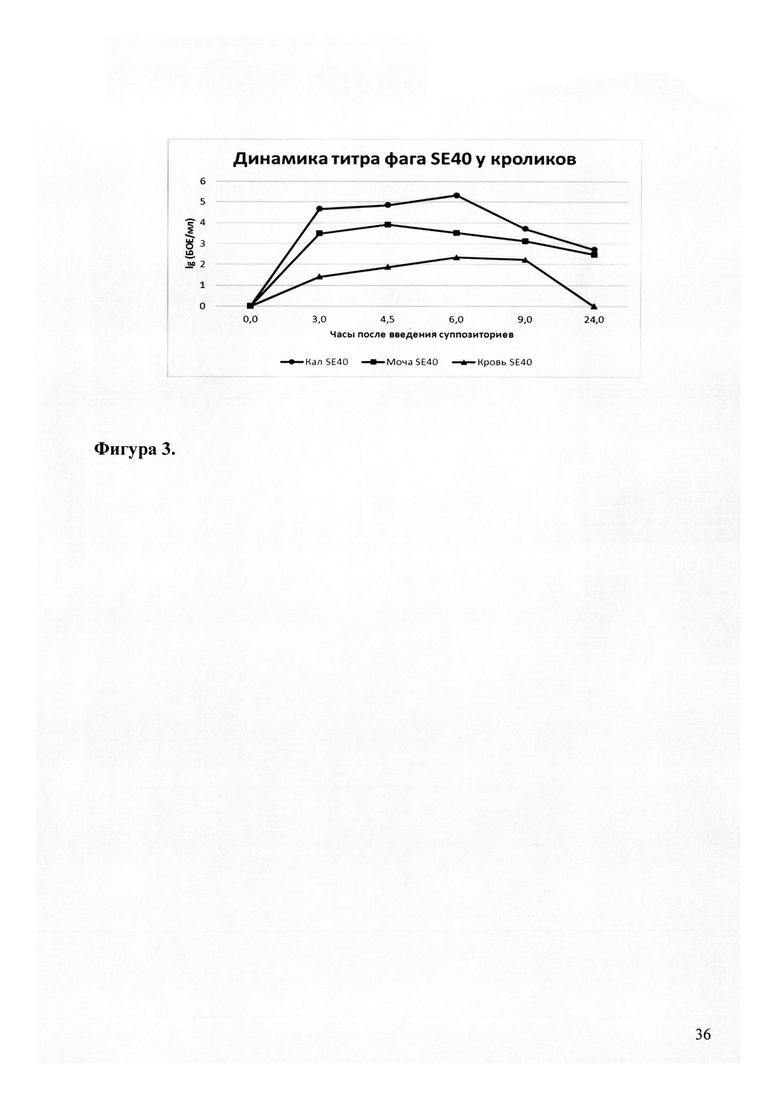
На итоговом графике (фиг. 3) приведена динамика титра бактериофага SE40 в крови, моче и кале кроликов. Траектории уровней фаговых частиц в исследованных локусах по своей форме (синхронизация минимумов и максимумов значений) практически полностью повторяют друг друга, что свидетельствует, также, как и выработка специфических антител, о системном действии бактериофагов, проникающих после введения per rectum, в органы кровообращения, легкие, печень, желчный пузырь, почки, мочевой пузырь, тонкий и толстый кишечник.
Примеры осуществления изобретения
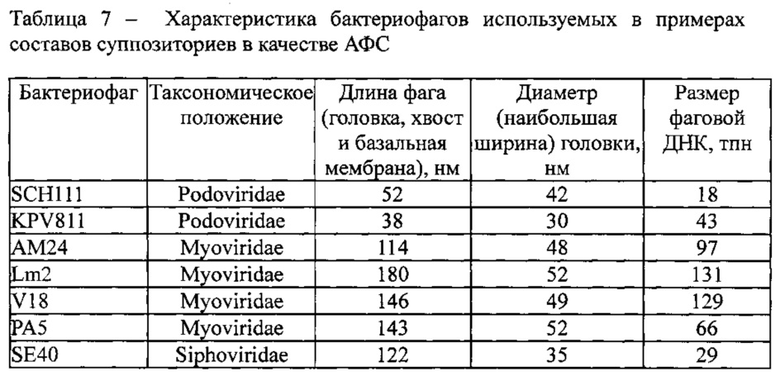
Пример 1. Суппозитории для профилактики и лечения нозокомиальных инфекций.
Состав на один суппозиторий массой 1,5 г: жидкая субстанция бактериофагов в количестве 0,2 г, состоящая из трех штаммов фагов, синегнойного РА5 - 2×108 БОЕ/супп, эшерихиозного V18 - 6,0×108 БОЕ/супп и сальмонеллезного SE40 - 1×109 БОЕ/супп, Витепсол W 35 - 1,23, Твин (полисорбат)-80 - 0,07 г.
Технология изготовления суппозиториев заключается в следующем: в расплавленный при температуре 43-47 градусов витепсол W 35, вводят твин (полисорбат)-80, перемешивают, основу охлаждают до температуры 40 градусов и постепенно при перемешивании вводят жидкую субстанцию бактериофагов, затем суппозиторную массу выливают в ячейки для суппозиториев, охлаждают, запаивают, нарезают и готовые суппозитории упаковывают.
Пример 2. Суппозитории для профилактики и лечения инфекций, передающихся пищевым путем (Food-borne infections).
Состав на один суппозиторий массой 1,5 г: жидкая субстанция бактериофагов в количестве 0,2 г, состоящая из трех штаммов фагов, листериозного Lm2 - 2×108 БОЕ/супп, эшерихиозного V18 - 6,0×108 БОЕ/супп и сальмонеллезного SE40 - 1×109 БОЕ/супп, Витепсол W 35 - 1,23, Твин (полисорбат)-80 - 0,07 г.
Технология изготовления суппозиториев заключается в следующем: в расплавленный при температуре 43-47 градусов витепсол, вводят твин (полисорбат)-80, перемешивают, основу охлаждают до температуры 40 градусов и постепенно при перемешивании вводят жидкую субстанцию бактериофагов, затем суппозиторную массу выливают в ячейки для суппозиториев, охлаждают, запаивают, нарезают и готовые суппозитории упаковывают.
Пример 3. Суппозитории для профилактики и лечения инфекций, связанных с оказанием медицинской помощи (ИСМП).
Состав на один суппозиторий массой 1,5 г: жидкая субстанция бактериофагов в количестве 0,2 г, состоящая из четырех штаммов фагов, стафилококкового SCH111 - 3×108 БОЕ/супп, клебсиеллезного KPV811 - 2×108 БОЕ/супп, ацинетобактерного АМ24 - 1×109 БОЕ/супп и синегнойного РА5 - 2×108 БОЕ/супп, Витепсол W 35 - 1,26, Твин (полисорбат)-80 - 0,04 г.
Технология изготовления суппозиториев заключается в следующем: в расплавленный при температуре 43-47 градусов витепсол W 35, вводят твин (полисорбат)-80, перемешивают, основу охлаждают до температуры 40 градусов и постепенно при перемешивании вводят жидкую субстанцию бактериофагов, затем суппозиторную массу выливают в ячейки для суппозиториев, охлаждают, запаивают, нарезают и готовые суппозитории упаковывают.
Пример 4. Суппозитории для профилактики и лечения острых кишечных и пищевых токсикоинфекций.
Состав на один суппозиторий массой 1,5 г: жидкая субстанция бактериофагов в количестве 0,2 г, состоящая из пяти штаммов фагов, стафилококкового SCH111 - 3×108 БОЕ/супп, клебсиеллезного KPV811 - 2×108 БОЕ/супп, листериозного Lm2 - 2×108 БОЕ/супп, эшерихиозного V18 - 6,0×108 БОЕ/супп и сальмонеллезного SE40 - 1×109 БОЕ/супп, твердый жир типа А - 1,23, Твин (полисорбат)-80 - 0,07 г.
Технология изготовления суппозиториев заключается в следующем: в расплавленный при температуре 45-50 градусов твердый жир типа А, вводят твин (полисорбат)-80, перемешивают, основу охлаждают до температуры 40-42 градусов и постепенно при перемешивании вводят жидкую субстанцию бактериофагов, затем суппозиторную массу выливают в ячейки для суппозиториев, охлаждают, запаивают, нарезают и готовые суппозитории упаковывают.
Пример 5. Определение специфической антибактериальной активности (титра бактериофагов) опытной серии суппозиториев на основе бактериофагов на конец срока годности препарата 1 год при температуре хранения 4±2°С.

В результате проведенного исследования нами заявлено получение жидкой субстанции бактериофагов в качестве АФС для суппозиторной лекарственной формы в титре 1010 БОЕ/мл, что является исходно достаточным количеством фаговых частиц с точки зрения последующего определения специфической антибактериальной активности бактериофагов в готовой лекарственной форме. Так, в оптимальном по технологии и физическим показателям (определенным в ГФ) заявляемом составе минимальная концентрация бактериофага составляет 2×108 БОЕ/супп, что при сравнении с зарегистрированными пероральными средствами на основе бактериофагов, позволяет сделать вывод о соответствии концентрации АФС в суппозитории терапевтической дозе, не менее 106 БОЕ/мл. Доклинические испытания заявляемой суппозиторной лекарственной формы, проведенные на лабораторных животных (кроликах), также подтверждают безопасность и оптимальность разработанного состава суппозиториев с точки зрения обеспечиваемого уровня биодоступности АФС. Уровень бактериофагов в образцах клинического материала, полученного от кроликов после однократного введения суппозиториев, достигал максимума через 4,5-6 часов после введения суппозиториев. Бактериофаги сохранялись в крови, моче и кале неинфицированных бактерией-хозяином животных до 24 часов и более. Подтвержденный фармакокинетическими и иммунологическими методами исследований системный механизм действия ректально введенного препарата на основе субстанции бактериофагов предполагает создание нового подхода к индивидуализированной антибактериальной терапии для лечения инфекций, вызванных лекарственно-устойчивыми штаммами возбудителей.
Список литературы
1. «Bacteriophages and Probiotics - Alternatives to Antibiotics» dedicated to the 120th birth anniversary of Professor George Eliava, July 1-4, 2012, Tbilisi, Georgia.
2. Abuladze Τ, Li M, Menetrez MY, Dean T, Senecal A, Sulakvelidze A. Bacteriophages reduce experimental contamination of hard surfaces, tomato, spinach, broccoli, and ground beef by Escherichia coli O157:H7. Appl Environ Microbiol. 2008; 74(20):6230-8.
3. Alisky J, Iczkowski K, Rapoport A, Troitsky N. Bacteriophages show promise as antimicrobial agents. J Infect. 1998;36:5-15.
4. Bacteriophages. Ed. Ipek Kurtboke, InTech, 2012; 268. Abedon TS, Kuhl JS, Blasdel GB, Kutter ME. Phage treatment of human infections. Bacteriophage, 2011; 1(2):66-85.
5. Boratyński J, Syper D, Weber-Dabrowska B, Łusiak-Szelachowska M, Poźniak G, Górski A. Preparation of endotoxin-free bacteriophages. Cell mol boil lett. 2004; 9:253-9.
6. Borysowski J, Dabrowska K, Ohams M, et al. The response of the immune system to phage: potential associations with phage therapy. Abstract book, conference.
7. Breitbart M, Haynes M, Kelley S, Angly F, Edwards RA, Felts B, et al. Viral diversity and dynamics in an infant gut. Research in Microbiology. 2008; 159:367-73.
8. Bruce S. Seal, Nikolay V. Volozhantsev, Brian B. Oakley, Cesar A. Morales, Johnna K. Garrish, Mustafa Simmons, Edward A. Svetoch and Gregory R. Siragusa. Bacteriophages of Clostridium perfringens. In book: Bacteriophages, Edited by Ipek Kurtboke, ISBN 978-953-51-0272-4, 268 pages, Publisher: InTech, Chapters published March 14, 2012 under CC BY 3.0 license. DOI: 10.5772/1065.
9. Brussow H. Phage therapy: the Escherichia coli experience. Microbiology. 2005; 151:2133-40.
10. Carlton RM, Noordman WH, Biswas B, de Meester ED, Loessner MJ. Bacteriophage Ρ100 for control of Listeria monocytogenes in foods: Genome sequence, bioinformatic analyses, oral toxicity study, and application. Regulatory Toxicology and Pharmacology. 2005; 43:301-12.
11. Fortuna W, Miedzybrodzki R, Weber-Dabrowska B, Górski A. Bacteriophage therapy in children: Facts and prospects. Med Sci Monit. 2008; 14(8): 126-32.
12. Greer GG. Bacteriophage control of foodborne bacteria. J of Food Protection. 2005; 68(5):1102-11.
13. Guenther S, Huwyler D, Richard S, Loessner MJ. Virulent bacteriophage for efficient biocontrol of Listeria monocytogenes in ready-to-eat foods. Appl Environ Microbiol. 2009; 75(1):93-100.
14. Hooton SP, Atterbury RJ, Connerton IF. Application of a bacteriophage cocktail to reduce Salmonella Typhimurium U288 contamination on pig skin. Int J Food Microbiol. 2011 Dec; 151(2):157-63.
15. Lawrence DG, Abedon TS. Bacteriophage biocontrol and bioproccessing: application of phage therapy to industry. SIM News. 2003; 53(6):254-62.
16. Lawrence DG, Bledar B. Phage-based biocontrol strategies to reduce foodborne pathogens in foods. Bacteriophage. 2011; 1(3): 130-7.
17. Letarov A.V. Bacteriophages as a part of the human microbiome. In book: Bacteriophages in Health and Disease 2012. C. 6-20.
18. Leverentz B, Conway WS, Janisiewicz W, Camp MJ. Optimizing Concentration and Timing of a Phage Spray Application To Reduce Listeria monocytogenes on Honeydew Melon Tissue. Journal of Food Protection. 2004; 67(8): 1682-6.
19. Loe-Carrillo C, Abedon TS. Pros and cons of phage therapy. Bacteriophage. 2011;1(2):111-14.
20. Lusiak-Szelachowska M, Annabhani Abdulhabib, Weber-Dabrowska B, et al. Escherichia coli bacteriophages in human stool of patients with gastrointestinal tract diseases. Gastroenterologia Polska. 2008; 15(2):87-90.
21. Mai V, Ukhanova M, Visone L, et al. Bacteriophage administration reduces the Concentration of Listeria monocytogenes in the gastrointestinal tract and its translocation to spleen and liver in experimentally infected mice. International J of Microbiology. 2010; 1-6.
22. Merabishvili M, Pimay JP, Verbeken G, Chanishvili N, Tediashvili M, Lashkhi N, et al. Quality-controlled small-scale production of a well-defined bacteriophage cocktail for use in human clinical trials. PLoS One. 2009; 4:e4944.
23. Sulakvelidze A. A new journal for the most ubiquitous organisms on Earth. Bacteriophage. 2011; 1:1-2.
24. Walker K. Use of bacteriophages as novel food additives. Food Regulation in the United States, Michigan State University, 2006; 9. FS06 ANR 490/811.
25. Акимкин В.Г. Перспективы научных исследований в области неспецифической профилактики инфекций, связанных с оказанием медицинской помощи. Дезинфекционное дело. 2014. Т. 89. №3. С. 5-10.
26. Асланов Б.И., Зуева Л.П., Кафтырева Л.А., Бойцов А.Г., Акимкин В.Г., Долгий А.А., Брусина Е.Б., Дроздова О.М. Рациональное применение бактериофагов в лечебной и противоэпидемической практике. Федеральные клинические (методические) рекомендации. Москва, 2014.
27. Дарбеева О.С., Майская Л.М., Перепанова Т.С. Опыт использования адаптированных препаратов бактериофагов // БИОпрепараты. 2002. №1. С. 13-17.
28. Дроздова О.М., Брусина Е.Б. Применение бактериофагов в эпидемиологической практике: взгляд через столетие. Эпидемиология и инфекционные болезни. 2010. №5. С. 20-24.
29. Миришников К.А. Геномика и протеомика литических бактериофагов Pseudomonas aeruginosa. // Диссертация на соискание ученой степени доктора химических наук. - Москва. - 2013. - 234 с.
30. Феоктистова Н.А., Васильев Д.А., Золотухин C.H., Алешкин А.В. Бактериофаги рода Bacillus и перспективы их применения. Инфекция и иммунитет. 2014. №S. С. 116-117.


Изобретение относится к фармацевтической промышленности и медицине и представляет собой антибактериальную композицию в виде суппозитория и способ ее получения, где композиция содержит жидкую субстанцию бактериофагов, включающую, по меньшей мере, три бактериофага с титром не менее 2×108 БОЕ на суппозиторий каждого штамма, суппозиторную основу, включающую витепсол или твердый жир типа А, а также твин-80, причем компоненты в композиции находятся, в определенном соотношении, в % на 1 суппозиторий. Изобретение обеспечивает системное антибактериальное действие и сохранение исходного высокого титра фаголизата. 2 н.п. ф-лы, 2 ил., 7 табл., 5 пр., 3 ил.
1. Антибактериальная композиция в виде суппозитория, характеризующаяся тем, что содержит жидкую субстанцию бактериофагов, включающую по меньшей мере три бактериофага с титром не менее 2×108 БОЕ/суппозиторий каждый, суппозиторную основу, включающую витепсол или твердый жир типа А, а также твин-80, при следующем соотношении компонентов на 1 суппозиторий, масс. %:
2. Способ приготовления антибактериальной композиции в виде суппозитория по п. 1, отличающийся тем, что сначала в расплавленный при температуре 43-50°C витепсол или твердый жир типа А вводят твин-80, затем полученную основу охлаждают до температуры 40-42°C и при перемешивании вводят в нее жидкую субстанцию бактериофагов.
| СУППОЗИТОРИИ | 2000 |
|
RU2185817C2 |
| СПОСОБ ИЗГОТОВЛЕНИЯ СВЕЧЕЙ С БАКТЕРИОФАГОМ | 2001 |
|
RU2188629C1 |
| ИММУНОБИОЛОГИЧЕСКИЙ БАКТЕРИЦИДНЫЙ ПРЕПАРАТ (ВАРИАНТЫ) | 2007 |
|
RU2366708C2 |
| WO 2016003307 A1, 07.01.2016 | |||
| WO 2014133322 A1, 04.09.2014. | |||
Авторы
Даты
2017-06-19—Публикация
2016-03-21—Подача