Способ определения индивидуальной химиочувствительной опухолей у больных in vitro.
Изобретение относится к медицине, разделу биологии.
Тестовые системы по исследованию индивидуальной химиочувствительности опухолей у больных основаны на культурах опухолевой ткани, получаемых из биопсийного материала, оперативно удаленной опухоли, или из осадка клеток, находящихся в асцитической или плевральной жидкости, взятой у больного. Чаще всего используются суспендированные культуры, монослойные культуры и колониеобразование в чашках Петри с агаром.
1. Первичные краткосрочные (3-4-часовые) суспендированные культуры на питательной среде Игла. Оценку химиочувствительности производили радиометрическим способом с определением процента торможения синтеза ДНК с помощью жидкостного сцинцилляционного счетчика (Грантс Э.А. Зитаре И.Я. Мурниеце Э. В. Берзиньш Ю.А. Прогнозирование химиотерапевтического эффекта как способа повышения эффективности лечения больных раком легкого, в кн. Возможности повышения эффективности химиотерапии злокачественных опухолей, Рига, 1981, с. 23-25; Вышинская Г.В. Добрынин Я.В. Исследование чувствительности злокачественных опухолей человека к действию противоопухолевых препаратов в культуре ткани, в кн. Актуальные вопросы онкологии и рентгенологии, Ташкент, 1981, с. 88-92; M. Kaufmann, Biochemical short-term predictive assay: results of correlative trials in comparison to other assays, in Recent Results in cancer Research, Berlin-Heidelberg, 1984, v 94, p 151-160.
Менее распространен спектрофотометрический способ оценки химиочувствительности в краткосрочных суспедированных культурах путем определения суммарного прироста количества нуклеиновых кислот (Шелапутина З.Ф. Вышинская Г.В. Нахалова Т.А. Мороз Л.В. Сравнительное изучение чувствительности клеток злокачественных опухолей молочных желез к химиопрепаратам in vivo и in vitro, в кн. Актуальные проблемы химиотерапии опухолей, Черноголовка, 1982, с. 249-250), а также сочетание радиометрического и спектрофотометрического способов оценки (Яворская Н. П. Использование первичных суспендированных культур опухолевых клеток для первичной оценки противоопухолевого действия новых препаратов, в кн. Проблемы химиотерапии злокачественных опухолей, Москва-Киев, 1974, с. 180-182).
Недостатком первичной суспендированной краткосрочной культуры следует считать: 1) необходимость приготовления суспензии опухолевых клеток, поэтому чаще используют асцитные формы опухолей; 2) недостаточность времени культивирования клеток; 3) нарушение эпителиально-стромальных взаимоотношений в опухоли из-за отсутствия прикрепления опухолевых клеток.
Чаще используются первичные 3-5-дневные монослойные культуры опухолевых клеток, при этом опухолевые клетки прикреплены либо к стеклу пробирки, либо к дну флакона. Оценка химиочувствительности производилась по индексу высеваемости в асцитных опухолях (Щорс Т.А. Попытка контроля методом монослойных культур эффективности химиотерапии рака яичников, в сборнике: Культура тканей в онкологии, М, 1968, с. 321), по угнетению степени пролиферации клеток (M. Albrecht, W.E. Simon and F. Hölzel Individual chemosensitivity of in vitro proliferating mamary and ovarian carcinoma cells in comparison clinical Results of chemotherapy, J. Cancer Research clinical oncology, 1985, v 109, N 3, p. 210-216) или авторадиографически по степени подавления ДНК-синтезирующих клеток (P. P Dendy, M.P.A. Dawson, D.J. Honess, Studies on the drug sensitivity of Human Tumor cells in short Term culture in: Actuelle Probleme der Therapie malignant Tumoren, Stuttgart, 1973, p. 34-45).
В последнее время при оценке индивидуальной химиочувствительности широко применяют биохимический тест, определяющий степень подавления дегидрогеназной активности клеток в краткосрочных монослойных культурах. Метод состоит в том, что после экспозиции монослойной культуры с химиопрепаратом к ней добавляют тетразолиевый краситель С1(4,5)-диметилтиазолил-2ил-2,5 дифенилтетразолийбромид (МТТ), который под действием эстераз и дегидрогеназ живых клеток (в отличие от мертвых) восстанавливается до пурпурного формазана,последний определяется колориметрически. Чувствительными считаются опухоли, в клетках которых наблюдается снижение интенсивности окраски более, чем на 50% (S.Frühauf and W. J. Zeller, In vitro evaluation of platinum, titanium and ruthenium metal complexes in cisplatinum-sensitive and resistant ratovarian tumors, Cancer Chemotherapy and Pharmacology, 1991, v. 27 p. 301-307).
При этом можно тестировать одновременно большое количество химиопрепаратов (от 12 до 26 и более) (Teruaki Hongo, Yaji Fnjii, Yoshio Igarashi, In vitro chemosensitivity Test for the screening of anti-cancer drugs in childhood Leukemia, Cancer, 1990, v. 65, p. 1263-1272) в двух-трех концентрациях. Для этого были выпущены фирменные наборы микроячеек, где идет культивирование, экспозиция с лекарствами и инкубация с тетразолиевым красителем. Затем микроячейки "прочитываются" спектрофотометром. Результаты метода зависят от "чистоты" опухолевых культур. Загрязнение их стромальными клетками, клетками-мигрантами влияет на степень сукцинат-дегидрогеназной активности и следовательно на результаты оценки химиочувствительности. Поэтому некоторые авторы при использовании МТТ-теста предварительно проводят процедуру "очищения" опухолевых культур, что является достаточно сложным (H. Yamaue, H. Tanimura etal. Chemosensitivity Testing with Highly Purified Fresh Human Tumor cells with the MTT-Colorimetris assay, Europ. J. Cancer, 1991, v. 27, N 10, p. 1258-1263).
На восстановление формазана влияет концентрация красителя в среде для инкубации, причем оптимальная концентрация широко варьируется для разных линий клеток, кроме того, спектр поглощения формазана зависит от рН и плотности суспензии клеток, при суспензии большей плотности возникают ошибки, приводящие к переоценке результатов химиочувствительности. Самое главное преимущество МТТ-метода его скорость. Результаты могут быть получены в течение трех дней, поэтому МТТ-метод признан перспективным для исследования индивидуальной химиочувствительности, хотя он нуждается в техническом усовершенствовании.
Не менее, чем МТТ-тест, распространен клоногенный метод, оценивающий чувствительность опухоли по степени подавления колониеобразования. Он считается высоко информативным, так как оценивает репродуктивную способность стволовых клеток, ответственных за метастазирование и рецидивы. Метод клонирования опухолей на чашках Петри в полужидком агаре с подложкой был разработан в 1977 г. (A. Hamburger and S.E. Salmon, Primary Bioassay of Human Myeloma stem cells, J. of Clinical Investigation, 1977, v. 60 p. 846-854). Для образования колоний в культуре нужна суспензия одиночных клеток, обогащенные питательные среды, колониестимулирующие факторы, несмотря на это эффективность культивирования низкая 0,1-0,01% (Потапов С.Л. Корман Д.Б. Клоногенные клетки в опухолях человека и чувствительность к химиопрепаратам, Экспериментальная онкология, 1986, т. 8, с. 7-12). Наличие корреляции между действием противоопухолевого препарата и клоногенной способностью клеток in vitro делает метод удобным для прогнозирования индивидуальной химиочувствительности (Hamburger A.W. Salmon S.E. Kim M.B. et al. Direct cloning of human ovarian carunoma cells in agas, Cancer Research, 1978, v. 38, p. 3438-43). Продемонстрирована клиническая корреляция с чувствительностью 71% с устойчивостью 90% Оценка химиочувствительности производится путем подсчета числа выживших неокрашенных колоний. Hедостатком метода исследования индивидуальной химиочувствительности колониеобразованием является низкая эффективность выхода культур из-за низкой жизнеспособности суспендированных клеток, трудность интерпретации результатов колониеобразования при фазово-контрастном микроскопировании неокрашенных колоний, длительность исследования, так как подсчет колоний возможен лишь на 14-21 день. Дальнейшей модификацией метода является его сочетание с МТТ-тестом (Hid Toyaki, Ued Rynzo, Ta Kahasci Takashi et al. Chemosensitivity and radiosensitivity of small cell lung cancer cell-lines studied by a newly developed 3(4,5-dimethylthiazol-2-yl)-2,5 diphenyltetrazolium bromide (MTT) hybrid assay, Cancer Research, 1989, v. 49, N 17, p. 4785-4790).
Прототипом к нашему изобретению послужило исследование (D.J. Weaver, B. A. L. Barrett, G. Gross and E.H. Adelstein, Transitional explant reduction assay a new in vitro testing system for intravesical chemotherapy, in J. Urology, 1986, v. 135 p. 386-391, N 2), которое определяло химиочувствительность первичных культур переходно-клеточного рака мочевого пузыря, полученных из эксплантатов опухолей, взятых у больных. Эксплантаты помещали в чашки Петри с питательной средой McCOY5A. Определялась разница в величине прироста площади культур в контрольных эксплантатах и эксплантатах, леченных химиопрепаратами. Эту разницу определяли визуально по фотографиям, а затем методом компьютерного анализа (площадь культур очерчивали с помощью графопостроителя с последующей компьютерной обработкой результатов).
Цель настоящего изобретения получить простой краткосрочный способ оценки индивидуальной химиочувствительности опухолей у больных на основе разработанного ранее авторами "Способа культивирования тканей in vitro" (авт. св. N 1791452, приор. от 22.01.91).
Практически указанная цель достигалась следующим образом: кусочки оперативно удаленных опухолей по 1-1,5 см в диаметре брали в питательную среду Игла с добавлением антибиотиков (по 100 ЕД пенициллина + стрептомицина + 50 мкг гентамицина на 1 мл среды), в стерильных условиях механически измельчали на фрагменты по 1-1,5 мм, отмывали в трех порциях такой же среды, трипсинизировали 5-7 мин при 37oС, после чего рассаживали по 1-у фрагменту на стандартные стерильные предметные стекла, покрытые слоем желатины в качестве подложки, накрывали сверху другими такими же предметными стеклами. При этом кусочки ткани слегка расплющивались. Затем на каждую пару стекол с заключенными внутри эксплантатами накладывали сверху кусочек стерильной прозрачной пластмассовой пленки и, держа стекла над подсветкой, обводили технической ручкой исходный контур эксплантата, маркировали пленку и стекло. Техническая ручка mars graphic line 0,1 мм (Германия) приспособлена для письма на целлулоидной пленке с толщиной линии 0,1 мм, что обеспечивает достаточно малую погрешность измерений. В качестве подсветки использовали осветитель к микроскопу ЛОМО ОИ ЗIT II. Затем пары стекол помещали вертикально в закрытые пластмассовые кассеты, заполняли их культуральной средой так, чтобы покрыть кусочки, хотя по закону капиллярности среда заполняла все пространство между стеклами.
Состав культуральной среды I:
Среда Игла (по 20 мл в каждую кассету);
Пенициллин 100 ЕД/мл;
Стрептомицин 100 ЕД/мл;
Гентамицин 50 мкг/мл.
В каждую кассету, кроме контрольной, стерильным шприцом вводили один из тестируемых цитостатиков (винбластин, винкристин, метотрексат, рубомицин, тиофосфамид, фторафур, 5-фторурацил, цис-платина) в дозах, 10-кратно превышающих терапевтические, в пересчете на 1 мл культуральной среды (Переводчикова Н.И. Противоопухолевая химиотерапия, 1993). Количество кассет определялось числом тестируемых цитостатиков + 1 кассета без цитостатиков для контроля. Кассеты с эксплантатами между предметными стеклами помещали в сухие стерильные банки, объемом 0,5 л, которые сверху накрывали стерильными чашками Петри, и ставили в термостат при 37oС для культивирования. Экспозиция с цитостатиками продолжалась 24 ч, после чего в стерильном боксе шприцом извлекали среду из кассет и заполняли свежей средой, дополненной витаминами, поливинилпирролидоном, стимуляторами роста.
Состав культуральной среды II (- 30 мл в кассету):
Среда Игла 80 об./% (24 мл в 1 кассету);
Сыворотка крови крупного рогатого скота 20 об./% (6 мл в 1 кассету);
Витамин А 2 ЕД/мл;
Витамин Е 1 мкг/мл;
Вит. В12 0,2 мгк/мл;
Витамин К 1 мгк/мл;
Преднизолон 0,1 мгк/мл;
Инсулин 0,1 ЕД/мл;
Поливинилпирролидон 2 мг/мл;
Пенициллин 100 ЕД/мл;
Стрептомицин 100 ЕД/мл;
Гентамицин 50 мкг/мл;
Левомицетин 25 мкг/мл;
Феррум-лек 600 мкг/мл.
После замены среды кассеты вновь возвращали в термостат и продолжали культивировать еще 3-4 сут. Затем кассеты поочередно вынимали из термостата и обводили контуры выросших культур. Полученные контуры культур и стекла маркировали. Затем из кассет сливали культуральную среду и заполняли 10%-ным нейтральным формалином, в котором стекла оставляли на 24 ч при комнатной температуре. После фиксации пары стекол разбирали, окрашивали гематоксилин-эозином, заключали в полистирол и исследовали под световым микроскопом для морфологической идентификации. Полученные на прозрачной пленке исходные и окончательные контуры культур использовали для измерения площади и анализа степени ее прироста. Для этого кусочки пленки с контурами накладывали на стандартную масштабно-координатную бумагу марки Н с шагом в 1 мм. Оценку индивидуальной химиочувствительности производили следующим образом: первоначальную площадь эксплантатов обозначали как S01, S02, S03 и т.д. Sn, где n количество пар стекол с эксплантатами. Площади культур, полученные по окончании срока культивирования, обозначали как ST1, SТ2, SТ3, и т.д. STn, где n количество пар стекол. Изменение площади вычисляли как разность STn-SOn и обозначали как ΔS: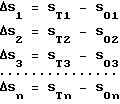
Поскольку площади эксплантатов опухолей изначально отличались вариабельностью, то для каждого фрагмента опухоли находили прирост площади на 1 мм2 от первоначальной, что обозначали как индекс роста (ИР) и выражали в процентах.

Средняя арифметическая индекса роста (UPm) вычислялась по формуле: 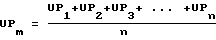 где n -число пар стекол. По этой формуле производили вычисления индексов роста в контрольной и опытной группах. Количество тестируемых химиопрепаратов и их виды брали произвольно, но использовали препараты с прямым цитостатическим эффектом на опухолевые клетки. Средний индекс роста (ИРm) в контрольных кассетах принимали за 100% по отношению к которому вычисляли относительный индекс роста для каждой группы культур, на которую воздействовали химиопрепаратом, последний обозначили как индекс химиочувствительности (ИХ)
где n -число пар стекол. По этой формуле производили вычисления индексов роста в контрольной и опытной группах. Количество тестируемых химиопрепаратов и их виды брали произвольно, но использовали препараты с прямым цитостатическим эффектом на опухолевые клетки. Средний индекс роста (ИРm) в контрольных кассетах принимали за 100% по отношению к которому вычисляли относительный индекс роста для каждой группы культур, на которую воздействовали химиопрепаратом, последний обозначили как индекс химиочувствительности (ИХ)  . Опухоль считали чувствительной к химиопрепарату при ИХ не менее 50% При ИХ выше 50% опухоль считали устойчивой к химиопрепарату. данным способом мы провели исследование индивидуальной химиочувствительности опухолей 47-и больных (22 больных из онкоурологического отделения, 15 больных из проктологического отделения и 10 больных из торакального отделений Областной клинической больницы г. Воронежа). Все первичные опухоли были индетифицированы гистологически.
. Опухоль считали чувствительной к химиопрепарату при ИХ не менее 50% При ИХ выше 50% опухоль считали устойчивой к химиопрепарату. данным способом мы провели исследование индивидуальной химиочувствительности опухолей 47-и больных (22 больных из онкоурологического отделения, 15 больных из проктологического отделения и 10 больных из торакального отделений Областной клинической больницы г. Воронежа). Все первичные опухоли были индетифицированы гистологически.
Пример. Больному Б. 71 года, произведена операция резекции сигмовидной кишки по поводу рака. В операционной после визуального исследования удаленной опухоли стерильным скальпелем иссекли 2 кусочка опухолевой ткани (1х1х0,5), поместили в стерильный флакон с питательной средой Игла с добавлением антибиотиков (по 100 ЕД пенициллина + стрептомицина). Флакон закрыли резиновой пробкой и доставили в лабораторию. Все дальнейшие работы производили в стерильном боксе: кусочки опухоли измельчали в чашке Петри с небольшим количеством культуральной среды на фрагменты по 1-2 мм, трижды промывали культуральной средой, затем в течение 5 мин инкубировали в термостате в 0,25% -ном растворе трипсина. Вновь промывали культуральной средой и оставляли в чашке Петри в свежей среде. Затем по одному кусочку опухоли высаживали на предметные стекла с желатиновой подложкой. Каждое стекло с фрагментом опухоли накрывали другим сухим стерильным, покрытым желатиной стеклом. На каждую пару стекол с заключенными внутри эксплантатами накладывали кусочек стерильной прозрачной пластмассовой пленки и, держа стекла над подсветкой, обводили технической ручкой исходный контур эксплантата и маркировали пленку и стекло. Пары стекол помещали вертикально в закрытые пластмассовые кассеты с культуральной средой 1.
Состав культуральной среды 1:
Среда Игла (по 20 мл в каждую кассету)
Пенициллин 100 ЕД/мл;
Стрептомицин 100 ЕД/мл;
Гентамицин 50 мкг/мл.
В каждую кассету, кроме контрольной, стерильным шприцом вводили по одному химиопрепарату, в дозах 10-кратно превышающих терапевтические, в пересчете на 1 мл культуральной среды (адриабластин 8 мкг/мл, винбластин 3 мгк/мл, винкристин 0,4 мкг/мл, метотрексат 0,7 мкг/мл, рубомицин 16 мкг/мл, тиофосфамид 2 мгк/мл, фторафур 0,3 мкг/мл, цисплатина 5,5 мкг/мл). Кассеты с эксплантатами между предметными стеклами помещали в сухие стерильные банки объемом 0,5 л, накрывали стерильными чашками Петри, маркировали в соответствии с названием химиопрепарата, обозначали контрольную банку и ставили в термостат на 37oС для культивирования. Экспозиция с цитостатиками длилась 24 ч, после чего в стерильном боксе шприцом извлекали среду из кассет и заполняли свежей средой II.
Состав культуральной среды II (- 30 мл в кассету):
Среда Игла 80 об./% (24 мл в кассету)
Сыворотка крови крупного рогатого скота 20 об./% (6 мл в кассету);
Витамин A 2 ЕД/мл;
Витамин E 1 мкг/мл;
Витамин B12 0,2 мкг/мл;
Витамин K 1 мкг/мл;
Преднизолон 0,1 мкг/мл;
Инсулин 0,1 ЕД/мл;
Поливинилпирролидон 2 мг/мл;
Пенициллин 100 ЕД/мл;
Стрептомицин 100 ЕД/мл;
Гентамицин 50 мкг/мл;
Левомицетин 25 мкг/мл;
Феррум-лек 600 мкг/мл.
После замены среды кассеты продолжали культивировать еще 3 сут, затем поочередно вынимали из термостата и обводили контуры выросших культур. Полученные контуры культур и стекла маркировали. Затем из кассет извлекали культуральную среду, заполняли 10%-ным нейтральным формалином, фиксировали 24 ч при комнатной температуре. После фиксации пары стекол разбирали, окрашивали гематоксилин-эозином, заключали в полистирол и исследовали под световым микроскопом для морфологической идентификации наличия роста. Полученные на прозрачной пленке исходные и окончательные контуры культур использовали для измерения площади и анализа ее прироста. Для этого кусочки пленки с контурами накладывали на стандартную масштабно-координатную бумагу марки H с шагом 1 мм и подсчитывали площадь в мм2.
Первоначальная площадь эксплантатов в контроле составила:
S01 19,5 мм2
S02 10,5 мм2
S03 20,0 мм2
S04 10,5 мм2
S05 16,5 мм2.
Площади культур, полученные по окончании срока культивирования в контроле составили:
ST1 35 мм2
ST2 16,5 мм2
ST3 30 мм 2
ST4 31 мм2
ST5 31 мм 2
Изменения площадей были соответственно равны:
Следовательно значения индексов роста были (в):
UP1 15,5/19,5•100% 79,5
UP2 6/10,5•100% 57,1
UP3 10/20•100% 50
UP4 7,5/10,5•100% 78,4
UP5 14,5/16,5•100% 87,0
Средняя арифметическая индексов роста (ИР) в контрольной группе равнялась:
ИР 69±6,8% (М±m).
Результаты представлены в табл. 1.
Таким образом, средние значения индексов роста для всех групп сведены в табл. 2.
Приняв затем среднее значение ИР в контрольной группе за 100% высчитали, какую долю от него (в) составляют средние значения ИР в каждой из опытных групп, т.е. вычислили индекс химиочувствительности (ИХ) (см. в табл.). Опухоль считали чувствительной к тем химиопрепаратам, для которых ИХ был менее 50% В приведенном примере опухоль оказалась чувствительной к адриабластину, винбластину, метотрексату, тиофосфамиду, к остальным химиопрепаратам устойчива.
Предложенный способ исследования химиочувствительности опухолей путем анализа изменения площади прироста культур под влиянием цитостатиков по сравнению с контролем имеет ряд преимуществ перед существующими методами исследования химиочувствительности опухолей:
1. В отличии от других методов культуру ткани получают из кусочка ткани, а не из суспензии отдельных клеток, что значительно упрощает метод и уменьшает травматизацию опухолевых клеток.
2. Для культивирования ткани может использоваться широко распространенная в лечебных учреждениях питательная среда Игла, в качестве стимуляторов роста применяются общеизвестные лекарственные препараты.
3. Возможность светооптического контроля роста культур, окрашенных гематоксилин-эозином, после формалиновой фиксации, повышает точность и надежность метода.
4. Заключение препаратов в полистирол или бальзам дает возможность длительного сохранения и повторного исследования контрольных и опытных культур в отличии от распространенного способа колониеобразования в агаре.
5. Метод отличается высокой эффективностью культивирования (выход культур 71-89%).
6. Сравнительно короткие сроки исследования (4-5 дн культивирования + 1-2 дн для обработки и оценки) позволяют рекомендовать его для использования в практическом здравоохранении.
7. Возможность применения ЭВМ для оценки прироста площади и статистической обработки результатов сократит сроки выдачи результатов и повысит их точность.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ОЦЕНКИ ИНДИВИДУАЛЬНОЙ ХИМИОЧУВСТВИТЕЛЬНОСТИ ОПУХОЛЕЙ У БОЛЬНЫХ | 1992 |
|
RU2068563C1 |
| Способ культивирования тканей IN VIтRо | 1991 |
|
SU1791452A1 |
| КЛЕТОЧНАЯ ЛИНИЯ ЭМБРИОНАЛЬНОЙ РАБДОМИОСАРКОМЫ ЧЕЛОВЕКА 862 RMSar KDD | 2020 |
|
RU2737248C1 |
| КЛЕТОЧНАЯ ЛИНИЯ ОСТЕОГЕННОЙ САРКОМЫ ЧЕЛОВЕКА793 OsSar RVV | 2019 |
|
RU2722867C1 |
| КЛЕТОЧНАЯ ЛИНИЯ ВЕРЕТЕНОКЛЕТОЧНОЙ САРКОМЫ МЫШИ 164 MSar FE | 2023 |
|
RU2796351C1 |
| СПОСОБ ОПРЕДЕЛЕНИЯ ЛЕКАРСТВЕННОЙ ЧУВСТВИТЕЛЬНОСТИ НЕМЕЛКОКЛЕТОЧНОГО РАКА ЛЕГКОГО IN VITRO | 2021 |
|
RU2766662C1 |
| КЛЕТОЧНАЯ ЛИНИЯ КОЛОРЕКТАЛЬНОГО РАКА ЧЕЛОВЕКА 485 colo can | 2017 |
|
RU2650757C1 |
| ПРИМЕНЕНИЕ КЛЕТОЧНОЙ ЛИНИИ СВЕТЛОКЛЕТОЧНОГО РАКА ПОЧКИ ЧЕЛОВЕКА RC291C | 2018 |
|
RU2673729C1 |
| ПРИМЕНЕНИЕ КЛЕТОЧНОЙ ЛИНИИ МЕЛАНОМЫ КОЖИ ЧЕЛОВЕКА 388mel | 2018 |
|
RU2675541C1 |
| КЛЕТОЧНАЯ ЛИНИЯ РАКА МОЧЕВОГО ПУЗЫРЯ ЧЕЛОВЕКА 198 BlCan RLA | 2019 |
|
RU2733230C1 |


Использование: в области медицины, в частности в онкологии. Сущность изобретения: кусочки оперативно удаленных опухолей брали в питательную среду Игла, механически измельчали, рассаживали на стандартные предметные стекла с желатиновой подложкой, которые накрывали сверху другими такими же стеклами. Затем на поверхность каждой пары стекол накладывали кусочки прозрачной пленки и технической ручкой, подсвечивая снизу, обводили контур каждого эксплантата. Пары стекол с заключенными между ними эксплантатами помещали вертикально в пластмассовые кассеты с культуральной средой и химиопрепаратами (по одному химиопрепарату в каждую кассету). Затем кассеты помещали в термостат при 37oC. Экспозиция с цитостатиками продолжалась сутки, затем производили замену среды, кассеты вновь ставили в термостат при 37oC и продолжали инкубировать 3-4 суток. По окончании культиварования обводили контур конечной площади культур, препараты фиксировали, окрашивали гематоксилинэозином, заключали в полистирол. Полученные исходные и окончательные контуры использовали для измерения площади и анализа степени ее прироста под влиянием цитостатиков с определением индекса химиочувствительности по формуле:  , где ИХ - индекс химиочувствительности, UPm в опыте - средний арифметический индекс роста в присутствии цитостатика, UPm в контроле - средний арифметический индекс роста в контроле. При индексе химиочувствительности менее 50% опухоль считалась чувствительной к химиопрепарату. Способ прост в исполнении и краткосрочен. 2 табл.
, где ИХ - индекс химиочувствительности, UPm в опыте - средний арифметический индекс роста в присутствии цитостатика, UPm в контроле - средний арифметический индекс роста в контроле. При индексе химиочувствительности менее 50% опухоль считалась чувствительной к химиопрепарату. Способ прост в исполнении и краткосрочен. 2 табл.
Способ определения индивидуальной химиочувствительности опухоли у больных in vitro путем исследования первичной пятидневной культуры, выращенной в капиллярном пространстве между двумя предметными стеклами, отличающийся тем, что производят измерение прироста площади культуры в контроле и под влиянием цитостатиков с определением индекса химиочувствительности по формуле
где ИХ индекс химиочувствительности;
ИРm в опыте средний индекс роста в опыте;
ИРm в контроле средний индекс роста в контроле,
и при индексе химиочувствительности менее 50% опухоль считают чувствительной к химиопрепарату.
| Weaver B.A.L | |||
| et al Transitional explant reduction assay - a new in vitro testing system for in travesical shemotherapy | |||
| / J Urology, 1986, v | |||
| Способ обделки поверхностей приборов отопления с целью увеличения теплоотдачи | 1919 |
|
SU135A1 |
| Счетная бухгалтерская линейка | 1922 |
|
SU386A1 |
Авторы
Даты
1997-10-27—Публикация
1994-08-16—Подача