Изобретение относится к диспецифическим и олигоспецифическим, моно- и олиговалентным антителам, которые получают методом генетической инженерии при слиянии участков ДНК, кодирующих F(ab)-фрагменты антител двух или нескольких различных специфичностей, с помощью различных связующих. При этом одна специфичность антитела направлена к находящемуся на оболочке клетки или в интерстиции связанному с опухолью антигену или же антигену, локализованному в эндотелии опухоли, в то время как остальные специфичности направлены к высокомолекулярным или низкомолекулярным лигандам, например комплексам этилендиаминтетраацетата или диэтилентриаминпентаацетата с изотопом иттрия 90 (ЕДТА-У90 или ДТРА-У90). В особенно предпочтительном варианте осуществления изобретения связывание антител с комплексами происходит посредством fos-jun-взаимодействия (или авидин-биотин-взаимодействия). Предпочтительно также использование антител с каталитическими свойствами.
Известны следующие способы получения биспецифических антител.
Химическое связывание антител различной специфичности через гетеробифункциональное связующее (H. Paulus, Behring Inst. Mitt, 78 (1986), 118-132).
Слияние уже имевшихся гибридов и выделение биспецифического моновалентного участка (U.S. Staers и M.J.Bevan, Proc. Natl. Acad Sci. США 83 (1986), 1453-1467).
Трансфекция легких и тяжелых генов цепи двух различных моноклональных антител (4 гена) в созревающие клетки миеломы или другие эукариотические системы экспрессии и выделение биспецифического моновалентного фрагмента (U. Zemmermann. Rev. Physio. Bloohem. Phannacol 105 (1986), 176-260; J. van Dijk et al. Int. J.Cancer 436 (1989), 944-349).
Такие биспецифические антитела применяют для лечения и диагностики злокачественных опухолей. Принцип способа заключается в том, что на первой стадии благодаря инъекции биспецифических макромолекул через более продолжительные интервалы и в высоких дозах достигают насыщения опухолевых эпитопов. На второй стадии, которая заключается в многодневном прорыве лечения, происходит аутоэлиминация неспецифически адсорбированного антитела из нецелевых тканей.
Третья стадия способа заключается во внутривенной инъекции меченого, гидрофильного, ненакапливающегося в клетках низкомолекулярного лиганда с коротким временем полужизни в организме, который имеет высокую степень связывания с бета- и гамма-излучателями, например Y90, Re186, Re188, Re189, 99mTe или IIIIn и к которым направлена специфичность биспецифического антитела. В результате достигают накопления радиоактивного лиганда, что влечет за собой селективное разрушение целевой ткани или позволяет проводить диагностику, например, в случае метастазирования.
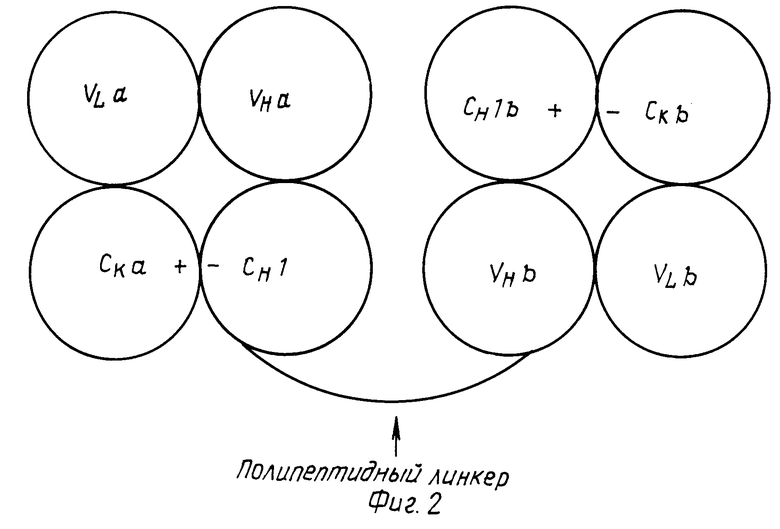
Изобретение относится к биспецифическим или олигоспецифическим антителам, которые в зависимости от целей исследований образуют моно- или олиговалентные связи с соответствующими эпитопами. Такие антитела получают методом генетической инженерии при использовании подходящих "связующих". При этом фрагменты генов, которые кодируют VH и CHI области антител a и b, с помощью соответствующих синтетических олигонуклеотидов, как показано, например, в табл.4, связываются таким образом, что N-концевой участок н-домена моноклонального антитела (МАК), соединен ковалентно через полипептидный линкер с C-концевым участком CHI домена МАК (фиг.1). Конструкцию генов из VHaCHIa-подипептидного линкера VHbCHIb вместе с генами легких цепей антител a и b переносят в эукариотические клетки (например, клетки миеломы мыши). CH1a, CH1b, CKa и CKb домены модифицированы таким образом, что на контактирующих поверхностях константных доменов находятся противоположные заряды (CH1a(+)CKa(-); CH1b(-)CKb(+)) (+) положительный, (-) отрицательный или гидрофобные, или гидрофильные группы.
В результате этого трансфектомы продуцируют преимущественно гибридные молекулы, у которых правильно спарены тяжелые и легкие цепи (фиг.2).
Антитело a представляет собой, например, антиопухолевое антитело, антитело b представляет собой, например, антитело, направленное к низкомолекулярному лиганду, предпочтительно комплексу ДГРА-У90 или ЕДГА-У90.
Би- или олигоспецифическое антитело относится соответственно с конструкции из VH и CH1 доменов антител различной специфичности, полученной посредством данного связующего, так что обеспечивается необходимая подвижность для соединения с нужными легкими цепями и антитело способно связывать антиген.
Под валентностью подразумевают число участков связывания антигена. Биспецифический трехвалентный рецептор имеет, следовательно, один участок связывания антигена одной специфичности и два участка связывания антигена другой специфичености.
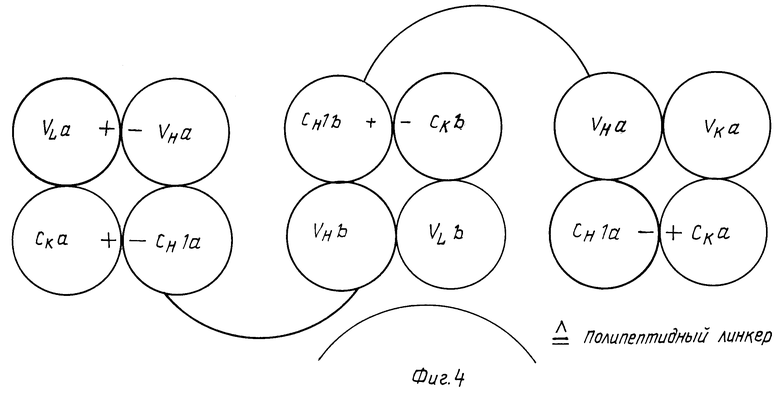
Биспецифические антитела, которые двухвалентны по отношению к антигену опухоли (МАК a) и моновалентны по отношению к ЕДГА-У90 (МАК в), получают следующим образом. Охарактеризованную выше генную конструкцию тяжелой цепи с помощью олигонуклеотидного связующего соединяют с участком гена, который кодирует VH и CH1 домены МАК a (фиг.3), так что C-концевой участок CH1 домена МАК b связывается с N-концевым участком VH домена МАК a посредством полипептидного линкера. Эти конструкции генов вместе с генами легких цепей МАК a и b переносят в эукариотические клетки (например, клетки миеломы). CH1 и CK домены имеют, как описано выше, комплементарные заряды или гидрофобные или гидрофильные группы. Трансфектомы продуцируют слитые молекулы антител, состоящих из двух F(ab)-фрагментов МАК a и одного F(ab)-фрагмента МАК b (фиг. 4). Подвижность пептидного линкера позволяет направить оба F(ab)-фрагмента МАК a в опухолевой клетке при одновременном ориентировании F(ab)-фрагмента МАК b в направлении межклеточного пространства. Соответственно можно вводить в конструкцию антитела другие участки связывания с идентичной или иной специфичностью. При этом расположение специфических участков связывания в конструкциях можно свободно комбинировать.
Изобретение, следовательно, относится к биспецифическим или олигоспецифическим, моно- или олиговалентным антителам, которые специфичны как по отношению к находящемуся на оболочке клетки или в интерстиции опухолевому антигену, так и по отношению к низкомолекулярному или высокомолекулярному лиганду, который распределяется исключительно во внеклеточном пространстве. При этом одна специфичность касается преимущественно опухолевоспецифического антигена, как предложено в заявке на патент ФРГ P 39 09 799.4, в то время как другая специфичность предпочтительно касается ДТРА-У90 или ЕДГА-У90. В особенно предпочтительном варианте осуществления изобретения происходит связывание антител с комплексами происходит посредством fos-jun-взаимодействия (см. пример 5). Предпочтительно также использование антител с каталитическими. При этом расположение специфических участков связывания можно выбирать произвольно, как, например, показано на фиг.4 для трехвалентного биспецифического антитела.
Особенно предпочтительно использование конструкций V-гена, приведенных в табл. 5, 6, 7 и/или 8. Антитела с такими последовательностями и их свойства описаны в заявке на патент ФРГ P 39 09 799.4. При этом области, определяющие комплементарность (CDR's) можно идентифицировать, используя методику Кабата и Ву (Seguences of Proteins of Immunological Interest, US Dept. of Health and Human Services. US Government Printing Office (1987)).
Кроме того, изобретение относится к способу получения моноклональных антител, имеющих указанную выше специфичность. Такие антитела могут быть использованы в противоопухолевой терапии. При этом на 1-й стадии после инъекции антител происходит насыщение соответствующих эпитопов на клетках-мицелиях, а затем неспецифически адсорбированные или несвязавшиеся антитела элиминируются. Следующая стадия заключается в инъекции на накапливающегося в клетках низко- или высокомолекулярного лиганда, который является цитотоксическим или в последующем становится цитотоксическим, например, в результате ферментативного активирования, микроволнового облучения или обработки лазерным лучом.
Пример 1. Получение анти-ДТРА-У90 или ЕДТА-У90-МАК.
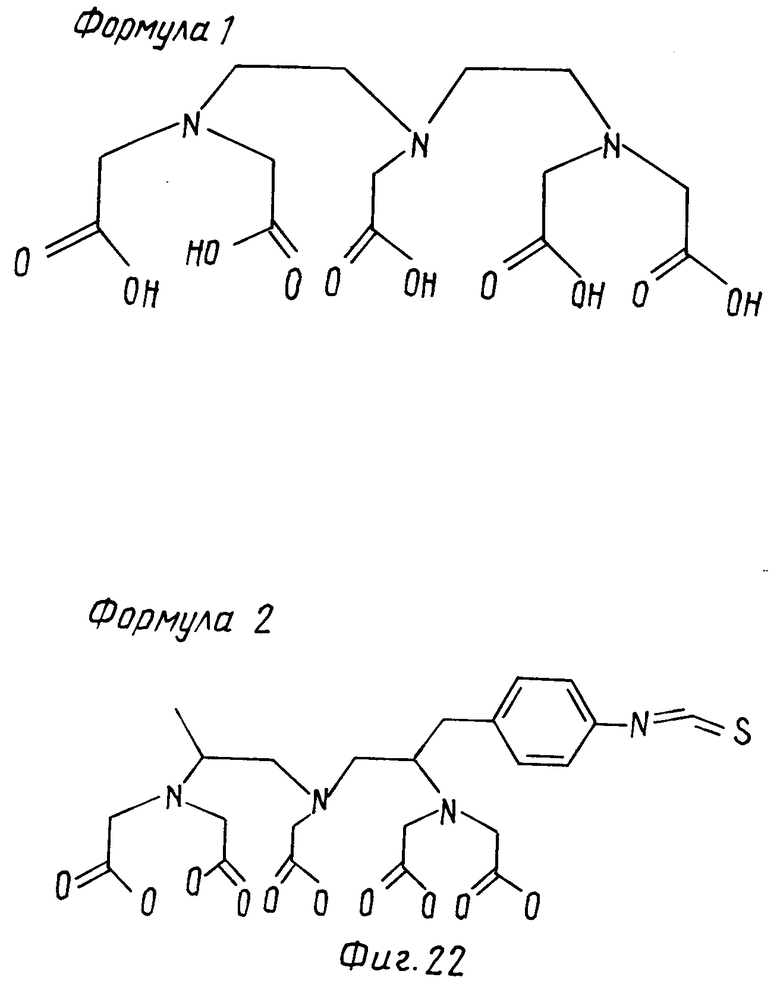
Гаптен изотиоцианато-бензил-ДТРА (формула 2, фиг.22) ковалентно соединяют с сывороточным альбумином (HSA) как носителем 19 в соотношении молекул БЕНЗИЛ-ДТРА-на молекулу HSA согласно известной методике (N.W. Brechbiel et al. Inorganic Chemistry 25, (1988) 2772-2781). Затем 20 мг комплекса гаптен-носитель, в который был введен холодный иттрий, впрыскивают подкожно на 0 день с фармацевтическим препаратом Фрейнда, на 7 и 14 дни с неполным фармацевтическим препаратом Фрейнда и на 21-й день с PBS мышам линии Ваеb/c. На 24-й день клетки селезенки мышей с максимальными анти-ДРТА титрами антител сливает с клеточной линией миеломы SP2/0-Ag 14 (Shulman et al. Nature 276, (1978) 269). Образующиеся гибридомы тестируют с помощью ELISA на образование МАК, имеющих высокое сродство к ДТРА и ЕДТА. На твердой фазе абсорбируют комплекс бензил-ДТРА-Y. Тестируемую надосадочную жидкость, содержащую МАК, предварительно инкубируют со свободным лигандом или его комплексами с ионами металла и оценивают ее сродство к специфической твердой фазе. Для этого используют фермент, связанный с анти-иммуноглобулинами мыши. Детали методики описаны в приложении 1а и 1б.
В результате получает МАК, которые имеет описанные в приложении 1в свойства.
Полученные МАК, в противоположность многим другим анти-ДТРА/ЕДТА МАК, не связываются с человеческими нормальными тканями, как было определено (Cordell et. al. J. Histoshem. Cytoсhem 32: 219, 1984) на криопротектичных тканях. Следовательно, возможно применение таких МАК на живом организме с целью диагностики и терапии.
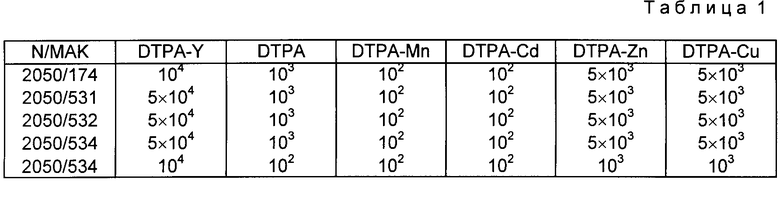
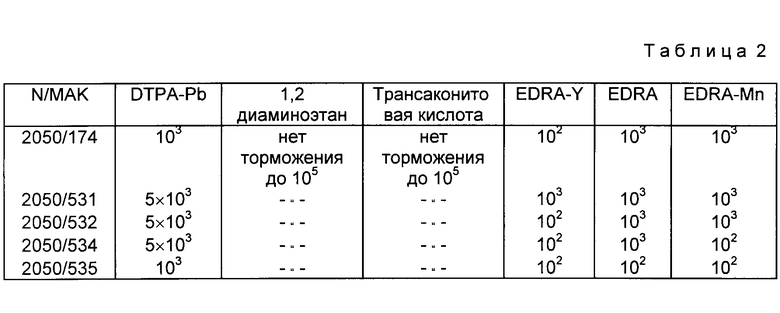
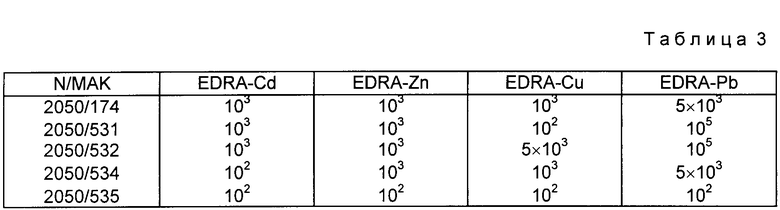
В качестве конкурентных соединений применяет лиганды ДТРА, ЕДТА в некомплексированной и в комплексированной форме (приложение 1с). Дополнительно в качестве ингибиторов используют сходные по структуре соединения, такие как трансаконитовую кислоту и 1,2-диаминоэтан (см. приложение 1с). Особенно пригодны для применения на живом организме МАК BW 2050/-174, которые в отличие от всех других МАК предпочтительно связываются с ЕДТА-У ((см. приложение 1е, более низкий избыток конкурента для ЕДТА-У (100-кратный), более высокий избыток для других ЕДТА-комплексонов)). Поэтому гибридому 2060/174 стабилизируют и используют для получения биспецифических антител.
Пример 2. Получение и экспрессия генной конструкции VHIa-CHI-линкер-VH1bCH1
Примененные здесь методики, если нет других указаний, заимствуют из Molecular Cloning, A. Laboratory Manual; Sambrook, Fritsch, Maniatis, Cold Spring Habor Laboratory 1982 (стр. 11-44, 51-127, 133-134, 141, 146, 150-167, 170, 188-193, 197-199, 248-255, 270-294, 310-328, 364-401, 437-506) и из Molecular Cloning, A. Laboratory Manual, Second Edition, Sambrook, Fritsch Maniatis, Cold Spring Harbor Laboratory Press 1989, (16.2-16.22, 16.30-16,40, 16,54-16,55).
IgG3-ген человека получают из банка генов человека в EMBL3 фагах (A.M. Frischauf et. al. J. Mol. Biol 170, 827-842 (1933) и G.H.A. Seemarn et al. The EMBO Journal 5 (1986), 547-552).
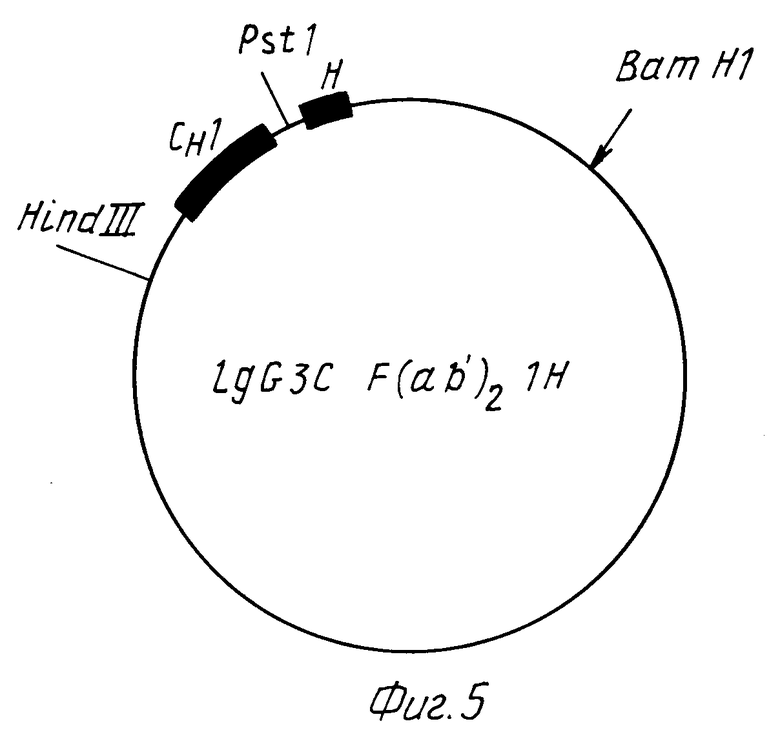
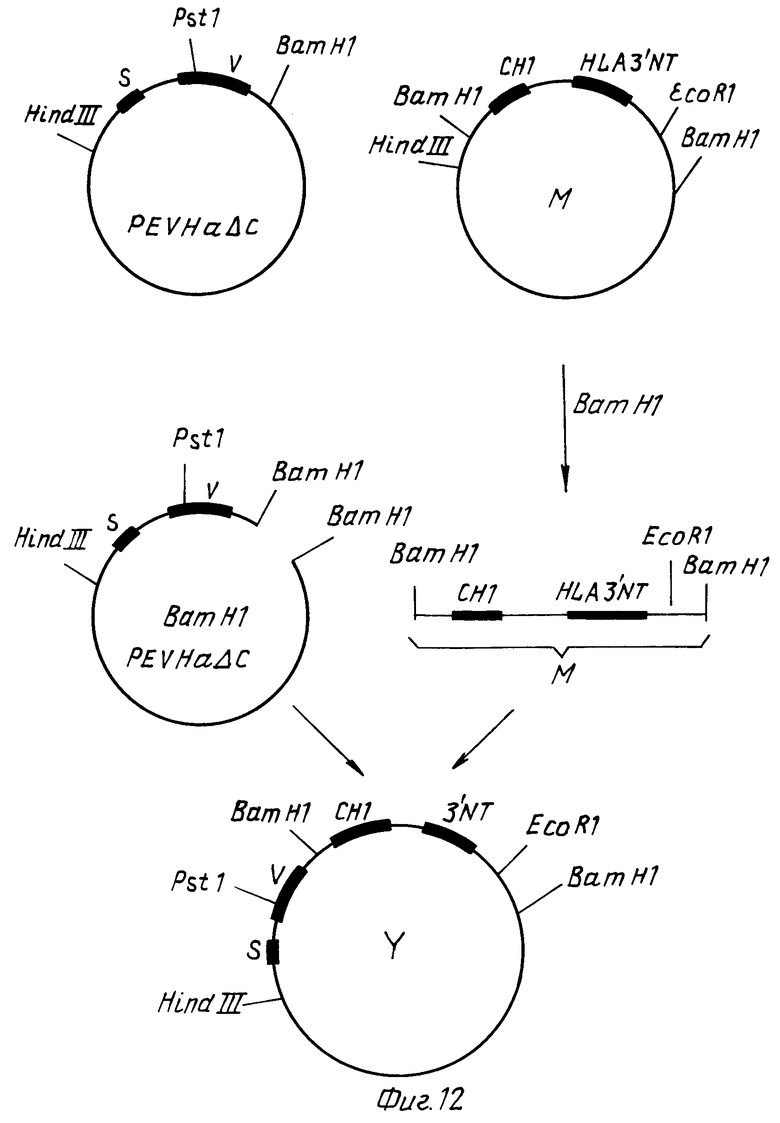
Из IgG3 C-гена, получают, как описано в заявке на патент ФРГ P 38 25 615.0, конструкции, которые содержат, во-первых, CH1-экзон и экзон шарнирной области (фиг.5) и, во-вторых, CH1 экзон и 3'NT область HLA B27 гена (фиг.6, фрагмент M в плазмиде M).
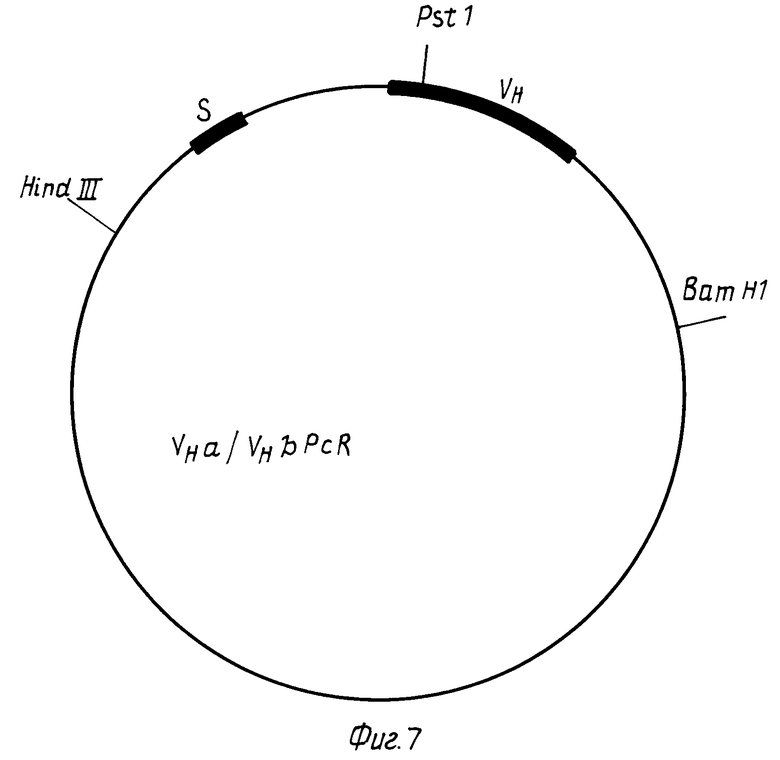
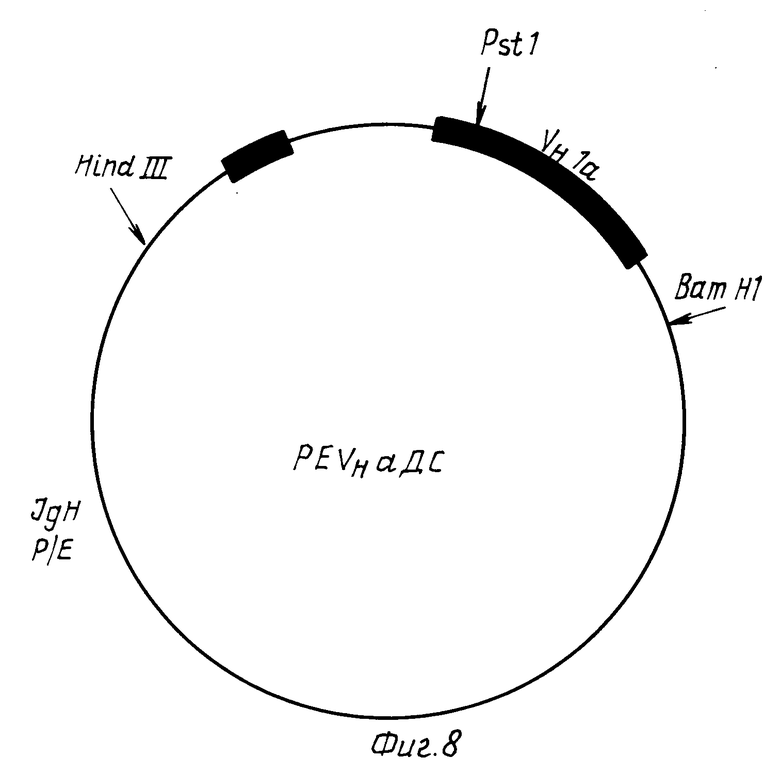
VHa и VHb гены амплифицируют из мРНК гибридных клонов a и b, как описано Orlandi et al. (Proc. Natl. Acad. Sci. США 86, (1989), 3833-3837) и клонируют в M13 (V a PCR или VHb PCR или VHb PCR) (фиг.7). VHа ген клонируют как Hind 111 Barn Hi фрагмент в эукариотической системе экспрессии pEVH (Simon et al. Nucl. Acids. Res. 16, (1988), 354) (фиг. 8) с образованием плазмиды PEVHa C.
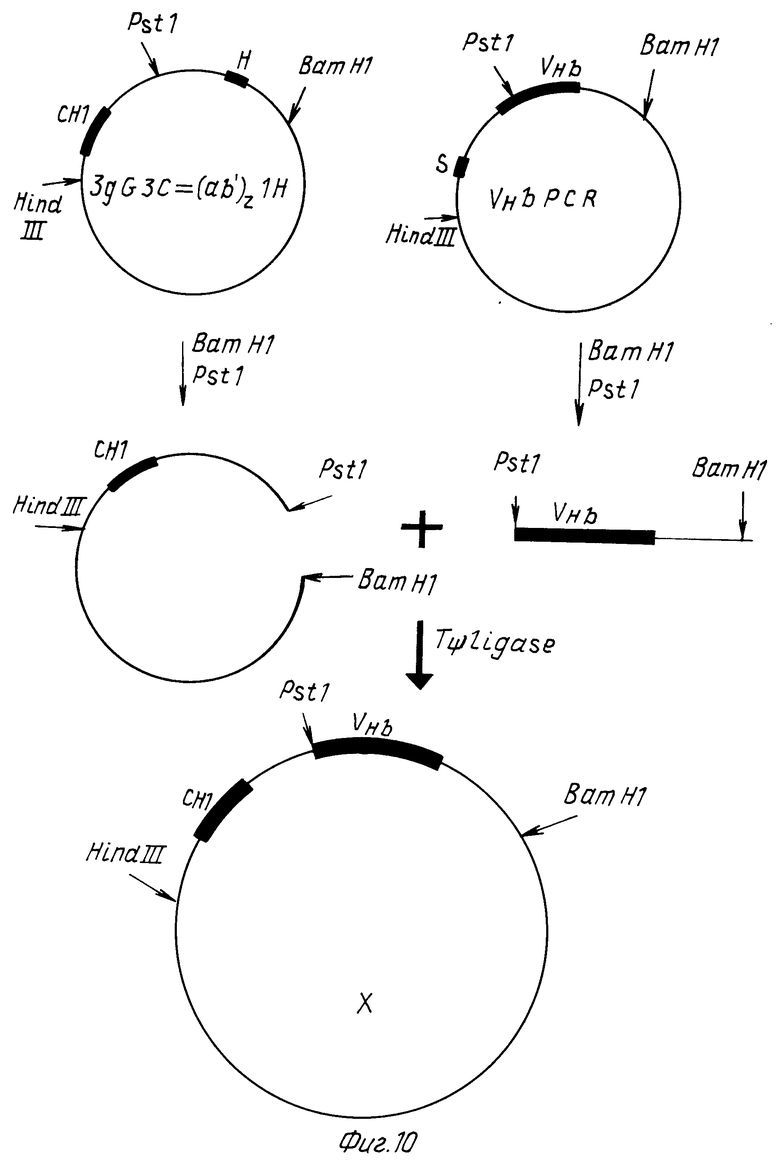
Субклонированный IgG C-ген человека с CH 1-экзоном и экзоном шарнирной области (Hinge) (фиг. 5) содержит между CH 1-экзоном и Hinge-экзоном сайт рестрикции для PstI. VH гены содержат на 5' конце сайт рестрикции для PstI. Связующий нуклеотид проектируется таким образом, что он на 5' конце перекрывается сайтом рестрикции для PstI CH1 + 1H субфрагмента IgG C-гена и на 3'-конце перекрывается сайтом рестрикции для PstI VHb гена. Связующий олигонуклеотид клонируют по его сайту рестрикции для PstI в плазмиде PUC 18 (фиг. 9) с образованием плазмидного клона L.
Плазмиду с субфрагментом C-гена IgG, содержащим CH1-экзон и Hinge-экзон, расщепляют при помощи PstI т BamH1 и связывают с вырезанным как PstI BamH1-фрагмент из VHb PCR VHb генным фрагментом (фиг.10). Образуется плазмида X.
Плазмиду X расщепляют PstI и связывают с вырезанными при помощи PstI из плазмиды L связующим фрагментом (фиг. 11). При помощи анализа последовательностей нуклеиновых кислот идентифицируют клон Z, у которого линкер клонирован в правильной ориентации CH1 и VHb, не нарушая область интрон/экзон между интроном 3 и экзоном линкера.
Плазмиду pEVa C расщепляют BamHI и лигируют с вырезанным посредством BamHI из плазмиды M фрагментом M. Идентифицируют клон Y, который содержит фрагмент M в правильной ориентации (фиг. 12).
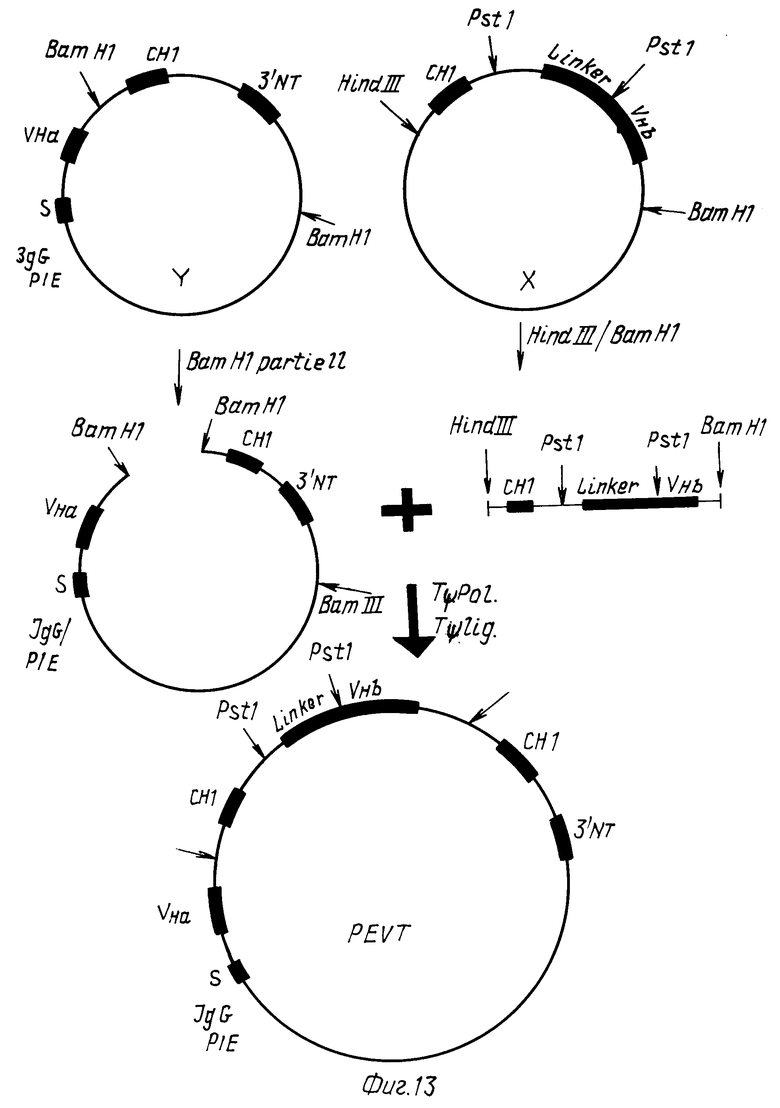
Плазмиду Y расщепляют частично BamHI и лигируют с вырезанным HindIII и BamHI фрагментом плазмиды X (C 1-линкер VHb) после достраивания всех концов. Секвенированием нуклеотидов и ограниченным картированием идентифицируют плазмидный клон PEVT, который содержит ген VHaCH1-линкер-VHbCH1 с правильной ориентацией всех экзонов (фиг.13).
Плазмиду PEVT вместе с плазмидами, которые несут гены для легких цепей антител a или b, переносят в соответствующие эукариотические клетки, чтобы подучить белок слияния (Fab)-фрагмент антитела a-(Fаb)-фрагмент антитела b.
Пример 3. Перенос легких и тяжелых генов цепи двух различных МАК(4 гена). Выделение иммуноглобулиновых генов описано в заявке на патент ФРГ P 39 09 799.4.
Клонированные гены при помощи электропорации после линеаризации векторов клонирования переносят в X63Ag8, 653 клетки миеломы (H.Stopper et al. Biohem Biophys. Acta 900 (1987), 38-44). Выросшие в избирательной среде трансфектомы испытывают на образование биспецифических моновалентных МАК в радиоиммуноанализе (RIA). На твердой фазе адсорбируют опухолевоспецифический антиген и затем после блокады неспецифических участков связывания казеином наносят испытываемые надосадочные жидкости трансфектом. После добавления комплексированных при помощи Y90 или 99mTc ДТРА или ЕДТА и отмывания их избытка выявляет те трансфектомы, которые продуцируют биспецифические моновалентные антитела к ЕДТА и опухолевоспецифическому антигену.
Транрсфектому 9 стабилизируют в процессе клонирования с методом предельных разведений. Надосадочные жидкости культуры клеток концентрируют в 10 раз, МАК очищают хроматографией на протеине A (P.L.Ey et al. Immunochemistry 15, (1878), 429) и биспецифические моновалентные МАК далее очищают анионообменной хроматографией (J.Van Dijk et al. Int. J. Cancer 43, (1089), 344-349).
Пример 4. Биологическая активность
Очищенные биспецифические моновалентные МАК (BW 431/26 x BW 2050/174) в дозах 500 мг в дни 0, 3, 6, 8, 10, 12 вводят внутривенно голым мышам, несущим ксенотрансплантаты опухоли человека (CoCa 4). На 27-30 дни животным вводят по 50 мкюри ЕДТА-У90 внутривенно. 2-я группа животных получает в эти же дни вместо биспецифического МАК 500 мг МАК BW 431/26 и, как описано выше, ЕДТА-У90-иньекции.
Третья имеющая опухоль группа животных получает вместо МАК и ЕДТА-У90 инъекции PBS (контроль роста опухоли)
За ростом опухоли наблюдают в течение 6 недель. Инъекция ЕДТА-У90 в группе, которая получала биспецифические моновалентные МАК, приводит к значительному торможение роста опухоли, тогда как у инъецированных МАК BW 431/26 и ЕДТА-У90 животных не обнаруживается торможения роста опухоли, так же как и у животных, которые получали только PBS.
Эти данные указывают на избирательное терапевтическое действие на опухоль биспецифического моновалентного МАК в комплексе с ЕДТА-У90 в качестве токсического начала.
Еще более обнадеживающие результаты лечения опухоли получают при использовании олиговалентных (биспецифических или олигоспецифических) антител, так как они благодаря бивалентной связи с опухолевоспецифическим антителом находятся в опухоли более продолжительное время и тем самым лиганд также задерживается в опухоли на более продолжительное время и в более высокой концентрации.
Пример 5. Оптимизация биологической активности би- или олигоспецифических антител за счет повышения аффинности к комплексонам.
Решающим фактором, который оказывает влияние на эффективность связывания гидрофильного, распределяющегося вне клетки комплексона (лиганда) к соответствующему участку олигоспецифического антитела, является аффинность этого участка к комплексону. Аффинность моноклональных антител к соответствующим эпитопам лежат в интервале 105-1011 л/моль. Так как эта сила связи, возможно, недостаточна, чтобы локализовать необходимое для эффективной радиоиммунотерапии количество комплексона на опухоли, в следующем примере используют крайне сильное взаимодействие fos-лейцин-пептида (fos-пептид) с jun-лейцин пептидом по принципу "застежки-молнии" (jun - пептид) (Erin K.O'Shera et al. Sciencl. 245, 1989), чтобы по возможности прочно фиксировать комплексон на соответствующем участке антитела. При использовании этого сильного fos-jun-взаимодействия связывает ковалентно с комплексоном (ДТРА) преимушественно fos-пептид. Для этого на первой стадии изотиоцианатобензил ДТРА связывают с гидразином (или диаминоалканом), образовавшийся ДТРА-бензил-тиокарбазид на 2-й стадии затем взаимодействует с N-(гамма-малеимидобутирил-окси) сукцинимидом или каким-либо аналогом с образованием ДТРА-бензил-(гамма-малеитмидобутирил)-тиокарбазида. Затем на 3-й стадии это соединение связывают с удлиненным на глицин-глицин-цистеин fos-пептидом через свободную SH-группу аминотерминального цистеина. Образовавшийся таким путем fos-петид-ДТРА-конъюгат комплексируют на 4-й стадии с хлоридом иттрия. Комплекс fos-пептид-ДТРА-Y-коньюгат далее используют для присоединения к jun-пептиду би- или олиго-специфического антитела в живом организме. Описанная методика ниже раскрыта более подробно.
A) Получение комплекса fos-ЕДТА-Y-коньюгата
Стадия 1. Синтез ЕДТА-бензил-тиокарбазида
Изотиоцианатобензил-ЕДТА (SCN-Bn-ЕТРА) (30 мг, 54 моль) перемешивают 1 ч в 10% (объем/объем) водного гидразина. Затем растворитель удаляют в высоком вакууме, остаток высушивает над полупятиокисью фосфора в высоком вакууме, и, наконец, подвергает лиофилизации. Продукт нейтрализует при помощь Доуэкс WX 2 (H+-форма) и снова подвергает лиофилизации (выход 28 мг).
Стадия 2. Синтез ЕДТА-бензил-(гамма-малеимдобутирил) тиокарбазида
Полученный на стадии 1 ЕТРА-бензил-тиокарбозид (20 мг, 34 мкмоль и N-(гамма-малеитмидобутирилокси)сукцинимид (8 мг, 29 мкмоль 0,9 эквивалента) перемешивают 1 ч в безводном диметилформамиде. Затем сгущают досуха и остаток высушивают в высоком вакууме.
Стадия 3. Связывание ЕДТА-бензил-(гамма-малеимидобутирил)тиокарбазида с аминоконцевым цистеином fos-пептида
Раствор fos-пептида (4,8 мг, 1 ммоль) (см. стадия 3.1) в буферном растворе фосфата поваренной соли (2мл) смешивают с суспензией полученного на стадии 2 продукта (4 мг) в диметилформамиде (400 мл) и инкубируют 1 ч при комнатной температуре. Затем реакционную смесь подвергают гельфильтрации на Сефадекс 615-колонке в буферном растворе фосфата поваренной соли. Протеионсодержащий элеат собирает и хранят при -30oC (выход 4,2 мг).
Стадия 3.1. Последовательность аминокислот fos-пептида (400 мкм) с N-концевым GGC удлинением
Ac-CGGyLTDTLGAETD QLED KKSALQTEIANLLKEKEKLEFILAAYy
Буквы обозначают следующие аминокислоты: A аланин, С цистеин, D - аспарагиновая кислота, E глутаминовая кислота, G глицин, I изолейцин, K лизин, L лейцин, M метионин, N аспарагин, Q глутамин, R аргинин, S серин, T треонин, V валин, Y тирозин.
Синтез олигопептида осуществляют при помощи пептидного синтезатора (Applied Biosystems Model 430A) на твердой фазе по методике Меррифилда (Stewart и Young. Solid Phase Synthesis. Pierce Chemical company 2-е издание. Рокфорд 111) с защитной трет.-бутилоксикарбониловой группой. После отщепления защитных групп (Tom et аl. 1983, J.Am. Chem. Soc. 105. 6442-6455) олигопептиды очищают обратно фазовой хроматографией Pep RPC-колонка, Фармация), как описано Rivier et al. (J. Chromatography 288, 303-328, 1984).
Стадия 4. Получение хелата fos-пептид-ЕДТА-иттрий на основе изготовленного конъюгата fos-пептид-ЕДТА (стадия 3)
Полученный на стадии 3 конъюгат fos-пептид-ЕДЕА (4,2 мг) подвергает диализу относительно изотонического раствора хлористого натрия/0,1-молярного цитрата натрия, pH 7,0, в камере диализа с предельным размером пор мембраны 1000 (Spectrum) и смешивают с 6 мл хлористого иттрия, растворенного в 3 мл изотонического раствора хлористого натрия/0,1-молярного цитрата натрия, pH 7,0. Через 1 ч проводят обратный диализ относительно буферного раствора фосфата поваренной соли и хранят хелатный раствор при -30oC. Полученный таким образом fos-пептид-ЕДТА-иттрий-хелат используют далее в качестве лиганда для связывания с jun-пептидом на би- или олигоспецифическом антителе. Строение предпочтительной молекулы антитела, используемой для данного взаимодействия, указано ниже.
B) Конструкция молекулы слияния МАК-jun
Примененные здесь методики, если нет других указаний, были заимствованы из Maniatis et al. (Laboratory Manual EMBL (1082), Гейдельберг, и Sambrook (Molecular Cloning: A Laboratory Manual).
Стадия 1
C-ген IgG3 человека получают из банка генов человека в фагах EMBL3 (A.M. Fritschauf et al. J. Mol. Biol. 170, 827-842, 1983 и G.H.A. Seemann et al. The EMBO Journal 5, 547-552, 1986). Из C-гена IgG3, как описано в заявке на патент ФРГ P 3825615.0, получают конструкцию (D), которая содержит CH1-экзон и первый экзон шарнирной области (Ninge) IgG3 C-гена (фиг.14).
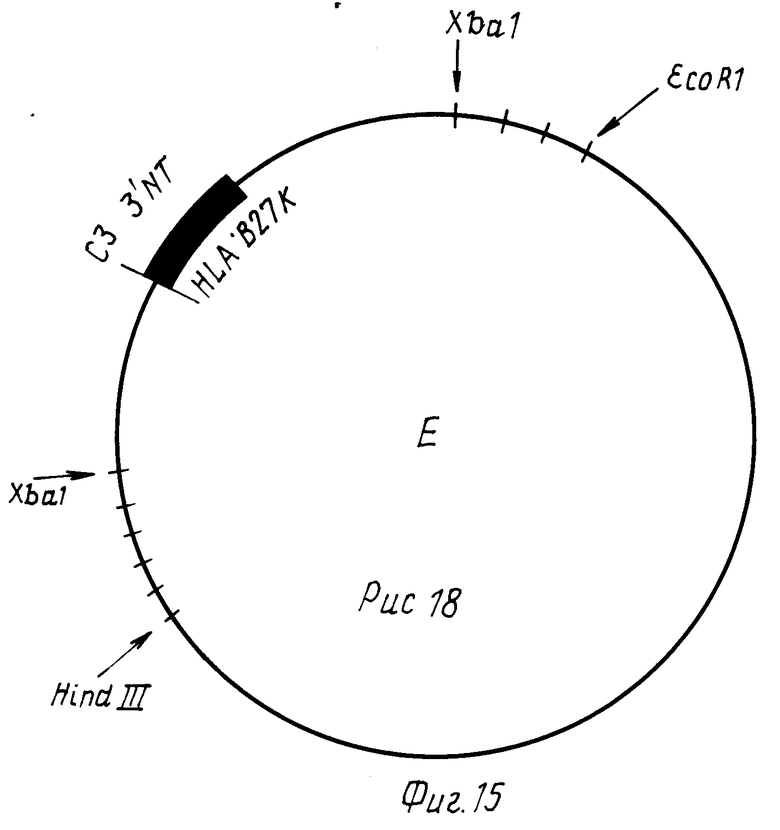
Из такого же банка генов, как описано в заявке на патент ФРГ P 3825615.0, получают HLA B27k ген. Из HLA B 27k гена получают конструкцию (E), которая содержит C3 экзон и 3' NT область HLA B 27k гена (фиг.15).
Стадия 2
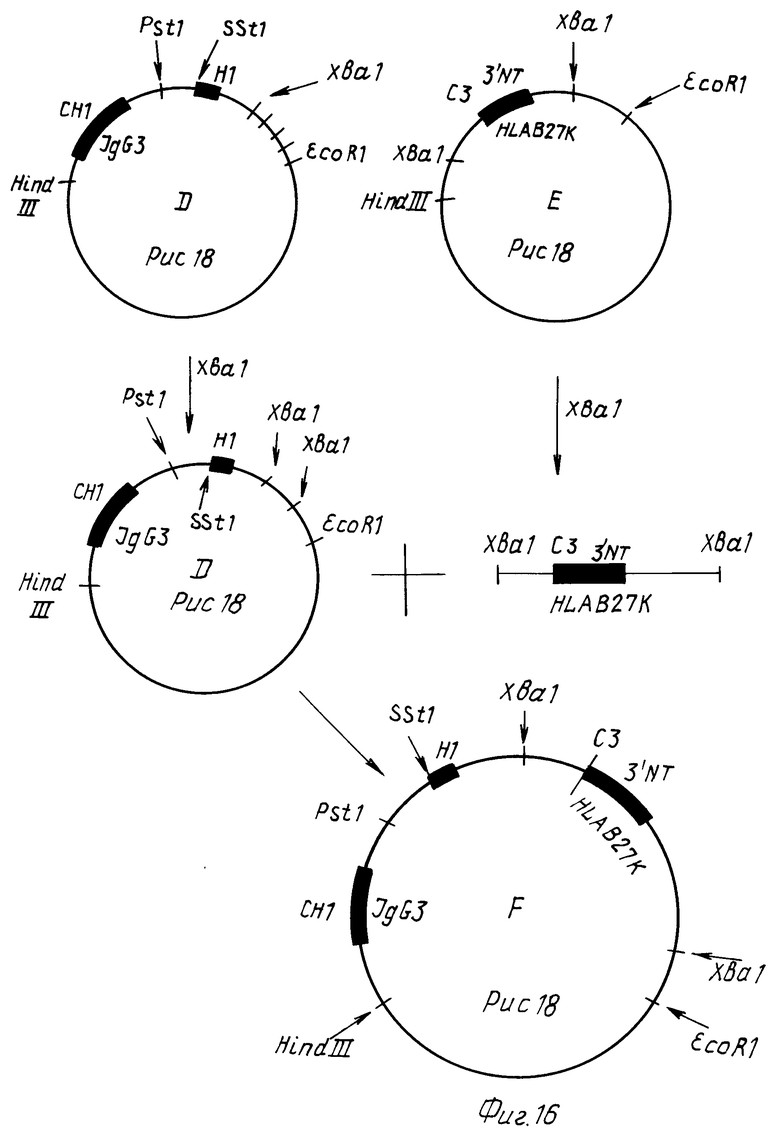
C1-экзон с 3' NT областью HLA B27k гена вырезают с помощью Xbal из плазмиды E, выделяют фрагмент и клонируют по Xba-сайту. Путем секвенирования идентифицируют клон F, который содержит C3-экзон и 3' NT область HLA B27c гена в правильной 5'-3' ориентации от 3'-конца фрагмента C-гена IgG3 (фиг. 16).
Стадия 3
Вставку клона F вырезают с помощью эндонуклеаз Hind 111 и EcoRl и клонируют между Hind 111 и EcoRl-сайтами в двуцепочечный геном M13mp18. Выделяют фаговый клон G, который содержит антитело/HLA фрагмент слияния (фиг. 17).
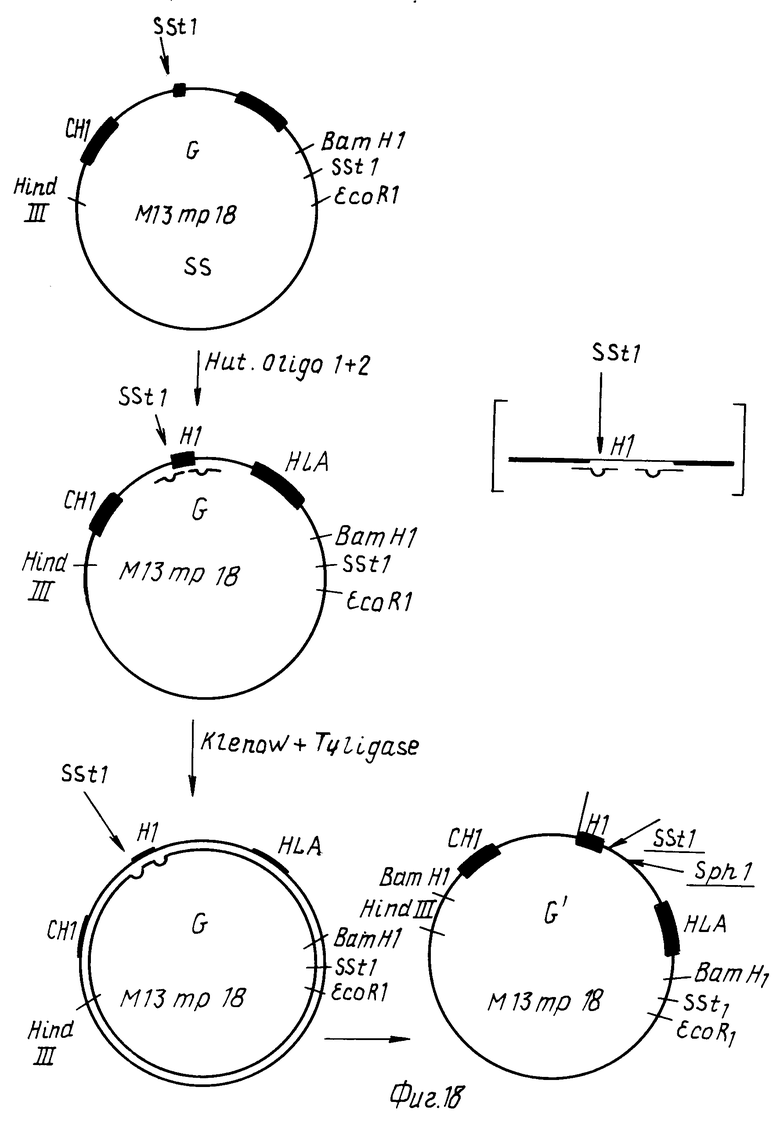
Стадия 4
Из фагового клона Q по методу T. A. Kunkel, 1985, Proc. Natl. Acad Science США, 82, 488-492, получают однонитевые петли, которые гибридизуют с мутагенными олинонуклеотидами 1 и 2 (табл.9) и промежутки между олигонуклеотидами заполняют ДНК полимеразой Кленова и T4-лигазой. После трансформации E.coli путем секвенирования идентифицируют фаговый клон (G), у которого сайт Sst 1 на 5'-конце Hinge-экзона делетирован. Одновременно на 3'-конце Hinge-экзона вводят Sst 1 и Sph 1-сайты (фиг.18). Для делетирования Sst 1-сайта третье основание 2-го кодона Hinge-экзона C превращают в G, а для введения Sst1- и Sph1-сайтов между 15-м и 16-м кодоном Hinge-экзона вводят последовательность 5' GAGCTGGGGGCA3' (табл.10).
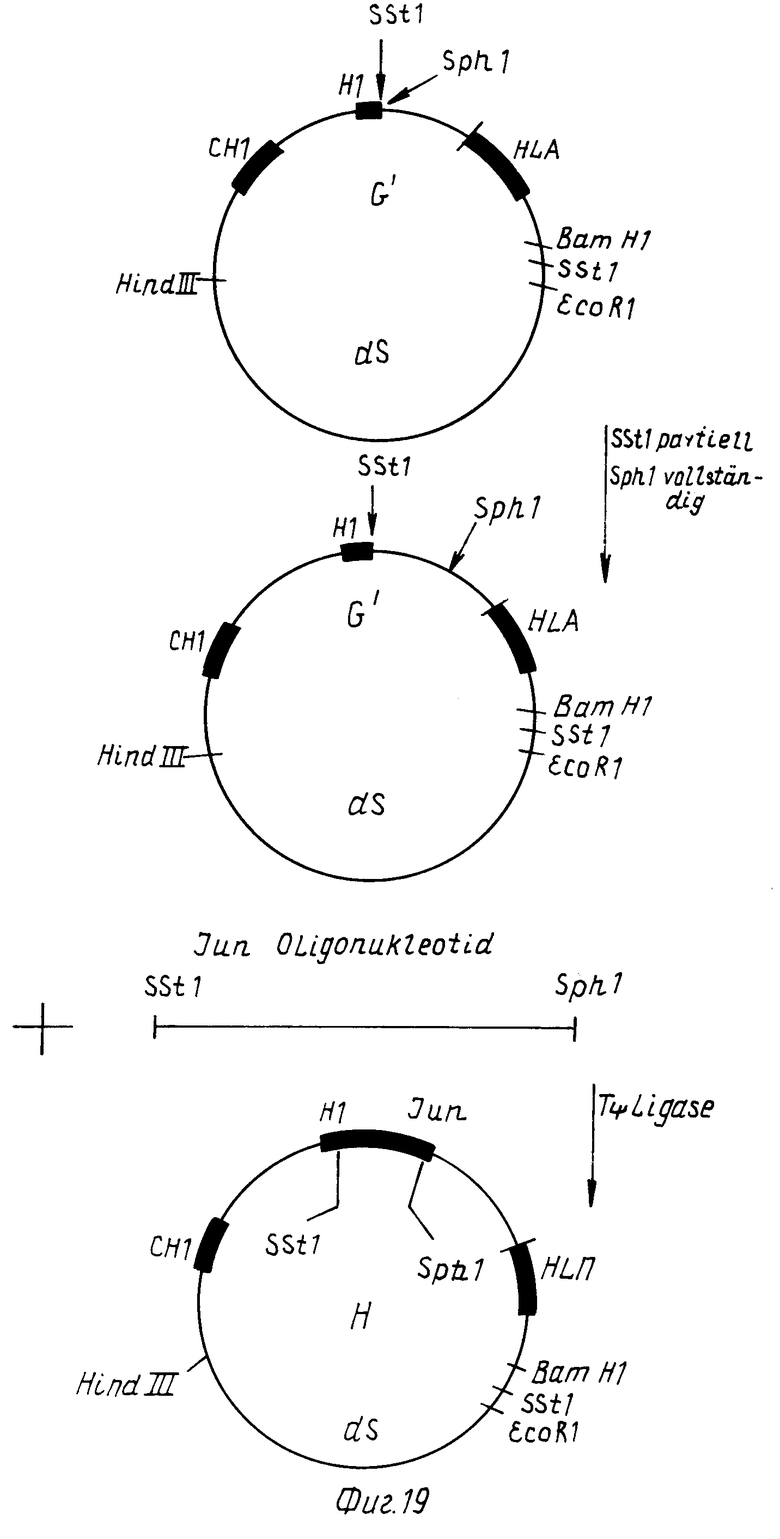
Стадия 5
Двуцепочечную ДНК фагового клона G' расщепляют полностью Sph 1 и частично с помощью Sst 1. Синтетические олигонуклеотиды Jun 1 и Jun 11 (табл. 11) соединяют с двуцепочечной ДНК фрагмента, который на своих концах содержит по расщепленному Sph1- и Sst 1-сайту кодирует пептид Jun-лейцин (O'Shea et al. Science, 245, 646-648, 1989).
Двуцепочечный ДНК-фрагмент клонируют по Sst1- и Sph1-сайтам в F' фаговом клоне и идентифицируют фаговый клон H, содержащий генную конструкцию, у которой в Hinge-экзон встроена последовательность Jun-пентида (фиг. 19).
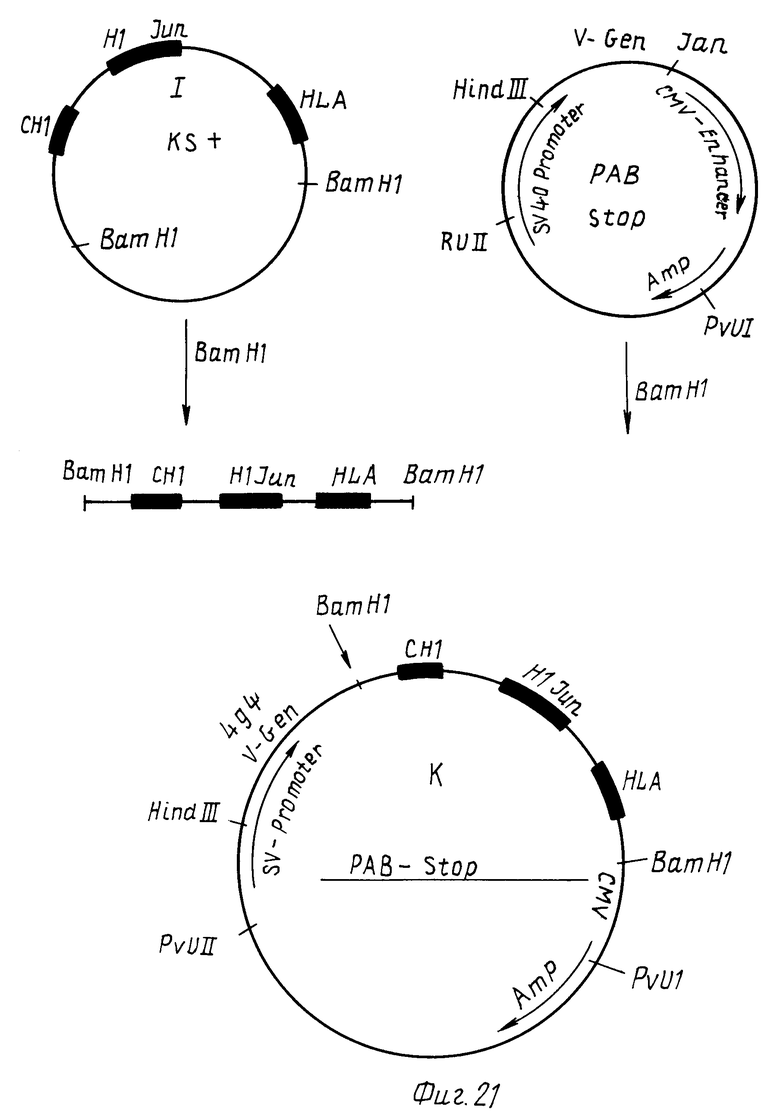
Стадия 6
Двуцепочечную вставку фага H вырезают с помощью эндонуклеаз Hind 111 и EcoR1, концы достраивают T4 полимеразой и клонируют в расщепленную SmaI плазмиду KsF (Stratagene, 11099 North Torrey Pines Road, La Jolla California 92037). Идентифицируют плазмидой клон H, содержащий ген слияния антитело /Jub/HLA в такой ориентации (фиг.20), когда он по обоим сторонам фланкирован BamHl-сайтом.
Стадия 7
Ген слияния антитело /Jun/HLA вырезали BamHI из клона KSI и клонируют в экспрессионной плазмиде pABstop (Берингверке АГ), которая содержит специфический функциональный V-ген иммуноглобулина. Специфический V-ген получают, как описано в заявке на патент P 3209799.4. Идентифицируют экспрессионную плазмиду K, которая содержит конструкцию гена слияния антитело /Jun/HLA в правильной ориентации за VH геном (фиг.21).
Котрансформация плазмиды K с плазмидой, содержащей ген для легкой цепи специфического МАК, и плазмидой, имеющей ген резистентности, приводит к экспрессии специфического F(ab') 2 фрагмента антитела, который в шарнирной области содержит два Jun-пептида, причем Jun-пептид изменен таким образом, что больше не происходит никакого образования гомодимеров (Jun/Jun).
Пример 6. Оптимизация количества би- или олигоспецифического антитела, воздействующего на опухоль, и минимизация его содержания в крови или нормальных тканях.
Научные исследования показали, что проникновение в твердые опухоли макромолекул с мод. массой > 50 кДа происходит медленно, и в большинстве случаев оно происходит только по краю опухоли или на ее незначительных участках. Эти исследования основаны на однократных инъекциях небольших количеств макромолекул. В противоположность этому авторы обнаружили, что благодаря повторным внутривенным инъекциям больших количеств би- или олигоспецифических антител (10 x 250 мг антитела/мышь за 10 дней) возможно значительное проникновение их во всю опухолевую массу у привитых голых мышей. Затем би- или олигоспецифические антитела благодаря своей специфической связи с опухолевыми антигенами длительное время (>20 дней) в больших количествах фиксированными на оболочке клеток опухоли и в интерстиции опухоли. Эти данные были получены при окрашивании щелочной фосфатазой хранимых на холоде тонких срезов привитых опухолей толстой кишки и поджелудочной железы человека.
В течение этого времени (уже после 10 дней) молекулы би- или олигоспецифических антител выводятся из нормальных тканей и крови. Чтобы ускорить этот процесс, антиидиотипические МАК (анти Id), которые реагируют только с опухолевоспецифическим участком несвязанных би- или олигоспецифических антител, вводят внутривенно (1x50 мг анти Id), через 24 ч после окончания 10-й инъекции би- или олигоспецифических антител. Эта одноразовая инъекция способствует ускоренному выведению несвязанных молекул би- или олигоспецифических антител из крови и более быстрому метаболизму их в печени и селезенке.
С учетом изложенного инъекция комплексона (ЕДТА-У90) может происходить уже через 4 дня после окончания фазы проникновения и связывания би- или олигоспецифического антитела. На основании описанных исследований выводят следующую схему лечения (для голых мышей):
a) 1-10 день, внутривенная инъекция по 1 x 250 мг би- или олигоспецифического антитела,
b) 11-й день, внутривенная инъекция 1 x 50 мг анти Id,
c) 14-й день, внутривенная инъекция терапевтической дозы ЕДТА-У90.
На основании сравнительных иммуносцинтиграфических данных для голых мышей и пациентов с опухолями эту схему следует применять также для лечения опухолей у человека. Правда, в этом случае для инъекций используют другие количества препаратов, например, 10x5-10 г биспецифического антитела и 1x1 г анти-ld. Инъекция анти-Id для терапии не обязательна.
Приложение 1а
Количественное торможение в ELISA для МАК и ДТРА- или ЕДТА-комплексов
Материал: 96-луночные полистироловые микропланшеты для тестирования (U-форма) типа B, фирма Нунк, N 4-60445
1) В каждую лунку вносят из пипетки 50 мл У бензил-ДТА-HSA 19-конъюгата с концентрацией 2 мг конъюгата на 1 мл PBS, pH 7,2 и инкубируют в течение ночи при комнатной температуре (RT).
2) Надосадочную жидкость отсасывают и промывают три раза 0,05-молярным буферным раствором трис-цитрата, pH 7,4 (промывной раствор 1), (однократная промывка 250 мл раствора на лунку, 2 мин выдержки, отсасывание).
3) Если микропланшет не используют сразу, его выдерживают в течение ночи на целлюлозе при комнатной температуре (лунками вниз). После этого планшет заваривают в пленку. В таком виде планшеты остаются устойчивыми при +4oC по меньшей мере 8 недель.
4) 250 мл блок-раствора вносят в каждую лунку и инкубируют 30 мин при 37oC.
5) Во время блокирования происходит предварительная инкубация разбавленной надосадочной жидкости гибридомы с конкурентом.
6) 50 мл испытываемых, соответственно предварительно разбавленных и предварительно инкубированных надосадочных жидкостей гибридомы, вносят в каждую лунку и инкубируют 30 мин при комнатной температуре.
7) Затем промывают трижды раствором указанным в 2).
8) После этого 50 мл разбавленных в блок-растворе в соотношении 1:500, маркированных щелочной фосфатазой антител козы IgG-антитедам мыши вносят в каждую и инкубируют 30 мин при комнатной температуре.
9) Данные трижды промывают раствором для Enzygnost.
10) Затем добавляют 50 мл 0,1 мкмоля NADP (амидадениндинуклеотидфосфата никотиновой кислоты).
11) После этого инкубируют 30 мин при комнатной температуре.
12) После инкубирования с NADP составляет закрепляющий раствор следующим образом.
На один планшет используют 2 части INT и 1 часть PBS, pH 7,2, затем добавляют из пипетки 1 часть диафоразы, потом 1 часть АДН.
13) В каждую лунку добавляет 50 мл закрепляющего раствора.
14) При отчетливом изменении окраски от прозрачной до красной реакцию прекращают при помощи 100 мл 0,1-нормального раствора H2SO4 на одну лунку.
15) Измеряют поглощение при 492 нм в ТИТЕРТЕКR МУЛЬТИСКАН. В качестве контрольной величины используют поглощение 50 мл NADP с 50 мл закрепляющего раствора и 100 мл 0,1-нормальной H2SO4.
NADP фирма Сигма компонент N 0505
INT фирма Сигма компонент N 1-8377
АДН фирма Сигма компонент N А-3263
ДИАФОРАЗА фирма Сигма компонент N D-2381
Промывочный раствор фирма Беринг компонент N OSEW 96, содержит Твин, PBS
Блокирующий раствор:
PBS, pH 7,2, получают добавкой казеина и 30-минутным перемешиванием 3% -ного казеина и регулированием pH до 7,4. После этого частицы 10' центрифугируют при 4000 оборотов/мин.
Разбавленное маркированной щелочной фосфатозой антитела козы к IgG-антителу мыши (фирма Souuthern Biotechnology Associates, Cat. N 1090-04).
Получение 0,1 мМ NADP:
7,85 мг NADP растворяют в 100 мл 20 мМ трис, 0,1 мМ MdSO4, pH 9,5, раствор можно хранить при -20oC несколько месяцев.
Получение INT (P-йодо-нитротетразол фиолетовый):
2,5 мг/мл 30% -ного этанола растворяют в ультразвуковой ванне, всегда составляют свежую смесь.
Получение диафоразы:
1 мг диафоразы/мл PBS, pH 7,2 хранят порциями при -20oC.
Получение алкогольдегидрогеназы:
0,5 мг АДН/мл PBS, pH 7,2, хранят порциями при -20oC.
Приложение 1б
Предварительное инкубирование надосадочной жидкости гибридома с конкурентом
Определение концентрации IgG мыши в надосадочных жидкостях гибридом можно проводить при помощи имевшихся в продаже количественных ELISA-тест-систем.
На основании определения концентрации IgG в надосадочные жидкости гидридом разбавляет до 1,25 мг/мл в PBS без Ca++ и Mg++
Пересчет граммов в моли:
150000 г 1 моль МАК
1,25 x 10 г x Моль
1,25 мг х 8,3310 моль
Чтобы получить отношение 1+1 МАК и ингибитора, к 50 мл надосадочной жидкости гибридом с концентрацией 8,33 x 10 мол/мл добавляет 10 мл ингибитора с концентрацией, которая в 5 раз превышает концентрацию 8,33 x 10-12 моль/200 мл.
Надосадочную жидкость гибридомы инкубируют со 100000-кратным, 50000-кратным, 10000-кратным, 5000-кратным, 1000-кратным и 100-кратным избытком конкурента для 30' при комнатной температуре. 50 мл данного раствора закапывает пипеткой в лунки микропланшета при осуществлении ELISA (см. приложение 1а, пункт 6).
Приложение 1в
Получение ДТРА- или ЕДТА-комплексов
Константа аффинности ДТРА или ЕДТА к приведенным в табл.1 ионам металлов крайне высокая, так что при эквимолярной смеси ДТРА или ЕДТА с этими ионами металлов можно ожидать полного насыщения. Поэтому соответствующие ионы металлов инкубируют с 3-кратным избытком ДТРА или ЕДТА. Например, 170 мл 10 мМ раствора сульфата кадмия в бидистиллированной воде инкубируют для 5' при комнатной температуре. Добавление 10 мл этого конкурентного раствора к надосадочной жидкости гибридомы приводит к 100000-кратному избытку конкурента над содержащимися в надосадочной жидкости гибридома МАК. Более низкие отношения конкурента к МАК достигаются в результате того, что раствор конкурента в соответствии с требуемым молярным избытком (см. приложение 1б) разбавляют в соответствующем растворе ионов соли.
Приложение 1в
Количественный торможением в ELISA для МАК и ЭТРА или ЕДТА
Молярный избыток конкурента, который приводит к 50% торможения связывания с антигеном на твердой фазе, дан в табл. 1 3.
Приложение 1г
Источники и соответствующе физико-химические параметры используемых ионов металлов.
Из следующих ионов металлов получали 10-молярные растворы в бидистиллированной воде:
Хлористый марганец MG 161,88; фирма "Мерк" N 5934 ионный радиус Mn: 80 pm
Сульфат кадмия MG 256,5; фирма "Ридель де Гаен" N 31145 ионный радиус Cd: 97 pm
Хлористый цинк MG 136,28; фирма "Мерк" N 8816 ионный радиус Zn: 74 pm
Сульфат меди MG 159,61; фирма "Ридель де Гаен" N 31294 ионный радиус Cu: 96 pm
Хлористый иттрий MG 303,36; фирма "Альдрих" N 20,491-9 ионный радиус Y: 92 pm
Нитрат свинца (11) MG 331,20; фирма "Ридель де Гаен" N 31137 ионный радиус Pb: 120 рм.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ ДИМЕРНОГО ОДНОЦЕПОЧЕЧНОГО СЛИТОГО БЕЛКА (ВАРИАНТЫ) | 1993 |
|
RU2128709C1 |
| КОМПОЗИЦИЯ И СПОСОБ ДЛЯ ИММУНИЗАЦИИ, СПОСОБ ПРОДУЦИРОВАНИЯ НЕПРИРОДНОГО УПОРЯДОЧЕННОГО И ПОВТОРЯЮЩЕГОСЯ МАССИВА АНТИГЕНОВ | 2002 |
|
RU2438701C2 |
| КОМПОЗИЦИЯ И СПОСОБ ДЛЯ ИММУНИЗАЦИИ, СПОСОБ ПРОДУЦИРОВАНИЯ НЕПРИРОДНОГО, УПОРЯДОЧЕННОГО И ПОВТОРЯЮЩЕГОСЯ МАССИВА АНТИГЕНОВ | 2002 |
|
RU2294211C2 |
| КОМПОЗИЦИЯ И СПОСОБ ДЛЯ ИММУНИЗАЦИИ, СПОСОБ ПРОДУЦИРОВАНИЯ НЕПРИРОДНОГО, УПОРЯДОЧЕННОГО И ПОВТОРЯЮЩЕГОСЯ МАССИВА АНТИГЕНОВ И ОБОЛОЧЕЧНЫЙ БЕЛОК | 2002 |
|
RU2295973C2 |
| БИСПЕЦИФИЧЕСКИЕ АНТИТЕЛА | 2011 |
|
RU2573588C2 |
| СПОСОБ ПОЛУЧЕНИЯ АНТИГЕН-СВЯЗЫВАЮЩЕГО ДОМЕНА V ИСПОЛЬЗОВАНИЕ | 2005 |
|
RU2398882C2 |
| БИСПЕЦИФИЧЕСКИЕ ДВУХВАЛЕНТНЫЕ АНТИТЕЛА АНТИ-VEGF/АНТИ-ANG-2 | 2011 |
|
RU2597973C2 |
| ПОЛИВАЛЕНТНАЯ АНТИГЕН-СВЯЗЫВАЮЩАЯ FV-МОЛЕКУЛА | 2011 |
|
RU2613368C2 |
| АНТИТЕЛА, НЕ СОДЕРЖАЩИЕ FC-ФРАГМЕНТА, ВКЛЮЧАЮЩИЕ ДВА FAB-ФРАГМЕНТА, И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2012 |
|
RU2617970C2 |
| Вирус-кодируемые регулируемые агенты, связывающие T-клетки (CATVERT) или NK-клетки (CATVERN), нацеленные на рак | 2020 |
|
RU2827779C2 |














Использование: изобретение относится к биспецифическим и олигоспецифическим, моно- и олиговалентным рецепторам, которые получают методом генетической инженерии, и может быть использовано в биотехнологической промышленности. Сущность изобретения: фрагменты геонов одного или двух антител, кодирующих вариабельные и первые константные домены тяжелых цепей, слитых с помощью jun-пептида, при необходимости соединяют с помощью линкера и совместно с генами легких цепей встраивают в вектор экспрессии, которым трансформируют клетки миеломы. Выращивают полученные трансфектомы в подходящей питательной среде и выделяют целевой продукт из культуральной жидкости. 2 з.п. ф-лы, 11 табл., 22 ил.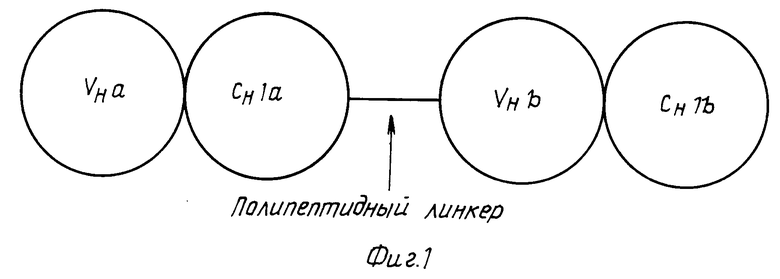
Авторы
Даты
1997-11-20—Публикация
1990-06-21—Подача