Данное изобретение относится к биспецифическим антителам, способам их получения, фармацевтическим композициям, содержащим указанные антитела, и к их применению.
Уровень техники
В последнее время был разработан широкий спектр форматов полиспецифических рекомбинантных антител, например, четырехвалентных биспецифических антител, например, путем слияния антитела формата IgG и одноцепочечных доменов (см., например, Coloma, M.J., et al., Nature Biotech 15 (1997) 159-163; WO 2001/077342; и Morrison, S.L., Nature Biotech. 25 (2007) 1233-1234).
Кроме того, было разработано несколько других новых форматов, в которых больше не сохраняется центральная структура антитела (IgA, IgD, IgE, IgG или IgM), например димерные, тримерные или тетрамерные антитела, миниантитела, несколько одноцепочечных форматов (scFv, Bis-scFv), которые способны связывать два или более двух антигенов (Holliger, P., et al., Nature Biotech 23 (2005) 1126-1136; Fischer, N., Leger O., Pathobiology 74 (2007) 3-14; Shen, J., et at., Journal of Immunological Methods 318 (2007) 65-74; Wu, С., et al., Nature Biotech. 25 (2007) 1290-1297).
Все эти форматы используют линкеры либо для слияния центральной структуры антитела (IgA, IgD, IgE, IgG или IgM) с другим связывающим белком (например, scFv), либо для слияния, например, двух Fab-фрагментов или scFv (Fischer N., Leger О., Pathobiology 74 (2007) 3-14). Следует иметь в виду, что можно сохранить эффекторные функции, такие как, например, комплемент-зависимую цитотоксичность (CDC) или антитело-зависимую клеточную цитотоксичность (ADCC), которые опосредованы Fc-рецепторным связыванием, сохраняя высокую степень сходства с природными антителами.
В WO 2007/024715 сообщается об иммуноглобулинах с двойственным вариабельным доменом, полученных путем генной инженерии в виде поливалентных и полиспецифичных связывающих белков. Процесс получения биологически активных димеров антител представлен в патенте США 6897044. Многовалентные Fv-конструкции антител, имеющие по меньшей мере четыре вариабельных домена, которые связаны друг с другом через пептидные линкеры, представлены в патенте США 7129330. Димерные и мультимерные структуры, связывающие антиген, представлены в патенте США 2005/0079170. В патенте США 6511663 представлен трех- или четырехвалентный моноспецифический антигенсвязывающий белок, содержащий три или четыре Fab-фрагмента, связанных друг с другом ковалентно с помощью связывающей структуры, при этом белок не является природным иммуноглобулином. В патенте WO 2006/020258 представлены четырехвалентные биспецифические антитела, которые могут эффективно экспрессироваться в прокариотических и эукариотических клетках, и могут быть использованы в терапевтических и диагностических способах. В патенте США 2005/0163782 представлен способ разделения или преимущественно синтеза димеров, которые связаны по меньшей мере одной межцепочечной дисульфидной связью, из димеров, которые не связаны по меньшей мере одной межцепочечной дисульфидной связью, из смеси, содержащей два типа полипептидных димеров. В патенте США 5959083 представлены биспецифические четырехвалентные рецепторы. В патенте WO 2001/077342 представлены созданные путем генной инженерии антитела с тремя или более чем тремя функциональными сайтами связывания антигена.
В патенте WO 1997/001580 представлены полиспецифические и поливалентные антигенсвязывающие полипептиды. В патенте WO 1992/004053 представлены гомоконъюгаты, как правило, полученные из моноклональных антител класса IgG, ковалентно связанных путем синтетического сшивания, которые связываются с одной и той же антигенной детерминантой. В патенте WO 1991/06305 представлены олигомерные моноклональные антитела с высокой авидностью к антигену, как правило, класса IgG, которые секретируются в виде двух или более чем двух иммуноглобулиновых мономеров, связанных вместе для формирования четырехвалентных или шестивалентных молекул IgG. В патенте США 6350860 представлены антитела, полученные от овец, и конструкции антител, полученные путем генной инженерии, которые могут быть использованы для лечения заболеваний, при которых активность гамма-интерферона является патогенной. В патенте США 2005/0100543 представлены целевые конструкции, которые являются поливалентными носителями биспецифических антител, т.е. каждая молекула целевой конструкции может служить носителем двух или более чем двух биспецифических антител.
В патенте WO 1995/009917 представлены генно-инженерные биспецифические четырехвалентные антитела. В патенте WO 2007/109254 представлены стабилизированные связывающие молекулы, состоящие из или содержащие стабилизированные scFv.
О биспецифических антителах против EGFR и IGF-1R известно из Lu, D., et al., Biochemical and Biophysical Research Communications 318 (2004) 507-513; Lu, D., et al., J. Biol. Chem., 279 (2004) 2856-2865; и Lu, D., et al., J. Biol Chem. 280 (2005) 19665-72.
Патент США 2007/0274985 относится к синтетическим молекулам антител, содержащим одноцепочечные белки Fab (scFab), которые также могут быть связаны сдимерами, включая гетеромерные антитела, в которых по меньшей мере две одноцепочечные молекулы антител ассоциированы друг с другом.
Патент WO 2009/080253 относится к биспецифическим двухвалентным антителам.
Тем не менее, в силу различных проблем и аспектов мультиспецифических антител (таких как, например, фармакокинетические и биологические свойства, стабильность, агрегация, выход экспрессии, побочные продукты), существует необходимость других альтернативных форматов полиспецифических антител.
Сущность изобретения
В одном аспекте изобретение относится к биспецифическому антителу, содержащему
а) тяжелую цепь и легкую цепь первого антитела полной длины, которое специфически связывается с первым антигеном;
б) тяжелую цепь и легкую цепь второго антитела полной длины, которое специфически связывается со вторым антигеном, где М-конец тяжелой цепи связан с С-концом легкой цепи через пептидный линкер.
В другом аспекте изобретения биспецифическое антитело в соответствии с изобретением также характеризуется тем, что
СН3-домен тяжелой цепи антитела полной длины а) и СН3-домен тяжелой цепи антитела полной длины б) встречаются на контактной поверхности, которая включает изменение в исходной контактной поверхности между СН3-доменами антитела;
где i) в СН3-домене одной тяжелой цепи
аминокислотный остаток заменен аминокислотным остатком с боковой цепью большего объема и создает тем самым выступ в контактной поверхности СН3-домена одной тяжелой цепи, которая размещается в полости на контактной поверхности СН3-домена другой тяжелой цепи,
и где
ii) в СН3-домене другой тяжелой цепи
аминокислотный остаток заменен аминокислотным остатком с боковой цепью меньшего объема и создает тем самым полость в контактной поверхности второго СН3-домена, в которой размещается выступ на контактной поверхности первого СН3-домена.
В другом аспекте биспецифическое антитело в соответствии с изобретением характеризуется тем, что
оба СН3-домена далее изменены путем введения цистеина (С) в качестве аминокислоты в соответствующих позициях каждого СН3-домена таким образом, чтобы между двумя СН3-доменами мог быть сформирован дисульфидный мостик.
В другом аспекте изобретения биспецифическое антитело в соответствии с изобретением характеризуется тем, что
вариабельный домен тяжелой цепи антитела (VH) и вариабельный домен легкой цепи антитела (VL) тяжелой и легкой цепей второго антитела полной длины б) являются дисульфид-стабилизированными за счет введения дисульфидных связей между следующими позициями:
i) позицией 44 вариабельного домена тяжелой цепи и позицией 100 вариабельного домена легкой цепи,
ii) позицией 105 вариабельного домена тяжелой цепи и позицией 43 вариабельного домена легкой цепи, или
iii) позицией 101 вариабельного домена тяжелой цепи и позицией 100 вариабельного домена легкой цепи.
В другом аспекте изобретения биспецифическое антитело в соответствии с изобретением характеризуется тем, что
а) первое антитело полной длины специфически связывается с IGF-1R и включает тяжелую цепь с аминокислотной последовательностью SEQ ID №1 и легкую цепь с аминокислотной последовательностью SEQ ID №2, и
б) второе антитело полной длины специфически связывается с EGFR и включает тяжелую цепь, связанную с легкой цепью через пептидный линкер, где указанные тяжелая и легкая цепи, связанные пептидом, имеют аминокислотную последовательность SEQ ID №3.
В другом аспекте изобретения биспецифическое антитело в соответствии с изобретением характеризуется тем, что
а) первое антитело полной длины специфически связывается с IGF-1R и включает тяжелую цепь с аминокислотной последовательностью SEQ ID №1 и легкую цепь с аминокислотной последовательностью SEQ ID №2 и
б) второе антитело полной длиной специфически связывается с EGFR и включает тяжелую цепь, связанную с легкой цепью через пептидный линкер, где указанные тяжелая и легкая цепи, связанные пептидом, имеют аминокислотную последовательность SEQ ID №4.
В другом аспекте изобретения биспецифическое антитело в соответствии с изобретением характеризуется тем, что
а) первое антитело полной длины специфически связывается с EGFR и включает тяжелую цепь с аминокислотной последовательностью SEQ ID №5 и легкую цепь с аминокислотной последовательностью SEQ ID №6,
б) второе антитело полной длиной специфически связывается с IGF-1R и включает тяжелую цепь, связанную с легкой цепью через пептидный линкер, где указанные тяжелая и легкая цепи, связанные пептидом, имеют аминокислотную последовательность SEQ ID №7.
В другом аспекте изобретения биспецифическое антитело в соответствии с изобретением характеризуется тем, что
а) первое антитело полной длины специфически связывается с EGFR и включает тяжелую цепь с аминокислотной последовательностью SEQ ID №5 и легкую цепь с аминокислотной последовательностью SEQ ID №6,
б) второе антитело полной длиной специфически связывается с IGF-1R и включает тяжелую цепь, связанную с легкой цепью через пептидный линкер, где указанные тяжелая и легкая цепи, связанные пептидом, имеют аминокислотную последовательность SEQ ID №8.
В другом аспекте изобретения биспецифическое антитело в соответствии с изобретением характеризуется тем, что антитело содержит константную область IgG1.
В другом аспекте изобретения биспецифическое антитело в соответствии с изобретением характеризуется тем, что антитело гликозилировано сахарной цепью на Asn297, где количество фукозы в сахарной цепи составляет 65% или ниже.
Кроме того, другими аспектами изобретения являются фармацевтическая композиция, содержащая указанное биспецифическое антитело, указанная композиция для лечения рака, применение указанного биспецифического антитела для изготовления лекарственного средства для лечения рака, способ лечения пациентов, страдающих от рака, путем введения указанного биспецифического антитела пациенту, нуждающемуся в таком лечении.
Еще один аспект изобретения представляет собой молекулу нуклеиновой кислоты, кодирующую цепь биспецифического антитела в соответствии с изобретением.
Кроме того, изобретение предусматривает экспрессионные векторы, содержащие указанную нуклеиновую кислоту в соответствии с изобретением, способные экспрессировать указанную нуклеиновую кислоту в прокариотической или эукариотической клетке-хозяине, и клетки-хозяева, содержащие такие векторы, для рекомбинантной продукции биспецифического антитела в соответствии с изобретением.
Кроме того, изобретение включает прокариотическую или эукариотическую клетку-хозяина, содержащую вектор в соответствии с изобретением.
Кроме того, изобретение включает способ получения биспецифического антитела в соответствии с изобретением, который характеризуется экспрессией нуклеиновой кислоты в соответствии с изобретением в прокариотической или эукариотической клетке-хозяине и извлечением указанного биспецифического антитела из указанной клетки или из супернатанта клеточной культуры. Кроме того, изобретение включает антитело, полученное таким способом, для производства биспецифического антитела.
Другим аспектом изобретения является способ получения биспецифического антитела в соответствии с изобретением, включающий этапы
а) трансформации клетки-хозяина векторами, содержащими нуклеиновокислотные молекулы, кодирующие
аа) тяжелую цепь и легкую цепь первого антитела полной длины, которое специфически связывается с первым антигеном; и
аб) тяжелую цепь и легкую цепь второго антитела полной длины, которое специфически связывается со вторым антигеном, где N-конец тяжелой цепи связан с С-концом легкой цепи через пептидный линкер;
б) культивирования клетки-хозяина в условиях, обеспечивающих синтез указанной молекулы антитела; и
в) извлечения указанной молекулы антитела из указанной культуры.
Было обнаружено, что биспецифические антитела в соответствии с изобретением обладают ценными характеристиками, такими как хороший выход экспрессии в клетках млекопитающих (например, HEK293- и СНО-клетках), стабильность, биологическая или фармакологическая активность, фармакокинетические свойства. Они могут быть использованы, например, для лечения таких заболеваний как рак. Эти биспецифические антитела в соответствии с изобретением, содержащие три полипептидные цепи, имеют профиль ценного побочного продукта при экспрессии в клетках млекопитающих.
Описание графических материалов
Фиг.1. Схематическая структура антитела полной длины без домена СН4, которое специфически связывается с первым антигеном 1 с двумя парами тяжелых и легких цепей, которые содержат вариабельные и константные домены в типичном порядке.
Фиг.2. Схематическая структура биспецифического антитела в соответствии с изобретением.
Фиг.3а и 3b. Схематическая структура биспецифического антитела в соответствии с изобретением, включающего изменение СН3-доменов типа «ключ-замок».
Фиг.4а и 4b. Схематическая структура биспецифического антитела в соответствии с изобретением, включающего изменение СН3-доменов типа «ключ-замок» и дисульфидную стабилизацию VH- и VL-домена тяжелой и легкой цепи второго антитела.
Фиг.5. Ингибирование пролиферации HUVEC биспецифическим антителом в соответствии с изобретением Ang2-VEGF-OA-Ava-N-scFabLC06.
Фиг.6. Ингибирование фосфорилирования Tie2 биспецифическим антителом в соответствии с изобретением Ang2-VEGF-OA-Ava-N-scFabLC06.
Фиг.7. Вестерн-блот (восст.) OA-Ak18-scFab-GA201 (фиг.7а) и OA-GA201-scFab-Ak18 (фиг.7b).
Фиг.8. Подавление роста раковых клеток Н322М биспецифическим <EGFR-IGF1R> антителом OA-GA201-scFab-Ak18_WT (дозозависимое) по сравнению с родительскими моноспецифическими антителами <IGF-1R> HUMAB клон 18 или<EGFR>ICR62.
Фиг.9. Biacore (поверхностный плазменный резонанс)-сенсограмма: Биспецифическое антитело OA-GA201-scFab-Ak18_WT показало одновременное связывание аминосвязанного человеческого EGFR и человеческого IGF1R (ось абсцисс: ответ, ось ординат: время).
Фиг.10. Подавление роста опухоли на модели с ксенотрансплантатом ВхРС3 антителом OA-GA201-scFab-Ak18_WT по сравнению с комбинацией родительских моноспецифических антител <IGF-1R> HUMAB клон 18 и <EGFR> ICR62.
Подробное описание изобретения
В одном аспекте изобретение относится к биспецифическому антителу, содержащему
а) тяжелую цепь и легкую цепь первого антитела полной длины, которое специфически связывается с первым антигеном;
б) тяжелую цепь и легкую цепь второго антитела полной длины, которое специфически связывается со вторым антигеном, где N-конец тяжелой цепи связан с С-концом легкой цепи через пептидный линкер.
Термин «антитело полной длины» означает антитело, состоящее из двух «тяжелых цепей антитела полной длины» и двух «легких цепей антитела полной длины» (см. фиг.1). «Тяжелая цепь антитела полной длины» представляет собой полипептид, содержащий от N-конца по направлению к С-концу вариабельный домен тяжелой цепи антитела (VH), константный домен 1 тяжелой цепи антитела (СН1), шарнирную область антитела (HR), константный домен 2 тяжелой цепи антитела (СН2) и константный домен 3 тяжелой цепи антитела (СН3), сокращенно VH-CH1-HR-CH2-CH3, и, возможно, константный домен 4 тяжелой цепи антитела (СН4) в случае антитела подкласса IgE. Предпочтительно «тяжелая цепь антитела полной длины» представляет собой полипептид, содержащий от N-конца по направлению к С-концу VH, СН1, HR, СН2 и СН3. «Легкая цепь антитела полной длины» представляет собой полипептид, содержащий от N-конца по направлению к С-концу вариабельный домен легкой цепи антитела (VL) и константный домен легкой цепи антитела (CL), сокращенно VL-CL. Константный домен легкой цепи антитела (CL) может быть к (каппа) или Л (лямбда). Две цепи антитела полной длины связаны друг с другом посредством межполипептидных дисульфидных связей между доменом CL и доменом СН1 и между шарнирными областями тяжелых цепей антитела полной длины. Примерами типичных антител полной длины являются природные антитела, такие как IgG (например, IgG1 и IgG2), IgM, IgA, IgD и IgE. Антитела полной длины в соответствии с изобретением могут быть от одного вида, например, человека, либо они могут быть химерными или гуманизированными антителами. Антитела полной длины в соответствии с изобретением состоят из двух антигенсвязывающих сайтов, каждый из которых образован парой VH и VL, которые специфически связываются с одним и тем же антигеном. С-конец тяжелой или легкой цепи указанного антитела полной длины обозначает последнюю аминокислоту на С-конце указанной тяжелой или легкой цепи. N-конец тяжелой или легкой цепи указанного антитела полной длины обозначает последнюю аминокислоту на N-конце указанной тяжелой или легкой цепи.
Термин «пептидный линкер», используемый в изобретении, обозначает пептид с аминокислотной последовательностью, которая предпочтительно имеет синтетическое происхождение. Эти пептиды в соответствии с изобретением используются для соединения С-конца легкой цепи с N-концом тяжелой цепи второго антитела полной длины (которое специфически связывается со вторым антигеном) через пептидный линкер. Пептидный линкер в рамках тяжелой и легкой цепей второго антитела полной длины представляет собой пептид с аминокислотной последовательностью длиной не менее 30 аминокислот, предпочтительно с длиной от 32 до 50 аминокислот. В одном воплощении пептидный линкер представляет собой пептид с аминокислотной последовательностью длиной от 32 до 40 аминокислот. В одном воплощении указанный линкер представляет собой (GxS)n, где G = глицин, S = серин, (х=3, n=8, 9 или 10 и m=0, 1, 2 или 3) или (х=4 и n=6, 7 или 8, m=0, 1, 2 или 3), предпочтительно х=4, n=6 или 7 и m=0, 1, 2 или 3, более предпочтительно х=4, n=7 и m=2. В одном воплощении указанный линкер представляет собой (G4S)6G2. Предпочтительно СН3-домены биспецифического антитела в соответствии с изобретением могут быть изменены по технологии «ключ-замок», которая подробно описана в нескольких примерах, например, в WO 96/027011, Ridgway J.B., et al., Protein Eng 9 (1996) 617-621; и Merchant, A.M., et al., Nat Biotechnol 16 (1998) 677-681. В этом способе поверхности взаимодействия двух СН3-доменов изменены таким образом, чтобы увеличилась гетеродимеризация обеих тяжелых цепей, содержащих эти два СН3-домена. Каждый из двух СН3-доменов (двух тяжелых цепей) может быть «замком», а другой «ключом». Введение дисульфидного мостика стабилизирует гетеродимеры (Merchant, A.M, et al., Nature Biotech 16 (1998) 677-681; Atwell, S., et al. J. Mol. Biol. 270 (1997) 26-35) и увеличивает выход.
В одном аспекте изобретения биспецифическое антитело в соответствии с изобретением дополнительно характеризуется тем, что
СН3-домен одной тяжелой цепи и СН3-домен другой тяжелой цепи встречаются на контактной поверхности, которая включает исходную контактную поверхность между СН3-доменами антитела;
где указанная контактная поверхность изменена таким образом, чтобы способствовать формированию биспецифического антитела, причем изменение характеризуется тем, что:
а) СН3-домен одной тяжелой цепи изменен таким образом,
что в исходной контактной поверхности СН3-домена одной тяжелой цепи, которая встречается с исходной контактной поверхностью СН3-домена другой тяжелой цепи в биспецифическом антителе,
аминокислотный остаток заменен аминокислотным остатком с боковой цепью большего объема и создает тем самым выступ в контактной поверхности СН3-домена одной тяжелой цепи, которая размещается в полости на контактной поверхности СН3-домена другой тяжелой цепи,
и
б) СН3-домен другой тяжелой цепи изменен таким образом,
что в исходной контактной поверхности второго СН3-домена, который встречается с исходной контактной поверхностью первого СН3-домена в биспецифическом антителе,
аминокислотный остаток заменен аминокислотным остатком с боковой цепью меньшего объема и создает тем самым полость в контактной поверхности второго СН3-домена, в которой размещается выступ на контактной поверхности первого СН3-домена.
Таким образом, антитело в соответствии с изобретением предпочтительно характеризуется тем, что
СН3-домен тяжелой цепи антитела полной длины а) и СН3-домен тяжелой цепи антитела полной длины б) встречаются на контактной поверхности, которая включает изменения в исходной контактной поверхности СН3-доменов антитела;
где i) в СН3-домене одной тяжелой цепи
аминокислотный остаток заменен аминокислотным остатком с боковой цепью большего объема и создает тем самым выступ в контактной поверхности СН3-домена одной тяжелой цепи, которая размещается в полости на контактной поверхности СН3-домена другой тяжелой цепи,
и где
ii) в СН3-домене другой тяжелой цепи
аминокислотный остаток заменен аминокислотным остатком с боковой цепью меньшего объема и создает тем самым полость в контактной поверхности второго СН3-домена, в которой размещается выступ на контактной поверхности первого СН3-домена.
Предпочтительно указанный аминокислотный остаток, имеющий боковую цепь большего объема, выбран из группы, состоящей из аргинина (R), фенилаланина (F), тирозина (Y), триптофана (W).
Предпочтительно указанный аминокислотный остаток, имеющий боковую цепь меньшего объема, выбран из группы, состоящей из аланина (А), серина (S), треонина (Т), валина (V).
В одном аспекте изобретения оба СН3-домена также изменены путем введения цистеина (С) в качестве аминокислоты в соответствующих позициях каждого СН3-домена, так что может быть сформирован дисульфидный мостик между двумя СН3-доменами.
В одном воплощении биспецифическое антитело содержит мутацию T366W в СН3-домене «цепи-ключа» и мутации T366S, L368A, Y407V в СН3-домене «цепи-замка». Также может быть использован дополнительный межцепочечный дисульфидный мостик между СН3-доменами (Merchant, A.M, et al., Nature Biotech 16 (1998) 677-681), например, путем введения мутации Y349C в СН3-домен «цепи-ключа» и мутации Е356С или мутации S354C в СН3-домен «цепи-замка».
В другом воплощении биспецифическое антитело в соответствии с изобретением содержит мутации Y349C, T366W в одном из двух СН3-доменов и мутации Е356С, T366S, L368A, Y407V в другом из двух СН3-доменов. В другом предпочтительном воплощении биспецифическое антитело содержит мутации Y349C, T366W в одном из двух СН3-доменов и мутации S354C, T366S, L368A, Y407V в другом из двух СН3-доменов (дополнительная мутация Y349C в одном СН3-домене и дополнительная мутация Е356С или S354C в другом СН3-домене для формирования межцепочечного дисульфидного мостика) (нумерация всегда в соответствии с ЕС индексом Кабата). Альтернативно или дополнительно также могут быть использованы и другие технологии типа «ключ-замок», описанные в ЕР 1870459А1. Таким образом, другим примером биспецифического антитела являются мутации R409D; K370E в СН3-домене области «цепи-ключа» и мутации D399K; E357K в СН3-домене области «цепи-замка» (нумерация всегда в соответствии с ЕС индексом Кабата).
В другом воплощении биспецифическое антитело содержит мутацию T366W в СН3-домене «цепи-ключа» и мутации T366S, L368A, Y407V в СН3-домене «цепи-замка», и дополнительно мутации R409D; K370E в СН3-домене «цепи-ключа» и мутации D399K; E357K в СН3-домене «цепи-замка».
В другом воплощении биспецифическое антитело содержит мутации Y349C, T366W в одном из двух СН3-доменов и мутации S354C, T366S, L368A, Y407V в другом из двух СН3-доменов, или указанное трехвалентное биспецифические антитело содержит мутации Y349C, T366W в одном из двух СН3-доменов и мутации S354C, T366S, L368A, Y407V в другом из двух СН3-доменов, и дополнительно мутации R409D; K370E в СН3-домене «цепи-ключа» и мутации D399K; E357K в СН3-домене «цепи-замка».
В одном воплощении вариабельный домен тяжелой цепи антитела (VH) и вариабельный домен легкой цепи антитела (VL) тяжелой и легкой цепей второго антитела полной длины (которое специфически связывается со вторым антигеном) являются дисульфид-стабилизированными за счет введения дисульфидной связи между следующими позициями:
i) позицией 44 вариабельного домена тяжелой цепи и позицией 100 вариабельного домена легкой цепи,
ii) позицией 105 вариабельного домена тяжелой цепи и позицией 43 вариабельного домена легкой цепи, или
iii) позицией 101 вариабельного домена тяжелой цепи и позицией 100 вариабельного домена легкой цепи (нумерация всегда в соответствии с ЕС индексом Кабата).
В одном воплощении вариабельный домен тяжелой цепи антитела (VH) и вариабельный домен легкой цепи антитела (VL) тяжелой и легкой цепей второго антитела полной длины (которое специфически связывается со вторым антигеном) являются дисульфид-стабилизированными за счет введения дисульфидной связи между следующими позициями: позицией 44 вариабельного домена тяжелой цепи и позицией 100 вариабельного домена легкой цепи.
Такая дальнейшая дисульфидная стабилизация достигается за счет введения дисульфидной связи между вариабельными доменами VH и VL тяжелой и легкой цепей второго антитела полной длины. Методики введения неприродных дисульфидных мостиков для стабилизации одноцепочечного Fv описаны, например, в WO 94/029350, Rajagopal, V., et al, Prot. Engin. 10 (1997) 1453-59; Kobayashi, H., et al., Nuclear Medicine & Biology, Vol.25, (1998) 387-393; или Schmidt, М., et al., Oncogene (1999) 18, 1711-1721. В одном воплощении возможная дисульфидная связь между вариабельными доменами тяжелой и легкой цепей второго антитела полной длины находится между позицией 44 вариабельного домена тяжелой цепи и позицией 100 вариабельного домена легкой цепи. В одном воплощении возможная дисульфидная связь между вариабельными доменами находится между позицией 105 вариабельного домена тяжелой цепи и позицией 43 вариабельного домена легкой цепей (нумерация всегда в соответствии с ЕС индексом Кабата).
В одном воплощении предпочтительным является биспецифическое антитело в соответствии с изобретением с указанной дополнительной дисульфидной стабилизацией между вариабельными доменами VH и VL тяжелой и легкой цепей второго антитела полной длины.
В одном воплощении предпочтительным является биспецифическое антитело в соответствии с изобретением без указанной дополнительной дисульфидной стабилизации между вариабельными доменами VH и VL тяжелой и легкой цепей второго антитела полной длины.
Обе части биспецифического антитела в соответствии с изобретением содержат антигенсвязывающие сайты (тяжелая и легкая цепи первого антитела полной длины содержат один антигенсвязывающий сайт, и тяжелая и легкая цепи второго антитела полной длины содержат один антигенсвязывающий сайт). Термины «сайт связывания» или «антигенсвязывающий сайт», используемые в данном документе, обозначают область(и) указанного биспецифического антитела в соответствии с изобретением, с которой обычно связывается соответствующий антиген. Каждый из антигенсвязывающих сайтов тяжелой и легкой цепей первого антитела полной длины и тяжелой и легкой цепей второго антитела полной длины сформированы парой, состоящей из вариабельного домена легкой цепи антитела (VL) и вариабельного домена тяжелой цепи антитела (VH).
Антигенсвязывающие сайты, которые связываются с нужным антигеном (например, EGFR) могут быть получены а) из известных антител к антигену (например, анти-EGFR-антител) или б) из новых антител или фрагментов антител, полученных с помощью способов иммунизации de novo с использованием, помимо прочего, антигенного белка или нуклеиновой кислоты или их фрагментов или с помощью фагового дисплея.
Антигенсвязывающий сайт антитела в соответствии с изобретением содержит шесть определяющих комплементарность областей (CDR), которые в разной степени способствуют аффинности сайта связывания и антигена. Существует три CDR вариабельного домена тяжелой цепи (CDRH1, CDRH2 и CDRH3) и три CDR вариабельного домена легкой цепи (CDRL1, CDRL2 и CDRL3). Протяженность CDR и каркасных областей (FR) определяют путем сравнения с базой данных аминокислотных последовательностей, в которых эти области были определены в соответствии с вариабельностью среди последовательностей.
Специфичность антитела относится к селективному распознаванию антителом определенного эпитопа антигена. Природные антитела, например, являются моноспецифическими. Термин «биспецифическое» антитело используемый в данном документе, означает антитело, которое имеет два или более двух антигенсвязывающих сайтов и связывается с двумя различными антигенами или двумя различными эпитопами одного и того же антигена. «Биспецифические антитела» в соответствии с изобретением являются антителами, которые имеют две различных антигенсвязывающих специфичности. В одном воплощении антитела данного изобретения являются биспецифическими для двух различных антигенов, т.е. VEGF в качестве первого антигена и Ang-2 в качестве второго антигена или, например, EGFR в качестве первого антигена и IGF-1R в качестве второго антигена, или наоборот.
Термин «моноспецифическое» антитело, используемый в данном документе, означает антитело, которое имеет один или более чем один сайт связывания, каждый из которых связывается с одним и тем же эпитопом одного и того же антигена.
Термин «валентность», используемый в данной заявке, означает наличие определенного количества сайтов связывания в молекуле антитела. Таким образом, термины «трехвалентный», «четырехвалентный», «пятивалентный» и «шестивалентный» обозначают наличие в молекуле антитела трех сайтов связывания, четырех сайтов связывания, пяти сайтов связывания и шести сайтов связывания, соответственно. Природное антитело, например, или биспецифическое антитело в соответствии с изобретением обладает двумя сайтами связывания и является двухвалентным.
Термин «EGFR», используемый в данном документе, относится к рецептору человеческого эпидермального фактора роста (также известному как HER-1 или Erb-B1, SEQ ID №13), 170 кДа трансмембранному рецептору, кодируемому протоонкогеном с-erbB и демонстрирующему внутреннюю тирозинкиназную активность (Modjtahedi, H., et al., Br. J. Cancer 73 (1996) 228-235; Herbst, R.S., и Shin, DM, Cancer 94 (2002) 1593-1611). Запись в базе данных SwissProt P00533 предусматривает последовательность EGFR. Есть также изоформы и варианты EGFR (например, альтернативные РНК-транскрипты, усеченные версии, полиморфизмы и т.д.), включая те, которые определены записями в базе данных Swissprot №№ Р00533-1, Р00533-2, Р00533-3 и Р00533-4, но не ограничиваясь ими. EGFR, как известно, связывает лиганды, в том числе эпидермальный фактор роста (EGF), трансформирующий фактор роста-α (TGF-амфирегулин, гепарин-связывающий EGF (hb-EGF), бетацеллюлин и эпирегулин (Herbst, R.S., and Shin, D.M., Cancer 94 (2002) 1593-1611; Mendelsohn, J., и Baselga, J., Oncogene 19 (2000) 6550-6565). EGFR регулирует многочисленные клеточные процессы через опосредованные тирозинкиназой пути передачи сигнала, в том числе, но не ограничиваясь этим, активацию путей передачи сигнала, которые контролируют клеточную пролиферацию, дифференцировку, выживание клеток, апоптоз, ангиогенез, митогенез и метастазирование (Atalay, G., et al., Ann. Oncology 14 (2003) 1346-1363; Tsao, A.S., и Herbst, R.S, Signal 4 (2003) 4-9; Herbst, R.S., и Shin, DM, Cancer 94 (2002) 1593-1611; Modjtahedi, H., et al., Br. J. Cancer 73 (1996) 228-235).
Термин «IGF-1R», используемый в данном документе, относится к рецептору человеческого инсулин-подобного фактора роста I (IGF-IR, антиген CD 221; SEQ ID №14), который принадлежит к семейству трансмембранных белков тирозинкиназ (LeRoith, D., et al., Endocrin. Rev. 16 (1995) 143-163; и Adams, Т.Е., et al., Cell. Mol. Life Sci. 57 (2000) 1050-1063). Запись в базе данных SwissProt P08069 предусматривает последовательность IGF-1R. IGF-IR связывает IGF-I с высокой аффинностью и инициирует физиологическую реакцию на этот лиганд in vivo. IGF-IR также связывается с IGF-II, однако с несколько более низкой аффинностью. Сверхэкспрессия IGF-IR способствует опухолевой трансформации клеток, и существует доказательство того, что IGF-IR участвует в злокачественной трансформации клеток и, следовательно, является полезной мишенью для разработки терапевтических агентов для лечения рака (Adams, Т.Е., et al., Cell. Mol. Life Sci. 57 (2000) 1050-1063).
В предпочтительном аспекте изобретения биспецифическое антитело в соответствии с изобретением специфически связывается с человеческим IGF-1R, а также с человеческим EGFR (т.е. биспецифическое антитело в соответствии с изобретением является биспецифическим анти-IGF-1R/анти-EGFR-антителом). Биспецифическое антитело основано на антигенсвязывающих сайтах человека <IGF-1R> HUMAB клон 18 (DSM АСС 2587; WO 2005/005635, сокращенно <IGF-1R> клон 18 или <IGF-1R> AK18) и гуманизированного <EGFR> ICR62 (WO 2006/082515, сокращенно <EGFR> ICR62). Соответствующие аминокислотные последовательности легкой и тяжелой цепей этих биспецифических двухвалентных антител приведены в SEQ ID №1, SEQ ID №2, SEQ ID №3 (для OA-Ak18-scFab-GA201), в SEQ ID №5, SEQ ID №6, SEQ ID №7 (для OA-GA201-scFab-Ak18), в SEQ ID №1, SEQ ID №2, SEQ ID №4 (для OA-Ak18-scFab -GA201_WT), а в SEQ ID №5, SEQ ID №6, SEQ ID №8 (для OA-GA201-scFab-Ak18_WT).
Биспецифические антитела <EGFR-IGF-1R> в соответствии с изобретением демонстрируют преимущества для пациентов, людей, нуждающихся в EGFR- и IGF-IR-нацеленной терапии. Антитела в соответствии с изобретением имеют весьма ценные свойства, дающие пользу пациентам, страдающим от таких заболеваний, особенно страдающих от рака. Биспецифические антитела <EGFR-IGF-1R> в соответствии с изобретением демонстрируют, например, снижение интернализации рецепторов IGF-1R по сравнению с моноспецифическим родительским антителом <IGF-1R>. Кроме того, они демонстрируют хорошее нацеливание на опухолевые клетки, экспрессирующие оба антигена EGFR и IGF-1R, что является выгодным в плане соотношения эффективности/токсичности для пациентов, страдающих от рака, экспрессирующего оба антигена, EGFR и IGF-1R.
Таким образом, в одном аспекте изобретения биспецифическое антитело в соответствии с изобретением характеризуется тем, что
а) первое антитело полной длины специфически связывается с IGF-1R и включает тяжелую цепь с аминокислотной последовательностью SEQ ID №1 и легкую цепь с аминокислотной последовательностью SEQ ID №2, и
б) второе антитело полной длины специфически связывается с EGFR и включает тяжелую цепь, связанную с легкой цепью через пептидный линкер, где указанные связанные тяжелая и легкая цепи имеют аминокислотную последовательность SEQ ID №3.
В другом аспекте изобретения биспецифическое антитело в соответствии с изобретением характеризуется тем, что
а) первое антитело полной длины специфически связывается с IGF-1R и включает тяжелую цепь с аминокислотной последовательностью SEQ ID №1 и легкую цепь с аминокислотной последовательностью SEQ ID №2, и
б) второе антитело полной длины специфически связывается с EGFR и включает тяжелую цепь, связанную с легкой цепью через пептидный линкер, где указанные связанные тяжелая и легкая цепи имеют аминокислотную последовательность SEQ ID №4.
В другом аспекте изобретения биспецифическое антитело в соответствии с изобретением характеризуется тем, что
а) первое антитело полной длины специфически связывается с EGFR и включает тяжелую цепь с аминокислотной последовательностью SEQ ID №5 и легкую цепь с аминокислотной последовательностью SEQ ID №6, и
б) второе антитело полной длины специфически связывается с IGF-1R и включает тяжелую цепь, связанную с легкой цепью через пептидный линкер, где указанные связанные тяжелая и легкая цепи имеют аминокислотную последовательность SEQ ID №7.
В другом аспекте изобретения биспецифическое антитело в соответствии с изобретением характеризуется тем, что
а) первое антитело полной длины специфически связывается с EGFR и включает тяжелую цепь с аминокислотной последовательностью SEQ ID №5 и легкую цепь с аминокислотной последовательностью SEQ ID №6, и
б) второе антитело полной длины специфически связывается с IGF-1R и включает тяжелую цепь, связанную с легкой цепью через пептидный линкер, где указанные связанные тяжелая и легкая цепи имеют аминокислотную последовательность SEQ ID №8.
Таким образом, в одном воплощении изобретения биспецифическое антитело представляет собой анти-IGF-1R/анти-EGFR-антитело и характеризуется тем, что содержит аминокислотные последовательности SEQ ID №1, SEQ ID №2 и SEQ ID №3. 22. Соответственно, одним из аспектов данного изобретения является биспецифическое антитело, которое специфически связывается с человеческим IGF-1R и человеческим EGFR и характеризуется тем, что содержит аминокислотные последовательности SEQ ID №1, SEQ ID №2 и SEQ ID №3.
Таким образом, в одном воплощении изобретения биспецифическое антитело представляет собой анти-IGF-1R/анти-EGFR-антитело и характеризуется тем, что содержит аминокислотные последовательности SEQ ID №1, SEQ ID №2 и SEQ ID №4. Соответственно, одним из аспектов данного изобретения является биспецифическое антитело, которое специфически связывается с человеческим IGF-1R и человеческим EGFR и характеризуется тем, что содержит аминокислотные последовательности SEQ ID №1, SEQ ID №2 и SEQ ID №4.
Таким образом, в одном воплощении изобретения биспецифическое антитело представляет собой анти-IGF-1R/анти-EGFR-антитело и характеризуется тем, что содержит аминокислотные последовательности SEQ ID №5, SEQ ID №6 и SEQ ID №7. Соответственно, одним из аспектов данного изобретения является биспецифическое антитело, которое специфически связывается с человеческим IGF-1R и человеческим EGFR и характеризуется тем, что содержит аминокислотные последовательности SEQ ID №5, SEQ ID №6 и SEQ ID №7.
Таким образом, в одном воплощении изобретения биспецифическое антитело представляет собой анти-IGF-1R/анти-EGFR-антитело и характеризуется тем, что содержит аминокислотные последовательности SEQ ID №5, SEQ ID №6 и SEQ ID №8. Соответственно, одним из аспектов данного изобретения является биспецифическое антитело, которое специфически связывается с человеческим IGF-1R и человеческим EGFR и характеризуется тем, что содержит аминокислотные последовательности SEQ ID №5, SEQ ID №6 и SEQ ID №8.
В одном воплощении изобретения биспецифическое антитело представляет собой анти-IGF-1R/анти-EGFR-антитело и характеризуется тем, что
а) содержит аминокислотные последовательности SEQ ID №1, SEQ ID №2 и SEQ ID №3.
б) содержит аминокислотные последовательности SEQ ID №1, SEQ ID №2 и SEQ ID №4.
в) содержит аминокислотные последовательности SEQ ID №5, SEQ ID №6 и SEQ ID №7, или
г) содержит аминокислотные последовательности SEQ ID №5, SEQ ID №6 и SEQ ID №8.
В одном воплощении изобретения указанное биспецифическое анти-IGF-1R/анти-EGFR-антитело характеризуется наличием одного или более чем одного из следующих свойств (определяемых в анализах, описанных в примере 4 и 5):
- анти-IGF-1R/анти-EGFR-антитело ингибирует фосфорилирование IGF-1R с IC50, равным 5 нМ или менее (предпочтительно 2 нМ или менее), на опухолевых клетках Н322М;
- биспецифическое анти-IGF-1R/анти-EGFR-антитело ингибирует фосфорилирование EGFR с IC50, равным 5 нМ или менее (предпочтительно 2 нМ или менее), на опухолевых клетках Н322М;
- биспецифическое анти-IGF-1R/анти-EGFR-антитело уменьшает подавление IGF-1R на 50% или более по сравнению с анти-IGF-1R-антителом <IGF-1R> HUMAB клон 18 (DSM АСС 2587).
В другом аспекте изобретения биспецифическое антитело в соответствии с изобретением характеризуется тем, что
а) первое антитело полной длины специфически связывается с EGFR и включает тяжелую цепь с аминокислотной последовательностью SEQ ID №5 и легкую цепь с аминокислотной последовательностью SEQ ID №6,
б) второе антитело полной длины специфически связывается с IGF-1R и включает тяжелую цепь, соединенную с легкой цепью через пептидный линкер, где указанные связанные тяжелая и легкая цепи имеют аминокислотную последовательность SEQ ID №7 с не более чем 1 аминокислотной заменой в CDR, и где KD-значение аффинности связывания равно или снижено менее чем в 4 раза по сравнению с KD-значением аффинности связывания немутированной аминокислотной последовательности SEQ ID №7.
В другом аспекте изобретения биспецифическое антитело в соответствии с изобретением характеризуется тем, что
а) первое антитело полной длины специфически связывается с EGFR и включает тяжелую цепь с аминокислотной последовательностью SEQ ID №5 и легкую цепь с аминокислотной последовательностью SEQ ID №6,
б) второе антитело полной длины специфически связывается с IGF-1R и включает тяжелую цепь, соединенную с легкой цепью через пептидный линкер, где указанные связанные тяжелая и легкая цепи имеют аминокислотную последовательность SEQ ID №8 с не более чем 1 аминокислотной заменой в CDR, и где KD-значение аффинности связывания равно или снижено менее чем в 4 раза по сравнению с KD-значением аффинности связывания немутированной аминокислотной последовательности SEQ ID №8.
В другом аспекте изобретения биспецифическое антитело в соответствии с изобретением характеризуется тем, что
а) первое антитело полной длины специфически связывается с EGFR и включает тяжелую цепь с аминокислотной последовательностью SEQ ID №5 и легкую цепь с аминокислотной последовательностью SEQ ID №6,
б) второе антитело полной длины специфически связывается с IGF-1R и включает тяжелую цепь, соединенную с легкой цепью через пептидный линкер, где указанные связанные тяжелая и легкая цепи имеют аминокислотную последовательность SEQ ID №7 с не более чем 1 аминокислотной заменой в CDR3H, и где KD-значение аффинности связывания равно или снижено менее чем в 4 раза по сравнению с KD-значением аффинности связывания немутированной аминокислотной последовательности SEQ ID №7.
В другом аспекте изобретения биспецифическое антитело в соответствии с изобретением характеризуется тем, что
а) первое антитело полной длины специфически связывается с EGFR и включает тяжелую цепь с аминокислотной последовательностью SEQ ID №5 и легкую цепь с аминокислотной последовательностью SEQ ID №6,
б) второе антитело полной длины специфически связывается с IGF-1R и включает тяжелую цепь, соединенную с легкой цепью через пептидный линкер, где указанные связанные тяжелая и легкая цепи имеют аминокислотную последовательность SEQ ID №8 с не более чем 1 аминокислотной заменой в CDR3H, и где KD-значение аффинности связывания равно или снижено менее чем в 4 раза по сравнению с KD-значением аффинности связывания немутированной аминокислотной последовательности SEQ ID №8.
В другом аспекте изобретения биспецифическое антитело в соответствии с изобретением характеризуется тем, что
а) первое антитело полной длины специфически связывается с EGFR и включает тяжелую цепь с аминокислотной последовательностью SEQ ID №5 и легкую цепь с аминокислотной последовательностью SEQ ID №6,
б) второе антитело полной длины специфически связывается с IGF-1R и включает тяжелую цепь, соединенную с легкой цепью через пептидный линкер, где указанные связанные тяжелая и легкая цепи имеют аминокислотную последовательность SEQ ID №7 с не более чем 1 аминокислотной заменой в CDR, и где KD-значение аффинности связывания было равно или снижено менее чем в 4 раза по сравнению с KD-значением аффинности связывания немутированной аминокислотной последовательности SEQ ID №7;
и обладает одним или более чем одним из следующих свойств (определяемых в анализах, описанных в примере 4 и 5):
- анти-IGF-1R/анти-EGFR-антитело ингибирует фосфорилирование IGF-1R с IC50, равным 5 нМ или менее (предпочтительно 2 нМ или менее), на опухолевых клетках Н322М;
- биспецифическое анти-IGF-1R/анти-EGFR-антитело ингибирует фосфорилирование EGFR с IC50, равным 5 нМ или менее (предпочтительно 2 нМ или менее), на опухолевых клетках Н322М;
- биспецифическое анти-IGF-1R/анти-EGFR-антитело уменьшает подавление IGF-1R на 50% или более по сравнению с анти-IGF-1R-антителом <IGF-1R> HUMAB клон 18 (DSM АСС 2587).
В другом аспекте изобретения биспецифическое антитело в соответствии с изобретением характеризуется тем, что
а) первое антитело полной длины специфически связывается с EGFR и включает тяжелую цепь с аминокислотной последовательностью SEQ ID №5 и легкую цепь с аминокислотной последовательностью SEQ ID №6,
б) второе антитело полной длины специфически связывается с IGF-1R и включает тяжелую цепь, соединенную с легкой цепью через пептидный линкер, где указанные связанные тяжелая и легкая цепи имеют аминокислотную последовательность SEQ ID №8 с не более чем 1 аминокислотной заменой в CDR, и где KD-значение аффинности связывания равно или снижено менее чем в 4 раза по сравнению с KD-значением аффинности связывания немутированной аминокислотной последовательности SEQ ID №8;
и обладает одним или более чем одним из следующих свойств (определяемых в анализах, описанных в примере 4 и 5):
- анти-IGF-1R/анти-EGFR-антитело ингибирует фосфорилирование IGF-1R с IC50, равным 5 нМ или менее (предпочтительно 2 нМ или менее), на опухолевых клетках Н322М;
- биспецифическое анти-IGF-1R/анти-EGFR-антитело ингибирует фосфорилирование EGFR с IC50, равным 5 нМ или менее (предпочтительно 2 нМ или менее), на опухолевых клетках Н322М;
- биспецифическое анти-IGF-1R/анти-EGFR-антитело уменьшает подавление IGF-1R на 50% или более по сравнению с анти-IGF-1R-антителом <IGF-1R> HUMAB клон 18 (DSM АСС 2587).
В другом аспекте изобретения биспецифическое антитело в соответствии с изобретением характеризуется тем, что
а) первое антитело полной длины специфически связывается с EGFR и включает тяжелую цепь с аминокислотной последовательностью SEQ ID №5 и легкую цепь с аминокислотной последовательностью SEQ ID №6,
б) второе антитело полной длины специфически связывается с IGF-1R и включает тяжелую цепь, соединенную с легкой цепью через пептидный линкер, где указанные связанные тяжелая и легкая цепи имеют аминокислотную последовательность SEQ ID №7 с не более чем 1 аминокислотной заменой в CDR3H, и где KD-значение аффинности связывания равно или снижено менее чем в 4 раза по сравнению с KD-значением аффинности связывания немутированной аминокислотной последовательности SEQ ID №7;
и обладает одним или более чем одним из следующих свойств (определяемых в анализах, описанных в примере 4 и 5):
- анти-IGF-1R/анти-EGFR-антитело ингибирует фосфорилирование IGF-1R с IC50, равным 5 нМ или менее (предпочтительно 2 нМ или менее), на опухолевых клетках Н322М;
- биспецифическое анти-IGF-1R/анти-EGFR-антитело ингибирует фосфорилирование EGFR с IC50, равным 5 нМ или менее (предпочтительно 2 нМ или менее), на опухолевых клетках Н322М;
- биспецифическое анти-IGF-1R/анти-EGFR-антитело уменьшает подавление IGF-1R на 50% или более по сравнению с анти-IGF-1R-антителом <IGF-1R> HUMAB клон 18 (DSM ACC 2587).
В другом аспекте изобретения биспецифическое антитело в соответствии с изобретением характеризуется тем, что
а) первое антитело полной длины специфически связывается с EGFR и включает тяжелую цепь с аминокислотной последовательностью SEQ ID №5 и легкую цепь с аминокислотной последовательностью SEQ ID №6,
б) второе антитело полной длины специфически связывается с IGF-1R и включает тяжелую цепь, соединенную с легкой цепью через пептидный линкер, где указанные связанные тяжелая и легкая цепи имели аминокислотную последовательность SEQ ID №8 с не более чем 1 аминокислотной заменой в CDR3H, и где KD-значение аффинности связывания было равным или снижалось менее чем в 4 раза по сравнению с KD-значением аффинности связывания немутированной аминокислотной последовательности SEQ ID №8;
и обладает одним или более чем одним из следующих свойств (определяемых в анализах, описанных в примере 4 и 5):
- анти-IGF-1R/анти-EGFR-антитело ингибирует фосфорилирование IGF-1R с IC50, равным 5 нМ или менее (предпочтительно 2 нМ или менее), на опухолевых клетках Н322М;
- биспецифическое анти-IGF-1R/анти-EGFR-антитело ингибирует фосфорилирование EGFR с IC50, равным 5 нМ или менее (предпочтительно 2 нМ или менее), на опухолевых клетках Н322М;
- биспецифическое анти-IGF-1R/анти-EGFR-антитело уменьшает подавление IGF-1R на 50% или более по сравнению с анти-IGF-1R-антителом <IGF-1R> HUMAB клон 18 (DSM АСС 2587).
Примеры замен аминокислотных остатков в CDR3H из SEQ ID №7 или SEQ ID №8, где KD-значение аффинности связывания равно или уменьшено менее чем в 4 раза по сравнению с KD-значением аффинности связывания немутированной аминокислотной последовательности, описаны, например, в ЕР10166860.6.
Термин «VEGF», используемый в данном документе, относится к человеческому фактору роста эндотелия сосудов (VEGF/VEGF-A) (SEQ ID №15), который описан, например, в Leung, D.W., et al., Science 246 (1989) 1306-9; Keck, P.J., et al., Science 246 (1989) 1309-12, и Connolly, D.T, et al., J. Biol. Chem. 264 (1989) 20017-24. VEGF участвует в регуляции нормального и патологического ангиогенеза и неоваскуляризации, связанной с опухолями и внутриглазными расстройствами (Ferrara, N., et al., Endocr. Rev. 18 (1997) 4-25; Berkman, R.A., et al., J. Clin. Invest. 91 (1993) 153-159; Brown, L.F., et al., Human Pathol. 26 (1995) 86-91; Brown, L.F., et al., Cancer Res. 53 (1993) 4727-4735; Mattern, J., et al., Brit. J. Cancer. 73 (1996) 931-934; b Dvorak, H., et al., Am. J. Pathol. 146 (1995) 1029-1039). VEGF является гомодимерным гликопротеином, который был выделен из нескольких источников. VEGF демонстрирует высоко специфическую митогенную активность по отношению к эндотелиальным клеткам.
Термин «ANG-2», используемый в данном документе, относится к человеческому ангиопоэтину-2 (ANG-2) (альтернативно сокращенному как ANGPT2 или ANG2) (SEQ ID №16), который описан в Maisonpierre, P.C., et al, Science 277 (1997) 55-60, и Cheung, A.H., et al., Genomics 48 (1998) 389-91. Ангиопоэтины-1 и -2 и Ang-2 были обнаружены в качестве лигандов для Ties, семейства тирозинкиназ, которые селективно экспрессируются в сосудистом эндотелии. Yancopoulos, G.D., et al., Nature 407 (2000) 242-48. В настоящее время известно четыре определенных члена семейства ангиопоэтина. Ангиопоэтин-3 и -4 (Ang-3 и Ang-4) могут представлять широко различающиеся копии одного и того же локуса гена у мыши и человека. Kim, I., et al., FEBS Let, 443 (1999) 353-56; Kim, I., et al., J Biol Chem 274 (1999) 26523-28. ANG-1 и ANG-2 изначально были определены в экспериментах на культуре ткани как агонист и антагонист, соответственно (см. про ANG-1: Davis, S., et al., Cell 87 (1996) 1161-69; и про ANG-2: Maisonpierre, P.C., et al., Science 277 (1997) 55-60). Все известные ангиопоэтины связываются в первую очередь с Tie2, и оба Ang-1 и -2 связываются с Tie2 с аффинностью 3 нМ (Kd). Maisonpierre, P.C., et al., Science 277 (1997) 55-60.
В предпочтительном воплощении указанное биспецифическое антитело в соответствии с изобретением специфически связывается с человеческим VEGF, a также с человеческим ANG-2 (т.е. биспецифическое антитело в соответствии с изобретением является биспецифическим анти-VEGF/анти-ANG-2-антителом). Биспецифическое антитело предпочтительно основано на антигенсвязывающих сайтах aHTH-VEGF-антитела бевацизумаба и ANG2J-LC06 (которое описано в WO2010/040508 (заявка РСТ № РСТ/ЕР2009/007182) и получено с помощью фагового дисплея). Соответствующие аминокислотные последовательности легкой и тяжелой цепей этих биспецифических двухвалентных антител приведены в SEQ ID №9, SEQ ID №10, SEQ ID №11 (для Ang2-VEGF-OA-Ava-N-scFabLC06SS) и в SEQ ID №9, SEQ ID №10, SEQ ID №12 (для Ang2-VEGF-OA-Ava-N-scFabLC06).
Таким образом, в одном аспекте изобретения биспецифическое антитело в соответствии с изобретением характеризуется тем, что
а) первое антитело полной длины специфически связывается с VEGF и включает тяжелую цепь с аминокислотной последовательностью SEQ ID №9 и легкую цепь с аминокислотной последовательностью SEQ ID №10, и
б) второе антитело полной длины специфически связывается с Ang-2 и включает тяжелую цепь, соединенную с легкой цепью через пептидный линкер, где указанные связанные тяжелая и легкая цепи имеют аминокислотную последовательность SEQ ID №11.
В другом аспекте изобретения биспецифическое антитело в соответствии с изобретением характеризуется тем, что
а) первое антитело полной длины специфически связывается с VEGF и включает тяжелую цепь с аминокислотной последовательностью SEQ ID №9 и легкую цепь с аминокислотной последовательностью SEQ ID №10, и
б) второе антитело полной длины специфически связывается с Ang-2 и включает тяжелую цепь, соединенную с легкой цепью через пептидный линкер, где указанные связанные тяжелая и легкая цепи имеют аминокислотную последовательность SEQ ID №12.
Таким образом, в одном воплощении изобретения биспецифическое антитело представляет собой анти-VEGF/анти-Ang-2-антитело и характеризуется тем, что содержит аминокислотные последовательности SEQ ID №9, SEQ ID №10 и SEQ ID №11.
Таким образом, в одном воплощении изобретения биспецифическое антитело представляет собой анти-VEGF/анти-Ang-2-антитело и характеризуется тем, что содержит аминокислотные последовательности SEQ ID №9, из SEQ ID №10 и SEQ ID №12.
Антитела полной длины изобретения содержат иммуноглобулиновые константные области одного или более чем одного класса иммуноглобулинов. Иммуноглобулиновые классы включают изотипы IgG, IgM, IgA, IgD и IgE и, в случае IgG и IgA, их подтипы. В предпочтительном воплощении антитело полной длины изобретения имеет структуру константного домена антитела типа IgG.
Используемые в данном документе термины «моноклональное антитело» или «композиция с моноклональным антителом» относятся к препарату молекул антитела единого аминокислотного состава.
Термин «химерное антитело» относится к антителу, содержащему вариабельную область, т.е. связывающую область, из одного источника или вида, и по меньшей мере часть константной области, полученной из другого источника или вида, как правило полученному с помощью методик рекомбинантной ДНК. Предпочтительными являются химерные антитела, содержащие мышиную вариабельную область и человеческую константную область. Другими предпочтительными формами «химерных антител», охватываемыми данным изобретением, являются те, в которых константную область модифицировали или изменяли по сравнению с исходным антителом, создавая свойства в соответствии с изобретением, особенно в связи с C1q-связыванием и/или Fc-рецепторным (FcR) связыванием. Такие химерные антитела также называют «антителами с переключением класса». Химерные антитела являются продуктом экспрессированных иммуноглобулиновых генов, содержащих сегменты ДНК, кодирующие вариабельные области иммуноглобулинов, и сегменты ДНК, кодирующие константные области иммуноглобулинов. Способы получения химерных антител включают обычные методики рекомбинантной ДНК и генной трансфекции, в настоящее время хорошо известные в данной области. См., например, Morrison, S.L, et al, Proc. Natl. Acad Sci. USA 81 (1984) 6851-6855; патенты США 5202238 и 5204244.
Термин «гуманизированное антитело» относится к антителам, в которых каркасные области или «области, определяющие комплементарность» (CDR) были изменены так, чтобы они содержали CDR иммуноглобулина другой специфичности, отличной от родительского иммуноглобулина. В предпочтительном воплощении мышиный CDR прививают каркасной области человеческого антитела для получения «гуманизированного антитела». См., например, Riechmann, L, et al., Nature 332 (1988) 323-327; и Neuberger, M.S., et al., Nature 314 (1985) 268-270. Особенно предпочтительные CDR соответствуют тем, которые представляют последовательности, распознающие антигены, отмеченные выше для химерных антител. Другими формами «гуманизированных антител», предусмотренными данным изобретением, являются такие антитела, которые были дополнительно модифицированы или изменены в константной области по сравнению с исходным антителом для создания свойств в соответствии с изобретением, особенно в отношении C1q-связывания и/или FcR-связывания.
Термин «человеческое антитело», используемый в данном документе, включает антитела с вариабельными и константными областями, полученными из человеческих зародышевых последовательностей иммуноглобулина. Человеческие антитела хорошо известны в данной области (van Dijk, M.A., and van de Winkel, J.G., Curr. Opin. Pharmacol. 5 (2001) 368-374). Человеческие антитела могут быть также получены на трансгенных животных (например, мышах), которые способны после иммунизации продуцировать полный репертуар или выборку человеческих антител в отсутствие эндогенной продукции иммуноглобулина. Перенос совокупности человеческих зародышевых генов иммуноглобулинов в такую мышь, мутантную по зародышевой линии, приведет к продукции человеческих антител в ответ на введение антигена (см., например, Jakobovits, A., et al., Proc. Natl. Acad. Sci. USA 90 (1993) 2551-2555; Jakobovits, A., et al., Nature 362 (1993) 255-258; Brueggemann, M.D., et al., Year Immunol. 7 (1993) 33-40). Человеческие антитела могут быть также получены в библиотеках фагового дисплея (Hoogenboom, H.R., and Winter, G., J. Mol. Biol. 227 (1992) 381-388; Marks, J.D., et al., J. Mol. Biol. 222 (1991) 581-597). Методики Cole, et al. и Boerner, et al. также доступны для изготовления человеческих моноклональных антител (Cole, et al., Monoclonal Antibodies and Cancer Therapy, Alan R. Liss, p.77 (1985); и Boerner, P., et al., J. Immunol. 147 (1991) 86-95). Как уже было упомянуто в отношении химерных и гуманизированных антител в соответствии с изобретением, термин «человеческое антитело», используемый в данном документе, включает также такие антитела, которые были модифицированы в константной области для создания свойств в соответствии с изобретением, особенно в отношении C1q-связывания и/или FcR-связывания, например, путем «переключения класса», т.е. путем изменения или мутации Fc-частей (например, из IgG1 в IgG4 и/или мутации IgG1/IgG4).
Термин «рекомбинантное человеческое антитело», используемый в данном документе, охватывает все человеческие антитела, которые получают, экспрессируют, создают или выделяют с помощью рекомбинантных средств, например, антитела, выделенные из клетки-хозяина, такой как клетка NSO или СНО, или животного (например, мыши), которое является трансгенным для человеческих генов иммуноглобулинов или антител, экспрессируемых с помощью рекомбинантного экспрессионного вектора, трансфицированного в клетку-хозяина. Такие рекомбинантные человеческие антитела имеют вариабельные и константные области в перегруппированной форме. Рекомбинантные человеческие антитела в соответствии с изобретением подвергали соматическому гипермутированию in vivo. Таким образом, аминокислотные последовательности областей VH и VL рекомбинантных антител являются последовательностями, которые, будучи полученными из и связанными с человеческими зародышевыми последовательностями VH и VL, не могут естественным образом существовать в репертуаре человеческих зародышевых антител in vivo.
Термин «вариабельный домен» (вариабельный домен легкой цепи (VL), вариабельный домен тяжелой цепи (VH)), используемый в данном документе, означает каждую пару легкой и тяжелой цепей, которые непосредственно участвуют в связывании антитела с антигеном. Вариабельные домены легкой и тяжелой цепей человека имеют одинаковую общую структуру, и каждый домен содержит четыре каркасные области (framework region, FR), последовательности которых в значительной степени консервативны, соединенные тремя «гипервариабельными областями» (или областями, определяющими комплементарность, CDR). Каркасные области принимают конформацию β-складчатости, а CDR могут образовывать петли, связывающие β-складчатую структуру. CDR в каждой цепи удерживаются в их трехмерной структуре с помощью каркасных областей и образуют вместе с CDR из другой цепи антигенсвязывающий сайт. CDRS-области тяжелой и легкой цепей антитела играют особенно важную роль в специфичности/аффинности связывания антител в соответствии с изобретением и, следовательно, обеспечивают дальнейший предмет изобретения.
Термины «гипервариабельная область» или «антигенсвязывающая часть антитела», используемые в данном документе, относятся к аминокислотным остаткам антитела, которые отвечают за связывание антигена. Гипервариабельная область антитела содержит аминокислотные остатки из «областей, определяющих комплементарность», или «CDR». «Каркасные участки», или «FR-области», являются такими областями вариабельных доменов, которые отличаются от остатков гипервариабельных областей, определенных выше. Таким образом, легкая и тяжелая цепи антитела содержат от N-конца к С-концу домены FR1, CDR1, FR2, CDR2, FR3, CDR3 и FR4. CDR в каждой цепи разделены такими аминокислотами каркасного участка. В частности, CDR3 тяжелой цепи является областью, которая вносит наибольший вклад в связывание антигена. CDR и FR-области определяют в соответствии со стандартным определением Kabat et al., Sequences of Proteins of Immunological Interest, 5th Ed. Public Health Service, National Institutes of Health, Bethesda, MD. (1991).
Используемые в данном документе термины «связывающийся с», или «который специфически связывается с», или «специфически связывающийся с», относятся к связыванию антитела с эпитопом антигена в анализе in vitro, предпочтительно в анализе плазменного резонанса (BIAcore, GE-Healthcare, Упсала, Швеция) с очищенным антигеном дикого типа. Аффинность связывания определяется значениями ka (константа скорости ассоциации антитела из комплекса антитело/антиген), kD (константа диссоциации) и KD (kD/ka). В одном воплощении связывание или специфическое связывание означает аффинность связывания (KD) в 10-8 моль/л или менее, предпочтительно от 10-9 М до 10-13 моль/л. Таким образом, биспецифическое антитело в соответствии с изобретением предпочтительно специфически связывается с каждым антигеном, для которого он является специфическим с аффинностью связывания (KD) 10-8 моль/л или менее, предпочтительно от 10-9 М до 10-13 моль/л.
Связывание антитела к FcγRIII может быть исследовано в анализе BIAcore (GE Healthcare, Упсала, Швеция). Аффинность связывания определяется значениями ka (константа скорости ассоциации антитела из комплекса антитело/антиген), kD (константа диссоциации) и KD (kD/ka).
Термин «эпитоп» включает любую полипептидную детерминанту, способную специфически связываться с антителом. В некоторых воплощениях эпитопная детерминанта включает химически активные поверхностные группировки молекул, такие как аминокислоты, сахарные боковые цепочки, фосфорил или сульфонил, а в некоторых воплощениях может иметь специфические трехмерные структурные характеристики и/или специфические характеристики заряда. Эпитоп является областью антигена, которая связывается антителом.
В некоторых воплощениях антитело специфически связывается с антигеном, когда оно преимущественно распознает свой антиген-мишень в сложной смеси белков и/или макромолекул.
Термин «константная область», используемый в данной заявке, обозначает сумму доменов антитела помимо вариабельной области. Константная область непосредственно не участвует в связывании с антигеном, но проявляет различные эффекторные функции. В зависимости от аминокислотной последовательности константной области их тяжелых цепей антитела делятся на классы: IgA, IgD, IgE, IgG и IgM, и некоторые из них могут быть разделены на подклассы, такие как IgG1, IgG2, IgG3 и IgG4, IgAt и IgA2. Константные области тяжелой цепи, которые соответствуют различным классам антител, называют α, δ, ε, γ и µ, соответственно. Константные области легкой цепи (CL), которые можно найти во всех пяти классах антител, называют κ (каппа) и λ (лямбда).
Термин «константная область человеческого происхождения», используемый в данной заявке, обозначает константную область тяжелой цепи человеческого антитела подкласса IgG1, IgG2, IgG3 или IgG4 и/или константную область легкой цепи каппа или лямбда. Такие константные области хорошо известны в данной области и описаны, например, в Kabat, E.A., (see e.g. Johnson, G. and Wu, T.T., Nucleic Acids Res. 28 (2000) 214-218; Kabat, E.A., et al., Proc. Natl. Acad. Sci. USA 72 (1975) 2785-2788).
Термин «комплемент-зависимая цитотоксичность (CDC, complement-dependent cytotoxicity)» означает процесс, начинающийся при связывании фактора комплемента C1q с Fc-частью большинства подклассов IgG-антител. Связывание C1q с антителом обусловлено определенными белок-белковыми взаимодействиями на так называемом сайте связывания. Такие сайты связывания Fc-части известны в данной области (см. выше). Такими сайтами связывания Fc-части являются сайты, например, охарактеризованные аминокислотами L234, L235, D270, N297, Е318, K320, K322, Р331 и Р329 (нумерация в соответствии с EU индексом Кабата). Антитела подклассов IgG1, IgG2 и IgG3 обычно демонстрируют активацию комплемента, включающую связывание C1q и С3, в то время как IgG4 не активируют систему комплемента и не связывают C1q и/или С3.
В то время как антитела подкласса IgG4 демонстрируют уменьшение связывания Fc-рецептора (FcγRIIIa), антитела других подклассов IgG демонстрируют сильное связывание. Тем не менее, Pro238, Asp265, Asp270, Asn297 (с потерей Fc-углевода), Pro329, Leu234, Leu235, Gly236, Gly237, Ile253, Ser254, Lys288, Thr307, Gln311, Asn434 и His435 являются остатками, которые, если они изменены, также снижают связывание Fc-рецептора (Shields, R.L., et al., J. Biol. Chem. 276 (2001) 6591-6604; Lund, J., et al, FASEB J. 9 (1995) 115-119; Morgan, A., et al., Immunology 86 (1995) 319-324; EP 0307434).
В одном воплощении антитело в соответствии с изобретением обладает пониженным связыванием FcR по сравнению с антителом IgG1 и родительским антителом полной длины в связи с FcR-связыванием подкласса IgG4 или подкласса IgG1 или IgG2 с мутацией в S228, L234, L235 и/или D265 и/или содержит мутацию PVA236. В одном воплощении мутациями в родительском антителе полной длины являются S228P, L234A, L235A, L235E и/или PVA236. В другом воплощении мутациями в родительском антителе полной длины являются S228P и L235E в IgG4 и L234A и L235A в IgG1.
В другом воплощении биспецифическое антитело в соответствии с изобретением характеризуется тем, что указанное антитело полной длины представляет собой человеческое антитело подкласса IgG1.
Термин «антитело-зависимая клеточная цитотоксичность (ADCC, antibody-dependent cellular cytotoxicity)» относится к лизису человеческих клеток-мишеней антителом в соответствии с изобретением в присутствии эффекторных клеток. ADCC предпочтительно измеряют путем обработки препарата клеток, экспрессирующих EGFR и IGF-1R, антителом в соответствии с изобретением в присутствии эффекторных клеток, таких как свежевыделенные РВМС (peripheral blood mononuclear cell, периферические мононуклеры крови) или очищенные эффекторные клетки из лейкоцитной пленки, такие как моноциты или натуральные киллеры (NK, natural killers), или постоянно растущая клеточная линия NK.
Термин «комплемент-зависимая цитотоксичность (CDC)» означает процесс, начинающийся при связывании фактора комплемента C1q с Fc-частью большинства подклассов IgG-антитела. Связывание C1q с антителом обусловлено определенными белок-белковыми взаимодействиями в так называемом сайте связывания. Такие сайты связывания Fc-части известны в настоящее время (см. выше). Такими сайтам связывания Fc-части являются, например, сайты, охарактеризованные аминокислотами L234, L235, D270, N297, Е318, K320, K322, Р331 и Р329 (нумерация в соответствии с EU индексом Кабата). Антитела подклассов IgG1, IgG2 и IgG3 обычно демонстрируют активацию комплемента, включающую связывание C1q и С3, в то время как IgG4 не активируют систему комплемента и не связывают C1q и/или С3.
Константная область антитела непосредственно участвует в ADCC (антитело-зависимой клеточной цитотоксичности) и CDC (комплемент-зависимой цитотоксичности). Активация комплемента (CDC) инициируется связыванием фактора комплемента C1q с константной областью большинства подклассов антитела IgG. Связывание C1q с антителом вызвано определенными белок-белковыми взаимодействиями на так называемом сайте связывания. Такие сайты связывания константных областей известны в настоящее время и описаны, например, в Lukas, T.J., et al., J. Immunol. 127 (1981) 2555-2560; Brunhouse, R., and Cebra, J.J., Mol. Immunol. 16 (1979) 907-917; Burton, D.R., et al., Nature 288 (1980) 338-344; Thommesen, J.E., et al., Mol. Immunol. 37 (2000) 995-1004; Idusogie, E.E., et al., J. Immunol. 164 (2000) 4178-4184; Hezareh, M, et al., J. Virol. 75 (2001) 12161-12168; Morgan, A., et al., Immunology 86 (1995) 319-324; и ЕР 0307434. Такими сайтами связывания константных областей являются, например, сайты, охарактеризованные аминокислотами L234, L235, D270, N297, Е318, K320, K322, Р331 и Р329 (нумерация в соответствии с EU индексом Кабата).
В одном воплощении биспецифические антитела в соответствии с изобретением включают константную область антитела подкласса IgG1 или IgG3 (предпочтительно подкласса IgG1) предпочтительно человеческого происхождения. В одном воплощении биспецифические антитела в соответствии с изобретением содержат Fc-часть антитела IgG1- или IgG3-подкласса (предпочтительно IgG1-подкласса) предпочтительно человеческого происхождения.
Антитело-зависимая клеточная цитотоксичность (ADCC) моноклональных антител может быть усилена путем инженерии их олигосахаридного компонента, как описано в Umana, P., et al., Nature Biotechnol. 17 (1999) 176-180 и патенте США 6602684. Антитела типа lgG1, наиболее часто используемые терапевтические антитела, являются гликопротеинами, которые имеют консервативный N-связанный сайт гликозилирования на Asn297 в каждом СН2-домене. Два сложных двухантенных олигосахарида, присоединенные к Asn297, скрыты между СН2-доменами, образуя обширные контакты с полипептидным остовом, и их присутствие имеет важное значение для антитела, чтобы опосредовать эффекторные функции, такие как антитело-зависимую клеточную цитотоксичность (ADCC) (Lifely, M.R., et al., Glycobiology 5 (1995) 813-822; Jefferis, R., et al, Immunol. Rev. 163 (1998) 59-76; Wright, A., and Morrison, S.L, Trends Biotechnol. 15 (1997) 26-32). В Umana, P., et al. Nature Biotechnol. 17 (1999) 176-180 и WO 99/54342 показано, что сверхэкспрессия в клетках яичника китайского хомячка (СНО) β(1,4)-N-ацетилглюкозаминилтрансферазы III («GnTIII»), гликозилтрансферазы, катализирующей формирование олигосахаридов с симметричным разветвлением, значительно увеличивает in vitro ADCC-активность антител. Изменения в составе Asn297-углевода или его ликвидация также влияет на связывание с FcγR и C1q (Umana, P., et al., Nature Biotechnol. 17 (1999) 176-180; Davies, J., et al., Biotechnol. Bioeng. 74 (2001) 288-294; Mimura, Y, et al., J. Biol. Chem. 276 (2001) 45539-45547; Radaev, S., et al., J. Biol. Chem. 276 (2001) 16478-16483; Shields, R.L, et al., J. Biol. Chem. 276 (2001) 6591-6604; Shields, R.L., et al., J. Biol. Chem. 277 (2002) 26733-26740; Simmons, L.C., et al., J. Immunol. Methods 263 (2002) 133-147).
Способы усиления опосредованных клетками эффекторных функций моноклональных антител через уменьшение количества фукозы приведены, например, в WO 2005/018572, WO 2006/116260, WO 2006/114700, WO 2004/065540, WO 2005/011735, WO 2005/027966, WO 1997/028267, US 2006/0134709, US 2005/0054048, US 2005/0152894, WO 2003/035835, WO 2000/061739, Niwa, R., et al., J. Immunol. Methods 306 (2005) 151-160; Shinkawa, Т., et al., J Biol Chem, 278 (2003) 3466-3473; WO 03/055993 или патенте США 2005/0249722.
Гликозилирование человеческого IgG1 или IgG3 происходит на Asn297 как гликозилирование сердцевинного фукозилированного двухантенного сложного олигосахарида, заканчивающегося двумя остатками Gal. Человеческие константные области тяжелых цепей антител подклассов IgG1 или IgG3 подробно описаны Kabat, E.A., et al., Sequences of Proteins of Immunological Interest, 5th Ed. Public Health Service, National Institutes of Health, Bethesda, MD. (1991), и Brueggemann, M., et al., J. Exp. Med. 166 (1987) 1351-1361; Love, T.W., et al., Methods Enzymol. 178 (1989) 515-527. Эти структуры обозначаются как G0-, G1- (α-1,6- или α-1,3-) или G2-гликанановые остатки в зависимости от количества концевых Gal-остатков (Raju, T.S, Bioprocess Int. 1 (2003) 44-53). Тип гликозилирования Fc-частей антитела в СНО описан, например, Routier, F.H., Glycoconjugate J. 14 (1997) 201-207. Антитела, которые рекомбинантно экспрессируются в негликомодифицированных клетках-хозяевах СНО, обычно фукозилированы на Asn297 в количестве по меньшей мере 85%. Модифицированные олигосахариды родительского антитела полной длины могут быть гибридными или сложными. Предпочтительно олигосахариды с симметричным разветвлением, восстановленные/нефукозилированные, являются гибридными. В другом воплощении олигосахариды с симметричным разветвлением, восстановленные/нефукозилированные, являются сложными.
В соответствии с изобретением «количество фукозы» означает количество указанного сахара в сахарной цепочке на Asn297, связанное с суммой всех гликоструктур, присоединенных к Asn297 (например, сложных, гибридных и высокоманнозных структур), которое измеряется масс-спектрометрией MALDI-TOF и рассчитывается как среднее значение. Относительное количество фукозы представляет собой процент фукозосодержащих структур, связанных со всеми гликоструктурами, выявленными в образце, обработанном N-гликозидазой F (например, сложными, гибридными и олиго- и высокоманнозными структурами, соответственно) при MALDI-TOF (см. пример 10).
Биспецифические <EGFR-IGF-1R> антитела в соответствии с изобретением демонстрируют снижение интернализации рецепторов EGFR и IGF-1R по сравнению с их родительскими антителами <EGFR> и/или <IGF-1R>. Поэтому в одном предпочтительном воплощении изобретения биспецифическое <EGFR-IGF-1R> антитело гликозилировано (подкласс IgG1 или IgG3, предпочтительно подкласс IgG1) сахарной цепочкой на Asn297, где количество фукозы в указанной сахарной цепочке составляет 65% или ниже (нумерация в соответствии с Кабатом). В другом воплощении количество фукозы в указанной сахарной цепочке составляет от 5% до 65%, предпочтительно от 20% до 40%. Понятие «Asn297» в соответствии с изобретением означает аминокислоту аспарагиновую кислоту, расположенную примерно в позиции 297 в Fc-области. На основании незначительных изменений последовательностей антител Asn297 также может быть расположен на некоторых аминокислотах (обычно не более чем ±3 аминокислоты) до или после позиции 297, т.е. между позициями 294 и 300. Такие гликоинженерные антитела в данном документе также называют нефукозилированными антителами.
Нефукозилированное биспецифическое антитело в соответствии с изобретением может быть экспрессировано в гликомодифицированной клетке-хозяине, созданной для экспрессии по меньшей мере одной нуклеиновой кислоты, кодирующей полипептид с активностью GnTIII, в количестве, достаточном для частично фукозилированных олигосахаридов в Fc-области. В одном воплощении полипептид с активностью GnTIII является гибридным полипептидом. Альтернативно α1,6-фукозилтрансферазная активность клетки-хозяина может быть уменьшена или устранена в соответствии с патентом США 6946292 для создания гликомодифицированных клеток-хозяев. Степень фукозилирования антитела может быть предопределена, например, в ферментативных условиях (например, по времени ферментирования) или при сочетании по меньшей мере двух антител с различной степенью фукозилирования. Такие нефукозилированные антитела и соответствующие гликоинженерные способы описаны в WO 2005/044859, WO 2004/065540, W02007/031875, Umana, P., et al. Nature Biotechnol. 17 (1999) 176-180, WO 99/154342, WO 2005/018572, WO 2006/116260, WO 2006/114700, WO 2005/011735, WO 2005/027966, WO 97/028267, US 2006/0134709, US 2005/0054048, US 2005/0152894, WO 2003/035835, WO 2000/061739. Эти гликоинженерные антитела обладают повышенной ADCC. Другие гликоинженерные способы, дающие нефукозилированные антитела в соответствии с изобретением, описаны, например, в Niwa, R., et al., J. Immunol. Methods 306 (2005) 151-160; Shinkawa, Т., et al., J Biol Chem, 278 (2003) 3466-3473; WO 03/055993 или US 2005/0249722.
Одно воплощение представляет собой способ изготовления биспецифического антитела подкласса IgG1 или IgG3, которое гликозилировано сахарной цеппочкой на Asn297, где количество фукозы в указанной сахарной цепочке составляет 65% или ниже, с использованием процедуры, описанной в WO 2005/044859, WO 2004/065540, WO 2007/031875, Umana, P., et al., Nature Biotechnol. 17 (1999) 176-180, WO 99/154342, WO 2005/018572, WO 2006/116260, WO 2006/114700, WO 2005/011735, WO 2005/027966, WO 97/028267, US 2006/0134709, US 2005 / 0054048, US 2005/0152894, WO 2003/035835 или WO 2000/061739.
Одно воплощение представляет собой способ изготовления биспецифического антитела подкласса IgG1 или IgG3, которое гликозилировано сахарной цеппочкой на Asn297, где количество фукозы в указанной сахарной цепочке составляет 65% или ниже, с использованием процедуры, описанной в Niwa, R., et al., J. Immunol. Methods 306 (2005) 151-160; Shinkawa, Т., et al., J Biol Chem, 278 (2003) 3466-3473; WO 03/055993 или US 2005/0249722.
Антитело в соответствии с данным изобретением получают с помощью рекомбинантных средств. Таким образом, один аспект данного изобретения представляет собой нуклеиновую кислоту, кодирующую антитело в соответствии с изобретением, а другой аспект представляет собой клетку, содержащую указанную нуклеиновую кислоту, кодирующую антитело в соответствии с изобретением. Способы рекомбинантной продукции широко известны в данной области и включают экспрессию белка в прокариотических или эукариотических клетках с последующим выделением антитела и, как правило, очисткой до фармацевтически приемлемой чистоты. Для экспрессии вышеупомянутых антител в клетке-хозяине нуклеиновые кислоты, кодирующие легкие и тяжелые цепи, вставляют в соответствующие векторы экспрессии с помощью стандартных способов. Экспрессию осуществляют в соответствующих прокариотических или эукариотических клетках-хозяевах, таких как клетки СНО, клетки NS0, клетки SP2/0, клетки HEK293, клетки COS, клетки PER.C6, дрожжевые клетки, клетки E.coli, и выделяют антитело из клеток (из супернатанта или из клеток после лизиса). Основные способы рекомбинантной продукции широко известны в данной области и описаны, например, в статьях Makrides, S.C., Protein Expr. Purif. 17 (1999) 183-202; Geisse, S., et al., Protein Expr. Purif. 8 (1996) 271-282; Kaufman, R.J., Mol. Biotechnol. 16 (2000) 151-161; Werner, R.G., Drug Res. 48 (1998) 870-880.
Биспецифические антитела в соответствии с изобретением соответственно выделяют из культуральной среды с помощью обычных процедур очистки иммуноглобулинов, таких как, например, с помощью белка А-сефарозы, гидроксиапатитной хроматографии, гель-электрофореза, диализа или аффинной хроматографии. ДНК и РНК, кодирующие моноклональные антитела, можно легко выделить и секвенировать с помощью обычных процедур. Гибридомные клетки могут служить источником таких ДНК и РНК. После выделения ДНК может быть вставлена в экспресионные векторы, которыми затем трансфицируют клетки-хозяева, например, клетки HEK 293, клетки СНО или клетки миеломы, которые в противном случае не продуцируют иммуноглобулиновый белок, чтобы получить синтез рекомбинантных моноклональных антител в клетках-хозяевах.
Варианты (или мутанты) аминокислотной последовательности биспецифического антитела получают путем внесения соответствующих нуклеотидных замен в ДНК антитела или путем нуклеотидного синтеза. Тем не менее, такие модификации могут быть выполнены лишь в очень ограниченном диапазоне. Например, модификации не меняют приведенные выше характеристики антител, такие как изотип IgG и связывание антигена, но могут улучшать выход рекомбинантной продукции, стабильность белка или облегчать очистку.
Термин «клетка-хозяин», используемый в данной заявке, обозначает любой вид клеточной системы, который может быть разработан для создания антител в соответствии с данным изобретением. В одном воплощении в качестве клеток-хозяев используют клетки HEK293 и клетки СНО.
Используемые в данном документе выражения «клетка», «клеточная линия» и «клеточная культура» используются взаимозаменяемо, и все такие обозначения включают потомство. Таким образом, слова «трансформанты» и «трансформированные клетки» включают первичную клетку-объект и культуры, полученные из нее, независимо от количества переносов. Также понятно, что все потомство может не быть точно идентичным по содержанию ДНК из-за преднамеренных или случайных мутаций. Подразумевается вариантное потомство, которое имеет такие же функции или биологическую активность, как и у исходной трансформированной клетки. Где имеются в виду другие значения, будет ясно из контекста.
Экспрессия в клетках NSO описана, например, в Barnes, L.M., et al., Cytotechnology 32 (2000) 109-123; Barnes, L.M., et al., Biotech. Bioeng. 73 (2001)261-270. Временная экспрессия описана, например, в Durocher, Y., et al., Nucl. Acids. Res. 30 (2002) E9. Клонирование вариабельных доменов описано в Orlandi, R., et al., Proc. Natl. Acad. Sci. USA 86 (1989) 3833-3837; Carter, P., et al., Proc. Natl. Acad. Sci. USA 89 (1992) 4285-4289; и Norderhaug, L., et al., J. Immunol. Methods 204 (1997) 77-87. Предпочтительная система для временной экспрессии (HEK 293) описана в Schlaeger, E.-J., and Christensen, K., in Cytotechnology 30 (1999) 71-83 и в Schlaeger, E.-J., in J. Immunol. Methods 194 (1996) 191-199.
Контрольные последовательности, которые подходят для прокариот, например, включают промотор, возможно операторную последовательность и сайт связывания рибосомы. Эукариотические клетки, как известно, используют промоторы, энхансеры и сигналы полиаденилирования.
Нуклеиновая кислота является «функционально связанной», когда она находится в функциональной взаимосвязи с другой нуклеиновокислотной последовательностью. Например, ДНК предпоследовательности или секреторной лидерной последовательности функционально связана с ДНК полипептида, если она экспрессируется как пребелок, который участвует в секреции полипептида; промотор или энхансер функционально связан с кодирующей последовательностью, если он влияет на транскрипцию последовательности; или сайт связывания рибосомы функционально связан с кодирующей последовательностью, если он расположен так, чтобы облегчить трансляцию. Как правило, «функционально связан» означает, что последовательности ДНК являются смежными и, в случае секреторного лидера, смежными и одной рамке считывания. Тем не менее, энхансеры не обязательно должны быть смежными. Связывание осуществляется путем лигирования на подходящих сайтах рестрикции. Если таких сайтов не существует, в соответствии с обычной практикой используются синтетические олигонуклеотидные адаптеры или линкеры.
Очистку антител проводят с целью устранения других клеточных компонентов или других загрязняющих веществ, например, других клеточных нуклеиновых кислот или белков, с помощью стандартных методик, в том числе щелочной/SDS-обработки, CsCl, колоночной хроматографии, электрофореза в агарозном геле и других хорошо известных в данной области методик. См. Ausubel, F., et al., ed. Current Protocols in Molecular Biology, Greene Publishing and Wiley Interscience, New York (1987). Для очистки белков приняты и широко применяются различные способы, такие как, например, аффинная хроматография с микробными белками (например, аффинная хроматография с белком А или белком G), ионообменная хроматография (например, катионообменная (с карбоксиметиловыми смолами), анионообменная (с аминоэтиловыми смолами) и со смешанным режимом обмена), тиофильная адсорбционная хроматография (например, с бета-меркаптоэтанолом и другими SH-лигандами), хроматография гидрофобных взаимодействий или адсорбционная хроматография с ароматическими группами (например, с фенил-сефарозой, аза-аренофильными смолами или м-аминофенилбороновой кислотой), металл-хелатная аффинная хроматография (например, с носителем со сродством к Ni(II)- и Cu(II)), эксклюзионная хроматография и электрофоретические способы (такие как гель-электрофорез, капиллярный электрофорез) (Vijayalakshmi, M.A., Appl. Biochem. Biotech. 75 (1998) 93-102).
Термин «трансформация» в данном описании относится к процессу переноса векторов/нуклеиновых кислот в клетку-хозяина. Если в качестве клеток-хозяев используются клетки без трудно преодолимой клеточной стенки, то трансфекцию осуществляют, например, путем осаждения фосфатом кальция, как описано Graham, F.L, and van der Eb, A.J., Virology 52 (1973) 456ff. Тем не менее, также могут быть использованы другие способы введения ДНК в клетки, например, введение в ядро или слияние протопластов. Если используются прокариотические клетки или клетки, которые содержат значительные конструкции клеточной стенки, то одним из способов трансфекции является например, обработка кальцием с использованием хлорида кальция, как описано в Cohen, F.N, et al, PNAS. 69 (1972) 7110ff.
Используемое в данном документе выражение «экспрессия» относится к процессу, посредством которого нуклеиновая кислота транскрибируется в мРНК, и/или к процессу, в котором транскрибированная мРНК (также известная как транскрипт) впоследствии транслируется в пептиды, полипептиды или белки. Транскрипты и кодируемые полипептиды в совокупности называются продуктом гена. Если полинуклеотид является производным геномной ДНК, то экспрессия в эукариотической клетке может включать сплайсинг мРНК.
«Вектор» представляет собой молекулу нуклеиновой кислоты, в частности самореплицирующуюся, которая переносит вставленную нуклеиновокислотную молекулу в и/или между клетками-хозяевами. Этот термин включает векторы, которые функционируют в основном для введения ДНК или РНК в клетку (например, для хромосомной интеграции), репликации векторов, которые функционируют в основном для репликации ДНК или РНК, и экспрессионные векторы, которые отвечают за транскрипцию и/или трансляцию ДНК или РНК. Кроме того, включены векторы, которые выполняют более чем одну из описанных функций.
«Экспрессионный вектор» представляет собой полинуклеотид, который, будучи введенным в соответствующую клетку-хозяина, может быть транскрибирован и транслирован в полипептид. Понятие «экспрессионной системы» обычно относится к подходящей клетке-хозяину, содержащей экспрессионный вектор, который может функционировать для получения нужного продукта экспрессии.
Было обнаружено, что биспецифические антитела в соответствии с изобретением обладают ценными характеристиками, такими как хороший выход экспрессии в клетках млекопитающих, стабильность, биологическая или фармакологическая активность, фармакокинетические свойства или токсичность. Они могут быть использованы, например, для лечения таких заболеваний как рак. Антитела в соответствии с изобретением, особенно биспецифические <IGF-1R-EGFR> антитела, демонстрируют весьма ценные свойства, такие как подавление роста раковых клеток, экспрессирующих оба рецептора IGF-1R и EGFR, и противоопухолевая эффективность, дающая пользу пациентам, страдающим от рака. Биспецифические <IGF-1R-EGFR> антитела в соответствии с изобретением демонстрируют сниженную интернализацию обоих рецепторов IGF-1R и EGFR по сравнению с их родительскими моноспецифическими антителами <IGF-1R> и <EGFR> на раковых клетках, экспрессирующих оба рецептора IGF-1R и EGFR.
Одним из аспектов изобретения является фармацевтическая композиция, содержащая антитело в соответствии с изобретением. Другим аспектом изобретения является применение антитела в соответствии с изобретением для изготовления фармацевтической композиции. Еще один аспект изобретения представляет собой способ изготовления фармацевтической композиции, содержащей антитело в соответствии с изобретением. В другом аспекте данное изобретение предусматривает композицию, например, фармацевтическую композицию, содержащую антитело в соответствии с данным изобретением, собранную в состав вместе с фармацевтическим носителем.
Одно воплощение изобретения представляет собой биспецифическое антитело в соответствии с изобретением для лечения рака.
Другой аспект изобретения представляет собой указанную фармацевтическую композицию для лечения рака.
Другим аспектом изобретения является применение антитела в соответствии с изобретением для изготовления лекарственного препарата для лечения рака.
Другим аспектом изобретения является способ лечения пациентов, страдающих от рака, путем введения антитела в соответствии с изобретением пациенту, нуждающемуся в таком лечении.
Упоминаемый в данном документе «фармацевтический носитель» включает любые и все растворители, дисперсные среды, покрытия, антибактериальные и противогрибковые агенты, изотонические и задерживающие абсорбцию агенты и т.п., которые являются физиологически совместимыми. Предпочтительно, носитель подходит для внутривенного, внутримышечного, подкожного, парентерального, спинномозгового или эпидермального введения (например, путем инъекции или инфузии).
Композиция данного изобретения может быть введена различными способами, известными в данной области. Как будет понятно специалисту, путь и/или режим введения будет варьировать в зависимости от желаемого результата. Для введения соединения изобретения определенным путем может потребоваться покрытие соединения или одновременное введение соединения с материалом, предотвращающим его инактивацию. Например, соединение может быть введено субъекту в соответствующем носителе, например, в липосомах или разбавителе. Фармацевтически приемлемые разбавители включают физиологический раствор и водные буферные растворы. Фармацевтические носители включают стерильные водные растворы или дисперсии и стерильные порошки для приготовления стерильных растворов для инъекций или дисперсий непосредственно перед применением. Применение таких сред и агентов для фармацевтически активных веществ известно в данной области.
Фразы «парентеральное введение» и «вводят парентерально», используемые в данном документе, означают способы введения, отличные от энтерального и местного введения, как правило, путем инъекций, и включают, но не ограничиваясь ими, внутривенные, внутримышечные, внутриартериальные, интратекальные, внутрикапсулярные, интраорбитальные, внутрисердечные, внутрикожные, внутрибрюшинные, транстрахеальные, подкожные, субкутикулярные, внутрисуставные, субкапсулярные, субарахноидальные, спинномозговые, эпидуральные и интрастенальные инъекции и инфузии.
Термин «рак», используемый в данном документе, относится к лимфопролиферативным заболеваниям, таким как лимфомы, лимфоцитарные лейкозы, а также к таким как рак легкого, немелкоклеточный рак легкого (NSCL), бронхиолоальвеолярный рак легкого, рак кости, рак поджелудочной железы, рак кожи, рак головы или шеи, кожная или внутриглазная меланома, рак матки, рак яичников, рак прямой кишки, рак анальной области, рак желудка, рак толстой кишки, рак молочной железы, рак матки, карцинома фаллопиевых труб, карцинома эндометрия, карцинома шейки матки, карцинома влагалища, карцинома вульвы, болезнь Ходжкина, рак пищевода, рак тонкой кишки, рак эндокринной системы, рак щитовидной железы, рак паращитовидной железы, рак надпочечника, саркома мягких тканей, рак уретры, рак полового члена, рак предстательной железы, рак мочевого пузыря, рак почек или мочеточников, почечно-клеточная карцинома, карцинома почечной лоханки, мезотелиома, гепатоцеллюлярный рак, рак желчного пузыря, опухоли центральной нервной системы (ЦНС), опухоли спинного мозга, глиома головного мозга, мультиформная глиобластома, астроцитомы, шванномы, эпендимомы, медуллобластомы, менингиомы, плоскоклеточные карциномы, аденома гипофиза и саркома Юинга, включая рефракторные версии любого из вышеперечисленных видов рака, или комбинацию одного или более чем одного из вышеперечисленных видов рака.
Эти композиции также могут содержать вспомогательные вещества, такие как консерванты, смачивающие агенты, эмульгаторы и диспергирующие агенты. Профилактика наличия микроорганизмов может быть обеспечена как за счет стерилизации, как сказано выше, так и за счет включения различных антибактериальных и противогрибковых агентов, например, парабена, хлорбутанола, фенола, сорбиновой кислоты и т.п. Также может быть целесообразным включение в композиции изотонических агентов, таких как сахара, хлорид натрия и т.п. Кроме того, удлиненную абсорбцию инъекционной фармацевтической формы можно получить путем включения агентов, которые задерживают абсорбцию, таких как моностеарат алюминия и желатин.
Независимо от выбранного пути введения, соединения данного изобретения, которые могут быть использованы в подходящей гидратированной форме, и/или фармацевтические композиции данного изобретения составляют в фармацевтически приемлемые лекарственные формы с помощью традиционных способов, известных специалистам в данной области.
Фактические уровни доз активных ингредиентов в фармацевтических композициях данного изобретения могут быть изменены таким образом, чтобы получить количество активного ингредиента, эффективное для достижения желаемого терапевтического эффекта для конкретного пациента, композиции и способа введения, но не токсичное для пациента. Выбранный уровень доз будет зависеть от ряда фармакокинетических факторов, включая активность конкретных используемых композиций данного изобретения, путь введения, время введения, скорость выведения конкретного используемого соединения, продолжительность лечения, другие препараты, соединения и/или материалы, используемые в сочетании с конкретными используемыми композициями, возраст, пол, вес, состояние, общее состояние здоровья и историю болезни пациента, подлежащего лечению, и т.п.факторов, хорошо известных в медицине.
Композиция должна быть стерильной и жидкой при условии, что она доставляется с помощью шприца. Кроме воды, предпочтительным носителем является изотонический буферный солевой раствор.
Соответствующая текучесть может быть обеспечена, например, путем использования покрытий, таких как лецитин, путем поддержания требуемого размера частиц в случае дисперсии и путем применения поверхностно-активных веществ. Во многих случаях в композицию предпочтительно включать изотонические агенты, например, сахара, многоатомные спирты, такие как маннит или сорбит, и хлорид натрия.
Описание аминокислотных последовательностей
№1 <IGF-1R> тяжелая цепь, OA-Ak18-scFab-GA201 (+WT)
№2 <IGF-1R> легкая цепь, OA-Ak18-scFab-GA201 (+WT)
№3 <EGFR> связанные пептидом тяжелая и легкая цепи с дисульфидной стабилизацией VH 44/VL100 из OA-Ak18-scFab-GA201
№4 <EGFR> связанные пептидом тяжелая и легкая цепи OA-Ak18-scFab-GA201_WT
№5 <EGFR> тяжелая цепь, OA-GA201-scFab-Ak18 (+WT)
№6 <EGFR> легкая цепь, OA-GA201-scFab-Ak18 (+WT)
№7 <IGF-1R> связанные пептидом тяжелая и легкая цепи с дисульфидной стабилизацией VH 44 /VL100-OA-GA201-scFab-Ak18
№8 <IGF-1R> связанные пептидом тяжелая и легкая цепи OA-GA201-scFab-Ak18_WT
№9 <VEGF> тяжелая цепь, Ang2-VEGF OA-Ava-N-scFabLC06 (+SS)
№10 <VEGF> легкая цепь, Ang2-VEGF OA-Ava-N-scFabLC06 (+SS)
№11 <ANG-2> связанные пептидом тяжелая и легкая цепи с дисульфидной стабилизацией VH 44/VL100 of Ang2-VEGF OA-Ava-N-scFabLC06SS
№12 <ANG-2> связанные пептидом тяжелая и легкая цепи Ang2-VEGF OA-Ava-N-scFabLC06
№13 Человеческий EGFR
№14 Человеческий IGF-1R
№15 Человеческий VEGF
№16 Человеческий ANG-2
Далее приведены примеры, список последовательностей и графические материалы, чтобы помочь пониманию данного изобретения, истинные рамки которого изложены в формуле изобретения. Следует понимать, что в изложенных процедурах могут быть сделаны изменения без отступления от сущности изобретения.
Экспериментальная процедура
Примеры
Материалы и методы
Методики рекомбинантной ДНК
Были использованы стандартные способы манипулирования ДНК, описанные в Sambrook, J. et al., Molecular cloning: A laboratory manual; Cold Spring Harbor Laboratory Press, Cold Spring Harbor, New York, 1989. Молекулярно-биологические реагенты использовали в соответствии с инструкциями изготовителей.
Анализ последовательности ДНК и белка и управления данными о последовательностях
Общая информация о нуклеотидных последовательностях легких и тяжелых цепей человеческого иммуноглобулина приведена в: Kabat, E.A., et al., (1991) Sequences of Proteins of Immunological Interest, Fifth Ed., NIH Publication No 91-3242. Аминокислоты цепей антител пронумерованы в соответствии с нумерацией ЕС (Edelman, G.M., et al., PNAS 63 (1969) 78-85; Kabat, E.A., et al., (1991) Sequences of Proteins of Immunological Interest, Fifth Ed., NIH Publication No 91-3242). Пакет программного обеспечения GCG (Genetics Computer Group, Мэдисон, Висконсин) версии 10.2 и программа от Infomax Vector NTI Advance Suite версии 8.0 использовали для создания, картирования, анализа, аннотации и иллюстрации последовательности.
Секвенирование ДНК
Последовательности ДНК определяли путем секвенирования двойной цепи, осуществляемого на SequiServe (Vaterstetten, Германия) и Geneart AG (Регенсбург, Германия).
Синтез генов
Требуемые сегменты генов были изготовлены Geneart AG (Регенсбург, Германия) из синтетических олигонуклеотидов и ПЦР-продуктов путем автоматизированного синтеза генов. Сегменты генов, кодирующие тяжелые цепи антитела типа «ключ-замок», несущие мутации S354C и T366W, и тяжелые цепи антитела типа «ключ-замок», несущие мутации Y349C, T366S, L368A и Y407V в домене СНЗ в сочетании с немодифицированными VH-доменами или scFab-фрагментами антител, а также легкие цепи антитела фланкировали сайтами рестрикции уникальных рестриктаз (BamHI - XbaI и BamHI - KpnI) и клонировали в плазмиды pGA18 (ampR). Плазмидные ДНК очищали из трансформированных бактерий и определяли концентрацию путем УФ-спектроскопии. Последовательность ДНК субклонированных фрагментов генов подтверждали путем секвенирования ДНК. Все конструкции были разработаны с 5'-концевой последовательностью ДНК, кодирующей лидерный пептид (MGWSCIILFLVATATGVHS), который ориентирует белки на секрецию в эукариотических клетках.
Конструирование экспрессионных плазмид
Экспрессионный вектор Roche использовали для конструирования всех экспрессионных плазмид, кодирующих тяжелые цепи типа «ключ-замок», а также легкие цепи антител. Вектор состоит из следующих элементов:
- гена устойчивости к гигромицину в качестве маркера селекции,
- сайта начала репликации, oriP, вируса Эпштейна-Барр (ВЭБ),
- сайта начала репликации из вектора pUC18, который обеспечивает репликацию этой плазмиды в E.coli
- гена бета-лактамазы, который придает устойчивость к ампициллину в E.coli,
- немедленного раннего энхансера и промотора цитомегаловируса человека (HCMV),
- человеческой 1-иммуноглобулиновой сигнальной последовательности полиаденилирования(«поли А»), и
- уникальных сайтов рестрикции BamHI и XbaI.
Гены иммуноглобулинов, содержащие тяжелые цепи типа «ключ-замок» с немодифицированными VH-доменами или scFab-фрагментами, а также немодифицированные легкие цепи получали путем генного синтеза и клонировали в плазмиды pGA18 (ampR), как было описано. Плазмиды pG18 (ampR), несущие синтезированные ДНК-сегменты, и экспрессионный вектор Roche расщепляли с помощью рестрикционных ферментов BamHI и XbaI или BamHI и KpnI (Roche Molecular Biochemicals) и подвергали гель-электрофорезу в агарозном геле. Затем очищенные сегменты ДНК, кодирующие тяжелые цепи типа «ключ-замок» и немодифицированные легкие цепи, лигировали с выделенным фрагментом BamHI/XbaI или BamHI/KpnI экспрессионного вектора Roche, получая окончательные экспрессионные векторы. Окончательными экспрессионными векторами трансформировали клетки E.coli, выделяли ДНК экспрессионных плазмид (Miniprep) и подвергали рестрикционному анализу и секвенированию ДНК. Правильные клоны выращивали в 150 мл среды LB-Amp, снова выделяли плазмидную ДНК (Maxiprep) и подтверждали целостность последовательности путем секвенирования ДНК.
Временная экспрессия биспецифических антител в клетках HEK293
Рекомбинантные биспецифические антитела экспрессировали путем временной трансфекции человеческих эмбриональных почечных клеток 293-F с помощью системы для экспрессии FreeStyle™ 293 Expression System в соответствии с инструкцией изготовителя (Invitrogen, США). Вкратце, суспензию клеток FreeStyle™ 293-F культивировали в среде для экспрессии FreeStyle™ 293 при 37°C/8% CO2 и в день трансфекции высевали клетки в свежую среду с плотностью 1-2×106 жизнеспособных клеток/мл. Комплексы «ключ-замок» ДНК-293fectin получали в среде Opti-MEM® I (Invitrogen, США) с использованием 325 мкл 293fectin™ (Invitrogen, Германия) и 250 мкг плазмидной ДНК с тяжелыми цепями типа «ключ-замок» 1 и 2 и легкой цепью в молярном соотношении 1:1:1 или 1:2:1 в конечном объеме для трансфекции 250 мл. Клеточные культуральные супернатанты, содержащие антитела, собирали через 7 дней после трансфекции путем центрифугирования при 14000 g в течение 30 минут и фильтровали через стерильный фильтр (с размером пор 0,22 мкм). Супернатанты хранили при температуре -20°С до очистки.
Очистка биспецифических антител
Биспецифические антитела очищали из клеточных культуральных супернатантов с помощью аффинной хроматографии с использованием белка А-Sepharose™ (GE Healthcare, Швеция) и гель-проникающей хроматографии на Superdex200. Вкратце, стерильные профильтрованные клеточные культуральные супернатанты очищали на колонке HiTrap ProteinA HP (5 мл), уравновешенной буфером PBS (10 мМ Na2HPO4, 1 мМ KH2PO4, 137 мМ NaCl и 2,7 мМ KCl, рН 7,4). Несвязанные белки отмывали с помощью уравновешивающего буфера. Антитело и варианты антитела элюировали 0,1 М цитратным буфером, рН 2,8, и фракции, содержащие белок, нейтрализовали 0,1 мл 1 М Tris, рН 8,5. Затем элюированные белковые фракции объединяли, концентрировали с помощью устройства с центробежным фильтром Amicon Ultra (MWCO: 30 K, Millipore) до объема 3 мл и наносили на гель-фильтрационную колонку Superdex200 HiLoad 120 мл 16/60 (GE Healthcare, Швеция), уравновешенную 20 мМ гистидином, 140 мМ NaCl, рН 6,0. Фракции, содержащие очищенные биспецифические антитела с менее чем 5% высокомолекулярных агрегатов, собирали и хранили в виде аликвот 1,0 мг/мл при -80°С.
Анализ очищенных белков
Концентрацию белка в очищенных образцах белка определяли путем измерения оптической плотности (ОП) при 280 нм, используя коэффициент молярной экстинкции, рассчитанный на основе аминокислотной последовательности. Чистоту и молекулярную массу биспецифических и контрольных антител анализировали с помощью SDS-PAGE в присутствии и в отсутствие восстанавливающего агента (5 мМ 1,4-дитиотреитола) и окрашивания бриллиантовым синим Кумасси. Гелевую систему NuPAGE® Pre-Cast (Invitrogen, США) использовали в соответствии с инструкцией изготовителя (4-20% гели Tris-глицин). Общее содержание биспецифических и контрольных антител в образцах анализировали с помощью высокопроизводительной SEC с использованием аналитической гель-проникающей колонки Superdex 200 (GE Healthcare, Швеция) в рабочем буфере 200 мМ KH2PO4, 250 мМ KCl, рН 7,0, при 25°С. 25 мкг белка наносили на колонку со скоростью потока 0,5 мл/мин и изократически элюировали более 50 минут. Для анализа стабильности очищенные белки с концентрацией 1 мг/мл инкубировали при 4°С и 40°С в течение 7 дней, а затем оценивали с помощью высокопроизводительной SEC. Целостность аминокислотного остова легких и тяжелых цепей восстановленных биспецифических антител проверяли с помощью масс-спектрометрии NanoElectrospray Q-TOF после удаления N-гликанов путем ферментативной обработки пептид-N-глюкозидазой F (Roche Molecular Biochemicals).
Поверхностный плазменный резонанс
Аффинность связывания определяли путем стандартного анализа связывания при 25°С, такого как методика поверхностного плазменного резонанса (BIAcore®, GE Healthcare, Упсала, Швеция). Для измерения аффинности 30 мкг/мл анти-Fcγ-антител (козлиных, Jackson Immuno Research) связывали с поверхностью сенсорного чипа СМ-5 путем стандартного аминного связывания и химической реакции блокировки на инструменте SPR (Biacore Т100). После конъюгации моно- или биспецифические Her3/cMet-антитела вводили при 25°С со скоростью потока 5 мкл/мин, затем вводили серию разведении (от 0 нМ до 1000 нМ) человеческого HER3 или c-Met ECD со скоростью 30 мкл/мин. В качестве рабочего буфера в эксперименте связывания использовали PBS/0,1% BSA. Затем чип регенерировали с помощью 60-секундного импульса раствора 10 мМ глицин-HCl, рН 2,0.
Поверхностный плазменный резонанс EGFR/IGF-1R
Эксперименты SPR проводили с использованием инструмента Biacore Т100 (GE Healthcare Biosciences AB, Упсала, Швеция). IGF-1R или EGFR иммобилизовали на поверхности сенсорного чипа СМ5 с использованием стандартной химической реакции аминного связывания. IGF-1R или EGFR вводили в ацетате натрия, рН 5,0, в концентрации 1 мкг/мл с использованием процедуры иммобилизации Wizard с целью 200 RU (IGF-1R) или 100 RU (EGFR). Референсные контрольные проточные ячейки обрабатывали таким же образом, но только с буфером-носителем. Антитела разводили в 1xPBS рН 7,4, 0,05% Tween 20 (Roche Diagnostics GmbH) и вводили в возрастающих концентрациях от 3,125 до 50 нМ со скоростью потока 30 мкл/мин. Время контактирования (фаза ассоциации) составляло 3 мин (связывание EGFR) и 5 мин (связывание IGF-1R), время диссоциации составляло 10 мин (EGFR) и 3 мин (IGF-1R), Связывание EGFR регенерировали путем введения 0,85% фосфорной кислоты в течение 30 с со скоростью потока 5 мкл/мин. Связывание IGF-1R регенерировали путем введения 4 М хлорида магния в течение 1 мин со скоростью 5 мкл/мин. Кинетические константы скорости и константы равновесия диссоциации рассчитывали с использованием модели связывания Ленгмюра с соотношением 1:1 на программном обеспечении Biaevaluation.
Чтобы продемонстрировать одновременное связывание, биспецифические антитела наносили на EGFR-поверхность в концентрации 25 нМ на 1 мин со скоростью потока 5 мкл/мин. После захвата антитела на EGFR-поверхности IGF-1R в возрастающих концентрациях от 2,5 до 80 нМ со скоростью потока 30 мкл/мин. Поверхность регенерировали путем введения 0,85% фосфорной кислоты в течение 30 секунд со скоростью потока 5 мкл/мин. Кинетические константы скорости и константы равновесия диссоциации рассчитывали с использованием модели связывания Ленгмюра с соотношением 1:1 на программном обеспечении Biaevaluation.
Поверхностный плазменный резонанс (Biacore) ANG-2 связывания
Связывание антител с антигеном, например, человеческим Ang-2, исследовали путем поверхностного плазменного резонанса с помощью инструмента BIACORE Т100 (GE Healthcare Biosciences AB, Упсала, Швеция). Вкратце, для измерения аффинности козлиные поликлональные антитела <hlgG-Fcgamma> иммобилизовали на чипе СМ5 путем аминного связывания для презентации антител против человеческого ANG-2 (фиг.6 В). Связывание измеряли в буфере HBS (HBS-P (10 мМ HEPES, 150 мМ NaCl, 0,005% Tween 20, pH 7,4), 25°С. Очищенный ANG-2-His (с помощью R&D systems или самостоятельно очищенный) добавляли в различных концентрациях от 6,25 нМ до 200 нМ в растворе. Ассоциацию измеряли путем ANG-2-введения в течение 3 минут; диссоциацию измеряли путем промывания поверхности чипа буфером HBS в течение 3 минут, и рассчитывали значение KD с использованием модели связывания Ленгмюра 1:1. Из-за гетерогенности препарата Ang-2 связывания 1:1 не наблюдалось; значения KD, таким образом, являлись только относительными оценками. Отрицательные контрольные данные (например, кривые для буфера) вычитали из кривых для образцов для коррекции внутренней линии начала отсчета и для снижения уровня шума сигнала. Программное обеспечение Biacore Т100 Evaluation Software версии 1.1.1 использовали для анализа сенсограмм и для расчета значений аффинности. Кроме того, Ang-2 мог быть захвачен на уровне захвата 2000-1700 RU через PentaHisAntibody (PentaHis-Ab BSA-free, Qiagen, №34660), который иммобилизовали на чипе СМ5 путем аминного связывания (без BSA) (см. ниже).
Поверхностный плазменный резонанс (Biacore) VEGF-связывания
VEGF-связывание биспецифических антител <VEGF-Ang-2> исследовали с помощью методики поверхностного плазмонного резонанса на инструменте Biacore Т100 в соответствии со следующим протоколом и анализировали с помощью программного пакета Т100: Вкратце, антитела <VEGF> фиксировали на чипе СМ5 за счет связывания с козлиным противочеловеческим IgG (JIR 109-005-098). Антитело захвата иммобилизовали путем аминного связывания, прводя стандартное аминное связывание следующим образом: буфер HBS-N служил рабочим буфером, активацию осуществляли смесью EDC/NHS с целевой плотностью лиганда 700 RU. Антитело захвата разводили в связывающем NaAc-буфере, рН 5,0, с=2 мкг/мл, наконец, еще активированные карбоксильные группы блокировали путем введения 1 М этаноламина. Захват моноклональных антител <VEGF> проводили со скоростью потока 5 мкл/мин и концентрацией (МКА<VEGF>)=10 нМ, разводили рабочим буфером + 1 мг/мл BSA; должен быть достигнут уровень захвата примерно 30 RU. rhVEGF (rhVEGF, R&D Systems, кат. №293-VE) использовали в качестве анализируемого вещества. Кинетическая характеризацию VEGF-связывания с антителами <VEGF> проводили при 37°С в PBS+0,005% (объем/объем) Tween 20 в качестве рабочего буфера. Образец вводили со скоростью потока 50 мкл/мин, временем ассоциации 80 секунд и временем диссоциации 1200 секунд, с серией концентраций rhVEGF от 300 до 0,29 нМ. Регенерацию свободной от антител захват поверхности проводили с помощью 10 мМ глицина, рН 1,5, в течение времени контактирования 60 секунд после каждого аналитического цикла. Кинетические константы рассчитывали с использованием обычного способа двойного контроля (контроль: связывание rhVEGF с молекулой захвата козлиным противочеловеческим IgG, пустые измерительные проточные ячейки, концентрация rhVEGF «0», модель: связывание Ленгмюра 1:1, (настройки Rmax местные из-за связывания молекулы захвата).
Создание клеточной линии HEK293-Tie2
Для того чтобы определить вмешательство ангиопоэтин-2-антител в ANG2-стимулированное фосфорилирование Tie2 и связывание ANG2 с Tie2 на клетках, была создана рекомбинантная клеточная линия HEK293-Tie. Вкратце, плазмиды на основе pcDNA3 (RB22-pcDNA3 Topo hTie2), кодирующие человеческий Tie2 полной длины (SEQ ID №108) под контролем промотора CMV и с маркером устойчивости к неомицину, трансфицировали с использованием Fugene (Roche Applied Science) в качестве трансфекционного реагента в клетки HEK293 (АТСС), и выбирали устойчивые клетки в DMEM 10% FCS, 500 мкг/мл G418. Отдельные клоны выделяли с помощью цилиндров для клонирования, а затем анализировали на предмет экспрессии Tie2 посредством FACS. Клон 22 был идентифицирован как клон с высокой и стабильной экспрессией Tie2 даже в отсутствие G418 (HEK293-Tie2 клон 22). Затем HEK293-Tie2 клон 22 использовали для клеточных анализов: ANG2-индуцированное фосфорилирование Tie2 и анализ связывания клеточного лиганда ANG2.
Анализ VEGF-индуцированной пролиферации HUVEC
Пролиферация VEGF-индуцированных HUVEC (Human Umbilical Vein Endothelial Cells, человеческих эндотелиальных клеток пупочной вены, Promocell № С-12200) была выбрана для измерения клеточной функции VEGF-антител. Вкратце, 5000 HUVEC-клеток (низкое число пассажей, ≤5 пассажей) на 96 лунок инкубировали в течение ночи в 100 мкл минимальной среды (ЕВМ-2, эндотелиальная базальная среда 2, Promocell № С-22211, 0,5% FCS, пенициллин/стрептомицин) в покрытом коллагеном I 96-луночном микротитровальном планшете BD Biocoat Collagen I (BD №354407/35640). Различные концентрации антитела смешивали с rhVEGF (конечная концентрация 30 нг/мл, BD №354107) и предварительно инкубировали в течение 15 минут при комнатной температуре. Затем смесь добавляли к HUVEC-клеткам и инкубировали их в течение 72 ч при 37°С, 5% CO2. В день анализа планшет доводили до комнатной температуры в течение 30 мин и определяли жизнеспособность/пролиферацию клеток с помощью набора CellTiter-GloTM Luminescent Cell Viability Assay в соответствии с инструкцией (Promega, № G7571/2/3). Люминесценцию определяли в спектрофотометре.
Анализ ANG2-индуцированного фосфорилирования Tie2
Ингибирование ANG2-индуцированного фосфорилирования Tie2 биспецифическими антителами <ANG2-VEGF> измеряли в соответствии со следующим принципом анализа. HEK293-Tie2 клон 22 стимулировали ANG2 в течение 5 минут в отсутствие или в присутствии антител <ANG2-VEGF>, и количественно оценивали P-Tie2 путем ИФА типа «сэндвич». Вкратце, 2×105 клеток HEK293-Tie2 клона 22 на лунку выращивали в течение ночи в 96-луночном микротитровальном планшете, покрытом поли-D-лизином, в 100 мкл DMEM, 10% FCS, 500 мкг/мл генетицина. На следующий день в микротитровальном планшете готовили ряд титров антител <ANG2-VEGF> (4-кратный концентрированный, конечный объем 75 мкл/лунка, в дубликатах) и смешивали с 75 мкл разведения ANGPT2 (R&D systems, №623-AN] (3,2 мкг/мл в качестве 4-кратного концентрированного раствора). Антитела и ANG2 предварительно инкубировали в течение 15 мин при комнатной температуре. 100 мкл смеси добавляли к клеткам HEK293-Tie2 клон 22 (предварительно инкубированным в течение 5 мин с 1 мМ NaV3O4, Sigma, № S6508) и инкубировали в течение 5 мин при 37°С. Затем клетки промывали 200 мкл/лунка ледяного PBS + 1 мМ NaV3O4 и лизировали путем добавления 120 мкл/лунка буфера для лизиса (20 мМ Tris, pH 8,0, 137 мМ NaCl, 1% NP-40, 10% глицерин, 2 мМ EDTA, 1 мМ NaV3O4, 1 мМ PMSF и 10 мкг/мл апротинина) на льду. Клетки лизировали в течение 30 мин при 4°С на планшетном шейкере и 100 мкл лизатов переносили непосредственно в микротитровальный планшет для ELISA p-Tie2 (R&D Systems, R&D № DY990) без предварительного центрифугирования и без определения общего количества белка. Количество Р-Tie2 оценивали в соответствии с инструкцией изготовителя и определяли значения IC50 для ингибирования с использованием программного модуля XLfit4 для Excel (Dose-response one site, модель 205).
Люминесцентный анализ жизнеспособности клеток
Жизнеспособность и пролиферацию клеток количественно оценивали с помощью люминесцентного анализа титра клеток (Promega). Анализ проводили в соответствии с инструкцией изготовителя. Вкратце, клетки культивировали в 96-луночных планшетах в общем объеме 100 мкл в течение требуемого периода времени. Для анализа пролиферации клетки удаляли из инкубатора и оставляли при комнатной температуре на 30 мин. Добавляли 100 мкл реагента для люминесцентного анализа и помещали многолуночные планшеты на орбитальный шейкер на 2 мин. Люминесценцию количественно оценивали через 15 минут на микропланшетном ридере (Tecan).
Пример 1а
Экспрессия и очистка молекул биспецифических двухвалентных антител <VEGF-ANG-2>
В соответствии с процедурами, описанными в приведенном выше разделе Материалы и методы, экспрессировали молекулы биспецифических двухвалентных <VEGF-ANG-2>-антител Ang2-VEGF-OA-Ava-N-scFabLC06SS и Ang2-VEGF-OA-Ava-N-scFabLC06 и очищали их. VH- и VL-части <VEGF> основаны на бевацизумабе. VH- и VL-части <ANG2> основаны на VH- и VL-последовательностях ANG2i-LC06 (которое описано в заявке РСТ № РСТ/ЕР2009/007182 и получено с помощью фагового дисплея). Соответствующие аминокислотные последовательности легких и тяжелых цепей этих биспецифических двухвалентных антител приведены в SEQ ID №9, SEQ ID №10, SEQ ID №11 (для Ang2-VEGF-OA-Ava-N-scFabLC06SS), а также в SEQ ID №9, SEQ ID №10, SEQ ID №12 (для Ang2-VEGF-OA-Ava-N-scFabLC06). Экспрессию Ang2-VEGF-OA-Ava-N-scFabLC06SS и Ang2-VEGF-OA-Ava-N-scFabLC06 подтверждали путем вестерн-блоттинга. Очистка Ang2-VEGF-OA-Ava-N-scFabLC06SS и Ang2-VEGF-OA-Ava-N-scFabLC06 приводила к следующему выходу.
Связывание и другие свойства определены в соответстии с описанием выше.
Пример 1b
Экспрессия и очистка молекул биспецифических двухвалентных антител <IGF-1R-EGFR>
В соответствии с процедурами, описанными в приведенном выше разделе Материалы и методы, экспрессировали молекулы биспецифических двухвалентных <IGF-1R-EGFR> антител OA-Ak18-scFab-GA201 и OA-GA201-scFab-Ak18 с соотношением плазмид 1:1:1 и очищали их. Биспецифическое антитело основано на антигенсвязывающих сайтах <IGF-1R> HUMAB клон 18 (DSM АСС 2587; WO 2005/005635, сокращенно <IGF-1R> клон 18 или <IGF-1R> AK18) и гуманизированного <EGFR> ICR62 (WO 2006/082515, сокращенно <EGFR> ICR62). Соответствующие аминокислотные последовательности легких и тяжелых цепей этих биспецифических двухвалентных антител приведены в SEQ ID №1, SEQ ID №2, SEQ ID №3 (для OA-Ak18-scFab-GA201), а также в SEQ ID №5, SEQ ID №6, SEQ ID №7 (для OA-GA201-scFab-Ak18). Экспрессию OA-Ak18-scFab-GA201 и OA-GA201-scFab-Ak18 подтверждали путем вестерн-блоттинга. После очистки клеточных культуральных супернатантов на белке А обе конструкции показали от 50 до 58% биспецифического антитела с ожидаемой молекулярной массой приблизительно 148 кДа, определенной путем аналитической SEC, и большое количество полуантитела с молекулярной массой 100 кДа. После SEC-очистки обе конструкции показали от 86 до 90% однородного мономера с молекулярной массой 148 кДа и остаточный побочный продукт с массой 100 кДа. OA-GA201-scFab-Ak18 также экспрессировали с соотношением плазмид 1:2:1 и подвергали очистке на белке А и SEC-очистке. По сравнению с соотношением при экспрессии 1:1:1, количество полуантитела при уровнях экспрессии 1:2:1 после очистки на белке А было снижено с 30% до 6% при определении с помощью Bioanalyzer (Caliper analysis). Масс-спектрометрический анализ SEC-очищенных белков подтвердил эффективное удаление гуманизированного полуантитела, состоящего из тяжелой цепи 1 <EGFR> ICR62, путем изменения соотношения плазмид при трансфекции. Выход OA-GA201-scFab-Ak18 после очистки был увеличен на 40% с соотношением плазмид 1:2:1 при экспрессии в клетках HEK293.
Молекулу биспецифического двухвалентного <IGF-1R-EGFR> антитела ОА-GA201-scFab-Ak18_WT (с соответствующими аминокислотными последовательностями легких и тяжелых цепей, приведенными в SEQ ID №5, SEQ ID №6, SEQ ID №8) экспрессировали с соотношением плазмид 1:1:1 и 1:2:1 и очищали аналогичным образом.
Результаты для соотношения плазмид 1:2:1:
Конструкции ОА-scFab только с 3 плазмидами имели преимущество, заключающееся в ценном побочном продукте, по сравнению с аналогичными гетеродимерными подходами, использующими методику «ключ-замок» для создания биспецифических молекул с 4 экспрессионными плазмидами (см., например, WO 2009/080253). Антитела в соответствии с изобретением демонстрируют полное отсутствие ошибочно парных легких цепей или антител с отсутствием легкой цепи (данные не представлены).
Было показано, что описанный способ 1:2:1 дает выход биспецифических молекул с высокой чистотой и явным снижением количества полуантител и полным отсутствием ошибочно парных легких цепей или антител с отсутствием легкой цепи (данные не представлены).
Связывание и другие свойства определены, как описано выше.
Молекула биспецифического двухвалентного <IGF-1R-EGFR> антитела ОА-Ak18-scFab-GA201_WT (с соответствующими аминокислотными последовательностями легких и тяжелых цепей, приведенными в в SEQ ID №1, SEQ ID №2, SEQ ID №4 (для OA-Ak18-scFab-GA201_WT) может быть экспрессирована и очищена аналогичным образом.
Пример 2
(Одновременное) связывание биспецифических антител с обоими антигенами
Связывание различных форматов биспецифического антитела сравнивали со связыванием IgG «дикого типа», из которого получены связывающие модули и биспецифические антитела. Эти исследования проводили с применением поверхностного плазмонного резонанса (Biacore), описанного выше. Может быть обнаружено одновременное связывание биспецифического антитела OA-GA201-scFab-Ak18_WT с IGF-1R и EGFR.
Инструмент: Biacore T100 (GE Healthcare), T200 с повышенной чувствительностью
Программное обеспечение: T200 Control, версия 1.0
Программное обеспечение: T200 Evaluation, версия 1.0
Чип: CM5-Chip
Анализ
Стандартное аминное связывание в проточных ячейках с 1 по 4 в соответствии с инструкцией изготовителя: рабочий буфер: буфер HBS-N, активация смесью EDC/NHS, целевая плотность лиганда. EGFR разводили в связывающем NaAc-буфере, рН 4,5, с=15 мкг/мл; наконец, оставшиеся активированные карбоксильные группы блокировали путем введения 1М этаноламина.
Связанный с амином EGFR в проточной ячейке 1 использовали в качестве рефенсной контрольной поверхности для коррекции возможных буферных эффектов или неспецифического связывания.
Одновременное связывание измеряли при скорости потока 30 мкл/мин и температуре 25°С. Биспецифическое антитело вводили в течение 2 минут при концентрации с=10 нМ, после чего немедленно вводили человеческий или обезьяний IGF1R (время ассоциация: 2 минуты, время диссоциации: 3 минуты, с=150 нМ).
Все образцы разводили рабочим буфером + 1 мг/мл BSA.
После каждого цикла производили регенерацию с помощью 15 мМ NaOH, время контакта 1 минута, скорость потока 30 мкл/мин. Отрицательный контроль: вместо IGF1R в качестве отрицательного контроля вводили буфер для разведения.
Результаты
Биспецифические антитела: OA-GA201-scFab-Ak18_WT продемонстрировало одновременное связывание сцепленного амином человеческого EGFR и человеческого IGF1R (см. сенсограммы фиг.9).
Пример 3а
Ингибирование фосфорилирования Tie2 моноклональным антителом ANG2-VEGF
Ингибирование VEGF-индуцированной пролиферации HUVEC биспецифическими антителами <ANG2-VEGF> измеряли в соответствии с анализом по описанному выше принципу. Результаты представлены на фиг.5.
Пример 3b
Ингибирование фосфорилирования Tie2 моноклональным антителом ANG2-VEGF
Ингибирование ANG2-индуцированного фосфорилирования Tie2 биспецифическими антителами <ANG2-VEGF> измеряли в соответствии с принципом анализа. Описанные выше результаты показаны на фиг.6.
Пример 4
Интернализация/подавление IGF-1R биспецифическими антителами <EGFR-IGF1R>
Человеческое анти-IGF-1R-антитело <IGF-1R> HUMAB клон 18 (DSM АСС 2587) ингибирует сигналинг IGF-1R и вызывает интернализацию и последующее подавление IGF-1R. Для оценки потенциальной ингибирующей активности биспецифических антител <EGFR-IGF1R> анализировали степень подавления IGF-1R.
Для того чтобы обнаружить влияние антитела изобретения на количество рецептора IGF-1 (IGF-1R) в опухолевых клетках, выполняли эксперименты с течением времени и последующий анализ ELISA со специфическими антителами IGF-1R и EGFR.
Человеческие опухолевые клетки Н322М (полученные из NCI) культивировали в 96-луночных планшетах (1×104 клеток/лунка) в течение ночи при температуре 37°С и 5% CO2 в среде RPMI с добавлением 10% эмбриональной телячьей сыворотки, 2 мМ L-глутамина и 1% PenStrep.
Среду тщательно удаляли и замещали раствором биспецифического антитела <EGFR-IGF1R>, разведенного в среде RPMI до общего объема 100 мкл. Клетки инкубировали при 37°С и 5% CO2 в течение не менее 3, но не более 24 часов.
Среду тщательно удаляли путем аспирации и клетки лизировали с помощью 120 мкл/лунка холодного MES-буфера для лизиса (25 мМ MES, рН 6,5, 2% Triton X-100, 60 нМ октилглюкозид, 150 мМ NaCl, 10 мМ Na3VO4 и ингибитор протеазы Complete®). Планшеты хранили при температуре -20°С до дальнейшего анализа.
Обнаружение IGF-1R
Разведение 1:200 антитела AK1a-биотинилированного (<IGF-1R> HUMAB клон 1а (DSM АСС 2586), описанный в WO2004/087756, Roche, Германия) в PBS, 3% BSA и 0,2% Tween® 20 до конечной концентрации 2,4 мкг/мл вносили в каждую лунку покрытого стрептавидином микротитровального планшета (МТР) (Roche, ID №: 11965891001). Стрептавидин-МТР встряхивали в течение 1 часа при комнатной температуре и затем промывали три раза с помощью 200 мкл на лунку PBS, содержащего 0,1% Tween® 20.
После удаления раствора PBS/Tween в каждую лунку стрептавидин-МТР с антителом добавляли 100 мкл клеточного лизата.
Затем МТР инкубировали еще в течение часа при комнатной температуре со встряхиванием и затем промывали 3 раза с помощью PBS, содержащего 0,1% Tween® 20.
Кроличье антитело IGF-1Rβ (200 мкг/мл, Santa Cruz Biotechnology, кат. № SC-713), разведенное 1:750 в PBS, 3% BSA и 0,2% Tween® 20, использовали для обнаружения IGF-1R, связанного захватывающим антителом AK1a. 100 мкл вносили в каждую лунку и инкубировали в течение 1 часа при комнатной температуре при постоянном встряхивании. Затем раствор удаляли и лунки три раза промывали 200 мкл PBS, содержащим 0,1% Tween® 20. Меченый пероксидазой антикроличий IgG-HRP (Cell Signaling, кат. №7074) использовали в качестве второго антитела в разведении 1:4000 в PBS, 3% BSA и 0,2% Tween® 20. 100 мкл вносили в каждую лунку и инкубировали в течение 1 часа при комнатной температуре со встряхиванием. Планшет промывали шесть раз с помощью PBS, содержащего 0,1% раствор Tween® 20. Вносили 100 мкл на лунку субстрата пероксидазы 3,3'-5,5'-тетраметилбензидина (Roche, BM-Blue ID №11484581) и инкубировали в течение 20 минут при комнатной температуре со встряхиванием. Цветную реакцию останавливали добавлением 25 мкл на лунку 1М H2SO4 и инкубировали еще в течение 5 минут при комнатной температуре. Измеряли оптическую плотность при 450 нм.
Биспецифическое <EGFR-IGF1R> антитело OA-GA201-scFab-Ak18_WT вызывает меньшее подавление, чем человеческое анти-IGF-1R-антитело <IGF-1R> HUMAB клон 18. Подавление, вызванное OA-GA201-scFab-Ak18_WT, было уменьшено более чем на 50% по сравнению с <IGF-1R> HUMAB клон 18.
Пример 5
Ингибирование EGFR-, а также IGF-1R-сигнальных путей биспецифическими антителами <EGFR-IGF1R>
Человеческое анти-IGF-1R-антитело <IGF-1R> HUMAB клон 18 (DSM АСС 2587) ингибирует IGF-1R-сигналинг, а гуманизированное крысиное анти-EGFR-антитело ICR62 ингибирует EGFR-сигналинг. Для оценки потенциальной ингибирующей активности биспецифических антител <EGFR-IGF1R> была проанализирована степень ингибирования обоих сигнальных путей.
Человеческие опухолевые клетки (Н322М, 3×104 клеток/лунка) в среде RPMI с добавлением 10% эмбриональной телячьей сыворотки, 2 мМ L-глутамина и 1% PenStrep высевали в 96-луночные микротитровальные планшеты и культивировали в течение ночи при 37°С и 5% CO2.
Среду тщательно удаляли и заменяли 100 мкл бессывороточной среды DMEM (с добавлением 1 мг/мл RSA, 10 мМ Hepes, 1% PenStrep) и по меньшей мере инкубировали в течение 2,5 часов при 37°С и 5% CO2.
Среду снова тщательно удаляли и замещали разведенными биспецифическими антителами и контрольными антителами (<IGF-1R> HUMAB клон 18 и <EGFR> ICR62 в конечной концентрации 0,01 мг/мл) в бессывороточной среде DMEM в общем объеме 50 мкл, а затем инкубировали в течение 30 мин при 37°С и 5% CO2. Клетки стимулировали добавлением 50 мкл IGF-1 (10 нМ) или EGF (20 нг/мл) (разведенными в бессывороточной среде DMEM) и инкубировали в течение 10 мин при 37°С и 5% CO2.
Среду тщательно удаляли и клетки один раз промывали 100 мкл/лунка ледяным PBS. Клетки лизировали путем добавления 100 мкл/лунка буфера для лизиса клеток от BioRad (BioRad Cell Lysis Kit (BioRad, кат. №171-304012). Планшеты хранили при температуре -20°С до дальнейшего анализа.
Клеточный дебрис удаляли путем фильтрации клеточных лизатов через фильтровальные планшеты Multiscreen HTS с центрифугированием при 500 g в течение 5 минут. Фосфорилирование EGFR и IGF-1R в профильтрованных клеточных лизатах анализировали с использованием системы Luminex и набора Р-EGFR (Tyr) bead kit (Millipore, кат. №46-603) для анализа фосфорилирования EGFR и набора P-IGF-1R (Tyr1131) bead kit (BioRad, кат. №171V27343) для анализа фосфорилирования IGF-1R. Анализы на Luminex проводили, как описано в руководстве BioPlex Phosphoprotein Detection manual (BioRad Bulletin №2903), с использованием набора Phosphoprotein Detection Reagent Kits (BioRad, кат. №171-304004).
Биспецифическое <EGFR-IGF1R> антитело OA-GA201-scFab-Ak18_WT эффективно ингибирует фосфорилирование IGF-1R (IC50: 1 нМ, максимальное ингибирование: >70%) и фосфорилирование EGFR (IC50: 1 нМ, максимальное ингибирование: >90%) на опухолевых клетках Н322М.
Пример 6
Ингибирование роста опухолевых клеток NCI-H322M биспецифическими антителами <EGFR-IGF1R> в 3D-культуре
Человеческое анти-IGF-1R-антитело <IGF-1R> HUMAB клон 18 (DSM АСС 2587) ингибирует рост опухолевых клеточных линий, которые экспрессируют IGF-1R (WO 2005/005635). Аналогично было показано, что гуманизированное крысиное анти-EGFR-антитело <EGFR> ICR62 ингибирует рост опухолевых клеточных линий, которые экспрессируют EGFR (WO 2006/082515). Для оценки потенциальной ингибирующей активности биспецифических антител <EGFR-IGF1R> в анализе роста опухолевых клеточных линий также была проанализирована степень ингибирования на клетках Н322М, которые экспрессируют EGFR и IGF-1R.
Клетки карциномы легкого Н322М (NCI) культивировали в среде RPMI 1640 (РАА, Pasching, Австрия) с добавлением 10% FBS (РАА), 1 мМ пирувата натрия (Gibco, Дармштадт, Германия), заменимых аминокислот (Gibco) и 2 мМ L-глутамина (Sigma, Штайнхейм, Германия). 25000 клеток/лунка высевали в 96-луночные планшеты, покрытые поли-НЕМА (поли(2-гидроксиэтилметакрилатом) (Polysciences, Уоррингтон, Пенсильвания, США)), содержащие культуральную среду. Одновременно вносили различные концентрации биспецифических антител и инкубировали в течение 7 дней. В соответствии с инструкцией изготовителя проводили анализ CellTiterGlo® (Promega, Мэдисон, Висконсин, США) для определения жизнеспособности клеток путем измерения содержания АТФ в клетках.
Результаты показаны на фиг.8. Биспецифическое <EGFR-IGF1R> антитело OA-GA201-scFab-Ak18_WT ингибирует пролиферацию клеток Н322М дозозависимым образом. При дозе 1000 нМ биспецифическое <EGFR-IGF1R> антитело OA-GA201-scFab-Ak18_WT демонстрирует повышенное ингибирование пролиферации по сравнению с родительскими моноспецифическими антителами <IGF-1R> HUMAB клон 18 или <EGFR>ICR62.
Пример 7
Эффективность биспецифических антител <EGFR-IGF1R> in vivo на модели с подкожным ксенотрансплантатом с экспрессией EGFR и IGF-1R
Человеческое анти-IGF-1R-антитело <IGF-1R> HUMAB клон 18 (DSM АСС 2587) ингибирует рост опухолевых клеточных линий, которые экспрессируют IGF-1R (WO 2005/005635). Аналогично было показано, что гуманизированное крысиное анти-EGFR-антитело <EGFR> ICR62 ингибирует рост опухолевых клеточных линий, которые экспрессируют EGFR (WO 2006/082515). Для оценки потенциальной ингибирующей активности биспецифических антител <EGFR-IGF1R> в отношении роста опухоли in vivo была использована модель подкожного ксенотрансплантата ВхРС-3, которая характеризовалась экспрессией EGFR и IGF-1R.
Клетки человеческой клеточной линии рака поджелудочной железы ВхРС-3 (получены из АТСС) культивировали в среде RPMI 1640 (PAN™ Biotech GmbH) с добавлением 10% эмбриональной телячьей сыворотки (Sera Plus; PAN™ Biotech GmbH) и 2 мМ L-глутамина (PAN™ Biotech GmbH) при 37°С в насыщенной паром атмосфере при 5% CO2. В день инокуляции опухолевые клетки ВхРС-3 собирали (с помощью 1х трипсин-EDTA, Roche Diagnostics) из культуральных флаконов и переносили в питательную среду, центрифугировали, промывали один раз и ресуспендировали в PBS. Для введения клеток окончательный титр доводили до 1×108 клеток/мл. Затем 100 мкл этой суспензии (соответствующие 1×107 клеток) вводили подкожно самкам мышей SCID beige в правый бок. Введение носителя, антител <EGFR-IGF1R> и контрольных антител (<IGF-1R> HUMAB клон 18 и <EGFR> ICR62) начинали после того, как опухоли возникали и достигали среднего размера 150-250 мм3. Объем опухоли измеряли два раза в неделю и параллельно наблюдали за весом животного. Отдельные введения и сочетание отдельных антител сравнивали с терапией биспецифическим антителом.
Биспецифическое <EGFR-IGF1R> антитело OA-GA201-scFab-Ak18_WT (20 мг/кг; внутрибрюшинно, один раз в неделю (схема q7d)) демонстрировало сильную противоопухолевую эффективность на модели с подкожным ксенотрансплантатом ВхРС3 (см. фиг.10 и таб. ниже) и ингибировало рост опухоли немного лучше, чем сочетание моноспецифических <IGF-1R> антител HUMAB клон 18 (10 мг/кг; внутрибрюшинно, один раз в неделю (схема q7d)) и <EGFR> ICR62 (10 мг/кг; внутрибрюшинно, один раз в неделю (схема q7d)).
Пример 8
Изготовление гликоинженерных производных биспецифических антител <EGFR-IGF1R>
Гликоинженерные производные биспецифических антител <EGFR-IGF1R> получали путем котрансфекции клеток HEK293-EBNA экспрессионными векторами с тяжелыми и легкими цепями антител млекопитающих с использованием подхода трансфекции с помощью фосфата кальция. Экспоненциально растущие клетки HEK293-EBNA трансфицировали способом с фосфатом кальция. Для производства немодифицированного антитела клетки трансфицировали только экспрессионными векторами с тяжелой и легкой цепями антитела в соотношении 1:1. Для производства гликоинженерного антитела клетки котрансфицировали четырьмя плазмидами, две для экспрессии каждого антитела, одна для экспрессии гибридного полипептида GnTIII и одна для экспрессии маннозидазы II, в соотношении 4:4:1:1, соответственно. Клетки выращивали в виде прикрепленной однослойной культуры в Т-образных колбах с использованием культуральной среды DMEM с добавлением 10% FCS, и трансфицировали, когда их конфлюэнтность составляла от 50 до 80%. Для трансфекции в колбу Т75 за 24 часа до трансфекции высевали 7,5 (до 8) миллионов клеток примерно в 14 мл культуральной среды DMEM с добавлением FCS (до конечной концентрации 10% объем/объем) (конечная концентрация неомицина 250 мкг/мл), и помещали клетки в инкубатор с атмосферой 5% CO2 и температурой 37°С на ночь. Для каждой колбы Т75 для трансфекции готовили раствор ДНК, CaCl2 и воды путем смешивания 47 мкг общей плазмидной ДНК, раделенной поровну между экспрессионными векторами с легкой и с тяжелой цепью, 235 мкл 1 М раствора CaCl2 и добавления воды до конечного объема 469 мкл. К этому раствору добавляли 469 мкл 50 мМ HEPES, 280 мМ NaCl, 1,5 мМ Na2HPO4 при рН 7,05, немедленно смешивали в течение 10 секунд и оставляли при комнатной температуре на 20 секунд. Суспензию разводили примерно 12 мл DMEM с добавлением 2% FCS и добавляли к Т75 взамен находящейся там среды. Клетки инкубировали при 37°С, 5% CO2 в течение 17-20 часов, затем среду заменяли примерно 12 мл DMEM, 10% FCS. Кондиционированную культуральную среду собирали на 5-7 дней после трансфекции, центрифугировали в течение 5 минут при 210-300 g, стерильно фильтровали через фильтр с размером пор 0,22 мкм (или, альтернативно, центрифугировали в течение 5 минут при 1200 оборотах в минуту, затем центрифугировали второй раз в течение 10 минут при 4000 оборотах в минуту) и хранили при 4°С.
Секретированные антитела очищали путем аффинной хроматографии на белке А и заключительного этапа эксклюзионной хроматографии на колонке Superdex 200 (Amersham Pharmacia), заменяя буфер на фосфатно-солевой буфер и собирая чистые мономерные IgG1-антитела. Концентрацию антител оценивали с использованием спектрофотометра по поглощению при 280 нм. Антитела собирали в состав в растворе 25 мМ фосфата калия, 125 мМ хлорида натрия, 100 мМ глицина, рН 6,7.
Гликоинженерные варианты биспецифических антител получали путем котрансфекции экспрессионными векторами с антителами вместе с экспрессионным вектором с гликозилтрансферазой GNT-III или вместе с экспрессионным вектором с GNT-III и экспрессионным вектором с маннозидазой II Гольджи. Гликоинженерные антитела очищали и собирали в состав, как описано выше для негликоинженерных антител. Олигосахариды, прикрепленные к Fc-области антител, анализировали посредством MALDI/TOF-MS, как описано ниже для определения количества фукозы.
Олигосахариды ферментативно высвобождали из антител путем расщепления PNGason F, при этом антитела либо были иммобилизованы на мембране PVDF, либо находились в растворе.
Полученный после расщепления раствор, содержащий высвобожденные олигосахариды, либо непосредственно готовили для анализа MALDI/TOF-MS, либо далее расщепляли гликозидазой EndoH до получения проб для анализа MALDI/TOF-MS. Для всех биспецифических антител в соответствии с изобретением GE означает «гликоинженерное».
Пример 9
Связывание с FcgRIIIa и способность к ADCC биспецифических антител <EGFR-IGF1R>
Степень ADCC, опосредованная данным антителом, зависит не только от антигена, с которым оно связано, но также зависит от аффинностей константных областей к FcgRIIIa, который известен как Fc-рецептор, который вызывает ADCC-реакцию. Для анализа связывания биспецифических антител <EGFR-IGF1R> с FcgRIIIa применяется технология Biacore. По этой технологии оценивается связывание биспецифических антител <EGFR-IGF1R> с рекомбинантно полученными FcgRIIIa-доменами.
Все измерения поверхностного плазменного резонанса проводили на приборе BIAcore 3000 (GE Healthcare Biosciences AB, Швеция) при 25°С. Рабочим буфером и буфером для разведения выступал PBS (1 мМ KH2PO4, 10 мМ Na2HPO4, 137 мМ NaCl, 2,7 мМ KCl), pH 6,0, 0,005% (объем/объем) Tween 20. Растворимый человеческий FcgRIIIa разводили в 10 мМ ацетате натрия, pH 5,0, и иммобилизовали на биосенсорном чипе СМ5 с помощью стандартного набора для аминного связывания (GE Healthcare Biosciences AB, Швеция), чтобы получить поверхностную плотность FcgRIIIa примерно 1000 RU. HBS-P (10 мМ HEPES, pH 7,4, 150 мМ NaCl, 0,005% поверхностно-активное вещество Р20; GE Healthcare Biosciences AB, Швеция) использовали в качестве рабочего буфера во время иммобилизации. Биспецифические антитела XGFR разводили в PBS, 0,005% (объем/объем) Tween 20, рН 6,0, до концентрации 450 нМ и вводили в течение 3 минут со скоростью потока 30 мкл/мин. Затем сенсорный чип регенерировали в течение 1 минуты с помощью PBS, рН 8,0, 0,005% (объем/объем) Tween 20. Анализ данных осуществляли с помощью программного обеспечения BIAevaluation (BIAcore, Швеция).
Чтобы проанализировать, в какой степени способность биспецифических антител <EGFR-IGF1R> связываться с FcgRIIIa переносится также на ADCC-активность in vitro в отношении опухолевых клеток, ADCC-компетентность определяли в клеточных анализах. Для этих анализов получали гликомодифицированные производные биспецифических антител <EGFR-IGF1R> (см. выше) и испытывали их в анализе BIAcore формата ADCC-компетентности, а также в анализе ADCC in vitro, как описано ниже.
Человеческие мононуклеарные клетки периферической крови (РВМС, peripheral blood mononuclear cells) использовали в качестве эффекторных клеток и получали с использованием Histopaque-1077 (Greiner Leucosep №227288), по существу следуя инструкциям производителя. Вкратце, от здоровых добровольцев брали венозную кровь с помощью шприцов с гепарином. Кровь разводили 1:0,75-1,3 в PBS (не содержащем Ca++ или Mg++) и наносили на Histopaque-1077. Градиент центрифугировали при 800 g в течение 30 мин при комнатной температуре без перерывов. Интерфазу, содержащую РВМС, объединяли, промывали PBS (50 мл на клетки из двух градиентов) и собирали центрифугированием при 400 g в течение 10 минут при комнатной температуре. После ресуспендирования осадка в PBS РВМС подсчитывали и промывали второй раз путем центрифугирования при 400 g в течение 10 минут при комнатной температуре. Затем клетки ресуспендирули в соответствующей среде для последующих процедур.
Соотношение эффекторных клеток и мишени, используемое для анализов ADCC, составляло 25:1 для РВМС. Эффекторные клетки готовили в среде AIM-V в соответствующей концентрации и вносили по 50 мкл/лунка в круглодонные 96-луночные планшеты. Клетки-мишени были человеческими клетками, экспрессирующими EGFR/IGFR (например, Н322М, А549 или MCF-7), выращенными в DMEM, содержащей 10% FCS.
Клетки-мишени промывали в PBS, подсчитывали и доводили до плотности 1×106 клеток/мл. Клетки метили Calcein AM (10 мкМ) в течение 30 минут при 37°/5% CO2. Затем меченые клетки дважды промывали PBS и высевали с плотностью 5000 клеток/лунка в 50 мкл (среда AIM-V) в 96-луночных круглодонных планшетах. Антитела разводили в AIM-V, добавляли к 50 мкл предварительно посеянных клеток-мишеней. Затем добавляли эффекторные клетки и инкубировали планшет в течение 4 часов при 37°С в увлажненной атмосфере, содержащей 5% CO2. После инкубационного периода планшеты центрифугировали при 200 g в течение 10 минут, переносили 80 мкл супернатанта в черный флуоресцентный планшет с прозрачным дном и измеряли флуоресценцию (Ех 485 нм/Em 535 нм) с помощью ридера Tecan Infinite.
Следующие контроли включены в анализ:
- фон: аликвоты супернатанта по 50 мкл после мечения клеток + 100 мкл среды
- спонтанный лизис: 50 мкл суспензии клеток-мишеней + 100 мкл среды
- максимальный лизис: 50 мкл суспензии клеток-мишеней + 100 мкл среды/1,5% Triton X-100
- контроль лизиса без антитела: 50 мкл суспензии клеток-мишеней + 50 мкл среды + 50 мкл PBL (периферических лимфоцитов крови)
% антитело-зависимой цитотоксичности рассчитывается следующим образом:
ADCC% = x - спонтанное высвобождение/макс, лизис - спонтанный лизис × 100
Пример 10
Анализ гликоструктуры биспецифических антител <EGFR-IGF1R>
Для определения относительных соотношений содержащих и не содержащих фукозу олигосахаридных структур анализировали высвобожденные гликаны очищенного материала антител посредством MALDI-TOF-масс-спектрометрии. Для этого образец антитела (примерно 50 мкг) инкубировали в течение ночи при 37°C с 5 мЕд N-глюкозидазы F (Prozyme, № GKE-5010B) в 0,1 М натрий-фосфатном буфере, рН 6,0, для того, чтобы высвободить олигосахарид из белкового остова. Затем высвобожденные гликановые структуры выделяли и обессоливали с помощью наконечников для пипетки NuTip-Carbon (полученных от Glygen: NuTip1-10 мкл, кат. № NT1CAR). В качестве первого этапа наконечники для пипетки NuTip-Carbon готовили к связыванию олигосахаридов путем их промывания 3 мкл 1М NaOH, а затем 20 мкл чистой воды (например, стандарт ВЭЖХ-градиента от Baker, №4218), 3 мкл 30% (объем/объем) уксусной кислоты и снова 20 мкл чистой воды. Для этого соответствующие растворы загружали на поверхность хроматографического материала в наконечнике для пипетки NuTip-Carbon и продавливали их через него. После этого гликановые структуры, соответствующие 10 мкг антитела, связывали с материалом в наконечниках для пипетки NuTip-Carbon, протянув четыре-пять раз вверх и вниз продукт расщепления N-глюкозидазой F, описанный выше. Гликаны, связанные с материалом в наконечнике для пипетки NuTip-Carbon, промывали 20 мкл чистой воды таким образом, как описано выше, и поэтапно элюировали 0,5 мкл 10% и 2,0 мкл 20% ацетонитрила, соответственно. Для этого этапа элюирующие растворы помещали в 0,5 мл реакционные сосуды и тянули вверх и вниз по четыре-пять раз каждый. Для анализа посредством масс-спектрометрии MALDI-TOF оба элюата объединяли. Для этого измерения 0,4 мкл комбинированного элюата смешивали на MALDI target с 1,6 мкл матричного раствора SDHB (2,5-дигидроксибензойная кислота/2-гидрокси-5-метоксибензойная кислота [Bruker Daltonics, №209813], растворенные в 20% этаноле/5 мМ NaCl до 5 мг/мл) и анализировали с помощью соответственно настроенного прибора Bruker Ultraflex TOF/TOF. Как правило, регистрировали и суммировали 50-300 импульсов для одного эксперимента. Полученные спектры оценивали с помощью гибкого программного обеспечения для анализа (Bruker Daltonics) и определяли массы для каждого из обнаруженных пиков. Затем пики относили к содержащим и не содержащим фукозу гликольным структурам путем сравнения рассчитанных масс и теоретически ожидаемых масс соответствующих структур (например, комплексных, гибридных и олиго- или высокоманнозных, соответственно, с фукозой и без нее).
Для определения соотношения гибридных структур образец антитела расщепляли N-глюкозидазой F и эндогликозидазой Н в сопутствии. N-гликозидаза F высвобождает все N-связанные гликановые структуры (комплексные, гибридные и олиго- или высокоманнозные структуры) из белкового остова, а эндогликозидаза Н дополнительно расщепляет все гликаны гибридного типа между двумя GlcNAc-остатками на восстановленном конце гликана. Затем этот продукт расщепления обрабатывали и анализировали посредством MALDI-TOF-масс-спектрометрии таким же образом, как описано выше для образца, расщепленного N-глюкозидазой F. Сравнивая картину для продукта расщепления N-глюкозидазы F и для продукта расщепления комбинированных N-глюкозидазы F/эндогликозидазы Н, степень уменьшения сигналов специфической гликоструктуры использовали для оценки относительного содержания гибридных структур.
Из соотношения высоты пиков отдельных гликоструктур рассчитывали относительное количество каждой гликоструктуры и определяли сумму высот пиков всех гликоструктур. Количество фукозы представляет собой процент фукозосодержащих структур, связанных со всеми гликоструктурами, выявленными в образце, обработанном N-глюкозидазой F (например, комплексными, гибридными и олиго- или высокоманнозными структурами, соответственно). Количество афукозилирования представляет собой процент безфукозных структур, связанных со всеми гликоструктурами, выявленными в образце, обработанном N-глюкозидазой F (например, комплексными, гибридными и олиго- или высокоманнозными структурами, соответственно).
Количество фукозы, определенное для OA-GA201-scFab-Ak18_WT, составляло от 25% до 40%.
Пример 11
Связывание биспецифических антител <EGFR-IGF1R> с клетками с различной экспрессией EGFR и IGF-1R
Человеческое анти-IGF-1R-антитело <IGF-1R> HUMAB клон 18 (DSM АСС 2587) связывается с клетками, экспрессирующими IGF-1R, а гуманизированное крысиное анти-EGFR-антитело ICR62 связывается с клетками, экспрессирующими EGFR на своей поверхности. Для оценки связывающих свойств биспецифических антител <EGFR-IGF1R> по сравнению с моноспецифическими двухвалентными антителами к EGFR и IGF-1R проводили анализ конкурентного связывания на клетках с различным соотношением экспрессии IGF-1R/EGFR.
Человеческие опухолевые клетки (например, А549, ТС-71, MDA-MB-231, 2×105 клеток/лунка), разведенные в ледяном буфере (PBS + 2% FCS, Gibco), добавляли в смесь меченых моноспецифических антител (HUMAB клон 18 или гуманизированное крысиное анти-EGFR-антитело ICR62) (в конечной концентрации 1 мкг/мл) и различных концентраций немеченых антител <EGFR-IGF1R>, или немеченых моноспецифических антител, или Fab-фрагментов в качестве контролей (конечный диапазон титрования от 100 до 0,002 мкг/мл) в 96-луночном планшете. Смесь инкубировали на льду в течение 45 минут. Клетки промывали 2 раза добавлением 150-200 мкл буфера (PBS + 2% FCS) с последующим центрифугированием (300 g, 5 мин, 4°С). Затем клетки ресуспендировали в 200 мкл буфера для фиксации (1х CellFix, BD №340181), содержащего 6,25 мкл/мл 7-AAD (BD №559925), и инкубировали в течение 10-20 мин на льду, чтобы обеспечить фиксацию и проникновение 7-AAD в мертвые клетки. Флуоресцентный сигнал от образцов анализировали посредством FACS и рассчитывали значения IC50.
Результаты анализа конкурентного связывания по сравнению с <IGF-1R> HUMAB клон 18 (значения IC50) приведены в таблице X. На опухолевых клетках А549, экспрессирующих как IGF-1R, так и EGFR, связывание биспецифического <EGFR-IGF1R> антитела OA-GA201-scFab-Ak18_WT превосходило <IGF-1R> HUMAB клон 18 (примерно в 3 раза) и превосходило <IGF-1R> клон HUMAB 18 Fab-фрагмент (примерно в 30 раз), вероятно, из-за способности биспецифического антитела связываться одновременно с IGF-1R и с EGFR (эффекты авидности). На опухолевых клетках ТС-71, экспрессирующих IGF-1R, но не EGFR, связывание <EGFR-IGF1R>-антитела OA-GA201-scFab-Ak18_WT было сравнимо с <IGF-1R> HUMAB клон 18 Fab-фрагмент. В этих условиях, когда экспрессировался только IGF-1R, но не EGFR, OA-GA201-scFab-Ak18_WT могло связываться только с IGF-1R одной связывающей ветвью.
Эта способность биспецифических <EGFR-IGF1R> антител связываться сильнее с клетками, экспрессирующими IGF-1R и EGFR, может быть использована для достижения превосходной ориентации на опухолевую ткань и, возможно, для получения благоприятного профиля в плане безопасности и фармакокинетических свойств по сравнению с моноспецифическими антителами, направленными на IGF-1R и EGFR.
| название | год | авторы | номер документа |
|---|---|---|---|
| ТРИ- ИЛИ ТЕТРАСПЕЦИФИЧЕСКИЕ АНТИТЕЛА | 2010 |
|
RU2570633C2 |
| ОДНОВАЛЕНТНЫЕ МОДУЛИ-ПЕРЕНОСЧИКИ ЧЕРЕЗ ГЕМАТОЭНЦЕФАЛИТИЧЕСКИЙ БАРЬЕР | 2014 |
|
RU2799436C1 |
| ПОЛИСПЕЦИФИЧНЫЕ АНТИТЕЛА, ВКЛЮЧАЮЩИЕ АНТИТЕЛА ПОЛНОЙ ДЛИНЫ И ОДНОЦЕПОЧЕЧНЫЕ ФРАГМЕНТЫ FAB | 2010 |
|
RU2598248C2 |
| МОДИФИЦИРОВАННЫЕ АСИММЕТРИЧНЫЕ АНТИТЕЛА, СВЯЗЫВАЮЩИЕ Fc-РЕЦЕПТОР, И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2014 |
|
RU2687043C2 |
| АНТИГЕНСВЯЗЫВАЮЩИЕ БЕЛКИ | 2012 |
|
RU2607038C2 |
| АНТИТЕЛА ПРОТИВ 5-БРОМ-2'-ДЕЗОКСИУРИДИНА И СПОСОБЫ ПРИМЕНЕНИЯ | 2015 |
|
RU2705299C2 |
| ДВУХВАЛЕНТНЫЕ БИСПЕЦИФИЧЕСКИЕ АНТИТЕЛА | 2008 |
|
RU2587616C2 |
| СПОСОБ ПОЛУЧЕНИЯ И ОТБОРА МОЛЕКУЛ, ВКЛЮЧАЮЩИХ ПО МЕНЬШЕЙ МЕРЕ ДВЕ РАЗЛИЧНЫЕ ГРУППИРОВКИ, И ИХ ПРИМЕНЕНИЕ | 2013 |
|
RU2646159C2 |
| ДВУХВАЛЕНТНЫЕ БИСПЕЦИФИЧЕСКИЕ АНТИТЕЛА | 2008 |
|
RU2547615C2 |
| ОДНОВАЛЕНТНЫЕ МОДУЛИ-ПЕРЕНОСЧИКИ ЧЕРЕЗ ГЕМАТОЭНЦЕФАЛИЧЕСКИЙ БАРЬЕР | 2014 |
|
RU2694659C2 |











































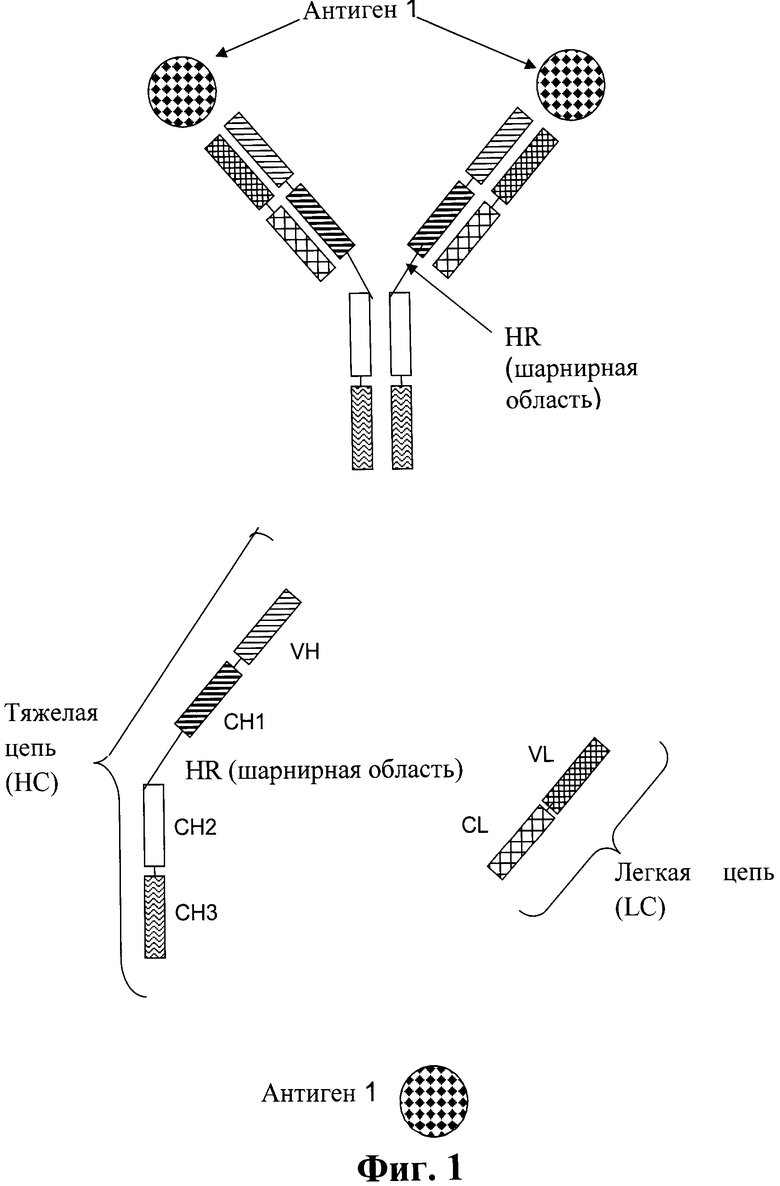
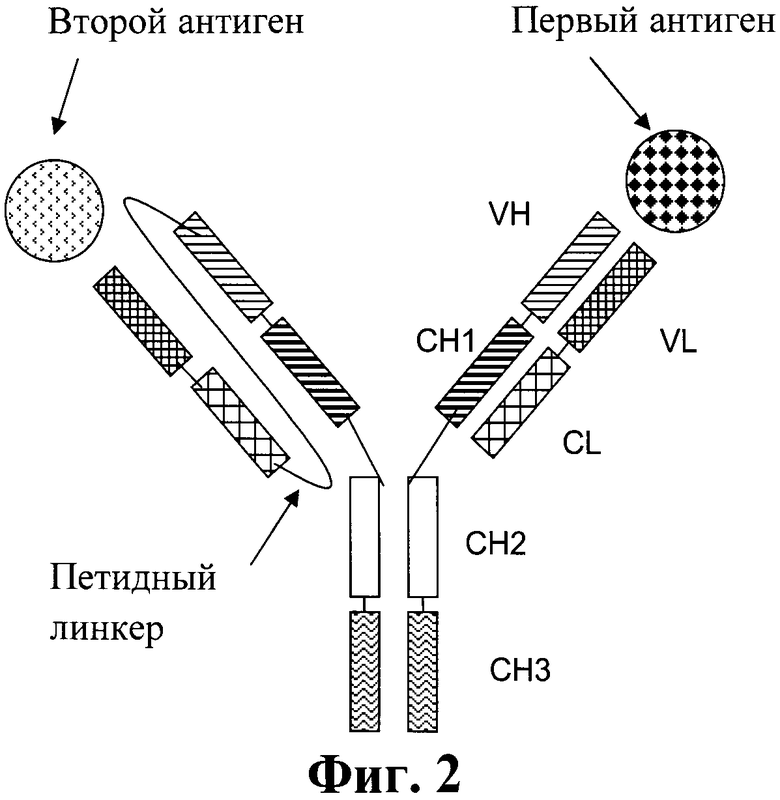
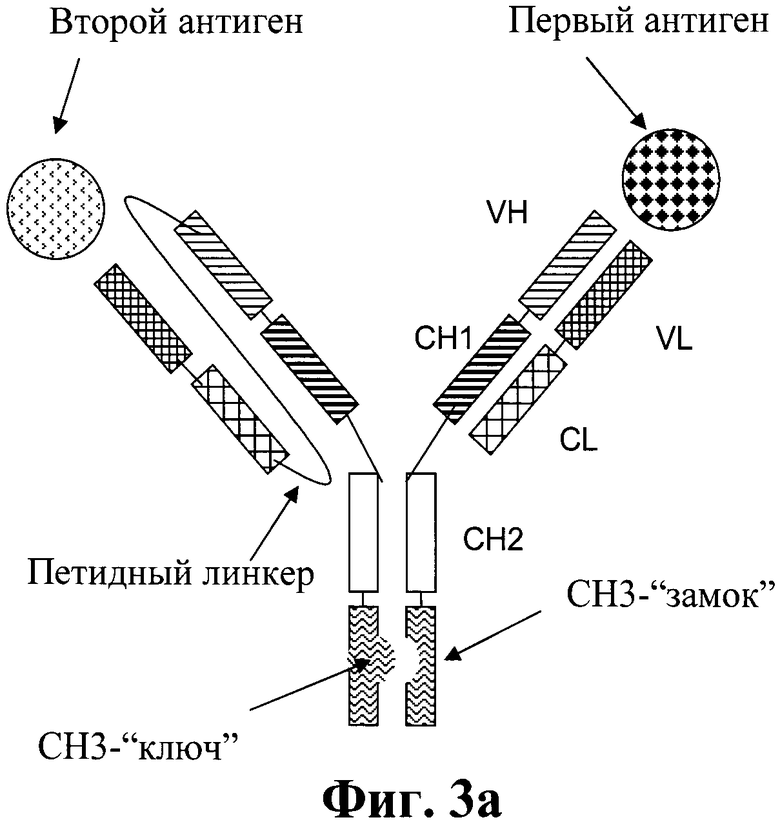
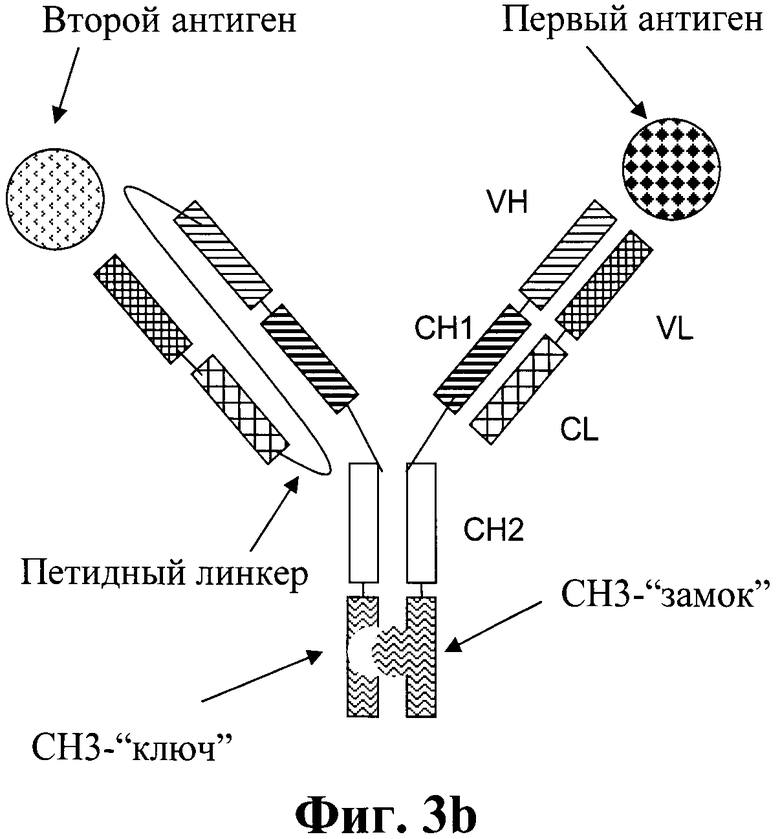
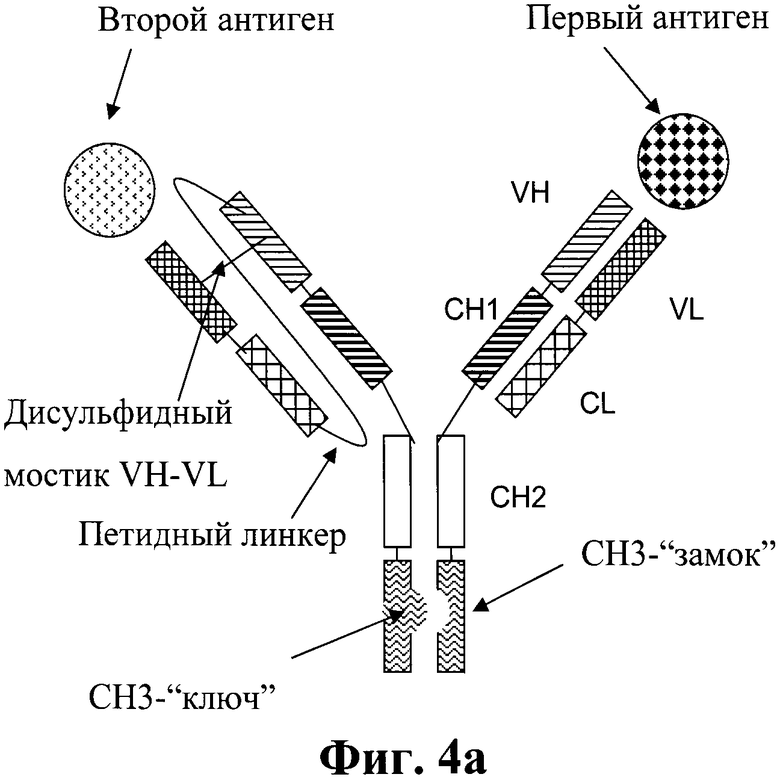
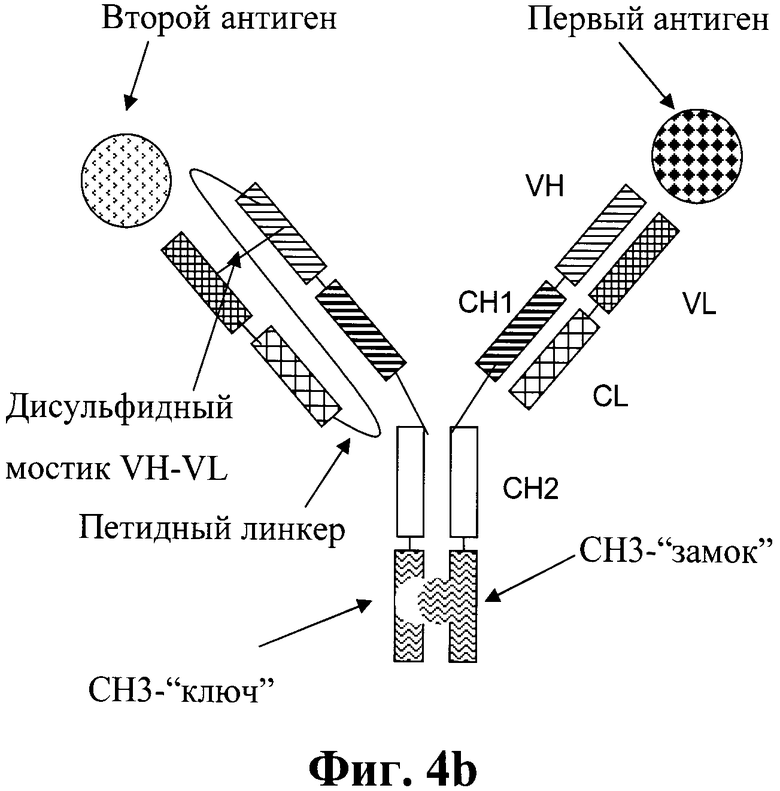
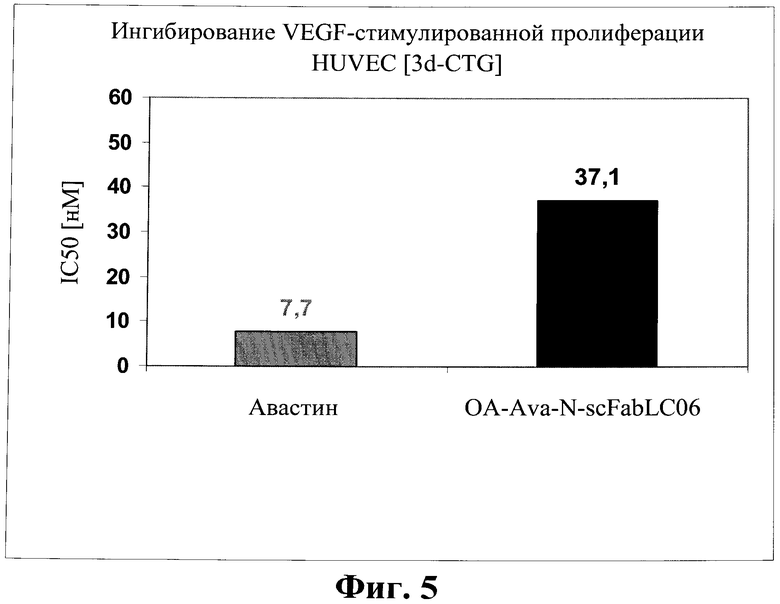
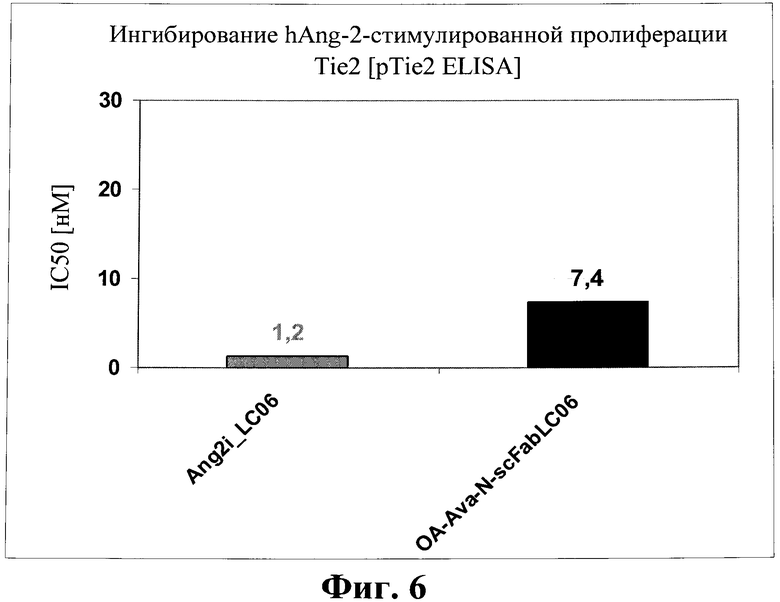
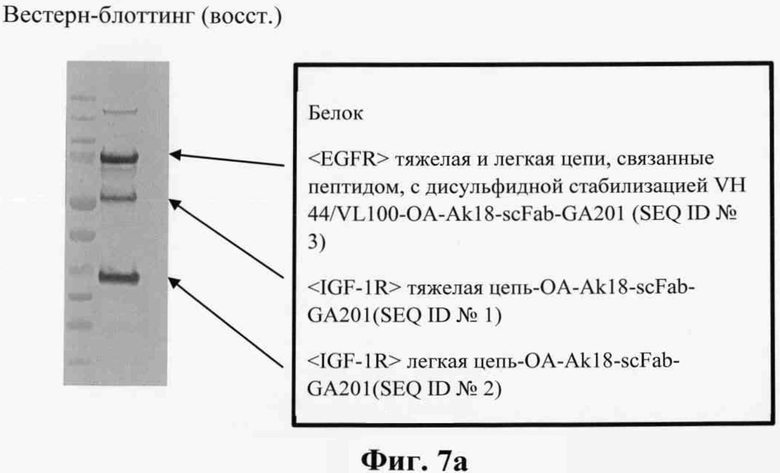
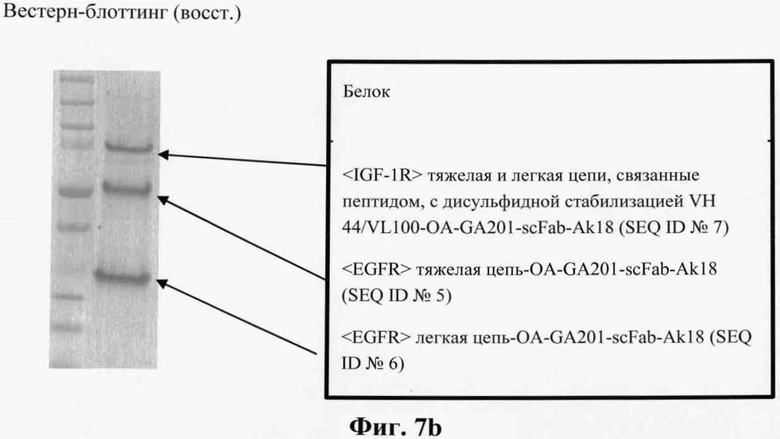
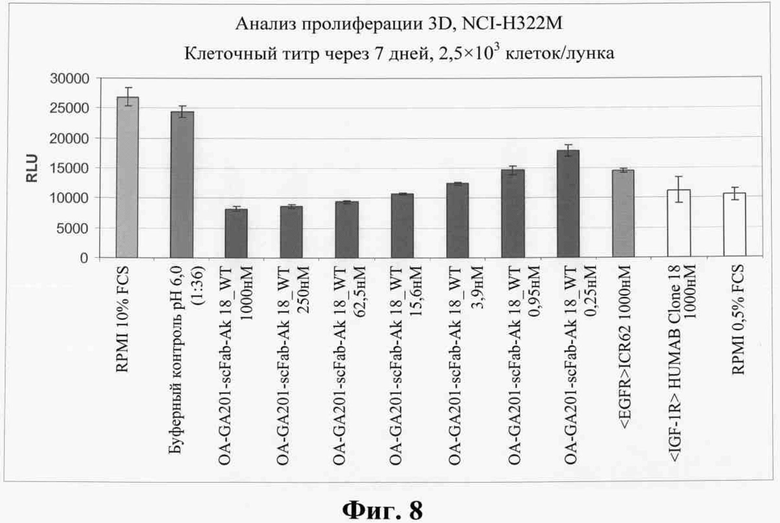
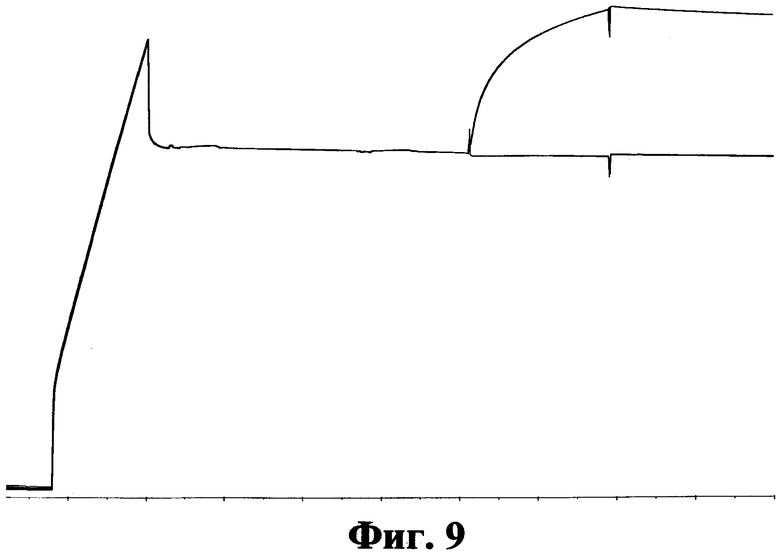
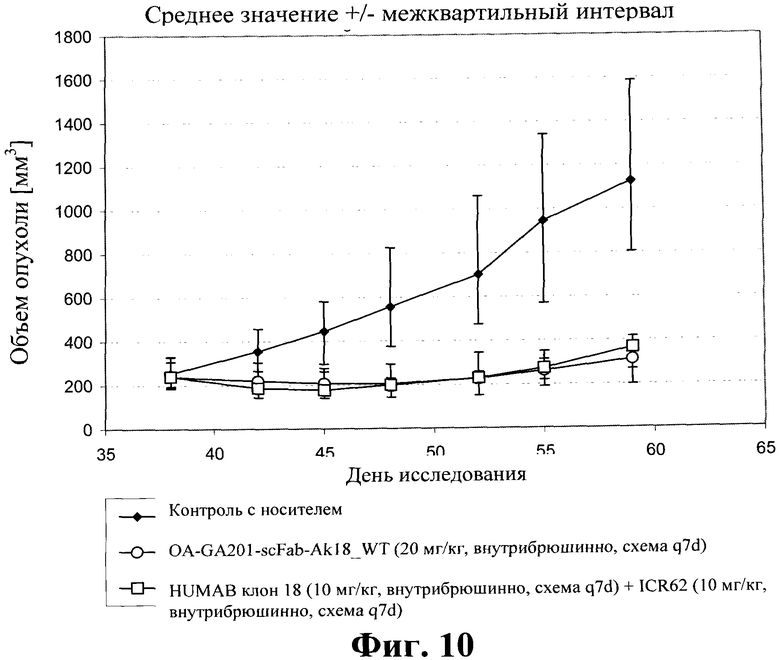
Изобретение относится к области биотехнологии и иммунологии и представляет собой способ изготовления биспецифического антитела, которое содержит: а) тяжелую цепь и легкую цепь первого антитела полной длины, которое специфически связывается с первым антигеном; и б) тяжелую цепь и легкую цепь второго антитела полной длины, которое специфически связывается со вторым антигеном, где N-конец тяжелой цепи связан с С-концом легкой цепи через пептидный линкер, причем каждый из СН3-домена тяжелой цепи антитела полной длины а) и СН3-домена тяжелой цепи антитела полной длины б) встречается на контактной поверхности, которая включает изменения в исходной контактной поверхности СН3-доменов антитела; где изменения в СН3-доменах тяжелых цепей представляют собой изменения типа «ключ-замок»; где указанный способ включает этапы: а) трансформации клетки-хозяина векторами, содержащими нуклеиновокислотные молекулы, кодирующие указанную молекулу биспецифического антитела, б) культивирования клетки-хозяина в условиях, обеспечивающих синтез указанной молекулы биспецифического антитела; и в) извлечения указанной молекулы биспецифического антитела из указанной культуры. Изобретение позволяет получать биспецифические антитела с указанной выше структурой с высоким выходом и чистотой. 16 з.п. ф-лы, 10 ил., 6 табл., 11 пр.
1. Способ изготовления биспецифического антитела, которое содержит
а) тяжелую цепь и легкую цепь первого антитела полной длины, которое специфически связывается с первым антигеном;
б) тяжелую цепь и легкую цепь второго антитела полной длины, которое специфически связывается со вторым антигеном, где N-конец тяжелой цепи связан с С-концом легкой цепи через пептидный линкер,
где каждый из CH3-домена тяжелой цепи антитела полной длины а) и CH3-домена тяжелой цепи антитела полной длины б) встречается на контактной поверхности, которая включает изменения в исходной контактной поверхности CH3-доменов антитела;
где i) в CH3-домене одной тяжелой цепи
аминокислотный остаток заменен аминокислотным остатком с боковой цепью большего объема и создает тем самым выступ в контактной поверхности CH3-домена одной тяжелой цепи, который размещается в полости на контактной поверхности CH3-домена другой тяжелой цепи,
и где
ii) в CH3-домене другой тяжелой цепи
аминокислотный остаток заменен аминокислотным остатком с боковой цепью меньшего объема и создает тем самым полость в контактной поверхности второго CH3-домена, в которой размещается выступ на контактной поверхности первого CH3-домена,
где указанный способ включает этапы
а) трансформации клетки-хозяина векторами, содержащими нуклеиновокислотные молекулы, кодирующие указанную молекулу биспецифического антитела, и
б) культивирования клетки-хозяина в условиях, обеспечивающих синтез указанной молекулы биспецифического антитела; и
в) извлечения указанной молекулы биспецифического антитела из указанной культуры.
2. Способ по п. 1, где в биспецифическом антителе указанный аминокислотный остаток, имеющий боковую цепь большего объема, выбран из группы, состоящей из аргинина (R), фенилаланина (F), тирозина (Y), триптофана (W), и указанный аминокислотный остаток, имеющий боковую цепь меньшего объема, выбран из группы, состоящей из аланина (А), серина (S), треонина (Т), валина (V).
3. Способ по п. 1, где в биспецифическом антителе оба CH3-домена далее изменяют путем введения цистеина (С) в качестве аминокислоты в соответствующих позициях каждого CH3-домена таким образом, чтобы между двумя CH3-доменами мог быть сформирован дисульфидный мостик.
4. Способ по п. 1, где в биспецифическом антителе вариабельный домен тяжелой цепи антитела (VH) и вариабельный домен легкой цепи антитела (VL) тяжелой и легкой цепей второго антитела полной длины в б) стабилизируют за счет введения дисульфидной связи между следующими позициями:
i) позицией 44 вариабельного домена тяжелой цепи и позицией 100 вариабельного домена легкой цепи,
ii) позицией 105 вариабельного домена тяжелой цепи и позицией 43 вариабельного домена легкой цепи, или
iii) позицией 101 вариабельного домена тяжелой цепи и позицией 100 вариабельного домена легкой цепи.
5. Способ по п. 1, где биспецифическое антитело содержит константную область IgG1.
6. Способ по любому из пп. 1-5, где в биспецифическом антителе
а) первое антитело полной длины специфически связывается с IGF-1R и включает тяжелую цепь с аминокислотной последовательностью SEQ ID №1 и легкую цепь с аминокислотной последовательностью SEQ ID №2, и
б) второе антитело полной длины специфически связывается с EGFR и включает тяжелую цепь, связанную с легкой цепью через пептидный линкер, где указанные тяжелая и легкая цепи, связанные пептидом, имеют аминокислотную последовательность SEQ ID №3.
7. Способ по любому из пп. 1-5, где в биспецифическом антителе
а) первое антитело полной длины специфически связывается с IGF-1R и включает тяжелую цепь с аминокислотной последовательностью SEQ ID №1 и легкую цепь с аминокислотной последовательностью SEQ ID №2, и
б) второе антитело полной длины специфически связывается с EGFR и включает тяжелую цепь, связанную с легкой цепью через пептидный линкер, где указанные тяжелая и легкая цепи, связанные пептидом, имеют аминокислотную последовательность SEQ ID №4.
8. Способ по любому из пп. 1-5, где в биспецифическом антителе
а) первое антитело полной длины специфически связывается с EGFR и включает тяжелую цепь с аминокислотной последовательностью SEQ ID №5 и легкую цепь с аминокислотной последовательностью SEQ ID №6, и
б) второе антитело полной длины специфически связывается с IGF-1R и включает тяжелую цепь, связанную с легкой цепью через пептидный линкер, где указанные тяжелая и легкая цепи, связанные пептидом, имеют аминокислотную последовательность SEQ ID №7.
9. Способ по любому из пп. 1-5, где в биспецифическом антителе
а) первое антитело полной длины специфически связывается с EGFR и включает тяжелую цепь с аминокислотной последовательностью SEQ ID №5 и легкую цепь с аминокислотной последовательностью SEQ ID №6, и
б) второе антитело полной длины специфически связывается с IGF-1R и включает тяжелую цепь, связанную с легкой цепью через пептидный линкер, где указанные тяжелая и легкая цепи, связанные пептидом, имеют аминокислотную последовательность SEQ ID №8.
10. Способ по любому из пп. 1-5, где в биспецифическом антителе
а) первое антитело полной длины специфически связывается с VEGF и включает тяжелую цепь с аминокислотной последовательностью SEQ ID №9 и легкую цепь с аминокислотной последовательностью SEQ ID №10, и
б) второе антитело полной длины специфически связывается с ANG-2 и включает тяжелую цепь, связанную с легкой цепью через пептидный линкер, где указанные тяжелая и легкая цепи, связанные пептидом, имеют аминокислотную последовательность SEQ ID №11.
11. Способ по любому из пп. 1-5, где в биспецифическом антителе
а) первое антитело полной длины специфически связывается с VEGF и включает тяжелую цепь с аминокислотной последовательностью SEQ ID №9 и легкую цепь с аминокислотной последовательностью SEQ ID №10, и
б) второе антитело полной длины специфически связывается с ANG-2 и включает тяжелую цепь, связанную с легкой цепью через пептидный линкер, где указанные тяжелая и легкая цепи, связанные пептидом, имеют аминокислотную последовательность SEQ ID №12.
12. Способ по любому из пп. 1-5, где биспецифическое антитело специфически связывается с человеческим IGF-1R и человеческим EGFR и где антитело характеризуется тем, что содержит аминокислотные последовательности SEQ ID №1, SEQ ID №2 и SEQ ID №3.
13. Способ по любому из пп. 1-5, где биспецифическое антитело специфически связывается с человеческим IGF-1R и человеческим EGFR и где антитело характеризуется тем, что содержит аминокислотные последовательности SEQ ID №1, SEQ ID №2 и SEQ ID №4.
14. Способ по любому из пп. 1-5, где биспецифическое антитело специфически связывается с человеческим IGF-1R и человеческим EGFR и где антитело характеризуется тем, что содержит аминокислотные последовательности SEQ ID №5, SEQ ID №6 и SEQ ID №7.
15. Способ по любому из пп. 1-5, где биспецифическое антитело специфически связывается с человеческим IGF-1R и человеческим EGFR и где антитело характеризуется тем, что содержит аминокислотные последовательности SEQ ID №5, SEQ ID №6 и SEQ ID №8.
16. Способ по любому из пп. 1-5, где биспецифическое антитело специфически связывается с человеческим VEGF и человеческим ANG-2 и где антитело характеризуется тем, что содержит аминокислотные последовательности SEQ ID №9, SEQ ID №10 и SEQ ID №11.
17. Способ по любому из пп. 1-5, где биспецифическое антитело специфически связывается с человеческим VEGF и человеческим ANG-2 и где антитело характеризуется тем, что содержит аминокислотные последовательности SEQ ID №9, SEQ ID №10 и SEQ ID №12.
| US 2009175851 A1, 09.07.2009 | |||
| THOMAS SCHIRRMANN, et al "Oligomeric forms of single chain immunoglobulin (scIgG)", mAbs Vol 2, Issue 1; January/February 2010, pp | |||
| Способ подготовки рафинадного сахара к высушиванию | 0 |
|
SU73A1 |
| DAN LU et al "Fab-scFv fusion protein: an efficient approach to production of bispecific antibody fragments", Journal of Immunological Methods 267 (2002) pp | |||
| Кулиса для фотографических трансформаторов и увеличительных аппаратов | 1921 |
|
SU213A1 |
| Способ действия абсорбционной (поглощательной) установки | 1926 |
|
SU12162A1 |
Авторы
Даты
2016-01-20—Публикация
2011-03-24—Подача