Настоящее изобретение относится к новым тандемным Fv-диателам и их применению.
УРОВЕНЬ ТЕХНИКИ
Разработаны различные форматы поливалентных рекомбинантных фрагментов антител в качестве альтернативы антителам квадромного происхождения.
В источниках US 7129330, Kipriyanov et al. J. Mol. Biol. (1999) 293, 41-56 и Kipriyanov Meth. Mol. Biol. (2009) 562, 177-193 описано конструирование и получение поливалентных фрагментов антител определенного формата, называемых "тандемными диателами" (TandAb®), поскольку их строение основано на межмолекулярном спаривании вариабельных доменов VH и VL двух различных полипептидов, как описано для диател (Holliger et al., 1993, Proc. Natl. Acad. Sci. USA, 90:6444-6448). Описанные антитела являются биспецифическими по отношению к CD19 и CD3. В отличие от двухвалентных тандемов scFv-scFv (scFv)2, тандемные диатела являются четырехвалентными, поскольку они содержат четыре антиген-связывающих сайта. Описаны полипептиды, образующие тандемные диатела, в соответствии с порядком доменов VHA-VLB-VHB-VLA с N-конца к C-концу. Порядок вариабельных доменов и линкерных пептидов между ними разработан таким образом, что каждый домен связывается с дополняющим доменом в еще одной идентичной молекуле с образованием димеризованного четырехвалентного тандемного диатела. Тандемные диатела не содержат константных иммуноглобулиновых доменов. Сообщалось, что тандемные диатела обладают такими преимуществами, как высокое сродство, повышенная авидность, сниженная скорость выведения, и демонстрируют приемлемую эффективность в условиях in vitro и in vivo.
Известно несколько дополнительных тандемных диател, обладающих специфичностью антител, например антитела против CD16, антитела против ЕрСАМ и антитела против CD30. В то же время во всех случаях порядок четырех доменов антител в полипептидных цепях тандемного диатела от N-конца к C-концу всегда представлял собой VHA-VLB-VHB-VLA, где VH и VL представляют собой вариабельные домены тяжелой и легкой цепи антител со специфичностью по отношению к антигенам А и В, соответственно. Такие биспецифические тандемные диатела могут образовывать мостик между опухолевой клеткой (например, клеткой B-CLL) и эффекторной клеткой иммунной системы человека (NK-клеткой, Т-клеткой, моноцитом, макрофагом или гранулоцитом), таким образом, обеспечивая уничтожение опухолевой клетки. Прочное связывание опухолевой клетки и цитотоксической клетки приводит к разрушению опухолевой клетки. Хотя такие тандемные диатела оказались подходящими для терапевтического применения, например для терапевтической концепции лечения опухолей, в настоящее время остается потребность в усовершенствованных антиген-связывающих молекулах.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
В одном аспекте настоящего изобретения предложена димерная антиген-связывающая молекула, содержащая первую и вторую полипептидную цепь, причем каждая из указанных первой и второй полипептидных цепей содержит (а) первый домен VLA, являющийся вариабельным доменом легкой цепи, специфичным к первому антигену А; (b) второй домен VHB, являющийся вариабельным доменом тяжелой цепи, специфичным ко второму антигену В; (с) третий домен VLB, являющийся вариабельным доменом легкой цепи, специфичным ко второму антигену В; и (d) четвертый домен VHA, являющийся вариабельным доменом тяжелой цепи, специфичным к первому антигену А, причем указанные домены упорядочены в указанных первой и второй полипептидных цепях в порядке VLA-VHB-VLB-VHA от N-конца к С-концу указанных полипептидных цепей, первый домен VLA первой полипептидной цепи связан с четвертым доменом VHA второй полипептидной цепи, образуя антиген-связывающий сайт первого антигена А; второй домен VHB первой полипептидной цепи связан с третьим доменом VLB второй полипептидной цепи, образуя антиген-связывающий сайт второго антигена В; третий домен VLB первой полипептидной цепи связан со вторым доменом VHB второй полипептидной цепи, образуя антиген-связывающий сайт второго антигена В; а четвертый домен VHA первой полипептидной цепи связан с первым доменом VLA второй полипептидной цепи, образуя антиген-связывающий сайт первого антигена А.
В некоторых вариантах реализации указанная антиген-связывающая молекула, описанная в настоящей заявке, является гомодимером, а первая и вторая полипептидные цепи имеют одинаковую аминокислотную последовательность. В некоторых вариантах реализации первая и вторая полипептидные цепи нековалентно связаны. В некоторых вариантах реализации антиген-связывающая молекула является четырехвалентной. В некоторых вариантах реализации антиген-связывающая молекула является биспецифической. В некоторых вариантах реализации указанные домены являются доменами человека или гуманизированными доменами. В некоторых вариантах реализации антиген-связывающая молекула содержит по меньшей мере одну дополнительную функциональную единицу. В некоторых вариантах реализации антиген-связывающая молекула является специфичной по отношению к В-клетке, Т-клетке, клетке - естественному киллеру (NK), миелоидной клетке или фагоцитарной клетке. В некоторых вариантах реализации антиген-связывающая молекула является биспецифической, причем указанная антиген-связывающая молекула дополнительно является специфичной к опухолевой клетке. В некоторых вариантах реализации вариабельный домен первой легкой цепи (VLA) и вариабельный домен первой тяжелой цепи (VHA) специфичны по отношению к опухолевой клетке. В некоторых вариантах реализации антиген-связывающая молекула является биспецифической по отношению к альбумину и CD3.
В еще одном аспекте настоящее изобретение обеспечивает полипептидную цепь, содержащую (а) первый домен VLA, являющийся вариабельным доменом легкой цепи, специфичным по отношению к первому антигену А; (b) второй домен VHB, являющийся вариабельным доменом тяжелой цепи, специфичным по отношению ко второму антигену В; (с) третий домен VLB, являющимся вариабельным доменом легкой цепи, специфичным по отношению ко второму антигену В; и (d) четвертый домен VHA, являющийся вариабельным доменом тяжелой цепи, специфичным по отношению к первому антигену А; причем указанные домены расположены в полипептидной цепи в порядке VLA-VHB-VLB-VHA от N-конца к С-концу полипептидных цепей. В некоторых вариантах реализации первый домен VLA и четвертый домен VHA не связаны с образованием антиген-связывающего сайта первого антигена А, а второй домен VHB и третий домен VLB не связаны с образованием антиген-связывающего сайта второго антигена В. В некоторых вариантах реализации первый домен VLA и второй домен VHB, второй домен VHB и третий домен VLB, а также третий домен VLB и четвертый домен VHA отделены друг от друга не более чем приблизительно 12 аминокислотными остатками. В некоторых вариантах реализации полипептидная цепь содержит аминокислотные остатки выше первого домена VLA и/или ниже четвертого домена VHA. В некоторых вариантах реализации полипептидная цепь присоединена к дополнительной функциональной единице. В конкретном варианте реализации вариабельные домены являются специфичными по отношению к альбумину и CD3.
В еще одном аспекте настоящего изобретения предложена молекула нуклеиновой кислоты, кодирующая полипептидную цепь согласно описанию настоящей заявки. В еще одном аспекте настоящего изобретения предложена фармацевтическая композиция, содержащая антиген-связывающую молекулу, полипептидную цепь или молекулу нуклеиновой кислоты, описанные в настоящей заявке, и фармацевтически приемлемый носитель.
В еще одном аспекте настоящего изобретения предложено медицинское применение антиген-связывающей молекулы в качестве лекарственного средства для лечения аутоиммунного заболевания, воспалительного заболевания, инфекционного заболевания, аллергии, рака и/или в качестве иммунодепрессанта.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
На Фиг. 1 показана генетическая организация конструкта, кодирующего антиген-связывающую молекулу в соответствии с настоящим изобретением, где VLA представляет собой вариабельный иммуноглобулиновый домен легкой цепи, специфичный по отношению к антигену A, VHB представляет собой вариабельный иммуноглобулиновый домен тяжелой цепи, специфичный по отношению к антигену В, VLB представляет собой вариабельный иммуноглобулиновый домен легкой цепи, специфичный по отношению к антигену В, VHA представляет собой вариабельный иммуноглобулиновый домен тяжелой цепи, специфичный по отношению к антигену A, L1 - пептидный линкер или пептидная связь, соединяющая VLA и VHB, L2 - пептидный линкер или пептидная связь, соединяющая VHB и VLB, a L3 - пептидный линкер или пептидная связь, соединяющая VLB и VHA.
На Фиг. 2 показано образование димерной антиген-связывающей молекулы в соответствии с настоящим изобретением от нефункциональных мономерных полипептидных цепей (А) за счет внутримолекулярного спаривания вариабельных доменов первой полипептидной цепи 1 и второй полипептидной цепи 2 друг с другом (В) до функциональной антиген-связывающей молекулы в соответствии с изобретениями в формате тандемного диатела, где "1" представляет собой первую полипептидную цепь, "2" представляет собой вторую полипептидную цепь, VLA представляет собой вариабельный иммуноглобулиновый домен легкой цепи, специфичный по отношению к антигену A, VHB представляет собой вариабельный иммуноглобулиновый домен тяжелой цепи, специфичный по отношению к антигену В, VLB представляет собой вариабельный иммуноглобулиновый домен легкой цепи, специфичный по отношению к антигену В, VHA представляет собой вариабельный иммуноглобулиновый домен тяжелой цепи, специфичный по отношению к антигену A, L1 - пептидный линкер или пептидная связь, соединяющая VLA и VHB, L2 - пептидный линкер или пептидная связь, соединяющая VHB и VLB, a L3 - пептидный линкер или пептидная связь, соединяющая VLB и VHA.
На Фиг. 3 показывано сравнение тандемных диател CD19×CD3 в анализе цитотоксичности. Вариант 0 = антитело А1 с порядком доменов VHA-VLB-VHB-VLA. Вариант 2 = антитело В с порядком доменов VLA-VHB-VLB-VHA в соответствии с настоящим изобретением. 1×104 клеток Raji, меченых кальцеином, инкубировали с 5×105 МПК в присутствии возрастающих концентраций указанных тандемных диател CD19×CD3. МПК культивировали в течение ночи в присутствии 25 ед/мл IL-2 человека до использования в качестве эффекторных клеток в анализе. После 4 часов инкубирования измеряли флуоресцентный кальцеин, высвобождаемый из апоптозных клеток-мишеней, в клеточной культуральной среде при длине волны 520 нм, и рассчитывали % специфического лизиса. Значения ЕС50 анализировали с помощью нелинейной регрессии с использованием программного обеспечения GraphPad. На график наносили среднее значение и стандартное отклонение двух повторов.
На Фиг. 4 показано сравнение тандемных диател CD19×CD3 в анализе цитотоксичности. Вариант 0 = антитело А2 с порядком доменов VHA-VLB-VHB-VLA. Вариант 2 = антитело C с порядком доменов VLA-VHB-VLB-VHA в соответствии с настоящим изобретением. ×104 клеток Raji, меченых кальцеином, инкубировали с 5×105 свежевыделенных МПК в присутствии возрастающих концентраций указанных тандемных диател CD19×CD3. После 4 часов инкубирования измеряли флуоресцентный кальцеин, высвобождаемый из апоптозных клеток-мишеней, в клеточной культуральной среде при длине волны 520 нм, и рассчитывали % специфического лизиса. Значения ЕС50 анализировали с помощью нелинейной регрессии с использованием программного обеспечения GraphPad. На график наносили среднее значение и стандартное отклонение двух повторов.
На Фигуре 5 показана регуляция TCR тандемными антителами HSA×CD3 в Примере 2 в присутствии или в отсутствие HSA. Клетки CD3+ Jurkat культивировали в течение 2 ч в присутствии возрастающих концентраций варианта 0 (VHA-VLB-VHB-VLA; треугольники) или варианта 2 (VLA-VHB-VLB-VHA в соответствии с настоящим изобретением; квадраты) тандемного антитела HSA×CD3 с (темные символы) или без (светлые символы) добавления 50 мг/мл HSA. После промывки оставшиеся комплексы TCR/CD3 измеряли с помощью проточной цитометрии с использованием РС5-конъюгированного антитела против TCR α/β. Средние значения флуоресценции использовали для анализа с помощью нелинейной регрессии (эксперимент САВ-306).
На Фиг. 6 показана карта вектора pCDNA5FRT, кодирующего антитело В, с сайтами рестрикции. VH и VL: вариабельные домены тяжелой и легкой цепей.
На Фиг. 7 показана карта вектора pSKK3, кодирующего антитело С, с сайтами рестрикции. VH и VL: вариабельные домены тяжелой и легкой цепей.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
В одном аспекте настоящего изобретения предложена рекомбинантная димерная и четырехвалентная антиген-связывающая молекула с четырьмя иммуноглобулиновыми доменами (двумя вариабельными доменами тяжелой цепи и двумя вариабельными доменами легкой цепи), присоединенными друг к другу в составе полипептидной цепи и расположенными в порядке VLA-VHB-VLB-VHA от N-конца к С-концу полипептидной цепи. Такая антиген-связывающая молекула согласно настоящему изобретению вызывает повышенную биологическую активность, например усиленный иммунный ответ или усиленное подавление иммунного ответа.
В одном варианте реализации показано, что димерная, биспецифическая антиген-связывающая молекула формата тандемного диатела, являющаяся специфичной по отношению к CD3 и CD19 и содержащая полипептидные цепи с порядком доменов VLA-VHB-VLB-VHA, более чем в 60 раз активна в условиях in vitro, т.е. цитотоксична, чем соответствующая молекула тандемного диатела с аналогичными доменами, но расположенными в обратном порядке VHA-VLB-VHB-VLA.
В еще одном варианте реализации показано, что димерная, биспецифическая антиген-связывающая молекула формата тандемного диатела, являющаяся специфичной по отношению к альбумину (HSA) и CD19 и содержащая полипептидные цепи с порядком доменов VLA-VHB-VLB-VHA, обладает значительно более эффективной модулирующей активностью по отношению к T-клеточному рецептору in vitro, т.е. является более эффективным иммунодепрессантом, чем соответствующая молекула тандемного диатела с аналогичными доменами, но расположенными в обратном порядке VHA-VLB-VHB-VLA.
Таким образом, тандемные диатела с порядком доменов VLA-VHB-VLB-VHA от N-конца к С-концу полипептидных цепей обладает повышенным потенциалом для иммунотерапии. Дополнительным преимуществом улучшенной биологической активности является возможность снижения эффективных терапевтических дозировок для таких тандемных диател. Кроме того, побочные эффекты, вызванные вводимыми антиген-связывающими молекулами, также могут быть ослаблены за счет пониженных дозировок. Безотносительно к теоретическим представлениям, новый порядок доменов обеспечивает модифицированное перекрестное связывание димерной антиген-связывающей молекулы с антигеном А и антигеном В по сравнению с тандемными диателами, известными в данной области техники и, в некоторых аспектах изобретения, это позволяет указанной молекуле связываться с антигенами-мишенями, например рецепторами, более эффективно по сравнению с димерными антиген-связывающими молекулами, известными в данной области техники.
Таким образом, биологическую активность димерной антиген-связывающей молекулы, например тандемного антитела, можно усилить, если четыре вариабельных домена каждой полипептидной цепи, образующей димерную антиген-связывающую молекулу, упорядочены в виде VLA-VHB-VLB-VHA от N-конца к С-концу каждой полипептидной цепи. Запускаемая "биологическая активность" зависит от специфичности антиген-связывающей молекулы и может охватывать цитотоксичность, фагоцитоз, презентацию антигена, высвобождение цитокинов или подавление иммунитета, например антитело-зависимую клеточно-опосредованную цитотоксичность (ADCC), антитело-зависимый клеточно-опосредованный фагоцитоз (ADCP) и/или комплемент-зависимую цитотоксичность (CDC).
В некоторых вариантах реализации настоящего изобретения предложена димерная антиген-связывающая молекула, содержащая первую и вторую полипептидную цепь, причем каждая из указанных первой и второй полипептидных цепей содержит первый домен VLA, являющийся вариабельным доменом легкой цепи, специфичным по отношению к первому антигену А, второй домен VHB, являющийся вариабельным доменом тяжелой цепи, специфичным по отношению к второму антигену В, третий домен VLB, являющимся вариабельным доменом легкой цепи, специфичным по отношению к второму антигену В, четвертый домен VHA, являющийся вариабельным доменом тяжелой цепи, специфичным по отношению к первому антигену А, и указанные домены расположены в каждой из указанных первой и второй полипептидной цепи в порядке VLA-VHB-VLB-VHA от N-конца к С-концу указанных полипептидных цепей.
В некоторых вариантах реализации первый, второй, третий и четвертый вариабельные домены расположены в ориентации, предотвращающей внутримолекулярное спаривание в пределах одной полипептидной цепи, и первая полипептидная цепь связана, т.е. димеризована со второй полипептидной цепью таким образом, что первый домен VLA первой полипептидной цепи связан с четвертым доменом VHA второй полипептидной цепи, образуя антиген-связывающий сайт первого антигена А, второй домен VHB первой полипептидной цепи связан с третьим доменом VLB второй полипептидной цепи, образуя антиген-связывающий сайт второго антигена В, третий домен VLB первой полипептидной цепи связан со вторым доменом VHB второй полипептидной цепи, образуя антиген-связывающий сайт второго антигена В, а четвертый домен VHA первой полипептидной цепи связан с первым доменом VLA второй полипептидной цепи, образуя антиген-связывающий сайт первого антигена А.
Термин "антиген-связывающая молекула" относится к производному иммуноглобулина с поливалентными антиген-связывающими свойствами, предпочтительно содержащему по меньшей мере четыре антиген-связывающих сайта. Каждый антиген-связывающий сайт образован вариабельным доменом тяжелой цепи VH и вариабельным доменом легкой цепи VL с аналогичной антигенной, т.е. эпитопной, специфичностью. Предпочтительно антиген-связывающая молекула согласно настоящему изобретению лишена константных доменов иммуноглобулинов или фрагментов константных доменов иммуноглобулинов, но в некоторых случаях, описанных ниже, константный домен или его части могут быть присоединены к антиген-связывающей молекуле.
Антиген-связывающая молекула является "димерной"; данный термин относится к комплексу двух полипептидных мономеров. Указанные два полипептидных мономера являются первой и второй полипептидными цепями. Предпочтительно указанная антиген-связывающая молекула является "гомодимером"; данный термин означает, что указанная антиген-связывающая молекула состоит из идентичных полипептидных мономеров. В предпочтительной гомодимерной антиген-связывающей молекуле согласно настоящему изобретению первая и вторая полипептидные цепи могут обладать одинаковой аминокислотной последовательностью, т.е. первая и вторая полипептидные цепи являются идентичными и, таким образом, кодируются и экспрессируются одним и тем же одиночным полинуклеотидом. Иная ситуация имеет место в случае так называемых биспецифических диател, являющихся гетеродимерами, кодируемыми двумя различными полинуклеотидами. В этом случае каждая из первой и второй полипептидных цепей содержит четыре вариабельных домена, образуется четыре сайта связывания, и антиген-связывающая молекула является четырехвалентной. Такие четырехвалентные гомодимерные антиген-связывающие молекулы получили определенное признание в данной области техники как тандемные диатела.
Предпочтительно в антиген-связывающей молекуле первая и вторая полипептидная цепь нековалентно связаны друг с другом, в частности предусматривается, что ковалентные связи между первой и второй полипептидной цепью отсутствуют. Однако при необходимости две полипептидные цепи можно дополнительно стабилизировать по меньшей мере одной ковалентной связью, например, посредством дисульфидного мостика между остатками цистеина различных полипептидных цепей. Термин "полипептидная цепь" относится к полимеру из аминокислотных остатков, соединенных друг с другом амидными связями. Предпочтительно первая и вторая полипептидные цепи являются одиночными гибридными неразветвленными белками. В каждой из первой и второй полипептидных цепей указанные четыре домена расположены так, что второй домен VHB расположен в С-направлении от первого домена VLA, третий домен VLB расположен в С-направлении от второго домена VHB, а четвертый домен VHA расположен в С-направлении от третьего домена VLB. Первая и вторая полипептидные цепи могут содержать дополнительные аминокислотные остатки в N-направлении от первого домена VLA и/или в С-направлении от четвертого домена VHA. Например, полипептидная цепь может содержать маркерную последовательность, предпочтительно на С-конце, которую можно использовать при очистке полипептида. Примером маркерной последовательности является His-маркер, например His-маркер, состоящий из шести His-остатков.
В некоторых вариантах реализации первый, второй, третий и четвертый домены ковалентно связаны таким образом, что домены одной и той же полипептидной цепи не связываются, т.е. не спариваются друг с другом. Домены могут быть связаны между собой таким образом, что первый домен VLA связан со вторым доменом VHB с помощью первого линкера L1, второй домен VHB связан с третьим доменом VLB с помощью второго линкера L2, а третий домен VLB связан с четвертым доменом VHA с помощью третьего линкера L3, причем первый линкер L1 и третий линкер L3 расположены дистально по отношению к центральному линкеру L2 на каждой из первой и второй полипептидных цепей. Каждый из линкера L1, линкера L2 и линкера L3 может являться пептидным линкером, содержащим по меньшей мере один аминокислотный остаток, или пептидом, присоединенным без каких-либо промежуточных аминокислотных остатков между двумя соседними доменами.
В некоторых вариантах реализации длина каждого из линкеров L1, L2 и L3 такова, что домены первой полипептидной цепи могут связываться с доменами второй полипептидной цепи с образованием димерной антиген-связывающей молекулы. Длина линкеров влияет на гибкость антиген-связывающей молекулы. Желательная гибкость антиген-связывающей молекулы зависит от плотности антигена-мишени и доступности антигена-мишени, т.е. эпитопов. Более длинные линкеры обеспечивают более гибкие антиген-связывающие молекулы с более гибкими антиген-связывающими сайтами. Влияние длины линкера на образование димерных антиген-связывающих молекул описано, например, в Todorovska et al., 2001 Journal of Immunological Methods 248:47-66; Perisic et al., 1994 Structure 2:1217-1226; Le Gall et al., 2004, Protein Engineering 17:357-366 и WO 94/13804.
В некоторых предпочтительных вариантах реализации линкеры L1, L2 и/или L3 являются "короткими", т.е. состоят из 0, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11 или примерно 12 аминокислотных остатков. Такие короткие линкеры способствуют правильной димеризации первой и второй полипептидной цепи путем связывания и образования антиген-связывающих сайтов между вариабельными доменами легкой цепи и вариабельными доменами тяжелой цепи различных полипептидных цепей. В частности, центральный линкер L2 должен быть настолько коротким, чтобы он мог предотвращать образование одноцепочечной Fv (scFv) антиген-связывающей единицы в пределах одной полипептидной цепи двумя соседними областями VHB и VLB. Центральный линкер L2 влияет на гибкость полипептидной цепи. Если центральный линкер L2 является длинным и гибким (в общем случае состоит из приблизительно 12 или более аминокислотных остатков), полипептидная цепь может подвергаться фолдингу по типу "голова к хвосту" и образовать одноцепочечную антиген-связывающую молекулу, известную в данной области техники как одноцепочечное диатело. Если центральный линкер L2 является коротким и жестким, полипептидная цепь не может подвергаться фолдингу по типу "голова к хвосту" и димеризуется с другой полипептидной цепью. Количество аминокислотных остатков линкера для предотвращения фолдинга по типу "голова к хвосту" также зависит от вида вариабельных доменов, объединенных в составе полипептида. В общем случае, сокращение линкера до приблизительно 12 или менее аминокислотных остатков обычно предотвращает взаимодействие смежных областей одной и той же полипептидной цепи друг с другом. Таким образом, для предотвращения спаривания смежных областей одной и той же полипептидной цепи центральный линкер L2 и дистальные линкеры L1 и L3 должны предпочтительно состоять из приблизительно 12 или менее аминокислотных остатков. В предпочтительном варианте реализации настоящего изобретения линкеры L1, L2 и/или L3 состоят из приблизительно 3-10 смежных аминокислотных остатков. Линкеры могут состоять из различного числа аминокислотных остатков, однако, в предпочтительном случае дистальные линкеры L1 и L3 содержат одинаковое количество аминокислотных остатков или не отличаются по длине более чем на один или два аминокислотных остатка. В конкретном аспекте настоящего изобретения по меньшей мере один из линкеров L1, L2 и/или L3 состоит из девяти аминокислотных остатков. В конкретном варианте реализации настоящего изобретения все три линкера L1, L2 и/или L3 состоят из девяти аминокислотных остатков. В некоторых вариантах реализации по меньшей мере один из линкеров L1, L2 и/или L3 состоит из менее чем 10-3 аминокислотных остатков.
Дополнительные аминокислотные остатки обеспечивают дополнительную гибкость. В альтернативном аспекте центральный линкер L2 может содержать приблизительно 12 или менее аминокислотных остатков для предотвращения фолдинга полипептидной цепи по типу "голова к хвосту" и по меньшей мере один из дистальных линкеров L1 и/или L3 может содержать более 12 аминокислотных остатков для обеспечения дополнительной гибкости. В еще одном варианте реализации две полипептидные цепи содержат центральный линкер L2 из более чем 12 аминокислотных остатков, правильно димеризуются друг с другом, образуя четырехвалентную, димерную антиген-связывающую молекулу (см., например, Le Gall et al., 2004, Protein Engineering 17:357-366). Однако при использовании более длинных линкеров, например, состоящих из приблизительно 13 или более, в частности приблизительно 15 или более аминокислотных остатков димерную антиген-связывающую молекулу можно дополнительно стабилизировать по меньшей мере одной ковалентной связью между такими двумя полипептидными цепями.
Что касается аминокислотного состава линкеров, в некоторых вариантах реализации выбирают пептиды, не нарушающие димеризацию первой и второй полипептидных цепей. Например, линкеры, содержащие остатки глицина и серина, обычно обеспечивают гибкость и устойчивость к протеазам. Аминокислотную последовательность линкеров можно оптимизировать с целью улучшения связывания антигена и выхода продукции молекул, например, с помощью способов фагового дисплея. В некоторых вариантах реализации настоящего изобретения линкер может содержать аминокислотную последовательность GGSGGSGGS.
Первый домен VLA, второй домен VHB, третий домен VLB и четвертый домен VHA являются вариабельными доменами легкой цепи и тяжелой цепи иммуноглобулина. Вариабельные домены включают гипервариабельные петли или комплементарные связывающие области (CDR), содержащие остатки, вступающие в контакт с антигеном, и сегменты, участвующие в правильном фолдинге и отображении CDR. В предпочтительном случае каждый из вариабельных доменов тяжелой цепи и легкой цепи содержит соответствующие три CDR. Указанные домены могут быть получены из иммуноглобулина любого класса, например IgA, IgD, IgE и IgM или их подкласса. Иммуноглобулин может быть получен из организма животного, в частности млекопитающего. Каждый домен может являться полным вариабельным доменом тяжелой или легкой цепи иммуноглобулина, мутантным доменом, фрагментом или производным вариабельного домена естественного происхождения, или синтетическим, например рекомбинантным доменом, полученным с помощью генной инженерии. Производное представляет собой вариабельный домен, отличающийся от аминокислотной последовательности вариабельного домена естественного происхождения делецией, заменой, добавлением или инсерцией по меньшей мере одной аминокислоты. Синтетические, например, рекомбинантные домены, можно получить, например, с помощью хорошо известных воспроизводимых способов из антител гибридомного происхождения или иммуноглобулиновых библиотек фагового дисплея. Например, способы фагового дисплея можно применять для получения вариабельных доменов антител человека к антигену путем скрининга библиотеки последовательностей иммуноглобулинов человека. Сродство первоначально отобранных антител можно дополнительно повысить путем созревания аффинности, например перетасовки цепей или случайного мутагенеза. Специалист в данной области техники должен быть знаком со способами получения доменов из природных или рекомбинантных антител (см., например, лабораторное руководство Antibody engineering: methods and protocols/edited by Benny K.C. Lo; Benny K.C. II Series: Methods in molecular biology (Totowa, N.J.)). В общем случае, любое антитело, известное в данной области техники, можно использовать в качестве источника вариабельных доменов согласно настоящему изобретению.
В конкретном аспекте настоящего изобретения по меньшей мере один, предпочтительно все из первого домена VLA, второго домена VHB, третьего домена VLB и четвертого домена VHA являются полностью человеческими, гуманизированными или химерными доменами. Гуманизированный вариабельный домен содержит каркасную область, содержащую главным образом аминокислотную последовательность иммуноглобулина человека и CDR из иммуноглобулина нечеловеческого происхождения. Гуманизированные антитела можно получить с помощью общепринятых способов, например пересадки CDR (см., например, Antibody engineering: methods and protocols/edited by Benny K.C. Lo; Benny K.C. II Series: Methods in molecular biology (Totowa, N.J.)). Таким образом, специалист в данной области техники легко может получить гуманизированный или полностью человеческий вариант антиген-связывающих молекул и вариабельных доменов из источников, отличных от человека, например мыши, с помощью стандартных молекулярно-биологических методик, известных в данной области техники с целью снижения иммуногенности и улучшения эффективности указанной антиген-связывающей молекулы в иммунной системе человека. В предпочтительном варианте реализации настоящего изобретения все домены (например, VLA, VHB, VLB и VHA) являются гуманизированными или полностью полученными от человека; наиболее предпочтительно димерная антиген-связывающая молекула согласно настоящему изобретению является гуманизированной или полностью полученной от человека. Термин "полностью полученный от человека", используемый в настоящей заявке, означает, что аминокислотные последовательности вариабельных доменов и пептидов, связывающих вариабельные домены в первой и второй полипептидных цепях, происходят или могут обнаруживаться в организме человека. В некоторых вариантах реализации настоящего изобретения вариабельные домены, но не пептиды, связывающие вариабельные домены, могут являться доменами человека или гуманизированными доменами.
В одном из вариантов реализации первый домен VLA, второй домен VHB, третий домен VLB и четвертый домен VHA специфичны к одному и тому же антигену, так что антиген-связывающие сайты, образованные указанными доменами, связываются с одним и тем же эпитопом или с различными эпитопами одного и того же антигена. В этом случае выражения "антиген А" и "антиген В" относятся к одному и тому же антигену. Такие антиген-связывающие молекулы являются моноспецифическими.
В еще одном из вариантов реализации первый домен VLA, второй домен VHB, третий домен VLB и четвертый домен VHA специфичны к различным антигенам, так что VLA и VHA образуют антиген-связывающий сайт для антигена А, или первый сайт специфичности, a VHB и VLB образуют антиген-связывающий сайт для антигена В, или второй сайт специфичности. Различные антигены могут быть ассоциированы с различными видами клеток, или представляют собой различные антигены одного и того же типа клеток. Такие антиген-связывающие молекулы согласно изобретению являются биспецифическими.
В некоторых вариантах реализации по меньшей мере один антиген-связывающий сайт может быть специфичным к веществу бактериального происхождения, вирусному белку, аутоиммунному маркеру или антигену, присутствующему на конкретной клетке, например поверхностному белку В-клеток, Т-клеток, естественных киллеров (NK-клеток), миелоидных клеток, фагоцитарных клеток, опухолевых клеток.
В одном аспекте настоящего изобретения димерная антиген-связывающая молекула является биспецифической и содержит первый сайт специфичности по отношению к эффекторной клетке и второй сайт специфичности по отношению к клетке-мишени, отличающейся от эффекторной клетки. Такие антиген-связывающие молекулы способны перекрестно связывать две клетки и могут применяться для нацеливания эффекторных клеток на определенную мишень. В еще одном аспекте настоящего изобретения димерная антиген-связывающая молекула может являться биспецифической по отношению к клетке-мишени и молекуле, выбранной из группы, состоящей из лекарственного средства, токсина, фермента, радионуклида, альбумина и липопротеина, природных лигандов, например цитокинов или хемокинов. Если молекула-мишень является альбумином, источник альбумина или сывороточного альбумина можно выбрать из группы, состоящей из человека, крупного рогатого скота, кролика, собаки и мыши.
"Эффекторные клетки", как правило, относятся к клеткам иммунной системы, способным стимулировать или запускать цитотоксичность, фагоцитоз, презентацию антигена, высвобождение цитокинов. Такие эффекторные клетки являются, например, Т-клетками, естественными киллерами (NK-клетками), гранулоцитами, моноцитами, макрофагами, дендритными клетками, эритроцитами и антиген-презентирующими клетками, но не ограничиваются ими. Примеры подходящих специфичностей для эффекторных клеток включают CD2, CD3, CD5, CD28 и другие компоненты Т-клеточного рецептора (TCR) для Т-клеток; CD16, CD38, CD44, CD56, CD69, CD335 (NKp46), CD336 (NKp44), CD337 (NKp30), NKp80, NKG2C и NKG2D для NK-клеток; CD18, CD64 и CD89 для гранулоцитов; CD18, CD64, CD89 и рецептор маннозы для моноцитов и макрофагов; CD64 и рецептор маннозы для дендритных клеток; CD35 для эритроцитов, но не ограничиваются ими. В некоторых аспектах изобретения указанные специфичности, т.е. молекулы клеточной поверхности эффекторных клеток подходят для опосредования уничтожения клеток, за счет связывания биспецифического антитела с такой молекулой клеточной поверхности, что приводит к цитолизу или апоптозу.
"Клетки-мишени" обычно относятся к сайтам, на которые должны быть нацелены эффекторные клетки для индукции или запуска соответствующего биологического, например иммунного, ответа. Примеры клеток-мишеней могут являться опухолевыми клетками или инфекционными агентами, например вирусными или бактериальными патогенами, например вирусом денге, вирусом простого герпеса, вирусом гриппа, ВИЧ или клетками, несущими аутоиммунные мишени, например IL-2, аутоиммунный маркер или аутоиммунный антиген.
В предпочтительном варианте реализации настоящего изобретения димерная антиген-связывающая молекула является биспецифической по отношению к опухолевой клетке и эффекторной клетке, в частности, Т-клетке или NK-клетке. Подходящие специфичности для опухолевых клеток могут являться опухолевыми антигенами и антигенами клеточной поверхности на соответствующей опухолевой клетке, например определенными опухолевыми маркерами. Такая биспецифическая димерная антиген-связывающая молекула связывается как с опухолевой клеткой, так и с иммунной эффекторной клеткой, тем самым запуская цитотоксический ответ, вызванный Т-клетками или NK-клетками. Термин "опухолевый антиген", используемый в настоящей заявке, включает опухоле-ассоциированный антиген (ТАА) и опухоле-специфический антиген (TSA). Термин "опухоле-ассоциированный антиген" (ТАА), используемый в настоящей заявке, относится к белку, присутствующему на опухолевых клетках, а также на нормальных клетках в течение эмбрионального периода (однократные эмбриональные антигены), и после родов в отдельных органах, однако в значительно более низкой концентрации, чем на опухолевых клетках. ТАА могут также присутствовать в строме в непосредственной близости от опухолевой клетки, однако в строме других частей тела они экспрессируются в низких количествах. В противоположность этому, термин "опухоль-специфический антиген" (TSA) относится к белку, экспрессируемому опухолевыми клетками. Термин "антиген клеточной поверхности" относится к любому антигену или его фрагменту, который может распознаваться антителом на поверхности клетки.
Примеры специфичностей для опухолевых клеток включают CD19, CD20, CD30, белок-предшественник рецептора ламинина, EGFR1, EGFR2, EGFR3, Ер-САМ, PLAP, антиген Томсона-Фриденрайха (TF), MUC-1 (муцин), IGFR, CD5, IL-4-R альфа, IL13-R, FcεRI и IgE, как описано в данной области техники, но не ограничиваются ими.
В одном варианте реализации специфичности для эффекторных клеток могут представлять собой CD3 или CD16, а специфичности для опухолевых клеток можно выбрать из CD19, CD20, CD30, предшественника рецептора ламинина, Ер-САМ, EGFR1, EGFR2, EGFR3, PLAP, антигена Томсона-Фриденрайха (TF), MUC-1 (муцина), IGFR, CD5, IL-4-R альфа, IL13-R, FcεRI и IgE. Конкретные примеры таких антиген-связывающих молекул являются биспецифическими по отношению к CD3 и CD19 или CD16 и CD30.
В конкретном аспекте настоящего изобретения первый домен VLA и четвертый домен VHA обладают специфичностью по отношению к опухолевой клетке, а два других домена, а именно второй домен VHB и третий домен VLB, обладают специфичностью по отношению к эффекторной клетке, в частности Т-клетке или NK-клетке. В одном варианте реализации первый домен VLA и четвертый домен VHA обладают специфичностью по отношению к опухолевой клетке, а два других домена, а именно второй домен VHB и третий домен VLB, обладают специфичностью по отношению к CD3 или CD16. В определенном варианте реализации первый домен VLA и четвертый домен VHA обладают специфичностью по отношению к CD19, CD20, CD30, предшественнику рецептора ламинина, Ер-САМ, EGFR1, EGFR2, EGFR3, PLAP, антигену Томсона-Фриденрайха (TF), MUC-1 (муцину), IGFR, CD5, IL-4-R альфа, IL13-R, FcεRI, а два других домена, а именно второй домен VHB и третий домен VLB, обладают специфичностью по отношению к CD3.
В еще одном аспекте настоящего изобретения первый домен VLA и четвертый домен VHA обладают специфичностью по отношению к эффекторной клетке, в частности Т-клетке или NK-клетке, а два других домена, а именно второй домен VHB и третий домен VLB, обладают специфичностью по отношению к опухолевой клетке. В одном варианте реализации первый домен VLA и четвертый домен VHA обладают специфичностью по отношению к CD3 или CD16, а два других домена, а именно второй домен VHB и третий домен VLB, обладают специфичностью по отношению к опухолевой клетке. В особенно предпочтительном варианте реализации первый домен VLA и четвертый домен VHA обладают специфичностью по отношению к CD3, а два других домена, а именно второй домен VHB и третий домен VLB, обладают специфичностью по отношению опухолевой клетке, выбранной из группы, состоящей из CD19, CD20, CD30, предшественника рецептора ламинина, Ер-САМ, EGFR1, EGFR2, EGFR3, PLAP, антигена Томсона-Фриденрайха (TF), MUC-1 (муцина), IGFR, CD5, IL-4-R альфа, IL13-R, FcεRI и IgE.
Антиген CD3 связан с комплексом Т-клеточного рецептора на Т-клетках. В случае, когда специфичность для эффекторной клетки представляет собой CD3, связывание димерной антиген-связывающей молекулы согласно настоящему изобретению с CD3 может вызвать цитотоксическую активность Т-клеток по отношению к клеткам-мишеням. А именно, биспецифическое связывание димерной антиген-связывающей молекулы с CD3 и с клеткой-мишенью, например опухолевой клеткой, может индуцировать лизис клетки-мишени. Димерные антиген-связывающие молекулы со специфичностью к CD3 и их получение известны в данной области техники (и описаны, например, в Kipriyanov et al., 1999, Journal of Molecular Biology 293:41-56, Le Gall et al., 2004, Protein Engineering, Design & Selection, 17/4:357-366).
Моноспецифические антиген-связывающие молекулы против CD3 известны своими иммуносупрессивными свойствами при связывании с Т-клеточным рецептором и его модуляции (например, как описано в WO 2004/024771). В одном варианте реализации антиген-связывающая молекула согласно настоящему изобретению является биспецифической по отношению к CD3 и альбумин для применения в качестве иммунодепрессанта, например при трансплантации.
Антиген CD16 (FcγIIIA) является рецептором, экспрессируемым на поверхности NK-клеток. NK-клетки обладают характерной цитолитической активностью, и биспецифическое связывание димерной антиген-связывающей молекулы согласно настоящему изобретению с CD16 может запустить цитотоксическую активность NK-клеток по отношению к клеткам-мишеням. Описан пример биспецифической антиген-связывающей молекулы, обладающей специфичностью по отношению к CD16, например в Arndt et al., 1999, Blood, 94:2562-2568. В конкретном варианте реализации настоящего изобретения по меньшей мере один из вариабельных доменов тяжелой или легкой цепи получен из антитела против CD16, описанного в WO 2006/125668, в частности антител, распознающих изоформу CD16A, но не изоформу CD16B.
Димерные антиген-связывающие молекулы согласно изобретению, в которых опухолевая специфичность обеспечивается сродством к антигену CD19, можно применять для иммунотерапии В-клеточных злокачественных новообразований, поскольку антиген CD19 экспрессируется практически на всех злокачественных новообразованиях В-ряда от лимфобластного лейкоза (ALL) до неходжкинской лимфомы (NHL). В частности, для лечения неходжкинской лимфомы можно применять димерные антиген-связывающие молекулы, специфичные по отношению к CD19 или CD20. Димерные антиген-связывающие молекулы, обладающие специфичностью к CD19, и их получение известны в данной области техники (и описаны, например, в Cochlovius et al., 2000, Cancer Research 60:4336-4341).
Димерные антиген-связывающие молекулы согласно настоящему изобретению, в которых опухолевая специфичность обеспечивается сродством к рецептору ламинина или предшественнику рецептора ламинина, можно применять, например не ограничиваясь этим, для лечения хронического В-клеточного лимфолейкоза (B-CLL), неходжкинской лимфомы, лимфомы Ходжкина, рака легкого, рака толстой кишки, карциномы молочной железы, рака поджелудочной железы, рака предстательной железы, в частности состояний метастазирующего рака или минимального остаточного рака. Димерные антиген-связывающие молекулы, обладающие специфичностью по отношению к предшественнику рецептора ламинина, описаны, например, в Zuber et al., 2008, J. Mol. Biol., 378:530-539.
Димерные антиген-связывающие молекулы согласно настоящему изобретению, в которых опухолевая специфичность обеспечивается сродством к EGFR1, могут быть особенно полезны при лечении рака, при котором стимулируется или изменяется экспрессия EGFR1, например рака молочной железы, мочевого пузыря, головы и шеи, предстательной железы, почек, немелкоклеточного рака легкого, рака толстой кишки и глиомы.
Димерные антиген-связывающие молекулы согласно настоящему изобретению, в которых опухолевая специфичность обеспечивается сродством к TF-антигену, могут быть особенно полезны при лечении рака молочной железы или толстой кишки и/или метастазов в печень.
Димерные антиген-связывающие молекулы, в которых опухолевая специфичность обеспечивается сродством к CD30, могут быть особенно полезны при лечении болезни Ходжкина. Антиген-связывающие молекулы, обладающие специфичностью по отношению к CD30, описаны, например, в Arndt et al., 1999, Blood, 94:2562-2568.
Димерные антиген-связывающие молекулы, в которых опухолевая специфичность обеспечивается сродством к альфа-цепи рецептора IL-4 (IL4R альфа), могут быть особенно полезны при лечении солидных опухолей, в частности карцином молочной железы, яичников, выделительной системы, головы и шеи, злокачественной меланомы и саркомы Капоши при СПИДе. Димерные антиген-связывающие молекулы, содержащие по меньшей мере одну дополнительную специфичность по отношению к EGFR3/HER3 и/или EGFR2/neu, могут быть особенно полезны при лечении рака молочной железы. Димерные антиген-связывающие молекулы, в которых опухолевая специфичность обеспечивается сродством к IGFR, могут быть особенно полезны при лечении рака предстательной железы, толстой кишки, яичников или молочной железы.
Димерные антиген-связывающие молекулы, в которых опухолевая специфичность обеспечивается сродством к CD5, могут быть особенно полезны при лечении хронического лимфоцитарного лейкоза.
Димерные антиген-связывающие молекулы, в которых опухолевая специфичность обеспечивается сродством к MUC-I, могут быть особенно полезны при лечении рака желудка и рака яичников.
Димерные антиген-связывающие молекулы, в которых опухолевая специфичность обеспечивается сродством к ЕрСАМ, могут быть особенно полезны при лечении карцином ободочной кишки, почек и молочной железы.
Димерные антиген-связывающие молекулы, в которых опухолевая специфичность обеспечивается сродством к PLAP, могут быть особенно полезны при лечении рака яичников или яичек.
Димерные антиген-связывающие молекулы, в которых опухолевая специфичность обеспечивается сродством к OFA-iLR, могут быть особенно полезны при лечении метастатических опухолей.
В конкретном аспекте настоящего изобретения антиген-связывающая молекула, как описано в настоящей заявке, является димерной и биспецифической по отношению к CD3 и CD19, или антиген-связывающая молекула является димерной и биспецифической по отношению к CD16 и CD19. В конкретном варианте реализации первый домен VLA и четвертый домен VHA обладают специфичностью по отношению к CD3 и CD16, соответственно, в то время как второй домен VHB и третий домен VLB обладают специфичностью по отношению к CD19. В обоих случаях первая и вторая полипептидные цепи обладают порядком доменов 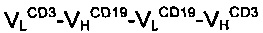 or
or 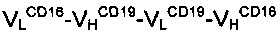 от N-конца к С-концу полипептидных цепей. В предпочтительном варианте реализации первый, второй, третий и четвертый домены являются гуманизированными или полностью полученными от человека. В наиболее предпочтительном варианте реализации первая и вторая полипептидная цепь, как установлено выше, являются гуманизированными или полностью полученными от человека. В еще одном аспекте настоящего изобретения димерная антиген-связывающая молекула может являться биспецифической, например, по отношению к ЕрСАМ и CD3; альбумину, например HSA и CD3 или EGFR и CD3.
от N-конца к С-концу полипептидных цепей. В предпочтительном варианте реализации первый, второй, третий и четвертый домены являются гуманизированными или полностью полученными от человека. В наиболее предпочтительном варианте реализации первая и вторая полипептидная цепь, как установлено выше, являются гуманизированными или полностью полученными от человека. В еще одном аспекте настоящего изобретения димерная антиген-связывающая молекула может являться биспецифической, например, по отношению к ЕрСАМ и CD3; альбумину, например HSA и CD3 или EGFR и CD3.
В дополнительном аспекте настоящего изобретения антиген-связывающая молекула, как описано в настоящей заявке, является специфической по отношению к альбумину, например сывороточному альбумину человека, и еще одному антигену, не являющемуся альбумином. Такая антиген-связывающая молекула связывается с сывороточным альбумином, что увеличивает период полужизни в сыворотке крови и in vivo. Таким образом, такие антиген-связывающие молекулы являются предпочтительными для медицинского или диагностического применения и фармацевтических композиций, в которых полипептид таких антиген-связывающих молекул содержит вариабельный домен легкой цепи и вариабельный домен тяжелой цепи терапевтического или диагностического антитела и вариабельный домен легкой цепи и вариабельный домен тяжелой цепи, специфичные по отношению к альбумину. Известные и/или коммерчески доступные терапевтические, диагностические антитела или антитела против альбумина можно применять в качестве источников вариабельных доменов легких цепей и вариабельных доменов тяжелой цепи. Кроме того, в данной области техники известны способы стимуляции синтеза и получения антител или Fv-фрагментов, специфичных по отношению к альбумину, например HSA. В таких антиген-связывающих молекулах домены полипептидной цепи расположены в порядке VLA-VHB-VLB-VHA, где антиген А или антиген В является альбумином. В предпочтительном варианте реализации альбумин является антигеном А. В определенном аспекте настоящего изобретения другой антиген представляет собой CD3. В конкретном варианте реализации антиген А является сывороточным альбумином человека (HSA), и полипептид антиген-связывающей молекулы HSA×CD3 обладает порядком доменов  , как показано в Примере 2. Для получения такой антиген-связывающей молекулы, например, можно получить и встроить в соответствующем порядке вариабельные домены антител или фрагментов антител против HSA и против CD3, например, аналогично описанию для CD3×CD19 в Примере 1 в экспрессирующую плазмиду, показанную на Фиг. 7, путем замены показанных доменов против CD3 и против CD19, или в любую другую подходящую экспрессирующую плазмиду или экспрессирующий конструкт.
, как показано в Примере 2. Для получения такой антиген-связывающей молекулы, например, можно получить и встроить в соответствующем порядке вариабельные домены антител или фрагментов антител против HSA и против CD3, например, аналогично описанию для CD3×CD19 в Примере 1 в экспрессирующую плазмиду, показанную на Фиг. 7, путем замены показанных доменов против CD3 и против CD19, или в любую другую подходящую экспрессирующую плазмиду или экспрессирующий конструкт.
Дополнительный аспект настоящего изобретения обеспечивает димерную антиген-связывающую молекулу по любому из вышеописанных вариантов реализации, связанную с дополнительной функциональной единицей, например функциональным доменом или агентом, независимо опосредующим биологическую функцию, в частности биохимическое событие. Дополнительная функциональная единица может входить в состав комплекса с или являться ковалентно связанной с по меньшей мере одной из двух отдельных полипептидных цепей димерной антиген-связывающей молекулы. В одном аспекте указанная дополнительная функциональная единица может быть ковалентно связана с только одной из отдельных полипептидных цепей, а в другом аспекте указанная дополнительная функциональная единица может быть ковалентно связана с обеими полипептидными цепями димерной антиген-связывающей молекулы, таким образом, соединяя две полипептидные цепи. В дополнительном аспекте каждая из двух полипептидных цепей по отдельности ковалентно связана с дополнительной функциональной единицей. Если указанная дополнительная функциональная единица ковалентно связана с по меньшей мере одной из двух полипептидных цепей, указанную дополнительную функциональную единицу можно объединить с по меньшей мере одной из двух полипептидных цепей с помощью пептидной связи или пептидного линкера. Кроме того, указанная дополнительная функциональная единица может быть присоединена посредством химического конъюгирования, например дисульфидного мостика, например, между остатком цистеина по меньшей мере одной полипептидной цепи и остатком цистеина дополнительной функциональной единицы, сложноэфирной связи или химического перекрестного связывания. В определенном аспекте настоящего изобретения указанная дополнительная функциональная единица может быть связана с антиген-связывающей молекулой с помощью расщепляемого линкера, например, дисульфидной связи.
Указанная дополнительная функциональная единица может быть связана с N-концом или С-концом первой и/или второй полипептидных цепей. Если одна дополнительная функциональная единица присоединена к обеим (первой и второй) полипептидным цепям, указанную дополнительную функциональную единицу можно присоединить по N-концу к одной полипептидной цепи и по С-концу к другой полипептидной цепи.
Гомобифункциональные и гетеробифункциональные реагенты для химического перекрестного связывания полипептидной цепи с дополнительной функциональной единицей, например дополнительным полипептидом или агентом, хорошо известны в данной области техники. Примеры включают 5,5'-дитиобис(2-нитробензойную кислоту) (DTNB), о-фенилендималеимид (o-PDM), сукцинимидил-3-(2-пиридилдитио)пропионат (SPDP), N-сукцинимидил-S-ацетилтиоацетат (SATA), сукцинимидил-4-(N-малеимидометил)циклогексан-1-карбоксилат (SMCC) или гидразид 4-(4-N-малеимидофенил)бутановой кислоты (МРВН), но не ограничиваются ими. Способы перекрестного связывания полипептидных цепей, включающих иммуноглобулиновые цепи с дополнительным полипептидом или химическим агентом, описаны, например, в Graziano et al., Methods in Molecular Biology, 2004, vol. 283, 71-85 and Hermanson, G.T. "Bioconjugate Techniques" Academic Press, London, 1996.
В одном аспекте указанная дополнительная функциональная единица может являться по меньшей мере одним дополнительным вариабельным доменом иммуноглобулина. Дополнительный вариабельный домен иммуноглобулина может являться специфичным по отношению к первому антигену А или второму антигену В, к которым специфичны сайты связывания димерной антиген-связывающей молекулы или, в качестве альтернативы, специфичным по отношению к третьему антигену С, который отличается от антигена А и антигена В. В конкретном аспекте изобретения с каждой из двух полипептидных цепей можно объединить дополнительный вариабельный домен легкой цепи VL и дополнительный вариабельный домен тяжелой цепи VH, так что один дополнительный домен, в частности VH, присоединен к N-концу, а другой дополнительный домен, в частности VL, присоединен к С-концу, что приводит к получению полипептида, содержащего шесть вариабельных доменов, связывающегося с другим идентичным полипептидом с образованием димерной антиген-связывающей молекулы, содержащей шесть антиген-связывающих сайтов. В еще одном аспекте изобретения один дополнительный вариабельный домен иммуноглобулина можно объединить с одной из полипептидных цепей антиген-связывающей молекулы, которая затем нековалентно связывается с комплементарным вариабельным доменом иммуноглобулина с аналогичным сайтом специфичности дополнительного третьего полипептида, тем самым образуя дополнительный антиген-связывающий сайт с участием димерной антиген-связывающей молекулы и дополнительного третьего полипептида. В еще одном аспекте изобретения дополнительная антиген-связывающая единица, в том числе scFv или диатело, может быть связана в качестве дополнительной функциональной единицы с димерной антиген-связывающей молекулой.
В конкретном аспекте изобретения указанная дополнительная функциональная единица может являться по меньшей мере одной дополнительной димерной антиген-связывающей молекулой, как описано в настоящей заявке. Соответственно, две или более димерные антиген-связывающие молекулы согласно изобретению можно присоединить друг к другу с целью повышения валентности и авидности антиген-связывающих молекул.
В еще одном аспекте изобретения дополнительная функциональная единица может являться эффекторным доменом, в том числе Fc-доменом, CH2-доменом, CH3-доменом, шарнирным доменом или их фрагментом. Такая единица может придавать антиген-связывающей молекуле эффекторные свойства в случае связывания с Fc-рецепторами. Такие функциональные единицы могут также применяться для увеличения времени полужизни антиген-связывающей молекулы в сыворотке.
В еще одном аспекте изобретения указанная дополнительная функциональная единица может являться ферментом. В случае, если фермент способен превращать пролекарство в активное лекарство, такую антиген-связывающую молекулу можно применять при антитело-зависимой терапии с использованием ферментов и пролекарств (ADEPT). Для этого антиген-связывающая молекула нацеливает фермент на ткань, представляющую интерес, и при связывании антиген-связывающей молекулы с указанной тканью в этой области активируется пролекарство. Кроме того, в данной области техники известно применение биспецифических антиген-связывающих молекул для нацеливания ферментов на терапевтические средства для лечения рака, например биспецифических антиген-связывающих молекул, обладающих специфичностью по отношению к CD30 и щелочной фосфатазе, которая катализирует превращение фосфата митомицина в спирт митомицина, или специфичностью по отношению к плацентарной щелочной фосфатазе и β-лактамазе, которые активируют противораковые пролекарства на основе цефалоспорина, но не ограничиваясь ими. Кроме того, возможно применение биспецифических антиген-связывающих молекул, обладающих специфичностью по отношению к фибрину и тканевому активатору плазминогена, для фибринолиза, и применение конъюгированных с ферментом антиген-связывающих молекул для иммуноферментного анализа.
В еще одном аспекте изобретения указанная функциональная единица может являться лекарством, токсином, радиоактивным изотопом, лимфокином, хемокином или молекулой-меткой. Такая антиген-связывающая молекула доставляет функциональную единицу к желательному месту действия. Например, химиотерапевтическое лекарственное средство, присоединенное к антиген-связывающей молекуле, специфичной по отношению к опухолевому антигену, можно доставлять к опухолевой клетке, а токсины можно доставлять к патогенам или опухолевым клеткам. Антиген-связывающую молекулу, присоединенную к токсину, можно применять для нацеливания NK-клеток или макрофагов; предпочтительно, она специфична по отношению к CD16. Примерами токсинов являются, не ограничиваясь ими, рибозилтрансферазы, сериновые протеазы, активатор гуанилциклазы, кальмодулин-зависимая аденилциклаза, рибонуклеаза, ДНК-алкилирующий агент или ингибитор митоза, например доксорубицин. Молекула-метка может являться, например, флуоресцентной, люминесцентной или радиоактивной молекулой, металлохелатом или ферментом (например, пероксидазой хрена, щелочной фосфатазой, бета-галактозидазой, малатдегидрогеназой, глюкозооксидазой, уреазой, каталазой и т.д.), который, в свою очередь, при взаимодействии с субстратом реагирует с ним с получением обнаруживаемого химического радикала и который можно применять для визуализации или иммуноанализа in vivo при связывании с антиген-связывающей молекулой в соответствии с изобретением. При применении для иммуноанализа димерную антиген-связывающую молекулу также можно иммобилизовать на нерастворимом носителе, например стекле, полистироле, полипропилене, полиэтилене, декстране, нейлоне, природных и модифицированных целлюлозах, полиакриламидах, агарозе и магнитных гранулах.
Для увеличения времени полужизни антиген-связывающих молекул согласно изобретению в организме, антиген-связывающую молекулу при желании можно объединить с альбумином или пегилировать, сиалировать или гликозилировать (см., например, Stork et al., 2008, J. Biol. Chem., 283:7804-7812). В качестве альтернативы для объединения дополнительной молекулы альбумина с антиген-связывающей молекулой в соответствии с настоящим изобретением, сама указанная антиген-связывающая молекула может быть специфична по отношению к альбумину и другому антигену, как описано выше в настоящем документе.
Димерную антиген-связывающую молекулу по любому из вариантов реализации, описанных выше в настоящей заявке, можно получить путем экспрессии полинуклеотидов, кодирующих отдельные полипептидные цепи, которые связываются друг с другом с образованием димерной антиген-связывающей молекулы. Таким образом, дополнительным вариантом реализации настоящего изобретения являются полинуклеотиды, например ДНК или РНК, кодирующие полипептидные цепи димерной антиген-связывающей молекулы, как описано выше в настоящей заявке.
Указанные полинуклеотиды можно сконструировать с применением способов, известных специалистам, например, путем комбинирования генов, кодирующих первый домен VLA, второй домен VHB, третий домен VLB и четвертый домен VHA, разделенные пептидными линкерами или непосредственно связанные между собой пептидными связями, в едином генетическом конструкте, функционально связанном с подходящим промотором и, необязательно, подходящим терминатором транскрипции, и их экспрессии в бактерии или другой соответствующей системе экспрессии. В зависимости от выбранных векторной системы и хозяина, можно использовать любой набор подходящих элементов транскрипции и трансляции, включая конститутивные и индуцируемые промоторы. Промотор выбирают так, чтобы он управлял экспрессией полинуклеотида в соответствующей клетке-хозяине.
Полинуклеотиды можно подвергать оптимизации кодонов путем изменения смещения использования кодонов в соответствии с экспрессией в выбранном хозяине.
Полинуклеотид можно встроить в векторы, предпочтительно экспрессирующие векторы, которые представляют собой дополнительный вариант реализации настоящего изобретения. Указанные рекомбинантные векторы можно сконструировать в соответствии со способами, хорошо известными специалистам в данной области техники, см., например, Sambrook, Molecular Cloning A Laboratory Manual, Cold Spring Harbor Laboratory (1989) N.Y.
Для встраивания и экспрессии полинуклеотидов, кодирующих полипептидные цепи по настоящему изобретению, можно использовать множество систем экспрессионных векторов/хозяев. Указанные системы включают, не ограничиваясь ими, микроорганизмы, например бактерии, трансформированные рекомбинантным бактериофагом, плазмидными или космидными ДНК-экспрессирующими векторами, дрожжи, трансформированные дрожжевыми экспрессирующими векторами; клетки насекомых, инфицированные вирусными экспрессирующими векторами (например, бакуловирусом); системы на основе клеток растений, трансформированных вирусными экспрессирующими векторами (например, вирусом мозаики цветной капусты CaMV; вирусом табачной мозаики, TMV) или бактериальными экспрессирующими векторами (например, плазмидами Ti или pBR322); или системы на основе клеток животных, для которых можно использовать экспрессирующие системы на основе вирусов.
Конкретный предпочтительный экспрессирующий вектор для экспрессии в E. coli представляет собой pSKK (LeGall et al., J Immunol Methods. (2004) 285(1):111-27), или pcDNA5 (Invitrogen) для экспрессии в клетках млекопитающих.
Таким образом, димерную антиген-связывающую молекулу, как описано в настоящей заявке, можно получить путем встраивания полинуклеотида или вектора, кодирующего полипептидную цепь, как описано выше, в клетку-хозяина и культивирования указанной клетки-хозяина в условиях, при которых экспрессируется указанная полипептидная цепь. Димерную антиген-связывающую молекулу, полученную из экспрессированных полипептидных цепей, можно выделить и, при необходимости, дополнительно очистить. Условия для роста и поддержания клеток-хозяев, экспрессии, выделения и очистки димерных антиген-связывающих молекул согласно изобретению из этих клеток-хозяев полностью описаны в литературе.
В дополнительном варианте реализации настоящего изобретения предложены композиции, содержащие димерную антиген-связывающую молекулу или полинуклеотид, как описано выше, и по меньшей мере один дополнительный компонент. Для применения при профилактике или лечении заболевания или расстройства указанную композицию, содержащую димерную антиген-связывающую молекулу или молекулу-полинуклеотид, кодирующую полипептидные цепи, образующие антиген-связывающую молекулу, предпочтительно объединяют с подходящим фармацевтически приемлемым носителем. Подразумевается, что термин "фармацевтически приемлемый носитель" включает любой носитель, не влияющий на биологическую активность ингредиентов и нетоксичный для пациента при введении. Примеры подходящих фармацевтических носителей хорошо известны в данной области техники и включают физиологические растворы с фосфатным буфером, воду, эмульсии, например эмульсии масло/вода, различные типы смачивающих агентов, стерильные растворы и т.д. Такие носители можно составить обычными способами и вводить субъекту в подходящей дозе. Предпочтительно указанные композиции являются стерильными. Указанные композиции также могут содержать адъюванты, например консерванты, эмульгаторы и диспергаторы. Предотвращение действия микроорганизмов можно обеспечить путем включения различных антибактериальных и противогрибковых агентов. Введение подходящих композиций можно осуществлять различными способами, например, путем внутривенного, внутрибрюшинного, подкожного, внутримышечного, местного или внутрикожного введения. Путь введения, разумеется, зависит от лечения и типа соединения, содержащегося в фармацевтической композиции. Схему приема может определить лечащий врач с учетом других клинических факторов. Как известно в области медицины, дозировки для любого пациента зависят от многих факторов, включая размеры пациента, площадь поверхности тела, возраст, пол, конкретное соединение, подлежащее введению, время и путь введения, вид лечения, общее состояние здоровья и другие одновременно вводимые препараты.
Кроме того, настоящее изобретение обеспечивает медицинское применение или способ, в котором димерную антиген-связывающую молекулу, как описано выше, вводят в эффективной дозе субъекту, например пациенту, для иммуносупрессивной терапии, например при трансплантации, лечении аутоиммунного заболевания, воспалительного заболевания, инфекционного заболевания, аллергии или рака (например, неходжкинской лимфомы; хронического лимфолейкоза; лимфомы Ходжкина; солидных опухолей, например, при раке молочной железы, раке яичников, раке толстой кишки, раке почки или раке желчного протока; минимальной остаточной болезни; метастатических опухолей, например метастазирующих в легкие, кости, печень или головной мозг). Антиген-связывающую молекулу можно применять в профилактических или терапевтических целях, отдельно или в сочетании с текущей терапией.
Рак, который можно лечить с применением антиген-связывающей молекулы по настоящему изобретению, включает первичный и метастазирующий рак коры надпочечников, рак заднего прохода, апластическую анемию, рак желчных протоков, рак мочевого пузыря, рак костей, метастазы в кости, опухоли ЦНС, рак периферической ЦНС, рак молочной железы, болезнь Кастлемена, рак шейки матки, неходжкинскую лимфому у детей, рак ободочной и прямой кишки, рак эндометрия, рак пищевода, семейство опухолей Юинга (например, саркому Юинга), рак глаза, рак желчного пузыря, карциноидные опухоли желудочно-кишечного тракта, опухоли стромы желудочно-кишечного тракта, гестационную трофобластическую болезнь, волосатоклеточный лейкоз, болезнь Ходжкина, саркому Капоши, рак почек, рак гортани и гипофаринкса, острый лимфолейкоз, острый миелолейкоз, лейкоз у детей, хронический лимфолейкоз, хронический миелолейкоз, рак печени, рак легких, карциноидные опухоли легких, неходжкинскую лимфому, рак молочной железы у мужчин, злокачественную мезотелиому, множественную миелому, миелодиспластический синдром, миелопролиферативные заболевания, рак носовой полости и придаточных пазух, рак носоглотки, нейробластому, рак ротовой полости и ротоглотки, остеосаркому, рак яичников, рак поджелудочной железы, рак полового члена, рак гипофиза, рак предстательной железы, ретинобластому, рабдомиосаркому, рак слюнных желез, саркому (рак мягких тканей у взрослых), меланому, немеланомный рак кожи, рак желудка, рак яичек, рак тимуса, рак щитовидной железы, рак матки (например, саркому матки), рак влагалища, рак вульвы и макроглобулинемию Вальденстрема, но не ограничивается ими.
"Эффективная доза" относится к количеству активного ингредиента, достаточному для влияния на ход и тяжесть заболевания, что приводит к ослаблению или ремиссии патологии. "Эффективную дозу" для лечения и/или профилактики указанных заболеваний или расстройств можно определить с помощью способов, известных специалисту (см., например, Fingl et al., The Pharmacological Basis of Therapeutics, Goddman and Gilman, eds. Macmillan Publishing Co., New York, pp. 1-46 (1975)).
В еще одном аспекте настоящего изобретения димерную антиген-связывающую молекулу, как описано выше, применяют при производстве иммунодепрессанта или медикамента для лечения аутоиммунного заболевания, воспалительного заболевания, инфекционного заболевания, аллергии или рака (например, неходжкинской лимфомы; хронического лимфолейкоза; лимфомы Ходжкина; солидных опухолей, например, при раке молочной железы, раке яичников, раке толстой кишки, раке почки или раке желчного протока; минимальной остаточной болезни; метастатических опухолей, например, метастазирующих в легкие, кости, печень или головной мозг). Если указано, что полиспецифические связывающие молекулы описаны выше как имеющие особую ценность при лечении указанного заболевания, указанные связывающие молекулы также можно применять при производстве лекарственного средства для указанного заболевания.
Способы изготовления фармацевтических композиций, т.е. лекарственных средств, и клинического применения антиген-связывающих молекул при профилактике и/или лечении таких заболеваний, как, например, рак, известны специалистам.
В предпочтительном аспекте настоящего изобретения димерная антиген-связывающая молекула является биспецифической и применяется для лечения рака, поскольку такие антитела можно применять для перенацеливания цитотоксических эффекторных клеток против опухолевых клеток. Указанная терапевтическая концепция широко известна в данной области техники. Например, клинические исследования продемонстрировали регрессию опухоли у пациентов, получавших биспецифическое антитело против CD3 и опухолей (например, Canevari, S. et al., J. Natl. Cancer Inst., 87:1463-1469,1996) или у пациентов, получавших биспецифическое антитело против CD16 и опухолей (например, Hartmann et al.; Clin Cancer Res. 2001; 7(7):1873-81). Кроме того, продемонстрировано доказательство правильности концепции для различных молекул рекомбинантных биспецифических антител, включающих только вариабельные домены (Fv), например, димерных и четырехвалентных антиген-связывающих молекул CD3×CD19, характеризующихся порядком доменов VHA-VLB-VHB-VLA (Cochlovius et al.; Cancer Research, 2000, 60:4336-4341) или в недавних клинических исследованиях с применением молекул мономерных одноцепочечных Fv-антител формата BiTE® (два одноцепочечных антитела различной специфичности, присоединенные друг к другу; Micromet AG, Germany; Bargou R. et al., Science, 2008, 321(5891):974-977; Baeuerle PA and Reinhardt C, Cancer Res. 2009, 69(12):4941-4944). Димерные антиген-связывающие молекулы, описанные в настоящем документе, можно применять в качестве лекарственных средств и в способах лечения аналогично биспецифическим антителам, известным в данной области техники, поскольку они способны перенаправлять терапевтические, например, цитотоксические механизмы с использованием аналогичных комбинированных специфичностей антител. Кроме того, известно применение иммуносупрессивных антител, моноспецифических по отношению к CD3, например муромонаб-CD3, для лечения отторжения трансплантата, острого отторжения трансплантатов почек (аллотрансплантатов), трансплантатов печени и сердца. Таким образом, антиген-связывающие молекулы, биспецифические по отношению к альбумину и CD3, можно применять в тех же способах лечения, как и известные моноспецифические антитела против CD3. Кроме того, антиген-связывающие молекулы, специфичные по отношению к альбумину и другому антигену, т.е. мишени терапии или диагностики, как описано в настоящем документе, можно использовать для соответствующего клинического применения антигенной специфичности, отличающейся от альбумина.
Антиген-связывающие молекулы и их композиции могут быть представлены в форме для перорального, внутривенного, внутрибрюшинного введения, или другой фармацевтически приемлемой лекарственной форме. В некоторых вариантах реализации указанную композицию вводят перорально, и лекарственная форма представляет собой таблетку, капсулу, каплет или другую перорально доступную форму. В некоторых вариантах реализации композиция предназначена для парентерального введения, например внутривенного, внутрибрюшинного, внутримышечного, подкожного введения; ее вводят с помощью раствора, содержащего антиген-связывающую молекулу.
Специалист легко может сконструировать и получить антиген-связывающие молекулы, описанные в настоящем документе, используя установленные методики и стандартные способы, известные в данной области техники, см., например, Sambrook, Molecular Cloning A Laboratory Manual, Cold Spring Harbor Laboratory (1989) N.Y.; The Protein Protocols Handbook, edited by John M. Walker, Humana Press Inc. (2002); или Antibody engineering: methods and protocols/edited by Benny K.C. Lo; Benny K.C. II Series: Methods in molecular biology (Totowa, N.J.)). Кроме того, специалист может изготовить антиген-связывающие молекулы, описанные в настоящем документе, с использованием стандартных методов, известных в данной области техники, и модифицируя способы, описанные в патенте США 7129330, Kipriyanov et al. J. Mol. Biol. (1999) 293, 41-56 or Le Gall et al., 2004, Protein Engineering 17:357-366, таким образом, что образуются димерные антиген-связывающие молекулы, как описано выше, включающие две полипептидные цепи, характеризующиеся порядком доменов VLA-VHB-VLB-VHA от N-конца к С-концу каждой полипептидной цепи.
Примеры, приведенные ниже, дополнительно иллюстрируют настоящее изобретение, не ограничивая его.
Пример 1
Для конструирования функциональных димерных тандемных диател (TandAb®) при использовании порядка доменов, отличающегося от VHA-VLB-VHB-VLA, несколько таких димерных тандемных диател сконструировали с использованием порядка доменов VLA-VHB-VLB-VHA в соответствии с настоящим изобретением, используя два домена гуманизированного одноцепочечного антитела против CD19 и гуманизированного одноцепочечного антитела против CD3, соответственно. Полученные результаты подтвердили с использованием двух вариантов каждой антиген-связывающей молекулы, представляющих собой продукты различных стадий процедуры созревания аффинности, выполненной как для гуманизированного антитела против CD19, так и гуманизированного антитела против CD3.
Моноклональные антитела мыши HD37 и UCHT против CD19 и CD3, соответственно, являлись исходным материалом для получения гуманизированных антител с относительно высоким сродством. В каждом случае VH-домен вначале объединяли с библиотекой VL человека в фагмидном scFv-векторе с целью выбора подходящей VL-цепи человека с помощью фагового дисплея. На втором этапе выбранную VL-цепь человека объединяли с библиотекой VH-доменов, в которых область CDR3 оставалась постоянной. Эта процедура привела к получению гуманизированных антител против CD19 и против CD3, соответственно, которые содержали короткую последовательность мыши лишь в области VHCDR3. Затем эти клоны подвергали созреванию аффинности путем введения точечных мутаций в остатки, предположительно вовлеченные в связывание антигена. Затем осуществляли отбор мутантов, характеризовавшихся лучшим связыванием, с помощью фагового дисплея. Клоны, выбранные для построения TandAb, являлись M13 и M39, связывавшимися с CD19 и C4, и LcHC21, связывавшимся с CD3.
Были получены следующие антитела:
Антитело A1: 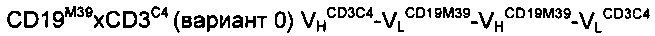
Антитело В: 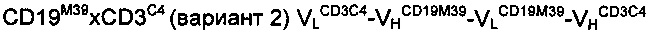
Антитело A2: 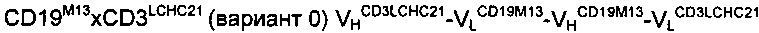
Антитело C: 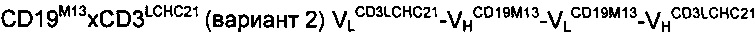
Плазмиды, кодирующие гибридные мономеры 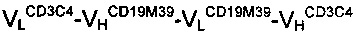 антитела В и
антитела В и 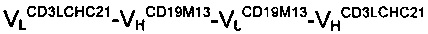 антитела С, были получены поставщиком услуг по инженерии и обработке ДНК. Последовательность каркаса мономера
антитела С, были получены поставщиком услуг по инженерии и обработке ДНК. Последовательность каркаса мономера  содержала последовательности ДНК двух scFv-антител, а именно scFvCD19M39 и scFvCD3C4, соответственно. Последовательность мономера
содержала последовательности ДНК двух scFv-антител, а именно scFvCD19M39 и scFvCD3C4, соответственно. Последовательность мономера 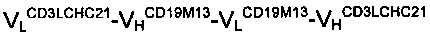 объединяла вариабельные домены одноцепочечного Fv CD19M13 и одноцепочечного Fv CD3LCHC21. Все четыре scFv были получены путем отбора одноцепочечных антител против антигенов CD19 и CD3 с использованием фагового дисплея. В обоих случаях информацию о последовательности использовали для конструирования вышеуказанных гибридных мономеров. 9-аминокислотный (G2S)3 линкер использовали для присоединения доменов друг к другу. Синтезированный ген, кодировавший
объединяла вариабельные домены одноцепочечного Fv CD19M13 и одноцепочечного Fv CD3LCHC21. Все четыре scFv были получены путем отбора одноцепочечных антител против антигенов CD19 и CD3 с использованием фагового дисплея. В обоих случаях информацию о последовательности использовали для конструирования вышеуказанных гибридных мономеров. 9-аминокислотный (G2S)3 линкер использовали для присоединения доменов друг к другу. Синтезированный ген, кодировавший 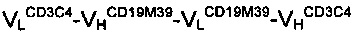 , клонировали в экспрессирующем векторе млекопитающих pCDNA5FRT (Invitrogen). Ген
, клонировали в экспрессирующем векторе млекопитающих pCDNA5FRT (Invitrogen). Ген 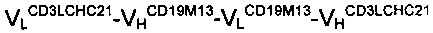 также клонировали в экспрессирующем векторе и амплифицировали с помощью ПЦР с использованием прямого праймера, внедряющего сайт расщепления Ncol, и обратного праймера, внедряющего сайт расщепления Notl. После анализа и выделения в агарозном геле продукт ПЦР дважды расщепляли с помощью Ncol и Notl и клонировали в Ncol и Notl-линеаризованном векторе pSKK3. Правильность клонирования подтверждали с помощью секвенирования ДНК.
также клонировали в экспрессирующем векторе и амплифицировали с помощью ПЦР с использованием прямого праймера, внедряющего сайт расщепления Ncol, и обратного праймера, внедряющего сайт расщепления Notl. После анализа и выделения в агарозном геле продукт ПЦР дважды расщепляли с помощью Ncol и Notl и клонировали в Ncol и Notl-линеаризованном векторе pSKK3. Правильность клонирования подтверждали с помощью секвенирования ДНК.
Карта вектора pCDNA5FRT, кодирующего антитело В, показана на Фиг. 6. Карта вектора pSKK3, кодирующего антитело С, показана на Фиг. 7.
Для интенсивного производства вектор, содержащий ген 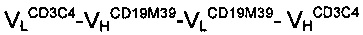 , временно трансфицировали (с помощью CaPO4) в адгезивные клетки HEK293. Ферментацию белка осуществляли в ростовых условиях, широко известных в данной области техники.
, временно трансфицировали (с помощью CaPO4) в адгезивные клетки HEK293. Ферментацию белка осуществляли в ростовых условиях, широко известных в данной области техники.
Рекомбинантный белок экспрессировали в виде His-Tag-гибридного белка с сигнальным пептидом. Белок выделяли из супернатанта клеточной культуры с помощью аффинной хроматографии с использованием иммобилизованных металлов (IMAC), как описано (Kipriyanov et al., 1999, J. Mol. Biol., 293, 41-56). Очищенный материал затем анализировали с помощью электрофореза в ДСН-ПААГ. Окрашивание ДСН-ПААГ Кумасси и эксклюзионной хроматографии на калиброванной колонке Superdex 200 HR10/30 (Amersham Pharmacia, Фрайбург, Германия) в натрий-фосфатном буфере (30 мМ NaPO4, 0,75 М аргинин/HCl, pH 6,0) выявило чистый и правильно собранный рекомбинантный белок (антитело В).
Для интенсивной экспрессии ген, кодирующий гуманизированный мономер  с последующим 6×His-маркером, клонировали в плазмиде pSKK3, содержавшей систему генов клеточного суицида hok/sok и ген skp, кодирующий периплазматический фактор Skp/OmpH (LeGall et al., 2004, J. Immunol. Methods, 285, 111-127). Указанную плазмиду трансфицировали в штамм E. coli K12 (АТСС 31608™).
с последующим 6×His-маркером, клонировали в плазмиде pSKK3, содержавшей систему генов клеточного суицида hok/sok и ген skp, кодирующий периплазматический фактор Skp/OmpH (LeGall et al., 2004, J. Immunol. Methods, 285, 111-127). Указанную плазмиду трансфицировали в штамм E. coli K12 (АТСС 31608™).
Трансформированные бактерии выращивали во встряхиваемых колбах и индуцировали практически в соответствии с предшествующим описанием (Cochlovius et al., 2000, J. Immunol., 165, 888-895). Рекомбинантные белки выделяли как из растворимой периплазматической фракции, так и из супернатанта бактериальной культуры с помощью аффинной хроматографии с использованием иммобилизованных металлов (IMAC), как описано (Kipriyanov et al., 1999, J. Mol. Biol., 293, 41-56).
Затем очищенный материал анализировали с помощью окрашивания ДСН-ПААГ Кумасси голубым и эксклюзионной хроматографии на калиброванной колонке Superdex 200 HR10/30 (Amersham Pharmacia, Фрайбург, Германия) в натрий-фосфатном буфере (30 мМ NaPO4, 0,75 М аргинин/HCl, pH 6,0). Полученный продукт был чистым и правильно собранным.
Антитела для сравнения А1 и А2 получили аналогично антителам В и С соответственно, причем порядок доменов в антителах А1 и А2 соответственно был обратным по сравнению с антителами В и С соответственно.
Анализ цитотоксичности проводили, как описано в Т. Dreier et al. (2002, Int J Cancer 100, 690-697). МПК, использованные в качестве эффекторных клеток, выделили из периферической крови здоровых добровольцев путем центрифугирования в градиенте плотности. В некоторых случаях МПК культивировали в течение ночи в присутствии 25 ед/мл IL-2 человека до использования в качестве эффекторных клеток в анализе цитотоксичности. Чистоту и экспрессию антигена выделенными МПК в каждом случае проверяли с помощью проточной цитометрии (данные не показаны).
Клетки-мишени CD19+ JOK-1 или Raji культивировали в среде RPMI 1640 с добавлением 10% FCS, 2 mM L-глутамина и 100МЕ/мл натрий-пенициллина G и 100 мкг/мл стрептомицина сульфата (называемой в настоящем документе средой RPMI; все компоненты приобрели в Invitrogen). Для анализа цитотоксичности клетки метили 10 мкМ кальцеина AM (Molecular Probes/Invitrogen) в течение 30 мин в среде RPMI без FCS при 37°C. После осторожного промывания меченые клетки ресуспендировали в среде RPMI до плотности 1×105/мл. Затем 1×104 клеток-мишеней высевали вместе с 5×105 МПК с указанными антителами в отдельных лунках круглодонного 96-луночного микропланшета в общем объеме 200 мкл/лунку. После центрифугирования в течение 2 мин при 200 g анализируемые клетки инкубировали в течение 4 часов при 37°C в увлажненной атмосфере с 5% CO2. За 15 мин до конца инкубирования в лунки, содержавшие только клетки-мишени, добавляли 20 мкл 10% Тритона Х-100 в среде RPMI. Во все остальные лунки добавляли 20 мкл среды RPMI. Из каждой лунки собирали 100 мкл супернатанта клеточной культуры после дополнительного центрифугирования в течение 5 мин при 500 g и измеряли флуоресценцию высвобожденного кальцеина при 520 нм с использованием флуоресцентного планшет-ридера (Victor 3, Perkin Elmer). На основании измеренного количества импульсов рассчитывали специфический лизис клеток по следующей формуле: [флуоресценция (образец) - флуоресценция (спонтанная)] / [флуоресценция (максимальная) - флуоресценция (спонтанная)] × 100%. Флуоресценция (спонтанная) представляет собой количество флуоресцентных импульсов клеток-мишеней в отсутствие эффекторных клеток и антител, а флуоресценция (максимальная) представляет собой полный лизис клеток, вызванный добавлением тритона X100. Сигмоидные кривые зависимости "доза-ответ" и значения ЕС50 рассчитывали с помощью программного обеспечения Prism (GraphPad Software).
Результаты
Результаты анализа цитотоксичности тандемных диател, характеризующихся порядком доменов, начиная с N-конца VHA-VLB-VHB-VLA (антитело А) и VLA-VHB-VLB-VHA (антитело В) соответственно, с использованием варианта M39 антитела против CD19 и варианта C4 антитела против CD3, показаны на Фигуре 3.
Неожиданным образом цитотоксическая активность указанных двух тандемных диател значительно различалась. Тандемное диатело, характеризующееся порядком доменов согласно изобретению, обозначенное как "антитело В", обладало более чем в 60 раз повышенной активностью по сравнению с тандемным диателом, обозначенным как "антитело В", согласно определению путем сравнения значений их EC50 при данных условиях.
Превосходство расположения доменов, представленного в настоящем изобретении (антитело С) с точки зрения цитотоксичности подтвердили с помощью двух дополнительных вариантов антител против CD19 и против CD3 (см. Фигуру 4).
Значение EC50 тандемного диатела с порядком доменов в соответствии с изобретением, представленного в варианте 2, являлось крайне низким (0,1 пМ). Оно было в 27 раз более активным, чем TandAb, представленное в варианте 0, согласно сравнению значений EC50 в данных условиях.
Пример 2
Модуляция T-клеточного рецептора антителами TandAb против сывороточного альбумина человека (HSA)×CD3 in vitro
Для определения различий в эффективности антител TandAb HSA×CD3 с разным порядком доменов при индукции модулирования T-клеточного рецептора (TCR)/CD3 на T-клетках in vitro клетки CD3+ Jurkat культивировали в присутствии возрастающих концентраций биспецифических антител TandAb HSA×CD3, а затем анализировали оставшиеся TCR. Анализ модулирования проводили в присутствии или в отсутствие HSA для измерения влияния HSA на активность TandAb.
Вкратце, 1×106 клеток Jurkat высевали в отдельные лунки круглодонного 96-луночного микропланшета в среде RPMI 1640 с добавлением 2 тМ L-глутамина и 100 МЕ/мл натрий-пенициллина G и 100 мкг/мл стрептомицина сульфата (все компоненты приобрели в Invitrogen). В отдельный микропланшет высевали клетки Jurkat в среде RPMI, как описано выше, но с добавлением 50 мг/мл HSA (Sigma). После добавления указанных антител клетки инкубировали в общем объеме 200 мкл/лунку при 37°C в увлажненном инкубаторе в присутствии 5% CO2. В качестве контроля клетки культивировали в отсутствие антител. После промывки ледяным физиологическим раствором с фосфатным буфером (PBS, Invitrogen, Карлсруэ, Германия) с добавлением 2% FCS, инактивированной нагреванием (Invitrogen, Карлсруэ, Германия) и 0,1% азида натрия (Roth, Карлсруэ, Германия) (называемого FACS-буфером) клетки окрашивали 10 мкл PC5-конъюгированного антитела против TCR α/β (Beckman-Coulter) в общем объеме 100 мкл FACS-буфера в течение 45 на льду в темноте. После двукратной промывки FACS-буфером измеряли флуоресценцию 104 клеток при 675 нм на проточном цитометре FC500 MPL (Beckman-Coulter). Средние значения флуоресценции определяли с помощью программного обеспечения СХР (Beckman-Coulter) и использовали для анализа путем нелинейной регрессии/4-параметрической логистической аппроксимации с использованием GraphPad Prism версии 3.03 для Windows, GraphPad Software, Сан-Диего, Калифорния, США.
Результаты, полученные в ходе эксперимента по модулированию TCR САВ-306, отображенные на Фиг. 5 и сведенные в Таблице 1, демонстрировали сопоставимую эффективность модулирования TCR с помощью TandAb HSA×CD3 с порядком доменов VHA-VLB-VHB-VLA (= вариант 0) и VLA-VHB-VLB-VHA (= вариант 2), которые демонстрировали эффективность модулирования, если HSA являлся антигеном В. В то же время, в присутствии физиологических концентраций HSA эффективность модулирования в случае TandAb варианта 0 (VHA-VLB-VHB-VLA) значительно снижалась, в то время как значение EC50 TandAb с вариантом ориентации 2 (VLA-VHB-VLB-VHA) повышалось лишь в 2,6 раза.
Указанные данные ясно показывают превосходство TandAb HSA×CD3 с вариантом ориентации доменов 2 (VLA-VHB-VLB-VHA) по сравнению с TandAb HSA×CD3 варианта 0 (VHA-VLB-VHB-VLA).
Значения EC50, полученные в эксперименте по модулированию TCR двумя антителами TandAb HSA×CD3 в присутствии или в отсутствие HSA (Фиг. 5; эксперимент САВ-306), определяли с помощью нелинейной регрессии/4-параметрической логистической аппроксимации.
Хотя в настоящем документе показаны и описаны предпочтительные варианты реализации настоящего изобретения, для специалистов в данной области техники очевидно, что такие варианты реализации приведены лишь в качестве примера. Специалисты могут осуществить различные модификации, изменения и замены без выхода за рамки настоящего изобретения. Следует понимать, что при осуществлении настоящего изобретения возможно использование различных альтернативных вариантов реализации настоящего изобретения, описанных в настоящем документе. Предполагается, что следующая формула изобретения определяет рамки настоящего изобретения и что она охватывает способы и структуры в рамках указанных пунктов формулы изобретения и их эквиваленты.
| название | год | авторы | номер документа |
|---|---|---|---|
| ОДНОВАЛЕНТНЫЕ АСИММЕТРИЧНЫЕ БИСПЕЦИФИЧЕСКИЕ АНТИТЕЛА С ТАНДЕМНЫМ FAB | 2017 |
|
RU2780591C2 |
| ИММУНОГЛОБУЛИН С ТАНДЕМНЫМ РАСПОЛОЖЕНИЕМ FAB-ФРАГМЕНТОВ И ЕГО ПРИМЕНЕНИЕ | 2014 |
|
RU2769133C2 |
| ИММУНОГЛОБУЛИН С ТАНДЕМНЫМИ FAB-ФРАГМЕНТАМИ И ВАРИАНТЫ ЕГО ПРИМЕНЕНИЯ | 2017 |
|
RU2767329C2 |
| СТАБИЛЬНЫЕ АНТИТЕЛА, СВЯЗЫВАЮЩИЕСЯ С НЕСКОЛЬКИМИ АНТИГЕНАМИ | 2012 |
|
RU2652886C2 |
| ЧЕТЫРЕХВАЛЕНТНЫЕ СИММЕТРИЧНЫЕ БИСПЕЦИФИЧЕСКИЕ АНТИТЕЛА | 2019 |
|
RU2807346C2 |
| ОПРЕДЕЛЯЮЩИЕ КОМПЛЕМЕНТАРНОСТЬ УЧАСТКИ ДЛЯ СВЯЗЫВАНИЯ CD3 И СОДЕРЖАЩАЯ ИХ БИСПЕЦИФИЧЕСКАЯ АНТИГЕНСВЯЗЫВАЮЩАЯ МОЛЕКУЛА | 2019 |
|
RU2738802C1 |
| САЙТЫ АНТИТЕЛ, СПЕЦИФИЧНО СВЯЗЫВАЮЩИЕ EGFRvIII | 2014 |
|
RU2696892C2 |
| БИСПЕЦИФИЧЕСКИЕ СВЯЗЫВАЮЩИЕ МОЛЕКУЛЫ, СПОСОБНЫЕ СВЯЗЫВАТЬ CD137 И ОПУХОЛЕВЫЕ АНТИГЕНЫ, И ВАРИАНТЫ ИХ ПРИМЕНЕНИЯ | 2018 |
|
RU2805648C2 |
| ТРИСПЕЦИФИЧНЫЕ СВЯЗЫВАЮЩИЕ МОЛЕКУЛЫ, КОТОРЫЕ СПЕЦИФИЧЕСКИ СВЯЗЫВАЮТ АНТИГЕНЫ МНОЖЕСТВА ЗЛОКАЧЕСТВЕННЫХ ОПУХОЛЕЙ, И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2015 |
|
RU2718692C2 |
| CD3-СВЯЗЫВАЮЩИЙ ДОМЕН | 2015 |
|
RU2742691C2 |
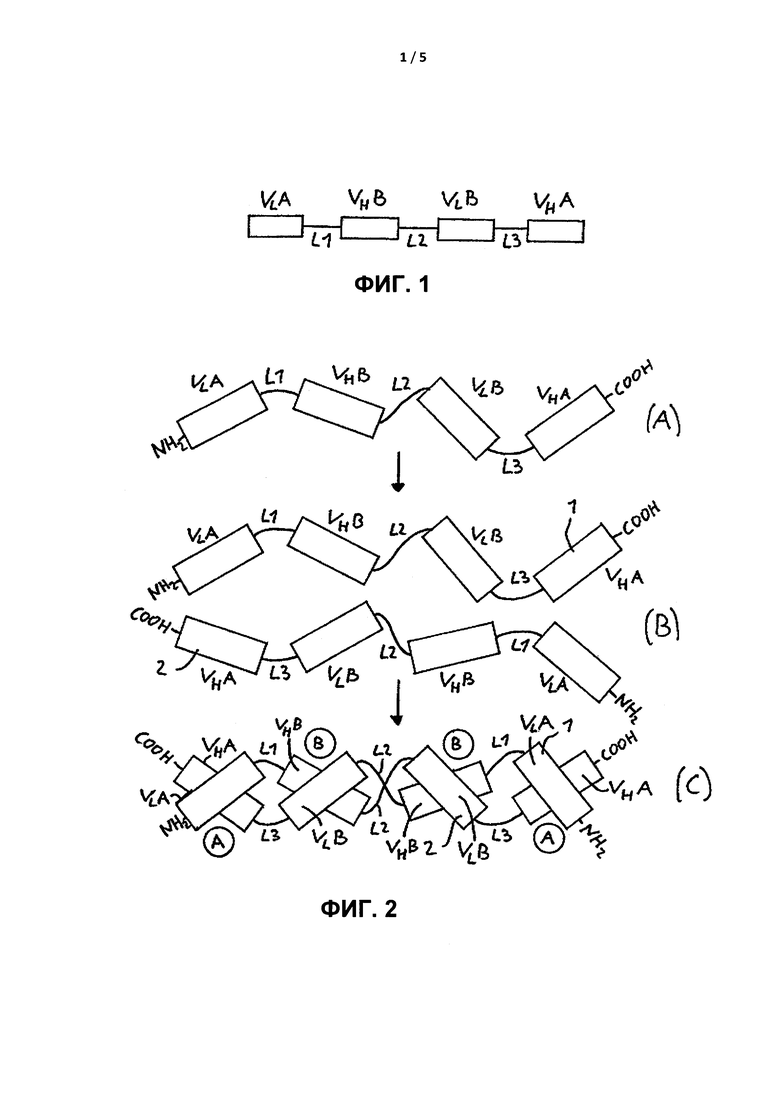


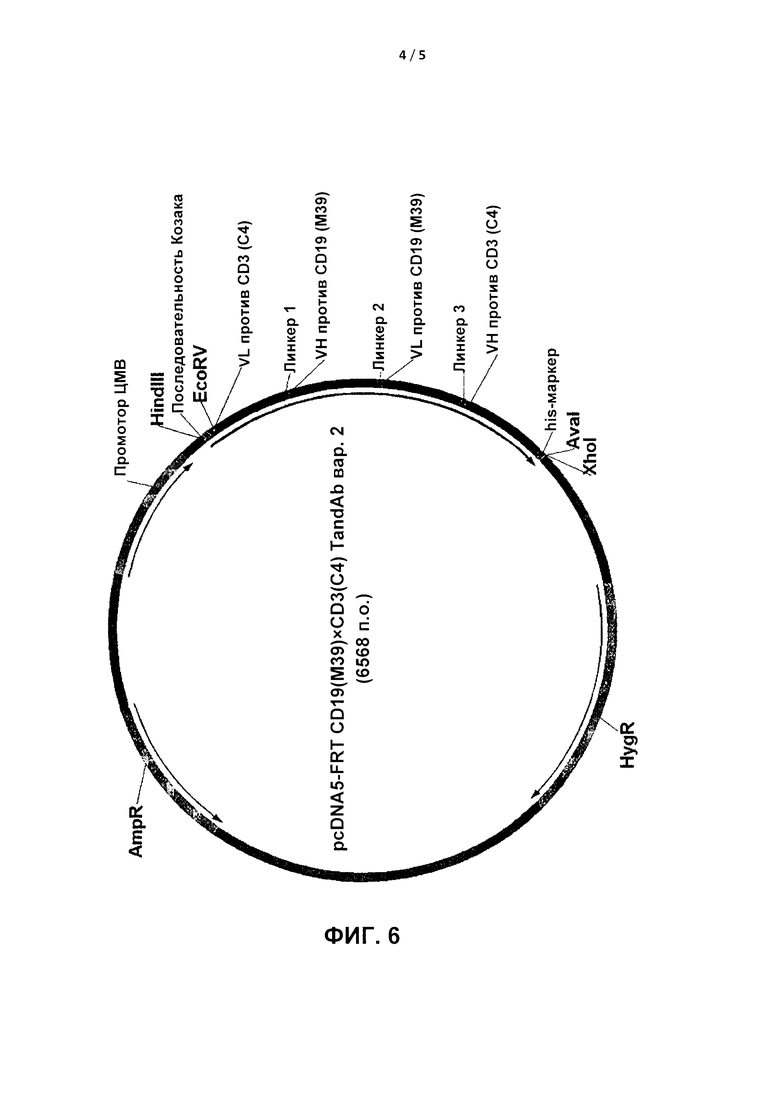
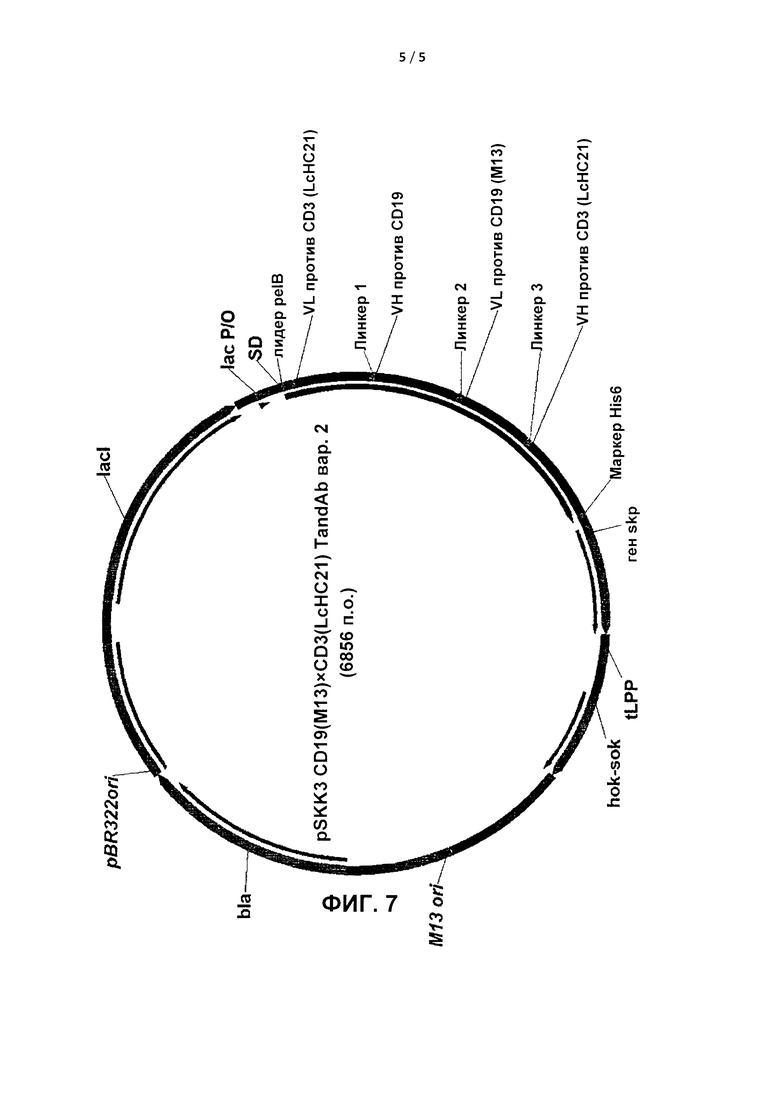
Настоящее изобретение относится к биохимии и иммунологии, в частности к димерной антиген-связывающей молекуле, которая перекрёстно связывается с антигеном А и антигеном В. Указанная молекула состоит из двух полипептидных цепей, каждая из которых содержит вариабельный домен лёгкой цепи, специфичный к антигену А (VLA), вариабельный домен тяжёлой цепи, специфичный к антигену В (VНВ), вариабельный домен лёгкой цепи, специфичный к антигену В (VLВ) и вариабельный домен тяжёлой цепи, специфичный к антигену А (VНA). Домены расположены в следующем порядке VLA – VНВ - VLВ – VНA. При этом VLA первой полипептидной цепи связан с VНA второй полипептидной цепи с образованием антиген-связывающего сайта для антигена А, VНВ первой полипептидной цепи связан с VLВ второй полипептидной цепи с образованием антиген-связывающего сайта для антигена В, VLВ первой полипептидной цепи связан с VНВ второй полипептидной цепи с образованием антиген-связывающего сайта для антигена В и VНA первой полипептидной цепи связан с VLA второй полипептидной цепи с образованием антиген-связывающего сайта для антигена А. Настоящее изобретение раскрывает композицию, предназначенную для лечения заболеваний, при которых экспрессируются антигены А и В и содержащую указанную антиген-связывающую молекулу. Настоящее изобретение благодаря именно такому расположению вариабельных доменов в антиген-связывающей молекуле VLA – VHB – VLB – VHA от N-конца к C-концу полипептида, делающему возможным перекрёстное связывание между антигенами А и В, позволяет улучшить эффективность связывания с целевыми антигенами. 2 н. и 13 з.п. ф-лы, 7 ил., 1 табл., 2 пр.
1. Димерная антиген-связывающая молекула тандемного диатела для перекрестного связывания с антигеном А и антигеном В, состоящая из первой и второй полипептидной цепи, причем каждая из указанных первой и второй полипептидных цепей содержит
- первый домен VLA, являющийся вариабельным доменом легкой цепи, специфичным по отношению к первому антигену А;
- второй домен VHB, являющийся вариабельным доменом тяжелой цепи, специфичным по отношению ко второму антигену В;
- третий домен VLB, являющийся вариабельным доменом легкой цепи, специфичным по отношению ко второму антигену В; и
- четвертый домен VHA, являющийся вариабельным доменом тяжелой цепи, специфичным по отношению к первому антигену А, причем
- указанные домены расположены в каждой из указанных первой и второй полипептидных цепей в порядке VLA-VHB-VLB-VHA от N-конца к С-концу указанных полипептидных цепей,
- первый домен VLA связан со вторым доменом VHB посредством первого линкера L1, второй домен VHB связан с третьим доменом VLB посредством второго линкера L2, и третий домен VLB связан с четвертым доменом VHA посредством третьего линкера L3;
- линкер L2 состоит из 12 или менее аминокислотных остатков;
и
- первый домен VLA первой полипептидной цепи связан с четвертым доменом VHA второй полипептидной цепи с образованием антиген-связывающего сайта для первого антигена А;
- второй домен VHB первой полипептидной цепи связан с третьим доменом VLB второй полипептидной цепи с образованием антиген-связывающего сайта для второго антигена В;
- третий домен VLB первой полипептидной цепи связан со вторым доменом VHB второй полипептидной цепи с образованием антиген-связывающего сайта для второго антигена В; и
- четвертый домен VHA первой полипептидной цепи связан с первым доменом VLA второй полипептидной цепи с образованием антиген-связывающего сайта для первого антигена А.
2. Антиген-связывающая молекула по п. 1, отличающаяся тем, что первая и вторая полипептидные цепи нековалентно связаны.
3. Антиген-связывающая молекула по п. 1 или 2, отличающаяся тем, что указанная антиген-связывающая молекула является четырехвалентной.
4. Антиген-связывающая молекула по п. 1, отличающаяся тем, что указанная антиген-связывающая молекула является биспецифичной, и первый антиген А или второй антиген В является альбумином.
5. Антиген-связывающая молекула по п. 1, отличающаяся тем, что указанная антиген-связывающая молекула является биспецифичной по отношению к (i) HSA и CD3, (ii) CD3 и CD19 или (iii) CD16 и CD19.
6. Антиген-связывающая молекула по п. 1, отличающаяся тем, что указанные домены являются доменами человека или гуманизированными доменами.
7. Антиген-связывающая молекула по п. 1, отличающаяся тем, что указанная антиген-связывающая молекула содержит по меньшей мере одну дополнительную функциональную единицу.
8. Антиген-связывающая молекула по п. 1, отличающаяся тем, что указанная антиген-связывающая молекула является специфичной по отношению к В-клетке, Т-клетке, естественному киллеру (NK-клетке), миелоидной клетке или фагоцитарной клетке.
9. Антиген-связывающая молекула по п. 8, отличающаяся тем, что указанная антиген-связывающая молекула является биспецифичной, причем указанная антиген-связывающая молекула дополнительно является специфичной к опухолевой клетке.
10. Антиген-связывающая молекула по п. 9, отличающаяся тем, что указанная биспецифичная антиген-связывающая молекула специфична по отношению к (а) антигену, присутствующему в опухолевой клетке, или (b) Т-клетке или NK-клетке.
11. Антиген-связывающая молекула по п. 1 для перекрестного связывания с антигеном А на поверхности клетки и антигеном В на поверхности другой клетки.
12. Антиген-связывающая молекула по п. 1, отличающаяся тем, что указанные линкеры L1 и L3 состоят из 12 или менее аминокислотных остатков.
13. Антиген-связывающая молекула по п. 12, отличающаяся тем, что указанные линкеры L1, L2 и L3 состоят из 3-10 аминокислотных остатков.
14. Композиция для лечения заболевания, при котором экспрессируются антиген А и антиген В, содержащая антиген-связывающую молекулу по любому из пп. 1-13 и фармацевтически приемлемый носитель.
15. Композиция по п. 14 для применения в качестве лекарственного средства.
| KIPRIYANOV S.M., et al., Bispecific tandem diabody for tumor therapy with improved antigen binding and pharmacokinetics, J Mol | |||
| Biol., 1999, No.293, pp.41-56, eps | |||
| abstract, fig.9, pp.49-50;EP 1500665 A1, 26.01.2005 | |||
| RU 2007138741 А, 27.05.2009 | |||
| ДЕЕВ С.М., и др., Современные технологии создания неприродных антител для клинического применения, Acta nature, 2009, No.1, с.32-50. |
Авторы
Даты
2017-03-16—Публикация
2011-07-22—Подача