Изобретение относится к медицине, а имеено к офтальмологии.
Опыт лечения глаукомы показывает, что медикаментозное и лазерное лечение глаукомы часто дают лишь временный эффект. Радикальным способом нормализации повышенного внутриглазного давления является хирургическое лечение, причем наиболее успешные результаты могут быть получены при лечении начальных стадий заболевания.
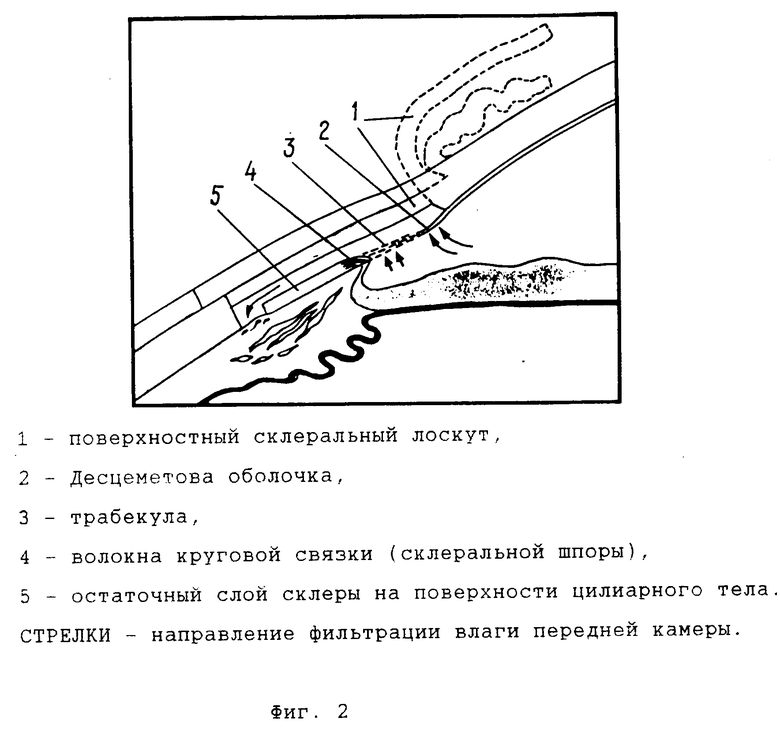
Главное требование к хирургии глаукомы максимальная безопасность при стойком гипотензивном эффекте. В наибольшей степени этим требованиям отвечает антиглаукоматозная операция нового типа непроникающая глубокая склерэктомия НГСЭ [1] Механизм ее действия основан на принципе операции глубокой склерэктомии, в результате которой обеспечивается отток влаги передней камеры (водянистой влаги, внутриглазной жидкости), минуя дренажную зону глаза, частично в супрахориоидальное пространство с последующим проникновением сквозь стенки капилляров цилиарного тела в кровеносное русло, а частично под конъюнктиву. При операции НГСЭ пути оттока те же. Однако передняя камера не вскрывается, а влага из нее проходит через сохраненный трабекулярный аппарат, проницаемость которого увеличивается при удалении наружной стенки Шлеммова канала и при обнажении Десцеметовой мембраны. Такой способ исключает возможность возникновения различных операционных и послеоперационных осложнений [1] (фиг. 1 и 2).
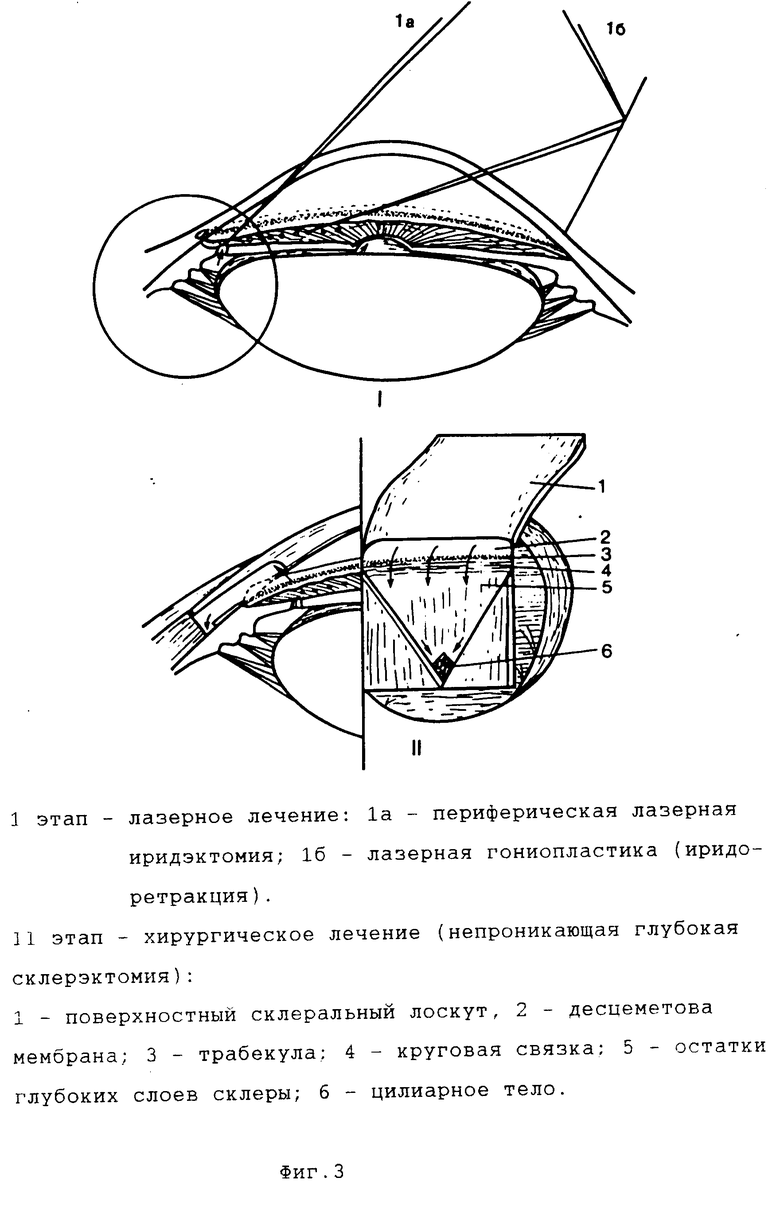
При выполнении данной операции анестезия и акинезия производятся традиционным способом. Конъюнктива отсепаровывается в верхнем сегменте в 5-6 мм от лимба. Лезвием выкраивается лоскут склеры квадратной формы 5х5 мм на половину толщины склеры основанием к лимбу. Лоскут отсепаровывается до роговичной части лимба на 1 мм в прозрачные слои роговицы. Этот этап выполняется фианитовым ножом-расслаивателем с круглой режущей кромкой. Из подлежащих слоев склеры выкраивается лоскут треугольной формы, основанием обращенный к лимбу. На отдельных участках склера иссекается до поверхности цилиарного тела (т.е. открывается супрахориоидальное пространство). Отсепаровку начинают с вершины треугольного лоскута и постепенно доходят до круговой связки. Далее алмазным ножом (треугольной формы) отсепаровывают глубокий склеральный лоскут от круговой связки вместе с наружной стенкой Шлеммова канала и полоской корнеосклеральной ткани. Толщина роговичной части составляет 0,5-0,8 мм, доходя до Десцеметовой мембраны. Последняя освобождается единым лимбально-склеральным лоскутом или отдельно от склеры. Если над трабекулой остается слой склеральной ткани, то в просвет Шлеммова канала вводится зонд, с помощью которого наружная стенка Шлеммова канала удаляется ирис-пинцетом и алмазным лезвием. Степень фильтрации оценивается с помощью фильтровальной бумаги. При недостаточной фильтрации снимается слой эндотелия с трабекулы. При удалении глубокого лимбально-склерального лоскута возможна микроперфорация трабекулы или Десцеметовой мембраны. В этом случае, как правило, радужная оболочка вставляется в перфорационное отверстие. Если при введении ацетилхолина в переднюю камеру через парацентез радужка не отходит от перфорационного отверстия, необходимо произвести периферическую иридэктомию или иридотомию. Поверхностный склеральный лоскут фиксируется к склере одним или двумя узловыми швами. На конъюнктиву накладывается непрерывный шов. Операция заканчивается субконъюнктивальной инъекцией кортикостероидов и антибиотика. При широком зрачке в конъюнктивальную полость закладывается 1% пилокарпиновая мазь [1]
Послеоперационный период после НГСЭ отличается благоприятным течением, не требует введения кортикостероидов под конъюнктиву и применения мидриатиков [1]
Отсутствие серьезных операционных и послеоперационных осложнений при НГСЭ способствовало ее широкому и успешному использованию, в том числе даже в амбулаторных условиях. Однако эта операция показана только при открытоугольной глаукоме. В 23% случаев [2] ухудшение оттока влаги передней камеры происходит не только в результате нарушения проницаемости трабекулярного аппарата, но и, как следствие, сужения угла передней камеры. В таких случаях диагностируется смешанная форма глаукомы.
Для использования преимуществ непроникающей операции в лечении смешанной глаукомы был предложен поэтапный лазерно-хирургический способ лечения смешанной глаукомы [3] При этом в качестве первого этапа производится расширение угла передней камеры путем выполнения ИАГ-лазерной иридэктомии в зоне предстоящей операции с возможным дополнением аргон-лазерной гониопластикой или иридопластикой. При достаточном расширении угла передней камеры через 2-3 недели после лазерного этапа производится второй этап лечения операция НГСЭ (фиг. 3).
В различные сроки после операции НГСЭ в 10-12% случаев [4] отмечается рецидив повышения офтальмотонуса, что связано с прогрессирующим ухудшением проницаемости трабекулы или Десцеметовой оболочки в послеоперационном периоде. Для нормализации давления производится десцеметогониопунктура в зоне операции, т. е. образование при помощи ИАГ-лазера микроперфораций кпереди от трабекулярной зоны на участке Десцеметовой оболочки, обнаженном в ходе операции. В результате гониопунктуры отток водянистой влаги восстанавливается. Отмечая значительную частоту рецидивов гипертензии после НГСЭ, ряд авторов предложил методику синустрабекулэктомии в два этапа, как новый способ лечения открытоугольной глаукомы, включающий выполнение НГСЭ с последующим (через 10-14 дней) вскрытием трабекулы с помощью ИАГ-лазера [5]
Целесообразность сочетания НГСЭ с различными лазерными методами лечения, на наш взгляд, обусловлена следующими соображениями.
1. Показания в НГСЭ ограничены открытоугольной формой глаукомы. Предварительное расширение угла передней камеры путем лазерной иридотомии (или иридэктомии) существенно расширяет показания, включая в них смешанную форму глаукомы и значительную часть случаев закрытоугольной глаукомы.
2. Гипотензивный эффект НГСЭ не во всех случаях достаточно продолжителен. Для восстановления оттока даже после успешной операции в ряде случаев необходима лазерная гониопунктура.
Таким образом, для достижения стойкого эффекта при непроникающем лечении различных форм глаукомы необходимо сочетание непроникающей операции с различными видами лазерного лечения: при недостаточно широком угле передней камеры необходима лазерная иридэктомия (даже, если узкий УПК не является существенной причиной повышения ВГД в конкретном случае и его расширение необходимо лишь для предотвращения блока зоны операции корнем радужки в послеоперационном периоде), при ухудшении оттока сквозь фильтрующую мембрану в послеоперационном периоде необходима лазерная гониопунктура.
Для того, чтобы обеспечить стойкий гипотензивный эффект при большинстве форм глаукомы, предлагается комбинированный лазерно-хирургический способ лечения глаукомы, включающий выполнение 3-х этапов: 1) лазерная иридэктомия, 2) непроникающая гипотензивная операция, 3) лазерная гониопунктура. При этом проведение всех трех этапов в каждом конкретном случае необязательно и проводится при наличии соответствующих показаний и/или при недостаточном эффекте предыдущего этапа. В соответствии с концепцией патогенетической поэтапной хирургии глаукомы недостаточный функциональный результат одного из этапов лечения должен рассматриваться не как неудачный исход, но как создание условий для следующего этапа лечения [6]
Методики лазерной иридэктомии и лазерной гониопунктуры отработаны, общеприняты и неоднократно описаны в литературе. В предлагаемом комбинированном способе лечения глаукомы эти методики используются без каких-либо изменений.
Центральное звено комбинированного лазерно-хирургического способа лечения глаукомы непроникающая гипотензивная операция, которая не только (и не столько) нормализует внутриглазное давление, но создает принципиально новую топографическую и гидродинамическую ситуацию в дренажной зоне глаза.
Новизна предлагаемого способа заключается в том, что лазерные методики используются в сочетании с новой непроникающей операцией, отличающейся от известной операции НГСЭ по области хирургического воздействия, по количеству и качественному составу удаляемых в ходе операции тканей, по степени гипотензивного эффекта и его продолжительности.
Преимущества описанных выше (и успешно применяемых) непроникающих методов лечения глаукомы очевидны. Принципиально новый, более высокий уровень безопасности, значительная эффективность, малая травматичность, существенная экономия материальных ресурсов и времени по всем важнейшим критериям непроникающая хирургия превосходит традиционные проникающие методы.
Вместе с тем, как и любая другая методика, НГСЭ и все способы лечения, основанные на принципе этой операции, не свободны от некоторых недостатков.
Как указывают авторы операции и их последователи, в ряде случаев (2-5% по данным К.Б. Першина [7] и 3,3% по данным С.Н. Федорова и др. [1]) в ходе НГСЭ возможна перфорация трабекулы или Десцеметовой оболочки. Перфорация, как правило, не приводит к серьезным последствиям, но делает операцию проникающей с соответствующим повышением вероятности более существенных осложнений. Так, гифемы и отслойки сосудистой оболочки после НГСЭ наблюдались почти исключительно в случаях, когда происходила перфорация трабекулы [1]
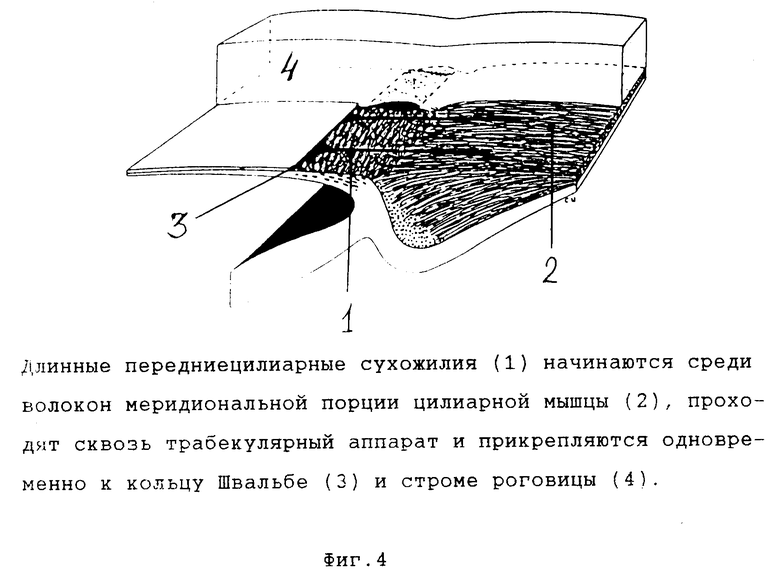
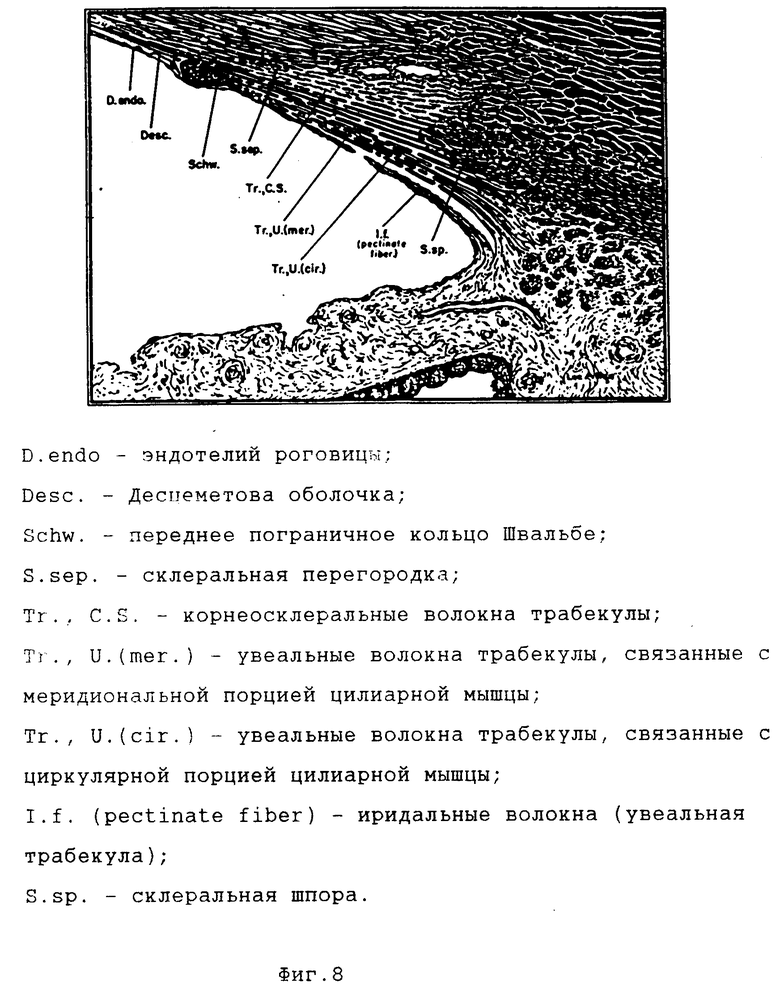
Причины возникновения перфораций и пути их предотвращения не были исследованы до настоящего времени. Помимо погрешностей в хирургической технике, когда перфорация возникает из-за неосторожного касания фильтрующей мембраны режущей кромкой лезвия или из-за случайного чрезмерного натяжения трабекулы, в ряде случаев перфорации происходят без видимой причины в ходе отделения лимбо-склерально-роговичного лоскута от фильтрующей мембраны. С учетом новых данных о строении дренажной зоны глаза и, в частности, трабекулярного аппарата можно предположить, что причиной перфорации в ряде случаев может быть наличие в трабекулярной ткани сухожилий цилиарной мышцы [8] Часть этих сухожилий (длинные передние цилиарные сухожилия) проходят от радиальной части цилиарной мышцы сквозь трабекулу, прикрепляясь к глубоким слоям роговицы над кольцом Швальбе. Эти волокна могут передавать на трабекулу перпендикулярные тракции, возникающие при оттягивании лимбально-роговичной ткани от трабекулы и Десцеметовой оболочки в ходе операции (фиг. 4).
Другая возможная причина перфорации наличие непрерывного перехода Десцеметовой оболочки в стекловидную пластинку трабекул [9] [10] Волокна корнеосклеральной трабекулы связаны с Десцеметовой оболочкой и глубокими пластинками роговицы. Таким образом, в пределах дренажной зоны глаза существует непосредственная связь между этими тканями, которые в пределах роговицы практически не соединены между собой. Дополнительные соединения между Десцеметовой мембраной и роговичной тканью могут недостаточно легко разрываться при отделении этих тканей друг от друга. Возникающие при этом локальные перпендикулярные тракции могут вызвать перфорацию Десцеметовой оболочки.
Как относительный недостаток операции НГСЭ, ограничивающий область ее применения, можно рассматривать различную степень снижения давления после операции при различных стадиях глаукомы. Операция наиболее эффективна в начальной и развитой стадиях глаукомы и значительно менее эффективна в случае ее проведения при далекозашедшей и терминальной стадиях [11]
Одна из негативных особенностей послеоперационного периода НГСЭ - вероятность повышения внутриглазного давления в различные сроки после операции, что связано с постепенным ухудшением проницаемости трабекулярной ткани. Наиболее вероятной причиной этого являются нарастающие патологические изменения ткани трабекулы, как следствие продолжающегося глаукомного процесса. Как известно, по мере прогрессирвания глаукомы патологические изменения постепенно распространяются из области Шлеммова канала на все слои трабекулы (снаружи кнутри) [12] Поэтому количество патологически измененной ткани (и, следовательно, сопротивление оттоку) в трабекуле, пораженной глаукомой, будет увеличиваться с течением времени. Таким образом, постепенное снижение гипотензивного эффекта НГСЭ зависит от стадии и скорости прогрессирования глаукомы и не может быть предотвращено какими-либо мероприятиями в ходе операции. Единственный известный нехирургический способ восстановления необходимого уровня фильтрации ИАГ-лазерная десцеметогониопунктура [4] Несмотря на применение в послеоперационном периоде лазерной гониопунктуры, в 6% случаев после проведенной НГСЭ приходится выполнять повторную операцию [13]
При разработке предлагаемого комбинированного лазерно-хирургического способа лечения глаукомы решается задача повышения эффективности основного (второго) этапа лечения непроникающей антиглаукоматозной операции за счет достижения максимальной фильтрации переднекамерной влаги через область операции в сосуды хориоидеи и конъюнктивы при сохранении непроникающего характера операции.
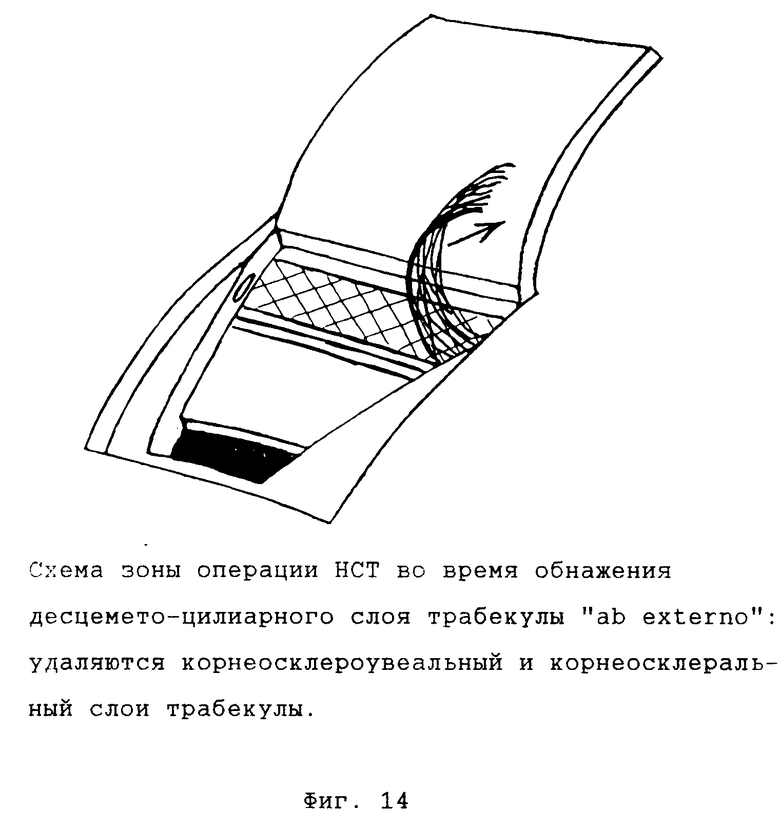
Решение задачи обеспечивается разработанным и многократно проверенным в клинических условиях способом непроникающей синустрабекулэктомиии, отличающейся тем, что на основном этапе операции после выделения фильтрующей мембраны, состоящей из трабекулярной ткани и прилежащей части Десцеметовой оболочки, снимают не только эндотелий с трабекулы, но и большую часть корнеосклеральной трабекулы: слои корнеосклеральных и увеально-меридиональных волокон до обнажения десцемето-цилиарного слоя (фиг. 5).
В течение последних трех лет в глаукомном отделении Самарской офтальмологической клинической больницы имени Т.И. Ерошевского было произведено более 150 операций непроникающей синустрабекулэктомии в сочетании (по показаниям) с лазерной иридэктомией и лазерной гониопунктурой при открытоугольной и смешанной формах глаукомы. Проанализированы непосредственные результаты 112 операций и отдаленные результаты 52 операций в сроки от 6 мес до 2 лет.
Из 112 пациентов у 62 была диагностирована II (развитая) стадия глаукомы, у 48 III (далекозашедшая); по 1 пациенту имели I(начальную) и IV(терминальную) стадии глаукомы. Внутриглазное давление (ВГД) до операции на фоне медикаментозного лечения было компенсировано у 4 пациентов, субкомпенсировано у 41, декомпенсировано у 67.
В тех случаях, когда угол передней камеры (УПК) был сужен (I-III степени раскрытия УПК), до операции производили ИАГ-лазерную иридэктомию на отечественном офтальмологическом лазерном перфораторе "Ятаган-4".
Второй хирургический этап лечения проводили по оригинальной методике непроникающей синустрабекулэктомии, отличающейся от НГСЭ тем, что в ходе основного этапа операции обнажается десцемето-цилиарный слой трабекулы, обладающий значительно большей проницаемостью, чем вся трабекула в целом (или трабекула после удаления с нее слоя эндотелия). Из интраоперационных осложнений были отмечены только 4 микроперфорации трабекулы (на этапе освоения техники операции), не приведшие к выпадению радужки и не вызвавшие необходимости проведения иридэктомии. В раннем послеоперационном периоде были отмечены 3 отслойки сосудистой оболочки (ОСО), купированные медикаментозно, и одна, потребовавшая проведения задней склерэктомии. Расширение супрахориоидального пространства (до 1-1,5 мм по данным ультразвукового В-сканирования) было отмечено у 9 пациентов. Это расширение не сопровождалось гипотонией и симптомом мелкой передней камеры, не имело офтальмоскопических признаков ОСО и поэтому было расценено как закономерное расширение супраувеальной щели в результате активной фильтрации водянистой влаги. В раннем послеоперационном периоде также были отмечены незначительный диастаз конъюнктивального шва 2, тромбоз ЦВС -1, тяжелый эндогенный задний увеит - 1. Все эти осложнения были ликвидированы соответствующими мероприятиями. Нормализация ВГД в ранние сроки после операции была достигнута во всех 112 случаях (100%), из них в двух в итоге лазерной гониопунктуры в ближайшие дни после операции. Отдаленные результаты в сроки от 6 мес до 2 лет прослежены у 52 пациентов (I стадия глаукомы 1, II 33, III 18). Осложнения в позднем послеоперационном периоде: тромбоз ЦВС 1, прогрессирование катаракты 1. Проведение третьего этапа комбинированного лечения глаукомы (лазерной гониопунктуры) потребовалось в 28 случаях, прошло без осложнений, ВГД было нормализовано преимущественно без применения гипотензивных медикаментов. В 6 случаях потребовалось введение цитостатического препарата для уменьшения послеоперационного рубцевания. Повторная операция (также непроникающая) была проведена у 1 пациента по поводу избыточного рубцевания в зоне операции. В результате комплексного лечения глаукома была стабилизирована у 49 пациентов и нестабилизирована у 3 (из 52, наблюдавшихся в отдаленном периоде).
Предлагаемый комбинированный лазерно-хирургический способ лечения глаукомы является попыткой усовершенствования широко применяемых и эффективных способов: синустрабекулэктомии в два этапа при открытоугольной глаукоме [5] и поэтапного лазерно-хирургического способа лечения смешанной глаукомы [3] основанных на концептуальной операции непроникающей глубокой склерэктомии [1] При этом усовершенствование касается именно данной операции как основного этапа упомянутых комбинированных методов лечения глаукомы.
Возможность нового подхода к непроникающей хирургии глаукомы вытекает из анализа архитектоники дренажной зоны глаза на основе оригинальной концепции строения угла передней камеры глаза [14] недостаточно отраженной в отечественной литературе, а также анализа данных эмбриогенеза глаза, имеющих непосредственное отношение к строению трабекулярного аппарата.
Большинство известных антиглаукоматозных операций направлено на образование отверстия в фиброзной оболочке глаза для создания нового пути оттока внутриглазной жидкости взамен нефункционирующих естественных путей. Происходит своего рода шунтирование цикруляторных путей водянистой влаги глаза с субконъюнктивальным пространством. Различие методов хирургического лечения глаукомы заключается, как правило, лишь в том, какое и где создается отверстие (фистула). В подавляющем большинстве случаев в ходе фистулизирующих операций необходимо выполнение иридэктомии (иссечение небольшого участка радужной оболочки на крайней ее периферии) в непосредственной близости от фистулы, чтобы предотвратить блокирование последней корнем радужки. Для такого рода операций (фистулизирующих или с "элементом фистулизации") характерны существенные недостатки и в первую очередь грубое нарушение гидродинамики глаза, образование значительного объема "застойной" влаги передней камеры, так как жидкость из задней камеры глаза, где она образуется, поступает сразу в подконъюнктивальное пространство вместо того, чтобы (как в норме) питать и очищать структуры переднего отрезка глаза. Нарушается питание трабекулярного аппарата, роговицы и хрусталика, появляется или значительно усиливается помутнение хрусталика, увеличивается риск значительного повышения внутриглазного давления в послеоперационном периоде. Фистулизирующие операции опасны также и риском чрезмерного снижения внутриглазного давления. Такая гипотония может привести к внутриглазным кровотечениям, развитию макулярной дистрофии, преретинального фиброза и даже атрофии глазного яблока. Резкое снижение внутриглазного давления в ходе операции опасно развитием тяжелых интраоперационных осложнений, могущих привести к потере зрения и даже всего глаза [15]
Для устранения указанных недостатков фистулизирующих операций была предложена непроникающая глубокая склерэктомия (НГСЭ), которая почти полностью исключает возможность осложнений как интраоперационных, так и послеоперационных. Механизм действия НГСЭ основан, как указывают авторы, на фильтрации водянистой влаги сквозь сохраненный в зоне операции трабекулярный аппарат, проницаемость которого увеличивается при удалении наружной стенки Шлеммова канала и при обнажении Десцеметовой мембраны с последующим оттоком жидкости в капилляры цилиарного тела, в супрахориоидальное пространство и под конъюнктиву [1]
Усилению фильтрации водянистой влаги после НГСЭ способствует ряд специфических изменений в строении дренажной зоны, достигаемых последовательно в ходе операции:
1) удаление наружной стенки Шлеммова канала устраняет функциональный блок склерального синуса наиболее раннее звено в патогенезе открытоугольной глаукомы [16]
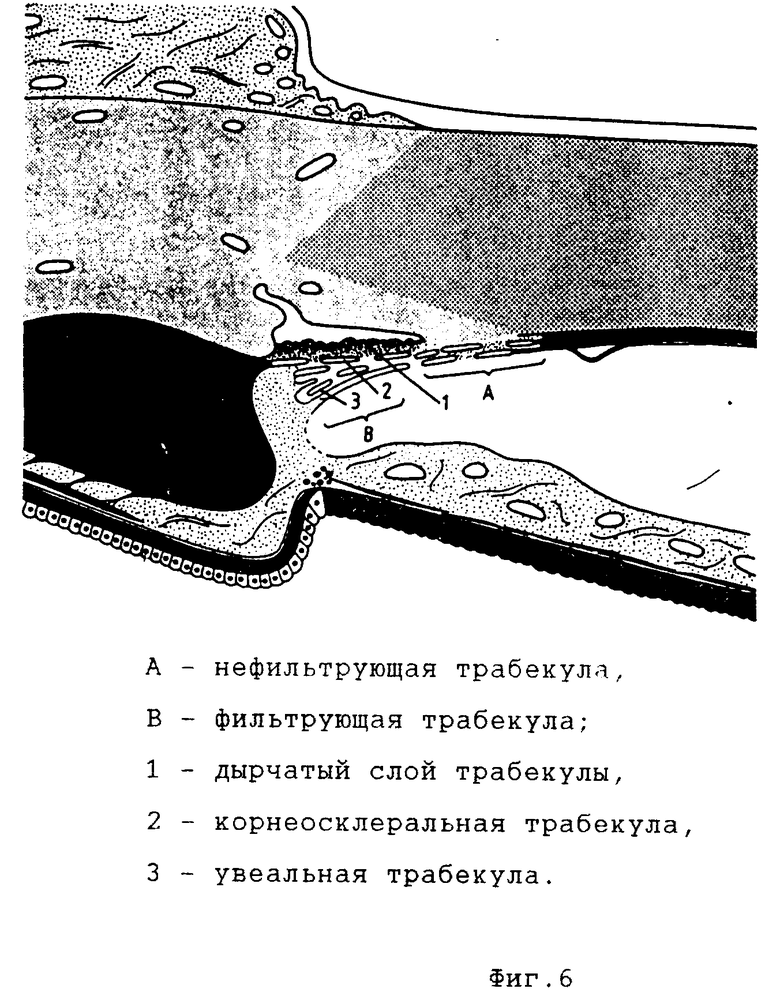
2) удаление глубоких слоев лимбальной ткани над участком трабекулы, лежащим между внутренней стенкой Шлеммова канала и Десцеметовой оболочкой, открывает дополнительную фильтрующую поверхность. В норме сквозь этот участок фильтрация влаги не происходит "нефильтрующая часть трабекулы" [8] (фиг. 6);
3) освобождение участка Десцеметовой оболочки от вышележащей роговичной ткани также увеличивает площадь фильтрующей мембраны (по мнению авторов операции Десцеметова оболочка достаточно проницаема для водянистой влаги и обеспечивает основной объем фильтрации после НГСЭ) [17]
4) если все эти факторы все же не обеспечивают достаточной фильтрации, то с трабекулы снимается слой эндотелия, что дополнительно повышает проницаемость внутренней стенки Шлеммова канала [1] [17] Под термином "снятие слоя эндотелия" с трабекулы может пониматься только удаление эндотелия Шлеммова канала (что крайне маловероятно из-за его чрезвычайной тонкости и непрочности) или удаление юкстаканаликулярного слоя трабекулы особого образования дренажной зоны глаза, которое обеспечивает основное сопротивление оттоку влаги в здоровом глазу и в значительно большей степени при глаукоме. Этот слой описывается различными терминами, в том числе: "эндотелий трабекулы", "эндотелиальная сеть", "эндотелиальная часть (слой) трабекулы", "дырчатый слой" или "юкстаканаликулярный слой". Морфологическая специфичность, его принципиальное отличие от остальных отделов трабекулы состоит в том, что он не разделен на слои и состоит из решеткообразного сплетения коллагеновых и зластикоподобных волокон, заключенных в гомогенное межклеточное вещество, содержащее фибробластоподобные клетки. Толщина этого слоя 5-20 мкм, со стороны склерального синуса он покрыт слоем эндотелия Шлеммова канала [6] [8] [12] [15] Таким образом, с точки зрения морфологии, "снятие эндотелия с трабекулы" может означать только удаление юкстаканаликулярной ткани вместе с эндотелием Шлеммова канала.
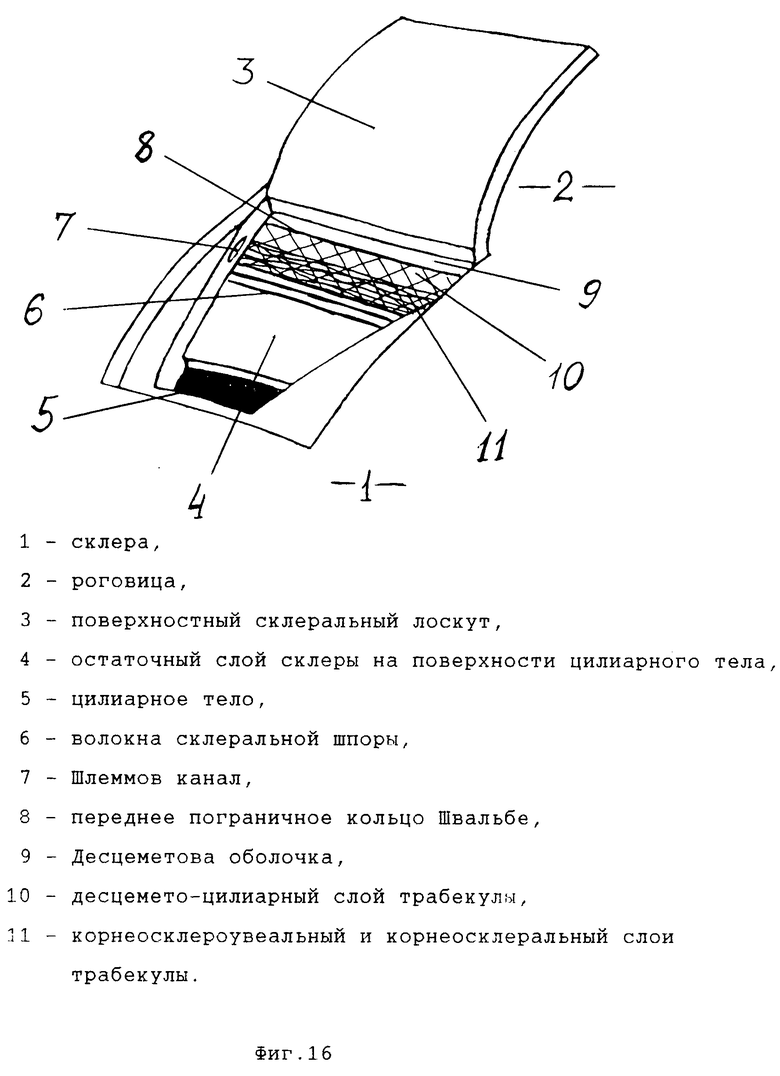
В результате НГСЭ на пути оттока водянистой влаги остается тонкая фильтрующая мембрана, состоящая из участка (1) внутренней стенки Шлеммова канала, участка (2) периферии Десцеметовой оболочки и участка (3) ранее функционально неактивной трабекулы, находящегося между (1) и )2) (фиг. 2 и 6). Все эти части представляют собой полупроницаемые мембраны, суммарная пропускная способность которых определяет уровень оттока внутриглазной жидкости после операции. Проницаемость для влаги частей (2) и (3) при глаукоме почти не уменьшается. Первая же часть состоит из структур, подвергающихся при глаукоме значительным изменениям.
Внутренняя стенка Шлемова канала состоит в основном из пластиковых корнеосклеральной и увеальной трабекул. Со стороны склерального синуса на них лежит слой юкстаканаликулярной ткани (эндотелий трабекулы) и эндотелий Шлеммова канала. В настоящее время считается, что начальные изменения тканей дренажной зоны глаза при глаукоме происходят именно в юкстаканаликулярной ткани, а затем распространяются на близлежащие структуры [12] Если в каком-то конкретном случае глаукомы максимальное сопротивление оттоку локализуется в юкстаканаликулярном слое, то его удаление значительно усилит фильтрацию жидкости сквозь оставшиеся слои трабекулярного аппарата. Следовательно, эффективность НГСЭ будет максимальной именно при начальной глаукоме, когда большая часть тканей дренажной зоны глаза еще относительно сохранна, что было подтверждено клинически [1] [11]
С целью повышения эффективности непроникающих антиглаукоматозных операций для достижения максимальной фильтрации при сохранении непроникающего характера операции предлагается операция "непроникающая синустрабекулэктомия" (НСТ), отличающаяся тем, что на основном этапе операции после выделения фильтрующей мембраны, состоящей из трабекулярной ткани и прилежащей части Десцеметовой оболочки, с этой фильтрующей мембраны снимается не только эндотелий трабекулы, но и большая часть корнеосклеральной трабекулы: слои корнеосклеральных и увеально-меридиональных волокон [14] Выделенная таким образом новая, значительно более тонкая фильтрующая мембрана состоит в своей трабекулярной части из увеально-радиального слоя корнеосклеральной трабекулы и увеальной трабекулы, непрерывно продолжающихся по направлению к центру передней камеры в кольцо Швальбе и Десцеметову мембрану.
Возможность именно такого расслоения трабекулы вытекает из концепции Allen, Burian и Bradley (1955) [14] и подтверждается проведенными нами гистологическими исследованиями на аутопсированных трупных глазах, которые были подвержены препаровке на основе принципов НГСЭ с последующим приготовлением плоскостных гистологических препаратов различных слоев трабекулы (с окраской гематоксилин-эозином, по Ваг-Гизону, по Вейгерту).
Традиционно трабекула разделяется на две части согласно описанию М. Зальцмана [9] (фиг. 7): основную часть корнеосклеральную и значительно более тонкую увеальную. Эти части разделяются на препарате сосудистой оболочки (отделенном от склеры и сохранившем на себе элементы дренажной зоны) путем отрывания радужки от цилиарного тела: корнеосклеральная трабекула остается в связи с цилиарным телом, увеальная с радужкой. Увеальная трабекула тонкий (толщиной в 1-2 клетки) слой в виде крупноячеистой сети, выстилающей угол передней камеры; ячейки этой сети вытянуты в меридиональном направлении, она начинается из поверхностных слоев радужки и прикрепляется к корнеосклеральной трабекуле и кольцу Швальбе. Корнеосклеральная трабекула многослойная структура из параллельных окончатых пластин и связывающих их перекладин, переходящая кпереди в Десцеметову мембрану и глубокие слои роговицы, а кзади
в склеральную шпору и цилиарное тело. Отверстия в пластинах вытянуты в циркулярном направлении, в соседних пластинах расположение отверстий не совпадает, размеры отверстий уменьшаются по направлению от передней камеры к склеральному синусу. Ряд авторов выделяют также эндотелиальную часть трабекулы как ее самостоятельный слой наряду со склеральным и увеальным [6]
Согласно данным исследованиям Allen, Burian и Bradley [14] в корнеосклеральной трабекуле выделяются три типа волокон: 1) корнеосклеральные натянутые между глубокими пластинами роговицы и склеральной тканью под и частично над Шлеммовым каналом; 2) увеальные (поверхностные), связанные с волокнами меридиональной порции цилиарной мышцы, склеральной шпорой и глубокими слоями роговицы, а также частично с Десцеметовой мембраной; 3) увеальные (глубокие), связанные с радиальными и циркулярными пучками цилиарной мышцы и прикрепляющиеся исключительно к Десцеметовой мембране (фиг. 8).
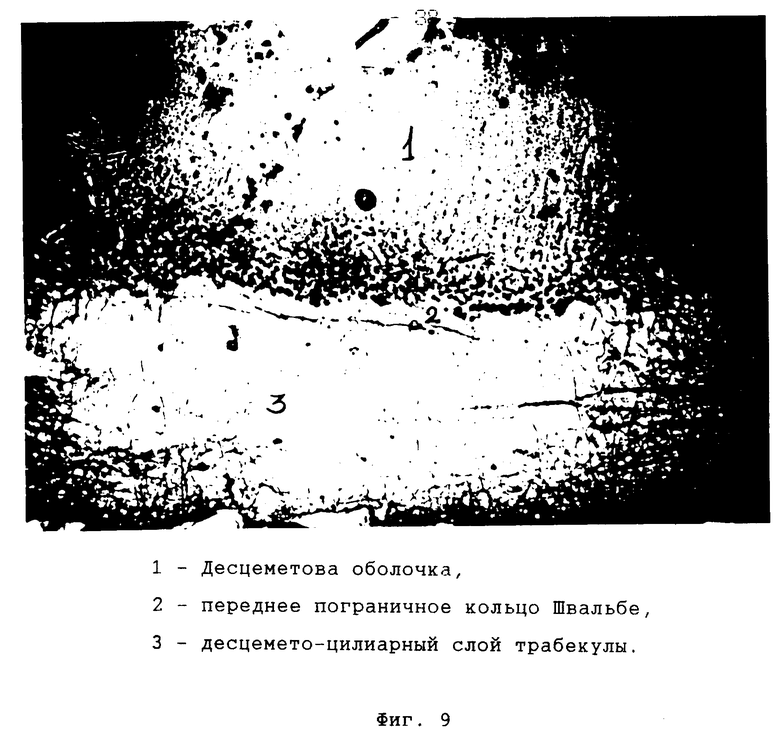
При изучении наших препаратов было обнаружено, что после удаления наружных слоев трабекулы пинцетом (что достигается относительно легко из-за циркулярного расположения волокон в них) четко выделяется слой трабекулярной ткани, соединяющий цилиарное тело и Десцеметову оболочку, причем волокна этого слоя непрерывно переходят со стороны роговицы в кольцо Швальбе, а со стороны склеры в цилиарную мышцу (фиг. 9). Этот слой не связан с другими образованиями дренажной зоны и может поэтому называться десцемето-цилиарным слоем. От лежащих снаружи остальных слоев корнеосклеральной трабекулы этот слой резко отличается по своей архитектонике и механическим свойствам. Из-за равномерной разнонаправленности волокон (фиг. 10) рассматриваемый слой легко противостоит растягивающим усилиям в различных направлениях, в то время как остальные, наружные слои трабекулы включают в себя почти параллельные волокна, располагающиеся циркулярно вдоль Шлеммова канала (фиг. 11), и легко отделяются от остальных тканей при поперечных тракциях. Со стороны передней камеры десцемето- цилиарный слой выстилает тонкая сетчатая редкоячеистая структура, связанная с кольцом Швальбе и корнем радужки. Эта сеточка отделяется от десцемето-цилиарного слоя при отрывании радужки от цилиарного тела, оставаясь прикрепленной к первой, что точно соответствует увеальной трабекуле в трактовке Зальцмана (фиг. 12).
Таким образом, десцемето-цилиарный слой полностью аналогичен глубокому увеальному слою корнеосклеральной трабекулы в трактовке Allen, Burian и Bradley (1955) [14]
Возвращаясь к непроникающим операциям, мы можем констатировать, что при непроникающей синустрабекулэктомии на пути оттока внутриглазной жидкости остается мембрана, состоящая из Десцеметовой оболочки и переходящего в нее десцемето-цилиарного слоя. Так как размеры отверстий в трабекулярных пластинах уменьшаются по направлению от передней камеры к Шлеммову каналу [18] то наибольшие отверстия находятся именно в десцемето-цилиарном слое, что вместе с его тонкостью (3-6 слоев пластин [14]) обеспечивает более высокую фильтрующую способность диафрагмы, образуемой в ходе предложенной нами операции по сравнению с ее прототипом НГСЭ.
Точка приложения хирургического воздействия при НСТ принципиально отлична от таковой при НГСЭ не только в силу биомеханической и морфологической разнородности вышеперечисленных слоев трабекулы, но, в первую очередь, из-за перемещения воздействия с корнеосклеральных структур на увеальные, что вытекает из анализа эмбрионального развития глаза и, в особенности, структур дренажной зоны.
Развитие и дифференцировка мезенхимы (зародышевой соединительной ткани), окружающей глазной бокал, происходит неравномерно. Дифференцировке подвергаются сначала только мезенхимальные клетки, прилежащие к наружному листку глазного бокала. Так, вначале вокруг последнего формируется слой капилляров (зачаток сосудистой оболочки) и только после этого зачаток склеры. Подобным же образом дифференцируется первичная роговица, т. е. пласт мезодермы, врастающий между эктодермой и хрусталиковым пузырьком. Этот пласт делится на два слоя: наружный зачаток стромы роговицы и внутренний - сосудистый (lamina irido-pupillaris), причем границей между ними служит слой правильно расположенных клеток (зачаток эндотелия) и этот слой заканчивается по направлению к краю глазного бокала скоплением точно таких же клеток - зачатком трабекулярного аппарата [9]
Более поздние эмбриологические исследования многих авторов показали, что эндотелий роговицы развивается независимо от стромы из особой группы клеток.
Rones описал врастание мезодермы и ее преобразование в монослой клеток на внутренней стороне эпителия у 7мм-ого эмбриона [19]
Thomas, цитируя Seefelder и Gluckmann, утверждает, что первый мезодермальный элемент роговицы эндотелий и он независим от клеток стромы. Эндотелий появляется под эпителием как компактный слой, а клетки стромы врастают в виде клина между эпителием и эндотелием [20]
Laguess описывает первичную роговицу, состоящую из 3 слоев: 1) поверхностной эктодермы (будущий эпителий роговицы); 2) бесклеточного фибриллярного слоя мезостромы, замещаемого впоследствии роговичными пластинками; 3) прорастающих мезодермальных клеток, которые впоследствии сформируют эндотелий [21]
Карлсон [22] отмечает, что эндотелий образуется путем миграции мезенхимальных клеток, связанных с сосудами, лежащими у края глазного бокала (предшественниками сосудистой оболочки глаза).
Редслоб считает, что эндотелий не результат дифференцировки клеток-предшественников стромы роговицы, а результат независимой миграции клеток той группы, из которой образуется впоследствии мышца Брюкке (меридиональная часть цилиарной мышцы), причем миграция эта происходит раньше, чем инвазия первичной бесклеточной подэпителиальной субстанции клетками роговицы [23]
В отличие от эндотелия роговицы элементы фиброзной капсулы глаза (строма роговицы и склера) формируются значительно позже путем конденсации клеток рыхлой мезенхимы, окружающей зачаток глазного яблока, причем склера начинает формироваться (по крайней мере в области лимба) в мезенхиме над уже достаточно четко видимой хориоидеей [20] Таким образом, эндотелий роговицы, цилиарная мышца и хориоидея происходят из одной группы мезенхимальных клеток, а строма роговицы и склера из другой.
В настоящее время считается установленным, что Десцеметова оболочка - продукт эндотелия, его кутикулярная мембрана. Особенно иллюстративен тот факт, что Десцеметова мембрана находится между роговичным эндотелием и его базальной мембраной [20]
Более поздние исследования показали, что клетки, образующие цилиарное тело, радужку, часть клеток роговицы и все клетки эндотелия роговицы имеют общий эмбриологический источник, а именно нейроэктодерму нервного гребня. Клетки нервного гребня вначале мигрируют в виде монослоя под эпителий зачатка роговицы, после чего появляются в строме роговицы (мигрируя не из эндотелия, а из окружающей эктомезенхимы), в зачатке радужки и в зоне угла передней камеры, которая даст позже начало трабекуле и цилиарному телу. На определенных, более поздних стадиях эмбриогенеза формируется единый слой клеток, покрывающий заднюю поверхность роговицы и непрерывно переходящий на трабекулярную область и поверхность радужки. Этот слой теряет свою непрерывность в области дренажной зоны только на стадии 7-8 мес внутриутробного развития человека [24] Нейроэктодермальная природа клеток эндотелия роговицы и, частично, задних ее слоев показана Tripathi [25] Есть данные об общности эмбрионального происхождения эпителия и эндотелия роговицы [26]
С другой стороны, родственность эндотелия роговицы с тканью трабекулы и цилиарного тела подтверждается исследованиями по локализации простагландиновых рецепторов (PG E2) в тканях глаза. Расположение этих рецепторов в трабекуле, в цилиарной мышце, в эндотелии роговицы и в эпителии хрусталика одинаково, существенно отличаясь от такового в остальных тканях глаза, в том числе и непосредственно прилежащих к указанным. [27]
Приведенные данные полностью подтверждают точку зрения Э.Фукса, высказанную им в еще 1910 году о том, что согласно истории эмбрионального развития трабекулярный аппарат и Десцеметова оболочка принадлежат uvea (сосудистой оболочке глаза), "которая представляет собой в зародышевой жизни совершенно замкнутый полый шар, состоящий из сосудистой оболочки, цилиарного тела, радужки, lig. pectinatum (трабекулы) и membrana Descsmeti" [28]
Суммируя вышеизложенное, логично заключить, что Десцеметова оболочка эмбриологически, морфологически и механически родственна сосудистой оболочке глаза, а с роговицей связана лишь общим расположением. Десцеметова оболочка, эндотелий роговицы и цилиарное тело части uvea (сосудистой оболочки глаза). Следовательно, структура, морфологически связанная только с Десцеметовой оболочкой и цилиарным телом, есть увеальная структура. Рассматривая в этом ключе строение дренажной зоны глаза, можно считать, что десцемето-цилиарный слой трабекулы не часть корнеосклеральной трабекулы, а один из слоев увеальной ее части.
Таким образом, формируемая в ходе новой операции НСТ фильтрующая мембрана состоит исключительно из увеальных элементов (производных сосудистой оболочки глаза), что, возможно, обусловливает особенно патогенетический характер этой операции, так как увеальные и корнеосклеральные ткани по-разному реагируют на внешние воздействия и, возможно, на патологические изменения при глаукоме.
Из вышеизложенного вытекает целесообразность нового разделения трабекулярной ткани на слои: юкстаканаликулярная ткань (соответственно общепринятой трактовке); корнеосклеральная трабекула (волокна натянуты между роговицей и склерой); корнео-склеро-увеальная (волокна проходят из роговицы через склеральную шпору, частично вплетаясь в нее, и переходят в соединительную ткань цилиарного тела); увеальная, состоящая из двух слоев: десцемето-цилиарного (волокна начинаются в кольце Швальбе и переходят в соединительную ткань цилиарного тела) и десцемето-иридального (волокна начинаются в кольце Швальбе и переходят в соединительную ткань радужной оболочки). Из указанных слоев корнеосклеральная трабекула (вместе с юкстаканаликулярным слоем) производные исключительно фиброзной капсулы глаза, увеальная (состоящая из двух слоев) дериват сосудистой оболочки, в пределах корнео-склеро-увеального слоя ткани увеального и корнеосклерального происхождения переплетаются, обеспечивая механическое соединение сосудистой оболочки и фиброзной капсулы глаза. Такое разделение трабекулярного аппарата на слои не только позволяет разрабатывать новые подходы к хирургическому лечению различных форм глаукомы, но и по-новому рассматривать вопросы патогенеза этого заболевания.
Выполнимость предложенного способа может быть проиллюстрирована описанной ниже технологией непроникающей синустрабекулэктомии.
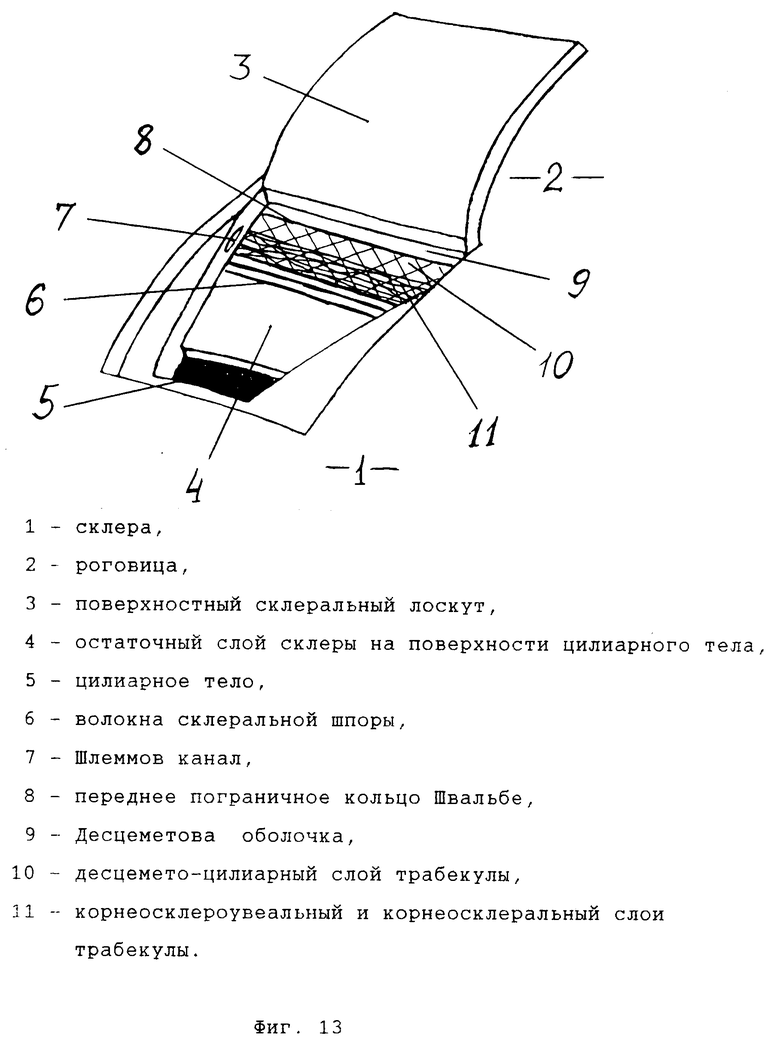
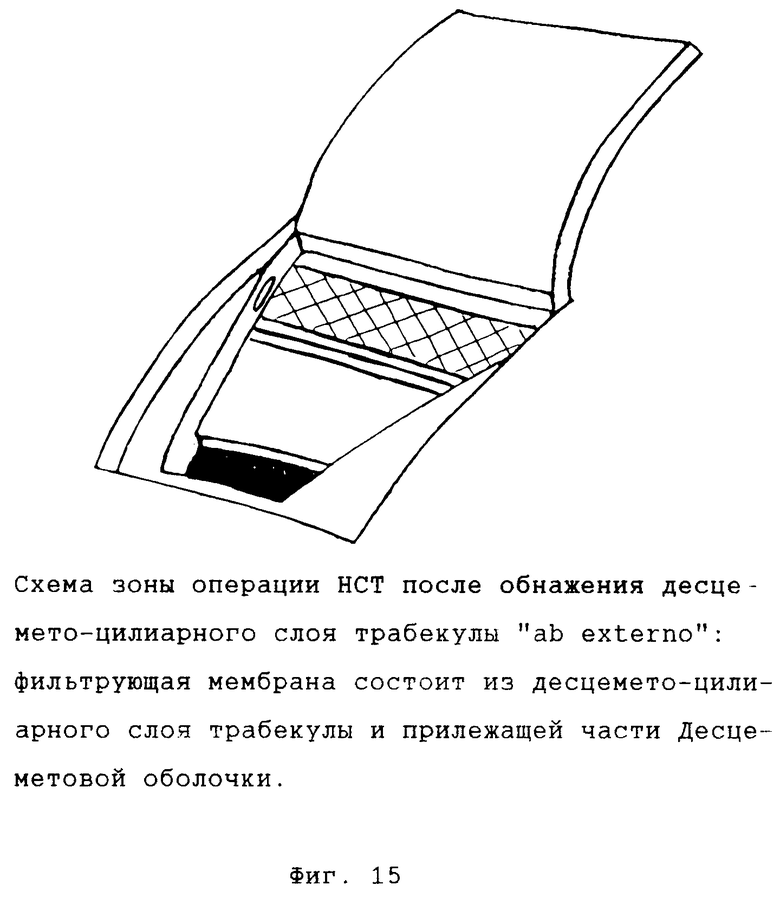
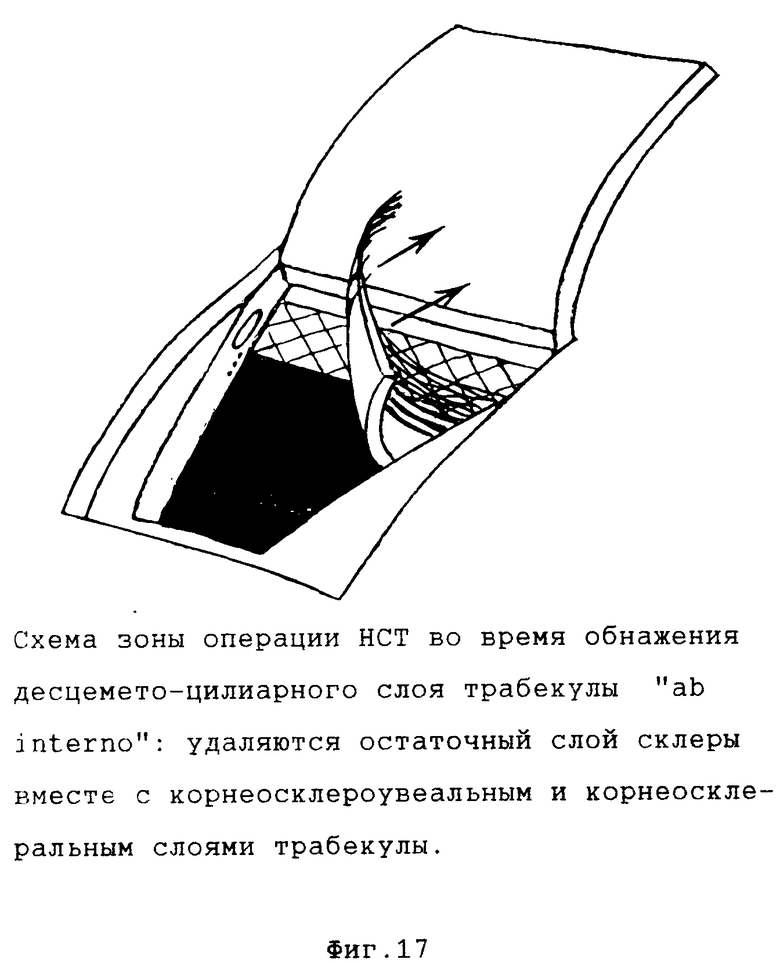
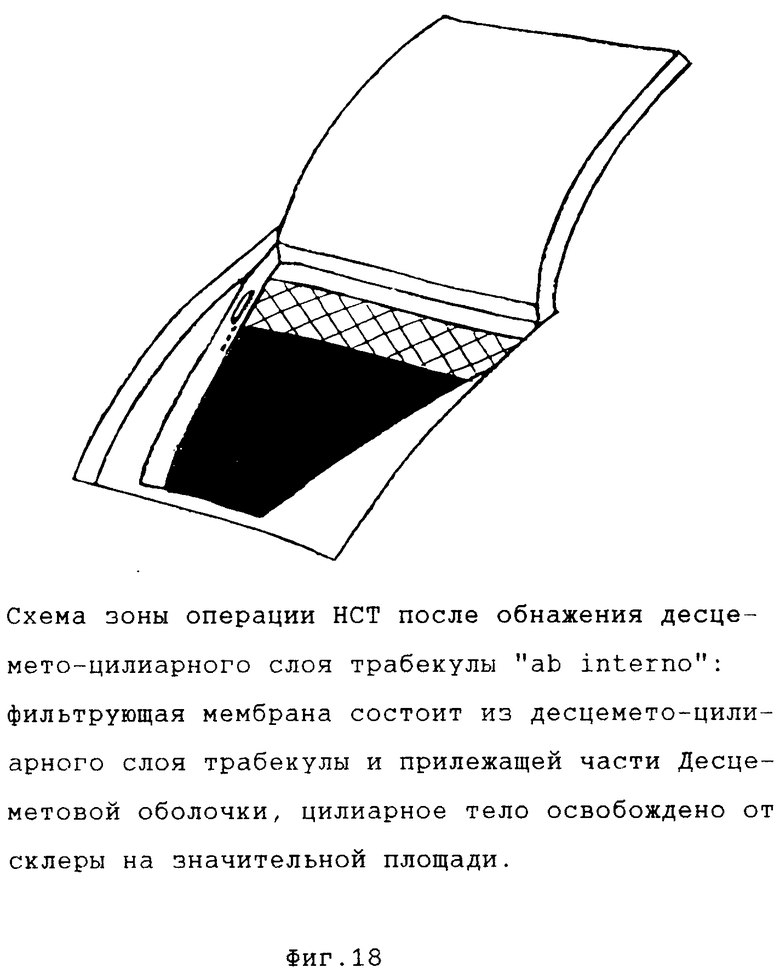
Возможны два варианта выполнения этой операции, отличающиеся по способу обнажения десцемето-цилиарного слоя: "ab externo" и "ab interno" ("снаружи" и "изнутри" соответственно) (фиг. 13 18).
Приемлем любой известный хирургический доступ к перилимбальной зоне склеры и лимбу. После открытия операционного поля на склере выкраивается поверхностный склеральный лоскут основанием в роговице с вхождением в строму роговицы до 1-1,5 мм. На открывшемся склеральном ложе из средних слоев склеры выкраивается глубокий склеральный лоскут и отсепаровывается от наиболее глубокого, лежащего на цилиарном теле слоя склеры в направлении дренажной зоны до появления волокон склеральной шпоры ("круговой связки" по терминологии, употребляемой в [1]), отличающихся циркулярным направлением и характерным "перламутровым" блеском. Вскрывается просвет Шлеммова канала. Образовавшийся лоскут ножом-расслаивателем с круглой режущей кромкой отсепаровывается от трабекулы и Десцеметовой мембраны с обязательным выделением и рассечением волокон, соединяющих последнюю с роговицей. После этого лоскут отсекается от окружающих тканей лимба и роговицы.
На основном этапе операции после удаления глубокого склеро-лимбально-роговичного лоскута и обнажения фильтрующей мембраны с последней (а точнее с ее участка, образованного стенкой Шлеммова канала) при помощи тонкого ирис-пинцета снимается слой трабекулярной ткани с циркулярным ходом волокон до обнажения десцемето-цилиарного слоя, непрерывно продолжающегося из ткани цилиарного тела в Десцеметову оболочку (вариант "ab externo"). При варианте "ab interno" начальные этапы операции те же, в то время как обнажение десцемето-цилиарного слоя производится иначе. После выделения фильтрующей мембраны тонкий глубокий склеральный лоскут рассекается лезвием, вскрывается супрахориоидальное пространство. Глубокий склеральный лоскут отделяется от цилиарного тела в направлении дренажной зоны до появления в склере со стороны цилиарного тела волокон склеральной шпоры линии соединения цилиарного тела и склеры. На периферии зоны операции в направлении, перпендикулярном Шлеммову каналу, рассекаются все волокна склеральной шпоры вместе с циркулярными волокнами трабекулы до появления десцемето-цилиарного слоя. Глубокий склеральный лоскут вместе со склеральной шпорой и поверхностными слоями трабекулы отделяется единым блоком от цилиарного тела и десцемето-цилиарного слоя трабекулы до противоположного края зоны операции, где отсекается и удаляется. Таким образом, при варианте "ab intetno" в области операции удаляются все корнеосклеральные структуры, а при варианте "ab externo" на поверхности цилиарного тела остается склеральная шпора с прилежащим участком глубокого слоя склеры. Состав фильтрующей мембраны при обоих вариантах одинаков, обеспечивая максимально возможный для непроникающих операций гипотензивный эффект. Поверхностный склеральный лоскут возвращается на свое место и подшивается. Ушивается рана конъюнктивы и теноновой оболочки.
Источники.
1. Федоров С.Н. и др. Непроникающая глубокая склерэктомия при открытоугольной глаукоме. Офтальмохирургия. 1989, N 3-4, с. 52-55.
2. Нестеров А.П. Первичная глаукома. М. Медицина, 1982. с. 112-113.
3. Козлов В.И. Магарамов Д.А. Ерескин Н.Н. Поэтапный лазерно-хирургический способ лечения смешанной глаукомы. В кн. Актуальные проблемы хирургического лечения глаукомы. М. 1989. с. 65-72.
4. Ерескин Н.Н. Методика лазерной гониопунктуры после операции непроникающей глубокой склерэктомии при открытоугольной глаукоме. В кн. Офтальмохирургия и применение лазеров в офтальмологии. М. 1990. с. 51.
5. Сергиенко Н.М. Кондратенко Н.М. Москальчук И.В. Синусотрабекулэктомия в два этапа как новый способ лечения открытоугольной глаукомы // Офтальмол. журн. 1993, N 3, с. 152-154. Цит. по: Нестеров А.П. Глаукома. М. Медицина, 1995, с. 229.
6. Краснов М.М. Микрохирургия глауком. М. Медицина, 1980. с. 31, 198-203.
7. Першин К.Б. Хирургическое лечение на ранних стадиях первичной глаукомы. В кн. Актуальные проблемы хирургического лечения глаукомы. М. 1989, с. 109-112.
8. Rohen J.W. Anatomy of aqueous outflow channels//Glaucoma/Ed. j. Cairns. London, 1986. Vol. 1. P. 277-288.
9. Зальцман М. Анатомия и гистология человеческого глаза в нормальном состоянии, его развитие и увядание. Пер. с нем. Л.И. Сергиевского. М. 1913, с. 45-53, 215-228.
10. Шепкалова В.М. Анатомия и гистология глаза. // Руководство по глазным болезням. Под ред. В.Н. Архангельского. М. 1962. Том 1; книга 1. с. 142, 157.
11. Фабрикантов О.Л. Белый Ю.А. Сравнительный анализ необходимости повторных антиглаукоматозных операций при первичной открытоугольной глаукоме. В кн. Актуальные проблемы современной офтальмологии. Саратов, 1996, с. 208-209.
12. Нестеров А. П. Внутриглазное давление: физиология и патология. М. Наука, 1974, с. 44, 279-281.
13. Белова Л.В. Балашевич Л.И. Сравнительная оценка исходов непроникающей глубокой склерэктомии (по Федорову-Козлову) и синустрабекулэктомии при открытоугольной глаукоме. В кн. Микрохирургия глаза. Ленинград: Медицина, 1990, с. 106.
14. Allen L. Burian H.M. Bradley A.E. A New Concept of the Anterior Chamber Angle, A. M. A. Arch. Opht. 53: 783, 1955. Цитир. по: Sugar H.S. The Glaucomas. A Hoeber-Harper Book, 1957. P. 9-12.
15. Нестеров А.П. Глаукома. М. Медицина, 1995, с. 108, 210-212.
16. Нестеров А.П. Первичная глаукома. М. Медицина, 1973, с. 95-100.
17. Козлов В.И. Анисимова С. Тимофеев А. Непроникающая антиглаукоматозная операция. Учебный фильм МНТК "Микрохирургия глаза". М. 1989.
18. Пригожина А.Л. Патологическая анатомия и патогенез глаукомы. М. Медицина, 1966, с. 58-64.
19. Rones B. Development of the human cornea. Arch. Opht. 8: 568-575, Oct. 1932.
20. Thomas C. The Cornea. Springfield, lllinois, USA, 1955. P. 3-45.
21. Laguesse E. Developpement de la cornee chez le poulet. Arch. d'anat. micros. 22: 216-265, Nov. 1926, Цитир. по: Thomas C. The Cornea. - Springfield, lllinois, USA, 1955. PP. 3-45.
22. Карлсон Б. Основы эмбриологии по Петтену. Том 2. М. Мир, 1983, с. 85-93.
23. Redslob E. Le developpement de la cornee. Arch. d'anat. d'histol. et d'embriol. 19: 135-229, 1935. Цитир. по: Thomas C. The Cornea. - Springfield, lllinois, USA, 1955. PP. 3-45.
24. Kupfer C. Datiles M.B. Kaiser-Kupfer M. I. Development of the Anterior Chamber of the Eye: Embriology and Clinical Implications. Basic aspects of glaucoma research. Stuttgart, 1982. P. 35-38.
25. Tripathi B. J. Tripathi R.S. Stefansson K. Adamis A. Molu ar M. Ememerson M. Neuroectodermal origin of corneal endotelium and keratocytes in human eyes // Invest. Ophtalmol. Vis. Sci. 1985. Vol. 26. No. 3. - Suppl. P. 274.
26. Shamsuddin A.K.M. Nizankari V.S. Purnell D.M. Is the corneal posterior cell layer truly endothelial? // Ophtalmology 1986. Vol. 93. - No. 10. P. 1298-1303.
27. Cong Zhao, Naoya Fujimoto, Hitoshi Shichi (Detroit) Prostaglandin (PG) E2 receptor subtypes in porcine ocular tissues. Investigative Ophtalmology Visual Science. Fort Lauderdale, Florida, USA, 1995. p. 129.
28. Фукс Э. Руководство к глазным болезням. М. Издание А.А. Карцева. 1910, с. 324.2
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ЛЕЧЕНИЯ ОТКРЫТОУГОЛЬНОЙ ГЛАУКОМЫ | 2007 |
|
RU2394534C2 |
| СПОСОБ ЛЕЧЕНИЯ ОТКРЫТОУГОЛЬНОЙ ГЛАУКОМЫ | 2012 |
|
RU2535790C2 |
| СПОСОБ ХИРУРГИЧЕСКОГО ЛЕЧЕНИЯ ОТКРЫТОУГОЛЬНОЙ ГЛАУКОМЫ | 1999 |
|
RU2180539C2 |
| СПОСОБ ФОРМИРОВАНИЯ ДОСТУПА ПРИ ОПЕРАЦИЯХ НА ПЕРИЛИМБАЛЬНОЙ ЗОНЕ СКЛЕРЫ | 1996 |
|
RU2112481C1 |
| СПОСОБ ЛЕЧЕНИЯ ГЛАУКОМЫ И УСТРОЙСТВО ДЛЯ ЕГО РЕАЛИЗАЦИИ (ВАРИАНТЫ) | 1999 |
|
RU2160574C1 |
| СПОСОБ ХИРУРГИЧЕСКОГО ЛЕЧЕНИЯ ОТКРЫТОУГОЛЬНОЙ ГЛАУКОМЫ | 2004 |
|
RU2290148C2 |
| Способ лечения первичной открытоугольной глаукомы | 2023 |
|
RU2815951C1 |
| СПОСОБ ХИРУРГИЧЕСКОГО ЛЕЧЕНИЯ ГЛАУКОМЫ | 2020 |
|
RU2738309C1 |
| Способ проведения непроникающей глубокой склерэктомии | 2024 |
|
RU2828739C1 |
| СПОСОБ УШИВАНИЯ ЛИМБАЛЬНО-РАДИАЛЬНОГО РАЗРЕЗА КОНЪЮНКТИВЫ | 1996 |
|
RU2114589C1 |





Изобретение относится к офтальмохирургии, а именно, к способам лечения глаукомы. Технический результат: получение максимальной фильтрации внутриглазной жидкости через фильтрующую мембрану. Сущность изобретения: при проведении непроникающей глубокой склерэктомии после выделения фильтрующей мембраны, состоящей из трабекулярной ткани и прилежащей части Десцеметовой оболочки, производят снятие с трабекулы эндотелия, а также слоя корнесклеральных и увеально-меридиональных волокон до обнажения десцемето-цилиарного слоя. 18 ил.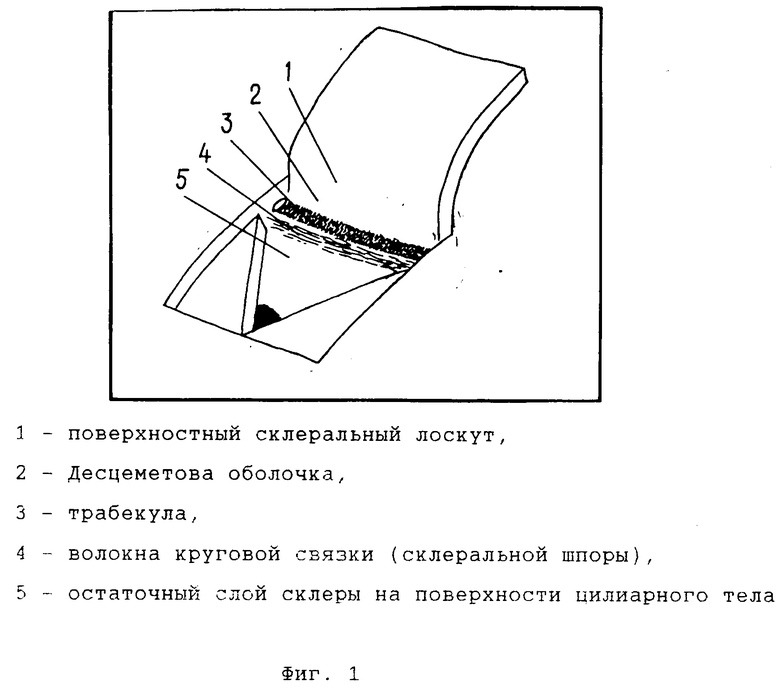
Способ лечения глаукомы, включающий выполнение непроникающей глубокой склерэктомии, отличающийся тем, что после выделения фильтрующей мембраны, состоящей из трабекулярной ткани и прилежащей части Десцеметовой оболочки, с трабекулы снимают эндотелий, а также слои корнеосклеральных и увеально-меридиональных волокон до обнажения десцемето-цилиарного слоя.
| Офтальмохирургия, N 3-4, 1989, с.52-55. |
Авторы
Даты
1997-11-27—Публикация
1996-12-02—Подача