Изобретение относится к гибридомной технологии и может быть использовано при диагностике гепатита В.
Гепатит В является тяжелым инфекционным заболеванием человека, HBsAg (поверхностный антиген вируса гепатита В) основной маркер заболевания, подтверждающий наличие острой или хронической формы инфекции или носительства. Для создания тест-систем для диагностики гепатита В необходимо наличие моноклональных антител (МКА) к HBsAg.
Ряд авторов [1,5] получили коллекции гибридом, продуцирующих МКА (моноклональные антитела) к HBsAg. Однако, только немногие из штаммов обладают свойствами, необходимыми для штаммов-продуцентов, пригодных в производстве диагностических тест-систем высокими ростовыми характеристиками, большим выходом антител на мышь в асцитной жидкости, стабильностью продуцируемых антител в растворе и сорбированными на твердой фазе, высокой активностью в реакции антиген -антитело, специфичностью к определенному участку "а" антигенной детерминанты и, главное, способностью выявлять HBsAg в низких концентрациях [3,4]
Известно, что группоспецифическая а-детерминанта молекулы HBsAg является сложной и содержит несколько сайтов связывания антител [6] Наличие МКА к различным сайтам на а-детерминанте молекулы HBsAg могло бы позволить конструктировать диагностикумы по двухсайтному методу, в котором взаимодействие иммуноспецифических реагентов проводится в одну стадию, используя независимость связывания МКА с разными эпитопами. При конструктировании тест-системы по двухсайтному методу можно более высокой чувствительности [3] Наиболее близкий к заявляемой является гибридома ЖАК-22, обладающая следующими свойствами: титр асцитной жидкости в ИФА 4х105, содержание специфических антител 9,7 мг/мл [1,2] чувствительность при определении HBsAg в РИА 2 нг/мл, в ИФА 1 нг/мл [3,4] По сравнению с ЖАК-22 у НВSV-4 больший выход асцитной жидкости на мышь, более высокие титры асцитной жидкости в ИФА, более высокая чувствительность при определении HBsAg, другой участок а-детерминанты. Целью данного изобретения является получение штамма гибридных культивируемых клеток животных Mus. musculus, продуцирующих МКА к определенному сайту группоспецифической а-детерминанты HBsAg. Цель достигается получением коллекций гибридом, продуцирующих МКА к HBsAg (по реакции в ИФА) и состоящей из 50 различных клонов. Гибридомы сравниваются по ростовым характеристикам, стабильности продукции антител, прививаемости мышам сингенной линии, объему получаемых асцитных жидкостей, титрам антител асцитных и культуральных жидкостей в разных вариантах ИФА, а также в РПГА и иммунодиффузии. Продуцируемые гибридомами антитела сравнивают также в реакции конкурентного ИФА, что позволяет разделить их на несколько групп конкуренции. Реакция с adw и avw генноинженерными вариантами HBsAg позволяет разделить их на несколько групп конкуренции. Реакция с adw и ayw генноинженерными вариантами HBsAg позволяет определить МКА комплементарные а-детерминанте молекулы HBsAg.
В результате анализа был отобран штамм, комплементарный определенному участку а-детерминанты HBsAg и обладающий хорошими характеристиками штамм-продуцента МКА.
Гибридомы получают слиянием клеток миеломы P3-NS1-Ag4-1 со спленоцитами мыши линии BALB/с, иммунизированной HBsAg.
Мышь линии BALB/c (самка, 8 нед) иммунизируют внутрибрюшинно HBsAg, выделенным из плазмы сыворотки хронически больных людей, в количестве 20 мкг 0,5 мл забуференного фосфатом физраствора (ЗФР), содержащего 50% полного адъюванта Фрейнда и через 8 нед 200 мкг HBsAg в 0,5 мл ЗФР внутрибрюшинно. Через 3 дн после второй иммунизации клетки селезенки иммунной мыши гибридизируют с клетками миеломы мыши P3-NS1-Ag4-1 (соотношение 3 1) в 1 мл раствора, содержащего 50% полиэтиленгликоля (м.м. 4000 "Merk") и 5% диметилсульфоксида. После гибридизации и отмывки от полиэтиленгликоля клетки высевают в 96-луночные планшеты по 3•105 клеток на лунку. Для культивирования и селекции гибридов используют среду ДМЕМ(м) с добавлением 10%-ной телячьей эмбириональной сыворотки, 10-4М гипоксантина, 4•10-7 аминоптерина и 1,6•10-5М тимидина. Гибриды-продуценты отбирают методом иммуноферментного анализа ИФА и дважды клонируют методом лимитирующих разведений.
Продуктивный штамм обозначили HBSV-4.
Штамм депонирован в Специализированной коллекции перевиваемых соматических клеток позвоночных Всесоюзной коллекции клеточных культур 30.11.93 под номером ВСКК/П/ 628 Д. Штамм депонирован с научным описанием (паспортом).
Штамм характеризуется следующими признаками.
Родословная штамма.
Гибридома получена слиянием клеток миеломы P3-NS1-Ag4-1 со спленоцитами мыши линии BALB/с, иммунизированной HBsAg с помощью полиэтиленгликоля (м.м. 4000). Селекцию гибридов проводили на НАТ среде. Клетки были дважды клонированы, процент позитивных клонов после 2-го клонирования 100% Число пассажей к моменту депонирования: 35 пассажей.
Стандартные условия выращивания.
Среда ДМЕМ с 10%-ной эмбриональной телячьей сывороткой, 40 мкг/мл гентамицина, 37oC, 5% СО2.
Культуральные свойства.
Гибридома культивируется в стеклянных или пластиковых флаконах объемом 0,05 1,5 л в стационарном состоянии, клетки снимаются смесью растворов трипсина (25 мкг/л) и Версена в соотношении 1:2, посевная доза 120 тыс. клеток в мл, кратность пересева 1 5 или 1 6, время субкультивирования 2 3 сут.
Культивирование гибридомы в организме животного.
Гибридома может быть культивирована в организме мышей линии BALB/с, сенсибилизированных внутрибрюшинно за 5 40 дн 0,5 мл пристана или вазелинового масла. Доза клеток при прививке 1 -10•105. Асцит образуется через 5-18 дн. Гибридома может перевиваться.
Морфологические признаки.
Культура состоит из крупных округлых клеток, сходных по морфологии и размерам с исходной родительской миеломой P3-NS1-Ag4-1.
Данные о видовой принадлежности.
Гибридома является мышиной получена слиянием клеток мышиной миеломы и спленоцитов мыши, может культивироваться в организме мыши, секретируемые ею МКА взаимодействуют с антисывороткой к иммуноглобулинам мыши.
Маркерные признаки и методы их оценки.
Гибридома представляет собой монослойно-суспензионную культуру клеток и продуцирует антитела со следующими маркерными признаками антитела принадлежат к классу IgG1, слабо взаимодействуют с белком А золотистого стафилококка (по данным ИФА и аффинной хроматографии), реагируют с ИФА с HBs-антигеном плазматическим и HBs-антигеном генноинженерным adw и ayw серотипов, дают положительный ответ в реакции диффузной преципитации в геле, РПГА и в "сэндвич"-варианте ИФА, взаимодействуя одновременно с HBsAg, собированном на твердой фазе, и с HBssAg, конъюгированном с пероксидазой и находящемся в растворе.
Данные о контаминации.
Бактерии и грибы не обнаружены, контроль на контаминацию вирусами и микоплазмами не проводился.
Характеристика биосинтеза полезных продуктов.
Секретируемые гибридомой МКА имеют титр около 1•10-4 в культуральной жидкости и 1•10-6 1•10-7 в асцитной жидкости (по данным ИФА), стабильность продуцирования антител сохраняются на протяжении 35 пассажей в культуре клеток (срок наблюдения).
Способ криоконсервации.
Клетки замораживаются на ростовой среде с 40%-ной фетальной сывороткой теленка и 10%-ным диметилсульфоксидом при температуре -70oC в пенопластовом контейнере с толщиной стенок 1,5 см в течение 1 2 мин при температуре 37 40oC, отмываются от криозащитной среды и культивируются на ростовой среде в стеклянных или пластиковых флаконах, выживаемость клеток при размораживании составляет 70 80% (по окраске трипановым синим).
Изобретение поясняется чертежом.
На оси абцисс номер трехкратного разведения конкурента. Конкурентом в реакции являются МКА HBSV-4 из асцита (2) и ЖАК-22 из асцита (1). Меченые антитела МКА ЖАК-22. Начальная концентрация МКА HBSV-4 200 мкг/мл, МКА ЖАК-22 4 мкг/мл.
Пример 1. Определение специфической активности антител.
HBsAg из плазмы больных людей или генноинженерный ayw серотипа сорбируют в лунки полистироловых планшетов из раствора ЗФР, содержащего антиген в концентрации 10 мкг/мл, в течение ночи; неспецифические места связывания на пластике блокируют с помощью 0,1% казеина в ЗФР; проводят титрование культуральной и асцитной жидкости с разведения 1/30 с кратностью 3 в блокирующем буфере; время реакции антиген -антитело в течение ночи при комнатной температуре; после отмывки в лунки добавляют антитела против иммуноглобулинов мыши, конъюгированные с пероксидазой хрена. После окончания инкубации (1 ч, 37oC) несвязавшиеся продукты реакции отмывают и связавшийся конъюгат определяют количественно по расщеплению субстрата (H2O2) в присутствии хромогена ортофенилендиамина. Положительная реакция проявляется коричневым окрашиванием и просчитывается при 492 нм. Титром считают разведение раствора антител, при котором наблюдается оптическое поглощение 0,2 о.е./мл при длине волны 492 нм.
При реакции с плазматическим HBsAg титры культуральной жидкости составляют 10-4, титры асцитной жидкости 10-6 10-7. Соотношение титров реакции с HBsAg плазматическим и генноинженерным ayw серотипа 1:27.
Пример 2. Реакция МКА с разными серотипами генноинженерного HBsAg (adw b ayw), МКА сорбируют из раствора ЗФР, содержащего антитела в концентрации 10 мкг/мл, в лунках полистироловых планшетов, блокируют 0,1%-ным раствором казеина и добавляют adw и ayw варианты генноинженерного HBsAg в блокирующем в блокирующем буфере и в концентрации 100 1,3 нг/мл с кратностью разведения 3. МКА для сорбции очищают с помощью аффинной хроматографии на беклке А золотистого стафилококка [8] Реакцию антиген - антитело ведут в течение ночи при комнатной температуре. После отмывки добавляют МКА HBSV-4, конъюгированные с пероксидазой хрена на 1 ч при 37oC/ Положительную реакцию определяли как описано выше. МКА HBSV-4 реагируют как с adw, так и с ayw серотипами генноинженерного HBsAg с соотношением титров 1 1.
Пример 3. Проведение конкурентного ИФА.
Метод основан на конкуренции между мечеными пероксидазой хрена и не мечеными МКА при ограниченной концентрации антигена. Конъюгаты МКА получают периодатным методом [7] В лунки полистироловых планшетов с сорбированным HBsAg добавляют конкурирующие антитела в серии 3-х кратных разведений и инкубируют 0,30 ч при 43oC, после чего вносили меченые МКА на 2 ч при 43oС. Разведение меченых МКА подбирают так, чтобы они в отсутствии конкурента дают в ИФА значение экстинкции на 492 нм 1 о.е./мл. Количество связавшейся метки определяют как описано выше.
Процент конкуренции вычисляют по формуле: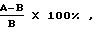
где А величина связывания метки в отсутствии конкурента;
В связывание метки в присутствии немеченного МКА.
На фиг.1 приведены кривые конкуренции клонов HBSV-4 и ЖАК-22. Из фиг. 1 следует, что МКА HBSV-4 не конкурируют за связывание с меченым МКА ЖАК-22, в то время как меченые и немеченые МКА ЖАК-22 конкурируют между собой.
Пример 4. Определение стабильности МКА в растворах HBSV-4.
Стабильность МКА определяют по соотношению титров в ИФА культуральных и асцитных жидкостей после из обработки следующим способами: прогрев при 37oC в течение 48 ч, прогрев при 60oC в течение 1 ч, трехкратная заморозка и разморозка.
Показано, что при всех методах обработки титры специфических антител, определенные методом ИФА, в культуральной и асцитной жидкостях не меняются.
Пример 5. Определение HBsAg в растворах.
МКА HBSV-4, очищенные методом аффинной хроматографии на белке А золотистого стафилококка, конъюгируют с пероксидазой хрена. В лунках полистироловых планшетов сорбируют очищенные МКА HBSV-4 из раствора ЗФР, содержащего МКА в концентрации 10 мкг/мл в течение ночи; места неспецифического связывания блокируют 0,1% раствором казеина 3ФР отмывают трижды водой и добавляют HBsAg в серии трехкратных разведений в концентрации 100 0,01 нг в объеме 100 мкл и конъюгат МКА HBSV-4 с пероксидазой хрена в разведении 1/1000 в объеме 50 мкл на 3 ч при 43oC. Реакцию проявляют как описано выше. Положительной считают реакцию, когда значение экстинкции на 492 нм превышает значение экстинкции для контрольной лунки (без HBsAg) на 0,04 о.е. Метод позволяет определять до 0,3 нг/мл HBsAg в растворе.
Штамм отличается от других близких штаммов следующей совокупностью признаков: продуцируемые им МКА реагируют в ИФА со следующими вариантами HBsAg: плазматическим из сыворотки переболевших людей, генноинженерными осповакцинными ayw и adw серотипов; не конкурируют за сайт связывания на молекуле HBsAg с МКА ЖАК-22; не связывается с HBsAg, денатурированным 2-меркаптоэтанолом, следовательно, МКА комплементарны конфармационной эпитопе на группоспецифической "а" антигенной детерминанте молекулы HBsAg (этот участок а-детерминанты молекулы HBsAg обозначается как В); МКА относятся к IgG1; могут быть очищены с помощью аффинной хроматографии на белке А золотистого стафилококка с высоким выходом, обладают высокой стабильностью при хранении в растворах и сорбции на пластике; клетки обладают отличными ростовыми характеристиками, стабильны по продукции МКА (срок наблюдения около 45 пассажей), хорошо прививаются животным и дают хороший выход асцитной жидкости на мышь (3 4 мл) с высоким содержанием специфических антител (5 -10 мг/мл) и с высокими титрами специфических антител в ИФА (106 107); МКА пригодны для выявления HBsAg в растворах, в сыворотке людей и сорбированного на пластике.
Перечисленные свойства позволяют использовать штамм HBSV-4 для производства диагностических тест-систем.
Источники информации
1. Кущ А. А. Момот А.М. Шумай Е.П. и др. Получение и характеристика гибридом, продуцирующих моноклональные антитела к поверхностному антигену вируса гепатита В, Вопросы вирусологии, N 4, 1987, с. 448 541.
2. Жданов В.М. Кущ А.А. Момот А.М. и др. Свойства моноклональных антител, взаимодействующих с детерминантами поверхностного антигена вируса гепатита В, Молекулярная генетика, микробиология, вирусология, N 12, 1986, с. 37 40.
3. Кущ А. А. Момот А.М. и др. Сравнение различных тест-систем для радиоиммунологического определения поверхностного антигена вируса гепатита В с использованием моноклональных антител, Вопросы вирусологии, N 5, 1987, с. 544 -548.
4. Воробьев С.М. Симонов В.И. Кущ А.А. Использование моноклональных антител для иммуноферментного определения поверхностного антигена вируса гепатита В, Биотехнология, N 6, 1987, с. 720 724.
5. Wands J.R. Zurawski V.R. High affinity monoсolonal antibodies to hepatitis B surface antigen (HBsAg) produced by somatic cell hybrids, Gastroenterology, 1981 y. v. 80, p. 225 232.
6. Wand J. R. et al. Signature analisis of hepatitus B viral antigenic structure: analisis by monoclonal radioimmunoassays, PNAS USA, 1984 y. v. 81, p. 2237 2241.
7. Nakane P.K. and Kawaoi A. Histochem. Cytochem. 1974 y. v.22, p. 1084.
8. Ey P.L. Prowse S.J. and Jenkin C.R. Isolation of pure IgG1, IgG2a and IgG2b immunoglobulins from mouse serum using protein A-Sepharose, Immunochemistry, v. 15, p. 429 436.
Использование: разработка биотехнологических методов диагностики гепатита В. Сущность изобретения: получение штамма гибридных культивируемых клеток мыши HBSV-4, продуцирующего моноклональные антитела (МКА) к а-детерминанте поверхностного антигена вируса гепатита В (HBsAg). Штамм получают гибридизацией клеток миеломы РЗ-NS1-Ag4-1 c клетками селезенки мышей линии Balb/c, иммунизированных поверхностным антигеном вируса гепатита В, выделенным из сыворотки крови хронических больных гепатитом. Полученный штамм продуцирует МКА класса IgGI, взаимодействующие с конформационным эпитопом на группоспецифической а-детерминанте HBsAg и обладающие высокой стабильностью. МКА позволяют выявлять HBsAg в растворах и биологических жидкостях организма. 1 ил.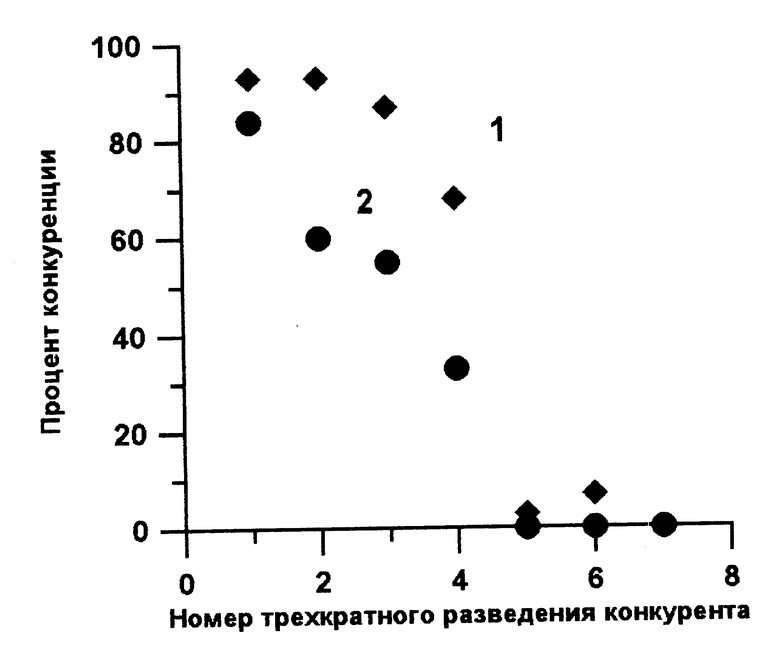
Штамм гибридных культивируемых клеток животного Mus musculus L. ВСКК(II) N 6280 продуцент моноклональных антител к а-детерминанте поверхностного антигена вируса гепатита В.
| Кущ А.А., Момот А.М., Шумай Е.П | |||
| и др | |||
| - Вопросы вирусологии, 1987, N 4, с | |||
| Корнерез для пней | 1921 |
|
SU448A1 |
Авторы
Даты
1997-11-27—Публикация
1994-10-13—Подача