Изобретение относится к биотехнологии, а именно к генной инженерии и касается рекомбинантных вакцин для профилактики вирусного гепатита В, содержащих в своем составе в качестве активного компонента HBs-антигены серотипов adw и / или ayw, выделенные из штаммов дрожжей Pichia angusta (Hansenula polymorpha) VKPM Y - 2412 и VKM Y-2924D.
Известна вакцина для иммунизации против гепатита В, включающая поверхностный антиген вируса гепатита В, содержащий пре S2, в эффективном количестве, и, по крайней мере, один из физиологически приемлемых компонентов, выбранных из группы носитель, разбавитель или адъювант. Продуцентом поверхностного антигена вируса гепатита В является штамм дрожжей S. cerevisia КСТС 0098 ВР.
RU, Патент №2122430, 1995, C 12 N 15/51, А 61 К 39/29.
При реализации известного технического решения не обеспечивается достаточно высокий уровень синтеза антигена, являющегося активной частью получаемой вакцины.
Известна рекомбинантная вакцина для профилактики вирусного гепатита В, содержащая эффективное количество поверхностного антигена вируса гепатита В, полученного путем культивирования штамма дрожжей S.cerevisiae ВКПМ Y-2203, адъювант, консервант и физиологически приемлемый носитель.
Патент РФ №2088664, 1996 г., А 61 К 39/29
При осуществлении изобретения в соответствии с указанным патентом при использовании штамма дрожжей S. cerevisiae невозможно добиться высоких уровней синтеза антигена. Описанные до сих пор способы достижения высокого уровня синтеза HBsAg в клетках дрожжей предполагали введение в клетки большого числа копий гена, его кодирующего. Проблема заключается в том, что некоторые из копий могут получать мутации, что, в свою очередь, может менять свойства получаемого белка. При этом контроль за возникновением мутаций на фоне высокой копийности гена практически невозможен. Более того, очень высокий уровень синтеза чужеродной РНК может приводить к истощению в клетке некоторых тРНК, в результате чего соответствующие им кодоны транслируются при помощи других тРНК. Это приводит к появлению в конечном продукте примеси мутантных форм полипептида, содержащих аминокислотные замены.
Все вышеизложенное в свою очередь может повлиять на качество получаемых вакцин.
Задачей изобретения является расширение арсенала средств для профилактики вирусного гепатита В, путем создания высокоиммуногенных, нетоксичных, не обладающих побочными эффектами вакцин.
Поставленная задача решена за счет введения в состав вакцин в качестве основных активных компонентов поверхностных антигенов вируса гепатита В серотипов ad и/или ау, полученных культивированием штаммов дрожжей Pichia angusta (Hansenula Polymorpha) VKPM Y-2412 и VKM Y-2924D.
Используемые для выделения антигенов дрожжевые продуценты должны обладать следующими свойствами: 1) способ получения продуцента должен позволять контролировать отсутствие мутаций в экспрессируемом чужеродном гене; 2) уровень экспрессии не должен быть очень высоким, чтобы увеличить точность трансляции чужеродной мРНК и при этом выход целевого белка должен быть достаточно высоким, чтобы обеспечить экономическую целесообразность использования продуцентов.
Согласно изобретению одна копия синтетической последовательности ДНК, кодирующей HBsAg/ayw или HBsAg/adw, интегрирована в геном штамма Pichia angusta (Hansenula polymorpha). Для увеличения доли антигена во фракции растворимых клеточных белков используется штамм с нарушенным геном МОХ, кодирующем алкогольоксидазу. Отсутствие мутаций, которые могли образоваться в гене, кодирующем HBsAg/ayw или HBsAg/adw, в процессе его введения в геном дрожжей или при культивировании штамма-продуцента, может быть выявлено определением нуклеотидной последовательности продукта полимеразной цепной реакции с праймерами к этому гену.
Дрожжи Pichia angusta (H. polymorpha) являются предпочтительными по сравнению с S. cerevisiae, поскольку позволяют добиваться более высоких уровней синтеза антигена при более простых способах получения культур высокой плотности.
Штаммы дрожжей Pichia angusta (H. polymorpha), являющиеся продуцентами поверхностного антигена вируса гепатита В серотипов ad и ау и вакцины против гепатита В, являются новыми и ни в патентной, ни в научно - технической литературе не описаны.
Изобретение может быть проиллюстрировано следующими примерами. При этом все рутинные генно-инженерные операции осуществляют согласно стандартным методикам (маниатис) и инструкциям компаний производителей ферментов и наборов для манипуляций с ДНК in vitro. Для ПЦР во всех случаях использовали полимеразу Vent (NEB). Синтез олигонуклеотидов производился ЗАО “Синтол” г. Москва. В работе для получения антигена серотипа ayw использовали следующие олигонуклеотиды:



В соответствии с изменениями, внесенными в классификацию дрожжей, Н. Polymorpha обозначается и как Pichia angusta.
Пример 1. Получение фрагмента ДНК, кодирующего HBsAg/ayw (фрагмент А). Реакционную смесь, содержащую олигонуклеотиды lu и 8L по 1 мкМ, олигонуклеотиды со 2u по 8u; с 1L по 7L по 10 пМ, ThermoPol буфер (10 mМ KCI, 20 mM tris-HCI рН 8.8, 10 mМ (NH4)2SO4 2 mМ MgSO4, 0,1% Triton X-100, 250 uM dNTP) и 5 единиц активности Vent полимеразы инкубируют в течение 30 циклов изменения температуры. Каждый цикл включает инкубацию при 95°С в течение 30 сек, при 50°С 30 сек, при 72°С 90 сек. После этого продукты реакции разделяют электрофоретически в 1% агарозном геле, и изолируют фрагмент размером 730 пар оснований. Соответствие выделенного фрагмента нужному размеру определяют также путем электрофореза в 1% агарозном геле, сравнивая его подвижность с подвижностью полос маркеров молекулярного веса.
Пример 2. Получение фрагмента геномной ДНК Pichia angusta (H. polymorpha), содержащего промотор гена МОХ (фрагмент Б).
Суспендируют 2-3 мкг клеток штамма Pichia angusta (Hansenula polymorpha) BKM 4-2559 (получен из почвы СС4 38-22-2 Институт биохимии и физиологии микроорганизмов РАН) в 0,1 мл 0,25% раствора додецилсульфата натрия и инкубируют на кипящей водяной бане в течение 5 мин. Клетки осаждают центрифугированием при 10000 g 5 мин. 1мкл полученного супернатанта добавляют к 25 мкл смеси, содержащей олигонуклеотиды moxU5 и moxL3 по 1 мкМ, ThermoPol буфер (10 mM KCI, 20 mM tris-HCI рН 8.8, 10 mM (NH4)2SO4, 2 mM MgSO4, 0,1% Triton X-100, 250 uM dNTP) и 5 единиц активности Vent полимеразы. Реакционную смесь инкубируют в течение 30 циклов изменения температуры. Каждый цикл включает инкубацию при 95°С в течение 30 сек, при 50°С 30 сек, при 72°С 90 сек. После этого продукты реакции разделяют электрофоретически в 1% агарозном геле и изолируют фрагмент размером 850 пар оснований. Соответствие выделенного фрагмента нужному размеру определяют также путем электрофореза в 1% агарозном геле, сравнивая его подвижность с подвижностью полос маркеров молекулярного веса.
Пример 3. Получение фрагмента геномной ДНК Pichia angusta (H. polymorpha), содержащего часть гена TRP 3 (фрагмент В).
Суспендируют 2-3 мкг клеток штамма Pichia angusta (H. polymorpha) ВКМ 4-2559 в 0,1 мл 0,25% раствора додецилсульфата натрия и инкубируют на кипящей водяной бане в течение 5 мин. Клетки осаждают центрифугированием при 10000 g 5 мин. 1 мкл полученного супернатанта добавляют к смеси содержащей олигонуклеотиды trpU5 и trpL3 по 1 мкМ, ThermoPol буфер (10 mM KCI, 20 mМ tris-HCI pH 8.8, 10 mМ (NH4)2SO4, 2 mМ MgSO4, 0,1% Triton X-100, 250 uM dNTP) и 5 единиц активности Vent полимеразы. Реакционную смесь инкубируют в течение 30 циклов изменения температуры. Каждый цикл включает инкубацию при 95°С в течение 30 сек, при 50°С 30 сек, при 72°С 120 сек, при 50°С 30 сек, при 72°С 120 сек. После этого продукты реакции разделяют электрофоретически в 1% агарозном геле и изолируют фрагмент размером 1360 пар оснований. Соответствие выделенного фрагмента нужному размеру определяют также путем электрофореза в 1% агарозном геле, сравнивая его подвижность с подвижностью полос маркеров молекулярного веса.
Пример 4. Получение фрагмента ДНК Pichia angusta (H. polymorpha), содержащего последовательность, кодирующую HBsAg/ayw, слитую с промотором МОХ и геном TRP 3 (фрагмент Г).
Реакционную смесь (0.05 мл), содержащую олигонуклеотиды moxU5 и trpL3 по 1 мкМ, фрагменты А, Б и В по 1 пг, ThermoPol буфер (10 mM KCI, 20 mM tris-HCI pH 8.8, 10 mM (NH4)2SO4, 2 mM MgSO4 0,1% Triton X-100, 250 uM dNTP) и 5 единиц активности Vent полимеразы инкубируют в течение 30 циклов изменения температуры. Каждый цикл включает инкубацию при 95°С в течение 30 сек, при 50°С 30 сек, при 72°С 3 мин. После этого продукты реакции разделяют электрофоретически в 1% агарозном геле и изолируют фрагмент размером 2,9 тысяч пар оснований. Соответствие выделенного фрагмента нужному размеру определяют также путем электрофореза в 1% агарозном геле, сравнивая его подвижность с подвижностью полос маркеров молекулярного веса.
Пример 5. Интеграция последовательности, кодирующей HBsAg/ayw, в геном Pichia angusta (H. polymorpha).
Штамм Pichia angusta (H. polymorpha) DLT (Agaphonov et al., 2002; коллекция штаммов лаборатории молекулярной генетики РКН ПК МЗ РФ) выращивают в течение 15-20 часов в среде YNB-D, содержащей триптофан 20 мг/л, при 37°С в условиях интенсивной аэрации. 0,5 мл культуры добавляют к 30 мл такой же среды и инкубируют в тех же условиях в течение 4-х часов. Клетки собирают центрифугированием при 3000 g 5 мин и суспендируют в 15 мл буфера Т (10 mМ tris-HCI pH 7.4; 100 mМ СН3СООLi; 0.5 mМ EDTA). После инкубации в течение 30 мин при 30°С клетки вновь осаждают и суспендируют в 200 мкл буфера Т. К 0,05 мл суспензии добавляют 1 мкг фрагмента Г, перемешивают, добавляют 120 мкл 70% раствора ПЭГ 4000, вновь перемешивают и инкубируют 1 час при 30°С.
Трансформационную смесь инкубируют при 45°С 15 мин, охлаждают до комнатной температуры и высевают на чашки Петри со средой, содержащей 50 мг/мл лейцина. Выросшие колонии трансформантов проверяют на способность расти на среде, содержащей метанол в качестве единственного источника углерода. Отбирают клоны, неспособные расти на такой среде и проверяют их на способность синтезировать HBsAg/ayw. Полученный штамм дрожжей Pichia angusta (H. polymorpha) является продуцентом поверхностного антигена вируса гепатита В (HBsAg/ayw). Штамм имеет регистрационный номер VKM Y-2924D, 25.02.2003 и депонирован в Институте биохимии и физиологии микроорганизмов РАН им. Г.К.Скрябина.
Пример 6. Анализ способности штамма синтезировать HBsAg/ayw. Тестируемый штамм засевают в среду YPD (1% дрожжевого экстракта, 2% пептона и 2% глюкозы) и инкубируют при 37°С в течение 15-20 часов в условиях высокой аэрации. Полученную культуру разводят в пять раз средой YPM (1% дрожжевого экстракта, 2% пептона и 2% метанола) и инкубируют в тех же условиях в течение 30-50 часов. Клетки из 0,5 мл культуры собирают центрифугированием, суспендируют в 0,2 мл дистиллированной воды, добавляют 0,2 мл 0,2 М NaOH и инкубируют на кипящей водяной бане 8 мин. Суспензию центрифугируют 10 мин при 10000 g, после чего супернатант анализируют методом электрофореза и иммуноблоттинга с использованием антител к HBsAg/ayw. В качестве стандарта используют очищенный белок HBsAg/ayw. В дорожках соответствующих штаммам, которые синтезируют HBsAg/ayw, выявляется полоса на уровне 24-27 кДа такая же, как и в случае очищенного белка.
Пример 7. Определение последовательности гена HBsAg/ayw в геноме дрожжей.
Суспендируют 2-3 мкг клеток анализируемого штамма в 0,1 мл 0,25% раствора додецилсульфата натрия и инкубируют на кипящей водяной бане в течение 5 мин. Клетки осаждают центрифугированием при 10000 g 5 мин. 1 мкл полученного супернатанта добавляют к смеси, содержащей олигонуклеотиды МОХ и TRP по 1 мкМ, ThermoPol буфер (10 mM KCI, 20 mМ tris-HCI рН 8.8, 10 mM (NH4)2SO4, 2 mM MgSO4, 0,1% Triton X-100, 250 uM dNTP) и 5 единиц активности Vent полимеразы. Реакционную смесь инкубируют в течение 30 циклов изменения температуры. Каждый цикл включает инкубацию при 95°С в течение 30 сек, при 50°С 30 сек, при 72°С 2 мин. После этого продукты реакции разделяют электрофоретически в 1% агарозном геле и изолируют фрагмент размером 800 пар оснований. Фрагмент секвенируют с использованием праймеров МОХ и TRP. Совпадение результатов секвенирования с исходной последовательностью показывает отсутствие мутаций в интегрированном в геном дрожжей гене HBsAg/ayw.
Пример 8. Выделение HBsAg(ayw) из клеток Pichia angusta (H. polymorpha).
После ферментации исходного штамма дрожжей Pichia angusta (H. polymorpha) HBsAg выделяют согласно общепринятой методике по следующей схеме. Клетки из культуральной жидкости осаждают центрифугированием при 4000 g на центрифуге Beckman. Осажденную биомассу ресуспендируют до концентрации 250 г влажных клеток на 1 литр в буфере экстракции PBS рН 6.8 с добавлением EDTA, PMSF и Tween-20. Далее клетки разрушают в мельнице Dyno-Mill типа KDL, используя стеклянные шары диаметра 0.5-0.7 мм. Основную массу нецелевых белков из полученного гомогенизата осаждают добавлением полиэтиленгликоля (PEG) до концентрации 4.5%. Осажденные белки отделяют центрифугированием. Полученный супернатант фильтруют на ультрафильтрах (500 кДа) Pellicon. При этом отделяются белки с мол. массой меньше 500 килоДальтон, а также удаляется PEG и раствор HBs антигена переводится в буфер PBS рН 6.7. Одновременно происходит концентрированно раствора, что существенно для следующей стадии абсорбции на стекло. Посадку HBsAg на макропористое стекло (МПС) осуществляют в колонках системы StreamLine, разработанной фирмой Pharmacia (Sweden). Для удаления неспецифически связанных белков колонку промывают тем же буфером PBS. Антиген элюируют карбонатным буфером (КБ) рН 9.5. Элюат концентрируют ультрафильтрацией и разделяют при помощи ультрацентрифугирования на зональном роторе (Beckman) в градиенте глицерин / сахароза. Полученные фракции анализируют на содержание HBsAg, используя РОПГА набор и фракции, содержащие антиген, объединяют и очищают гельфильтрацией на сорбенте Toyopearl HW-65 (ToyoSoda Corp., Japan). Чистоту полученного таким образом HBs антигена определяют методом SDS-PAGE. Если чистота продукта недостаточна (<95%), производят дополнительную очистку при помощи ионообменной хроматографии на сорбенте TSK-DEAE (ToyoSoda Corp., Japan). Выход антигена 25-30 мг с 1 л культуральной жидкости.
Полученный раствор HBsAg (ayw) анализируют рядом методов.
1. Антигенную активность измеряют наборами РОПГА (реакция обратной пассивной гемагглютинации эритроцитов) по методике производителя (НПО “Диагностические Системы”, Нижний Новгород) с использованием в качестве стандарта отраслевого стандартного образца активности HBsAg (ОСО 42-28-153-88), выпускаемого ГИСК им. Л.А.Тарасевича.
2. Чистота рекомбинантного HBsAg определяется электрофорезом в полиакриламидном геле в восстанавливающих условиях (SDS-PAGE) с окрашиванием серебром и Coomassie Brilliant Blue R-250. Чистота выделенного антигена не <95%.
3. Иммуноспецифичность антигена определяют методом иммуноблотинга. Первичные антитела для этой цели получали иммунизацией кролей рекомбинантным HBsAg (производства Комбиотех), восстановленным в присутствии 2% SDS и 5% меркаптоэтанола. Иммунными антисыворотками окрашивали иммуноблот с последующей визуализацией при помощи специфических антител к иммуноглобулинам кролей, коньюгированных с пероксидазой хрена, по методике улучшенной хемилюминисценции (ECL) (Amersham, UK). Рекомбинантный HBs антиген (ayw) представлен в виде полосы мономера 24-27 кДа и слабых полос димера и тримера.
Получение штамма дрожжей Pichia angusta (H. polymorpha) VKPM Y - 2412, (депонирован в ГНИИ Генетики. - продуцента поверхностного антигена вируса гепатита В (HBsAg/adw) проводят аналогично примерам 1-5 с той лишь разницей, что в работе используют следующие олигонуклеотиды:

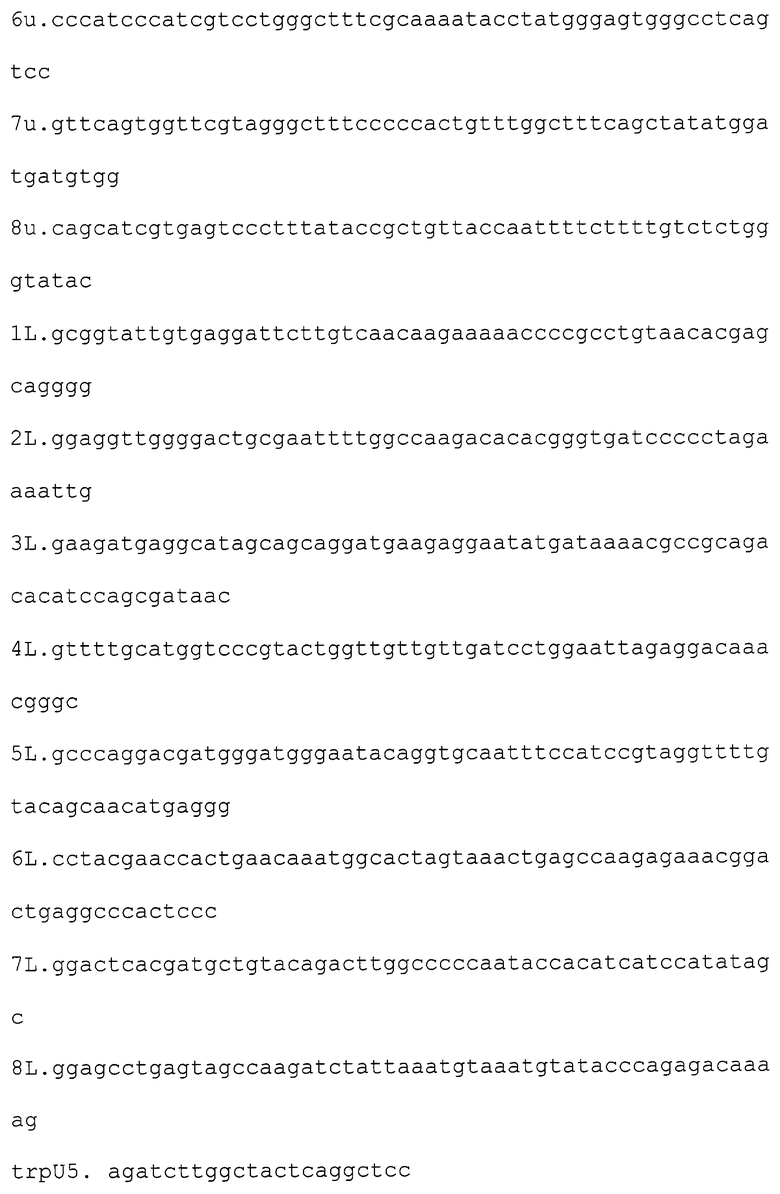

Выделение HBsAg/adw осуществляют аналогично примеру 8. Анализ выделенного HBsAg/adw проводят методами, описанными для антигена HBsAg/ayw.
Пример 9. Анализ способности штамма синтезировать HBsAg/adw. Тестируемый штамм засевают в среду YPD (1% дрожжевого экстракта, 2% пептона и 2% глюкозы) и инкубируют при 37°С в течение 15-20 часов в условиях высокой аэрации. Полученную культуру разводят в пять раз средой YPM (1% дрожжевого экстракта, 2% пептона и 2% метанола) и инкубируют в тех же условиях в течение 30-50 часов. Клетки из 0,5 мл культуры собирают центрифугированием, суспендируют в 0,2 мл дистиллированной воды, добавляют 0,2 мл 0,2 М NaOH и инкубируют 3-4 мин. Затем клетки осаждают, ресуспендируют в сэмплбуфере и инкубируют на кипящей водяной бане 8 мин. Суспензию центрифугируют 10 мин при 10000 g, после чего супернатант анализируют методом иммуноблоттинга с использованием антител к HBsAg/adw. В качестве стандарта используют очищенный белок HBsAg/adw.
Пример 10. Определение последовательности гена HBsAg/adw в геноме дрожжей.
Суспендируют 2-3 мкг клеток анализируемого штамма в 0,1 мл 0,25% раствора додецилсульфата натрия и инкубируют на кипящей водяной бане в течение 5 мин. Клетки осаждают центрифугированием при 10000 g 5 мин. 1 мкл полученного супернатанта добавляют к смеси содержащей олигонуклеотиды МОХ и TRP по 1 мкМ, ThermoPol буфер (10 mM KCI, 20 mМ tris-HCI рН 8.8, 10 mM (NH4)2SO4, 2 mM MgSO4, 0,1% Triton X-100, 250 uM dNTP) и 5 единиц активности Vent полимеразы. Реакционную смесь инкубируют в течение 30 циклов изменения температуры. Каждый цикл включает инкубацию при 95°С в течение 30 сек, при 50°С 30 сек, при 72°С 2 мин. После этого продукты реакции разделяют электрофоретически в 1% агарозном геле и изолируют фрагмент размером 800 пар оснований. Фрагмент секвенируют с использованием праймеров МОХ и TRP и определяют отсутствие мутаций путем сравнения результатов с исходной последовательностью.
Полученные штаммы имеют видовые названия Pichia angusta (Hansenula polymorpha), наименование штаммов VKPM Y - 2412 (HBsAg/adw) и VKM Y-2924D (HBsAg/ayw).
Культурально-морфологические особенности штаммов:
клетки округлой формы, небольшие по размеру;
на агаризованной среде YPD образуют крупные круглые колонии с выраженной выпуклой серединой.
Активность штаммов - не менее 30 мг/л культуральной жидкости.
Хранение при - 70°С в виде суспензии клеток в стерильном (30-50)%-ном растворе глицерина.
Генетические особенности:
ауксотроф по лейцину, фаги у дрожжей не обнаружены.
Штаммы не являются зоопатогенными или фитопатогенными.
Способ определения активности: в осветленном гомогенизате клеток методом иммуноферментного анализа.
Способ, условия и состав сред для размножения штаммов:
инкубирование прокачиванием при 30°С в питательной среде состава: 2% пептона, 1% дрожжевого экстракта, 2% глюкозы.
Условия и состав среды для ферментации: прокачивание при 29±1°С и рН 5,0-5,5 в среде, содержащей до 10-15% глицерина и соли.
Выделенные антигены вируса гепатита В серотипов ayw и adw используют для создания на их основе вакцин против гепатита В.
При этом получены вакцины в нескольких вариантах:
1) в составе композиции содержится антиген серотипа ayw и отсутствует консервант;
2) в составе композиции содержится антиген серотипа adw и отсутствует консервант;
3) в составе композиции содержится смесь антигенов двух серотипов ayw и adw в равных долях и отсутствует консервант;
4) получены варианты композиций, в составе которых могут присутствовать антигены различных серотипов или их смесь с дополнительным включением в составы консерванта - мертиолята.
Конкретные примеры композиций, полученных на основе выделенных антигенов.
1. Композиция для профилактики вирусного гепатита В содержит:
20 мкг HBsAg/ayw, полученного путем культивирования штамма дрожжей Pichia angusta (H. Polymorpha) VKM Y-2924D,
0,5 мг геля гидроокиси алюминия (в пересчете на Al3+),
до 1 мл фосфатно-солевого буфера (ФСБ),
представленного 50 mM Na - фосфатного буфера, рН 6,8 и 0,13 М NaCl.
2. Композиция для профилактики вирусного гепатита В содержит:
15 мкг HBsAg/adw, полученного путем культивирования штамма дрожжей
Pichia angusta (H. Polymorpha) VKPM Y - 2412,
0,3 мг геля гидроокиси алюминия (в пересчете на Al3+),
до 1 мл - ФСБ (50 mM Na - фосфатный буфер, рН 6,8 и 0.13 М NaCl).
3. Композиция для профилактики вирусного гепатита В содержит:
10 мкг HBsAg/ayw, полученного путем культивирования штамма дрожжей
Pichia angusta (H. Polymorpha) VKM Y-2924D,
0,5 мг геля гидроокиси алюминия (в пересчете на Al3+),
до 1 мл - ФСБ (50 mM Na - фосфатный буфер рН 6,8 и 0,13 М NaCl).
4. Композиция для профилактики вирусного гепатита В содержит:
25 мкг HBsAg/ayw, полученного путем культивирования штамма дрожжей Pichia angusta (H. Polymorpha) VKM Y-2924D,
0,6 мг геля гидроокиси алюминия (в пересчете на Al3+),
70 мкг мертиолята, до 1 мл ФСБ (50 mM Na - фосфатный буфер, рН 6,8 и 0,13 M NaCl).
5. Композиция для профилактики вирусного гепатита В содержит:
8 мкг HBsAg/adw, полученного путем культивирования штамма дрожжей Pichia angusta (H. polymorpha) VKPM Y - 2412,
8 мкг HBsAg/ayw, полученного путем культивирования штамма дрожжей
Pichia angusta (H. polymorpha) VKM Y-2924D,
35 мкг мертиолята,
0,5 мг геля гидроокиси алюминия (в пересчете на Al3+), до 1 мл ФСБ (50 mM Na - фосфатный буфер, рН 6,8 и 0,13 М NaCl)
Согласно изобретению композиции на основе выделенных антигенов можно получать как с введением в их состав консерванта - мертиолята, так и без него.
Отсутствие в составах консерванта не сказывается на качестве получаемых вакцин.
Установлено, что отсутствие в вакцинах химического реагента делает композиции более предпочтительными для введения детскому контингенту, снижая риск возникновения отдельных аллергических реакций.
Для детей готовят вакцины в прививочной дозе 0,5 мл. Содержание ингредиентов в готовых вакцинах может варьировать в следующих пределах (в 1 мл продукта):
HBsAg 20±5 мкг
Гидроокись алюминия 0,3-0,6 мг (в пересчете на Al3+)
Мертиолят 30-70 мкг
Содержание HBsAg в готовых вакцинах определяют методом иммуноферментного анализа с использованием наборов AUSZYME MONOCLONAL (Abbot Diagnostics, Иллинойс, США).
Иммуногенность вакцин в тесте на мышах линии Balb/c с массой 12-14 г составляет 0,05 - 0,1 мкг в расчете на ED 50 (доза вакцины, вызывающая сероконверсию у 50% мышей).
Известно, что медицинский персонал лечебно-профилактических учреждений относится к категории особого риска заражения, для которой вирусный гепатит В является профессиональным заболеванием, в связи с чем специфическая иммунопрофилактика является необходимой мерой.
По результатам предварительного скрининга маркеры инфицирования вирусом гепатита В отмечаются у значительной части сотрудников стационара, работающих с пациентами, больными гепатитом В: HBsAg - 7,4%; Anti-HBs - 22,6%; Anti-HBc - 37,8%.
В стационаре за несколько лет иммунизировано 2872 сотрудника, вакцинацию которых вакциной, полученной согласно изобретению, проводили по результатам предварительного скрининга при отсутствии у них маркеров инфицирования вирусом гепатита В в сыворотке крови. Иммунизацию проводили по известной стандартной схеме. (0-1-6 мес). Уровень anti-HBs в сыворотках крови после вакцинации определяли индивидуально методом количественного иммуноферментного анализа, используя наборы “Anti-HBsEIA”, фирмы “Hoffman - La Roche Ltd” (Швейцария) и отраслевой стандартный образец anti-HBs антигена вируса гепатита В (anti-HBsAg) (OCO-42-2815488).
По результатам исследований, проведенных через 3 месяца в группе вакцинированных по стандартней схеме, средняя геометрическая титров составила - 1783,5±73,5 ME, т.е. отмечена высокая иммунологическая эффективность.
Частота сероконверсий составляла от 93,8 до 98,5%.
Результаты исследований также свидетельствуют, что при анализе поствакцинального ответа подавляющая часть иммунизированных имели уровни специфического иммунитета более 500 МЕ/л - 75,5%.
В результате проведенной иммунопрофилактики не выявлено в дальнейшем ни одного вновь зарегистрированного случая заболевания или инфицирования вирусом гепатита В сотрудников, получивших курс вакцинации.
Изобретение относится к биотехнологии, а именно генной инженерии. Предложены рекомбинантные вакцины для профилактики вирусного гепатита В. Вакцины созданы на основе антигенов серотипов adw и ayw, полученных из штаммов дрожжей Pichia angusta VKPM Y - 2412 и VKM Y-2924D. Рекомбинантные вакцины для профилактики вирусного гепатита В содержат эффективное количество поверхностного антигена вируса гепатита В, адъювант и физиологически приемлемый разбавитель. Вакцины могут содержать антиген либо одного из серотипов, либо в равных количествах смесь серотипов adw и ayw. Полученные вакцины являются высокоиммуногенными, нетоксичными, не обладающими побочными эффектами препаратами. 3 н. и 3 з.п. ф-лы.
| СПОСОБ ПОЛУЧЕНИЯ ОЧИЩЕННЫХ ЧАСТИЦ ПОВЕРХНОСТНОГО АНТИГЕНА ГЕПАТИТА В, ОЧИЩЕННАЯ ЧАСТИЦА ПОВЕРХНОСТНОГО АНТИГЕНА ГЕПАТИТА В ЧЕЛОВЕКА И ВАКЦИНА ПРОТИВ ГЕПАТИТА В | 1990 |
|
RU2080876C1 |
| КОМБИНИРОВАННАЯ ВАКЦИНА НА ОСНОВЕ ПОВЕРХНОСТНОГО АНТИГЕНА ВИРУСА ГЕПАТИТА В, СПОСОБ ЕЕ ПОЛУЧЕНИЯ И СПОСОБ ПРЕДУПРЕЖДЕНИЯ ИНФЕКЦИИ ГЕПАТИТА В У ЧЕЛОВЕКА | 1993 |
|
RU2160120C2 |
| РЕКОМБИНАНТНАЯ ПЛАЗМИДНАЯ ДНК PDES20, КОДИРУЮЩАЯ ПОВЕРХНОСТНЫЙ АНТИГЕН ВИРУСА ГЕПАТИТА В (HBSAG/AYW), ШТАММ ДРОЖЖЕЙ SACCHAROMYCES CEREVISIAE, СОДЕРЖАЩИЙ РЕКОМБИНАНТНУЮ ПЛАЗМИДНУЮ ДНК PDES20 - ПРОДУЦЕНТ ПОВЕРХНОСТНОГО АНТИГЕНА ВИРУСА ГЕПАТИТА В (HBSAG/AYW) | 1996 |
|
RU2088664C1 |
| US 6099840 08.08.2000. | |||
Авторы
Даты
2004-10-20—Публикация
2003-03-14—Подача