Изобретение относится к новым производным пиразолилуксусной кислоты.
Известны α -(пиразол-5-ил)- b -метоксиакрилаты, замещенные в положение 4 пиразольного кольца некоторыми арилметоксигруппами (EP-A-0433899). Указанные соединения были предложены в качестве сельскохозяйственных фунгицидов.
Задачей изобретения является создание новых производных пиразола, обладающих фунгицидной активностью и являющихся эффективными против фитопатогенов.
Поставленная задача достигается новыми производными пиразола общей формулы I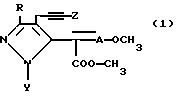
где
R представляет H, C1-4 алкил или CF3;
Y представляет C1-4алкил;
A представляет азот или CH; и
Z представляет C1-6-алкил, нафтил или фенил, необязательно замещенный 1-2 заместителями, выбранными из галоида, C1-4-алкила, C1-4-алкокси, трифторметила, которые оказались эффективными против фитопатогенов.
Особенно предпочтительными соединениями формулы I являются соединения формулы I, где Z представляет собой хлорфенил, фторфенил, метоксифенил, метилфенил, трифторметилфенил, дихлорфенил, хлорметоксифенил, хлорметилфенил.
Предпочтительными также являются соединения общей формулы I, в которой R представляет собой CF3 или CH3, Y представляет CH3, а Z - фенил или моно- или дизамещенный фенил, где заместители выбирают из галоида, C1-4-алкила, C1-4-алкокси и CF3.
Наиболее предпочтительными являются соединения, выбранные из метил- α -(1,3-диметил-4-(4-фторфенилэтинил)-5-пиразол)- b -метоксиакрилата; метил- a -(1,3-диметил-4-(3-трифторметилэтилфенилэтинил)-5-пиразол-)- b -метоксиакрилата, метил- a -(1,3-диметил-4-(3-хлор-4-метоксифенилэтинил)-5-пиразол)- b -метоксиакрилата, метил- a -(1-метил-3-фторметил-4-(4-хлорфенилэтинил)-5-пиразол)- b -метоксиакрилата.
Соединения формулы (I) получают O-метилированием соединения формулы II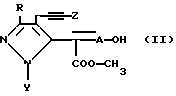
где A, R, Y и Z как определены выше.
O-метилирование можно выполнять известным способом per se для получения 3-метоксиакрилатов, использующих обычные агенты метилирования.
Соответствующими агентами метилирования являются метилиодид и диметилсульфат.
O-метилирование обычно выполняют в присутствии оснований.
Температура реакции находится в области от 0oC до температуры кипения реакционной среды, например, при температуре окружающей среды. Могут быть использованы инертные растворители.
Примеры соответствующих оснований включают гидроокиси щелочных металлов, такие как гидроокись натрия, гидриды щелочных металлов, такие как гидрид натрия, алкоголяты щелочных металлов, такие как метилат натрия, карбонаты щелочных металлов, или гидрокарбонаты щелочных металлов, такие как карбонат калия или гидрокарбонат натрия.
Соответствующими инертными растворителями являются ароматические углеводороды, такие как бензол и толуол; эфиры, такие как диэтиловый эфир, тетрагидрофуран и 1,2-диметоксиэтан; полярные растворители, такие как диметилформамид, диметилсульфоксид, вода, спирты, такие как метанол; ацетон или смеси, содержащие два или более указанных растворителя.
Желаемый конечный продукт выделяют и подвергают очистке известными способами, например, выпариванием растворителя, хроматографированием и кристаллизацией. Производные пиразола формулы I являются основаниями по своей природе. Они могут образовывать соли с достаточно сильными кислотами, такими как HCl и HBr.
Соединения формулы II, где A представляет -CH, могут быть получены реакцией соединений формулы III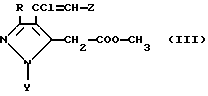
где P, Y и являются заместителями, как они определены выше, с метилформиатом в присутствии основания.
Эта реакция является по существу реакцией Кляйзена и может быть выполнена при условиях известных для такой реакции.
Соединения формулы II, где A представляет -N, могут быть получены реакцией соединений формулы II, с низшими алкилнитритами в присутствии основания. Алкилнитрилы согласно изобретению предпочтительно выбраны из C1-C5 алкилнитритов. Примерами соответствующих нитрилов являются изо-амилнитрит или трет-бутилнитрит.
Реакция (III _→ II) может быть выполнена в инертном растворителе, которые используются для реакции O-метилирования соединений формулы (II).
В качестве оснований используют такие типичные основания, используемые для реакции Кляйзена, как алкоголяты щелочных металлов, например, метилат натрия и гидриды щелочных металлов, например, гидрид натрия.
Температура реакции может варьировать в широкой области, например, от 0oC до температуры кипения реакционной смеси и предпочтительно используется температура окружающей среды.
Эфиры уксусной кислоты формулы III могут быть получены из соединения формулы IV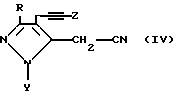
где R, Y и Z являются заместителями, как они определены выше, алкоголизом соляной кислотой в присутствии метанола.
Соединения формулы IV могут быть получены известным способом per se из известных соединений, например, аналогично способу, описанному в примерах, приведенных ниже.
Например, соединения формулы IV, где R представляет CF3, могут быть получены обработкой соединения формулы V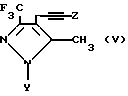
металлирующим агентом, таким как н-бутиллитий, и нейтрализацией промежуточного продукта двуокисью углерода и этерификацией свободной кислотной группы метанолом.
Соединения формулы (I) являются эффективными против фитопатогенов.
Их преимущественная фунгицидная активность установлена тестами in vivo с концентрациями от 0.5 до 500 мг активного ингредиента/л против Uromyces appendicu-latus на стеблях фасоли, против Puccinia triticina на пшенице и против Sphaerotheca fuliginea на огурцах, против Erysiphe graminis на пшенице и ячмене, против Podospaеra leucotricha на яблонях, против Uncinula necator на виноградной лозе, против Leptosphaeria nodorum на пшенице, против Cochliobolus sativus и Pirenophora graminea на ячмене, против Venturia sativus на яблонях, против Phytophthora infestans на томатах и против Plasmopara viticola на виноградной лозе.
Многие соединения формулы I обладают превосходной толерантностью с растениями и обладают системным действием. Соединения изобретения поэтому предназначены для обработки растений, семян и почв для борьбы с фитопатогенными грибами, например Basidiomycetes из отряда Uredinales (ржавчины), такие как Puccinia spp. Hemileia spp. Uromyces spp. и Ascomycetes из отряда Erisiphales (настоящей мучнистой росой, такой как Erysiphe spp. Podosphaera spp. Unsinula spp. Sphaerotheca spp. так же как Cochliobolus, Pirenophora spp. Venturia spp. Mycosphaerella spp. Leptosphaeria, Deuteromycetes, такие как Pyricularia, Pellicularia (Corticium), Botrytis и Oomycetes, такие как Phytophthora spp. Plasmopara spp.
Соединения формулы (I) являются особенно эффективными против мучнистой росы и грибковой ржавчины, в частности, против патогенов односемядольных растений, таких как злаки, включая пшеницу.
Количество применяемых соединений изобретения будет зависеть от различных факторов, таких как применяемое соединение, объект обработки (растение, почвы, семена), типа обработки (например, опрыскивание, опудривание, инкрустация семян), цели обработки (профилактика или терапия), типа обрабатываемых грибов и времени применения.
В общем получают удовлетворительные результаты, если соединения изобретения применяют в количествах от 0,0005 до 2,0 кг/га, предпочтительно от 0,01 до 1 кг/га, в случае обработки растений или почвы, например, 0,04 до 0,500 кг активного ингредиента (а.и.) на 1 га на полевых культурах, таких как злаки, или концентрации от 4 до 50 г а.и, на 1 гл в сельскохозяйственных культурах, таких как фрукты, виноградники и овощи (при применении объема от 300 до 1000 л/га в зависимости от размера или объема листа сельскохозяйственной культуры, которая эквивалентна норме применения приблизительно 30-500 г/га). Обработка может, если желательно, быть повторена, например, с интервалами от 8 до 30 дней.
Там, где соединения изобретения используют для обработки семян, получают в общем удовлетворительные результаты, если соединения используют в количествах от 0,05 до 0,5, предпочтительно от 0,1 до 0,3 г/кг семян.
Термин почва, как его используют здесь, предполагает охватить любую обычную растущую среду, натуральную или искусственную.
Соединения изобретения могут быть использованы для большого числа культур, таких как соевые бобы, кофе, декоративные культуры (например, пеларгония, розы), овощи (например, горох, огурцы, сельдерей, томаты и бобовые растения), сахарная свекла, сахарный тростник, хлопок, лен, маис (зерно), виноградники, мягких и жестких фруктах (например, яблоки, груши, сливы) и злаковые (например, пшеница, овес, ячмень, рис).
Предпочтительно соединения формулы I имеют один, предпочтительно более чем один и более предпочтительно все следующие заместители; R представляет CF3 или CH3; Y представляет CH3 и Z представляет фенил, незамещенный или моно- или дизамещенный заместителями, выбранными из галоида, C1-4алкил, C1-4алкокси и CF3.
Следующие примеры далее иллюстрируют изобретение. Все значения температур представлены в градусах. Величины Rf получены тонкослойной хроматографией на силикагеле, если не оговорено особо.
Пример 1. Метил α -(1-метил-4-фенилэтинил-5-пиразол)- b -метоксиакрилат.
К раствору метил a -(1-метил-4-фенилэтинил-5-пиразол) -b -гидроксипропионату (52 г) в диметилформамиде (200 мл) добавляют K2CO3 (50 г, 0,36 моль) и метилиодид (51 г, 0,36 моль) и смесь перемешивают в течение 3 ч при 25oC. Реакционную смесь разбавляют эфиром и фильтруют. Фильтрат промывают солевым раствором, сушат над MgSO4, фильтруют и концентрируют при пониженном давлении. Полученную таким образом смесь 12% I E/Z основного соединения хроматографируют на силикагеле (элюэнт:гексан/этилацетат 1:1) с образованием индивидуальных E- и Z -изомеров, E-изомер получают в виде масла; Z изомер имеет т.пл. 70-72oC.
1H-ЯМР (CDCl3):
E: 7.74 (с, 1H), 7.63 (с, 1H), 7.45-7.25 (м, 5H), 3.93 (с, 3H), 3.73(с, 3H), 3.70 (с, 3H).
Z: 7.63 (с, 1H), 7.45-7.25 (м, 5H), 6,96(с, 1H), 4.02(с, 3H), 3.77 (с, 3H), 3.73 (с, 3H).
Пример 2. Метил a -[1,3-диметил-4-фенилэтинил)-5-пиразол] b -метоксиакрилат.
Следуя процедуре примера 1 получают E- и Z-изомеры названного соединения из соответствующего b -гидроксипропионата.
E-изомер имеет т.пл. 103-105oC и Z-изомер имеет т.пл. 109-110oC.
1H-ЯМР (CDCl3).
E: 7.73 (с, 1H), 7.45-7.25 (м, 5H), 3,96 (с, 3H), 3.75 (с, 3H), 3.66 (с, 3H), 2,35 (с, 3H).
Z: 7.45-7.25 (м, 5H), 6.94 (с, 1H), 4.00 (с, 3H), 3.77 (с, 3H), 3.73 (с, 3H).
Пример 3. Метил a -[1-метил-3-трифторметил-4-(-4-фторфенилэтинил)-5-пиразол] a метоксииминоацетат.
0,9 г 80%-ной суспензии NaH (0,03 моль) растворяют в смеси 30 мл 1,2-диметоксиэтана и 1 мл метанола при 20oC. этой смеси по каплям добавляют раствор 3,0 г (0,01 моль) метил a -[метил-3-фторметил-4-(4-фторфенилэтинил)-5-пиразол] ацетата в 2,7 мл (0,02 моль) изо-амилнитрита. Через 15 мин добавляют 5 мл метилиодида. Реакционную смесь перемешивают в течение 1 ч 25oC, затем разбавляют диэтиловым эфиром и промывают солевым раствором. Органическую фазу отделяют, сушат MgSO4 и концентрируют. Остаток хроматографируют на силикагеле (элюэнт:гексан/этилацетат 1:1) получая чистый метил a -[1-метил-3-трифторметил-4-(4-фторфенилэтинил)-5- пиразол] a -метоксииминоацетат в форме бесцветных кристаллов с т.пл. 101-105oC.
1H-ЯМР (CDCl3): 7.46-6.98 (м, 4H аром.), 4.20 (с, 3H, OCH3), 3.92 (с, 3H, OCH3), 3,81 (с, 3H, NCH3).
Промежуточные соединения
Пример 4. Метил a -(1-метил-4-фенилэтинил-пиразолил)- b -гидроксипропионат.
Метил a -[1-метил-4-(1-фенил-2-хлор-2-этенил)-5-пиразолил]-ацетат (80 г, 0,28 моль) растворяют в метилформиате (метилмуравьином эфире) (300 мл) и добавляют к суспензии NaH (30 г, 80% в масле, 1 моль) в 1,2-диметоксиэтане (800 мл) и метаноле (1 мл) таким образом, чтобы температура реакции не превышала 30oC. Через 16 ч, смесь выливают в лед и органические растворители откачивают при пониженном давлении. Водную фазу промывают диэтиловым эфиром и затем подкисляют разбавленной соляной кислотой. Названное соединение экстрагируют диэтиловым эфиром и концентрируют и используют так, как в примере 1.
Пример 5. Метил-альфа -(1,3-диметил-4-фенилэтинил-5-пиразолил)- b -гидроксипропионат.
Следуя процедуре примера 4 получают метил a -(1,3-метил4-фенилэтинил-5-пиразолил)- b -гидроксипропионат из метил a -[1,3-метил-4-1-фенил-2-хлор-2-этенил)-5-пиразолил] ацетата.
Пример 6. Метил a -(1-метил-4-(1-фенил-2-хлор-2-этенил)-5-пиразолил)ацетат,
a) 1-метил-4-фенилэтинилпиразол.
К раствору 1-метил-4-йодпиразола (208 г, 1 моль) и фенилацетилена (112 г, 1,1 моль) в диизопропиламине (2 л) добавляют в атмосфере азота йодид меди (2 г), трифенилфосфин (0,1 г) и бис-(трифенилфосфин)палладийхлорид (0,5 г). Смесь выдерживают в течение 3 ч при температуре около 35oC и затем нагревают в течение 1 ч при 90oC. Охлажденную реакционную смесь разбавляют этилацетатом и фильтруют. Концентрируют фильтрат и получают дистиллат названного соединения с т.кип. 116-118oC/0,3 мбар, т.пл. 70-72oC.
b) 5-формил-1-метил-4-фенилэтинилпиразол.
К раствору соединения примера 6а (100 г, 0,55 моль) в абсолютном тетрагидрофуране (600 мл) добавляют по каплям при -50oC, н-бутиллитий (400 мл, 1,6 М в гексане). К суспензии литиевой соли через 30 мин добавляют диметилформамид (100 мл) таким образом, чтобы температура не превышала -40oC. Затем через 30 мин прозрачный раствор выливают в разбавленную соляную кислоту и откачивают органические растворители при пониженном давлении. Кристаллы отфильтровывают и сушат (т.пл. 90-91oC).
c) 5-гидроксиметил-1-метил-4-фенилэтинилпиразол
Альдегид примера 6b (100 г, 0,48 моль) добавляют 10 порциями к охлажденному раствору дигидро-бис-(2-метоксиэтокси) алюмината натрия (75 мл, 3,5 М в толуоле, 0,25 моль) в 1,2-диметоксиэтане (250 мл). Через 30 мин смесь осторожно выливают в холодную разбавленную соляную кислоту. Продукт отфильтровывают и сушат (т.пл. 143-145oC).
d ) 5-хлорметил-1-метил-4-фенилэтинилпиразол
К суспензии спирта примера 6c (100 г, 0,48 моль) в дихлорметане (1 л) добавляют по каплям при комнатной температуре тионилхлорид (30 мл, 0,5 моль). Через 10 ч реакционную смесь переводят в щелочную форму водным раствором карбоната натрия. Получают продукт в виде масла.
1H-ЯМР (CDCl3): 7,62 (с, 1H, пиразол), 7,55-7,32 (м, 5H, аром.), 4.95 (с, 2H, CH2), 3.96 (с, 3H, NMe).
e) (1-метил-4-фенилэтинил-5-пиразолил) ацетонитрил
Раствор соединения примера 6d (104 г, 0,46 моль) в ацетонитриле (200 мл) добавляют по каплям при 80oC в течение 60 минут к суспензии KCN (55 г, 0,86 моль) и 18,6 краунэфира (5 г) в ацетонитриле. Затем через 60 мин реакционную смесь охлаждают, разбавляют эфиром и промывают солевым раствором. Полученный таким образом нитрил, после хроматографирования на силикагеле (гексан-этилацетат 2:1) имеет т. пл. 95-96oC (бесцветные кристаллы).
f) Метил a -[1-метил-4-(1-фенил-2-хлор-2-этенил)-5- пиразолил]ацетат
Ацетонитрил (73 г, 0,33 моль) растворяют в метаноле (700 мл) и раствор насыщают при комнатной температуре соляной кислотой. После 2 ч кипячения с обратным холодильником, большее количество растворителя откачивают при пониженном давлении. Остаток переводят в щелочную форму водным раствором Na2CO3 и экстрагируют диэтиловым эфиром. Органическую фазу сушат (MgSO4), отфильтровывают и концентрируют. Соединение применяют без дальнейшей очистки в способе примера 4.
1H-ЯМР (CDCl3): 7,44 (с. 1H, пиразол), 7,24-7,05 (м, 5H, аром.), 6,91 (с, 1H, винил), 3.83 (с, 3H, OMe), 3,57 (с, 2H, CH2), 3,52 (с, 3H, NMe).
Пример 7. Метил a-(1,3-диметил-4-(1-фенил-2-хлор-2- этенил)-5-пиразолил) ацетат.
а) 1,3-диметил-4-йод-5-пиразолкарбоновая кислота этиловый эфир
Этиловый эфир 1,3-диметил-5-пиразолкарбоновой кислоты (185 г, 1,1 моля), йод (140 г, 0,55 моль) и HJO3 (38,7 г, 0,22 моль) кипятят с обратным холодильником в ледяной уксусной кислоте (450 мл), воде (150 мл) и 1,2-дихлорэтане (150 мл) в течение 1,5 ч. Смесь обесцвечивается при насыщении бисульфитом натрия, упаривается при пониженном давлении и продукт экстрагируют эфиром. Органическую фазу промывают бисульфитом натрия и водным раствором бикарбоната натрия.
Органическую фазу сушат над MgSO4, фильтруют и концентрируют, получая указанное соединение с т.пл. 31-34oC.
b) Этиловый эфир 1,3-диметил-4-фенилэтинил-5-пиразолкарбоновой кислоты
Реакция соединения примера 7а с фенилацетиленом аналогично способу примера 6a дает это соединение с т.пл. 97-98oC.
c) 1,3-диметил-5-гидроксиметил-4-фенилэтинилпиразол
Реакция соединения примера 7b в условиях, аналогичных условиям примера 6c, дает спирт (т.пл. 120-121oC).
d) 5-хлорметил-1,3-диметил-4-фенилэтинилпиразол
Реакция соединения примера 7c в условиях, аналогичных условиям примера 6d, дает хлорид с т.пл. 74-77oC (бесцветные кристаллы).
e) (1,3-диметил-4-фенилэтинил-5-пиразолил)ацетонитрил
Реакция соединения примера 7d в условиях аналогичных условиям примера 6е дает нитрил с т.пл. 105-106oC.
f) Метил a -(1,3-диметил-4-(1-фенил-2-хлор-2-этенил)- 5-пиразолил)ацетат
Реакция соединения примера 7е в условиях, аналогичных условиям примера 6f, дает указанное соединение
1H-ЯМР (CDCl3): 7,24-7,01 (м, 5H, аромат.), 6,97 (с, 1H, винил), 3,78 (с, 3H, OMe), 3,62 (с, 2H, CH2), 3,55(с, 3H, NMe).
Пример 8. Метил a -[1-метил-3-трифторметил-4-(4-фторфенилэтинил-5-пиразол]ацетат
а) 1,5-диметил-3-трифторметилпиразол
486 мл (3,5 моль) ангидрида трифторуксусной кислоты по каплям добавляют к раствору 330 мл (3,5 моль) изопропенилметилового эфира в смеси 600 мл трет-бутилметилового эфира и 290 мл (3,5 моль) пиридина при температуре от 0 до 5oC. Через 30 мин реакции при 5oC смесь промывают 1 л воды и 0,5 л насыщенного раствора бикарбоната натрия. Органическую фазу отделяют и при температуре -20oC добавляют 180 мл метилгидразина по каплям. Смесь оставляют нагреться до комнатной температуры и затем сушат над MgSO4 и концентрируют при пониженном давлении. Остаток разгоняют, т.кип. 70oC (21 мбар), получая 498 г 1,5-диметил-3-трифторметилпиразола.
b) 1,5-диметил-3-трифторметил-4-йодпиразол.
Реакция соединения примера 8a в условиях, аналогичных условиям примера 7a, дает соединение с т.пл. 98-100oC.
c) 1,5-диметил-3-фторметил-4-(4-фторфенилэтинил)-пиразол
Реакция соединения примера 8b) с 4-фторфенилацетиленом в условиях, аналогичных условиям примера 6a, дает указанное соединение, имеющее т.пл. 61-62oC, т.кип. 135-140oC (0,05 мбар).
d) 94 мл (0,15 моль) 1,6 молярного раствора н-бутиллития в гексане добавляют по каплям при -50oC к раствору 35 г (0,12 моль) соединения примера 8c в 200 мл тетрагидрофурана. Полученный красный раствор выливают в измельченную твердую CO2. Органический растворитель упаривают и остаток обрабатывают водой подкисленной 20%-ной соляной кислотой и экстрагируют диэтиловым эфиром. Органическую фазу сушат над MgSO4 и концентрируют. Маслообразный остаток (приблизительно 35 г) растворяют в метаноле и смешивают с 18 мл (0,25 моль) тионилхлорида при 0oC. Через 3 ч реакции смесь концентрируют при пониженном давлении и получают 35 г сырого метил a -[1-метил-3-трифторметил-4-(4-фторфенилэтинил)-5-пиразол]ацетата.
Соединения, приведенные в табл.1,2 получают аналогичным образом.
Пример А. Активность против мучнистой росы Sphaerotheca fuliginea.
7-дневные растения Cucumis sativus (огурцов) (в стадии семядоли) опрыскивали до состояния, близкого к стеканию суспензией, содержащей 100 мг/л активного ингредиента. Нанесенной суспензии затем позволяют высохнуть. День спустя обработанные растения засевают спорами суспезний, содержащей 1•105/мл свежесобранных Conidia of Sphaerotheca fuliginea и затем помещают в теплицу на 7 дней при 24oC и относительной влажности 60%
Эффективность испытываемых соединений определяют сравнением степени грибковой атаки с растениями, которые не подвергались обработке с инокулированными выбранными растениями. В этих тестах соединения 1.05, 1.06, 1.10, 1.13 и 2.02 показывают эффективность более 90%
Подобный способ использовали для испытаний соединений против следующих патогенов: Podosphaera leucotricha на яблоне, Erysiphe graminis на пшенице и ячмене (сухая инокуляция), Uncinula necator на винограде.
Пример B: Активность против ржавчины, парши, пиреноформ и лептосфаерии (Leptosphaeria) Uromyces appendiculatus.
14-дневные растения Phaseolus vulgaris (фасоли) в (стадии двух листьев) опрыскивают до состояния, близкого к стеканию суспензией, содержащей 100 мг/л активного ингредиента. Затем нанесенной суспензии позволяют высохнуть. День спустя обработанные растения засевают спорами суспензией, содержащей 1•105/мл свежесобранных спор Uromyces appendiculatus. Инкубацию осуществляют в течение 3 дней в условиях высокой влажности камеры при 23oC и относительной влажности >95% и после этого в течение 10 дней при 24oC и относительной влажности 60%
Эффективность соединений определяют сравнением степени грибковой атаки с растениями, которые не подвергались обработке, и с инокулированными выбранными растениями. В этих тестах соединения 1.05, 1.06, 1.10, 1.13 и 2.02 показывают эффективность по крайней мере 90%
Подобный способ использовали для испытаний соединений против следующих патогенов: Puccinia triticina на пшенице (10-дневные растения), Pyrenophora graminea на ячмене, Leptosphaeria nodorum на пшенице Venturia inaequalis (21-дневные растения; споровая суспензия содержит 1% солода).
Пример C. Активность против ложной мучнистой росы,
Растения Lycopersicon esculentum (томаты) с 6 листьями опрыскивают до состояния близкого к стеканию суспензией, содержащей 500 мг/л активного ингредиента. Затем нанесенной суспензии позволяют высохнуть. День спустя обработанные растения засевают спорами суспензией, содержащей 1•105/мл свежесобранных Sporagnia Phitophthora infestans и затем осуществляют инкубацию в течение 7 дней в камере с высокой влажностью при 18oC и относительной влажности 95% Эффективность испытываемых соединений определяют сравнением степени грибковой атаки с растениями, которые не подвергались обработке и с инокулированными выбранными растениями.
Подобный способ используют для испытаний соединений против Plasmopara viticola на виноградной лозе.
Пример D. Активность после обработки семян. Соединения изобретения могут быть также использованы для обработки семян. Преимущественную фунгицидную активность устанавливают на тестах in vitro по следующим патогенам: Pyrenophora graminea, Ustilago nuda, Gerlachia nivalis, Leptosupaeria nodorum.
Семена пшеницы помещают в автоклав и засевают спорами или мицелием патогенов и покрывают различными концентрациями испытываемых соединений с конечной дозой 50 г активного ингредиента/100 кг семян. Обработанные семена помещают затем на агаровые пластины и позволяют патогенам расти в течение 3-8 дней при 24oC в темноте.
Эффективность испытываемых соединений определяют сравнением степени роста грибов, появляющихся из обработанных и необработанных инокулированных семян.
Для определения толерантности соединений и растения, здоровые семена пшеницы и ячменя покрывают вышеупомянутыми дозами испытываемых соединений. Затем семенам позволяют прорастать на чашках Петри на влажной фильтровальной бумаге в условиях высокой влажности в течение 10 дней при 18oC. Порчу растений регистрируют сравнением роста обработанных и необработанных проростков.
В этих тестах соединения 1.05, 1.06, 1.10 показывают эффективность по крайней мере 90% против Pyrenophora graminea.
| название | год | авторы | номер документа |
|---|---|---|---|
| ФЕНИЛЭТЕНИЛ- ИЛИ ФЕНИЛЭТИНИЛПРОИЗВОДНЫЕ В КАЧЕСТВЕ АНТАГОНИСТОВ ГЛУТАМАТНОГО РЕЦЕПТОРА | 2001 |
|
RU2284323C9 |
| СПОСОБ ПОЛУЧЕНИЯ ЗАМЕЩЕННЫХ ФТАЛИДОВ ИЛИ ГЕТЕРОЦИКЛИЧЕСКИХ ФТАЛИДОВ | 1991 |
|
RU2040522C1 |
| ПРОИЗВОДНЫЕ 3,5-ДИОКСО- 3,4,5,6- ТЕТРАГИДРООКСАЗИНОВ И СПОСОБ БОРЬБЫ С СОРНЯКАМИ | 1991 |
|
RU2013956C1 |
| АМИНОГУАНИДИНЫ, СПОСОБ ИХ ПОЛУЧЕНИЯ И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ИХ ОСНОВЕ | 1992 |
|
RU2095347C1 |
| ПИРРОЛКАРБОКСАМИДЫ И АМИДЫ ПИРРОЛТИОКАРБОНОВОЙ КИСЛОТЫ И ИХ ИСПОЛЬЗОВАНИЕ В АГРОХИМИИ | 2001 |
|
RU2294925C2 |
| ФУНГИЦИДНЫЕ СОЕДИНЕНИЯ | 2020 |
|
RU2817796C2 |
| ИНСЕКТИЦИДНЫЕ СОЕДИНЕНИЯ | 2008 |
|
RU2493148C2 |
| ПЕСТИЦИДНАЯ КОМПОЗИЦИЯ, СПОСОБ КОНТРОЛЯ ВРЕДИТЕЛЕЙ, СПОСОБ КОНТРОЛЯ ЭНДОПАРАЗИТОВ, ЭКТОПАРАЗИТОВ ИЛИ ОБОИХ И СПОСОБ УСИЛЕНИЯ ЖИЗНЕСТОЙКОСТИ РАСТЕНИЙ | 2011 |
|
RU2576316C2 |
| ПЕСТИЦИДНЫЕ КОМПОЗИЦИИ И СПОСОБЫ, ОТНОСЯЩИЕСЯ К НИМ | 2012 |
|
RU2605537C2 |
| ПЕСТИЦИДНЫЕ КОМПОЗИЦИИ | 2009 |
|
RU2513723C2 |



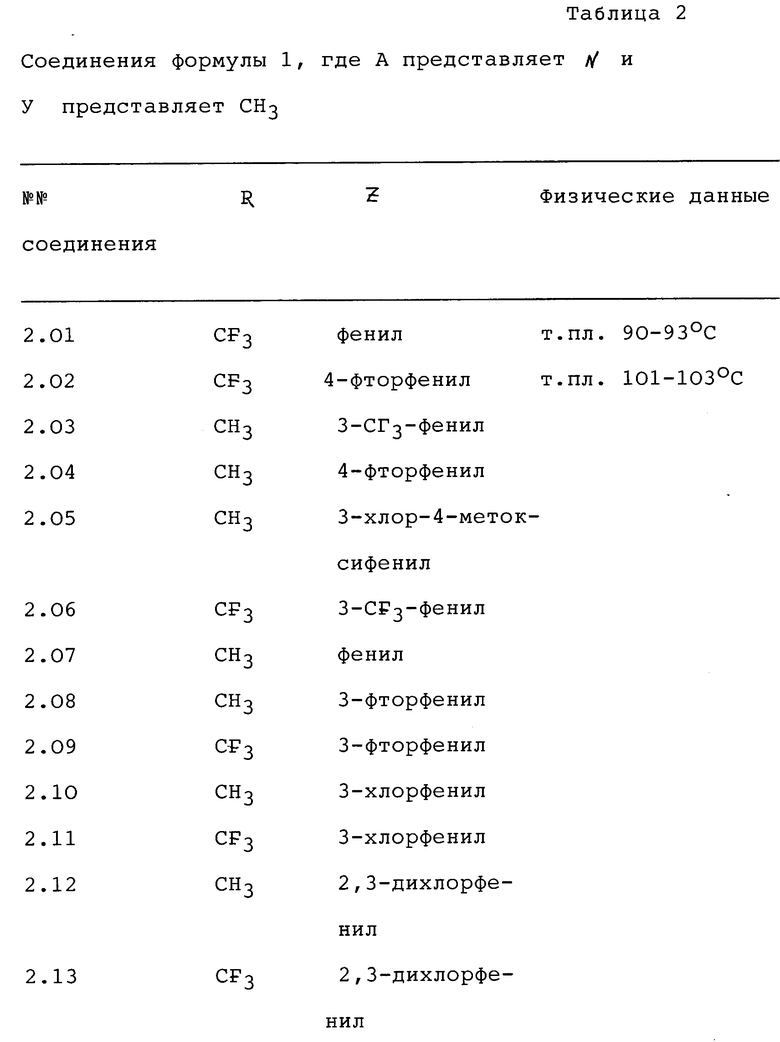
Использование: для борьбы против фитопатогенов. Сущность изобретения: производные пиразола формулы I ,
,
где R - H, C1-4-алкил, или CF3, Y - C1-4-алкил; A - азот или CH; Z - C1-6-алкил, нафтил или фенил, необязательно замещенный 1-2 заместителями, выбранными из галоида, C1-4-алкила, C1-4-алкокси, трифторметила. Реагент I: α -(1-метил-4-фенилэтинил пиразол)- β -метоксиакрилат. Условия реакции: перемешивание при 25oC в диметилформамиде в присутствии K2CO3 и метилиодида. 3 з.п.ф-лы, 2 табл.
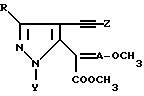
где R водород, C1 C4-алкил или CF3;
Y C1 C4-алкил;
A азот или CН;
Z C1 C6-алкил, нафтил или фенил, необязательно замещенный 1 2 заместителями, выбранными из галоида, C1 - C4-алкила, C1 C4-алкокси, трифторметила.
Приоритет по признакам:
13.05.92 при R Н, C1 C4-алкил, CF3; Y - C1-C4-алкил; A CH, Z C1-C6- алкил, нафтил или фенил, необязательно замещенный 1 2 заместителями, выбранными из галоида, C1 C4-алкила, C1 C4-алкокси, CF3.
| EP, патент, 483851, кл.C 07D 231/18, 1992. |
Авторы
Даты
1997-12-10—Публикация
1993-05-12—Подача