Изобретение относится к ветеринарной микробиологии, а именно, к конструированию бактериальных вакцин для профилактики стрептококкоза и пастереллеза нутрий.
Стрептококкоз, пастереллез и сальмонеллез наносят огромный ущерб нутриеводческим хозяйствам, регистрируются как в отдельности так и в ассоциации: погибает молодняк после отсадки (до 80%), самки абортируют во второй половине беременности (до 80%). При этом большие затраты дополняются нарушением технологии выращивания животных, а также за счет проведения ветеринарно-санитарных мероприятий при ликвидации этих болезней.
Сальмонеллез, стрептококкоз и пастереллез нутрий являются факторными болезнями этих животных. В связи с этим специфическая профилактика выше названных болезней необходима.
С целью профилактики сальмонеллеза применяется поливалентная вакцина против сальмонеллеза и калибактериоза пушных зверей. Биопрепарат вводят подкожно в области внутренней поверхности бедра щенкам нутрий с 30 - 45-дневного возраста трехкратно в дозах 0,25, 1,0 и 1,5 см3 с интервалом в 8 10 дней.
Через 14 дней после курса профилактики сальмонеллеза нутрий вакцинирует против стрептококкоза. Вводят внутримышечно формолгидрооксильалюминиевую вакцину против стрептококкоза нутрий двухкратно в области бедра в дозах 1,0 и 1,5 см3 с интервалом 6 дней не зависимо от возраста.
Через 14 дней после последнего введения биопрепарата против стрептококкоза нутрий вакцинируют против пастереллеза. С этой целью применяют сапонин-фармолвакцину строго внутримышечно, с внутренней поверхности бедра, двукратно в дозах 0,5 см3 и 1,0 см3 с интервалом 10 12 дней.
Курс специфической профилактики особо опасных инфекционных болезней для нутрий при применении моновакцин длительный (более 3 месяцев), и поэтому, несмотря на их высокую специфическую активность, падеж зверей отмечают от заболеваний, которые профилактируют в последнюю очередь.
Поэтому целью настоящего изобретения является конструирование иммуногенной ассоциированной вакцины против стрептококкоза и пастереллеза нутрий, чтобы существующую систему профилактических и оздоровительных мероприятий дополнить ассоциированной вакцинацией поголовья и добиться более эффективного эпизоотологического контроля стрептококкоза и пастереллеза нутрий.
Вакцину для профилактики стрептококкоза и пастереллеза нутрий готовили на основе штамма стрептококка серогруппы C N и пастерелл N 6011, 2394, 1015, которые выделены нами от павших нутрий и депонированы в коллекции штаммов микроорганизмов Всероссийского Государственного научно -исследовательского института контроля, стандартизации и сертификации ветеринарных препаратов.
Пример 1. Для изготовления 1-й серии вакцины против стрептококкоза и пастереллеза нутрий использовали отдельные ампулы с лиофилизированной культурой стрептококка серологической группы C штамма N К-ДЕП и пастерелл N 6011, 2394, 1015. Содержимое каждой ампулы в отдельности высевали на МПА с 1% глюкозы в 3 4 чашки Петри по следующей методике: 0,1 0,2 мл суспензии культуры штамма вносили на поверхность агара и стеклянным стерильным шпателем распределяли ее по поверхности агара. Этим же шпателем проводили по поверхности агара последовательно еще 3 чашек. Посевы на МПА инкубируют 48 ч при 37 37,5oC. Одновременно делают высевы на МПБ, МППБ под вазелиновым маслом и среду Сабуро по 2 пробирки с каждой средой и инкубировали при тех же температурных режимах (на среде Сабуро при 20 24oC) посевы на МППБ и на среде Сабуро 10 сут. а на МПБ 3 сут.
По истечении срока инкубации культуры с каждой питательной средой в отдельности проверяли на чистоту и характер роста визуальным просмотром, а также просмотром мазков, окрашенных по Граму. Рост культур на питательных средах должен быть характерным для возбудителей стрептококкоза и пастереллеза.
Из культур, выросших на чашках Петри, отбирают 2 3 колонии стрептококка и пастерелл в отдельности и высевали в МПБ с добавлением 1% глюкозы и инкубировали при температуре 37 37,5oC 18 22 ч. Проверяли частоту роста просмотром мазков, окрашенных по Граму, и высевают в МПБ с глюкозой (1%) во флаконы в соотношении 1:100.
Для приготовления маточной расплотки из флаконов или колб суточные бульонные культуры пересевали в подогретый до температуры 37-37,5oC МПБ с глюкозой (1% ) в 2,5-литровые баллоны из расчета 80-100 мл на 10 л. Посевы культивировали при температуре 37-37,5oC в течение 18-24 ч. К этому сроку концентрация бактериальной массы должна быть не ниже 4•109 м.к. в 1 мл.
Убедившись в частоте роста стрептококков и пастерелл, биомассы сливали в 20 литровые бутыли в соотношении 1:1 и добавляли 0,3% коммерческого формалина.
Инактивацию культур проводят в течение 48 часов при температуре 16-18oC, подвергая взбалтыванию каждый баллон до 3-4 раз в течение 60 мин.
После инактивации отбирают пробы культур из каждого баллона в отдельности для контроля полноты инактивации. С этой целью проводили посевы в пробирки на МПА, МПБ, МППБ под вазелиновым маслом. Посевы не должны иметь роста в течение 10 дней наблюдения.
По истечении срока инактивации и получения требуемых результатов контроля чистоты роста (полноты инактивации) в бактериальную массу вносили стерильный адъювант 3%-ный раствор гидроокиси алюминия (ГОСТ 18287-81) из расчета 15% к объему культуры. Второй адъювант сапанин добавляли из расчета 100 мг на 1 л. Адъюванты вносили при непрерывном взбалтывании бактериальной массы.
Примечание: 3% -ный раствор гидроокиси алюминия на физиологическом растворе стерилизуют в автоклаве при температуре 120oC в течение 30 мин.
Через 3 сут. после внесения адъюванта формировали серию вакцины, pH готовой вакцины должен быть в пределах 7,0-7,2.
Расфасовку вакцины производят по 20, 100, 200 мл в стерильные флаконы, которые закрывают алюминиевыми колпачками, обеспечивая герметичность укупорки содержимого флакона.
Полученная вакцина имеет следующий состав об.
а) корпускулярный антиген в культуральной жидкости, содержащей стептококки и пастереллы 18-22 часового роста в концентрации (4-5)•109 микробных клеток 1 см3 83,7
б) глюкоза 1,0
в) формалин 0,3
г) гидроокись алюминия до 100
Для определения качества сапонин-формолгидроокисьалюминиевой вакцины делали выборку из разных мест серии в количестве 10 флаконов, из которых 5 использовали для проведения испытаний, а 5 флаконов хранили в архиве в течение 12 месяцев.
Для определения внешнего вида, цвета, наличия посторонней примеси, хлопьев, плесени, неразбивающегося осадка флаконы с вакциной тщательно встряхивали и просматривали визуально в проходящем свете. Одновременно флаконы проверяли на герметичность укупорки и правильность этикетирования.
Концентрацию водородных ионов определяли электрометрическим методом, используя потенциометр марки ЛПУ-01 или другой прибор того же класса точности. Для испытания используют 3 флакона с вакциной. Содержимое каждого флакона испытывали отдельно. Определение pH вакцины проводят по инструкции, приложенной к потенциометру. Вакцина должна иметь pH в пределах 7,0-7,2.
Для проведения испытания на стерильность использовали 5 флаконов с вакциной. Посевы проводили из каждого флакона в две пробирки с МПА, МПБ, МППБ и среду Сабуро. Посевы проводят в объеме 0,2-0,3 мл вакцины. Питательные среды с посевами выдерживали в течение 10 дней, роста микрофлоры не отмечали.
Безвредность вакцины проводили на морских свинках массой 300-350 г и на белых мышах 16-18 г. Три флакона с вакциной встряхивали и из каждого флакона с вакциной с соблюдением стерильности отбирали 20-30 мл препарата, переносили в стерильный флакон, общую пробу использовали для определения безвредности и иммуногенности.
Для определения безвредности содержимое флакона тщательно встряхивали и вводили пяти морским свинкам подкожно в области спины в объеме 2 мл и десяти белым мышам подкожно в области спины в объеме 0,5 мл. Вакцина не вызывала заболевания и гибели морских свинок и белых мышей в течение десяти дневного срока наблюдения.
Для определения иммуногенной активности общую пробу вакцины во флаконе встряхивали и вводили 40-ти белым мышам массой 16-18 г подкожно с наружной стороны бедра в дозе 0,2 мл. Через 14 дней после иммунизации 40 вакцинированных и 40 контрольных белых мышей аналогичной массы заражали подкожно в области бедра подтитрованной десятикратной смертельной дозой вакцинных штаммов стрептококков и пастерелл в отдельности (по 20 мышей). Срок наблюдения 10 дней.
Вакцину считают иммуногенной, если она предохраняет от заболевания и гибели не менее 18 иммунизированных мышей в каждой опытной группе, при заболевании всех и гибели не менее 38 белых мышей в контрольных группах в течение 10 дней.
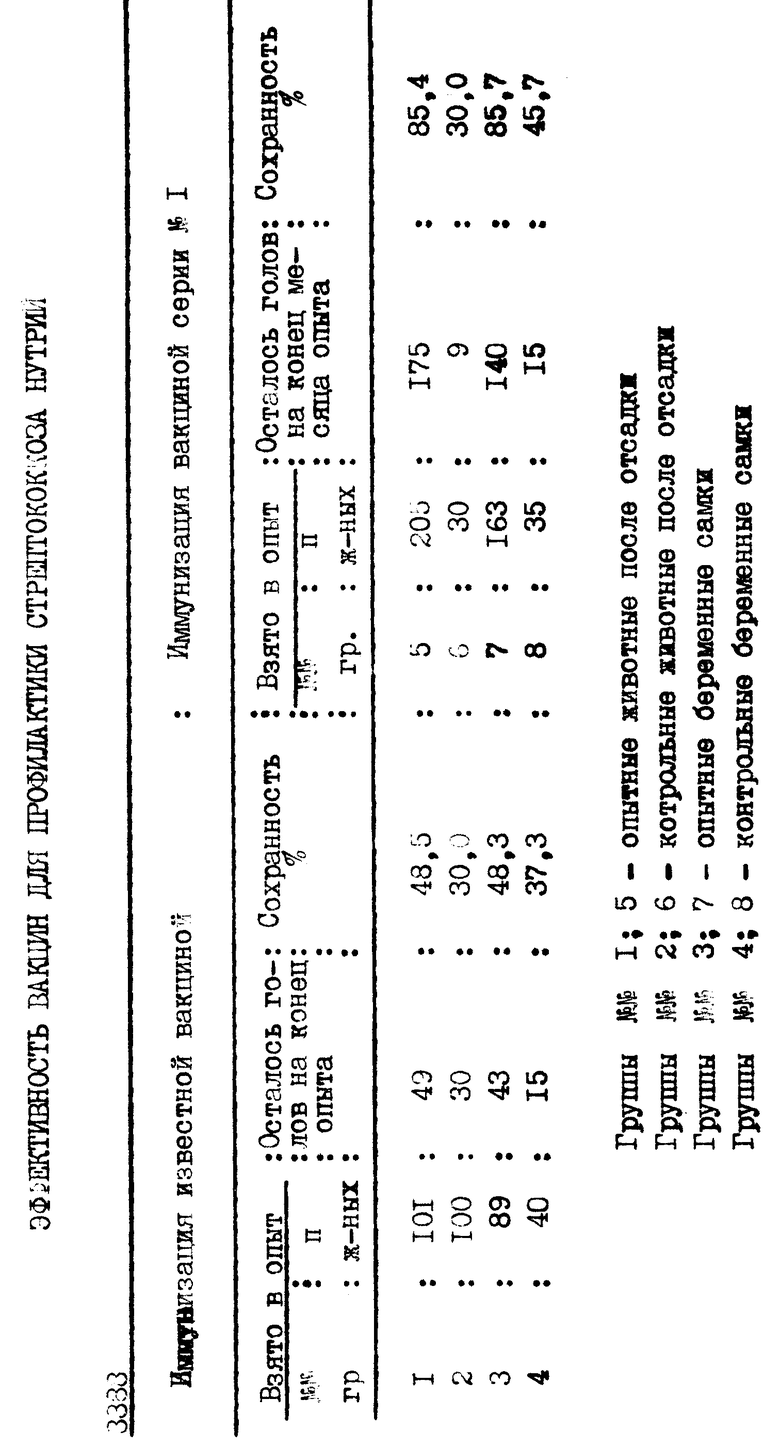
Полученную нами серию вакцины против стрептококкоза и пастереллеза нутрий и известную вакцину против диплококковой септицемии телят, ягнят и поросят мы испытали в производственных условиях (см. таблицу). Анализ полученных данных, представленных в таблице N 1, достоверно доказывает эффективность вакцины серии N 1, по сравнению с известной вакциной. Вакцины вводили внутримышечно в области бедра с внутренней стороны 1,0 и 1,5 с интервалом 7-10 дней. Вакцина серии N 1 безвредна, не вызывает осложнений у вакцинированных нутрий, обладает высокой активностью и профилактирует развитие клинических признаков стрептококкоза и гибель животных от болезни до 85,4%
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ ВАКЦИНЫ ПРОТИВ СТРЕПТОКОККОЗА И ПАСТЕРЕЛЛЕЗА НУТРИЙ | 1994 |
|
RU2099083C1 |
| ВАКЦИНА ПРОТИВ СТРЕПТОКОККОЗА НУТРИЙ | 1994 |
|
RU2099082C1 |
| СПОСОБ ПОЛУЧЕНИЯ ВАКЦИНЫ ДЛЯ ПРОФИЛАКТИКИ СТРЕПТОКОККОЗА НУТРИЙ | 1994 |
|
RU2099081C1 |
| ВАКЦИНА ПРОТИВ СТРЕПТОКОККОЗА КРУПНОГО РОГАТОГО СКОТА | 1998 |
|
RU2179861C2 |
| ШТАММ БАКТЕРИЙ STREPTOCOCCUS ZOOEPIDEMICUS, ИСПОЛЬЗУЕМЫЙ ДЛЯ ИЗГОТОВЛЕНИЯ ДИАГНОСТИЧЕСКИХ И ПРОФИЛАКТИЧЕСКИХ БИОПРЕПАРАТОВ ПРОТИВ СТРЕПТОКОККОЗА НУТРИЙ | 1994 |
|
RU2097422C1 |
| СПОСОБ ИЗГОТОВЛЕНИЯ ВАКЦИНЫ, АССОЦИИРОВАННОЙ ПРОТИВ СТРЕПТОКОККОЗА И ЭНТЕРОКОККОВОЙ ИНФЕКЦИИ НУТРИЙ | 2006 |
|
RU2301076C1 |
| СПОСОБ ИЗГОТОВЛЕНИЯ ВАКЦИНЫ, АССОЦИИРОВАННОЙ ПРОТИВ САЛЬМОНЕЛЛЕЗА И СТРЕПТОКОККОЗА НУТРИЙ | 2005 |
|
RU2292911C1 |
| ВАКЦИНА, АССОЦИИРОВАННАЯ ПРОТИВ САЛЬМОНЕЛЛЕЗА И СТРЕПТОКОККОЗА НУТРИЙ | 2005 |
|
RU2292912C1 |
| СПОСОБ ИЗГОТОВЛЕНИЯ ВАКЦИНЫ АССОЦИИРОВАННОЙ ПРОТИВ КОЛИБАКТЕРИОЗА, САЛЬМОНЕЛЛЕЗА, СТРЕПТОКОККОЗА И ЭНТЕРОКОККОВОЙ ИНФЕКЦИИ НУТРИЙ | 2006 |
|
RU2316345C1 |
| СПОСОБ ИЗГОТОВЛЕНИЯ ВАКЦИНЫ АССОЦИИРОВАННОЙ ПРОТИВ САЛЬМОНЕЛЛЕЗА И ЭНТЕРОКОККОВОЙ ИНФЕКЦИИ НУТРИЙ | 2005 |
|
RU2292914C1 |
Использование: ветеринарная микробиология, биотехнология, вакцина, профилактика стрептококкоза и пастереллеза нутрий. Сущность изобретения: для изготовления вакцины против стрептококкоза и пастереллеза нутрий раздельно выращивают штаммы Str. Zooepiolemicus ВГНКИ N К-ДЕП, P.multocida ВГНКИ N 6011, 2394, 1015. Выращенные культуры стрептококков и пастерелл объединяют в соотношении 1:1 и добавляют 0,3% раствор формалина. По истечении срока инактивации и получения требуемых результатов контроля чистоты роста в бактериальную массу вносят адьювант - 3%-ный раствор гидроокиси алюминия из расчета 15% к объему культуры. Второй адъювант сапонин добавляют из расчета 100 мг на 1 л биомассы. Адъюванты вносят при непрерывном взбалтывании. Получаемая сапонин-формолгидроокисьалюминиевая вакцина обеспечивает формирование иммунитета через 3-5 дней после вакцинации, который сохраняется не менее 12 месяцев. Эпизоотологическая эффективность составляет 95% и более от всех вакцинированных животных. 1 табл.
Вакцина против стрептококкоза и пастереллеза нутрий, отличающаяся тем, что содержит в качестве антигена суспензию клеток штамма Streptococcus zooepidemicus ВГНКИ N К-ДЕП с титром 2,5 • 109 3 • 109 кл/мл в культуральной среде, суспензию клеток штаммов Pasteurella multocida ВГНКИ N 6011, Pasteurella multocida ВГНКИ N 2394 и Pasteurella multocida ВГНКИ N 1015, взятых в равных соотношениях с общим титром 2,5 • 109 3 • 109 кл/мл в культуральной среде, глюкозу, формалин, гидроокись алюминия и сапонин при следующем соотношении компонентов, об.
Суспензия клеток штамма Streptococcus zooepidemicus ВГНКИ N К-ДЕП в культуральной среде с титром 2,5 • 109 3 • 109 41,3 44,35
Суспензия клеток штаммов Pasteurella multocida ВГНКИ N 6011, Pasteurella multocida ВГНКИ N 2394 и Pasteurella multocida ВГНКИ N 1015, взятых в равных соотношениях с общим титром 2,5 • 109 3 • 109 кл/мл в культуральной среде 41,3 44,35
Глюкоза 1,0 2,0
Формалин 0,3 0,4
Гидроокись алюминия 10 15
Сапонин Остальноео
| Инфекционные болезни животных | |||
| Справочник под ред | |||
| Осидзе Д.Ф | |||
| -М.: ВО "Агропромиздат", 1987, с | |||
| Вагонный распределитель для воздушных тормозов | 1921 |
|
SU192A1 |
Авторы
Даты
1997-12-20—Публикация
1994-09-30—Подача