Предлагаемое изобретение касается способа получения промышленного водного раствора хлорида натрия, находящего достаточно широкое применение в химической промышленности, а также применения водного раствора, полученного этим способом для получения водного раствора гидроокиси натрия, кристаллов хлорида натрия или карбоната натрия.
Промышленные способы производства упомянутых выше химических веществ требуют обычно наличия водных растворов хлорида натрия высокой чистоты, свободных, в частности, от примесей поливалентных металлов, таких как кальций, магний, алюминий, железо, свинец и цинк. Эти металлы перечислены здесь в качестве примера и этот перечень не является исчерпывающим. Упомянутое выше требование высокой чистоты растворов хлорида натрия является особенно строгим при использовании электролитических способов производства с применением селективных мембран, проницаемых для катионов. Речь идет, например, о мембранах из перфторированного полимера, содержащего функциональные группы, являющиеся производными карбоновой кислоты (см. патент Великобритании GB-A-1375126). В этих процессах электролиза используются обычно растворы хлорида натрия, в которых содержание поливалентных катионов, в частности катионов кальция, не превышает 0,1 ррm (см. патент Великобритании GB-A-2005723).
Водные растворы, предназначенные для электролизных ванн, получаются обычно путем растворения в воде каменной соли (Chlorine, Its manufacture, Properties and Uses J.S. Sconce Reinhold Pablishing Corporation, Нью-Йорк 1962, pp. 119-123). Однако полученные растворением в воде каменной соли рассолы обычно имеют слишком высокое содержание поливалентных катионов, не позволяющее непосредственно использовать эти рассолы в процессах электролиза. Для доведения этих рассолов до необходимых кондиций предложено обрабатывать их на смолах, являющихся агентами образования внутрикомплексных, или хелатных, элементоорганических соединений типа Na, с целью извлечения из них поливалентных катионов (The American Institute of Chemical Engineers, N 219, Vol. 78, 1982, pp. 46-53: J.J. Wolff and R.E. Anderson, Ion-exchenge purification of feed brine for chlor-alkali electrolysis cells; the role of Duolite ES-467).
Между тем, известен способ очистки дымовых газов, содержащих хлористый водород, в соответствии с которым эти дымовые газы обрабатываются в присутствии бикарбоната натрия таким образом, чтобы разложить хлористый водород и образовать хлорид натрия (смотри американский патент US-A-47867605; SOLVAY and Cie, brochure Tr. 895/5c-B-I-1290). В соответствии с этим известным способом бикарбонат натрия в виде порошка вводят в очищаемые дымовые газы и отделяют от них твердый остаток, содержащий хлорид натрия. Когда обрабатываемый таким образом дым содержит тяжелые металлы, что обычно имеет место в случае получения этих дымовых газов в результате сжигания или озоления бытовых и муниципальных отходов, получаемый твердый остаток хлорида натрия оказывается загрязненным этими тяжелыми металлами. В этом состоит причина трудностей при хранении или отбраковке этого остатка.
Данное изобретение имеет целью предложить способ, который позволяет использовать твердый остаток хлорида натрия, полученный по описанному выше известному способу, для изготовления водного раствора хлорида натрия, пригодного для применения в промышленных химических процессах.
Таким образом, предлагаемое изобретение касается способа получения промышленного водного раствора хлорида натрия, в соответствии с которым приготавливается водная среда, содержащая водный раствор хлорида натрия и поливалентные металлы, и эта водная среда обрабатывается затем соответствующим образом для удаления из нее поливалентных металлов. В соответствии с предлагаемым изобретением для приготовления упомянутой выше водной среды в воду вводят твердый продукт, полученный обработкой сухим способом с использованием бикарбоната натрия дымовых газов, содержащих хлористый водород и поливалентные металлы.
В способе в соответствии с предлагаемым изобретением под промышленным водным раствором хлорида натрия понимается водный раствор хлорида натрия, который предназначен для использования в качестве компонента химических реакций в промышленных технологических процессах.
Используемая в соответствии с предлагаемым изобретением водная среда содержит водный раствор хлорида натрия и поливалентные металлы. Упомянутый выше водный раствор обычно содержит также сульфат натрия, появляющийся в результате реакции бикарбоната натрия с окисью серы, присутствующей в дымовых газах, и карбонат натрия, соответствующий избытку бикарбоната натрия, используемого при обработке дымовых газов. Поливалентные металлы в упомянутой выше водной среде представляют собой металлы с валентностью, превышающей 1, и содержат тяжелые металлы. Эти металлы могут быть представлены в виде растворимых и/или нерастворимых в вводном растворе хлорида натрия соединений. В соответствии с предлагаемым изобретением эта водная среда получается введением в воду твердого продукта, полученного при обработке сухим способом с использованием бикарбоната натрия дымовых газов, содержащих хлористый водород и поливалентные металлы.
Обработка дымовых газов сухим способом с использованием бикарбоната натрия означает процесс обработки, в котором бикарбонат натрия в твердом порошкообразном состоянии вводится в дымовые газы в отсутствие жидкости, в частности воды. Обычно бикарбонат натрия используется в этом процессе в порошке, который вдувается в поток дымовых газов, циркулирующий в реакционной камере. В этой камере бикарбонат натрия разлагает хлористый водород, присутствующий в дыме, с образованием хлорида натрия. Представляет интерес использование порошка бикарбоната натрия с равномерным и возможно более тонким гранулометрическим составом с тем, чтобы ускорить разложение хлористого водорода. Рекомендуется использовать порошок бикарбоната натрия, средний диаметр частиц которого составляет менее 50 мкм. Предпочтительным является гранулометрический состав, соответствующий среднему диаметру частиц, не превышающему 25 мкм и заключенному, например, в диапазоне от 5 до 20 мкм.
Твердый продукт, полученный в процессе обработки дымовых газов с использованием бикарбоната натрия, содержит хлорид натрия (появляющийся в результате реакции хлористого водорода с бикарбонатом натрия) и поливалентные металлы в свободном или связанном состоянии. В случае дымовых газов, содержащих окислы серы, этот продукт содержит также сульфат натрия (получающийся в результате реакции окислов серы с бикарбонатом натрия). Он содержит также карбонат натрия, соответствующий избытку бикарбоната натрия, используемого в реакции с хлористым водородом и, в отдельных случаях, с окислами серы.
Упомянутая выше водная среда получается в результате введения упомянутого выше твердого продукта в воду. Количество используемой воды должно быть, по меньшей мере, достаточным для растворения всего количества хлорида натрия и других растворимых веществ этого твердого продукта. Однако несмотря на это условие, количество используемой воды не является критическим. Использование избыточного количества воды не дает каких-либо преимуществ. В качестве варианта вместо воды можно также использовать разбавленный раствор хлорида натрия.
Происхождение используемых дымовых газов не является критическим, если они в обязательном порядке содержат хлористый водород и поливалентные металлы в свободном или в связанном состоянии. Предлагаемое изобретение специально применяется к дымовым газам, получаемым в результате сжигания или озоления бытовых или муниципальных отходов, которые обычно содержат хлорсодержащие соединения, хлориды металлов и поливалентные металлы (VGB Kraftwerkstechnik, 69, Heft 2, 1989, pр. 212-220). В зависимости от происхождения сжигаемых отходов поливалентные металлы, уносимые дымовыми газами, могут содержать кадмий, ртуть, сурьму, свинец, кобальт, хром, медь, марганец, ванадий, олово, железо, никель, кальций, магний, алюминий и цинк, причем этот перечень не является исчерпывающим.
В способе в соответствии с предлагаемым изобретением удаление поливалентных металлов из водной среды может быть обеспечено любыми подходящими в данном случае средствами.
В предпочтительной форме практической реализации способа в соответствии с предлагаемым изобретением используется щелочная водная среда с тем, чтобы получить поливалентные металлы в виде осадка их гидроокисей, этот осадок отделяется от водной среды и полученная таким образом жидкость обрабатывается на хелатной смоле. В этой форме осуществления способа в соответствии с предлагаемым изобретением жидкость имеет щелочной показатель pH и может быть сама по себе обработана на хелатной смоле. Предпочтительно регулировать pH этого раствора в пределах от 8 до 14.
Щелочность водной среды может быть реализована при помощи растворенного карбоната натрия, который в этой среде присутствует и который соответствует избытку бикарбоната натрия, использованного для обработки дымовых газов. В случае необходимости в водную среду можно внести дополнительную присадку неорганического основания, такого, например, как карбонат натрия или гидроокись натрия.
Хелатные смолы, используемые в этой форме практической реализации способа в соответствии с предлагаемым изобретением, хорошо известны в технике. Они содержат полимерный скелет, к которому прививочной сополимеризацией присоединены хелатные функциональные группы, являющиеся агентами образования внутрикомплексного элементоорганического соединения и содержащие взаимозаменяемые катионы. Примеры полимеров, используемых в качестве полимерного скелета упомянутых выше хелатных смол, включают полиолефины (например, полиэтилен), полимерные производные стирола (например, производные сополимеры стирола и дивинилбензола), а также акриловые смолы. Смола берется обычно в гранулированном состоянии и в контакте с этими гранулами осуществляется циркуляция водной среды.
В описанной выше форме практической реализации способа в соответствии с предлагаемом изобретением можно использовать как хелатную смолу типа Н, так и хелатную смолу типа Na. Смолы типа Na (которые представляют собой смолы, где взаимозаменяемыми катионами являются катионы натрия) являются, однако, более предпочтительными, поскольку они обеспечивают при прочих равных условиях оптимальную экстракцию ионов поливалентных металлов, в частности ионов кальция, в соответствии с процессом, описанном в документе "The American Institute of Chemical Engineers", N 219, Vol. 78Б 1982, рp. 46-53: J.J.Wolff and R. E. Anderson, Ion-exchange purification of feed brine for chor-alkali electrolysis cell; the role of Duolite ES-467. По окончании процесса смола должна быть регенерирована, что может быть выполнено известным способом, обрабатывая ее водным раствором соляной кислоты. В случае использования смолы типа Na обработка водным раствором соляной кислоты должна производиться вслед за обработкой водным раствором гидроокиси натрия.
В рамках предлагаемого изобретения предпочтительными видами хелатных смол являются те, в которых функциональные группы содержат лиганды азота. Они могут содержать, например, соединения, являющиеся производными от аминов или от иминов. В данном случае специально рекомендуются хелатные смолы, которые содержат функциональные группы, являющиеся производными органических кислот, причем предпочтение отдается хелатным смолам, содержащим функциональные группы, являющиеся производными имино-ацетоуксусной кислоты или амино-фосфоновой кислоты. Такие смолы описаны, в частности, в американском патенте US-A-4002564 и в заявке на патент EP-A-0087934. Примеры смол, используемых в способе в соответствии с предлагаемым изобретением, распространены на рынке химических веществ под марками DUOLITE (ROHM HAAS COMPANY) и LEWATIT (BAYER AG). В частном случае, когда водная жидкость содержит ртуть, предпочтительно проводить обработку на смоле, содержащей лиганды азота, после предварительной обработки на хелатной смоле, содержащей лиганды серы, с целью осаждения на ней ртути.
В частном варианте предпочтительной формы осуществления предлагаемого способа, описанной выше, щелочную водную среду подкисляют и фильтруют. В этом варианте предлагаемого изобретения подкисление может быть выполнено добавлением водного раствора соляной кислоты к водной среде. Функция этого подкисления состоит в том, чтобы разложить карбонат натрия и растворить поливалентные металлы. Фильтрация служит для удаления нерастворимых веществ, в частности летучего пепла из дымовых газов.
В тех случаях, когда водная среда содержит анионы SO
В соответствии с первым методом гидроокись или хлорид кальция добавляют в водную жидкость, полученную после отделения осадка металлических гидроокисей. Тогда сульфат кальция выпадает в осадок в виде малозагрязненного гипса, который вследствие этого может легко найти промышленное применение или может быть просто удален. В случае удаления осадка эта операция не требует специальной выгрузки, что представляет собой экономическое преимущество. В том случае, когда водная среда содержит ионы карбоната, необходимо использовать достаточное количество гидроокиси или хлорида кальция, чтобы прореагировать с ионами сульфата и с ионами карбоната и водной жидкости, причем в этом случае карбонат кальция осаждается до образования сульфата кальция.
В соответствии со вторым методом щелочную водную среду подкисляют, например, добавлением соляной кислоты и вводят в нее достаточное количество хлорида кальция для образования сульфата кальция с ионами сульфата. Цель подкисления водной среды состоит в разложении ионов карбоната и растворении поливалентных металлов. Предпочтительно регулировать это подкисление таким образом, чтобы придать водной среде величину pH меньше 6, установив ее на уровне, например, от 3 до 5. После отделения осадка сульфата кальция (обычно в виде гипса) водную среду подщелачивают (предпочтительно при помощи добавления гидроокиси натрия) и обрабатывают ее затем так, как было изложено выше, для извлечения из раствора поливалентных металлов.
В соответствии с третьим методом процесс начинают с подкисления щелочной водной среды путем, например, добавления к ней соляной кислоты, затем подщелачивают эту водную среду, добавляя к ней гидроокись кальция и, в случае необходимости, гидроокись натрия. Подкисление водной среды производится в тех же условиях, что и во втором методе, описанном выше, с тем, чтобы разложить ионы карбоната и растворить поливалентные металлы. Количество гидроокиси кальция, используемое впоследствии, должно быть, по меньшей мере, достаточным для того, чтобы прореагировать с всей совокупностью анионов сульфата в данной водной среде. В то же время, общее количество гидроокиси кальция и гидроокиси натрия должно быть достаточным для того, чтобы реализовать щелочную величину pH в данной водной среде (предпочтительно величина pH должна быть, по меньшей мере, равной 8). В этом третьем методе осуществления предлагаемого способа сульфат кальция (обычно в виде гипса) и металлические гидроокиси осаждаются одновременно, что является преимуществом этого метода. Действительно, можно видеть, что это совместное осаждение облегчает и ускоряет седиментацию осадка и улучшает последующее отделение осадка и рекуперацию водной жидкости.
Способ в соответствии с предлагаемым изобретением позволяет получить промышленные водные растворы хлорида натрия весьма высокой чистоты, в которых содержание ионов поливалентных металлов составляет менее 1 ppm. Этот способ позволяет, в частности, получить насыщенные водные растворы хлорида натрия, которые имеют весовое содержание кальция менее 0,1 ppm, не превышающее обычно на практике величину 0,05 ppm.
Водные растворы хлорида натрия, полученные с помощью способа в соответствии с предлагаемым изобретением, находят самые разнообразные применения в промышленности. В частности, они могут служить исходным материалом для производства карбоната натрия способом кальцинированной соды (Manufacture of soda Te Pang Hou Hafner Pablishing Company, 1969), для электролитического производства хлора и водных растворов гидроокиси натрия, для электролитического получения водных растворов хлората натрия, а также для производства твердой соли.
Предлагаемое изобретение касается также использования водных растворов хлорида натрия, полученных посредством способа в соответствии с предлагаемым изобретением, для получения водных растворов гидроокиси натрия методом электролиза или электродиализа. Способы электролитического получения водных растворов гидроокиси натрия хорошо известны в технике и включают, в частности, способ в электролитической ванне с селективными мембранами, проницаемыми для катионов (Chlorine, Its manufacture, Oroperties and Uses J.S. Sconce-Reinhold Publishing Corporation, Нью-Йорк 1962, pp. 127-199; европейский патент EP-B-0253430 и заявки на бельгийский патент 09000497 и 09000924 на имя фирмы Солвей).
Способы производства водных растворов гидроокиси натрия методом электродиализа также хорошо известны в технике (американский патент US-A-2829095). В соответствии с предлагаемым изобретением в процессах электролиза или электродиализа в качестве исходного материала используется промышленный водный раствор хлорида натрия, полученный посредством способа в соответствии с предлагаемым изобретением, описанного выше.
Другим объектом предлагаемого изобретения является использование водного раствора хлорида натрия, полученного посредством способа в соответствии с предлагаемым изобретением, для производства кристаллов хлорида натрия. Производство кристаллов хлорида натрия высокой чистоты путем выпаривания водных растворов хлорида натрия хорошо известно в технике (Sodium Chloride - Dale W. Kaufmann Рейнольд Паблишинг Корпорейшн, Нью-Йорк 1960, pp. 205-274; заявка на европейский патент EP-A-0352847). В соответствии с предлагаемым изобретением в качестве подвергающегося выпариванию водного раствора хлорида натрия используется промышленный водный раствор хлорида натрия, полученный посредством способа в соответствии с предлагаемым изобретением, описанного выше.
Дополнительным объектом предлагаемого изобретения является использование промышленного водного раствора хлорида натрия для производства карбоната натрия по технологии с кальцинированной содой или по технологии с нерастворимыми аминами. Технология с кальцинированной содой (называемая также "способом Сольвей") хорошо известна и включает растворение газообразного аммиака в водном растворе хлорида натрия таким образом, чтобы получить аммиачный рассол, обработку этого аммиачного рассола газом, содержащим двуокись углерода с тем, чтобы кристаллизовать бикарбонат натрия, и преобразование этого бикарбоната натрия в карбонат натрия (Te-Pang Hou, Manufacture of Soda with special reference to the Ammonia Process, 1969, Хафнер Паблишинг Компани).
В технологии с аминами смешивают водный раствор хлорида натрия и органический раствор амина, нерастворимого в воде, и обрабатывают полученную таким образом смесь с газом, содержащим двуокись углерода с тем, чтобы кристаллизовать бикарбонат натрия и преобразовать его затем в карбонат натрия (патенты Великобритании GB-A-1084436 и Франции FR-A-2545079). В соответствии с предлагаемым изобретением водный раствор хлорида натрия, используемый в двух этих технологиях, является промышленным водным раствором, полученным посредством способа в соответствии с предлагаемым изобретением, описанного выше.
Предлагаемое изобретение оригинальным и экономичным способом находит применение продуктам очистки дымовых газов. Оно специальным образом адаптировано к обработке дымовых газов, получаемых от установки по сжиганию или озолению бытовых или муниципальных отходов и мусора.
Особенности и подробности практической реализации предлагаемого изобретения будут выявлены в приведенном ниже описании нескольких форм его реализации.
На фиг. 1 представлена схема установки, использующей одну из частных форм практической реализации предлагаемого изобретения; на фиг. 2, 3, 4 представлены три схемы, аналогичных схеме, приведенной на фиг. 1, и представляющих установки, использующих соответственно три других формы реализации предлагаемого изобретения.
На приведенных схемах одинаковыми позициями обозначены идентичные элементы.
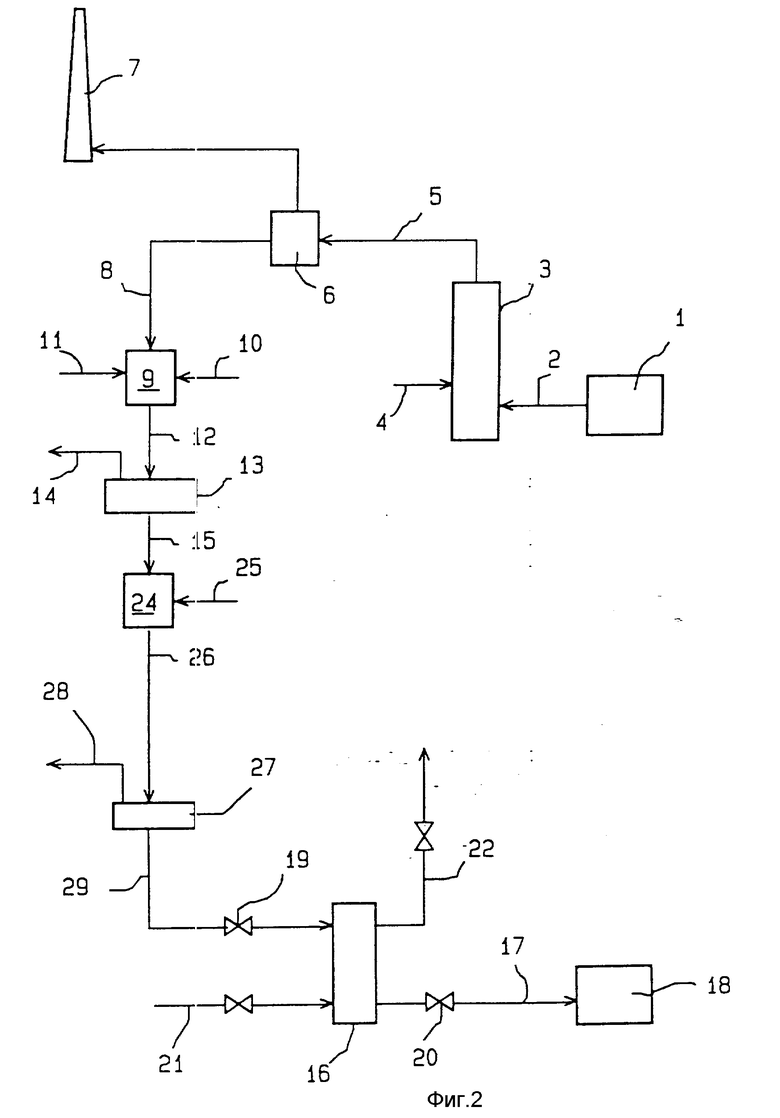
Технологические установки, представленные на чертежах, разработаны для очистки дымовых газов, получаемых при сжигании или озолении бытовых или муниципальных отходов и мусора, и для полезного применения газообразных отходов, получаемых при очистке этих дымовых газов. Этот дым содержит хлористый водород, двуокись серы и поливалентные металлы (такие, например, как кадмий, ртуть, сурьма, свинец, кобальт, хром, медь, марганец, ванадий, олово, никель, кальций, магний, алюминий, цинк, причем этот перечень не является исчерпывающим). Дымовые газы содержат, кроме того, летучие частицы пепла и золы. Этот дым на приведенных схемах обозначен позицией 2.
Установки содержат трубчатый реактор 3, в который в его нижней части подается дым 2, получаемый из мусоросжигательной печи 1. Бикарбонат натрия 4 в виде обезвоженного порошка вдувается в дым 2 в реакторе 3. В этом реакторе 3 бикарбонат натрия реагирует с хлористым водородом из дыма, образует при этом хлорид натрия. В то же время, он реагирует с двуокисью серы, образуя при этом сульфат натрия.
Дым 5, получаемый в верхней части трубчатого реактора 3, проходит через обеспечивающее устройство 6, а затем отводится в дымовую трубу 7. Вследствие того, что дым 5 является сухим, устройство обеспыливания 6 в предпочтительном варианте может быть образовано механическим сепаратором из фильтрующей ткани (рукавный фильтр), эффективность которого можно считать оптимальной. Могут быть использованы также и другие типы сепараторов, например, электростатические фильтры.
В устройстве обеспыливания 6 дым 5 освобождается от твердых частиц 8, которые в нем присутствуют. Эти твердые частицы содержат хлорид натрия, сульфат натрия, карбонат натрия, поливалентные металлы и летучие частицы пепла.
В технологической установке, представленной на фиг. 1, этот твердый продукт 8 вводят в камеру растворения 9, где его разводят в некотором количестве воды 10, достаточном для растворения всех растворимых в воде веществ, содержащихся в этом продукте. Полученная таким образом водная среда обычно имеет щелочную реакцию. Величину pH этой водной среды доводят до величины от 8 до 14 путем добавления водного раствора 11 гидроокиси натрия или соляной кислоты, в зависимости от того, в какую сторону первоначальное значение pH отличается от желаемой величины.
Щелочная водная среда 12, получаемая из камеры растворения 9, содержит поливалентные металлы в виде нерастворимых гидроокисей металлов. Эта водная среда пропускается через фильтр 13 отделения нерастворимых соединений 14 (летучие частицы пепла и золы, и гидроокиси поливалентных металлов). Водная жидкость 15, получаемая на выходе из фильтра 13, представляет собой водный раствор хлорида натрия, сульфата натрия и карбоната натрия. Этот водный раствор загрязнен поливалентными металлами, растворенными обычно в слишком больших количествах для непосредственного его использования в промышленных процессах. В соответствии с предлагаемым изобретением этот водный раствор заставляют циркулировать в реакционной колонне 16 в контакте с хелатной смолой, содержащей функциональные группы типа Na, являющиеся производными аминофосфоновой кислоты. В этой колонне 16 осуществляется ионный обмен между катионами натрия из смолы и поливалентными катионами из водного раствора 15. В результате такого процесса из колонны 16 получают промышленный водный раствор хлорида натрия 17 такой чистоты, которой оказывается достаточно для того, чтобы он мог быть непосредственно использован в промышленных химических процессах. Раствор 17, содержащий в растворенном виде сульфат и карбонат натрия, находит применение в промышленной установке 18, служащей для получения карбоната натрия по технологии с кальцинированной содой.
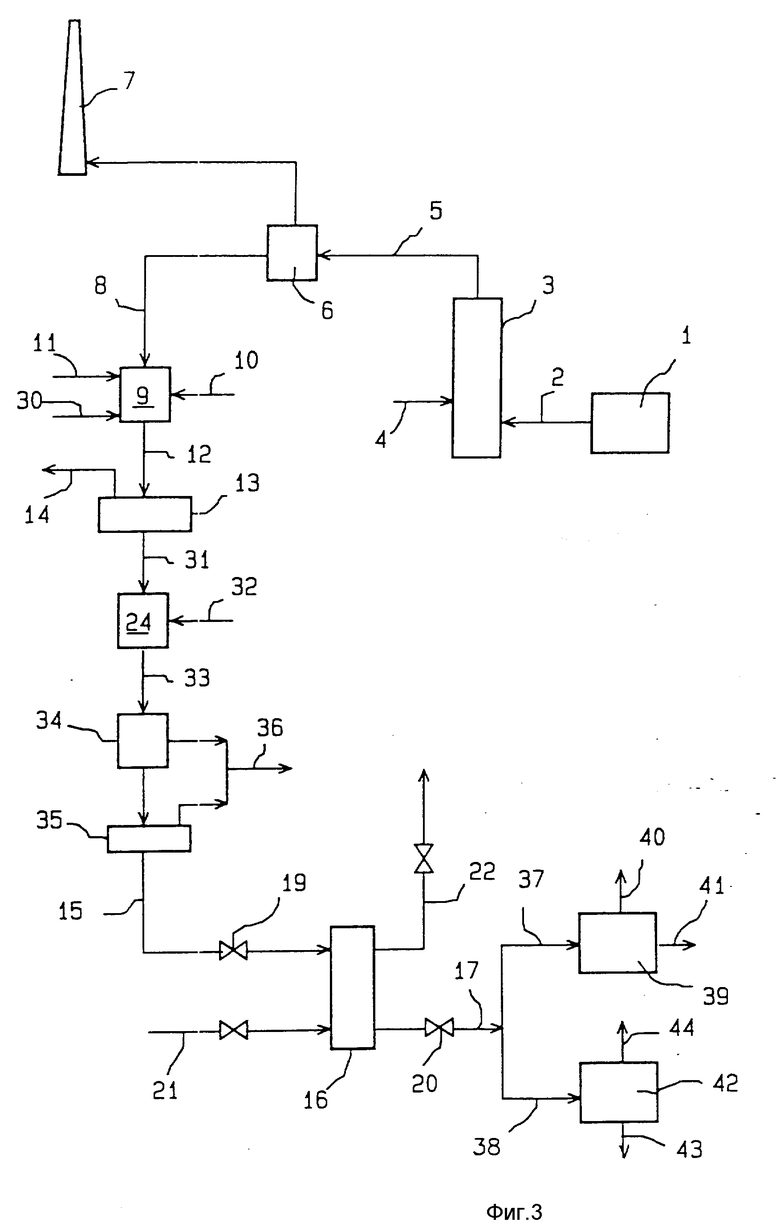
В технологической установке, показанной на фиг. 2, щелочной водный раствор 15 (водный раствор хлорида натрия, сульфата натрия и карбоната натрия, загрязненный растворенными поливалентными металлами) получается также, как было изложено выше со ссылками на схему фиг. 1. Этот щелочной водный раствор направляется затем в реактор 24, где к нему добавляется водный раствор хлорида кальция 25 в количестве, достаточном для реагирования со всей совокупностью карбоната и сульфата натрия и осаждения карбоната кальция и сульфата кальция (в виде гипса). Водная суспензия 26, полученная таким образом в реакторе 24, пропускается через фильтр 27 для отделения от нее осадка 28 карбоната и сульфата кальция, который удаляется из фильтра. Водный раствор хлорида натрия 29, полученный на выходе из фильтра 27, направляется в реакционную колонну 16, где подвергается обработке на хелатной смоле так, как было описано выше со ссылками на фиг. 1.
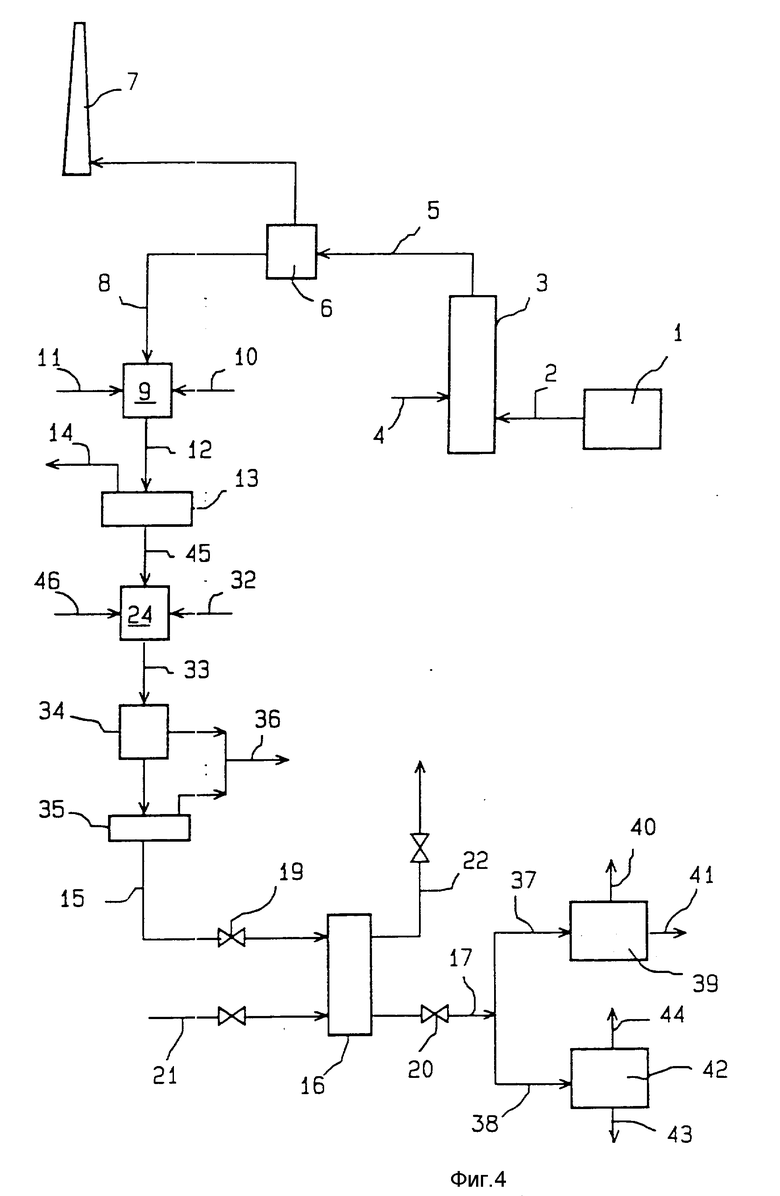
В технологической установке, схематически представленной на фиг. 3, в реакционную камеру 9 вводят кислоту 11 в количестве, достаточном для подкисления находящейся там водной среды, разложения ионов карбоната и растворения поливалентных металлов. Кроме того, в реакционную камеру 9 вводят водный раствор хлорида кальция 30 в количестве, достаточном для реагирования с сульфатом натрия и выпадения в осадок гипса.
Водная среда с кислотной реакцией 12, полученная таким образом в реакционной камере 9, направляется затем на фильтр 13, где от нее отделяются нерастворимые вещества 14 (сульфат кальция в виде гипса и летучие частицы пепла). На выходе из фильтра 13 получают водный раствор 31 хлорида натрия, свободный от сульфата и карбоната натрия и содержащий поливалентные металлы в растворенном состоянии. Этот водный раствор 31 направляется в реактор 24, где он подвергается подщелачиванию до уровня pH в диапазоне от 8 до 14 путем добавления к нему водного раствора гидроокиси натрия 32. Результатом такого подщелачивания раствора является выпадение в осадок поливалентных механизмов в виде металлических гидроокисей. На выходе из реактора 24 получают водную суспензию 33, которую затем последовательно направляют в камеру декантации или отстойник 34 и пропускают через фильтр 35, где от нее отделяется осадок 36 гидроокисей поливалентных металлов, который удаляется из фильтра. Водный раствор 15, получаемый на выходе из фильтра 35, представляет собой водный раствор хлорида натрия, загрязненный растворенными поливалентными металлами. Этот раствор направляется в реакционную колонну 16 для того, чтобы там подвергнуться обработке, уже описанной выше со ссылками на схему фиг. 1. На выходе из реакционной колонны 16 после соответствующей обработки получают водный раствор 17 хлорида натрия высокой чистоты, совершенно свободный от примесей поливалентных металлов и ионов сульфата и карбоната. Далее этот водный раствор разделяется на две фракции 37 и 38.
Фракция 37 в соответствии с предлагаемым изобретением направляется в электролизную ванну 39, оборудованную селективной мембраной, проницаемой для катионов. В этой электролизной ванне 39 водный раствор 37 подвергается способом, который сам по себе известен, процессу электролиза, приводящему к получению хлора 40 и водного раствора гидроокиси натрия 41.
Фракция 38 направляется в испаритель 42, из которого получают кристаллизованный хлорид натрия 43 и водяной пар 44. Твердый кристаллический хлорид натрия 43 находит весьма разнообразные применения в промышленности.
В технологической установке, схематически представленной на фиг. 4, в камеру растворения 9 вводят соляную кислоту 11 в количестве, достаточном для подкисления находящейся там водной среды, разложения ионов карбоната и растворения поливалентных металлов.
Подкисленная водная среда 12, получаемая из камеры растворения 9, представляет собой водный раствор хлорида натрия и сульфата натрия, содержащий, кроме того, растворенные поливалентные металлы. Эта водная среда пропускается через фильтр 13, где от нее отделяются нерастворенные вещества 14 (в данном случае это главным образом летучие частицы дымового пепла). Получаемый на выходе из фильтра 13 водный раствор 45 хлорида натрия и сульфата натрия, содержит поливалентые металлы в растворенном виде.
Полученный таким образом раствор 45 направляется в реактор 24. В этом реакторе водный раствор 45 подщелачивают до получения pH в диапазоне от 8 до 14 и, кроме того, переводят в осадок в виде гипса содержащиеся в нем катионы сульфата. С этой целью в реактор 24 вводят известковое молоко 46 в количестве, достаточном для разложения всей совокупности сульфата натрия в растворе 45, и в случае необходимости делают также добавку 32 водного раствора гидроокиси натрия для доведения pH до желаемой величины, заключенной в диапазоне от 8 до 14. Таким образом, поливалентные металлы совместно выпадают в осадок в виде гидроокисей металлов с сульфатом кальция.
На выходе из реактора 24 получают водную суспензию 33, которую затем последовательно пропускают через камеру декантации или отстойник 34 и через фильтр 35, где происходит отделение от этой суспензии совместно осажденных гидроокисей металлов поливалентного характера и гипса 36, которые удаляются после отделения от раствора. На выходе из фильтра 35 получают водный раствор 15, который затем обрабатывают так, как было описано выше со ссылками на схему, показанную на фиг. 3.
В одном из специфических вариантов исполнения форм реализации технологических процессов, представленных на фиг. 1-4, дымовые газы 2 пропускаются через соответствующий фильтр, не показанный на приведенных схемах, для отделения от этих газов летучих частиц пепла и золы перед введением этих газов в трубчатый реактор 3.
В различных формах практической реализации способа в соответствии с предлагаемым изобретением, описанных выше со ссылками на схемы, приведенные на фиг. 1-4, хелатная смола в реакционной колонне 16 периодически должна подвергаться регенерации. С этой целью реакционную колонну 16 изолируют от трубопроводов 15 (или 29) и 17 при помощи изолирующих клапанов или вентилей 19 и 20. Затем последовательно проводятся два этапа обработки этой хелатной смолы так, как это описано в документе, уже упомянутом выше на стр. 2 описания.
На первом этапе в реакционную колонну 16 через трубопровод 21 вводят водный раствор соляной кислоты для восстановления протонов в активных центрах хелатной смолы и получают через трубопровод 22 водный раствор соляной кислоты, содержащий поливалентные металлы. На втором этапе обработки через трубопровод 21 в реакционную колонну 16 вводят водный раствор гидроокиси натрия для восстановления катионов натрия в протонах активных центров упомянутой выше смолы и через трубопровод 22 получают разбавленный водный раствор гидроокиси натрия.
Полученные после регенерации хелатной смолы разбавленный водный раствор соляной кислоты и разбавленный водный раствор гидроокиси натрия могут быть снова возвращены в цикл в данном способе. Например, при использовании формы реализации предлагаемого способа, представленной схемой фиг. 4, разбавленный водный раствор гидроокиси натрия может быть снова введен в реакторную камеру 9. Тот же раствор может быть возвращен в цикл введением его в реакторную камеру 24.
Использование: изобретение относится к способу получения промышленного водного раствора хлорида натрия, который может быть использован в производстве кристаллов хлорида натрия или карбоната натрия, водного раствора гидроокиси натрия. Сущность способа состоит в том, что из дымовых газов выделяют с использованием порошкообразного бикарбоната натрия твердый продукт, содержащий хлорид натрия и тяжелые металлы. Твердый продукт диспергируют в воде для растворения хлорида натрия, подщелачивают для отделения осадка гидроокисей тяжелых металлов, а водный раствор хлорида натрия контактирует с хелатной смолой. 6 3.п. ф-лы, 4 ил.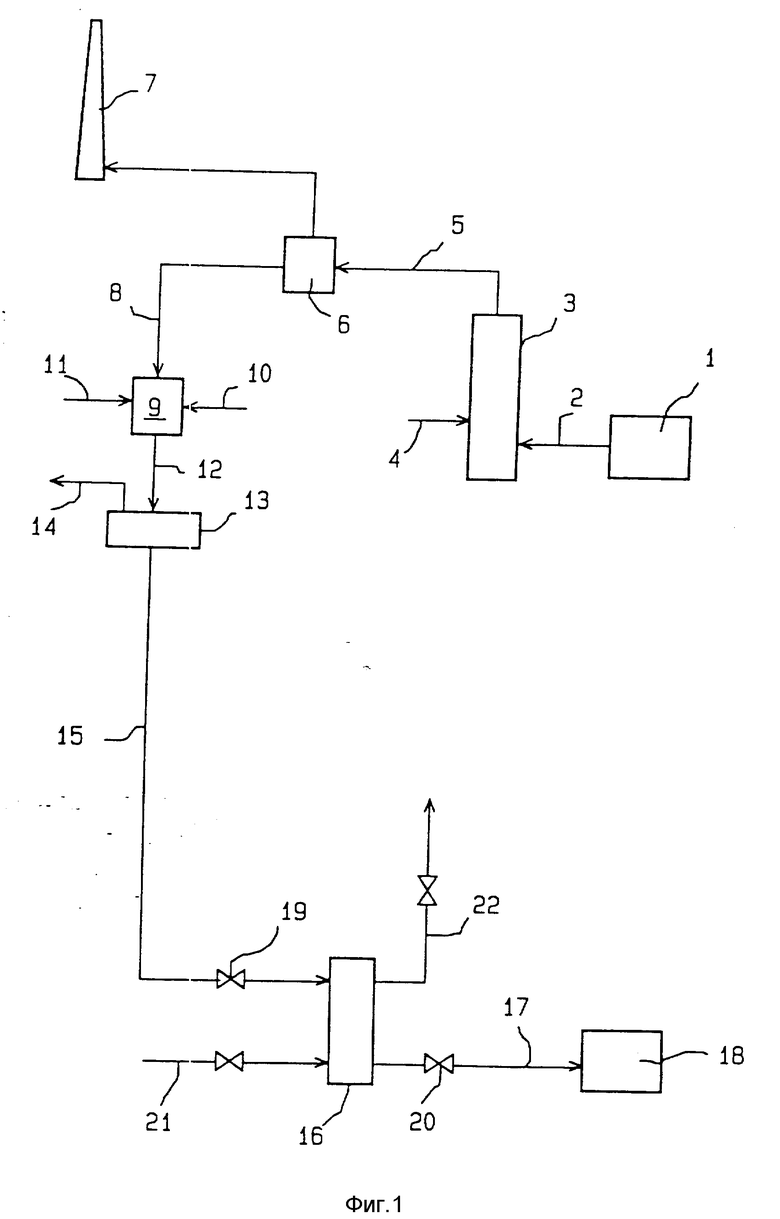
| US, патент, 4767605, кл | |||
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
Авторы
Даты
1997-12-20—Публикация
1994-03-09—Подача