Изобретение относится к биотехнологии и представляет собой способ выделения человеческого альфа-фактора некроза опухолей препарата медицинского назначения из биомассы бактериальных клеток, содержащих рекомбинантную плазмидную ДНК с геном альфа-фактора некроза опухолей ( α - ФНО) человека. Данный способ предназначен для производства рекомбинантного человеческого a -ФНО в медицинской и микробиологической промышленности.
Высокоочищенный a -ФНО человека получают в ограниченных количествах из линий человеческих клеток гематопоэтического происхождения (см. Williamson B. D. et al. Proc. Natl. Acad. Sci. USA, 1983, v. 80, pp. 5397-5401; EP 0218868, C 12 P 21/02, C 12 N 15/00, 1985).
В последние годы разработаны способы получения человеческого a -ФНО из принципиально нового источника микроорганизмов, способных синтезировать белок a -ФНО человека в результате применения технологии рекомбинантных дезоксирибонуклеиновых кислот (EP 0220966, кл. C 07 K 3/20, 1985; US 4677063, кл. C 12 P 21/00; EP 0263518, кл. C 07 K 3/18).
Использование микробиологических продуцентов позволяет решать проблему создания крупномасштабного производства a -ФНО человека и обеспечить потребность медицины в препарате.
Самым близким по технологической сущности является способ выделения человеческого a -ФНО из клеток Escherichia coli W3110/pT4TNFST8rop, содержащих рекомбинантную плазмиду pT4TNFST8rop, предусматривающий: разрушение клеток микроорганизмов высоким давлением в гомогенизаторе в 10 мМ Tris-HCl буфере (pH 0,8), осаждение белков из раствора добавлением аммония сульфата до 80% насыщения, растворение осадка в 10 мМ Tris-HCl буфере (pH 8,0) и диализ белкового раствора, последующую хроматографическую очистку белка на DEAE-Toyopearl 650C с элюцией градиентом ионной силы до 0,3 М NaCl в 10 мМ Tris-HCl буфере (pH 8,0), дальнейшую очистку на DEAE-сефарозе CL-6B с элюцией градиентом ионной силы до 0,2 M NaCl в 10 мМ Tris-HCl буфере (pH 7,0), хроматографию на Matrex Blue A и фенил-сефарозе CL-4B, обессоливание на Сефакриле S-200 и, наконец, обращенно-фазную высокоэффективную жидкостную хроматографию на колонке Microbonder Pack C18 (US 4871663, C 12 P 21/00, 1989).
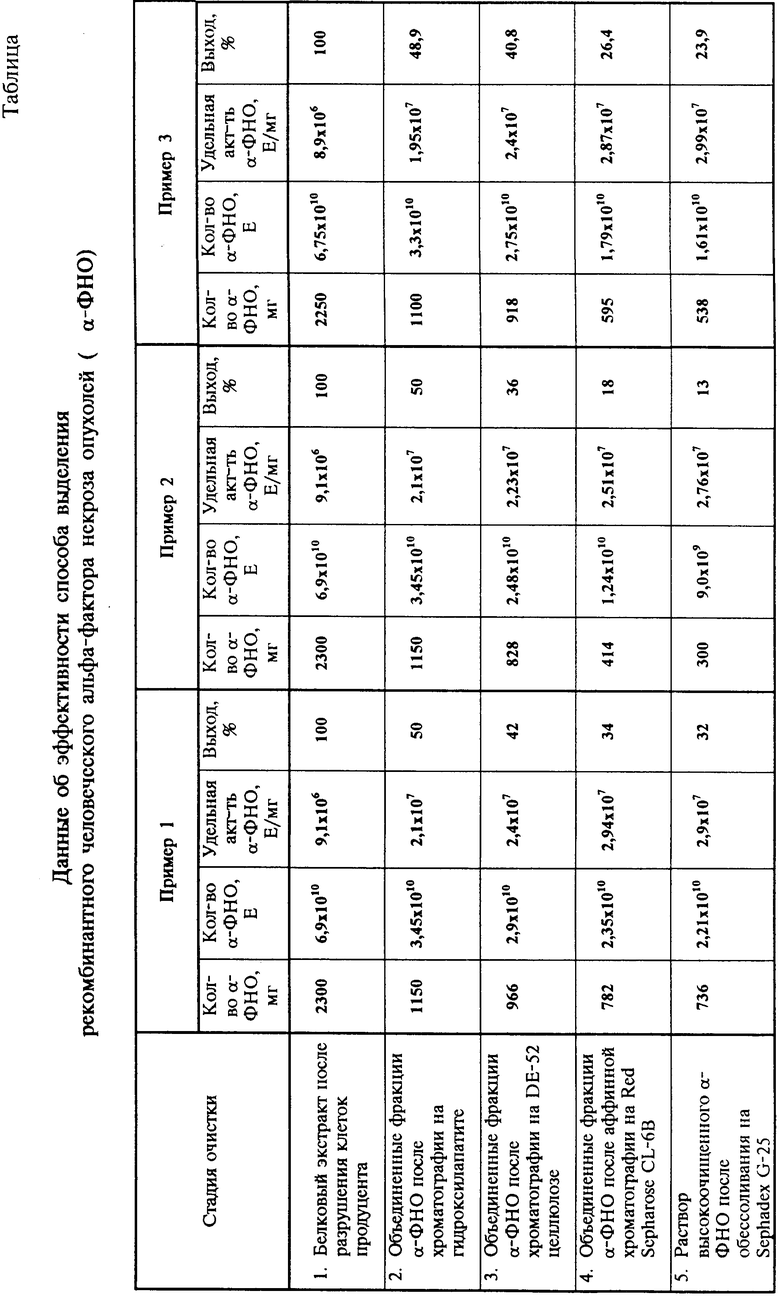
Технической задачей изобретения является повышение выхода и степени очистки препарата a -ФНО человека и создание технологической схемы выделения гомогенного белка. Эта задача решается с помощью следующих приемов: в качестве продуцента используют штамм E.coli ВКПМ В-3967, полученный после разрушения клеток экстракт этого штамма подвергают хроматографии на гидроксилапатите с элюцией линейным градиентом Na2HPO4 от 50 мМ до 220-300 мМ при pH 7,0, ионообменную хроматографию осуществляют на ДЕ-52 целлюлозе с элюцией линейным градиентом NaCl от 0 до 140-200 мМ в 20 мМ трис-буфере при pH 7,5-8,0, аффинную хроматографию проводят на Red Sepharose CL-6B с применением для элюции линейного градиента NaCl от 0 до 1,5-2,0 М в 25 мМ Na2HPO4 при pH 7,2, а гель-фильтрацию осуществляют в фосфатно-солевом растворе с pH 7,2 с использованием Sephadex G-25.
Все операции очистки, начиная с хроматографии на гидроксилапатите, проводят в стерильных условиях с использованием апирогенных сорбентов и буферных растворов.
Отличие предлагаемого способа производства a -ФНО человека заключается в том, что для первичного выделения целевого белка из клеточного экстракта вводится стадия хроматографии на гидроксилапатите, и далее хроматографическая очистка целевого белка до гомогенного состояния осуществляется с использованием ионообменного и аффинного сорбентов без применения обращенно-фазной высокоэффективной жидкостной хроматографии при высоком давлении на колонке Microbonder Pack C18. Это позволяет за один цикл получить до 2,2•1010E препарата. Использование новых сорбентов и условий хроматографии позволяет неограниченно масштабировать процесс, одновременно значительно повысив выход и степень очистки целевого белка, что важно для промышленного производства.
Пример 1. 1.1 Экстрагирование a -ФНО из клеток путем разрушения аппаратом Мантон-Гаулин. 120 г замороженной при -70oC биомассы E.coli ВКПМ В-3967 дробят механически на куски объемом 0,5-1 см3, загружают в стеклянный сосуд, добавляют 2400 мл 20 мМ Tris, содержащего 200 мМ NaCl, pH 7,5, при 3-5oC перемешивают до образования гомогенной суспензии. Затем полученную суспензию 2-3 раза пропускают через аппарат Мантон-Гаулин при давлении 500-600 кг/см2. Экстракт центрифугируют в течение 1 ч на центрифуге Бэкман J2-21 при 14000 об/мин. Получают 2350 мл белкового экстракта (см. таблицу).
1.2 Удаление нуклеиновых кислот. К полученному экстракту белков добавляют 500 мл DE-52 целлюлозы, уравновешенной 20 мМ Tris с 200 мМ NaCl, pH 7,5, и перемешивают в течение 15-20 мин при 3-5oC. Сорбент отделяют от белкового раствора декантированием и повторно промывают 500 мл 20 мМ Tris в присутствии 200 мМ NaCl, pH 7,5. Оба белковых раствора объединяют. Получают 2900 мл белкового раствора.
1.3. Хроматография на гидроксилапатите. Полученный раствор белков разбавляют в 3 раза 20 мМ Tris, pH 7,0, и наносят на колонку К 45/100 ("Pharmacia", Швеция), содержащую 1000 мл гидроксилапатита, уравновешенного 50 мМ Na2HPO4, pH 7,0, при 3-5oC. Далее через колонку пропускают уравновешивающий раствор в количестве до 4-5 объемов от объема колонки. Элюцию a -ФНО человека проводят линейным градиентом ионной силы до 220 мМ Na2HPO4, pH 7,0. Скорость элюции 500 мл/ч. Собирают фракции, содержащие a -ФНО (см. таблицу). Весь процесс, начиная с этой стадии, проводят в стерильных условиях.
1.4. Ультрафильтрация. Объединенные фракции после хроматографии на гидроксилапатите подвергают ультрафильтрации на аппарате "Minitan" ("Millipore", США). Проводят пять циклов. Применяют мембраны с величиной пор 10000 дальтонов. При этом используют 20 мМ Tris, pH 7,5.
1.5 Хроматография на DE-52 целлюлозе. Белковый раствор после диализа наносят на колонку К 45/100 ("Pharmacia", Швеция) объемом 2000 мл, уравновешенную 20 мМ Tris, pH 7,5, при 3-5oC. Далее через колонку пропускают уравновешивающий буфер до достижения базовой линии контрольного оборудования для детекции белков типа UV-1 ("Pharmacia", Швеция). Элюцию проводят линейным градиентом ионной силы до 140 мМ NaCl в 20 мМ Tris при pH 7,5. Скорость 2000 мл/ч. Фракции, содержащие a -ФНО, с общим объемом в 3000 мл, объединяют (см. таблицу).
1.6. Аффинная хроматография на Red-Sepharose CL-6B. Сорбент уравновешивают буферным раствором 25 мМ Na2HPO4, pH 7,2. Объединенные фракции наносят на колонку К 50/40 ("Pharmacia", Швеция) объемом в 300 мл. Через колонку пропускают уравновешивающий буфер до достижения базовой линии. Элюируют градиентом ионной силы до 1,5 M NaCl в 25 мМ Na2HPO4, pH 7,2, с дальнейшей промывкой колонки буферным раствором в присутствии 1,5 М NaCl, pH 7,2. Фракции, содержащие a -ФНО с общим объемом в 1600 мл объединяют (см. таблицу).
1.7. Ультрафильтрация. Объединенные фракции после Red-Sepharose CL-6B подвергают ультрафильтрации на аппарате "Minitan" ("Millipore", США). Мембраны с величиной пор 10000 дальтонов. Белковый раствор подвергают ультрафильтрации до достижения концентрации белка не более 4 мг/мл.
1.8 Обессоливание на колонке Sephadex G-25. Для этого используют колонку К 100/100 ("Pharmacia", Швеция), содержащую 7500 мл Sephadex G-25, уравновешенную 100 мМ фосфатным буфером с 200 мМ NaCl, pH 7,2. Концентрированный белок пропускают через колонку со скоростью 400 мл/ч. Собирают фракции, содержащие a -ФНО, в общем объеме 800 мл (см. таблицу).
Пример 2. 2.1. Экстрагирование a -ФНО из клеток проводят по 1.1. При использовании аппарата Мантон-Гаулин для разрушения клеток бактериального продуцента давление достигало 700-800 кг/см2.
2.2 Удаление нуклеиновых кислот проводят по 1.2.
2.3. Хроматография на гидроксилапатите. Элюцию a -ФНО проводят линейным градиентом ионной силы до 300 мМ Na2HPO4, pH 7,0.
2.4. Ультрафильтрация. Проводят по 1.4.
2.5. Хроматография на DE-52 целлюлозе. Элюцию проводят линейным градиентом ионной силы до 200 мМ NaCl в 20 мМ Tris при pH 8,0.
2.6. Аффинная хроматография на Red-Sepharose CL-6B. Элюируют градиентом ионной силы до 2 М NaCl в 25 мМ Na2HPO4, pH 7,2.
2.7. Ультрафильтрация. Проводят по 1.7.
2.8. Обессоливание на Sephadex G-25. Проводят по п.1.8.
Пример 3. 3.1. Экстракцию a -ФНО из клеток проводят по 1.1. При использовании аппарата Мантон-Гаулин для разрушения клеток бактериального продуцента давление достигает 300-400 кг/см2.
3.2. Удаление нуклеиновых кислот проводят по 1.2.
3.3. Хроматографию на гидроксилапатите проводят по 1.3.
3.4. Ультрафильтрацию проводят по 1.4.
3.5. Хроматографию на DE-52 целлюлозе проводят по 1.5.
3.6. Аффинную хроматографию на Red-Sepharose CL-6B проводят по 1.6, элюируя градиентом ионной силы до 1,5 M NaCl в 25 мМ Na2HPO4, pH 7,2, без дальнейшей промывки колонки буферным раствором в присутствии 1,5 M NaCl, pH 7,2.
3.7. Ультрафильтрацию проводят по 1.7.
3.8. Обессоливание на Sephadex G-25 проводят по 1.8.
Полученный препарат является апирогенным, стерильным, электрофоретически и иммунохимически гомогенным и обладает биологической активностью не менее 3•107 E на мг белка.
Гомогенность полученного препарата a -ФНО человека подтверждена электрофорезом в полиакриламидном геле в присутствии додецилсульфата натрия. В полученном препарате a -ФНО человека прослеживается одна полипептидная цепь с N-концевой аминокислотной последовательностью Ser-Arg-Thr-Pro-. определенной автоматическим секвенированием по методу Эдмана в модификации Чанга.
Аминокислотная последовательность полученного a -ФНО человека отличается от природного отсутствием четырех N-концевых аминокислот Val-Arg-Ser-Ser-.
Биологическая активность препарата, определенная на клетках мышиных фибробластов L929, составляет 3•107E на 1 мг белка, в прототипе - 1•107 E на 1 мг белка.
Применение описанной технологической схемы позволяет увеличить выход a -ФНО человека до 32% и получить за цикл 2,2•1010 E препарата. Данные об эффективности способа выделения рекомбинантного a -ФНО человека представлены в таблице.
Полученный препарат можно использовать как биологически активное вещество для клеточных культур, а также для приготовления лекарственной формы без дополнительной обработки.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ РЕКОМБИНАНТНОГО ФАКТОРА НЕКРОЗА ОПУХОЛЕЙ-БЕТА ЧЕЛОВЕКА | 1997 |
|
RU2132385C1 |
| СПОСОБ ПОЛУЧЕНИЯ РЕКОМБИНАНТНОГО ФАКТОРА НЕКРОЗА ОПУХОЛЕЙ АЛЬФА ЧЕЛОВЕКА | 1997 |
|
RU2144958C1 |
| СПОСОБ ПОЛУЧЕНИЯ ПОЛИПЕПТИДА СО СВОЙСТВАМИ ЛИМФОТОКСИНА ЧЕЛОВЕКА | 1992 |
|
RU2048521C1 |
| Способ выделения и очистки рекомбинантного белка, аналога фрагмента каппа-казеина человека, обладающего цитотоксической активностью по отношению к раковым клеткам человека | 2018 |
|
RU2693251C1 |
| СПОСОБ ПОЛУЧЕНИЯ ВЫСОКООЧИЩЕННОГО РЕКОМБИНАНТНОГО ПОЛИПЕПТИДА СО СВОЙСТВАМИ ФАКТОРА НЕКРОЗА ОПУХОЛЕЙ АЛЬФА ЧЕЛОВЕКА | 2004 |
|
RU2274656C1 |
| СПОСОБ ОЧИСТКИ РЕКОМБИНАНТНОГО ГРАНУЛОЦИТАРНОГО КОЛОНИЕСТИМУЛИРУЮЩЕГО ФАКТОРА ЧЕЛОВЕКА | 2011 |
|
RU2440417C1 |
| СПОСОБЫ ОЧИСТКИ БЕЛКОВ, СОДЕРЖАЩИХ ОБЛАСТЬ Fc | 2006 |
|
RU2415865C2 |
| СПОСОБ ПРОМЫШЛЕННОЙ ОЧИСТКИ РОМИПЛОСТИМА | 2021 |
|
RU2804622C2 |
| ШТАММ-ПРОДУЦЕНТ БЕЗМЕТИОНИНОВОГО CRM197 НА ОСНОВЕ КЛЕТОК E. coli BL21 (DE3) | 2015 |
|
RU2575621C1 |
| ПРОМЫШЛЕННЫЙ СПОСОБ ПОЛУЧЕНИЯ И ОЧИСТКИ РЕКОМБИНАНТНОГО ГОРМОНА РОСТА ЧЕЛОВЕКА ИЗ ТЕЛЕЦ ВКЛЮЧЕНИЯ | 2011 |
|
RU2473556C1 |
Использование: биотехнология, медицинская и микробиологическая промышленность. Сущность изобретения: биомассу бактериального продуцента E. coli ВКПМ В-3967 обрабатывают высоким давлением, клеточный экстракт хроматографируют последовательно на гидроксилапатите с элюцией линейным градиентом Na2HPO4 (от 50 до 220-300 мМ) при pH 7,0, на ДЕ-52 целлюлозе с элюцией линейным градиентом NaCl (от 0 до 140-220 мМ) в 20 мМ трис-буфере при pH 7,5-8,0 и на Red-Sepharose CL-6B с элюцией линейным градиентом NaCl (от 0 до 1,5-2М) в 25 мМ Na2HPO4 при pH 7,2, а затем подвергают гель-фильтрации с использованием Sephadex G-25. 1 табл.
Способ выделения рекомбинантного человеческого альфа-фактора некроза опухоли, включающий разрушение клеток продуцента Escherichia coli с применением высокого давления, ионообменную хроматографию, аффинную хроматографию на связанном с красителем агарозном носителе и гель-фильтрацию, отличающийся тем, что в качестве продуцента используют штамм E. coli ВКПМ В-3967, полученный после разрушения клеток экстракт сначала подвергают хроматографии на гидроксилапатите с элюцией линейным градиентом Na2HPO4 от 50 ммоль до 220 300 ммоль при pH 7, ионообменную хроматографию осуществляют на DE-52 целлюлозе с элюцией линейным градиентом NaCl от 0 до 140 220 ммоль в 20 ммоль трис-буфере при pH 7,5 8,0, аффинную хроматографию проводят на Red Sepharose CL-6B с применением для элюции линейного градиента NaCl от 0 до 1,5 2,0 моль в 25 ммоль Na2HPO4, pH 7,2, а гель-фильтрацию осуществляют в фосфатно-солевом растворе при pH 7,2 с использованием Sephadex G-25.
| US, патент, 4871663, кл | |||
| Способ гальванического снятия позолоты с серебряных изделий без заметного изменения их формы | 1923 |
|
SU12A1 |
Авторы
Даты
1998-01-10—Публикация
1992-09-22—Подача