Изобретение относится к биотехнологии, генетической и белковой инженерии, конкретно, к способу выделения и очистки рекомбинантного белка, аналога фрагмента каппа-казеина человека (рекомбинантного белка EL1), обладающего цитотоксической активностью по отношению к раковым клеткам человека.
Снижение смертности людей от злокачественных образований является важной задачей современной медицины. Одним из направлений при решении данной задачи является разработка и внедрение современных противоопухолевых средств. Особого внимания заслуживает создание препаратов, индуцирующих апоптоз раковых клеток. В настоящее время несколько таких белковых препаратов уже применяются в клиниках для терапии некоторых онкологических заболеваний. В основном это препараты на основе фактора некроза опухолей (ФНО) и других белков семейства ФНО (TRIAL, FasL).
Известен способ выделения и очистки рекомбинантного белка ФНО-бета, включающий культивирование штамма-продуцента E.coli SG20050/pLT 21, разрушение клеток ультразвуком, удаление клеточного дебриса, хроматографическую очистку на колонках с диэтиламиноэтилцеллюлозой (ДЕАЕ-целлюлозой) и гидроксилапатитом и дополнительную стадию очистки продукта на гидроксилапатите в градиенте концентрации калия фосфорнокислого однозамещенного при значениях рН 7,0-7,2 (Патент RU 2132385 C1, оп. 27.06.1999).
Известен способ выделения и очистки рекомбинантных противоопухолевых белков TRAIL человека, заключающийся в следующем. Разрушенную клеточную массу осаждают центрифугированием при 28000 об/мин в течение 40 мин. Растворимую фракцию наносят на хроматографическую колонку с никелевой агарозой (Ni-NTA High Performance). Слитные белки Trx-DR5-A или Trx-DR5-B элюируют в буфере, содержащем 25 мМ NaH2PO4, 500 мМ NaCl, 500 мМ имидазола (рН 7.4). Очищенные препараты диализуют против буфера, содержащего 50 мМ Tris/HCl (рН 8.0), 80 мМ NaCl и 1 мМ ДТТ при 4°С в течение 18 часов. После диализа белки Trx-DR5-A или Trx-DR5-B расщепляют рекомбинантной легкой цепью человеческой энтеропептидазы в течение 18 часов при комнатной температуре. После расщепления остаточную активность энтеропептидазы удаляют на колонке с STI (soybean trypsin inhibitor, соевый ингибитор трипсина)-агарозой. Мутантные белки DR5-A или DR5-B отделяют от тиоредоксина на колонке с никелевой агарозой. На последней стадии препараты диализуют против буфера, содержащего 50 мМ фосфата натрия (рН 7.5) и 150 мМ NaCl, после чего стерилизуют через фильтр и хранят при 4°С для дальнейшего использования (патент RU 2405038 C1, оп. 27.11.2010).
Известен способ получения гибридного белка TNFRl-Fc, включающий культивирование клеток НЕК293, последовательно трансформированных введением вектора pFIG-hTNFr и вектора psiRNA-h7SK-miR7 в жидкой питательной среде с последующим выделением и очисткой белка TNFRl-Fc с помощью аффинной хроматографии на G сефарозе (Amersham). Для этого колонки объемом 5 мл уравновешивают рабочим буфером, содержащим 25 мМ трис-HCl, рН 7.5, 150 мМ NaCl, пропускают полученные супернатанты через колонку со скоростью 1 мл/мин, затем промывают колонки рабочим буфером (10 V колонки) и элюируют белок 0,1М раствором глицина рН 2,5 в пробирки, содержащие 100 мМ раствор трис-HCl, рН 9,0 (патент RU 2625010 C1, оп. 11.07.2017).
Однако препараты на основе противовоспалительных цитокинов вызывают серьезные побочные эффекты, что ограничивает их применение, поэтому поиск новых белков, способных подавлять рост и вызывать апоптотическую гибель раковых клеток является актуальной задачей.
Ранее был обнаружен и исследован природный пептид, названный лактаптином, обладающий цитотоксическим действием на раковые клетки (патент RU 2317304 C1, оп. 20.02.2008). Этот пептид, являющийся фрагментом каппа-казеина из человеческого молока, имеет молекулярную массу около 8,6 кДа и содержит установленную последовательность из 74 аминокислотных остатков, в которую входит протеолитический фрагмент каппа-казеина с 63 по 123 аминокислотный остаток. Известный белок обладает апоптотической активностью в отношении культур клеток аденокарциномы молочной железы MCF-7 (Некипелая В.В. и др. Лактаптин - пептид человеческого молока, индуцирующий апоптоз клеток аденокарциномы MCF-7 (Докл. АН. - 2008, - Т. 419. - С. 268-2712)).
Основным недостатком препарата на основе природного каппа-казеина человека является дороговизна и ограниченность источника сырья для его производства.
Позднее был получен ряд рекомбинантных аналогов природного белка (Semenov D.V. et al., The Protein Journal. - 2010. - Vol. 29. - N. 3. - P. 174-180; патент ЕАПО 023475, оп. 30.06.2016; патент ЕАПО 023387, оп. 31.05.2016) и показано, что рекомбинантные аналоги лактаптина индуцируют апоптоз раковых клеток человека в культуре и тормозят рост и метастазирование опухолей животных и человека в системе in vivo.
Наиболее близким к заявляемому способу - прототипом, является способ выделения и очистки аналога лактаптина, рекомбинантного белка RL2, в системе Е.coli, заключающийся в следующем.
Культуральную среду, полученную со стадии культивирования клеток-продуцентов E.coli XL-blu/pFK2, очищают с помощью аффинной хроматографии на никелевой агарозе Ni-NTA (никель нитрилотриуксусной кислоте). Для этого, на хроматографическую колонку с Ni-NTA агарозой, уравновешенную буфером А, содержащем 50 мМ Na-фосфатный буфер рН 8.0, 300 мМ NaCl, 10 мМ имидазол, 1 мМ фенилметилсульфонил фторид, 10 мМ 2-меркаптоэтанол, наносят лизат индуцированных клеток со скоростью потока 1 мл/мин. Для удаления неспецифически сорбирующихся белков E.coli элюируют 20 мл буфера А, содержащего 50 мМ имидазола. Рекомбинантный пептид RL2 элюируют 10 мл буфера Б, содержащего 250 мМ имидазола, а затем проводят дополнительную элюцию в денатурирующих условиях 10 мл буфера В, содержащего 50 мМ Трис-HCl рН 8.0, 6 М гуанидин-HCl. Полученные белковые фракции дважды диализуют в течение 18 ч при 5°С против раствора, содержащего 150 мМ NaCl и Трис-HCl рН 7.5. Фракции, содержащие рекомбинантный белок RL2, концентрируют ионообменной хроматографией на диэтиламиноэтилцеллюлозе (ДЕАЕ-целлюлозе). Общий выход RL2 составляет 150 мкг из 500 мл культуры клеток Escherichia coli (патент RU 2401307 С1, оп. 10.10.2010)
Недостатками прототипа являются низкая специфическая активность и недостаточная чистота целевого продукта из-за загрязнения со-выделяемыми липополисахаридами (LPS) бактерий-продуцентов, которые могут вызывать неспецифические иммунные реакции при введении млекопитающим.
Задачей изобретения является разработка способа выделения и очистки рекомбинантного белка EL1, аналога фрагмента каппа-казеина человека, продуцируемого эукариотическими клетками НЕК293Т, обладающего высокой цитотоксической активностью по отношению к раковым клеткам человека.
Технический результат: повышение специфической активности и чистоты целевого продукта.
Поставленная задача достигается предлагаемым способом, заключающимся в следующем.
Культуральную среду, полученную от клеток эмбрионального почечного эпителия человека (НЕК293Т) концентрируют и очищают с помощью ионообменной хроматографии на сульфопропил сефарозе (SP-сефарозе), для чего к образцу культуральной среды добавляют два объема 50-100 мМ ацетатного буфера рН 5.5 и наносят на хроматографическую колонку, уравновешенную первым буферным раствором, содержащим 50-75 мМ NaCl, 50 мМ Na-ацетатный буфер рН 6.0. После нанесения образца сорбент промывают первым буферным раствором. Для удаления неспецифически сорбирующихся белков культуральной среды, проводят последовательную элюцию сначала вторым буферным раствором, содержащим 150-175 мМ NaCl, 50 мМ Na-ацетатный буфер рН 6.0, затем третьим буферным раствором, содержащим 50-75 мМ NaCl, 50 мМ Na-ацетатный буфер рН 5.5 и далее четвертым буферным раствором, содержащим 50-75 мМ NaCl, 50 мМ Tris-HCl рН 7.0. Фракцию положительно заряженных белков, предположительно содержащую рекомбинантный белок EL1, элюируют пятым буферным раствором, содержащим 300-400 мМ NaCl, 50 мМ Tris-HCl рН 7.0.
Фракции, содержащие рекомбинантный белок EL1, далее очищают на хроматографической колонке с сорбентом IMAC сефарозой (Immobilized metal ion affinity chromatography), с ионами никеля, и уравновешенной пятым буферным раствором. Не связавшиеся с сорбентом белки элюируют пятым буферным раствором.
Для удаления слабо связанных с сорбентом белков проводят элюцию сначала шестым буферным раствором, содержащим 20-25 мМ имидазол, 50 мМ Tris-HCl рН 7.0, а затем седьмым буферным раствором, содержащим 500-600 мМ NaCl, 50 мМ Na-ацетатный буфер рН 6.0. Элюцию прочно связанных с сорбентом белков проводят восьмым буферным раствором, содержащим 300-400 мМ имидазола. Фракцию, содержащую белок, с электрофоретической подвижностью, соответствующей 16 кДа (финальная стадия очистки) далее двукратно диализуют против раствора 150 мМ NaCl в течение 18 ч при 5°С. На всех этапах очистки все полученные фракции анализируют методом электрофореза в 12% полиакриламидном геле (ПААГ) по Лэммли (Laemmli U.K. Cleavage of structural proteins during the assembly of the head of bacteriophage T4. // Nature. - 1970. - V.227. - P. 680-685). Выход целевого продукта составляет 17 мкг из 100 мл культуральной жидкости от клеток-продуцентов НЕК293Т.
Определяющими отличиями предлагаемого способа от прототипа, являются:
1). В качестве клеток-продуцентов используют клетки НЕК293Т, экспрессирующие рекомбинантный белок EL1, что позволяет повысить качество целевого продукта за счет повышения его цитотокической ативности.
2) Первую стадию хроматографической очистки рекомбинантного белка EL1 от компонентов культуральной среды осуществляют с помощью катионообменной хроматографии на SP-сефарозе, а вторую стадию очистки осуществляют с помощью никель-аффинной хроматографии на IMAC- сефарозе, что позволяет повысить качество целевого продукта.
3) Для элюции слабо- и неспецифически связанных с сорбентом белков и целевого продукта используют экспериментально подобранную оптимальную систему из восьми буферных растворов, что позволяет повысить чистоту и гомогенность целевого продукта.
Изобретение иллюстрируется следующими графическими материалами:
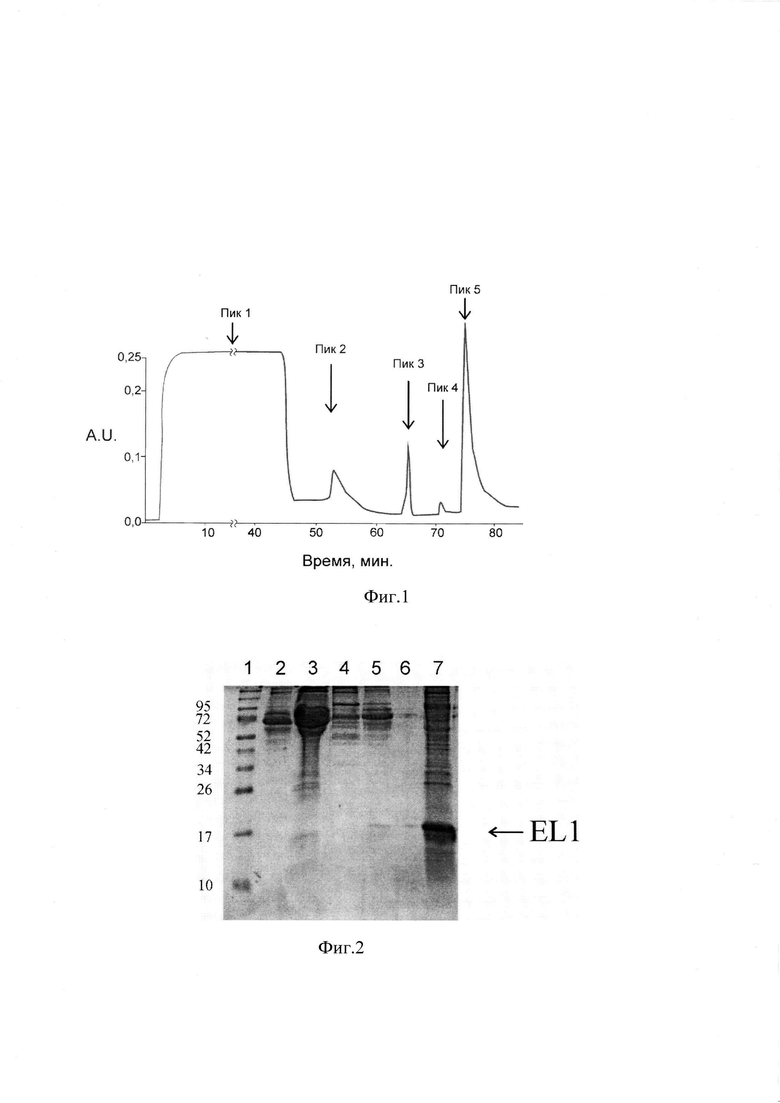
На фиг. 1 приведена хроматограмма (пики 1-5) культуральной среды, кондиционированной клетками НЕК293Т, экспрессирующими рекомбинантный белок EL1 на ионообменной SP-сефарозе.
На фиг. 2 приведена электрофореграмма в 12% SDS-ПААГ белков фракций, полученных выделением рекомбинантного белка EL1 ионообменной хроматографией на SP-сефарозе (пики 1-5), где дорожки: 1 -белковые маркеры, молекулярная масса в кДа приведена слева; 2 - Белки культуральной среды от клеток-продуцентов НЕК293Т, экспрессирующих белок EL1; 3 - пик 1 - белки не сорбирующиеся на SP-сефарозу; 4 - пик 2 -неспецифически сорбирующиеся белки, элюируемые раствором 150 мМ NaCl, при рН 6.0; 5 - пик 3 - белки, элюируемые 50 мМ NaCl при рН 5.5; 6-пик 4 -белки, элюируемые 50 мМ NaCl при рН 7.0; 7 - пик 5 -белки, элюируемые 300 мМ NaCl при рН 7.0.
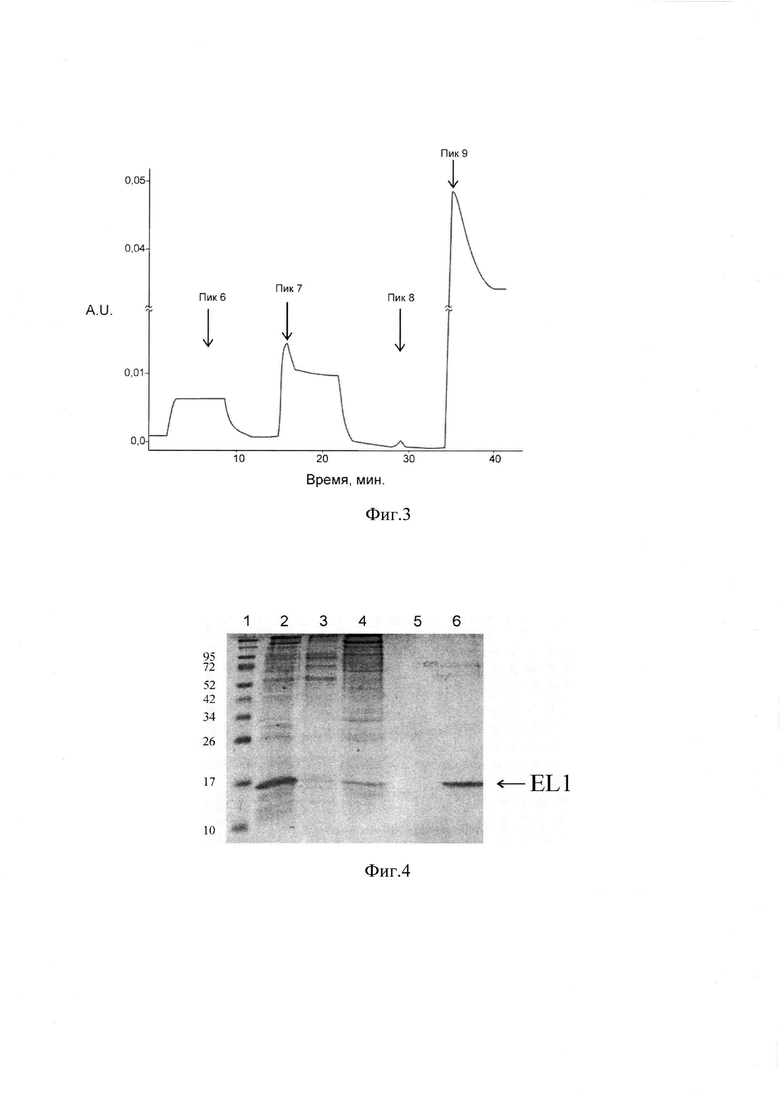
На фиг. 3 приведена хроматограмма (пики 6-9) на IMAC-сефарозе фракции белков, предварительно элюированной пятым буферным раствором с SP-сефарозы и содержащей рекомбинантный белок EL1.
На фиг. 4 приведена электрофореграмма разделения в 12% SDS-ПААГ белковых фракций, полученных в результате аффинной хроматографии на IMAC-сефарозе (образцы пиков 5-9), где дорожки: 1 - белковые маркеры, (молекулярная масса в кДа приведена слева); 2 - пик 5 - фракция, элюированная с SP-сефарозы 300 мМ NaCl; 3 - пик 6 - белки, не сорбирующиеся на IMAC-Sepharose; 4 - пик 7 - белки, элюируемые 20 мМ имидазола при рН 7.0; 5 - пик 8 - белки, элюируемые 600 мМ NaCl при рН 6.0: 6 - пик 9 - белки, элюируемые 250 мМ имидазола.
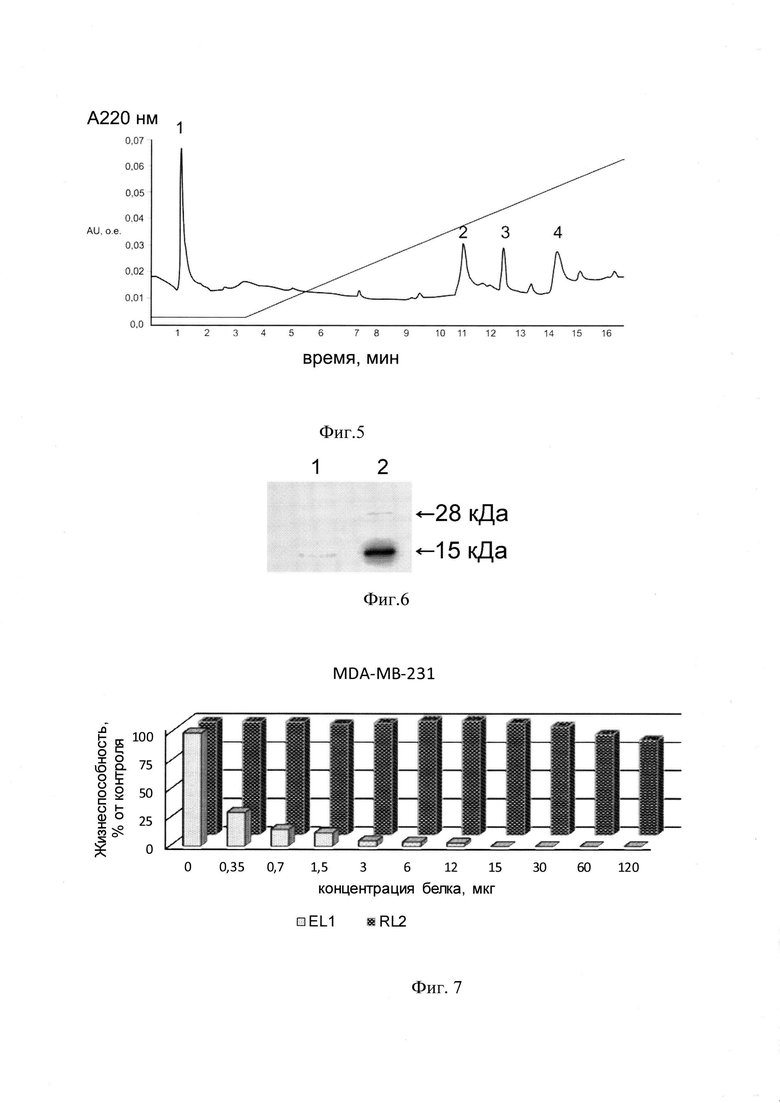
На фиг. 5 приведен анализ очищенного белка EL1 после стадии диализа против 150 мМ NaCl (финальная стадия очистки) на чистоту методом ОФ ВЭЖХ в градиенте от 0 до 100% ацетонитрила в 0.1% Н3РО4, пик 3 - белок EL1, пик 1 - NaCl, пики 2,4 - системные пики.
На фиг. 6 приведен анализ очищенного белка EL1 после стадии диализа против 150 мМ NaCl (финальная стадия очистки) на подлинность методом вестерн-блота.
На фиг. 7 приведен анализ цитотоксической активности белка EL1 после финальной стадии очистки в отношении клеток аденокарциномы молочной железы человека MDA-MB-231.
Для лучшего понимания сущности предлагаемого изобретения ниже следуют примеры его осуществления.
Пример 1. Получение трансфицированных клеток человека НЕК293Т, секретирующих рекомбинантный белок EL1.
Клетки НЕК293 трансформируют сконструированной плазмидой pEL1 (Вавиловский журнал генетики и селекции. - 2017. - 21(7):764-769) при помощи кальций-фосфатной трансфекциии и выращивают 6 ч в среде IMDM (Iscove's Modified Dulbecco’s Medium) с добавлением фетальной сыворотки коров до 10%, 100 мкг/мл стрептомицина и 100 ед./мл пенициллина в атмосфере 5% CO2 при 37°С. Через 6 часов после трансфекции среду в чашках заменяют на новую и инкубируют клетки 48 часов.
Пример 2. Выделение и очистка рекомбинантного белка EL1.
Культуральную среду, полученную от клеток-продуцентов НЕК293Т, концентрировали и очищали с помощью ионообменной хроматографии на SP-сефарозе, согласно инструкции производителя. Для этого, к образцу культуральной среды добавляли два объема 100 мМ ацетатного буфера рН 5.5 и наносили со скоростью 1 мл/мин на хроматографическую колонку, упакованную 5-ю мл SP-сефарозы (SP Sepharose Fast Flow 6) и уравновешенную буферным раствором 1, содержащим 50 мМ NaCl, 50 мМ Na-ацетатный буфер рН 6.0. После нанесения образца сорбент промывали буферным раствором 1. Для удаления неспецифически сорбирующихся белков культуральной среды проводили последовательную элюцию буферными растворами 2, 3 и 4, содержащими соответственно 150 мМ NaCl, 50 мМ Na-ацетатный буфер рН 6.0; 50 мМ NaCl, 50 мМ Na-ацетатный буфер рН 5.5 и 50 мМ NaCl, 50 мМ Tris-HCl рН 7.0. Фракцию положительно заряженных белков, предположительно содержащую рекомбинантный белок EL1, элюировали буферным раствором 5, содержащим 300 мМ NaCl, 50 мМ Tris-HCl рН 7.0.
Все полученные хроматографические фракции анализировали методом электрофореза в 12% ПААГ с SDS по Лэммли в восстанавливающих условиях для идентификации фракции, содержащей рекомбинантный белок EL1.
Фракции, содержащие рекомбинантный белок EL1 далее очищали методом аффинной хроматографии со скоростью 1 мл/мин. на хроматографической колонке, упакованной 5-ю мл сорбента IMAC-сефарозой (IMAC Sepharose Fast Flow 6), с ионами никеля, и уравновешенной буферным раствором 5.
Не связавшиеся с сорбентом белки, элюировали буферным раствором 5. Для удаления слабо связанных с сорбентом белков проводили элюцию буферными растворами 6 и 7, содержащими 20 мМ имидазол, 50 мМ Tris-НС1 рН 7.0 и 600 мМ NaCl, 50 мМ Na-ацетатный буфер рН 6.0, соответственно. Элюцию прочно связанных с сорбентом белков проводили буферным раствором 8, содержащим 250 мМ имидазола. Все фракции анализировали методом электрофореза в 12% ПААГ с SDS по Лэммли в восстанавливающих условиях. Фракцию, содержащую белок, с электрофоретической подвижностью, соответствующей 16 кДа далее диализовали против раствора 150 мМ NaCl (две смены по 18 ч при 5°С). Целевой продукт (отдиализованный образец) анализировали хроматографически методом ВЭЖХ.
На фиг. 5 видно, что по сравнению с градиентом без образца, на хроматографии выделяется всего один пик. Таким образом, очищенный образец содержит всего один белковый продукт. Соответствие белка с молекулярной массой около 16 кДа целевому белку - рекомбенантному белку EL1 - анализировали методом вестерн-блота с применением моноклональных антител к рекомбинантному белку RL2. На фиг. 6 видно, что на Вестерн-блоте визуализируется единственная полоса. Данная полоса соответствует белку - фрагменту каппа-казеина человека с подвижностью, соответствующей белку с молекулярной массой около 16 кДа. В качестве контрольного образца нанесен белок RL2, две полосы которого соответствуют мономерной и димерной формам фрагмента каппа-казеина. Таким образом, белок, полученный после хроматографической очистки, соответствует целевому рекомбинантному белку EL1.
Концентрацию целевого белка в образце определяли методом Брэдфорда (Anal. Biochem. - 1976. - V. 72. - P. 248-254). Для построения калибровочной кривой использовали бычий сывороточный альбумин (Serva, США). Выход целевого продукта составил 17 мкг из 100 мл культуральной жидкости от клеток-продуцентов НЕК293Т.
Пример 3. Выделение и очистка рекомбинантного белка EL1.
Культуральную среду, полученную от клеток-продуцентов НЕК293Т концентрировали и очищали с помощью ионообменной хроматографии на колонке с SP-сефарозой (GE HealthCare, Швеция). Для этого, к образцу культуральной среды добавляли два объема 50 мМ ацетатного буфера рН 5.5 и наносили со скоростью 1 мл/мин на хроматографическую колонку, упакованную 5-ю мл SP-сефароза и уравновешенную буферным раствором 1, содержащим 75 мМ NaCl, 50 мМ Na-ацетатный буфер рН 6.0. После нанесения образца сорбент промывали буферным раствором 1. Для удаления неспецифически сорбирующихся белков культуральной среды проводили последовательную элюцию буферными растворами 2, 3 и 4, содержащими соответственно 175 мМ NaCl, 50 мМ Na-ацетатный буфер рН 6.0; 75 мМ NaCl, 50 мМ Na-ацетатный буфер рН 5.5 и 75 мМ NaCl, 50 мМ Tris-HCl рН 7.0. Фракцию положительно заряженных белков, предположительно содержащую рекомбинантный белок EL1, элюировали раствором 5, содержащим 400 мМ NaCl, 50 мМ Tris-HCl рН 7.0.
Все полученные хроматографические фракции анализировали методом электрофореза в 12% ПААГ с SDS по Лэммли в восстанавливающих условиях для идентификации фракции, содержащей рекомбинантный белок EL1. Фракции, содержащие рекомбинантный белок EL1, далее очищали методом аффинной хроматографии со скоростью 1 мл/мин. на хроматографической колонке, упакованной 5-ю мл сорбента IMAC сефароза (IMAC Sepharose Fast Flow 6), с ионами никеля, и уравновешенной раствором 5.
Не связавшиеся с сорбентом белки, элюировали раствором 5. Для удаления слабо связанных с сорбентом белков проводили элюцию буферными растворами 6 и 7, содержащими 30 мМ имидазол, 50 мМ Tris-HCl рН 7.0 и 500 мМ NaCl, 50 мМ Na-ацетатный буфер рН 6.0, соответственно. Элюцию прочно связанных с сорбентом белков проводили буферным раствором 8, содержащим 400 мМ имидазола. Все фракции анализировали методом электрофореза в 12% ПААГ с SDS по Лэммли в восстанавливающих условиях. Фракцию, содержащую белок, с электрофоретической подвижностью, соответствующей 16 кДа далее диализовали против раствора 150 мМ NaCl (две смены по 18 ч при 5°С). Отдиализованный образец анализировали хроматографически методом ВЭЖХ. Соответствие белка с молекулярной массой около 16 кДа целевому белку - рекомбенантному белку EL1 анализировали методом вестерн-блота с применением моноклональных антител к рекомбинантному белку RL2. Концентрацию целевого белка в образце определяли методом Брэдфорд. Для построения калибровочной кривой использовали бычий сывороточный альбумин (Serva, США). Выход целевого продукта составил 17 мкг из 100 мл культуральной жидкости от клеток-продуцентов НЕК293Т.
Пример 4. Оценка цитотоксической активности рекомбинантного белка EL1 по отношению к раковым клеткам человека MDA-MB-231 при помощи МТТ-теста.
Для оценки цитотоксической активности очищенного предложенным способом рекомбинантного белка EL1 используют клетки аденокарциномы молочной железы человека линии MDA-MB-231, полученные из коллекции клеточных культур ЗАО «Исследовательский Институт Химического Разнообразия» (г. Химки, Московская область).
Клетки MDA-MB-231 культивируют в среде L15 (Gibco, Life Technologies, UK) в присутствии 10% FBS, 2 мМ L-глутамина, 250 мг/мл амфотерицина В и 100 ед./мл пенициллина/стрептомицина. Клетки T98G и РС3 культивируют в среде IMDM (Gibco, Life Technologies, UK) в присутствии 10% FBS, 2 мМ L-глутамина и 100 ед./мл пенициллина/стрептомицина. Клетки культивируют при 37°С в атмосфере 5% CO2.
В качестве способа, позволяющего быстро и точно оценить цитотоксический эффект рекомбинантного белка EL1, полученного в про- или эукариотической системе экспрессии, используют МТТ-тест. Клетки высаживают на 96-луночные планшеты для культур клеток в концентрации 4-5*103 клеток/лунку в 100 мкл питательной среды RPMI-1640 (Gibco, Life Technologies, UK), содержащей 10% по объему FBS с добавлением раствора антибиотиков-антимикотиков состава: 100 ед./мл пенициллина G, 100 мкг/мл стрептомицина сульфата, 0,25 мкг/мл амфотерицина, и инкубируют в течение 24 ч при температуре 37°С в атмосфере 5% СО2.
В качестве препарата сравнения используют рекомбинантный белок RL2 - аналог фрагмента каппа-казеина человека, полученный в прокариотической системе (E.coli). Из препарата сравнения RL2 и EL1 готовят ряд последовательных разбавлений в питательной среде RPMI-1640, не содержащей FBS. Вносят по 100 мкл полученных разведений белка в лунки пластикового планшета с клетками. Через 48 час инкубации при температуре 37°С в атмосфере 5% СО2 удаляют среду из лунок и вносят в каждую лунку по 200 мкл питательной среды RPMI-1640 и 10 мкл раствора МТТ (Sigma, США) с концентрацией 5 мг/мл, после чего продолжают инкубацию в тех же условиях в течение 4 ч. Затем удаляют среду с МТТ из лунок и растворяют образовавшиеся кристаллы МТТ-формазана добавлением 150 мкл ДМСО. Оптическую плотность растворенного в ДМСО МТТ-формазана измеряют на многоканальном планшетном сканере при λ=570 нм.
Результаты эксперимента представлены на фиг. 7 и свидетельствуют о том, что инкубация клеток в присутствии препарата сравнения - рекомбинантного белка RL2, полученного в системе Escherichia coli, и в присутствии рекомбинантного белка EL1, приводит к дозозависимому снижению жизнеспособности раковых клеток. Концентрация рекомбинантного очищенного белка RL2, приводящая к двукратному снижению жизнеспособности протестированных раковых клеточных линий (IC50) соответствует значению ~200 мкг/мл, в то время как IC50 для EL1, секретируемого человеческими клетками линии НЕК293Т, трансфицированными pEL1, не выше 400 нг/мл, т.е. наблюдаются по меньшей мере 500-кратные различия в IC50 для данных форм лактаптина.
Предлагаемый способ позволяет получать рекомбинантный белок, обладающий высокой удельной активностью против раковых клеток, что, в свою очередь, позволяет снизить белковую нагрузку при введении в качестве лекарственного средства млекопитающим.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ РЕКОМБИНАНТНОГО АНТАГОНИСТА РЕЦЕПТОРА ИНТЕРЛЕЙКИНА-1 ЧЕЛОВЕКА "АРИЛ" | 2004 |
|
RU2326947C2 |
| СПОСОБ ВЫДЕЛЕНИЯ И ОЧИСТКИ РЕКОМБИНАНТНОЙ ЧЕЛОВЕЧЕСКОЙ ПРОУРОКИНАЗЫ М5 | 2013 |
|
RU2553533C2 |
| Рекомбинантная плазмидная ДНК pET-15b_T1_RL, обеспечивающая синтез рекомбинантного слитого белка, состоящего из опухоль-специфического пептида и противоопухолевого пептида RL2, и рекомбинантный слитый белок, обладающий цитотоксической активностью по отношению к раковым клеткам и таргетными свойствами к опухолевой ткани | 2016 |
|
RU2619050C1 |
| СПОСОБ ПОЛУЧЕНИЯ РЕКОМБИНАНТНОЙ В-1,4-ГАЛАКТОЗИДАЗЫ BGAA ИЗ STREPTOCOCCUS PNEUMONIAE | 2019 |
|
RU2698460C1 |
| Рекомбинантная плазмидная ДНК pET-15b_T3_RL, обеспечивающая синтез рекомбинантного слитого белка, состоящего из опухоль-специфического пептида и противоопухолевого пептида RL2, и рекомбинантный слитый белок, обладающий противоопухолевой активностью по отношению к раку молочной железы человека | 2016 |
|
RU2619053C1 |
| СПОСОБ КРУПНОМАСШТАБНОГО ПОЛУЧЕНИЯ, ВЫДЕЛЕНИЯ И ОЧИСТКИ РЕКОМБИНАНТНОГО ГРАНУЛОЦИТАРНОГО КОЛОНИЕСТИМУЛИРУЮЩЕГО ФАКТОРА ЧЕЛОВЕКА | 2010 |
|
RU2487885C2 |
| Рекомбинантный пептид EL1, обладающий цитотоксической активностью по отношению к раковым клеткам человека | 2017 |
|
RU2683221C1 |
| ШТАММ БАКТЕРИЙ Escherichia coli - ПРОДУЦЕНТ БЕЛКА ТЕПЛОВОГО ШОКА 70 И СПОСОБ ПОЛУЧЕНИЯ ПРЕПАРАТА БЕЛКА ТЕПЛОВОГО ШОКА ЧЕЛОВЕКА | 2013 |
|
RU2564120C2 |
| СПОСОБ ПОЛУЧЕНИЯ РЕКОМБИНАНТНОЙ ЭНДОНУКЛЕАЗЫ SERRATIA MARCESCENS | 2021 |
|
RU2795623C2 |
| Рекомбинантная плазмидная ДНК pET21-IFN-γ, содержащая ген, кодирующий гамма-интерферон человека, штамм E.coli BL21/pET21-IFN-γ - продуцент рекомбинантного гамма-интерферона человека и способ получения гамма-интерферона человека | 2023 |
|
RU2827613C1 |
Изобретение относится к биотехнологии, генетической и белковой инженерии. Способ выделения и очистки рекомбинантного белка, аналога фрагмента каппа-казеина человека, включает культивирование клеток-продуцентов НЕК293Т, экспрессирующих рекомбинантный белок EL1, концентрирование и очистку культуральной среды сначала с помощью катионообменной хроматографии на SP-сефарозе, а затем с помощью никель-аффинной хроматографии на IMAC-сефарозе, осуществление последовательной элюции с сорбентов примесных белков и целевого продукта с использованием системы из восьми буферных растворов и последующую очистку целевого продукта диализом против 150 мМ NaCl. Изобретение позволяет повысить специфическую активность и чистоту целевого продукта. 7 ил., 4 пр.
Способ выделения и очистки рекомбинантного белка, аналога фрагмента каппа-казеина человека, обладающего цитотоксической активностью по отношению к раковым клеткам человека, включающий культивирование клеток-продуцентов, концентрирование и очистку культуральной среды с помощью ионообменной хроматографии, последовательную элюцию с сорбента примесных белков и целевого продукта с помощью буферных растворов, очистку полученных белковых фракций путем двукратного диализа в течение 18 ч при 5°С против раствора, содержащего 150 мМ NaCl, отличающийся тем, что в качестве клеток-продуцентов используют клетки HEK293T, экспрессирующие рекомбинантный белок EL1, очистку культуральной среды осуществляют с помощью катионообменной хроматографии на SP-сефарозе, а фракции, содержащие рекомбинантный белок EL1, очищают с помощью никель-аффинной хроматографии на IMAC-сефарозе, последовательную элюцию с сорбента примесных белков и целевого продукта проводят с использованием системы из восьми буферных растворов, при этом к образцу культуральной среды добавляют два объема 50-100 мМ ацетатного буфера рН 5.5 и наносят на хроматографическую колонку с SP-сефарозой, уравновешенную первым буферным раствором, содержащим 50-75 мМ NaCl, 50 мМ Na-ацетатный буфер рН 6.0, элюцию с сорбента SP-сефароза неспецифически сорбирующихся белков культуральной среды проводят сначала вторым буферным раствором, содержащим 150-175 мМ NaCl, 50 мМ Na-ацетатный буфер рН 6.0, затем третьим буферным раствором, содержащим 50-75 мМ NaCl, 50 мМ Na-ацетатный буфер рН 5.5 и далее четвертым буферным раствором, содержащим 50-75 мМ NaCl, 50 мМ Tris-HCl рН 7.0, элюцию с сорбента SP-сефароза фракции белков, содержащей рекомбинантный белок EL1, проводят пятым буферным раствором, содержащим 300-400 мМ NaCl, 50 мМ Tris-HCl рН 7.0, элюцию с сорбента IMAC-сефароза слабо связанных белков проводят сначала шестым буферным раствором, содержащим 20-25 мМ имидазол, 50 мМ Tris-HCl рН 7.0, а затем седьмым буферным раствором, содержащим 500-600 мМ NaCl, 50 мМ Na-ацетатный буфер рН 6.0, а элюцию с сорбента IMAC-сефароза прочно связанных белков проводят восьмым буферным раствором, содержащим 300-400 мМ имидазола.
| РЕКОМБИНАНТНАЯ ПЛАЗМИДНАЯ ДНК pFK2, ОБЕСПЕЧИВАЮЩАЯ СИНТЕЗ РЕКОМБИНАНТНОГО ПЕПТИДА, ЯВЛЯЮЩЕГОСЯ АНАЛОГОМ ФРАГМЕНТА КАППА-КАЗЕИНА ЧЕЛОВЕКА, СПОСОБ ПОЛУЧЕНИЯ РЕКОМБИНАНТНОГО ПЕПТИДА И РЕКОМБИНАНТНЫЙ ПЕПТИД, АНАЛОГ ФРАГМЕНТА КАППА-КАЗЕИНА ЧЕЛОВЕКА, ОБЛАДАЮЩИЙ АПОПТОТИЧЕСКОЙ АКТИВНОСТЬЮ ПО ОТНОШЕНИЮ К РАКОВЫМ КЛЕТКАМ | 2009 |
|
RU2401307C1 |
| СПОСОБ ХРОМАТОГРАФИЧЕСКОГО ВЫДЕЛЕНИЯ И ОЧИСТКИ БЕЛКА | 2006 |
|
RU2322505C1 |
| US 20170174721 A1, 22.06.2017 | |||
| ИБРАГИМОВ А.Н | |||
| и др | |||
| Хроматографические методы очистки белков | |||
| Учебно-методическое пособие, Казань, 2013, с.21 | |||
| ФОМИН А.С | |||
| и др | |||
| Генно-инженерные аналоги потенциального противоопухолевого пептида лактаптина, Вестник Новосибирского государственного университета | |||
| Серия: Биология, клиническая медицина, 2010, т.8, N 1, с.17-25. | |||
Авторы
Даты
2019-07-01—Публикация
2018-11-12—Подача