Изобретения относятся к области биотехнологии, в частности, к генетической инженерии высших растений и могут быть использованы для получения трансгенных растений, устойчивых к вирусной инфекции.
Известны способы получения трансгенных растений с антивирусной устойчивостью, которая обеспечивается с помощью экспрессии сателлитной или антисмысловой РНК в трансгенных растениях, а также в результате продукции в трансгенном растении белков вирусной оболочки. Общим недостатком известных способов является то, что они не обеспечивают защиту растений от широкого круга вирусов, из-за нестабильности вновь созданных механизмов устойчивости к вирусной инфекции [1].
Известны способы получения продуцирующих интерферон клеток человека, бактерий, дрожжей. Известен способ введения и временной экспрессии гена интерферона человека в растения турнепса в составе вируса мозаики цветной капусты [2].
Известна рекомбинантная плазмидная ДНК, кодирующая синтез альфа-интерферона в растениях, сконструированная на основе вируса мозаики цветной капусты (CAMV) со встроенным вместо orf II и, таким образом, находящимся под управлением 35S промотора, геном альфа-интерферона [2]. Вектор обеспечивает довольно высокий уровень синтеза интерферона в зараженных клетках 2•104-2•105 е. а. /г ткани, однако экспрессия альфа-интерферона человека не защищает растения от заражения вирусом желтой мозаики турнепса.
Основным недостатком известного способа и данной плазмидной ДНК является то, что в качестве переносимого гена плазмида содержит ген альфа-интерферона, и кроме того, гены, переносимые векторами такого типа не интегрируют в геном и, следовательно, не наследуются стабильно. Стабильное встраивание и экспрессию гена интерферона можно осуществить лишь путем генетической трансформации растений.
Наиболее ближайшим к заявляемому способу - прототипом, является способ получения трансгенных растений табака, устойчивых к вирусу табачной мозаики [3]. Способ заключается в клонировании гена рекомбинантного альфа-интерферона человека в экспрессионный вектор pGT6 под контроль сильного конститутивного промотора 35S из вируса мозаики цветной капусты, передаче полученной рекомбинантной плазмиды pST20 в штамм Agrobacterium tumefaciens C158, несущий "разоруженную" Ti-плазмиду pGV 2260, с последующей интеграцией плазмид pST 20 и pGV 2260, инфицировании полученным штаммом листового материала растений, селекции по признаку устойчивости к канамицину на твердой агарозной среде, отборе и регенерации на селективной среде полноценных трансгенных растений. Основным недостатком известного способа является невысокая эффективность антивирусной защиты растений.
Наиболее ближайшей к заявляемой плазмиде - прототипом, является рекомбинантная плазмидная ДНК pST 20, в которой ген рекомбинантного альфа-интерферона встроен в экспрессионый вектор pST 6 под контроль сильного промотора 35S вируса мозаики цветной капусты [4]. Известная плазмида pST 20, размером 7,7 т. п. о. содержит:
- BamHI-BamHI фрагмент ДНК плазмиды PINF размером 0,9 т.п.о. с геном альфа-интерферона человека, а также сайты рестрикции, регуляторные участки, генетические маркеры.
Основной недостаток данной плазмидной ДНК заключается в том, что она в качестве переносимого гена содержит ген альфа-интерферона, тогда как известно, что бета-интерферон, как индуктор антивирусного ответа имеет ряд преимуществ перед альфа-интерфероном и проявляет антивирусную активность в более широком, чем альфа-интерферон, диапазоне концентраций. Кроме того известная плазмидная ДНК кодирует белок только с внутриклеточной локализацией, что может быть не оптимально для проявления антивирусной активности.
Технической задачей группы изобретений является повышение эффективности антивирусной защиты растений. Поставленная техническая задача достигается сконструированной новой плазмидой, определяющей синтез в растениях бета-интерферона, заключается в клонировании синтетического гена бета-интерферона в плазмиде pB 322 совместно с синтетическим олигонуклеотидным адаптером, содержащим необходимый для последующего клонирования сайт рестриктазы CLcI селекцией гибридных клонов гибридизацией на два олигонуклеотидных зонда, один из которых комплементарен последовательности гена бета-интерферона, а второй - один из олигонуклеотидов адаптеров, последующим встраиванием гена бета-интерферона, выщепленного из полученной плазмиды рестриктазами CLaI и BamHI в плазмиду, содержащую функциональные элементы, необходимые для трансформации и экспрессии перенесенного гена в растениях.
В результате получают рекомбинантную плазмидную ДНК PG11, размером 9,1 т. п. н. , продуцирующую бета-интерферон человека и состоящую из следующих элементов:
-ДНК векторной плазмиды PGSH 160 размером 8,5 т.п.н.;
-EcoRI - BamHI фрагмента ДНК плазмиды pSK-1Fs, содержащего ген бета-интерферона;
-гена bla, кодирующего бета-лактамазу;
-гена Sm/Sp, кодирующего устойчивость к стрептомицину и спектиномицину;
-гена NPTII, кодирующего неомицинфосфотрансферазу 11, обеспечивающую устойчивость трансгенных растений к канамицину;
-промоторов PT1 и PT11.
Физическая карта плазмиды с указанием генетических маркеров приведена на фиг. 1. Плазмида pG11 имеет уникальные сайты рестрикции BamHI, CLaI, ScaI, KpnI и NcoI, несет бактериальные маркеры устойчивости к аж1ицилину и спектиномицину, фрагменты ДНК вектора pGSH 160-RB, LB, 3'osc, 3'T7, PT1 и PT2, обеспечивающие перенос, интеграцию и экспрессию в геноме растений гена-репортера неомицинфосфотрансферазы II (NPTII) и гена бета-интерферона человека.
Отличие полученной рекомбинантной плазмидной ДНК pG11 от прототипа состоит в использовании синтетического гена бета-интерферона, что позволяет получать трансгенные растения с более высокой устойчивостью к вирусной инфекции.
Предлагаемый способ получения трансгенных растений заключается в следующем. Растения инфицируют штаммом Agrobacterium tumefaciens CP 58 CI Rif R, содержащем бета-интерферон человека и маркерный ген неомицинфосфотрансферазы. Инфицированные экспланты помещают на агаризованные среды для индукции каллусо образования. Отбор трансформированных клеток проводят в условиях суспензионных культур с добавлением селективного агента, для этого кусочки каллусов переносят в жидкие среды для регенерации растений. Трансгенные растения с NPTII - активностью тестируют блот-гибридизацией и анализируют на устойчивость к вирусной инфекции.
Определяющим отличием предлагаемого способа от протопита является:
- использование рекомбинантной плазмидной ДНК pG11, определяющей синтез бета-интерферона человека в растениях, что позволяет повысить эффективность противовирусной защиты растений, так как бета-интерферон проявляет антивирусную активность в более широком диапазоне концентраций, чем альфа-интерферон, а индуцированная бета-интерфероновая устойчивость будет в меньшей степени зависеть от уровня продукции трансгена, определяющегося физиологическим состоянием растения, условиями окружающей среды и другими факторами;
- отбор трансформированных клеток, устойчивых к канамицину, проводят не на твердой агаризованной среде, а в условиях суспензионной культуры, что позволяет значительно повысить уровень трансформированных клеток и эффективность их отбора. Сущность группы изобретений поясняется следующими примерами.
Пример 1. Конструирование плазмиды pG11.
10 мкг ДНК плазмиды pSK-1Fs [5] обрабатывали 2 часа при 37oC рестриктазами EcoR (30 е.а.) и BamHI (50 е.а.) в 10 мкл буфера, содержащего 20 мМ трис-HCl pH 7,6, 50 мМ NaCI, 10 мМ MgCL2, (буфер M). Полученный гидролизат использовали для выделения фрагмента ДНК, содержащего ген бета-интерферона. С этой целью реакционную смесь разделяли электрофорезом в 1% геле агарозы, гель окрашивали раствором бромистого этидия в воде (1 мкг/мл) и фрагмент ДНК размером 0,5 т.п.н., выделяли из геля электроэлюцией на DЕ-81.
2 мкг ДНК векторной плазмиды рВR322 обрабатывали два часа при 37oC рестриктазами HindIII (10 е.а.) и BamHI (10 е.а.) в 30 мкл буфера М. Из полученного гидролизата выделяли фрагмент ДНК размером 3,7 т.п.н., как описано выше.
Смешивали 1 мкг HindIII-BamHI фрагмента плазмиды pBR 322, 1 мкг EcoRI-BamHI фрагмента ДНК плазмиды pSK-IFs, содержащего ген бета-интерферона, 0,3 мкг олигонуклеотида d(AGCTTAAGGGTATC-GAT) (Л1) и 0,3 мкг олигонуклеотида d(AATTATCGATACCCTTA) (Л2) в 20 мкл буфера, содержащего 20 мМ трис-HCl pH-7,6, 10 мМ MgCI2, в 1 мМ дитиотрейтола и 1 мМ АТФ (буфер Л). Смесь охлаждали до 4oC, добавляли 70 е.а. ДНК-лигазы фага T4 и инкубировали 16 часов. Лигазной смесью трансформировали компетентные клетки E. coli штамма MC1061 и трансформанты высевали на чашки с LB-агаром, содержащим 100 мкг/мл ампицилина. Клоны, несущие рекомбинантные плазмиды со встроенным геном и адаптером отбирали гибридизацией колоний с радиоактивно меченым олигонуклеотидом Л1 и последующим анализом плазмидных ДНК гибридизующихся клонов с помощью рестриктаз ClaI, BamHI и PstI. Частичное секвенирование методом Максама-Гилберта [6] в твердофазном варианте одной из плазмидных ДНК [7], отобранной по этим двум тестам, подтвердила соответствие нуклеотидной структуры в районе соединения гена с адаптером той, что была запланирована (плазмида pHCB). ClaI-BamHI фрагмент этой плазмиды был использован для конструирования плазмиды pG11. С этой целью 10 мкг ДНК плазмиды рНCB обрабатывали рестриктазами ClaI (20 е.а.) и BamHI (30 е.а.) в 50 мкл буфера M в течение 2-х часов при температуре 37oC. Из полученного гидролизата гель-электрофорезом в 1% агарозе выделяли фрагмент ДНК, размером 0,5 т.п.н., как описано выше. 2 мкг ДНК плазмиды pGSH160 гидролизовали рестриктазой ClaI (5 е.а.) и BamH1 (10 е.а.) в 20 мкл буфера M в течение 2-х часов при 37oC, ферменты удаляли фенолом и ДНК очищали от остатков фенола экстракцией хлороформом и спиртовым осаждением. 1 мкг полученной ДНК смешивали с 1 мкг ClaI- BamHI фрагмента плазмиды pHCB в 20 мкл буфера Л и обрабатывали ДНК-лигазой как описано выше. Лигазной смесью трансформировали компетентные клетки E.coli штамма MCI061 и трансформанты высевали на чашки с LB-агаром, содержащим по 100 мкг/мл ампицилина и спектиномицина. Клоны, несущие рекомбинантные плазмиды со встроенным геном бета-интерферона отбирали гибридизацией колоний с радиоактивно меченым олигонуклеотидом (TTCTGAGACACTCAAAATT) комплементарному участку гена бета-интерферона, кодирующему аминокислоты 14-19 в структуре зрелого белка. Плазмидную ДНК 5 клонов, дававших гибридизационный сигнал анализировали с помощью гидролиза рестриктазами ClaI, BamHI, PstI, ScaI, KpnI и NcoI и последующим разделением продуктов гидролиза гель-электрофорезом в 1% агарозе. Во всех 5 плазмидах набор полученных в результате этого анализа фрагментов ДНК подтвердил встройку гена бета-интерферона в плазмиду pGSH160 и сохранность основных элементов структуры вектора.
Перенос плазмиды pG11 из клеток E.coli в клетки агробактерии проводили следующим образом:
В питательном бульоне LB ночные культуры агробактерии Agrobacterium tumefaciens CR58CI Rif R (реципиент), E.coli MCI061 (донор) с плазмидой pG11 и E.coli HB 101 (pRK 2013) (штамм-помощник). Затем смешивают по 0,1 мл каждой из 3-х ночных культур, клетки осаждают с помощью центрифугирования, осадок переносят на LB агар и инкубируют 24 часа при 28oC. Появившиеся бактерии переносят на селективную агаризованную среду с антибиотиками: ампицилин (100 мкг/мл), рифампицин (100 мкг/мл) и спектиномицин (100 мкг/мл). Чашки инкубируют при 28oC в течение 2-3х суток, появившиеся колонии пассируют на той же среде до отдельных колоний. Полученные колонии агробактерии, несущие интегрированные плазмиды pG11, используют для инфицирования листовых дисков растений.
Пример 2. Получение трансгенных растений люцерны.
Листовые диски, отобранные по способности к регенерации in vitro растений люцерны, инкубировали на стандартной среде B5 (Sigma), модифицированной Мезенцевым А. В. [8] с добавлением 1,0 мг/л бензиламинопурина (БАП) и 0,1 мг/л нафтилуксусной кислоты (НУК), 1-2 капель свежей ночной культуры A. tumefaciens на шейкере (100 об/мин) в течение 3-х суток. После кокультивирования экспланты промывали стерильной дистиллированной водой 3-5 раз. Во все среды для кокультивирования на последующих стадиях добавляли карбеницилин 500 мг/л для предотвращения агробактериального роста и канамицин 100 мг/л как селективный агент трансформации. Индукцию каллуса, проводили на среде B5 с добавлением фитогормонов: 2,4-дихлорфеноксиуксусной кислоты (2,4-Д) -2,0 мг/л и кинетина - 2.0 мг/л. Экспланты инкубировали в темноте при 26oC в течение 3-4-х недель. Затем каллусы переносили на среду В5 с добавлением 2,4-Д - 8,0 мг/л, НУК - 3,0 мг/л и кинетина - 2,0 мг/л, - инкубировали на свету в течение 2-3х недель. Так как существует видоспецифическая устойчивость растений к антибиотикам, то отбор трансформированных клеток, устойчивых к канамицину проводили в условиях суспензионной культуры. Для этого кусочки каллусов помещали на жидкую питательную среду B5 с добавлением 2,0 мг/л 2,4-Д, 0,5 мг/л НУК, 100 мг/л канамицина и 500 мг/л карбеницилина на одну неделю, затем клеточную суспензию переносили на среду для дифференциации соматических эмбриоидов (B5 с добавлением БАП - 0,2 мг/л) и через 3-4 недели на среду для регенерации растений (B5 без фитогормонов). Полученные трансгенные растения тестировали по активности фермента неомицинфосфотрансферазы II [9].
На фиг. 2 представлены результаты анализа активности фермента неомицинфосфотрансферазы Пу8 трансгенных растений люцерны:
1-6: 9, 10- трансгенные растения люцерны,
8 - трансгенное растение табака,
7 - нетрансгенное растение люцерны (контроль).
Полученные результаты показывают, что белок активен, правильно процессируется и накапливается в трансгенных растениях. В качестве контроля было использовано не трансгенное растение люцерны (Фиг. 2, N7).
Методом блот-гибридизации по Саузерну доказали интеграцию переносимой генетической конструкции в растительный геном.
В потомстве от самоопыления исходных трансгенных растений отобрали NPTII+ растения и тестировали их вирусоустойчивость.
Пример 3. Тестирование устойчивости трансгенных растений к вирусу мозаики люцерны (ВМЛ)
Исходные молодые трансформированные растения, после пересадки в почву и анализа NPTII заражали ВМЛ с концентрацией 5 мг/мл. Устойчивость к вирусу оценивали по времени появления симптомов заболевания (мозаика на листьях) и накоплению ВМЛ в листьях. Для оценки накопления вируса в листьях люцерны использовали иммуноферментный анализ (сэндвич-вариант) [10].
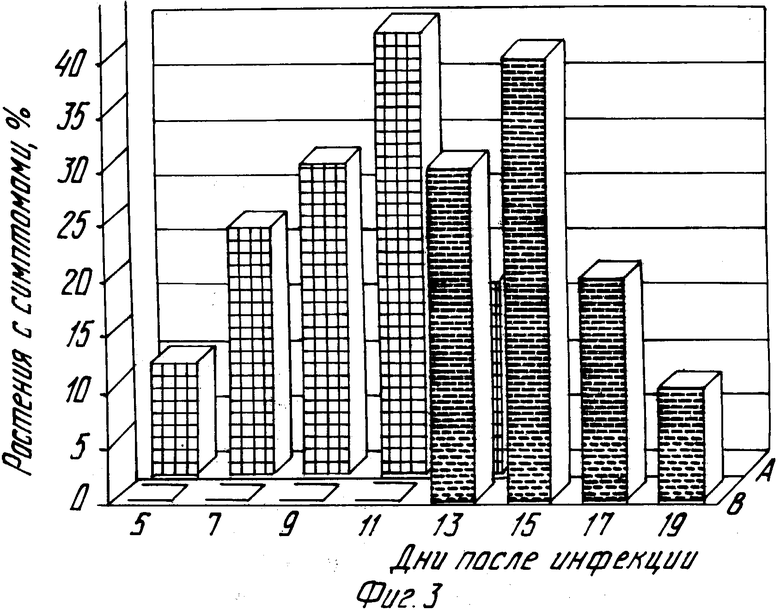
На фиг. 3 представлены результаты сравнения времени появления симптомов заражения ВМЛ у NPTII+ трансгенных растений люцерны:
А - линии 2, 8, 9, 15, 18, 20, 24 и контроль;
В - линии 1, 3, 12 и 22.
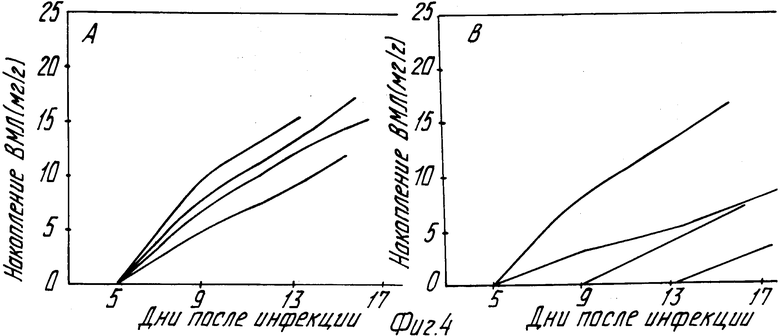
На основании этих результатов все растения были разделены на две группы: 1) линии, проявившие симптомы инфекции на уровне контроля (линии 2, 8, 9, 15, 18, 20, 24) и 2) линии с задержкой развития ВМЛ (линии 1, 3, 12 и 22). На фиг. 4 приведены гистограммы, описывающие время появления симптомов у этих двух групп растений.
А - линии 2, 8, 9, 15, 20, 24 и контроль;
В - линии 1,3, 12, 22.
Представленные результаты показывают, что линии 1, 3, 12 и 22 характеризуются значительной задержкой развития симптомов по сравнению с контролем и линиями 2, 8, 9, 15, 18, 20, 24. С этими данными хорошо согласуются результаты выборочного анализа накопления ВМТ в инфицированных растениях: вирус медленнее накапливается в растениях именно тех линий, у которых обнаружена задержка развития симптомов. Таким образом, приведенные данные свидетельствуют о том, что ген бета-интерферона, экспрессирующийся в растении, значительно изменяет его реакцию на вирусную атаку и стимулирует природные защитные потенции растительной клетки.
ЛИТЕРАТУРА
1. Murant A.F., Mayo M.A. Ann. Rev. Phytopatol., 1982, v.20, p. 49-70.
2. De Zoeten G.A.,Pauswick I.R., Horisberger H.A. - Virology, 1989, v. 172, p. 213-222.
3. AC SU N 17 82991 "Способ получения трансгенных растений табака, устойчивых к вирусу табачной мозаики " С 12 N15/83, 1992.
4. Смирнов С.П., Теверовская Э.Х., Крашенинникова Л.В., Пухальский В.А. Генетика, 1990, т. 26, с. 2111-2121.
5. Кумарев В.П., Ривкин М.И., Амирханов Н.В., Баранова Л.В., Богачев В. С. , Кобец М.Л., Ошевский С.И., Обухова Л.В., Рыбаков В.Н., Кузнеделов К.Д., Вершинина С.И., Гулевич В.В. ДАН СССР, 1986, т. 290, N1, с. 244-248.
6. Maxam A.M., Gilbert W. -Methods Enzymol., 1980, vol. 65, p. 499-560
7. Чувпило С. А. , Кравченко В.В. Биоорг. химия, 1983, т. 8, N 12, с. 4677-4688
8. Мезенцев А.В. Вестник с/х науки, 1981, N12, с. 76-85.
9. Reiss В. , Sprengel R., Will H., Schaller H. Gene, 1984, v. 30, p. 211-218.
10. Ahoonmanesh A., Hajimorad H.R., Ingham B.J., Francki R.J.B., Journal of Virological Methods, 1990, v. 30, p. 271-282.
| название | год | авторы | номер документа |
|---|---|---|---|
| РЕКОМБИНАНТНАЯ ПЛАЗМИДНАЯ ДНК PG 21, КОДИРУЮЩАЯ β - ИНТЕРФЕРОН ЧЕЛОВЕКА В РАСТЕНИЯХ | 1993 |
|
RU2035513C1 |
| СПОСОБ ПОЛУЧЕНИЯ ТРАНСГЕННЫХ РАСТЕНИЙ, УСТОЙЧИВЫХ К ВИРУСНОЙ ИНФЕКЦИИ | 2005 |
|
RU2300567C1 |
| СПОСОБ ПОЛУЧЕНИЯ ТРАНСГЕННЫХ РАСТЕНИЙ ТАБАКА С ПОВЫШЕННЫМ СОДЕРЖАНИЕМ ПРОЛИНА | 2006 |
|
RU2324737C1 |
| СПОСОБ ПОЛУЧЕНИЯ ТРАНСГЕННЫХ РАСТЕНИЙ ТАБАКА С ПОВЫШЕННЫМ СОДЕРЖАНИЕМ ПРОЛИНА | 2006 |
|
RU2324736C1 |
| РЕКОМБИНАНТНАЯ ПЛАЗМИДА pBi121-ESAT6-CFP10-gIFN, КОДИРУЮЩАЯ БЕЛКИ ESAT6 И CFP10 MYCOBACTERIUM TUBERCULOSIS И ГАММА-ИНТЕРФЕРОН ЧЕЛОВЕКА В ТРАНСГЕННЫХ РАСТЕНИЯХ | 2011 |
|
RU2468082C1 |
| РЕКОМБИНАНТНАЯ ПЛАЗМИДНАЯ ДНК pBi101-IL18, КОДИРУЮЩАЯ СИНТЕЗ ИНТЕРЛЕЙКИНА-18 ЧЕЛОВЕКА В ТРАНСГЕННЫХ РАСТЕНИЯХ | 2005 |
|
RU2302460C1 |
| РЕКОМБИНАНТНАЯ ПЛАЗМИДА, ОБЕСПЕЧИВАЮЩАЯ ЭКСПРЕССИЮ ГЕНА ЭКСТРАКЛЕТОЧНОЙ РИБОНУКЛЕАЗЫ Zinnia elegans ZRNaseII В ТРАНСГЕННЫХ РАСТЕНИЯХ (ВАРИАНТЫ), И СПОСОБ ПОЛУЧЕНИЯ ВИРУСОУСТОЙЧИВЫХ ФОРМ РАСТЕНИЙ | 2009 |
|
RU2393226C1 |
| СПОСОБ ПОЛУЧЕНИЯ ТРАНСГЕННЫХ РАСТЕНИЙ МОРКОВИ, ПРОДУЦИРУЮЩИХ ИНТЕРЛЕЙКИН-10 ЧЕЛОВЕКА | 2007 |
|
RU2374321C2 |
| СПОСОБ ПОЛУЧЕНИЯ ТРАНСГЕННЫХ РАСТЕНИЙ, РЕКОМБИНАНТНАЯ ПЛАЗМИДНАЯ ДНК PTIVY4, ПРЕДНАЗНАЧЕННАЯ ДЛЯ ПОЛУЧЕНИЯ ТРАНСГЕННЫХ РАСТЕНИЙ И ШТАММ БАКТЕРИЙ AGROBACTERIUM TUMEFACIENS, ИСПОЛЬЗУЕМЫЙ ДЛЯ ТРАНСФОРМАЦИИ РАСТЕНИЙ | 1988 |
|
SU1547316A3 |
| РЕКОМБИНАНТНАЯ ПЛАЗМИДА PGBP450F ДЛЯ ПОЛУЧЕНИЯ ТРАНСГЕННЫХ РАСТЕНИЙ И СПОСОБ ПОЛУЧЕНИЯ ТРАНСГЕННЫХ РАСТЕНИЙ ТАБАКА С ПОВЫШЕННОЙ ПРОДУКТИВНОСТЬЮ И УСТОЙЧИВОСТЬЮ К ГРИБНЫМ ФИТОПАТОГЕНАМ | 2002 |
|
RU2237717C2 |

(57) Использование: генетическая инженерия растений. Сущность: получение рекомбинантной плазмидной ДНК pGII, определяющей синтез, β интерферона в растениях, и растений устойчивых к вирусной инфекции. Плазмида pG-11 содержит E CORI-Bam HI фрагмент плазмиды pSK-IFs, включающий ген β - интерферона человека. Полученную плазмиду pGII передают в штамм агробактрий, инфицируют последним листовые диски растений и с последующим тестированием трансформированных клеток на чувствительность к канамицину в условиях суспензионной культуры регенерируют полноценные трансгенные растения на селективной среде. Растения устойчивы к широкому спектру фитовирусов. 2 с.п. ф-лы., 4 ил.
| SU, авторское свидетельство, 1782991, кл | |||
| Способ гальванического снятия позолоты с серебряных изделий без заметного изменения их формы | 1923 |
|
SU12A1 |
Авторы
Даты
1998-01-27—Публикация
1994-07-15—Подача