Изобретение относится к области биотехнологии, в частности к генетической инженерии высших растений, и может быть использовано для создания растительных продуцентов интерлейкина-18 (ИЛ-18) человека. Трансгенные растения-продуценты ИЛ-18 человека могут быть использованы для пероральной доставки ИЛ-18 к слизистым тонкого кишечника, а также для выделения ИЛ-18 в чистом виде для фармакологии. Известно, что ИЛ-18 является перспективным противоопухолевым препаратом, так как обладает непосредственным цитотоксическим эффектом по отношению к раковым клеткам, за счет индукции апоптоза, стимулирует продукцию других цитокинов, играющих ключевую роль при уничтожении опухоли, а также повышает цитотоксичность Т-киллеров и NK-клеток по отношению к раковым клеткам (Dinarello С. // METHODS. 1999, V.19, Р.121-122). ИЛ-18 повышает антигенпредставляющие способности макрофагов и может использоваться как адъювант при иммунизации вакцинами. Особый интерес представляет использование ИЛ-18 в качестве мукозного адъюванта при иммунизации животного организма «съедобными вакцинами».
Известна рекомбинантная плазмидная ДНК, кодирующая синтез зрелой формы ИЛ-18 человека в клетках E.coli, сконструированная на основе бактериального экспрессирующего вектора рКК223-3 (Ushio S., Namba M., Okura Т. et al. // The J. Immunol. 1996, V.156, P.4274-4279). Вектор обеспечивает высокий уровень продукции ИЛ-18 в бактериях. Однако в прокариотических клетках не происходит правильной укладки полипептидной цепи ИЛ-18, вследствие чего белок накапливается в виде нерастворимых внутриклеточных агрегатов. Для дальнейшего превращения рекомбинантного белка в растворимую и биологически активную форму требуются дорогостоящие и длительные процедуры рефолдинга. Другим недостатком прокариотических систем экспрессии является возможная контаминация целевого белка бактериальными токсинами.
Наиболее близкой к заявляемой плазмиде - прототипом, является рекомбинантная плазмидная ДНК pBin/hIL-18, в которой нуклеотидная последовательность про-ИЛ-18 встроена в экспрессионный вектор pBin438, под контроль двойного промотора 35S вируса мозаики цветной капусты (Zhang В., Yang Y.H., Lin Y.M. et al. // Biotechnol Lett., 2003, V.25, P.1629-1635). Известная плазмида pBin/hIL-18 размером 14 т.п.н. содержит:
- BamHI-SalI фрагмент ДНК плазмиды pCI-18, размером 0,58 т.п.н., кодирующий проИЛ-18 человека, а также сайты рестрикции, регуляторные участки, генетические маркеры.
- ДНК векторной плазмиды pBin438 размером 13,5 т.п.н
Основной недостаток данной плазмидной ДНК заключаются в том, что в качестве переносимого гена в ней содержится последовательность ДНК, кодирующая биологически неактивный предшественник ИЛ-18 человека (проИЛ-18) с молекулярным весом 24 кДа. Кроме того, в известной плазмидной ДНК закодирован белок, не содержащий какого-либо участка, обладающего высоким сродством к известным хроматографическим сорбентам, что затрудняет возможность выделения такого белка методами аффинной хроматографии.
Технической задачей изобретения является создание рекомбинантной плазмидной ДНК, обеспечивающей продукцию зрелой биологически активной формы ИЛ-18 человека в трансгенных растениях.
Поставленная задача достигается новой сконструированной плазмидной ДНК pBi101-IL18 размером 15 т.п.н., обеспечивающей перенос целевой последовательности ДНК в геном растений и экспрессию гена ИЛ-18 человека. Способ конструирования заключается в клонировании участка кДНК гена ИЛ-18 человека в плазмиде рЕТ15b+ совместно с нуклеотидной последовательностью шести аминокислот гистидина и сайта гидролиза ферментом тромбином. На следующем этапе фрагмент ДНК, состоящий из нуклеотидной последовательности полигистидина, тромбинового сайта и ИЛ-18 человека переносят в плазмиду pAVA321 по сайтам рестрикции NcoI/BglII. Плазмида pAVA321 содержит функциональные элементы, необходимые для экспрессии целевого гена в растении. На заключительном этапе клонирования Sail-BamHI фрагмент плазмидной ДНК pAVA321, содержащий ген ИЛ-18 человека под управлением растительных элементов экспрессии, субклонируют в полилинкер Т-ДНК области бинарной векторной плазмиды pBi101. В результате получают рекомбитнантную плазмидную ДНК pBi101-IL18 размером 15 т.п.н., обеспечивающую перенос целевой последовательности ДНК в геном растений и экспрессию гена ИЛ-18 человека.
Плазмида состоит из следующих элементов:
- ДНК векторной плазмиды pBi101 размером 13,9 т.п.н;
- NdeI-BamHI/BglII фрагмента ДНК, являющегося участком кДНК гена ИЛ-18 человека;
- NcoI-NdeI фрагмента плазмиды рЕТ15b;
- 5'UTR области из генома вируса гравировки табака;
- Двойного 35S CaMV промотора из генома вируса мозаики цветной капусты;
- 3'UTR области из генома вируса мозаики цветной капусты.
Физическая карта плазмиды pBi101-IL18 с указанием генетических маркеров приведена на фиг.1, где 6xHis - последовательность ДНК, кодирующая шесть аминокислотных остатков гистидина; Trs - последовательность ДНК, кодирующая сайт узнавания ферментом тромбином; IL-18 - нуклеотидная последовательность зрелой формы ИЛ-18 человека; 35SCaMV - двойной промотор гена 35S РНК вируса мозаики цветной капусты; TL - лидерная последовательность трансляции из генома вируса гравировки табака; TcaMV - терминатор гена 35S РНК вируса мозаики цветной капусты; LB, RB - левая и правая границы Т-ДНК области; PNOS - промотор гена нопалинсинтетазы из Ti-плазмиды Agrobacterium tumefaciens; NPTII-ген неомицинфосфотрансферазыII; TNOS - терминатор гена нопалинсинтетазы; В-Glue - нуклеотидная последовательность β-глюкуронидазы E.coli.
Отличие полученной рекомбинантной плазмидной ДНК от прототипа состоит в использовании нуклеотидной последовательности химерного белка, состоящего из безлидерной (зрелой) формы ИЛ-18 человека, N-концевого пептида из шести аминокислот гистидина и сайта гидролиза ферментом тромбином между ними. Использование такой последовательности ДНК в качестве целевого гена позволит получать растения-продуценты биологически активного ИЛ-18 человека, а также сделает возможным выделение рекомбинантного ИЛ-18 в чистом виде из растений методами металл-хелатной аффинной хроматографии.
Сущность изобретения поясняется следующими примерами.
Пример 1. Конструирование плазмиды pBi101-IL18.
10 мкг ДНК плазмиды pBluescriptSK-IL18, содержащей фрагмент кДНК ИЛ-18 человека, обрабатывали рестриктазами FauNDI (100 е.а.) и BamHI (100 е.а.) в течение 1 часа при 37°С в 50 мкл буфера, содержащего 10 mM Tris-HCl рН 7.6; 10 mM MgCl2; 50 mM NaCl; 1 mM DTT. Гидролизат разделяли электрофорезом в 1,5% агарозном геле, гель окрашивали раствором бромистого этидия в воде (1 мкг/мл) и фрагмент ДНК размером 460 п.н. выделяли из геля методом сорбции ДНК на силикагеле.
10 мкг ДНК плазмиды рЕТ15b гидролизовали рестриктазами FauNDI (100 е.а.) и BamHI (100 е.а.) 1 час при 37°С в 50 мкл буфера, содержащего 10 mM Tris-HCl рН 7.6; 10 mM MgCl2; 50 mM NaCl; 1 mM DTT. Реакционную смесь разделяли электрофорезом в 1,5% агарозном геле, гель окрашивали раствором бромистого этидия в воде (1 мкг/мл) и фрагмент ДНК размером 5700 п.н. выделяли из геля методом сорбции ДНК на силикагеле.
Смешивали 0.03 мкг FauNDI - BamHI фрагмента плазмиды рЕТ15b и 3 мкг FauNDI-BamHI фрагмента плазмиды pBluescriptSK-IL18, содержащего нуклеотидную последовательность ИЛ-18 человека, в 10 мкл буфера, содержащего 50 mM Tris-HCl рН 7.8; 10 mM MgCl2; 10 mM DTT; 1 mM АТР; 25 mkg/ml BSA. К смеси добавляли 100 е.а ДНК-лигазы фага Т4 и инкубировали 10 часов при 4°С. 5 мкл лигазной смеси использовали для трансформации компетентных клеток E.coli штамма XLBlue. Трансформанты высевали на чашку с LB-агаром, содержащем 100 мкг/мл ампициллина. Клоны, несущие рекомбинантные плазмиды со встроенным геном, отбирали методом ПЦР анализа ДНК отдельных колоний E.coli с праймерами на нуклеотидную последовательность ИЛ-18 человека. Плазмидные ДНК двух клонов из десяти отобранных для анализа, давших сигнал ПЦР, соответствующий по длине нуклеотидной последовательности ИЛ-18 человека, дополнительно анализировали с помощью гидролиза рестриктазами FauNDI и BamHI и последующим разделением продуктов гидролиза гель-электрофорезом в 1,5% агарозе. В результате рестрикционного анализа подтверждена встройка ИЛ-18 в обоих отобранных плазмидах.
Bsp19I - BamHI фрагмент одной из таких плазмид (pET15b-IL18) использовался для конструирования плазмиды pAVA321-IL18. С этой целью 2 мкг ДНК плазмиды pAVA321 обрабатывали рестриктазами Bsp19I (100 е.а.) и BglII (100 е.а.) 1 час при 37°С в 50 мкл буфера, содержащего 50 mM Tris-HCl рН 7.6; 10 mM MgCl2; 100 mM NaCl; 1 mM DTT. 10 мкг плазмиды pET15b-IL18 гидролизовали рестриктазами Bsp19I (100 е.а.) и BamHI (100 е.а.) в буфере того же состава. Продукты гидролиза разделяли в 1,5% агарозном геле. Выделяли фрагменты ДНК размером 4 т.п.н. и 540 п.н. из плазмид pAVA321 и pET15b-IL18 соответственно, как описано выше. 0,1 мкг фрагмента плазмидной ДНК pAVA321 и 0,5 мкг фрагмента из вектора pET15b-IL18 смешивали в 10 мкл лигазного буфера и обрабатывали ДНК-лигазой, как описано выше. Лигазной смесью трансформировали компетентные клетки E.coli штамма XLBlue, трансформанты высевали на чашки с LB-агаром, содержащие 100 мкг/мл ампицилина. Клоны, несущие рекомбинантные плазмиды со встроеным геном ИЛ-18 человека отбирали ПЦР-анализом. Плазмидную ДНК одного клона, давшего положительный ПЦР-сигнал, анализировали с помощью гидролиза рестриктазами Bsp19I и BamHI и последующим разделением продуктов гидролиза гель-электрофорезом в 1,5% агарозе.
По аналогичной схеме клонирования SalI - BamHI фрагмент ДНК из плазмиды pAVA321-IL18 был перенесен в полилинкерную область плазмиды pBi 101.
Пример 2. Получение моноинсерционных трансгенных растений.
Полученной плазмидной ДНК pBi101-IL18 трансформировали клетки Agrobacterium tumefaciens (штамм LBA4404). Трансформацию растений табака Nicotiana tabacum (линии SRI) проводили методом кокультивации листовых дисков с суспензией клеток агробактерий, как описано в (Horsch R., Fry J., Hoffman N. et al. // Plant Molecular Biology Manual. Dordrecht. Kluwer Academic Publishers. 1988, P. A5/1-A5/9). Полученные регенеранты выращивали на среде Мурашиге и Скуга (МС) (Murasige Т., Skoog F. // Physiol. Plant. 1962, V.15, Р.473-497), содержащей 250 мг/л клафорана и 50 мг/л канамицина.
После самоопыления растений-регенерантов Т0 анализировали соотношение устойчивых и неустойчивых к антибиотику растений T1 поколения на среде с канамицином. Для этого семена T1 поколения стерилизовали 10%-ным раствором гипохлорита натрия и 96° этанолом по стандартной методике и высевали на чашки со средой МС с добавлением 100 мг/л канамицина. Чашки инкубировали две недели при 25°С со стандартным световым режимом (16 часов свет, 8 часов темнота) и подсчитывали соотношение белых и зеленых проростков. Показано, что это соотношение близко к 3:1 у 6 из 30 проанализированных линий. Для дальнейших исследований были отобраны только T1 растения, среди которых наблюдалось достоверное расщепление 3:1 по признаку канамицинустойчивости.
Наличие нуклеотидной последовательности ИЛ-18 человека в геномах отобранных растений подтверждали методом ПЦР с праймерами на нуклеотидную последовательность ИЛ-18. Моноинсерционность растений дополнительно анализировали блот-гибридизацией HindIII - гидролизатов геномных ДНК растений с 32Р меченым фрагментом кДНК ИЛ-18 человека на нитроцеллюлозной мембране.
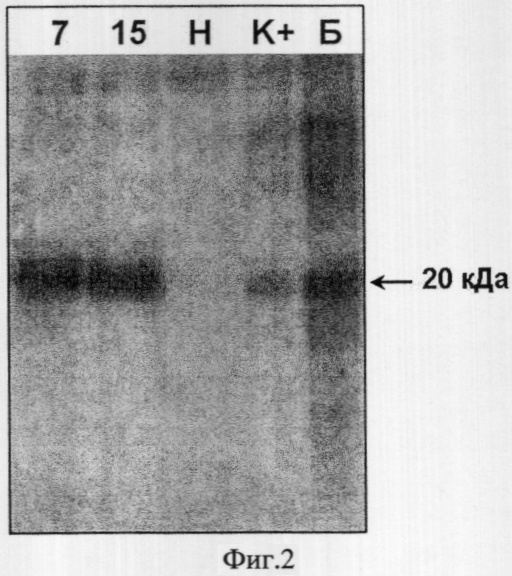
Анализ уровня экспрессии ИЛ-18 человека у трансгенных растений проводили методом Вестерн-блоттинга с применением поликлональных антител кролика, специфичных к ИЛ-18 человека. В качестве вторичных антител использовали козьи антитела к IgG2 кролика, коньюгированные с щелочной фосфатазой. Для детекции ферментативной активности щелочной фосфатазы использовали набор хемилюминесцентных реактивов Immunstar (BioRad, США). При приготовлении материала для Вестерн-блоттинга суммарный белок из 0,3 г листьев табака экстрагировали в 1 мл Буфера 1 (50 мМ Tris-HCl pH 8.0, 500 мМ NaCl, 0.1% Tween-20, 5 мМ β-МЕ, 1 мМ PMSF). Концентрацию белка в экстрактах определяли методом Бредфорда. Экстракты пропускали через микроколонки с 20 мкл Ni-NTA агарозы. В качестве промывочного раствора использовали буфер 1 с добавлением имидазола до концентрации 20 мМ. После 3-кратной промывки белок с колонок элюировали в 150 мкл буфера 1 с добавлением имидазола до концентрации 150 мМ. Для анализа использовали 75 мкл приготовленного элюата (30 нг белка).
На фиг.2 представлены результаты Вестерн-блоттинга двух независимых моноинсерционных трансгенных растений табака, где 7 и 15 - элюаты из экстрактов трансгенных растений №7 и №15 соответственно; Н - элюат из экстракта нетрансгенного растения; К+ - элюат из экстракта нетрансгенного растения с добавленным рекомбинантным ИЛ-18 человека, полученным из клеток E.coli, до концентрации 0,01% суммарного белка (400 нг/мл экстракта); Б - 700 нг рекомбинантного ИЛ-18 человека, полученного из клеток E.coli. Молярная масса ИЛ-18 человека, содержащего полигистидиновую последовательность и сайт гидролиза ферментом тромбином составляет 20 кДа, что характерно именно для зрелой формы.
Таким образом, у обоих растений показано присутствие белка, соответствующего по молекулярной массе и иммунологическим свойствам ИЛ-18 человека, полученному из клеток E.coli. В качестве положительного контроля использовали элюат, полученный из экстракта нетрансгенного растения с добавленным бактериальным ИЛ-18 человека до концентрации 0,01% суммарного белка. Сравнив интенсивности полос на дорожках 7, 15 и К, можно заключить, что содержание рекомбинантного белка у проанализированных растений составило более 0,01% суммарного белка или в пересчете на сырой вес растения - 1,3 мг/кг.
Пример 3. Исследование биологической активности рекомбинантного растительного химерного ИЛ-18 человека
При приготовлении материала для анализа биологической активности суммарный белок из 0,3 г листьев табака экстрагировали в 1 мл Буфера 1 (50 мМ Tris-HCl pH 8.0, 500 мМ NaCl 0.1% Tween-20, 5 мМ β-ME, 1 мМ PMSF). Концентрацию белка в экстрактах определяли методом Бредфорда. Экстракты пропускали через микроколонки с 20 мкл Ni-NTA агарозы. В качестве промывочного раствора использовали буфер 1 с добавлением имидазола до концентрации 20 мМ. После 3-кратной промывки белок с колонок элюировали в 150 мкл буфера 1 с добавлением имидазола до концентрации 150 мМ. Элюат диализовали против 50 мМ натрий-фосфатного буфера (рН 7.4) с 0.15 М соляной кислоты. Для анализа использовали 10 мкл приготовленного элюата.
Для изучении биологической активности рекомбинантного растительного ИЛ-18 человека исследовалось его влияние на спонтанную и стимулированную продукцию TNFα и IFNγ. Мононуклеарную фракцию клеток периферической крови получали у здоровых доноров методом центрифугирования в градиенте плотности фиколла. Количественное определение TNFα и IFNγ проводили методом электрохемилюминисценции. Для получения калибровочных кривых использовали рекомбинантные TNFα и IFNγ человека (R&D Systems, UK). Поликлональные и моноклональные антитела получены из Pepro Tech, Inc. (NJ, USA). Культивирование мононуклеарных клеток периферической крови человека в присутствии КонА (10 мкг/мл) или полученного элюата (10 мкл) приводит к достоверному повышению уровня продукции TNFα и IFNγ, совместная стимуляция клеток КонА и элюата усиливает эту продукцию. Данные по индукции TNFα (24 ч инкубации) и IFNγ (48 ч инкубации) в мононуклеарных клетках человека представлены в таблице.
Полученные результаты свидетельствуют о том, что элюат, обогащенный в отношении содержания рекомбинантного белка, несущего полигистидиновую последовательность, способен стимулировать синтез TNFα и IFNγ в мононуклеарной фракции человека при костимуляции Con А, что характерно для биологической активности зрелой формы интерелейкина 18 человека.
Таким образом, приведенные данные свидетельствуют о том, что сконструированная плазмидная ДНК pBi101-IL18 обеспечивает перенос нуклеотидной последовательности химерного ИЛ-18 человека в геномную ДНК растений и продукцию зрелой формы интерлейкина 18 человека, обладающей биологической активностью.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ ТРАНСГЕННЫХ РАСТЕНИЙ МОРКОВИ, ПРОДУЦИРУЮЩИХ ИНТЕРЛЕЙКИН-10 ЧЕЛОВЕКА | 2007 |
|
RU2374321C2 |
| РЕКОМБИНАНТНАЯ ПЛАЗМИДНАЯ ДНК pBinPLUS-ARS-EPSPS, ОБЕСПЕЧИВАЮЩАЯ ЭКСПРЕССИЮ ГЕНА АГРОБАКТЕРИАЛЬНОЙ 5-ЕНОЛПИРУВИЛ-ШИКИМАТ-3-ФОСФАТ-СИНТЕТАЗЫ В ТРАНСГЕННЫХ МИКРОВОДОРОСЛЯХ РОДА ХЛОРЕЛЛА | 2009 |
|
RU2407794C1 |
| СПОСОБ ПОЛУЧЕНИЯ ТРАНСГЕННЫХ РАСТЕНИЙ ТАБАКА С ПОВЫШЕННЫМ СОДЕРЖАНИЕМ ПРОЛИНА | 2006 |
|
RU2324737C1 |
| СПОСОБ ПОЛУЧЕНИЯ ТРАНСГЕННЫХ РАСТЕНИЙ ТАБАКА С ПОВЫШЕННЫМ СОДЕРЖАНИЕМ ПРОЛИНА | 2006 |
|
RU2324736C1 |
| РЕКОМБИНАНТНАЯ ПЛАЗМИДА pBi121-ESAT6-CFP10-gIFN, КОДИРУЮЩАЯ БЕЛКИ ESAT6 И CFP10 MYCOBACTERIUM TUBERCULOSIS И ГАММА-ИНТЕРФЕРОН ЧЕЛОВЕКА В ТРАНСГЕННЫХ РАСТЕНИЯХ | 2011 |
|
RU2468082C1 |
| РЕКОМБИНАНТНАЯ ПЛАЗМИДНАЯ ДНК PGII, ОПРЕДЕЛЯЮЩАЯ СИНТЕЗ БЕТА-ИНТЕРФЕРОНА ЧЕЛОВЕКА В ТРАНСГЕННЫХ РАСТЕНИЯХ, И СПОСОБ ПОЛУЧЕНИЯ ТРАНСГЕННЫХ РАСТЕНИЙ, УСТОЙЧИВЫХ К ВИРУСНОЙ ИНФЕКЦИИ | 1994 |
|
RU2103361C1 |
| РЕКОМБИНАНТНАЯ ПЛАЗМИДНАЯ ДНК PG 21, КОДИРУЮЩАЯ β - ИНТЕРФЕРОН ЧЕЛОВЕКА В РАСТЕНИЯХ | 1993 |
|
RU2035513C1 |
| РЕКОМБИНАНТНАЯ ПЛАЗМИДА, ОБЕСПЕЧИВАЮЩАЯ ЭКСПРЕССИЮ ГЕНА ЭКСТРАКЛЕТОЧНОЙ РИБОНУКЛЕАЗЫ Zinnia elegans ZRNaseII В ТРАНСГЕННЫХ РАСТЕНИЯХ (ВАРИАНТЫ), И СПОСОБ ПОЛУЧЕНИЯ ВИРУСОУСТОЙЧИВЫХ ФОРМ РАСТЕНИЙ | 2009 |
|
RU2393226C1 |
| ФРАГМЕНТ ГЕНА GАG HTLV-I/II, РЕКОМБИНАНТНАЯ ПЛАЗМИДНАЯ ДНК РATLG 579, ШТАММ БАКТЕРИЙ ESCHERICHIA COLI HB101/PATLG 579-ПРОДУЦЕНТ ПОЛИПЕПТИДА G579 | 1998 |
|
RU2149876C1 |
| РЕКОМБИНАНТНАЯ ПЛАЗМИДА pAd-SM, КОДИРУЮЩАЯ БЕЛКИ SOX2 И C-MYC ЧЕЛОВЕКА, ЯВЛЯЮЩАЯСЯ ОСНОВОЙ ДЛЯ ПОЛУЧЕНИЯ ВИРУЛЕНТНЫХ АДЕНОВИРУСОВ, ПРЕДНАЗНАЧЕННЫХ ДЛЯ ПОЛУЧЕНИЯ ИНДУЦИРОВАННЫХ ПЛЮРИПОТЕНТНЫХ КЛЕТОК ЧЕЛОВЕКА | 2012 |
|
RU2495127C2 |

Изобретение относится к биотехнологии, в частности к генетической инженерии высших растений. Конструируют рекомбинантную плазмидную ДНК pBi101-IL18, размером 15 т.п.н., содержащую фрагмент ДНК векторной плазмиды pBi101, размером 13,9 т.п.н; - NdeI-BamHI/BglII фрагмента ДНК, являющегося участком кДНК гена ИЛ-18 человека; - NcoI-NdeI фрагмента плазмиды рЕТ15b; кодирующий N-концевой полипептид из шести аминокислот гистидина и сайт гидролиза ферментом тромбином, - 5'UTR области из генома вируса гравировки табака; - двойной 35S CaMV промотора из генома вируса мозаики цветной капусты; - 3'UTR область из генома вируса мозаики цветной капусты. Изобретение обеспечивает перенос нуклеотидной последовательности ИЛ-18 человека в геномную ДНК растений и продукцию зрелой формы интерлейкина 18 человека, обладающей биологической активностью. 2 ил., 1 табл.
Рекомбинантная плазмидная ДНК pBi101-IL18, кодирующая синтез интерлейкина-18 человека в трансгенных растениях, имеющая размер 15 т.п.н и содержащая следующие конструктивные элементы: фрагмент ДНК векторной плазмиды pBi101, размером 13,9 т.п.н; NdeI-BamHI/BglII фрагмента ДНК, являющийся участком кДНК гена ИЛ-18 человека; NcoI-NdeI фрагмент плазмиды рЕТ15b, кодирующий N-концевой полипептид из шести аминокислот гистидина и сайт гидролиза ферментом тромбином; 5'UTR область из генома вируса гравировки табака; двойной 35S CaMV промотор из генома вируса мозаики цветной капусты; 3'UTR область из генома вируса мозаики цветной капусты.
| ZHANG В, et al «Expression and production of bioactive human interleukin-18 in transgenic tobacco plants», Biotechnol Lett | |||
| Способ и приспособление для нагревания хлебопекарных камер | 1923 |
|
SU2003A1 |
| Устройство для ориентации деталей | 1985 |
|
SU1340978A1 |
| Рекомбинантная плазмидная ДНК @ - @ 2-19, кодирующая синтез интерлейкина-2 человека, способ ее конструирования @ штамм бактерий ЕSснеRIснIа coLI - продуцент интерлейкина-2 человека | 1987 |
|
SU1703693A1 |
Авторы
Даты
2007-07-10—Публикация
2005-11-02—Подача