Изобретение относится к новым аналогам человеческого инсулина, отличающимся быстрым наступлением требуемого эффекта после подкожной инъекции, и растворам инсулина для инъекций, содержащим подобные аналоги инсулина и к способам получения новых аналогов инсулина.
Для лечения сахарного диабета в рассматриваемой области техники предлагались многие разновидности инсулиновых препаратов. Некоторые из этих препаратов являются быстродействующими, тогда как другие обеспечивают более или менее продолжительное действие.
Быстродействующие инсулиновые препараты могут применяться в острых ситуациях, таких как гипергликемическая кома, во время хирургических операций, беременности и в случаях тяжелых инфекций. Кроме того, многократные, ежедневные инъекции быстродействующих инсулиновых препаратов могут улучшать контроль течения болезни у диабетиков, которые испытывают трудности при контроле использованием инсулина длительного действия.
В последние годы все возрастает интерес к лечению инсулином, которое приближается к выделению инсулина бета-клетками здорового организма, то есть выработке инсулина в сочетании с приемом пищи и поддержанию базального уровня содержания инсулина. Клинические исследования показали, что диабетики могут получать инсулин и глюкозу в нормальных концентрациях с помощью одной суточной инъекции инсулина продолжительного действия для покрытия базальной потребности, дополненной инъекциями меньших количеств (болюс) быстродействующего инсулина перед приемом значительных количеств пищи.
Быстродействующие инсулины также используются в смесях с инсулинами промежуточного и длительного действия для лечения диабетиков, для которых требуется более сильный начальный эффект в дополнение к замедленному действию инсулинов промежуточного и длительного эффекта.
Наконец, быстродействующий инсулин используется в системах непрерывного поступления инсулина.
При подкожной инъекции растворов быстродействующего инсулина наблюдалась начальная задержка всасывания (Binder, Diabetes Care , 7, N 2 (1984), 1988-199 ). Однако задержка всасывания, обусловленная замедленным наступлением эффекта, является нежелательной, если ставится задача обеспечения строго метаболического контроля. Смешивание растворов быстродействующего инсулина с инсулиновыми препаратами длительного действия может, кроме того, приводить к снижению скорости всасывания быстродействующего инсулина.
Соответственно, существует потребность в растворах быстродействующего инсулина, обеспечивающих ускоренное наступление эффекта после подкожной инъекции и улучшенную смешиваемость с инсулиновыми препаратами продолжительного действия.
Другим недостатком известных растворов быстродействующего инсулина является склонность инсулина к фибрилляции и выпадению из растворов инсулина, используемых для непрерывной доставки инсулина, что ведет к забиванию механических узлов и доставочных катетеров.
Наконец, существует потребность в альтернативных инсулиновых препаратах для лечения пациентов, трудно поддающихся лечению нормальным инсулином.
Целью настоящего изобретения является создание новых растворов быстродействующего инсулина с одной или большим числом нижеследующих улучшенных характеристик:
1) быстрое наступление эффекта при подкожной инъекции или при введении другими методами,
2) улучшенная смешиваемость с инсулиновыми препаратами продолжительного действия,
3) пониженная склонность к фибрилляции при использовании в имплантированных системах доставки, и
4) пригодность для лечения резистентных пациентов (низкое сродство к ранее существовавшим антителам).
Указанные цели настоящего изобретения достигаются с помощью водных растворов для инъекций новых аналогов человеческого инсулина, описываемых ниже.
Известно большое число аналогов инсулина. Так, Marki et al. (Hoppe-Seyler's Z. Physiol. Chem. 360 (1979), 1619-1632) описывают синтез аналогов человеческого инсулина, которые отличаются от человеческого инсулина замещением аминокислоты в положениях 2, 5, 6, 7, 8 и 11 A-цепи и 5, 7, 13 и 16 B-цепи, что дает новые представления об интересной зависимости структура - активность в случае инсулина. В дальнейших исследованиях модифицирована главная область связывания рецептора в инсулине (В(22) - В(26)) для изучения влияния такой мутации на рецептор-связывающую активность. Однако известные аналоги человеческого инсулина не проявляют характеристик, к которым стремились авторы настоящего изобретения.
Известно, что сульфатированные инсулины обладают существенно более слабой склонностью к фибрилляции ( Albisser et al., Desired Characteristics of insulin to be used in infusion pumps, в работе Jueriguian J.L. et al. (ред.) US Pharmacopeial Concention, Rockville, Maryland с. 84-95) и проявляют слабую антигенность. Однако сульфатированные инсулины представляют собой гетерогенную смесь минимум девяти разных производных инсулина, содержащих в среднем 4,5 эфирсульфатные группы на молекулу. Далее, сульфатированные инсулины проявляют пониженную инсулиновую активность, составляющую около 20% активности нативного инсулина. Дальнейший недостаток сульфатированных инсулинов в сравнении с нативным инсулином заключается в том, что они без надобности содержат аминокислотные остатки, которые химически модифицированы, то есть аминокислоты, которые в природе не встречаются.
Поэтому дополнительной целью настоящего изобретения является создание аналогов инсулина, которые однородны, имеют более высокую биологическую активность, чем сульфатированные инсулины, и, кроме того, содержат предпочтительно лишь встречающиеся в природе аминокислоты.
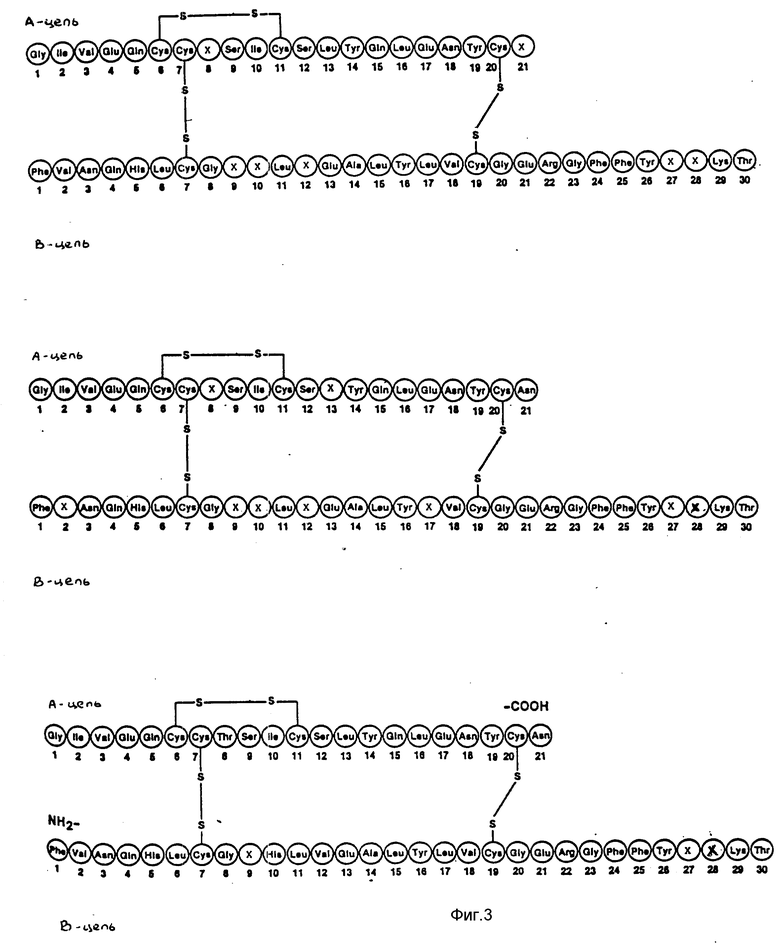
Термином "аналоги инсулина" в материалах заявки обозначается соединение, имеющее молекулярную структуру, аналогичную структуре человеческого инсулина, включая дисульфидные мостики между A(7) Cys и B(7) Cys, между A20) Cys и B(19) Cys и внутренний дисульфидный мостик между A(6) Cys и A(11) Cys, и проявляющее инсулиновую активность.
Настоящее изобретение основывается на том, что некоторые аналоги инсулина, в которых минимум один из аминокислотных остатков человеческого инсулина замещен встречающимися в природе аминокислотными остатками, проявляют требуемую быстродействующую активность.
В своем расширенном толковании настоящее изобретение предлагает новые, быстродействующие аналоги человеческого инсулина, образованные замещением одного или нескольких аминокислотных остатков человеческого инсулина, встречающихся в природе, аминокислотными остатками, приводящими к меньшему само-ассоциированию в димеры, тетрамеры, гексамеры или полимеры, и имеющие тот же заряд или больший отрицательный заряд при нейтральном pH, нежели человеческий инсулин.
Для достижения меньшей склонности к самоассоциированию в димеры, тетрамеры, гексамеры или полимеры, некоторые остатки человеческого инсулина предпочтительно замещены другими аминокислотными остатками, которые более гидрофильны, чем природный аминокислотный остаток в соответствующем положении в молекуле. Кроме того, в некоторых положениях молекулы инсулина замещение более объемистым аминокислотным остатком ведет к понижению склонности молекул инсулина к ассоциации в димеры, тетрамеры, гексамеры или полимеры.
На фиг.1 представлены предлагаемые новые производные инсулина общей формулы I, где X - представляют собой аминокислотные остатки человеческого инсулина или другие аминокислотные остатки, суммарная функция которых заключается в придании молекуле того же или большего отрицательного заряда при нейтральном pH по сравнению с человеческим инсулином при условии, что по крайней мере один X отличается от аминокислотных остатков человеческого инсулина в соответственном положении и молекулы инсулина, и когда X в положении A(8) является His или Phe, X в положении A(21) является Asp, X в положении B(5) является Ala, X в положении B(9) является Leu, X положении B(10) является Asn или Leu, X в положении B(12) является Asn или X в положении B(26) является Ala, то по меньшей мере один из остающихся X отличается от аминокислотных остатков человеческого инсулина в соответствующем положении молекулы инсулина, и при дальнейшем условии, что один или несколько аминокислотных остатков может быть удален с N- и/или C-концов A-цепи и/или B-цепи.
Предпочтительно по крайней мере большинство замещений аминокислотных остатков являются более гидрофильными, чем аминокислотный остаток на соответствующем сайте молекулы человеческого инсулина, и более предпочтительно, чтобы все замещения аминокислотных остатков были более гидрофильными, чем соответствующие аминокислотные остатки человеческого инсулина.
В отношении гидрофильности делается ссылка на работу C. Trommel, J. Theor. Biol. 111 (1984), 247-260 (табл.1).
Со ссылкой на приведенную формулу I отметим, что предпочтительно не более 7 заместителей Х отличаются от аминокислотного остатка в соответствующем положении молекулы человеческого инсулина. Предпочтительнее наличие 2-4 замещений.
Предпочтительные варианты воплощения изобретения.
Замещения аминокислотных остатков предпочтительно выбирают, из группы, включающей Asp, Glu, Ser, Thr, His и Ile , и более предпочтительно - отрицательно заряженные аминокислотные остатки, т.е. Asp и/или Glu.
Новый аналог человеческого инсулина может предпочтительно содержать Asp и/или Glu вместо одной или большего числа гидроксиаминокислот человеческого инсулина, или вместо одного или нескольких Glu и Asn человеческого инсулина.
Новые аналоги человеческого инсулина могут, кроме того, предпочтительно содержать Ser и/или Thr или Asp и/или Glu вместо одного или нескольких аминокислотных остатков человеческого инсулина с алифатической и/или ароматической боковой цепью.
Новые аналоги человеческого инсулина могут также предпочтительно содержать His вместо одного или нескольких аминокислотных остатков человеческого инсулина с алифатической и/или ароматической боковой цепью, или вместо одной или нескольких гидроксиаминокислот человеческого инсулина.
Предпочтительными сайтами замещений являются B9, B10, B12, B26, B27 и B28, предпочтительно B9, B12, B27 и B28, и в этих положениях одно замещение может быть достаточным для достижения пониженной склонности к самоассоциированию и большего быстродействия при употреблении.
Замещение аминокислотного остатка в положении B9 может быть выбрано из группы, включающей Asp, Pro, Glu, Ile, Leu, Val, His, Thr, Gln, Asn, Met, Tyr, Trp и Phe, и более предпочтительно из группы, включающей Asp, Glu, Gln, Asn и His.
Замещение аминокислотного остатка в положении B12 может быть выбрано из группы, включающей Ile и Tyr. Замещение аминокислотного остатка в положении B10 может быть выбрано из группы, включающей Asp, Arg, Glu, Asn и Gln, и в положениях B26, B27 и B28 замещения аминокислотных остатков являются предпочтительно Asp или Glu.
И в остальных положениях молекулы инсулина в минимум двух замещениях (предпочтительно в сочетании с вышеупомянутыми положениями) необходимо добиться улучшенных характеристик. B этих положениях могут быть сделаны замещения, представленные на фиг.2.
Дальнейшими предпочтительными соединениями согласно настоящему изобретению являются аналоги инсулина, в которых замещения находятся в следующих положениях:
B27, B12, B9, (B27+B9), (B27+A21), (B27+B12), (B12+A21), (B27+B17), (B27+A13), (B27+B16), (B27+A10), (B27+B28), (B27+B26), (B27+B10), (B27+B1), (B27+B2), (B27+B5), (B27+B14), (B27+B18), (B27+B20), (B12+B17), (B12+A10), (B12+A13), (B12+B16), (B12+B1), (B12+B2), (B12+B5), (B12+B10), (B12+B26), (B12+B28), (B9+B17), (B9+A13), (B9+B16), (B9+A8), (B9+A9), (B9+A10), (B9+B1), (B9+B2), (B9+B5), (B9+B10), (B9+B12), (B9+B14), (B9+B28), (B9+B18), (B9+B20), (B9+B26), (B27+B9+A21), (B9+B27+A8), (B27+B12+A21), (B27+B12+B9), (B9+B12+B27+B17), (B9+B12+B27+A13), (B9+B12+B27+B16) и (B12+B16+B17+B27+A10+A13).
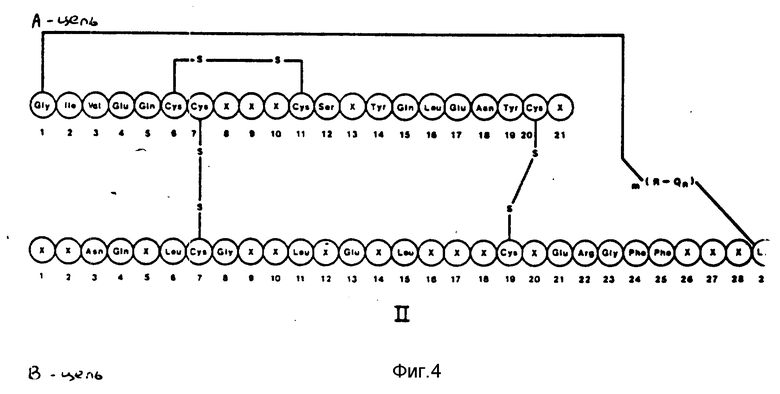
Предпочтительными воплощениями вышеприведенной формулы I являются соединения, представленные на фиг.3, где X определены выше.
Другие предпочтительные аналоги инсулина формулы I согласно настоящему изобретению таковы, что в положении B27 X представляет собой Glu, в положении B12 X - Ile или Tyr, X в положении A21 - Asp и в положении B27 - Glu, X в положении B9 - Asp, X в положении A21 и в положении B9 - Asp, и в положении B27 - Glu, X в положении A8 - His, в положении B9 - Asp и в положении B27 - Glu, X в положении B10 - Asp, X в положении B28 означает Asp или X в положении B9 - Asp и в положении B27 - Glu.
B соответствии со вторым аспектом настоящего изобретения предлагаются растворы для инъекций, обладающие инсулиновой активностью. Инсулиновые растворы для инъекций согласно настоящему изобретению содержат описанные выше аналоги человеческого инсулина или их фармацевтически допустимую соль в водном растворе, предпочтительно при нейтральном pH. Водная среда может быть приготовлена изотонической добавлением, например, хлористого натрия и глицерина. Кроме того, могут быть добавлены буферы, такие как ацетат или цитрат, и консерванты, такие как м-крезол, фенол или метиловый эфир 4-гидроксибензойной кислоты. Далее, растворы инсулина могут содержать ионы цинка.
Аналоги человеческого инсулина согласно изобретению могут заменять человеческий или свиной инсулин в быстродействующих инсулиновых растворах, известных до сих пор.
Получение аналогов инсулина.
После появления методов рекомбинантных ДНК возможности конструирования белков стали огромными. С помощью методов так называемого сайт-специфичного мутагенеза появилась возможность изменять генное кодирование встречающихся в природе белков путем замещения любого одного или нескольких кодонов нативного гена кодоном(ами) для других встречающихся в природе аминокислот. B альтернативе модифицированный ген может быть создан химическим синтезом полной ДНК-последовательности общеизвестными методами. Цель такой манипуляции с геном природного белка в типичном случае заключается в изменении свойств природного белка в том или ином требуемом направлении.
Новые аналоги инсулина могут быть получены изменением проинсулинового гена путем замены кодона(ов) в подходящем сайте нативного гена человеческого проинсулина кодоном(ами), кодирующим(и) требуемое(ые) замещение(я) аминокислотных остатков или путем синтеза полной ДНК-последовательности, кодирующей требуемый аналог человеческого инсулина. Новый модифицированный или синтетический ген, кодирующий требуемый аналог инсулина, затем вставляют в подходящий экспрессионный вектор, который при переносе в подходящий организм-хозяин, например E. coli, Bacillus или дрожжи, вырабатывают требуемый продукт. Продукт экспрессии затем выделяют из клеток или культурального бульона в зависимости от того, является ли продукт экспрессии секретом клеток или нет.
Наиболее близким по технической сущности к предлагаемому является способ получения новых аналогов инсулина, описанный Marki et al. (Hoppe-Seyler's Z. Physiol. Chem. 360 (1979), 1619-1632). Они могут быть также получены из отдельно приготовленных in vitro A- и B-цепей, содержащих подходящие замещения аминокислотных остатков, после чего модифицированные A- и B-цепи связывают вместе путем установления дисульфидных мостиков согласно известным методикам (например, Chauce et al., b Rick DH, Gross E. (ред.) Peptides: Synthesis-Structure-Function Proc. of Am 7th American peptide Symp., с.721-728).
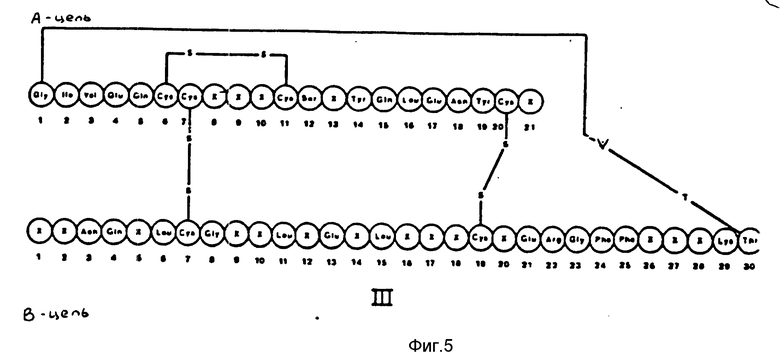
Новые аналоги инсулина предпочтительно получают реагированием биосинтетического предшественника, имеющего общую формулу II, представленную на фиг. 4, где Qn - пептидная цепь с n встречающимися в природе аминокислотными остатками; R - Lys или Arg; n - целое число от 0 до 33; m - 0 или 1, а X - определены выше при условии, что пептидная цепь - Qn-R - не содержит двух соседних основных аминокислотных остатков с L-треониновым эфиром в присутствии трипсина или производного трипсина и последующим преобразованием полученного треонинового эфира аналога человеческого инсулина в аналог человеческого инсулина известными методами. Так называемая реакция "транспептизации" описана в патенте США N 4343898 (материалы которого включены в виде ссылки).
С помощью реакции транспептизации мостик - (Qn-R)m между аминокислотой 29 в B-цепи и аминокислотой 1 и в A-цепи вырезается и треонинэфирная группа связывается с C-концом B29 Lys.
Предшественники вышеприведенной формулы II могут быть получены по методике, аналогичной описанной в европейском патентном описании N 0163529A, материалы которого включены сюда со справочными целями. С помощью этого метода ДНК-последовательность, кодирующая рассматриваемый предшественник, связывается с подходящим вектором экспрессии, который затем при переносе в дрожжевую клетку способен обеспечить экспрессию и секрецию требуемого соединения с правильно расположенными дисульфидными мостиками. Затем продукт экспрессии выделяют из культурального бульона.
Предлагаемые аналоги инсулина могут быть также получены реагированием биосинтетического предшественника общей формулы III, представленной на фиг. 5, где V и T представляют собой каждый Lys или Arg), а X - определены выше, в водном растворе с трипсином и карбоксипепсидазой-B, и выделением аналога человеческого инсулина из реакционного раствора.
Предшественники вышеприведенной формулы III могут быть получены по методике, аналогичной описанной в европейском патентном описании N 86302133.3, материалы которого включены сюда со справочными целями. Согласно этой методике ДНК-последовательность, кодирующую предшественник, встраивают в подходящий вектор экспрессии, который при переносе в дрожжи способен обеспечить экспрессию и секрецию продукта с правильно расположенными дисульфидными мостиками в среду культивирования.
Согласно третьему аспекту настоящего изобретения предлагается способ получения новых аналогов инсулина, в котором дрожжевой штамм, содержащий реплицируемый вектор экспрессии, включающий ДНК-последовательность, кодирующую предшественник аналога инсулина, культивируют в подходящей питательной среде и предшественник выделяют из культуральной среды и преобразуют в новый аналог инсулина с помощью ферментно-химической конверсии in vitro.
Настоящее изобретение относится также к новым предшественникам новых аналогов инсулина, ДНК-последовательностям, кодирующим такие новые предшественники, векторам экспрессии, содержащим такие ДНК-последовательности, и дрожжевым штаммам, трансформированным с помощью таких векторов экспрессии.
Модифицированные аналоги инсулина.
Настоящее изобретение охватывает также некоторые производные и дальнейшие замещения аналогов инсулина при условии, что такие производные или дальнейшие замещения не оказывают значительного влияния на достижение вышеописанной цели изобретения. Соответственно, представляется возможным внести производные одной или нескольких функциональных групп в аминокислотных остатках. Примером такого получения производных является известное само по себе преобразование кислотных групп в молекуле инсулина в сложноэфирные или амидные группы, преобразование спиртовых групп в алкоксигруппы или наоборот и избирательное деамидирование. Например, A21 Asn может быть деамидирован в A21 Asp гидролизом в кислой среде, или B3 Asn может быть деамидирован в B3 Asp в нейтральной среде.
Возможно, далее, модифицировать рассматриваемые аналоги инсулина либо присоединением, либо удалением аминокислотных остатков на N- или C-концах. Аналоги инсулина согласно настоящему изобретению могут не иметь до четырех аминокислотных остатков на N-конце B-цепи и до пяти аминокислотных остатков на C-конце B-цепи, что не оказывает значительного влияния на общие свойства аналога инсулина. Примерами таких модифицированных аналогов инсулина являются аналоги инсулина, в которых отсутствует аминокислотный остаток B1 Phe или B30 Thr.
Кроме того, встречающиеся в природе аминокислотные остатки могут быть присоединены к одному или больше концу полипептидных цепей при условии, что это не оказывает значительного влияния на достижение вышеописанной цели.
Такие исключения или добавления на концах полипептидной цепи предлагаемых аналогов инсулина могут быть осуществлены in vitro на аналогах инсулина с аминокислотными замещениями согласно настоящему изобретению. В альтернативе ген новых аналогов инсулина согласно изобретению может быть модифицирован либо путем присоединения, либо удалением кодонов, соответствующих лишним аминокислотным остаткам или отсутствующим аминокислотным остаткам на концах полипептидной цепи соответственно.
Используемые для аминокислот сокращения соответствуют приводимым в J. Biol. Chem, 243 (1968), 3558. Аминокислоты находятся в конфигурации L.
Как использовано в последующем тексте, B(1-29) означает укороченную B-цепь человеческого инсулина от B1 Phe до B29 Lys, а A(1-21) означает A-цепь человеческого инсулина.
Замещения, произведенные в молекуле человеческого инсулина при реализации настоящего изобретения обозначаются приставкой со ссылкой на человеческий инсулин. Например, B27 Ghi-человеческий инсулин означает аналог человеческого инсулина, в котором вместо Thr в положении 27 в B-цепи вставлен Glu. B27 Glu, B9 Asp-человеческий инсулин означает аналог человеческого инсулина, в котором Glu вставлен вместо Thr в положении 27 B-цепи, и A Asp вставлен вместо Ser в положении 9 B-цепи. B27 Glu, B(1-29)-Ala-Ala-Lys-A(1-21)-человеческий инсулин означает предшественник аналога инсулина (см. формулу II), в котором вставлен вместо Thr в положении 27 укороченной B-цепи (см. выше), а B(1-29)-цепь и A-цепь (A(1-21)) соединены пептидной последовательностью Ala-Ala-Lys. Если нет иных указаний, то следует понимать, что B(1-29)-цепь и A(1-21)-цепь соединены дисульфидными мостиками между A(7) Cys и B(7) Cys, между A(20) Cys и B(19) Cys соответственно, как в человеческом инсулине, и что A-цепь содержит внутренний дисульфидный мостик между A(6) Cys и A(11) Cys.
Как уже отмечалось, цель настоящего изобретения заключается в создании растворов быстродействующего инсулина для инъекций. В ходе достижения поставленной цели авторы изобретения впервые установили, что существуют значительные различия между инсулином в депо или болюсе и инсулином в кроветоке, включая совершенно неизбежное различие в концентрации инсулина. Более конкретно, инсулин в кроветоке является сильно разбавленным при содержании от 10-11 до 10-8 М и находится в мономерной форме, причем возможно некоторое количество инсулина находится в димерной форме. В гораздо более высокой концентрации накапливается в B-клеточных гранулах поджелудочной железы и в обычно принимаемом растворе находится в основном, если не главным образом, в неактивной гексамерной форме, например в виде общеизвестного 2-цинкгексамера.
Известно, что человеческий инсулин в растворе существует во многих молекулярных формах, а именно в виде мономера, димера, тетрамера и гексамера (Blundell et al. , Advances in Protein Chemistry, Academic Press, N.Y. -Zondon, 26, с. 279-330, 1972), причем олигомерным формам способствуют высокие концентрации инсулина, а мономер является наиболее активной формой инсулина. Тетрамер и гексамер не являются активными формами, и даже димер может быть неактивным. Заложенным в основу настоящего изобретения принципом является предположение автором, что выявленные ранее широко известные явления задержанного всасывания (Binder, Diabetes Care 7, N 1 (1984), 188-199) в значительной степени могут быть отнесены за счет времени, необходимого для диссоциирования инсулина из гексамерной, тетрамерной и димерной формы в (активную) мономерную форму.
Аналоги человеческого инсулина согласно изобретению обеспечивают свое быстродействие благодаря молекулярной структуре, которая не столь восприимчива к образованию димера, тетрамера, гексамера или полимера, т.е. характеризуется пониженной склонностью к самоассоциированию в димеры, тетрамеры, гексамеры или полимеры в присутствии или в отсутствии ионов цинка.
Давно признано, что значительные видовые различия аминокислотной последовательности, имеющейся в инсулине, свидетельствуют о том, что не все присутствующие в молекуле инсулина аминокислотные остатки являются важными для инсулиновой активности и что не существенные для инсулиновой активности некоторые аминокислоты важны для обеспечения физических свойств молекулы инсулина. Действительно, известно, что инсулин морских свинок не способен димеризоваться. Сульфатированный инсулин и тетранитротирозин-инсулин не димеризуется. Таким образом, многие из аминокислотных остатков молекулы человеческого инсулина могут быть изменены без существенного снижения инсулиновой активности. Предлагаемые здесь аминокислотные замещения в молекуле человеческого инсулина направлены на предотвращение образования димеров, тетрамеров, гексамеров или полимеров, не нарушая инсулиновой активности.
Аминокислотные остатки в положениях A-цепи и B-цепи формулы I, где могут быть произведены замещения, не являются критическими для инсулиновой активности, но они важны для обеспечения способности человеческого инсулина агрегироваться в димеры, тетрамеры, гексамеры или полимеры или для растворимости человеческого инсулина. Вносимые замещения аминокислотных остатков мешают соприкосновению атомов соседних молекул инсулина, которое способствует агрегированию в димеры, тетрамеры, гексамеры или полимеры.
Как и можно было бы ожидать, с точки зрения замещения изменения в некоторых положениях молекулы человеческого инсулина более эффективным, чем другие. В большинстве случаев одно единственное замещение в B-цепи может оказаться достаточным для ослабления склонности к самоассоциированию, тогда как для других остатков может потребоваться минимум два изменения. Замещения в A-цепи служат главным образом для улучшения растворимости диссоциированной молекулы. Предпочтительными положениями для осуществления замещений аминокислотных остатков являются B9, B12, B10, B26, B27 и B28 по отдельности, в сочетании друг с другом или вместе с замещениями в других местах молекулы инсулина, как это представлено в формуле I.
Замещение одного или большего числа отрицательно заряженных аминокислотных остатков вместо незаряженного или положительно заряженного аминокислотного остатка производится для создания более отрицательного заряда аналога человеческого инсулина при нейтральном pH и понижения изоэлектрической точки по сравнению с человеческим инсулином. Характерно, что аналоги человеческого инсулина согласно изобретению имеют тот же или более отрицательный заряд (при нейтральном pH) и более низкую изоэлектрическую точку, чем человеческий инсулин.
В большинстве случаев 1-3 замещения обеспечивают достижение непосредственных целей настоящего изобретения, а именно - получение более быстродействующего инсулина, что и составляет предпочтительные варианты воплощения изобретения. При использовании 2-3 замещений может быть достигнута улучшенная смешиваемость с защищенными инсулиновыми препаратами. Однако считается выгодным тот факт, что непосредственные цели настоящего изобретения могут быть достигнуты благодаря более, чем трем замещениям, поскольку это позволяет реализовать желательные вторичные цели.
В частности, дополнительный уровень замещения, например присутствие 4 или 5 аминокислотных остатков-заместителей, может давать аналог человеческого инсулина, который, кроме того, менее подвержен фибрилляции или полимеризации на границе раздела фаз, что является особенно желательным свойством, когда раствор инсулина предназначен для непрерывного вливания. В большинстве случаев для получения аналога человеческого инсулина согласно изобретению в молекуле инсулина реализуется не более 7 замещений. Предпочтительно 2-4 замещения.
Гены, кодирующие предшественники предлагаемых аналогов инсулина, могут быть получены модификацией генов, кодирующих описанные выше предшественники инсулина формулы II или III, в которых все X являются аминокислотными остатками человеческого инсулина, методами сайт-специфического мутагенеза для вставки или замещения кодонов или кодонами, кодирующими требуемую мутацию, ДНК-последовательность, кодирующая предшественник аналога инсулина, может быть получена ферментным синтезом из олигонуклеотидов, соответствующих всему или части гена предшественника аналога инсулина.
ДНК-последовательности, содержащие ген с требуемой мутацией гена инсулина, затем комбинируют с фрагментами, кодирующими TPI-промотор (TPIp) (T. Alber and G. Kawasaki, "Nucleotid Sequence of the triose phosphate isomerase gene of Saccharomycea cerevistac. J. Mol. Applied. Jenet. I (1982) 419-434), MF α I-лидер-последовательность (J. Kurjan and I. Herskowitz "Structure of an yeast pheromone gene (MF альфа I): A putative α-factor precursor contains four tandem coptes of mature α-factor. Cell 30 (1982) 933-943) и последовательность окончания транскрипции из TPI дрожжей S. cerevisiae (TPIT). Эти фрагменты дают последовательности, обеспечивающие высокую скорость транскрипции гена кодирования предшественника, а также дают предпоследовательность, которая может обеспечивать локализацию предшественника в секреторном контуре и в дальнейшую его экскрецию в среде для выращивания. Экспрессионные единицы, кроме того, снабжаются дрожжевым 2-мк началом репликации и выбираемым маркером LEU2.
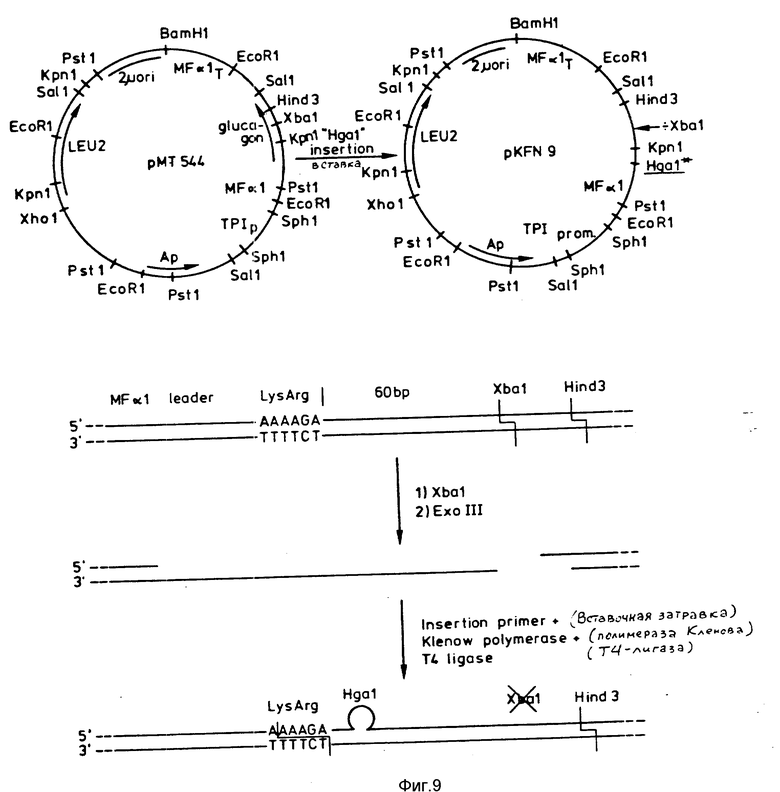
Во время созревания альфа-фактора in vivo в дрожжах, последние (C-конец шесть аминокислот MF α I-пептида-лидера (Lys-Arg-Glu-Ala-Glu-Ala) удаляют из предшественника альфа-фактора последовательно с помощью эндопептидазы, распознающей последовательность Lys - Arg, а аминодипептидазы, которая удаляет остатки Glu-Ala (Julius D. et al., Cell 32 (1983) 839-852). Для устранения необходимости в дрожжевой аминодипептидазе последовательность, кодирующую C-концевую Glu-Ala-Glu-Ala MF α I-лидера, удаляют из MF α I-последовательности-лидера с помощью мутагенеза in vitro. В последующем тексте "MF α I-лидер" означает всю лидер-последовательность, тогда как "MF α I-лидер (минус Glu-Ala-Glu-Ala)" означает лидер-последовательность, в которой удалена C-концевая последовательность Glu-Ala-Glu-Ala.
Пример 1. Построение синтетического гена, кодирующего B(1-29) Ala-Ala-Lys, -A-(1-21)-человеческий инсулин.
Дрожжевой кодон - оптимизированный структурный ген для В(1-29)-Ala-Ala-Lys-A(1-21)-человеческого инсулина строят следующим образом.
Нижеследующие 10 олигонуклеотидов, представленные на фиг. 6, синтезируют на автоматическом ДНК-синтезаторе с использованием фосфорамидитовых химпрепаратов на стеклянном носителе с контролируемым размером пор (S.Z. Beancage & M.H. Caruthers (1981) Jetrehedren Letters 22, 1859-1869).
Из указанных (фиг. 6) 10 лигонуклеотидов образуют 5 дуплексов A-E, как показано на фиг.7.
20 пмолей каждого из дуплексов A-Е образуют из соответствующих пар 5'-фосфорилированных олигонуклеотидов I-X нагреванием в течение 5 мин при 90oC последующим охлаждением до комнатной температуры в течение 75 мин. 33-мер (X) в диплексе E не подвергают 5'-фосфорилированию, чтобы избежать димеризации комплементарных Xba I-однонитевых концов во время лигации. Пять дуплексов смешивают и обрабатывают T4-лигазой. Синтетический ген выделяют в виде полосы 182/183 п.о. после электрофореза лигационной смеси на 2% агарозном геле.
Полученный синтетический ген представлен на фиг.7.
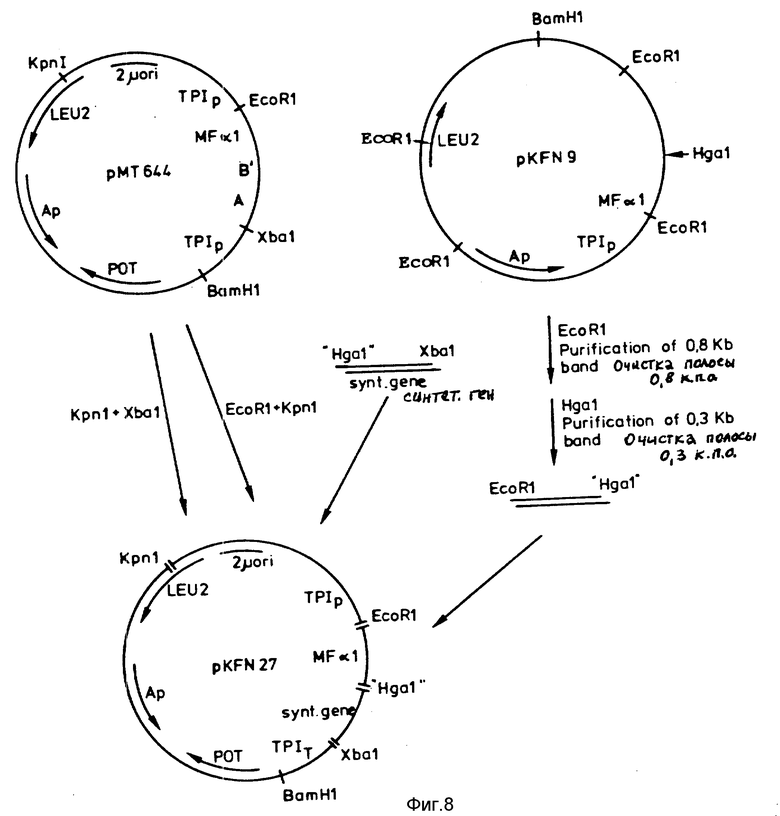
Синтетический ген лигатируют с 4 к.п.о. KpnI-EcoRI-фрагментом и 8 к.п.о. XbaI-KpnI-фрагментом из pMT644 и 0,3 к.п.о. EcoRI-Hgal-фрагментом из pKFN 9 с получением следующей структуры: TPIp-MF α I-лидер-B(1-29)-Ala-Ala-Lys-A(1-21)-TPLT.
Плазмида pMT644 содержит ДНК-последовательность TPIp-MF α I-лидep-B(1-29)-A(1-21)-TPIT и ее построение описано в патенте Дании N 1293/85. Построение плазмиды pKFN9 описано ниже.
Лигационная смесь использована для трансформации компетентного штамма E. coli (r-, m+) (MT172). 30 ампициллин-резистентных колоний переносили на чашки, содержащие минимальную среду M9 (T. Maniatis et al., Molecular Cloning, Cold Sprig Harbor Lab. 1982, с. 68), что приводило к 8 Leu+-колониям. Определение последовательности по Максэму-Джилберту для 32P-XbaI-EcoRI-фрагмента показало, что три плазмиды содержат ген с требуемой последовательностью. Для дальнейшего использования использована одна плазмида pKFN27.
Конструкция плазмиды pKFN27 представлена на фиг.8.
Построение плазмиды pKFN9. Цель построения плазмиды pKFN9 заключается в получении плазмиды, содержащей сайт Hga I непосредственно после MF α I-лидера. Плазмиду pMT544 (конструкция которой описана в патенте Дании N 278/85) разрезают с помощью Xba I и около 250 оснований удаляют с 3'-концов обработкой ExoIII-нуклеазой. Синтетическую 32-мерную вставочную затравку GGATAAAAGAGAGGCGCGTCTGAAGCTCACTC, содержащую Hga I-последовательность, гибридизуют до частично однонитевой ДНК. Двухнитевую кольцевую ДНК получают с использованием полимеразы Кленова и лигируют с помощью T4-лигазы. После трансформации E.coli (r-, m+) (MT172) колонии, содержащие мутированную плазмиду, идентифицируют гибридизацией колоний с 5'-32P-меченной 32-мерной вставочной затравкой. Появление нового Hga I-сайта подтверждается методом расщепления рестрикционным ферментом (EcoRI + HgaI, Hind 3 + HgaI). После повторной трансформации для дальнейшего использования выбирают "чистый" мутант pKFN9. Конструкция pKFN9 представлена на фиг.9.
Пример 2. Получение B27 Glu-человеческого инсулина.
B27 Glu-человеческий инсулин получают транспептидизацией B27 Glu, B(1-29)-Ala-Ala-Lys-A(1-21)-человеческого инсулина с помощью Thr-OBu+ и ацидолизом полученного треонинового эфира трифторуксусной кислотой. Процесс получения состоит из следующих стадий:
I. Построение гена, кодирующего B27 Glu, B(1-29)-Ala-Ala-Lys-A(1-21)-инсулин.
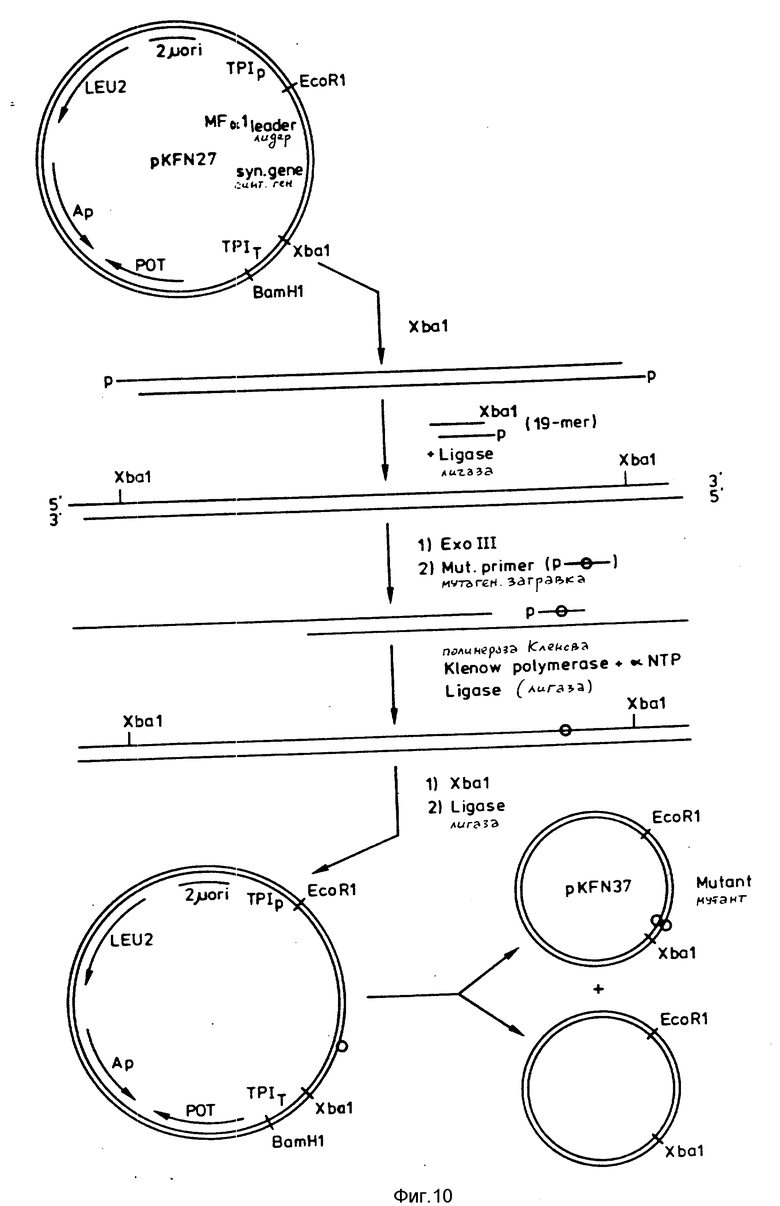
Плазмиду pKFN27 располагают по единственному XbaI-сайту, расположенному сразу же за геном предшественника синтетического инсулина. Чтобы не разрушить XbaI-сайт при связывании на описанной ниже стадии, каждый конец линейной плазмиды лигируют 19-мерным Hind 3-XbaI-двунитевым линкером
XbaI - Hind3
CTAGAAGAGCCCAAGACTA
TTCTCGGGTTCTGATTCGA
Линкер 5'-фосфорилирован на XbaI-однонитевом конце, но оставлен нефосфорилированным на Hind 3-конце, благодаря чему исключается полимеризация линкера во время стадии лигирования и получения кольцевой ДНК (см. фиг.10).
5'-мононуклеотиды удаляют с 3'-концов полученной линейной двунитевой ДНК с помощью обработки ExoIII-нуклеазой. Обработку ExoIII-нуклеазой осуществляют при 23oC в условиях, при которых около 250 нуклеотидов удаляется с каждого 3'-конца ДНК (L. Guo and R.Wu (1983), Methods in Enzymdogy, lOO, 60-96).
5'-фосфорилированный 25-мерный мутагенный праймер d(GTTTCTTCTACGAACCTAAGGCTGC) гибридизуют мутационным сайтом. После связывания с помощью полимеразы Кленова в присутствии T4-лигазы двунитевую ДНК переваривают с помощью XbaI. Затем гетеродуплексную кольцевую ДНК с мутацией в одной нити с помощью T4-лигазы.
Лигированную смесь трансформируют в E.coli (r-, m+) (MT172), выбираемые по резистентности к ампициллину.
Мутанты идентифицируют гибридацией колоний с 5'-32P-меченой 25-мерной мутагенной затравкой. После повторной трансформации показано, что плазмида pKFN37 на одной из результирующих колоний содержит требуемую мутацию по данным определения ДНК-последовательности 0,5 к.п.о. XbaI-EcoRI-фрагменты (A. Maxam and W.Gilbert (1980) Methods in Enzymology, 65, 499-560).
II. Трансформация.
S.cerevisiae штамм MT663 (E2-7B X EII-ЗC a/альфа, Δtpi/Δtpi, pep 4-3/pep 4-3) выращивают на YPGAL (1% бакто-дрожжевого экстракта, 2% бакто-пептона, 2% галактозы, 2% лактата) до получения оптической плотности ОД, равной 0,6 при длине волны 600 нм.
100 мл культуры центрифугируют, промывают 10 мл воды, повторно центрифугируют и вновь суспендируют в 10 мл 1,2 М сорбита, 25 мМ Na2ЭДТК pH 8,0, 6,7 мг/мл дитиотреитола. Суспензию инкубируют 15 мин при 30oC, центрифугируют и клетки повторно суспендируют в 10 мл 1,2 М сорбита, 10 мМ Na2ЭДТК, 0,1 М цитрата натрия pH 5,8, 2 мг "Новозима 234". Суспензию инкубируют 30 мин при 30oC, клетки собирают центрифугированием, промывают в 10 мл 1,2 М сорбита и в 10 мл CAS (1,2 М сорбита, 10 мМ CACl2, 10 мМ Трис (Трис = трис(гидроксиметил)-аминометан) pH 7,5) и повторно суспендируют в 2 мл CAS. Для трансформации 0,1 мл CAS-ресуспендированных клеток смешивают с приблизительно 1 мкг плазмиды pKFN37 и оставляют на 15 мин при комнатной температуре. Добавляют 1 мл 20% полиэтиленгликоля 4000, 10 мМ CACl2, 10 мМ Трис pH 7,5 и смесь оставляют при комнатной температуре еще на 30 мин. Смесь центрифугируют и гранулы повторно суспендируют в 0,1 мл SOS (1,2 М сорбита, 33 об. % YPGal, 6,7 мМ CACl2, 14 мкг/мл лейцина) и инкубируют 2 ч при 30oC. Затем суспензию центрифугируют и гранулы повторно суспендируют в 0,5 мл 1,2 М сорбита. Добавляют 6 мл верхнего агара (среда "SC" согласно Sherman et al. (Methods in Yeast Genesis. Cold Spring Harbor Labs, 1981) при отсутствии лейцина и содержащая 1,2 М сорбита + 2,5% агар) при 52oC и суспензию выливают на верхнюю часть чашек, содержащих тот же агар, но затвердевший, в виде сорбит-содержащей среды. Колонии-трансформанты отбирают спустя 3 сут при 30oC, повторно выделяют и используют для культивирования в жидких средах. Один такой трансформант KFN40 (=MT663/pKFN37) выбран для получения дальнейших характеристик.
III. Экспрессия предшественника B27 Glu, B(1-29)-Ala-Ala-Lys-A(1-21) инсулина.
Штамм дрожжей KFN40 выращивают на YPD - среде (1% дрожжевого экстракта, 2% пептона (оба производства фирмы "Дифло лэборотриз") и 2% глюкозы). 10-мл культуру штамма встряхивают при 30oC до OD60026. После центрифугирования надосадочную жидкость анализируют с помощью противофазной ВЭЖХ и выявляют 13,5 мг/л предшественника.
Аналог в надосадочной жидкости концентрируют на катионообменной колонке при низком pH с последующей десорбцией подходящим буферным раствором. Кристаллизацию осуществляют с помощью спиртового цитратного буфера.
IV. Транспептидация.
0,2 моля (47,1 г) Thr - OBut, НОАС растворяют в ДМФА с получением 100 мл раствора, добавляют 50 мл 76,5 об.% ДМФА в воде и 10 г неочищенного B27 Glu, B(1-29)-Ala-Ala-Lys-A(1-21)-человеческого инсулина растворяют в смеси, которую термостатируют при 12oC. Затем добавляют 1 г трипсина в 25 мл 0,05 М ацетата кальция и спустя 24 ч при 12oC смесь добавляют к 2 л ацетона и осажденные пептиды выделяют центрифугированием и сушат в вакууме. B27 Glu, B30 Thr-But-человеческий инсулин очищают на препаративной ВЭЖХ-колонке с силика-C18 в качестве материала колонки.
V. Конверсия в B27 Glu-человеческий инсулин.
B27 Glu, B30 Thr-OBut-человеческий инсулин растворяют в 100 мл трифторуксусной кислоты. По прошествии 2 ч при комнатной температуре раствор лиофилизуют. Лиофилизованный порошок растворяют в 400 мл 47,5 мМ цитрата натрия при pH 7. Пептиды осаждают при pH 5,5 после добавления 2,4 мл 1 M ZnCl2, выделяют центрифугированием и сушат в вакууме. Продукт очищают анионообменной хроматографией и соль удаляют гель-фильтрацией. Выход: 1,7 г B27 Glu-человеческого инсулина.
Пример 3. Получение B9 Asp-человеческого инсулина.
B9 Asp-человеческий инсулин получают транспептидизацией B9 Asp, B(1-29)-Ala-Ala-Lys-A(1-21)-человеческого инсулина с помощью Thr-OBut и ацидолизом полученного треонинового эфира трифторуксусной кислотой.
I. Построение гена, кодирующего B29 Asp, B(1-29)-Ala-Ala-Lys-A(1-21) -человеческий инсулин.
Этот ген строят по той же методике, которая описана для гена, кодирующего B27 Glu , B(1-29)-Ala-Ala-Lys-A(1-21)-человеческий инсулин, сайт-специфическим мутагенезом pKFN27, направляемым 23-мерной мутагенной затравкой d(CTTGTGCGGTGACCACTTGGTTG). Показано, что плазмида pKFN38 содержит требуемую мутацию.
II. Трансформация.
Плазмиду pKFN38 трансформируют в штамм MT663 S.cerevisiae по методике примера 2, II и выделяют трансформант KFN41.
III. Экспрессия B9 Asp, B(1-29)-Ala-Ala-Lys-A(1-21)-человеческого инсулина.
Дрожжевой штамм KFN41 выращивают на среде YPD по методике примера 2, III. В надосадочной жидкости обнаружено 2,5 мг/л предшественника аналога инсулина.
IV. Транспептидация.
7,4 г неочищенного B9 Asp, B(1-29)-Ala-Ala-Lys-A(1-21)-человеческого инсулина транспептидизируют по методике примера 2, IV с получением B9 Asp, B30 Thr-OBu+-человеческого инсулина.
V. Конверсия.
B9 Asp, BЗ0 Thr-OBu+-человеческий инсулин преобразуют в В9 Аsр-человеческий инсулин по методике примера 2, V. Выход: 0,83 г B9 Asp-человеческого инсулина.
Пример 4. Получение B9 Asp, B27 Glu-человеческого инсулина.
B9 Asp, B27 Glu-человеческий инсулин получают транспептидизацией B9 Asp, B27 Glu, B(1-21)-Ala-Ala-Lys-A(1-21)-человеческого инсулина с помощью Thr-OBu+, и ацидолизом полученного треонинового эфира трифторуксусной кислотой.
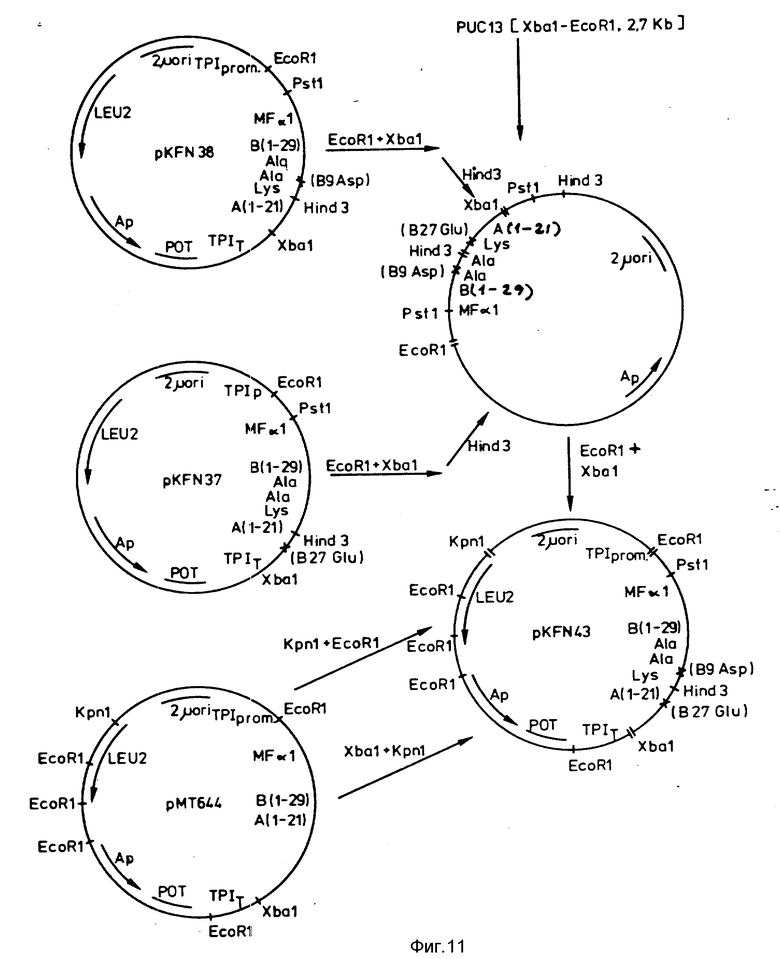
I. Построение гена, кодирующего B9 Asp, B27 Glu, B(1-29)-Ala-Ala-Lys-A(1-21)-человеческий инсулин.
367 п. о. EcoRI-Hind З-фрагмент из pKFN8 (см.пример 3) и 140 п.о. Hind 3-XbaI-фрагмент из pKFN37 (см. пример 2) лигируют с большим XbaI-EcoRI-фрагментом плазмиды pUC13 (эту плазмиду строят по методике, описанной для pUC8 и pUC9 Vieira et al. (1982), Gene. 19, 259-268). Лигированную смесь трансформируют в E.coli (MT172), выбранную по резистентности к ампициллину. Плазмиды получают из ряда трансформантов и анализируют по перевариванию с помощью PstI и Hind3. Фрагмент XbaI-EcoRI 0,5 к.п.о. из одной плазмиды, которая давала правильные рестрикционно-ферментные структуры, лигируют с 7,8 к. п. о. XbaI-KpnI-фрагментом и 4,3 к.п.о. KpnI-EcoRI-фрагментом, оба из которых из pMT644 (описана в патенте Дании N 1293/84). Лигированную смесь трансформируют в E.coli (MT172), выбранную по резистентности к ампициллину. Показано, что плазмида pKFN43 из одной из результирующих колоний содержит ген требуемого предшественника производного инсулина по данным определения ДНК-последовательности 0,5 к.п.о. XbaI-EcoRI-фрагмента. Конструкция pKFN43 представлена на фиг.11.
II. Трансформация.
Плазмиду pKFN38 трансформируют в штамм MT663 S.cerevisiae по методике примера 2, II и выделяют трансформант KFN44.
III. Экспрессия B9 Asp, B27 Glu, B(1-29)-Ala-Ala-Lys-A(1-21)-человеческого инсулина.
Дрожжевой штамм KFN44 выращивают на среде YPD по методике примера 2, III. 7,3 мг/л предшественника аналога инсулина получают из надосадочной жидкости.
IV. Транспептидация.
12,7 неочищенного B9 Asp, B27 Glu, B(1-29)-Ala-Ala-Lys-A(1-21)-человеческого инсулина транспептидизируют по методике примера 2, IV с получением B9 Asp, B27 Glu, B30 Thr-OBu+-человеческого инсулина.
V. Конверсия.
B29 Asp, B27 Glu, B30 Thr-OBut-человеческий инсулин преобразуют в B9 Asp, B27 Glu, B30 Thr-человеческий инсулин и очищают по методике примера 2, V. Выход: 1,0 B9 Asp, B27 Glu-человеческого инсулина.
Пример 5. Получение A8 His, B9 Asp, B27 Glu-человеческого инсулина.
A8 His, B9 Asp, B27 Glu-человеческий инсулин получают транспептидизацией A8 His, B9 Asp, B27 Glu, B(1-29)-Ala-Ala-Lys-A(1-21)-человеческого инсулина с помощью Thr-OBut и ацидолизом полученного треонинового эфира трифторуксусной кислотой по методике примера 2.
I. Построение гена, кодирующего A8 His, B9 Asp, B27 Glu, B(1-29)-Ala-Ala-Lys-A(1-21)-человеский инсулин.
Этот ген строят с помощью олигонуклеотидного направленного мутагенеза с использованием методики двунитевого разрыва (J. Moinega, T. Frances chimi, S. Inonyl, M. Inonyl (1984) Biotechnology 2, 636-639). Выведенная на основе pUC13 плазмида, кодирующая MF α I последовательность-лидер и предшественник B9 Asp B27 Glu-человеческого инсулина (фиг.11) расщепляют с помощью HpaI и XbaI. Большой фрагмент смешивают с плазмидой, линеаризованной с помощью Ndl I. После денатурирования под действием температуры и охлаждения смесь содержит дуплексы с двунитевым разрывом с однонитевым "окном" в области, соответствующей гену предшественника инсулина (HpaI-XbaI). 37-мерную мутагенную затравку рассогласования d(GAACAATGCTGTCACTCCATCTGCTCCTTGTACCAAT) гибридизируют с зажатым дуплексом с последующим заполнением полимеразой Кленова и лигацией. Смесь используют для трансформации E.coli (MT172), выбранной по резистентности к ампициллину. Мутанты идентифицируют по гибридизации колонии с 18-мерной 5'-32P-меченой пробой d(AATGCTGTCACTCCATCT). После повторной трансформации определено, что плазмида из одной из результирующих колоний содержит требуемую мутацию по данным определения ДНК-последовательности XbaI-EcoRI-фрагмента 0,5 к.п.о. Эта плазмида использована для построения дрожжевой плазмиды pKFN102, как это описано в примере 4 для случая построения pKFN43.
II. Трансформация.
Плазмиду pKFN102 трансформируют в S.cereovisiae штамм МТ663 по методике примера 2, II и выделяют трансформант KFN109.
III. Экспрессия A8 His, B9 Asp, B27 Glu, B(1-29)-Ala-Ala-Lys-A(1-21)-человеческого инсулина.
Дрожжевой штамм KFN109 выращивают на среде YPD по методике примера 2, III. В надосадочной жидкости выявлено 21,5 мг/л предшественника аналога инсулина.
IV-V. Транспептидация и конверсия.
22,0 г неочищенного A8 His, B9 Asp, B27 Glu, B(1-29)-Ala-Ala-Lys-A(1-21)-человеческого инсулина транспептидизируют, преобразуют и очищают по методике примера 2, IV-V. Выход: 4,0 г A8 His, B9 Asp, B27 Glu-человеческого инсулина.
Пример 6. Получение B12 Ile-человеческого инсулина.
B12 Ile-человеческий инсулин получают транспептидацией B12 Ile, B(1-29)-Ala-Ala-Lys-A(1-21)-человеческого инсулина с помощью Thr-OBu+ и ацидолизом полученного треонинового эфира трифторуксусной кислотой, как описано в примере 2, I. Построение гена, кодирующего B12 Ile, B(1-29)-Ala-Ala-Lys-A(1-21)-человеческий инсулин.
0,5 к. п.о. EcoRI-XbaI-фрагмент pMT598 (построение плазмиды pMT598 описано в заявке на европейский патент N 0163529A), кодирующий MF α 1-лидер (минус Glu-Ala-Glu-Ala)-B(1-29)-Ala-Ala-Lys-B(1-21) вставляют в M13 mp 10 RFфаг, расщепленный с помощью XbaI-EcoRI, и соответствующую однонитевую ДНК очищают от M13 mp 10-рекомбинантного фага. Однонитевую матричную ДНК гибридизируют с мутагенной 27-мерной затравкой NOR-092 d(GTAGAGAGCTTCGATCAGGTGTGAGCC). Затравки расширяют с помощью dNTPS и полимеразы Кленова и лигатируют с помощью T4-ДНК-лигазы. Мутагенную затравку KFN92 выбирают таким образом, чтобы разрушить сайт Bst NI (единственный во фрагменте XbaI-EcoRI). Поэтому для отбора относительно немутированного фрагмента EcoRI-XbaI, смесь расщепляют с помощью Bst NI, а затем EcoRI и XbaI и лигируют с вектором pUC13 расщеплением по EcoRI и XbaI. Из одного из полученных трансформантов выбирают плазмиду, pMT76О, не имеющую Bst NI-сайта в последовательности кодирования инсулина. Требуемую мутированную последовательность проверяют определением ДНК-последовательности по Максэму Джилберту. Плазмида pMT760 содержит 0,5 к.п.о. EcoRI-XbaI-последовательность, соответствующую тому же фрагменту из pMT598 (см. выше), если не считать мутации в B12 (Val-Ile). Эту мутированную последовательность затем связывают с дрожжевой экспрессионной плазмидой лигированием 0,5 к.п.о. EcoRI-XbaI-фрагмента из pMT76О с 7,8 к. п. о. XbaI-KpnI и 4,3 к.п.о. KpnI-EcoRI-фрагментом из pMT644 с получением pMTA.
II-V. Трансформация, экспрессия, транспептидация, конверсия.
Плазмиду pMTA трансформируют в дрожжевой штамм MT663, как это описано в примере 2, II, и трансформированный штамм MTA культивируют по методике примера 2, III. 10,4 мг/л предшественника аналога инсулина получают из надосадочной жидкости. 10 г неочищенного предшественника аналога транспептидизируют, преобразуют и очищают по методике примера 2, IV-V. Выход: 1,3 г B12 Ile-человеческого инсулина.
Пример 7. Получение B12 Tyr-человеческого инсулина.
B12 Tyr-человеческий инсулин может быть получен транспептидацией B12 Tyr, B(1-29)-Ala-Ala-Lys-A(1-21)-человеческого инсулина с помощью Thr-OBut и ацидолизом полученного треонинового эфира трифторуксусной кислотой по методике примера 2.
I. Построение гена, кодирующего B12 Tyr, B(1-29)-Ala-Ala-Lys-A(1-21)-человеческий инсулин.
Ген строят по методике, аналогичной методике получения гена, кодирующего B12 Ile, B(1-29)-Ala-Ala-Lys-A(1-21)-человеческий инсулин с тем исключением, что вместо KFN92 использована затравка KFN93 d(GTAGAGAGCTTCGTACAGGTGTGAGCC).
II-IV. Трансформация, экспрессия, транспепдидация, конверсия.
Стадии II-III проводят по методике примера 2. Из надосадочной жидкости получают 1,7 мг/л предшественника аналога инсулина. Неочищенный предшественник аналога может быть транспептидизирован, преобразован и очищен по методике примера 2, IV-V с получением B12 Tyr-человеческого инсулина.
Пример 8. Получение B10 Asp-человеческого инсулина.
B10 Asp-человеческий инсулин получают транспептидацией B10 Asp, B(1-29)-Ala-Ala-Lys-A(1-21)-человеческого инсулина с помощью Thr-OBut и ацидолизом полученного треонинового эфира трифторуксусной кислотой по методике примера 2.
I. Построение гена, кодирующего B10 Asp, B(1-29)-Ala-Ala-Lys-A(1-21)-человеческий инсулин.
Ген строят по методике, аналогичной получению гена, кодирующего B12 Ile, B(1-29)-Ala-Ala-Lys-A(1-21)-человеческий инсулин с тем отличием, что вместо KFN92 использована затравка KFN94 d(AGCTTCCACCAGATCTGAGCCGCACAG).
II-V. Трансформация, экспрессия, транспептидация, экспрессия.
Стадии II-III проводят по методике примера 2. В надосадочной жидкости выявляют 36 мг/л предшественника аналога инсулина. Неочищенный предшественник аналога транспептидируют, преобразуют и очищают по методике примера 2, IV-V. Выход: 7,6 г B10 Asp-человеческого инсулина.
Пример 9. Получение B28 Asp-человеческого инсулина.
B28 Asp-человеческий инсулин получают транспентидацией B28 Asp, B(1-29)-Als-Ala-Lys-A(1-21)-человеческого инсулина с помощью Thr-OMe и гидролизом полученного треонинового эфира при pH 8-12.
I. Построение гена, кодирующего B28 Asp, B(1-29)-Ala-Ala-Lys-A(1-21)-человеческий инсулин.
0,5 к. п.о. EcoRI-XbaI-фрагмент pMT462 (построение плазмиды pMT462 описано в патентной заявке Дании N 1257/86), кодирующий MF α I-лидер (минус Glu-Ala-Glu-Ala)-B-C-A, т.е. ген человеческого проинсулина с предшествующим модифицированным MF α I-лидером, вставляют в M13 mp 10RF-фаг, расщепляют с помощью XbaI-EcoRI и соответствующую однонитевую ДНК очищают от M13 mp 10-рекомбинантного фага. Однонитевую матричную ДНК гибридизируют с мутагенной 41-мерной затравкой NOR205 d(TTCCACAATGCCCTTAGCGGCCTTGTCTGTGTAGAAGAAGC) и универсальной секвенирующей затравкой M13 d(TCCCAGTCACGACGT). Затравки увеличены с помощью dNTP и полимеразы Кленова и лигированы с помощью T4 ДНК-лигазы.
После экстракции фенолом, осаждения этанолом и повторного суспендирования ДНК расщепляют рестрикционными ферментами Apa I, XbaI и KcoRI. После еще одной экстракции фенолом, осаждения этанолом и повторного суспендирования ДНК лигируют с EcoRI-XbaI, расщепленной pUC13. Лигированную смесь получают из ряда трансформантов. Плазмидные препараты расщепляют с помощью EcoRI и XbaI и препараты, дающие полосы на 0,5 и 0,6. к.п.о., повторно трансформируют в E.coli. После повторной трансформации выбирают трансформант, содержащий лишь pU13 со вставкой 0,5 к.п.о.
Из одного из полученных трансформантов выбирают плазмиду pMT881 с требуемой мутацией на B28 (Pro-Asp). Мутированную последовательность проверяют с помощью определения ДНК-последовательности по методу Максэма-Джилберта. Затем мутированную последовательность переносят на дрожжевую экспрессионную плазмиду лигированием 0,5 к.п.о. EcoRI-XbaI-фрагмента pMT881 с 7,8 к.п.о. XbaI-KpnI и 4,3 к.п.о,. KpnI-EcorI-фрагмента из pMT644 с получением pMTA1.
II. Трансформация.
Плазмиду pMTA1 трансформируют в S.сerevisiae штамм MT663 по методике примера 2, II и выделяют трансформант MTA1.
III. Экспрессия B28 Asp, B(1-29)-Ala-Ala-Lys-A(1-21)-человеческого инсулина.
Дрожжевой штамм MTA1 выращивают на среде YPD по методике примера 2, III. Из надосадочной жидкости получено: 7,2 мг/л предшественника аналога инсулина.
IV. Транспептидизация.
Неочищенный B28 Asp, B(1-29)-Ala-Ala-Lys-A(1-21) транспептизируют по методике примера 2, IV при замене Thr-OBut на Thr-OMe с получением B28 Asp, B30 Thr-OMe-человеческого инсулина.
V. Конверсия.
B28 Asp, B30 Thr-OMe-человеческий инсулин диспергируют в воде до 1% (мас./об.) и растворяют добавлением 1н. гидроксида натрия до pH 10,0. Значение pH выдерживают постоянным на уровне 10,0 в течение 24 ч при 25oC. Образованный B28 Asp-человеческий инсулин осаждают добавлением хлорида натрия до 8% (мас./об.), тригидрата ацетата натрия до 1,4% (мас./об.) и ацетата цинка дигидрата до 0,01% (мас./об.) с последующим добавлением 1н. хлористоводородной кислоты до pH 5,5. Осадок выделяют центрифугированием и очищают анионообменной хроматографией и соли удаляют гель-фильтрацией. Выход: 0,2 г B28 Asp-человеческого инсулина.
Пример 10. Получение A21 Asp, B9 Asp, B27 Glu-человеческого инсулина.
A21 Asp, B9 Asp, B27 Glu-человеческий инсулин получают из B9 Asp, B27 Glu-человеческого инсулина избирательным деамидированием (гидролиз 5% раствора в течение 14 сут при 37oC, pH 2,5). Деамидированный продукт выделяют анионообменной хроматографией.
Пример 11. Получение B27 Asp, A21 Asp-человеческого инсулина.
B21 Glu, A21 Asp-человеческий инсулин получают транспептидизацией B27 Glu, B21 Asp, B(1-29)-Ala-Ala-Lys-A(1-21) с помощью Thr-OBu+ и ацидолизом полученного треонинового эфира трифторуксусной кислотой по методике примера 2.
B27 Glu, A21 Asp, B(1-29)-Ala-Ala-Lys-A(1-21) получают из B27 Glu, B(1-29)-Ala-Ala-Lys-A(1-21) (см. пример 2) деамидированием, как это описано в примере 10.
Пример 12. В26 Glu-человеческий инсулин был получен при транспептидации B26 Glu, B(1-29)-Ala-Ala-Lys-A(1-21) Thr-OMe и гидролизом полученного треонинового эфира при pH от примерно 8 до 12, как описано в примере 9. Выход составил 6 мг.
Пример 13. B9 Asp, B27 Arg-человеческий инсулин был получен при транспептидации B9 Asp, B27 Arg, B(1-29)-Ala-Ala-Lys-A(1-21) Thr-OMe и гидролиз полученного треонинового эфира при pH от примерно 8 до 12, как описано в примере 9. Выход составил 0,5 г.
Пример 14. B16 Glu, B27 Glu человеческий инсулин был получен при транспептидации B16 Glu, B27 Glu, B(1-29)-Ala-Ala-Lys-A(1-21) Thr-OMe и гидролизе полученного треонинового эфира при pH от примерно 8 до 12, как описано в примере 9. Выход составил 8 г.
Пример 15. B20 Gln-человеческий инсулин был получен при транспептидации B20 Gln, B(1-29)-Ala-Ala-Lys-A(1-21) Thr-OMe и гидролизе полученного треонинового эфира при pH от примерно 8 до 12, как описано в примере 9. Выход составил 22 мг.
Пример 16. A13 Ser, B27 Glu-человеческий инсулин был получен при транспептидации A13 Ser, B27 Glu, B(1-29)-Ala-Ala-Lys-A(1-21) Thr- OMe и гидролизе полученного треонинового эфира при pH от примерно 8 до 12, как описано в примере 9. Выход составил 7,4 г.
Пример 17. B10 Asp, B28 Asp-человеческий инсулин был получен при транспептидации B10 Asp, B28 Asp, B(1-29)-Ala-Ala-Lys-A(1-21) Thr-OMe и гидролизе полученного треонинового эфира при pH от примерно 8 до 12, как описано в примере 9. Выход составил 3 г.
Пример 18. B17 Gln человеческий инсулин был получен при транспептидации B17 Gln, B(1-29)-Ala-Ala-Lys-A(1-21) Thr-OMe и гидролизе полученного треонинового эфира при pH от примерно 8 до 12, как описано в примере 9. Выход составил 4,2 г.
Пример 19. B19 Glu, B27 Glu-человеческий инсулин был получен при транспептидации B1 Glu, B27Glu, B(1-29)-Ala-Ala-Lys-A(1-21) Thr-OMe и гидролизе полученного треонинового эфира при pH от примерно 8 до 12, как описано в примере 8. Выход составил 24,4 г.
Пример 20. B2 Asp, B5 Ser, B27 Glu-человеческий инсулин был получен при транспептидации B2 Asp, B5 Ser, B27 Glu, B(1-29)-Ala-Ala-Lys-A(1-21) Thr-OMe и гидролизе полученного треонинового эфира при pH от примерно 8 до 12, как описано в примере 9. Выход составил 4,8 г.
Пример 21. B10 Thr-человеческий инсулин был получен при траспептидации B10 Thr, B(1-29)-Ala-Ala-Lys-A(1-21) Thr-OMe и гидролизе полученного треонинового эфира при pH от примерно 8 до 12, как описано в примере 9. Выход составил 6,4 г.
Пример 22. A13 Glu, B10 Glu-человеческий инсулин был получен при транспептидации A13 Glu, B10 Glu, B(1-29)-Ala-Ala-Lys-A(1-21) Thr-OMe и гидролизе полученного треонинового эфира при pH от примерно 8 до 12, как описано в примере 9. Выход составил 25,2 г.
Пример 23. B2 Ser, B10 Asp-человеческий инсулин был получен при транспептидации B2 Ser, B10 Asp, B(1-29)-Ala-Ala-Lys-A(1-21) Thr-OMe и гидролизе полученного треонинового эфира при pH от примерно 8 до 12, как описано в примере 9. Выход составил 7,3 г.
Пример 24. B16 His человеческий инсулин был получен при транспептидации B16 His, B(1-29)-Ala-Ala-Lys-A(1-21) Thr-OMe и гидролизе полученного треонинового эфира при pH от примерно 8 до 12, как описано в примере 9. Выход 78 г.
Пример 25. A21 Glu, B10 Asp-человеческий инсулин был получен при транспептидации A2l Glu, B10 Asp, B(1-29)-Ala-Ala-Lys-A(1-21) Thr-OMe и гидролизе полученного треонинового эфира при pH от примерно 8 до 12, как описано в примере 9. Выход составил 9,3 г.
Пример 26. A2l Glu, B28 Asp-человеческий инсулин был получен при транспептидации A21 Glu, B28 Asp, B(1-29)-Ala-Ala-Lys-A(1-21) Thr-OMe и гидролизе полученного треонинового эфира при pH от примерно 8 до 12, как описано в примере 9. Выход составил 3,4 г.
Пример 27. A21 Glu, B9 Asp-человеческий инсулин был получен при транспептидации A21 Glu, B9 Asp, B(1-29)-Ala-Ala-Lys-A(1-21) Thr-OMe и гидролизе полученного треонинового эфира при pH от примерно 8 до 12, как описано в примере 9. Выход 1,3 г.
Пример 28. B9 Asn-человеческий инсулин получали с помощью транспептидации B9 Asn, B(1-29)-Ala-Ala-Lys-A(1-21) человеческого инсулина Thr-Оме при 20oC и гидролиза полученного треонинового сложного эфира при pH примерно 8-12 и при температуре 26oC, как описано в примере 9. Выход был 3 г.
Пример 29. B10 Asp-человеческий инсулин получали с помощью транспептидации B10 Asp, B(1-29)-Ala-Ala-Lys-A(1-21) человеческого инсулина Thr-OMe при 18oC и гидролиза полученного сложного эфира треонина при pH примерно 8-12 и при температуре 10oC, как описано в примере 9. Выход был 43 г.
Пример 30. B16 Gln-человеческий инсулин был получен с помощью транспептидации B16 Gln, B(1-29)-Ala-Ala-Lys-A(1-21) человеческого инсулина Thr-OMe при 40oC и гидролиза полученного сложного эфира треонина при pH примерно 8-12 и при температуре 5oC, как описано в примере 9. Выход был 1 г.
Пример 31. B17 Ala-человеческий инсулин был получен с помощью транспептидации B17 Ala, B(1-29)-Ala-Ala-Lys-A(1-21) человеческого инсулина Thr-OMe при 5oC и гидролиза полученного сложного треонинового эфира при pH примерно 8-12, как описано в примере 9. Выход был 4 г.
Пример 32. B28 Asp-человеческий инсулин был получен с помощью транспептидации B28 Asp, B(1-29)-Ala-Ala-Lys-A(1-21) человеческого инсулина Thr-OMe при 15oC и гидролиза полученного сложного треонинового эфира при pH около 8-12, как описано в примере 9. Выход был 17 г.
Пример 33. B9 Glu, A21 Gly-человеческий инсулин был получен с помощью транспептидации B9 Glu, A21 Gly, B(1-29)-Ala-Ala-Lys-A(1-21) человеческого инсулина Thr-OMe при 12oC и гидролиза полученного сложного эфира треонина при pH около 8-12, как описано в примере 9. Выход был 4,6 г.
Пример 34. B16 Asp, A21 Gly-человеческий инсулин был получен с помощью транспептидации B16 Asp, A21 Gly, B(1-29)-Ala-Ala-Lys-A(1-21) человеческого инсулина Thr-OMe при 12oC и гидролиза полученного сложного эфира треонина при pH примерно 8-12, как описано в примере 9. Выход составил 0,2 г.
Пример 35. B9 Asp, B27 Glu, A21 Gly-человеческий инсулин был получен с помощью транспептидации B9 Asp, B27 Glu, A21 Gly, B(1-29)-Ala-Ala-Lys-A(1-21) человеческого инсулина Thr-OMe при 12oC и гидролиза полученного сложного эфира треонина при pH около 8-12 и при температуре 0oC в иных отношениях, как описано в примере 9. Выход был 1,3 г.
Пример 36. B9 Glu, B27 Glu, A21 Gly-человеческий инсулин был получен с помощью транспептидации B9 Glu, B27 Glu, A21 Gly, B(1-29)-Ala-Ala-Lys-A(1-21) человеческого инсулина Thr-OMe при 10oC и гидролиза полученного сложного эфира треонина при pH около 8-12, как описано в примере 9. Выход составил 2 г.
Пример 37. B9 Glu, B10 Glu, A21 Gly-человеческий инсулин был получен с помощью транспептидации B9 Glu, B10 Glu, A21 Gly, B(1-29)-Ala-Ala-Lys-A(1-21) человеческого инсулина Thr-OMe при 0oC и гидролиза полученного сложного эфира треонина при pH около 8-12, как описано в примере 9. Выход составил 2 г.
Пример 38. B2 Ser, B10 Glu, B27 Glu, A8 His, A21 Gly-человеческий инсулин был получен с помощью транспептидации B2 Ser, B10 Glu, B27 Glu, A8 His, A21 Gly, B(1-29)-Ala-Ala-Lys-A(1-21) человеческого инсулина Thr-OMe и гидролиза полученного сложного эфира треонина при pH около 8-12, как описано в примере 9. Выход составил 1,1 г.
Пример 39. B9 Gln-человеческий инсулин был получен с помощью транспептидации B9 Gln, B(1-29)-Ala-Ala-Lys-A(1-21) человеческого инсулина Thr-OMe при 40oC и гидролиза полученного сложного эфира треонина при pH около 8-12, как описано в примере 9. Выход составил 0,4 г.
Пример 40. B5 Tyr-человеческий инсулин был получен с помощью транспептидации B5 Tyr, B(1-29)-Ala-Ala-Lys-A(1-21) человеческого инсулина при pH около 8-12, как описано в примере 9. Выход составил 0,5 г.
Пример 41. B14 Ser, B17 Asp-человеческий инсулин был получен с помощью транспептидации B14 Ser, B17 Asp, B(1-29)-Ala-Ala-Lys-A(1-21) человеческого инсулина Thr-OMe при 17oC и гидролиза полученного сложного эфира треонина при pH около 8-12, как описано в примере 9. Выход составил 0,3 г.
Пример 42. B16 Glu, B27 Glu-человеческий инсулин был получен с помощью транспептидации B16 Glu, B27 Glu, B(1-29)-Ala-Ala-Lys-A(1-21) человеческого инсулина Thr-OMe и гидролиза полученного сложного эфира треонина при pH около 8-12, как описано в примере 9. Выход был 8 г.
Пример 43. B9 Glu, B10 Glu-человеческий инсулин был получен с помощью транспептидации B9 Glu, B10 Glu, B(1-29)-Ala-Ala-Lys-A(1-21) человеческого инсулина Thr-OMe и гидролиза полученного сложного эфира треонина при pH около 8-12, как описано в примере 9. Выход составил 20 г.
Пример 44. B10 Glu, des B30-человеческий инсулин получался с помощью превращения B10 Glu, B(1-29)-Ala-Ala-Lys-A(1-21) человеческого инсулина в B10 Glu, des B30-человеческий инсулин с помощью трипсина в водном растворе. Выход составил 5 г.
Пример 45. B1 Glu, B28 Glu-человеческий инсулин был получен с помощью транспептидации B1 Glu, B28 Glu, B(1-29)-Ala-Ala-Lys-A(1-21) человеческого инсулина Thr-OMe и гидролиза полученного сложного эфира треонина при pH около 8-12, как описано в примере 9. Выход составил 6,5 г.
Характеристика аналога человеческого инсулина согласно настоящему изобретению.
Определение молекулярной массы ( Gutfreund H, Biochemical Journal, 42 (544) 1948).
Методика: мембранный осмометр "Кнауэр", тип: 1,00; мембрана "Шляйхер энд Шолль", тип: R52.
Растворитель: 0,05 M NaCl pH 7,5, температура 21oC.
Результаты: все типы инсулина измерялись при концентрации 4 мг/мл.
Тип инсулина - Молекулярная масса, кДа
Человеческий 2Zn-инсулин - 36±2
Человеческий бесцинковый инсулин - 29±1
Бесцинковый B27 Glu-человеческий инсулин - 22±1
Бесцинковый B12 Ile-человеческий инсулин - 17±1
Бесцинковый B27 Glu, B21 Asp-человеческий инсулин - 8±1
Бесцинковый B9 Asp, B27 Glu-человеческий инсулин - 6±1
Бесцинковый B9 Asp-человеческий инсулин - 6±1
Бесцинковый B9 Asp, B27 Glu, A21 Asp-человеческий инсулин - 6±1
Бесцинковый B9 Asp, B27 Glu, A8 His-человеческий инсулин - 9±1
Бесцинковый B10 Asp-человеческий инсулин - 12±1
Бесцинковый B28 Asp-человеческий инсулин - 9±2
Как видно из приведенных выше данных аналоги человеческого инсулина имеют значительно меньшую молекулярную массу, чем человеческий инсулин, что приводит к снижению самоассоциирования в димеры, тетрамеры и гексамеры или в некоторых случаях к его отсутствию.
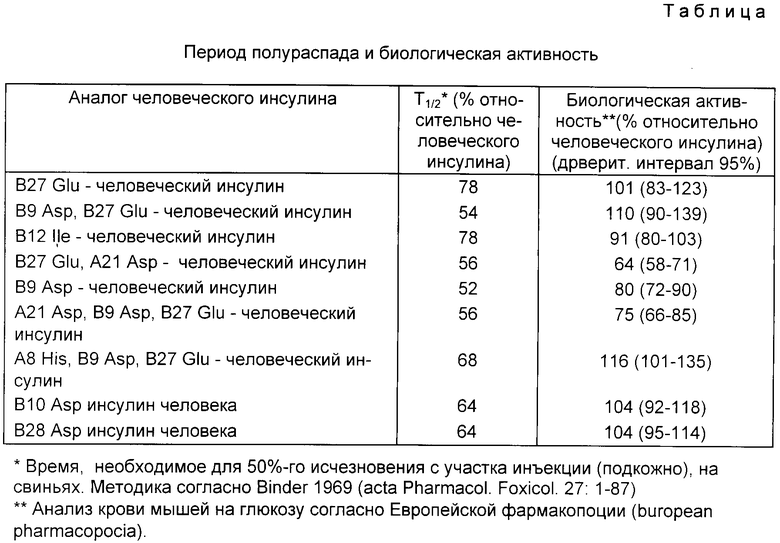
Как следует из приведенной ниже таблицы, время для 50%-го исчезновения аналогов инсулина с участка инъекции существенно снижается по сравнению с человеческим инсулином.
Биологическая сила действия аналогов инсулина сравнима с аналогичным показателем для человеческого инсулина или не намного меньше.
| название | год | авторы | номер документа |
|---|---|---|---|
| ПРОИЗВОДНОЕ ИНСУЛИНА, РАСТВОРИМАЯ ПРОЛОНГИРОВАННАЯ ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, СПОСОБ ПРОЛОНГИРОВАНИЯ ГИПОГЛИКЕМИЧЕСКОГО ДЕЙСТВИЯ ПРИ ЛЕЧЕНИИ ДИАБЕТА | 1994 |
|
RU2164520C2 |
| АНАЛОГ ИНСУЛИНА, ОБЛАДАЮЩИЙ АКТИВНОСТЬЮ СНИЖЕНИЯ УРОВНЯ ГЛЮКОЗЫ В КРОВИ | 1991 |
|
RU2109749C1 |
| СПОСОБ ПРОДУЦИРОВАНИЯ ПОЛИПЕПТИДА В ДРОЖЖАХ | 1995 |
|
RU2167939C2 |
| СПОСОБ ПОЛУЧЕНИЯ ГЕТЕРОЛОГИЧНОГО ПОЛИПЕПТИДА В ДРОЖЖАХ Saccharomyces cerevisiae | 1990 |
|
RU2194758C2 |
| ПРЕДШЕСТВЕННИК ИНСУЛИНА, СПОСОБ ЕГО ПОЛУЧЕНИЯ И ПРИМЕНЕНИЕ | 2000 |
|
RU2283846C2 |
| АНАЛОГИ ИНСУЛИНА, УСТОЙЧИВЫЕ К ПРОТЕАЗАМ | 2007 |
|
RU2524150C2 |
| ТОЛЕРОГЕННАЯ ДНК-ВАКЦИНА | 2017 |
|
RU2752608C2 |
| ОЧИСТКА ИНСУЛИНА | 2012 |
|
RU2603752C2 |
| СПОСОБ ПОЛУЧЕНИЯ ИНСУЛИНОВЫХ СОЕДИНЕНИЙ | 2002 |
|
RU2376379C2 |
| ЛИПОФИЛЬНЫЕ ПРОИЗВОДНЫЕ ПЕПТИДНЫХ ГОРМОНОВ | 1996 |
|
RU2171261C2 |



Использование: биотехнология, генная инженерия, медицина. Сущность изобретения: аналоги человеческого инсулина с замещениями одного или более аминокислотных остатков в А- и В-цепях инсулина человека на более гидрофильние аминокислотные остатки получают путем трансформации штамма дрожжей плазмидой, содержащей ДНК-последовательность, кодирующую предшественник аналога инсулина. Полученный предшественник превращают в аналоги с помощью реакции со сложным эфиром L-треонина в органическом растворе в присутствии трипсина. Предпочтительными аминокислотными замещениями являются Asp, Glu, Ser, Thr, His и Ile. 3 с.п. ф-лы, 11 ил., 1 табл.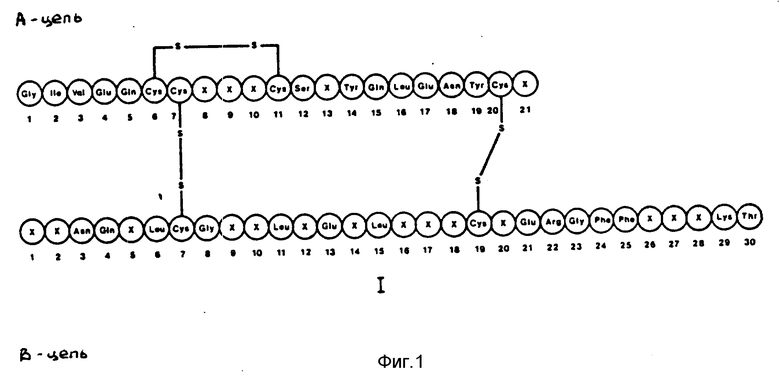
где X аминокислотный остаток инсулина человека или замещение, которое в положении A8 может быть His, Glu или Asp, в положении A1 3 Ser, Glu или Asp, в положении A2 1 Asp, Glu, Ser, Thr или Gly, в положении B1 Glu или Asp, в положении B2 Glu, Asp или Ser, в положении B5 Glu, Asp, Ser или Tyr, в положении B9 Asp, Glu, Gln или Asn, в положении B1 0 Glu, Asp или Thr, в положении B1 2 Ile или Tyr, в положении B1 4 - Glu, Asp или Ser, в положении B1 6 Asp, Gln, Glu или His, в положении B1 7 Gln, Glu, Asp или Ala, в положении B2 0 Gln, Asp или Glu, в положении B2 6 Glu или Asp, в положении B2 7 Glu, Asp или Arg и в положении B2 8 Asp или Glu; A1-O или Gly, и/или A2 1-O или X, и/или B1-O или X, и/или B1-O или X, и/или B3 0-O или Thr, при условии замещения не менее одного аминокислотного остатка в B-цепи и не более 7 от общего числа замещений в B- и A-цепях,
обладающие мол.м. примерно 6000 кД и активностью, по существу, сходной с активностью инсулина человека.
где X имеет указанное значение;
Qn пептидная цепь с числом n природных аминокислотных остатков;
R Lys или Arg;
n 0 33, целое число;
m 0 или 1,
клетки культивируют в подходящей питательной среде, предшественник выделяют из супернатанта культуральной среды и превращают в аналоги инсулина человека с помощью реакции со сложным эфиром L-треонина или его солью в органическом растворе при 12oС в присутствии трипсина или его производных, полученный сложный треониновый эфир инсулина человека гидролизуют в кислотных или основных условиях при комнатной температуре и выделяют целевой продукт.
| Hoppe-Seyler's | |||
| L | |||
| Physiol | |||
| Chem., 360, 1619 - 1632 (1979). |
Авторы
Даты
1998-02-10—Публикация
1986-08-29—Подача