Настоящее изобретение относится к фармацевтическим средствам. Более конкретно, оно относится к фармацевтической композици, содержащей в частности физическую форму производного гетероциклического амида, способам получения этой физической формы и к другим физическим формам гетероциклического амида, используемым при получении первой упомянутой физической формы.
В публикации Европейской патентной заявки ЕП-А2-0199543 раскрываются некоторые производные гетероциклического амида, которые противодействуют фармакологическому действию, являются антагонистами одного или более метаболитов арахидоновой кислоты, известных под названием лейкотриены, например C4, D4, и/или E4, которые, как известно, должны быть сильными спазмогенами (в частности легких), увеличивая сосудистую проницаемость и вовлекая в патогенез астмы и воспаления (см. J.L.Marx, Scince 1982, 215, 1380 - 1383), так же как и эндотоксического шока (см. J.A.Cook, и др. Pharmacol. Exp. The2. 1985, 230, 330). Таким образом эти соединения полезны при лечении заболеваний, в которых замешаны лейкотриены и антагонизм действия по отношению к которым полезен. Эти заболевания включают, например, аллергические легочные расстройства, такие как астма, сенная лихорадка и аллергические рениты и некоторые воспалительные заболевания, такие как бронхиты, эктопические и атопические экземы, псориазы, так же как вазоспастическое кардиоваскулярное заболевание и эндотоксичные и травматические шоковые условия.
Одним из производных гетероциклического амида, раскрытого в EP-A2-0199543 является N-[4-[5-(циклопентилоксикарбонил)амино-1-метилиндол-3-ил-метил]-3- метоксибензоил]-2-метилбензолсульфонамид. Это соединение описано в примере 105 патентной спецификации и будет обозначаться здесь и далее, как соединение 1.
Недавно при клинических испытаниях было установлено, что соединение 1 эффективно при лечении астмы при оральном введении препарата. Эта способность соединения 1 проявлять эффективное действие при оральном введении очень желательна.
Фармацевтическая композиция, использованная в вышеупомянутом клиническом испытании не полностью удовлетворила, и необходимо было думать об улучшенном составе.
Обнаружено, что соединение 1 обладает относительно слабой растворимостью в воде. Имеется потребность в фармацевтической композиции, подходящей для орального приема, которая бы включала соединение 1 в твердом состоянии.
Было обнаружено, что соединение 1 может быть получено в твердом состоянии как материал, имеющий диапазон различных физических свойств, зависящих от способа его выделения и последующей обработки. Было установлено, что эта способность обусловлена тем фактом, что соединение 1 может существовать в более чем одной физической форме, по крайней мере одна из которых физически нестабильна, и физические формы этого соединения 1 могут быть получены в смеси. Было также установлено, что различные образцы соединения 1 в твердом состоянии обладают различной биопригодностью.
Нежелательно разрабатывать препарат, содержащий смесь физических форм соединения, обладающих различной биопригодностью, особенно когда одна из форм, входящих в смесь, физически нестабильна, поскольку в этом случае нельзя точно контролировать эффективную дозу соединения. Следовательно, возникла необходимость в поиске методов для получения физических форм соединения 1 преимущественно свободных от других физических форм.
Методы получения трех физических форм соединения 1 преимущественно свободных от других физических форм были обнаружены, физическая стабильность и биопригодность этих трех форм была исследована. Две из этих форм, обозначаемые здесь и далее как формы B и X, как установлено, физически стабильны, но не очень биопригодны. Третья из этих форм, обозначенная здесь и далее как форма A, обладает вполне приемлемой биопригодностью. Однако было обнаружено, что эта форма имеет тенденцию превращаться в присутствии воды в форму B. Это свойство является недостатком для материала, который собираются вводить в твердую композицию, поскольку на стадии грануляции предусмотрено использование воды как адьюванта в процессе смешения. Таблетки, использованные в вышеупомянутом клиническом испытании, были получены способом влажной грануляции из формы A, и было установлено, что форма B содержится в препарате в количестве, варьирующемся от примерно 25 до примерно 30% по массе соединения 1.
Таким образом, существует необходимость в фармацевтической композиции, подходящей для орального введения которая бы включала соединение 1 в одной физической форме, преимущественно свободной от других физических форм, композиции, которая была бы физически стабильна, могла бы быть воспроизводимой и обладать хорошей биопригодностью.
Удивительно, но было установлено, что фармацевтические составы, удовлетворяющие этим требованиям, могут быть получены путем выбора в качестве активного ингредиента формы A и поливинилпирролидона - в качестве со-ингредиента.
Итак, настоящее изобретение обеспечивает фармацевтическую композицию, которая включает в качестве активного ингредиента физическую форму N-[4-[5-(циклопентилоксикарбонил)амино)-1-метилиндол-3-ил-метил]-3- метоксибензоил] -2-метилбензолсульфонамид (обозначенную здесь ранее как форма A), преимущественно свободную от других физических форм, эта физическая форма имеет следующие параметры ИК-спектра (0,5 % КВ): четкие полосы поглощения при 1690, 1530, 1490, 1420, 1155, 1060, 862 и 550 см-1, а также включает поливинилпирролидон.
На дифракционной рентгеновской диаграмме порошка формы A отсутствуют различимые пики, что свидетельствует о его аморфности.
Установлено, что композиции соответствующие данному изобретению обладают приемлемой физической стабильностью и могут быть приготовлены с воспроизводимыми характеристиками, а также обладают удивительно высокой биопригодностью.
Когда речь идет в данной спецификации о том, что форма A преимущественно свободна от других физических форм, то это предпочтительно означает, что по крайней мере 90 % массы соединения 1 присутствует в этой физической форме, более предпочтительно, когда в этой физической форме присутствует по крайней мере 95 %, например по крайней мере 96, 97 или 99 %.
Композиция, соответствующая данному изобретению, может находиться в любой стандартной форме, подходящей для перорального приема, например, в виде таблеток, капсул, гранул или порошка. Предпочтительно, когда она выпускается в форме таблеток.
В композиции, соответствующей данному изобретению, активный ингредиент обычно присутствует в количестве от 1 до 90 % по массе в расчете на общую массу композиции, например от 10 до 50 %.
Количество поливинилпирролидона составляет по крайней мере 1 % в расчете на общую массу композиции. Он может вместе с активным ингредиентом составлять всю массу композиции, однако, как правило, более характерно, когда композиция включает, кроме того, по крайней мере один фармацевтически приемлемый носитель. Например, поливинилпирролидон может присутствовать в количестве от 1 до 20 % от массы общей композиции, предпочтительно от 2 до 6 % по массе.
Примеры подходящих фармацевтически приемлемых носителей включают, например, производные сахаров, такие как манитол, лактоза, сорбитол, глюкоза, сахароза, декстроза, фруктоза, ксилитол, а также производные целлюлозы, такие как микрокристаллическая целлюлоза, порошкообразная целлюлоза, гидроксипропилметилцеллюлоза. Предпочтительно, когда композиция включает производное сахара, особенно лактозу, и производное целлюлозы, особенно микрокристаллическую целлюлозу. Количество производного сахара, присутствующего в композиции, может составлять, например, от 10 до 30 % от массы композиции. Количество производного целлюлозы, например, может варьироваться от 25 до 75 % от массы композиции.
Далее композиция может включать одну или более добавок, способствующих процессу приготовления препарата, таких как дезинтеграторы, например натрий кроскармелоза. крахмал и натрия гликолят крахмала, а также лабриканты, например стеарат магния, стеариновую кислоту, тальк, порошкообразный растительный стеарин. Дезинтегратор, может присутствовать, например, в количестве от 1 до 10 % по массе от массы композиции. Количество лабриканта может, например, варьироваться от 0,25 до 2 % от массы композиции.
Композиция может быть приготовлена при смешении ингредиентов согласно традиционно существующим способам, например, в процессе грануляции.
Соответственно, еще одной целью настоящего изобретения является создание способа приготовления фармацевтической композиции, которая включает смешение формы A, преимущественно свободной от других физических форм, с поливинилпирролидоном и водой и высушивание полученной смеси.
Количество использованной воды зависит от типа фармацевтической композиции, которую необходимо получить (например, таблетки, капсулы, порошок или гранулы) и природы других ингредиентов, которые включают в состав композиции. Традиционно использование такого количества воды, когда весовое отношение воды в форме A находится в интервале от 0,1 до 100:1.
Когда композиция изготовлена в виде таблеток, то вес таблетки может варьироваться от 25 до 500 мг, например, от 25 до 250 мг или, например, от 100 до 200 мг. Таблетки могут быть с покрытием или без покрытия. Таблетки могут иметь покрытие из стандартного материала, который может наноситься стандартным способом.
Еще одна цель настоящего изобретения состоит в обеспечении способов получения формы A преимущественно свободной от других физических форм соединения 1.
Итак, настоящее изобретение обеспечивает способ получения формы A, преимущественно свободной от других физических форм, который включает нагревание другой физической фирмы N-[4-[5-(циклопентилоксикарбонил)-амино-1-метилиндол- -3-ил-метил] -3-метоксибеноил]-2-метилбензолсульфонамида, обозначенного ранее как форма B, преимущественно свободной от других кристаллических форм, физическая форма которого представляет моногидрат N-[4-[5-(циклопентилоксикарбонил)-амино-1-метилиндол-3-ил-метил]- -3-метоксибензоил] -2-метилбензолсульфонамид, являющийся кристаллическим образованием, и имеет следующие параметры ИК-спектра (0,5% в KBr): четкие поглощения при 3560, 1690, 1660, 1540, 1440, 1165, 880 и 858 см-1, а рентгенограмма порошка имеет пики при угле 2θ = 10,0; 11,2; 14,6; 19,8 и 23,0o в температурном интервале от 90 до 125oC при пониженном давлении.
Дегидратирование формулы B предпочтительно проводить в температурном интервале от 115 до 122oC.
Давление в процессе дегидратации формы B предпочтительно не должно превышать 100 мбар (10 кПа), более предпочтительно должно превышать 50 мбар (5 кПа). Например, давление может изменяться в пределах от 0,5 до 5 кПа.
Форма B может быть получена преимущественно свободной от других кристаллических форм путем перекристаллизации из неводного ацетона. В частности, она может быть получена путем растворения источника соединения 1 в водном ацетоне при повышении температурах, с последующим давлением воды и выдержкой полученной смеси до охлаждения. Предпочтительно, когда воду добавляют быстро, так, чтобы соединение 1 в начале выделилось в виде масла. Полученный таким образом материал соответствует форме A в состоянии высокой степени морфологической чистоты.
Кристаллический продукт может быть высушен при повышенной температуре, например при 60oC или ниже. Если необходимо начинать работу с источником соединения 1, содержащим примеси, то было найдено, что лучше вначале этот исходный источник, содержащий примеси, растереть с горячей смесью толуола и этилацетата.
Следует учесть, что если форму B сушили при высокой температуре, например выше 60oC, то могло произойти частичное превращение формы B в форму A. Материал, полученный при сушке формы при температуре ниже или примерно равной 60oC преимущественно свободен от других физических форм, характерных для соединения 1.
Полагают, что форма B - этот неизвестная ранее форма соединения 1. Изобретение обеспечивает таким образом форму B, преимущественно свободную от других кристаллических форм.
Изобретение также обеспечивает другой способ получения формы, преимущественно свободной от других физических фирм соединения 1, который включает быстрое выпаривание растворителя из раствора соединения 1. Например, она может быть получена путем сушки распылением раствора соединения 1.
Растворителем может служить любое жидкое вещество, способное растворять соединение 1 и кипеть при температуре ниже точки плавления формы A соединения 1. К таким растворителям относятся, например, кетоны, такие как ацетон, и нитрилы, такие как ацетонитрил, возможно в смеси с водой. Было найдено, что конкретно водный раствор ацетона является подходящим растворителем.
Температура испарения растворителя должна быть ниже точки плавления формы A. Как правило, она ниже 125oC, предпочтительно, когда температура ниже 120oC. Было установлено, что в тех случаях, когда в качестве растворителя используется ацетон, значительное количество кристаллического материала получается тогда, когда температура ниже 100oC. Следовательно, температура испарения растворителя может быть в интервале от 100 до 125oC.
Раствор соединения 1, как правило, получают путем растворения кристаллической фирмы соединения 1, такой как форма B, в растворителе. Раствор, полученный таким путем должен содержать минимальное количество нелетучих примесей.
Из вышеуказанного следует учесть, что водный ацетон является, в частности, предпочтительным растворителем для использования при получения формы A, преимущественно свободной от других физических форм соединения 1. Также было установлено, что содержание органического растворителя в форме, полученной из формы B с использованием такого раствора, очень мало. Итак, кроме всего, настоящее изобретение обеспечивает раствор соединения 1 в водном ацетоне. Этот раствор может содержать, например, от 5 до 15% соединения 1, предпочтительно от 6 до 13%. Растворитель может содержать, например, от 3 до 9% воды, предпочтительно от 4 до 8%.
Преимущество таких композиций, соответствующих настоящему изобретению, может быть проиллюстрировано путем сопоставления их свойств со свойствами композиций, в которых форма A замещена на форму B или форму X и с композицией, содержащей форму A, но не содержащей поливинилпирролидона.
Форма X представляет физическую форму соединения 1, это кристаллическая форма, рентгенограмма порошка этой формы имеет характерные пики при угле 2θ = 8,1; 13,7; 16,4; 20,5 и 23,7; и ИК-спектр этой формы X имеет следующие параметры (0,5% в KBr): четкие полосы поглощения при 3370, 1670, 1525, 1490, 1280, 890, 870 и 550 см-1.
Форма X может быть получена преимущественно свободной от других физических форм следующим путем растворения источника, содержащего соединение 1 в горячем водном ацетоне, упаривание полученного раствора, прибавление толуола к оставшемуся объему и затем вновь упаривание раствора. Если в качестве источника соединения 1 используется материал, содержащий примеси, то лучше такой материал вначале растереть с горячей смесью толуола и этилацетата до проведения стадии кристаллизации.
Каждая из этих трех форм A, B и X может быть характеризована стандартными методами, например, путем получения рентгенограмм порошков каждой из форм или путем снятия ИК-спектров.
В данной спецификации для получения ИК-спектров были получены таблетки, содержащие 0,5% исследуемого материала в бромиде калия, спектр снимали в диапазоне длин волн от 4000 до 400 см-1.
Для получения рентгенограммы были использованы образцы, масса которых равнялась 2 г, эти образцы помещали в стандартный, глубоко расположенный держатель установки марки Phillips, измерения проводили в области сканирования 4-40o 2θ , считая 4 на точку с интервалом 0,02o, в результате получили запись зависимости интенсивности от расстояния для этой области.
Температура плавления (точки плавления) каждой из форм A, B и X зависит от степени их чистоты. Как правило, точка плавления формы X лежит выше 190oC, например примерно при 200oC, точка плавления формы A плавает в пределах от 115 до 140oC, например примерно от 124 до 132oC; и температура плавления формы B варьируется в пределах от примерно 140 до 160oC, например от 145 до 155oC. Было обнаружено, что форма B теряет воду при температуре выше примерно 60oC и поэтому не имеет резко выраженной температуры плавления, а плавится в интервале температур.
Как утверждалось здесь ранее, форма A обладает приемной стабильностью в композициях, соответствующих данному изобретению. Однако в условиях высокой влажности и при повышенных температурах, как было обнаружено, форма A может переходить в форму B. Соответственно, в определенных условиях желательно хранить фармацевтические составы, содержащие форму A, в присутствии подходящего осушителя, такого как силикагель. Также желательно хранить эти композиции в герметичных упаковках (контейнерах), таких как блистерная упаковка.
Доза соединения 1, назначаемая больному, в композиции, соответствующей настоящему изобретению, зависит от тяжести заболевания, возраста и веса больного. Как правило, соединение следует назначать в дозе, величина которой варьируется в пределах от 0,1 до 10 мг/кг, например от 0,2 до 5 мг/кг.
Исследования по определению острой токсичности были проведены на соединении 1 с целью установления величины LD50. Например, для крыс и мышей было установлено, что значения LD50 для соединения 1 превышает 500 мг/кг.
Приведенные ниже примеры иллюстрируют данное изобретение, не ограничивая его рамки.
Пример 1
Получение формы A
a. Получение источника соединения 1, содержащего примеси.
Метил 3-метокси-4-(1-метил-5-нитроиндол-3-ил-метил)-бензоат, полученный как описано в примере 4 УП-А2-0199543, был превращен в свободную кислоту путем обработки водным раствором гидроксида натрия. Свободную кислоту затем обработали в дихлорметане тионилхлоридом и получали хлорангидрид кислоты. Полученный хлорангидрид кислоты затем запустили в реакцию с о-толуолсульфонамидом в дихлорметане в присутствии 2,2 эквивалента 4-диметиламинопиридина для того, чтобы получить соль диметиламинопиридина и 4-(1-метил-5-нитроиндол-3-ил-метил)- -3-метоксибензоил-2-метилбензолсульфонамида.
Раствор диметиламинопиридиниевой соли 4-(1-метил-5-нитроиндол-3-ил-метил)-3-метоксибензоил-2- -метилбензолсульфонамида (30 г) в 2-метоксиэтаноле (130 мл) и концентрированный раствор гидроксида натрия (3,2 мл) загрузили в колбу, через которую продувается азот, содержащую 10% палладия на активированном угле (3,3 г 60,9% водой увлажненной пасты). Смесь затем перемешивали в атмосфере водорода под давлением 3 бар (3 00 кПа) в течение 2,5 ч. Смесь затем отфильтровали через диатомовую землю и промыли 2-метоксиэтанолом (37,5 мл). К объединенным растворам добавили циклопентилхлорформиат (9,2 мл) и смесь оставили перемешиваться в токе азота на ночь. Затем установили температуру 30-33oC, в течение 20 мин при энергичном перемешивании добавили 68 мл 0,8 M раствора хлористоводородной кислоты. Затем смесь охладили до 15 - 20oC и перемешивали еще час. Сырой кристаллический продукт отфильтровывали, промыли водой и высушили при 50oC. Он был затем использован в следующей стадии.
b. Растирание загрязненного соединения 1
60 г (0,101 г-моля) продукта стадии a) 240 мл толуола (4 объема) и 150 мл этилацетата (2,5 объема) медленно нагрели до кипения и отогнали 30 мл (0,5 объема) дистиллята, удалив при этом большую часть освободившейся воды. Смесь нагревали в колбе с обратным холодильником в течение одного часа (88-90oC) и затем охладили до 10-15oC. После перемешивания в течение 3 ч при 10-15oC отфильтровали твердый остаток через стеклянный спекшийся материал и промыли смесью 2: 1 толуола (80 мл) и этилацетата (40 мл). Продукт затем высушивали до постоянного веса на фильтре, получив в результате 53,2 г сухого соединения 1 (выход 91,5%).
c. Получение формы B
30 г продукта стадии b) 210 мл ацетона и 12 мл воды загрузили в 500 мл реакционную колбу. Смесь затем нагревали с обратным холодильником в течение 15 мин и затем пропустили через слой диатомовой земли на стеклянном спекшемся материале при 45-50oC непосредственно в 500 мл реакционной колбе. Колбу и спекшийся материал промыли смесью ацетона (60 мл) и воды (3 мл). Объединенные растворы затем перемешивали на водяной бане примерно при 40oC и затем в течение 5 мин добавили 120 мл воды. Сначала смесь выделилась в виде масла, но затем быстро закристаллизовалась. Смесь затем охладили до 20oC в течение 1 ч, затем перемешивали при 15-20oC в течение 2 ч и затем отфильтровали. Продукт промыли водой (60 мл) высушили как можно быстрее на стеклянном спекшемся материале, а затем подсушили в воздушной печи при температуре 60oC (макс.) Выход составил формы B 30,0 г (97%).
d. Получение формы A
15,0 г продукта стадии c) поместили в круглодонную колбу объемом 500 мл, которую затем откачали на роторном испарителе при давлении 20 мбар (20,0 Па). Затем колбу с содержимым погрузили в масляную баню, предварительно нагретую до 118oC и медленно вращали при этой температуре в течение 6 ч. Содержимое выгрузили при охлаждении и получили в результате порошок белого цвета.
В промышленных масштабах форма A может быть получена следующим образом.
30 кг продукта, полученного на стадии c) распылили равномерно на металлический поддон и нагрели при 120oC в вакуумной печи площадью 7 м2, вакуумный нагрев длился в течение 24 ч. Характерное давление было равно примерно 20 мбар (2,0 кПа). При охлаждении (до 40oC или ниже) материал выгрузили из печи и после помола получили требующуюся форму A.
В случае необходимости форма A до употребления может быть микронизирована.
Получение формы X
30,0 г продукта стадии b) (0,0521 моля) растворили в ацетоне (150 мл) и воде (4,7 мл) при умеренном нагревании до кипения, раствор отфильтровали через воронку с фильтром из спекшегося стекла. Фильтрат нагрели до температуры кипения и отобрали 90 мл дистиллята. Добавили 120 мл толуола и далее отобрали 75 мл дистиллята. Добавили еще 120 мл толуола и отобрали еще 75 мл дистиллята. После нагревания еще в течение часа с обратным холодильником смесь охладили до 15-20oC, продукт собрали и промыли толуолом (2•30 мл). Выход после сушки на фильтре воронки составил 29,5 г (98,3%).
Пример 2
Альтернативный вариант получения формы A
Раствор N-[4-[5-(циклопентилоксикарбонил)амино-1-метилиндол-3-ил-метил] -3- метоксибензоил]-2-метилбензол-сульфонамида сульфонамида в водном ацетоне высушивают путем распыления, используя для этого распыляющую сушилку Niro Laboratory Minor (полученную из AlS Niro Atomizer, Gladsaxevej 305, ДК-2860 Soeborg. Denmark). Раствор атомизировали со скоростью 2 кг/ч током со скоростью потока 6,6 кг/ч, используя двухсопловый жидкостный атомизатор. В качестве осушающего газа использовали азот со скоростью потока 70 кг/ч и температура на входе и выходе составляла соответственно 215 и 120oC. Полученную форму A собрали на бумажном фильтре.
Пример 3
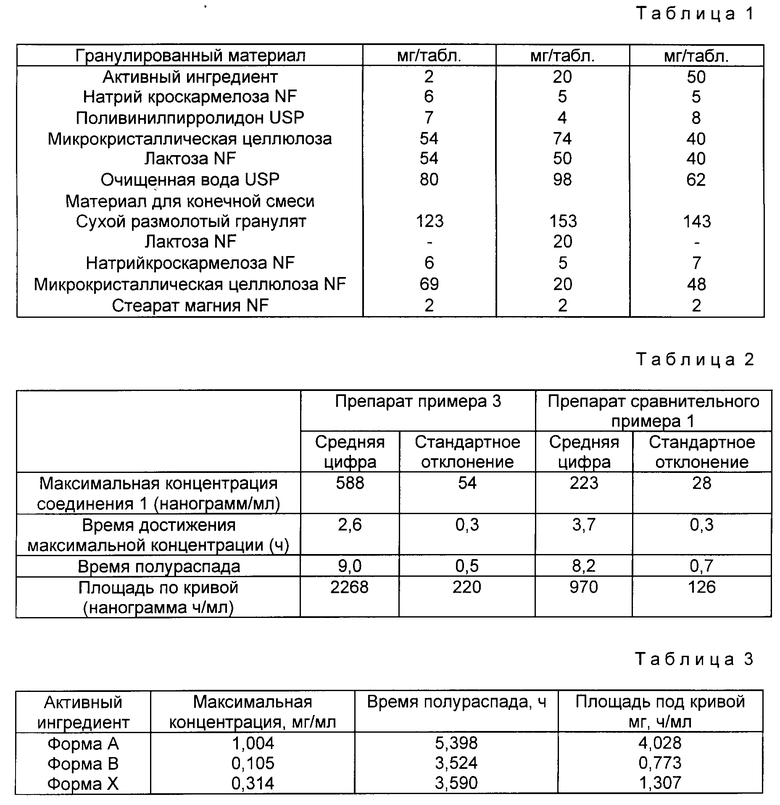
Состав таблетки с формой A приведены в табл. 1.
Ингредиенты гранулируемого материала были подвергнуты влажной грануляции. Гранулы затем были высушены и смолоты. Сухой молотый гранулят был затем смешан с другими ингредиентами, входящими в состав конечной смеси спрессован в таблетки.
Весовой процент присутствующий в таблетках формы B определяли методом рентгеноструктурного анализа. В таблетке массой 20 мг содержание формы B составило менее 8% общего количества соединения 1. В случае 50 мг таблеток были использованы более чувствительные методы рентгеноструктурного анализа. Содержание формы B до таблетирование было 3%, а после получения таблеток было 3,2%.
Примечание. В каждом из этих примеров использованный поливинилпирролидон имел значение K 29-32. Полагают, что поливинилпирролидон любой фармацевтической степени, например, имеющий значения в интервале от 10 до 100, пригоден для применения.
Пример 4
Определение кратковременной стабильности
Таблетки, приготовленные согласно способу, описанному в примере 3 и содержащие 20 мг формы A хранили в различных условиях в течение 1, 2 и 3 месяцев. Таблетки затем были исследованы методом рентгеноструктурного анализа (рентгеновская дифракция) для определения количества активного ингредиента, превратившегося в форму В. Полученные результаты суммированы и представлены ниже.
Определение стабильности таблетированных составов, содержащих форму A
Условия хранения - % превращения в форму B
Начало - не определим
1 месяц, темп. комнатная - -"-
2 месяца, темп. комнатная - -"-
3 месяца, темп. комнатная - -"-
3 месяца, 50oC - не определены
1 месяц, 40oC, 80% влажности - 87
2 месяца, 40oC, 80% влажности - 91
3 месяца, 40oC, 80% - 82
Таблетки, которые хранились при комнатной температуре и 50oC были во флаконах из полиэтилена высокой плотности белого цвета, закупоренных металлическими колпачками.
Таблетки, хранившиеся при 80% влажности, были экспонированы на воздухе.
Сравнительный пример 1
Таблетированные составы формы A, не содержащие поливинилпирролидона
Гранулированный материал - мг/таблетка
Активный ингредиент - 50,0
Прожелатинизированный крахмал NF - 20,0
Лактоза NF - 34, 55
Натриевый гликолят крахмала NF - 2,0
Микрокристаллическая целлюлоза NF - 34,95
Натрий лаурилсульфат NF - 0,5
Очищенная вода USP - 100,0
Материал для конечной смеси
Сухой размолотый гранулят - 142,0
Натриевый гликолят крахмала NF - 6,0
Микрокристаллическая целлюлоза NF - 50,0
Стеарат магния NF - 2,0
Ингредиенты гранулируемого материала были подвергнуты влажной грануляции. Затем гранулы были высушены и размолоты. Сухой размолотый гранулят затем смешали с другими ингредиентами материала для конечной смеси и полученную смесь спрессовали в таблетки.
Процентное содержание соединения 1, присутствующего в форме B, определили методом рентгеноструктурного анализа до грануляции и после грануляции. Было установлено, что до грануляции в смеси присутствует 1,5% формы B. Однако после грануляции 28% соединения 1 в смеси присутствует в форме B.
Эти результаты четко свидетельствуют о повышенной стабильности формы в композициях, соответствующих настоящему изобретению.
Пример 5
Содержимое капсулы - мг/капсула
Активный ингредиент - 20
Поливинилпирролидон - 20
Лактоза - 177,25
Микрокристаллическая целлюлоза - 177,25
Коллоидальный диоксид кремния - 0,5
Стеарат магния - 5,0
Капсула желатиновая, N0
Смешивают активный ингредиент, поливинилпирролидон, лактозу и микрокристаллическую целлюлозу в подходящем смесителе, смешивают с очищенной водой до пригодной консистенции, сушат, доводят до требуемого размера, используя для этих целей подходящую операцию размола. Смешивают с коллоидальным диоксидом кремния и стеаратом магния. Помещают в капсулы N 0, состоящие из двух частей.
Гранулы (сферические) - мг/капсула
Активный ингредиент - 10
Сахар (сферической формы) - 200
Поливинилпирролидон - 10
Готовят 10%-ную дисперсию поливинилпирролидона в очищенной воде. Добавляют активный ингредиент и перемешивают до образования однородной дисперсии, напыляют на сферические частицы сахара, используя для этих целей подходящее оборудование. Гранулы могут быть помещены в капсулы размером 1, состоящие из двух частей, или распределены по подходящим саше.
Состав порошка - мг/порошок
Активный ингредиент - 20
Поливинилпирролидон - 15
Маннитол - 364,6
Отдушка - 0,4
Смешивают активный ингредиент, поливинилпирролидон и маннитол в подходящем миксере. Смешивают до достижения подходящей консистенции с очищенной водой, сушат и пропускают через подходящую операцию измельчения.
Сравнительный пример 2
Сравнение биопригодности соединения 1 в композициях, приготовленных с использованием формы A с и без поливинилпирролидона.
Была сделана выборка из 24 здоровых мужчин-добровольцев, распределенных для лечения по группам. В соответствии с одним курсом лечения использовалась одна таблетка 50 мг, приготовленная в соответствии с описанием, приведенным в примере 3, а с другим - одна таблетка, приготовленная в соответствии с прописью сравнительного примера 1. В течение курса изучения препарата каждый доброволец получал оба препарата. В процессе каждого периода лечения периодически брались образцы крови на анализ и определялось содержание соединения 1.
Результаты приведены в табл. 2.
Эти результаты четко свидетельствуют об улучшенной биопригодности соединения 1, соответствующего настоящему изобретению.
Сравнительный пример 3
Сравнение биопригодности соединения 1 в композициях, приготовленных с поливинилпирролидоном и формации A, B и X.
Таблетки, содержащие 20 мг формы A, формы B или формы C, были получены в соответствии со следующей рецептурой.
Гранулированный материал - мг/таблетка
Активный ингредиент - 20
Натрий кроскармелоза NF - 6
Поливинилпирролидон USP - 7
Микрокристаллическая целлюлоза NF - 45
Лактоза NF - 45
Материал для конечной смеси
Натрий кроскармелоза NF - 6
Микрокристаллическая целлюлоза NF - 69
Стеарат магния NF - 2
Используя сбалансированную переходную схему, каждая из восьми собак получала каждую из трех таблетированных форм. В течение каждого периода исследования у каждого животного брались образцы крови на анализ и определяли концентрацию соединения 1.
Результаты приведены в табл. 3.
Эти результаты четко демонстрируют превосходную биопригодность композиций, соответствующих данному изобретению, в сравнении с композициями, содержащими форму B или форму X.
Изобретение относится к фармкомпозиции, содержащей N-[4-[5 (циклопентилоксикарбонил)амино 1-метилиндол-3 ил-метил] 3-метоксибензоил] 2-метилбензолсульфонамид, поливинилпирролидон и носитель при определенном весовом соотношении, способу ее получения путем смешивания и высушивания ингредиентов, физической форме действующего средства, характеризующейся максимумами поглощения при 1690, 1530, 1490, 1420, 1155, 1060, 862 и 550 см- 1, а также к способам ее получения. Композиция является антагонистом лейкотриенов, стабильна и обладает высокой фармактивностью. 5 с. и 6 з.п.ф-лы, 3 табл.
| EP, патент, 199543, C 07 D 299/18, 29.10.86. |
Авторы
Даты
1998-03-10—Публикация
1991-12-11—Подача