Предметом настоящего изобретения являются производные хиназолина или их фармацевтически приемлемые соли, которые обладают противораковым действием и являются полезными для лечения людей или животных. Настоящее изобретение также относится к способам получения указанных производных хиназолина, содержащим их фармацевтическим составам и к их использованию при изготовлении лекарственных препаратов, предназначенных для лечения раковых заболеваний у теплокровных животных, таких как человек.
Многие применяемые в настоящее время схемы лечения рака включают использование соединений, ингибирующих синтез ДНК. Такие соединения оказывают токсическое действие на все клетки, но при этом они весьма эффективно воздействуют на быстро делящиеся раковые клетки. Альтернативные подходы к созданию противораковых средств, действие которых не связано с ингибированием синтеза ДНК, основаны на достижении повышенной избирательности воздействия на раковые клетки.
В последние годы было установлено, что клетка становится раковой в результате превращения части ее ДНК в онкоген, то есть в ген, который под действием активирующих факторов ведет к образованию злокачественных клеток (Брэдшоу, Mutagenesis, 1986, 1, 91). Некоторые такие онкогены вызывают образование пептидов, являющихся рецепторами для факторов роста. Комплекс рецепторов для факторов роста затем ведет к увеличению пролиферации клеток. Например, известно, что некоторые онкогены кодируют различные типы тирозинкиназы и что определенные рецепторы для факторов роста также представляют различные типы тирозинкиназы (Ярден и др., Аnn. Rev. Biochem, 1988, 57, 443, Ларсен и др. Ann. Reports in Med., Chem 1989, глава 13).
Тирозинкиназы рецепторов играют важную роль при передаче биохимических сигналов, которые инициируют репликацию клеток. Эти ферменты крупного типа блокируют клеточную оболочку и захватывают внеклеточную область связывания для таких факторов роста, как фактор роста эпидермиса, и внутриклеточную часть, которая функционирует в качестве киназы, фосфорилируя тирозинаминокислоты в белках, а следовательно и влияя на пролиферацию клеток. Известно, что такие киназы часто присутствуют в раковых опухолях человека, таких как рак молочной железы (Сейнсбери и др., Brit J. Cancer, 1988, 58, 458; Гурин и др. , Oncogene Res., 1988, 3, 21), рак желудочно-кишечного тракта, например, рак прямой кишки, рак толстой кишки или рак желудка (Болен и др., Oncogene Res., 1987, 1, 149), лейкоз (Конака и др., Cell, 1984, 37, 1035) и рак яичника, рак бронхов или рак поджелудочной железы (описание изобретения Европейского патента N 0400586). При исследовании раковых тканей человека в отношении активности тирозинкиназы рецепторов весьма вероятно, что будет установлено их широкое распространение в других раковых опухолях, таких как рак щитовидной железы и рак матки. Также известно, что тирозинкиназа редко проявляет активность в нормальных клетках, при этом часто обнаруживается в раковых клетках (Хантер, Cell, 1987, 50, 823). Недавно было продемонстрировано (В.Дж. Галлик, Brit. Med. Bull., 1991, 47, 87), что рецептор для фактора роста эпидермиса, в котором наблюдается активность тирозинкиназы, чрезмерно выражен во многих раковых опухолях человека, таких как рак мозга, рак клеток сквамозного эпителия легкого, рак мочевого пузыря, рак желудка, рак молочной железы, рак головы и шеи, рак пищевода, рак половых органов и рак щитовидной железы.
Таким образом было установлено, что ингибитор тирозинкиназы рецептора должен быть весьма эффективным избирательным ингибитором роста раковых клеток у млекопитающих (Ейш и др., Science, 1988, 242, 933). Эта точка зрения подтверждается тем, что эрбстатин, ингибитор тирозинкиназы рецептора, эффективно замедляет рост трансплантированной "голым" мышам раковой опухоли молочной железы человека, в которой присутствует тирозинкиназа рецептора для фактора роста эпидермиса (EGF), но не оказывает воздействия на рост другой раковой опухоли, в которой отсутствует тирозинкиназа рецептора для EGF (Тои и др. , Eur, J. Cancer Clin. Oncol., 1990, 26, 722). Также указывается, что различные производные стирола обладают ингибирующими свойствами в отношении тирозинкиназы (заявки на Европейский патент N 0211363, 0304493 и 0322738) и являются полезными противоопухолевыми средствами. Ингибирующее действие двух таких производных стирола было продемонстрировано в живом организме в отношении роста раковой опухоли клеток сквамозного эпителия человека, привитой "голым" мышам (Йонеда и др., Cancer Research, 1991, 51. 4430). Таким образом было установлено, что ингибиторы тирозинкиназы рецепторов должны быть полезными при лечении различных раковых опухолей человека. Различные известные ингибиторы тирозинкиназы рассматриваются в недавно опубликованном обзоре, составленном Т.Р.Берком, младшим (Drugs of the Future, 1992, 17, 119).
Было установлено, что определенные производные хиназолина обладают противораковыми свойствами, которые, как считает заявитель, непосредственно связаны с присущими им ингибирующими свойствами в отношении тирозинкиназы рецепторов.
В настоящее время известны многие производные хиназолина, но ни в одном литературном источнике не указывалось, что какие-либо производные хиназолина обладают противораковым действием благодаря наличию у них ингибирующих свойств в отношении тирозинкиназы рецепторов.
Из заявки на патент Великобритании N 2033894 известно, что определенные производные хиназолина обладают болеутоляющими и противовоспалительными свойствами. Соединения и содержащие их фармацевтические составы представлены общей формулой II (приведенной ниже), в которой R1 означают водород, галоген, трифторметил или нитро;
R2 представляет водород, галоген, алкил или алкокси, и
R3 представляет водород или алкил.
За единственным исключением все примеры соединений, приведенные в указанной заявке, требуют, чтобы R1 представлял заместитель, не являющийся водородом. Исключением является соединение, определяемое как 4-/N-метиланилино/хиназолин, в котором оба заместителя R1 и R2 представляют водород, а R3 является метилом. Заявители полагают, что рассматриваемые ниже производные хиназолина не включают ни одного из соединений, описываемых в заявке на патент Великобритании N 2033894.
Другие известные производные хиназолина, указанные в заявке на патент Великобритании N 2033894, включают такие соединения, как 4-анилинохиназолин и 4-анилино-6-хлорхиназолин (J. org. Chem., 1976, 41, 2646 и патент США N 3985749), которые используются при лечении кокцидиоза.
Из "Chemical Abstracts", том 107, реферат N 134278, известно, что определенные производные 4-/4'-гидроксианилино/ хиназолина исследовались в отношении противоаритмических свойств. Соединения, указанные в качестве промежуточных химических продуктов, включают 4-/4'-гидроксианилино/-6-метоксихиназолин и 4-/4'-гидроксианилино/-6,7-метилендиоксихиназолин. Из "Chemical Abstracts", том 70, реферат N 68419, известно, что определенные производные 4-аминохиназолина обладают бронхолитическими и/или гипотензивными свойствами. Одним рассматриваемым соединением является 4-анилино-6,7-диметоксихиназолин/ Из "Chemical Abstracts", том 92, реферат N 76445, также известно, что определенные производные 6,7,8-триметоксихиназолина обладают противомалярийными свойствами. Одно соединение, указанное в качестве промежуточного химического продукта, представляет 4-/4'-гидроксианилино/-6,7,8-триметоксихиназолин.
Из "Chemical Abstracts", том 58, реферат N 9258, также известно, что определенные производные 4-/4'-азоанилино/хиназолина являются красителями. Соединение, указанное в этом реферате в качестве промежуточного продукта, представляет 6-амино-4-/4'-аминоанилино/хиназолин. Из журнала J.Chem, Soc., 1962, 4679, также известно, что 4-хлор-6-метилхиназолин взаимодействует с анилином с образованием 4-анилино-6-метилхиназолина.
В соответствии с одним аспектом настоящего изобретения предусматривается производное хиназолина формулы I (приводится ниже), в котором m равняется 1, 2 или 3 и R1 независимо от других элементов представляет гидрокси, амино, карбокси, карбамоил, уреидо, /1-4C/-алкоксикарбонил, N-/1-4C/-алкилкарбамоил, N, N-ди-[/1-4C/алкил] карбамоил, гидроксиамино, /2-4C/алкоксиамино, /2-4C/-алканоилоксиамино, трифтор-метокси, /1-4C/алкил, /1-4C/-алкокси, /1-3C/алкилендиокси, /1-4C/алкиламино, ди-[/1-4C/алкил]амино, пирролидин-1-ил, пиперидино, морфолино, пиперазин-1-ил, 4-/1-4C/алкилпиперазин-1-ил, /1-4C/алкилтио, /1-4C/алкилсульфинил, /1-4C/алкилсульфонил, галоген-/1-4C/алкил (не являющийся трифторметилом), гидрокси-/1-4C/алкил, /2-4C/алканоилокси-/1-4C/алкил, /1-4C/-алкокси-/1-4C/алкил, карбокси-/1-4C/алкил, /1-4C/алкоксикарбонил-/1-4C/алкил, карбамоил-/1-4C/алкил, N-/1-4C/-алкилкарбамоил-/1-4C/алкил, N,N-ди[/1-4C/алкил]карбамоил-/1-4C/-алкил, амино-/1-4C/алкил, /1-4C/алкиламино-/1-4C/алкил, ди-[/1-4C/алкил]амино-/1-4C/алкил, пиперидино-/1-4C/алкил, морфолино-/1-4C/алкил, пиперазин-1-ил-/1-4C/алкил, 4-/1-4C/алкилпиперазин-1-ил-/2-4C/алкил, гидрокси-/2-4C/алкокси-/1-4C/алкил, /1-4C/алкокси-/2-4C/-алкокси-/1-4C/алкил, гидрокси-/2-4C/алкиламино-/1-4C/алкил, /1-4C/алкокси-/2-4C/алкиламино/1-4C/алкил, /1-4C/алкилтио-/1-4C/алкил, гидрокси-/2-4C/алкилтио-/1-4C/алкил, /1-4C/алкокси-/2-4C/алкилтио-/1-4C/алкил, фенокси-/1-4C/алкил, анилино-/1-4C/алкил, фенилтио-/1-4C/алкил, циано-/1-4C/алкил, галоген-/2-4C/алкокси, гидрокси-/2-4C/алкокси, /2-4C/алканоилокси-/2-4C/алкокси, /1-4C/алкокси-/2-4C/алкокси, карбокси-/1-4C/алкокси, /1-4C/алкоксикарбонил/1-4C/алкокси, карбамоил-/1-4C/алкокси, N-/1-4C/алкилкарбамоил-/1-4C/алкокси, N,N-ди[/1-4C/алкил] карбамоил-/1-4C/алкокси, амино-/2-4C/алкокси, /1-4C/алкиламино-/2-4C/алкокси, ди[/1-4C/алкил] амино-/2-4C/алкокси, /2-4C/алканоилокси, гидрокси-/2-4C/алканоилокси, /1-4C/алкокси-/2-4C/алканоилокси, фенил-/1-4C/алкокси, фенокси-/2-4C/алкокси, анилино-/2-4C/алкокси, фенилтио-/2-4C/алкокси, пиперидино-/2-4C/алкокси, морфолино-/2-4C/алкокси, пиперазин-1-ил-/2-4C/алкокси, 4-/1-4C/алкилпиперазин-1-ил-/2-4C/алкокси, галоген-/2-4C/алкиламино, гидрокси-/2-4C/алкиламино, /2-4C/алканоилокси-/2-4C/алкиламино, /1-4C/алкокси-/2-4C/алкиламино, карбокси-/1-4C/алкиламино, /1-4C/алкоксикарбонил-/1-4C/алкиламино, карбамоил-/1-4C/алкиламино, N-/1-4C/алкилкарбамоил-/1-4C/алкиламино, N, N-ди-[/1-4C/алкил] карбамоил-/1-4C/алкиламино, амино-/2-4C/алкиламино, /1-4C/алкиламино-/2-4C/алкиламино, ди-[/1-4C/алкил] амино-/2-4C/алкиламино, фенил-/1-4C/алкиламино, фенокси-/2-4C/алкиламино, анилино-/2-4C/алкиламино, фенилтио-/2-4C/алкиламино, /2-4C/алканоиламино, /1-4C/алкоксикарбониламино, /1-4C/алкилсульфониламино, бензамидо, бензолсульфонамидо, 3-фенилуреидо, 2-оксопирролидин-1-ил, 2,5-диоксопирролидин-1-ил, галоген-/2-4C/алканоиламино, гидрокси-/2-4C/алканоиламино, /1-4C/алкокси-/2-4C/алканоиламино, карбокси-/2-4C/алканоиламино, /1-4C/алкоксикарбонил-/2-4C/алканоиламино, карбамоил-/2-4C/алканоиламино, N-/1-4C/алкилкарбамоил-/2-4C/алканоиламино, N,N-ди-[/1-4C/алкил] карбамоил-/2-4C/алканоиламино, амино-/2-4C/алканоиламино, /1-4C/алкиламино-/2-4C/алканоиламино или ди-[/1-4C/алкил]амино-/2-4C/алканоиламино и в которой указанный заместитель, представляющий бензамидо или бензолсульфонамидо, либо любая анилино, фенокси или фенильная группа в заместителе R1 может вариантно включать один или два заместителя, представляющих галоген, /1-4C/алкил или /1-4C/алкокси;
n означает 1 или 2 и R2 независимо от других элементов представляет водород, гидрокси, галоген, трифторметил, амино, нитро, циано, /1-4C/алкил, /1-4C/алкокси, /1-4C/алкиламино, ди-[/1-4C/алкил] амино, /1-4C/алкилтио, /1-4C/алкилсульфинил или /1-4C/алкилсульфонил, или его фармацевтически приемлемая соль;
за исключением того, что в объем настоящего изобретения не входят 4-/4'-гидроксианилино/-6-метоксихиназолин, 4-/4'-гидроксианилино/-6,7-метилендиоксихиназолин, 4-/4'-гидроксианилино/-6,7,8-триметоксихиназолин, 6-амино-/4-/4'-аминоанилино/хиназолин, 4-анилино-6-метилхиназолин или его хлористо-водородная соль и 4-анилино-6,7-диметоксихиназолин или его хлористо-водородная соль.
В соответствии с другим аспектом настоящего изобретения предусматривается производное хиназолина формулы I, приводимой ниже, в которой помимо вышеуказанных значений R2 может представлять /2-4C/алканоиламино, бензамидо или /2-4C/алканоил и в которой указанная бензамидогруппа может вариантно включать один или два заместителя, представляющих галоген, /1-4C/алкил или /1-4C/алкокси;
или его фармацевтически приемлемая соль.
В соответствии с еще одним аспектом настоящего изобретения предусматривается производное хиназолина формулы I, в которой m означает 1, 2 или 3 и R1 независимо от других элементов представляет гидрокси, амино, карбокси, карбамоил, уреидо, /1-4C/акоксикарбонил, N-/1-4C/алкилкарбамоил, N,N-ди-[/1-4C/алкил] карбамоил, /1-4C/алкил, /1-4C/алкокси, /1-3C/алкилендиокси, /1-4C/алкиламино, ди-[/1-4C/алкил]амино, /1-4C/алкилтио, /1-4C/алкилсульфинил, /1-4C/алкилсульфонил, галоген-/1-4C/алкил (кроме трифторметила), гидрокси-/1-4C/алкил, /2-4C/алканоилокси-/1-4C/алкил, /1-4C/алкокси-/1-4C/алкил, карбокси-/1-4C/алкил, /1-4C/алкоксикарбонил-/1-4C/алкил, карбамоил-/1-4C/алкил, N-/1-4C/алкилкарбамоил-/1-4C/алкил, N,N-ди-[/1-4C/алкил]карбамоил-/1-4C/алкил, амино-/1-4C/алкил, /1-4C/алкиламино-/1-4C/алкил, ди-[/1-4C/алкил]амино-/1-4C/алкил, пиперидино-/1-4C/алкил, морфолино-/1-4C/алкил, пиперазин-1-ил/1-4C/алкил, 4-/1-4C/алкилпиперазин-1-ил-/1-4C/алкил, гидрокси-/2-4C/алкокси-/1-4C/алкил, /1-4C/алкокси-/2-4C/алкокси-/1-4C/алкил, гидрокси-/2-4C/алкиламино/1-4C/алкил, /1-4C/алкокси-/2-4C/алкиламино-/1-4C/алкил, /1-4C/алкилтио-/1-4C/алкил, гидрокси-/2-4C/алкилтио-/1-4C/алкил, /1-4C/алкокси-/2-4C/алкилтио-/1-4C/алкил, галоген-/2-4C/алкокси, гидрокси-/2-4C/алкокси, /2-4C/алканоилокси-/2-4C/алкокси, /1-4C/алкокси-/2-4C/алкокси, карбокси-/1-4C/алкокси, /1-4C/алкоксикарбонил-/1-4C/алкокси, карбамоил-/1-4C/алкокси, N-/1-4C/алкилкарбамоил-/1-4C/алкокси, N, N-ди-[/1-4C/алкил] карбамоил-/1-4C/алкокси, амино-/2-4C/алкокси, /1-4C/алкиламино-/2-4C/алкокси, ди-[/1-4C/алкил] амино-/2-4C/алкокси, галоген-/2-4C/алкиламино, гидрокси-/2-4C/алкиламино, /2-4C/алканоилокси-/2-4C/алкиламино, /1-4C/алкокси-/2-4C/алкиламино, карбокси-/1-4C/алкиламино, /1-4C/алкоксикарбонил-/1-4C/алкиламино, карбамоил-/1-4C/алкиламино, N-/1-4C/алкилкарбамоил-/1-4C/алкиламино, N, N-ди-[/1-4C/алкил]карбамоил-/1-4C/алкиламино, амино-/2-4C/алкиламино, /1-4C/алкиламино-/2-4C/алкиламино, ди-[/1-4C/алкил]амино-/2-4C/алкиламино, /2-4C/алканоиламино, /1-4C/алкоксикарбониламино, /1-4C/алкилсульфониламино, бензамидо, бензолсульфонамидо, галоген-/2-4C/алканоиламино, гидрокси-/2-4C/алканоиламино, /1-4C/алкокси-/2-4C/алканоиламино, карбокси-/2-4C/алканоиламино, /1-4C/алкоксикарбонил-/2-4C/алканоиламино, карбамоил-/2-4C/алканоиламино, N-/1-4C/алкилкарбамоил-/2-4C/алканоиламино, N, N-ди-[/1-4C/алкил] карбамоил-/2-4C/алканоиламино, амино-/2-4C/алканоиламино, /1-4C/алкиламино-/2-4C/алканоиламино или ди-[/1-4C/алкил] амино-/2-4C/алканоиламино и в которой указанный заместитель, представляющий бензамидо или бензолсульфонамидо, может вариантно включать один или два заместителя, представляющих галоген, /1-4C/алкил или /1-4C/алкокси;
n означает 1 или 2 и R2 независимо от других элементов представляет водород, гидрокси, галоген, трифторметил, амино, нитро, циано, /1-4C/алкил, /1-4C/алкокси, /1-4C/алкиламино, ди-[/1-4C/алкил] амино, /1-4C/алкилтио, /1-4C/алкилсульфинил или /1-4C/алкилсульфонил, или его фармацевтически приемлемая соль;
за исключением того, что в объем настоящего изобретения не входят 4-/4'-гидроксианилино/-6-метоксихиназолин, 4-/4'-гидроксианилино/-6,7-метилендиоксихиназолин, 4-/4'-гидроксианилино/-6,7,8-триметоксихиназолин, 6-амино-/4-/4'-аминоанилино/хиназолин, 4-анилино-6-метилхиназолин или его хлористо-водородная соль и 4-анилино-6,7-диметоксихиназолин или его хлористо-водородная соль.
В соответствии с еще одним аспектом настоящего изобретения предусматривается производное хиназолина формулы I, в которой m означает 1 или 2 и R1 независимо от других элементов представляет гидрокси, амино, карбокси, /1-4C/алкоксикарбонил, /1-4C/алкил, /1-4C/алкокси, /1-3C/алкилендиокси, /1-4C/алкиламино, ди-[/1-4C/алкил]амино, /1-4C/алкилтио, /1-4C/алкилсульфинил, /1-4C/алкилсульфонил, гидрокси-/1-4C/алкил, /1-4C/алкокси-/1-4C/алкил, амино-/1-4C/алкил, /1-4C/алкиламино-/1-4C/алкил, ди-[/1-4C/алкил]амино-/1-4C/алкил, гидрокси-/2-4C/алкокси, /1-4C/алкокси-/2-4C/алкокси, карбокси-/1-4C/алкокси, /1-4C/алкоксикарбонил-/1-4C/алкокси, /2-4C/алканоиламино, /1-4C/алкилсульфониламино, бензамидо или бензолсульфонамидо и в которой указанные последними 2 заместителя могут вариантно включать один или два заместителя, представляющих галоген, /1-4C/алкил или /1-4C/алкокси;
n означает 1 или 2 и R2 независимо от других элементов представляет водород, гидрокси, галоген, трифторметил, амино, нитро, циано, /1-4C/алкил, /1-4C/алкокси, /1-4C/алкиламино, ди-[/1-4C/алкил] амино, /1-4C/алкилтио, /1-4C/алкилсульфинил или /1-4C/алкилсульфонил;
или его фармацевтически приемлемая соль;
за исключением того, что в объем настоящего изобретения не входят 4-/4'-гидроксианилино/-6-метоксихиназолин, 4-/4'-гидроксианилино/-6,7-метилендиоксихиназолин, 6-амино-/4-/4'-аминоанилино/хиназолин, 4-анилино-6-метилхиназолин или его хлористо-водородная соль и 4-анилино-6,7-диметоксихиназолин или его хлористо-водородная соль.
Химические формулы, обозначаемые в этой заявке римскими цифрами, приводятся для удобства на отдельном листе. В этом описании изобретения термин "алкил" включает алкильные группы как с прямой, так и с разветвленной цепью, но ссылки на отдельные алкильные группы, например "пропил", относятся к варианту с прямой цепью. Аналогичное условие относится и к другим родовым терминам.
Следует помнить, что в объем настоящего изобретения входят все таутомерные формы, образуемые хиназолином формулы 1, при этом на рисунках формул, приводимых в этом описании изобретения, может быть изображена только одна из возможных таутомерных форм. Следует понять, что настоящее изобретение включает все таутомерные формы, которые обладают противоопухолевым действием, и не ограничивается какой-либо одной таутомерной формой, изображенной на рисунках формул.
Хиназолины формулы I не замещаются в положении у атома 2. Это специально показано в формуле I наличием атома водорода в положении атома 2. Необходимо понять, что группы R1 находятся только в положении бензольного ядра хиназолинового кольца.
Также необходимо понять, что определенные хиназолины формулы I могут иметь сольватированные и несольватированные формы, например, гидратированные формы. Следует помнить, что настоящее изобретение включает все сольватированные формы, которые обладают противораковым действием.
Ниже приводятся приемлемые значения для родовых радикалов, рассмотренных выше.
Приемлемым значением для R1 или R2, когда он представляет /1-4C/-алкил, может быть, например, метил, этил, пропил, изопропил, бутил, изобутил, втор-бутил или трет-бутил; когда он представляет /1-4C/-алкокси, таким значением может быть, например, метокси; этокси, пропокси, изопропокси, или бутокси; когда он представляет /1-4C/алкиламино, таким значением может быть, например, метиламино, этиламино или пропиламино; когда он представляет ди-[/1-4C/алкил] амино, таким значением может быть, например, диметиламино, N-этил-N-метиламино, диэтиламино, N-метил-N-пропиламино или дипропиламино; когда он представляет /1-4C/алкилтио, таким значением может быть, например, метилтио, этилтио или пропилтио; когда он представляет /1-4C/алкилсульфинил, таким значением может быть, например, метилсульфинил, этилсульфинил или пропилсульфинил; когда он представляет /1-4C/алкилсульфонил, таким значением может быть, например, метилсульфонил, этилсульфонил или пропилсульфонил; и когда он представляет /2-4C/алканоиламино, таким значением может быть, например, ацетамидо, пропионамидо или бутирамидо.
Приемлемые значения для каждого заместителя R1, который может присутствовать в хиназолиновом кольце, включают, например:
для /1-4C/алкоксикарбонила: метоксикарбонил, этоксикарбонил, пропоксикарбонил и трет-бутоксикарбонил;
для N-/1-4C/алкилкарбамоила: N-метилкарбамоил, N-этилкарбамоил и N-пропилкарбамоил;
для N, N-ди[/1-4C/-алкил]-карбамоила;N,N-диметилкарбамоил, N-этил-N-метил-карбамоил и N,N-диэтилкарбамоил;
для /1-4C/алкоксиамино: метоксиамино, этоксиамино и пропоксиамино;
для /2-4C/алканоилоксиамино: ацетоксиамино, пропионилоксиамино и бутирилоксиамино;
для /1-3C/алкилендиокси: метилендиокси, этилендиокси и пропилендиокси;
для 5-/1-4C/алкилпиперазин-1-ила: 4-метилпиперазин-1-ил и 4-этил пиперазин-1-ил;
для галоген-/1-4C/алкила: фторметил, хлорметил, бромметил, дифторметил, дихлорметил, дибромметил, 2-фторэтил, 2-хлорэтил и 2-бромэтил; а трифторметил исключается из объема изобретения;
для гидрокси-/1-4C/алкила: гидроксиметил, 1-гидроксиэтил, 2-гидроксиэтил и 3-гидроксипропил;
для /2-4C/алканоилокси-/1-4C/алкила: ацетоксиметил, пропионилоксиметил, бутирилоксиметил, 2-ацетоксиэтил и 3-ацетоксипропил;
для /1-4C/алкокси-/1-4C/алкила: метоксиметил, этоксиметил, 1-метоксиэтил, 2-метоксиэтил, 2-этоксиэтил и 3-метоксипропил;
для карбокси-/1-4C/алкила: карбоксиметил, 1-карбоксиэтил, 2-карбоксиэтил и 3-карбоксипропил;
для /1-4C/алкоксикарбонил-/1-4C/алкила; метоксикарбонилметил, этоксикарбонилметил, трет- бутоксикарбонилметил, 1-метоксикарбонилэтил, 1-этоксикарбонилэтил, 2-метоксикарбонилэтил, 2-этоксикарбонилэтил, 3-метоксикарбонилпропил и 3-этоксикарбонилпропил;
для карбамоил-/1-4C/алкила: карбамоилметил, 1-карбамоилэтил, 2-карбамоилэтил и 3-карбамоилпропил;
для N-/1-4C/алкилкарбамоил-/1-4C/алкила: N-метилкарбамоилметил, N-этилкарбамоилметил, N-пропилкарбамоилметил, 1-/N-метилкарбамоил/ этил, 1-/N-этилкарбамоил/этил, 2-/N-метилкарбамоил/этил, 2-/N-этилкарбамоил/этил и 3-/N-метилкарбамоил/пропил;
для N, N-ди-[/1-4C/алкил]-карбамоил-/1-4C/алкила: N,N-диметилкарбамоилметил, N-этил-N-метилкарбамоилметил, N,N-диэтилкарбамоилметил, 1-/N,N-диметилкарбамоил/этил, 1-/N, N-диэтилкарбамоил/этил, 2-/N, N-диметилкарбамоил/этил, 2-/N,N-диэтилкарбамоил/этил и 3-/N,N-диметилкарбамоил/пропил;
для амино-/1-4C/алкила: аминометил, 1-аминоэтил, 2-аминоэтил и 3-аминопропил;
для /1-4C/алкиламино-/1-4C/алкила: метиламинометил, этиламинометил, 1-метиламиноэтил, 2-метиламиноэтил, 2-этиламиноэтил и 3-метиламинопропил;
для ди-[/1-4C/алкил]амино-/1-4C/алкила: диметиламинометил, диэтиламинометил, 1-диметиламиноэтил, 2-диметиламиноэтил и 3-диметиламинопропил;
для пиперидино-/1-4C/алкила: пиперидинометил и 2-пиперидиноэтил;
для морфолино-/1-4C/алкила: морфолинометил и 2-морфолиноэтил;
для пиперазин-1-ил/1-4C/-алкила: пиперазин-1-илметил и 2-/пиперазин-1-ил/этил;
для 4-/1-4C/алкилпиперазин-1-ил/1-4C/алкила: 4-метилпиперазин-1-илметил, 4-этилпиперазин-1-илметил, 2-/4-метилпиперазин-1-ил/этил и 2-/4-этилпиперазин-1-ил/этил;
для гидрокси-/2-4C/алкокси-/1-4C/алкила: 2-гидроксиэтоксиметил, 3-гидроксипропоксиметил, 2-/2-гидроксиэтокси/этил и 2-/3-гидроксипропокси/этил;
для /1-4C/алкокси-/2-4C/-алкокси-/1-4C/алкила: 2-метоксиэтоксиметил, 2-этоксиэтоксиметил, 3-метоксипропоксиметил, 3-этоксипропоксиметил, 2-/2-метоксиэтокси/этил и 2-/2-этоксиэтокси/этил;
для гидрокси-/2-4C/алкиламино-/1-4C/алкила: 2-гидроксиэтиламинометил, 3-гидроксипропиламинометил, 2-/2-гидроксиэтиламино/этил и 2-/3-гидроксипропиламино/этил;
для /1-4C/алкокси-/2-4C/-алкиламино-/1-4C/алкила: 2-метоксиэтиламинометил, 2-этоксиэтиламинометил, 3-метоксипропиламинометил, 2-/2-метоксиэтиламино/этил и 2-/2-этоксиэтиламино/этил;
для /1-4C/алкилтио-1-4C/алкила: метилтиометил, этилтиометил, 2-метилтиоэтил, 2-этилтиоэтил, 3-метилтиопропил и 3-этилтиопропил;
для гидрокси-/2-4C/алкилтио-/1-4C/алкила: 2-гидроксиэтилтиометил, 3-гироксипропилтиометил, 2-/2-гидроксиэтилтио/этил и 2-/3-гидроксипропилтио/этил;
для /1-4C/алкокси-/2-4C/-алкилтио-/1-4C/алкила: 2-метоксиэтилтиометил, 2-этоксиэтилтиометил, 3-метоксипропилтиометил, 2-/2-метоксиэтилтио/этил и 2-/2-этоксиэтилтио/этил;
для фенокси-/1-4C/алкила: феноксиметил, 2-феноксиэтил и 3-феноксипропил;
для анилино-/1-4C/алкила: анилинометил, 2-анилиноэтил и 3-анилинопропил;
для фенилтио-/1-4C/алкила: фенилтиометил, 2-фенилтиоэтил и 3-фенилтиопропил;
для циано-/1-4C/алкила: цианометил, 2-цианоэтил и 3-цианопропил;
для галоген-/2-4C/алкокси: 2-фторэтокси, 2-хлорэтокси, 2-бромэтокси, 3-фторпропокси и 3-хлорпропокси;
для гидрокси-/2-4C/алкокси: 2-гидроксиэтокси, 3-гидроксипропокси и 4-гидроксибутокси;
для /2-4C/алканоилокси-/2-4C/алкокси: 2-ацетоксиэтокси, 2-пропионилоксиэтокси, 2-бутирилоксиэтокси и 3-ацетоксипропокси;
для /1-4C/алкокси-/2-4C/алкокси: 2-метоксиэтокси, 2-этоксиэтокси, 3-метоксипропокси и 4-метоксибутокси;
для карбокси-/1-4C/алкокси: карбоксиметокси, 1-карбоксиэтокси, 2-карбоксиэтокси и 3-карбоксипропокси;
для /1-4C/алкоксикарбонил-/1-4C/алкокси: метоксикарбонилметокси, этоксикарбонилметокси, 1-метоксикарбонилэтокси, 2-метоксикарбонилэтокси, 2-этоксикарбонилэтокси и 3-метоксикарбонилпропокси;
для карбамоил-/1-4C/алкокси: карбамоилметокси, 1-карбамоилэтокси, 2-карбамоилэтокси и 3-карбамоилпропокси;
для N-/1-4C/алкилкарбамоил-/1-4C/алкокси: N-метилкарбамоилметокси, N-этилкарбамоилметокси, 2-/N-метилкарбамоил/этокси, 2-/N-этилкарбамоил/этокси и 3-/N-метилкарбамоил/пропоски;
для N, N-ди-[/1-4C/алкил]карбамоил-/1-4C/алкокси: N,N-диметилкарбамоилметокси, N-этил-N-метилкарбамоилметокси, N,N-диэтилкарбамоилметокси, 2-/N, N-диметилкарбамоил/этокси, 2-/N,N-диэтилкарбамоил/этокси и 3-/N,N-диметилкарбамоил/пропокси;
для амино-/2-4C/алкокси: 2-аминоэтокси и 3-аминопропокси;
для /1-4C/алкиламино-/2-4C/алкокси: 2-метиламиноэтокси, 2-этиламиноэтокси, 2-пропиламиноэтокси, 3-метиламинопропокси и 3-этиламинопропокси;
для ди-[/1-4C/алкил]амино/2-4C/алкокси: 2-диметиламиноэтокси, 2-/N-этил-N-метил/этокси, 2-диэтиламиноэтокси, 2-дипропиламиноэтокси, 3-диметиламинопропокси и 3-диэтиламинопропокси;
для /2-4C/алканоилокси: ацетокси, пропионилокси и бутирилокси;
для гидрокси-/2-4C/алканоилокси: 2-гидроксиацетокси, 3-гидроксипропионилокси и 4-гидроксибутирилокси;
для /1-4C/алкокси-/2-4C/алканоилокси: 2-метоксиацетокси, 2-этоксиацетокси и 3-метоксипропионилокси;
для фенил-/1-4C/алкокси: бензилокси, 2-фенилэтокси и 3-фенилпропокси;
для фенокси-/2-4C/алкокси: 2-феноксиэтокси, 3-феноксипропокси и 4-феноксибутокси;
для анилино-/2-4C/алкокси: 2-анилиноэтокси, 3-анилинопропокси и 4-анилинобутокси;
для фенилтио-/2-4C/алкокси: 2-фенилтиоэтокси, 3-фенилтиопропокси и 4-фенилтиобутокси;
для пиперидино-/2-4C/алкокси: 2-пиперидиноэтокси и 3-пиперидинопропокси;
для морфолино-/2-4C/алкокси: 2-морфолиноэтокси и 3-морфолинопропокси;
для пиперазин-1-ил-/2-4C/алкокси: 2-/пиперазин-1-ил/этокси и 3-/пиперазин-1-ил/пропокси;
для 4-/1-4C/алкилпиперазин-1-ил-/2-4C/алкокси: 2-/4-метилпиперазин-1-ил/этокси и 3-/4-метилпиперазин-1-ил/пропокси;
для галоген-/2-4C/алкиламино: 2-фторэтилано, 2-хлорэтиламино, 2-бромэтиламино, 3-фторпропиламино и 3-хлорпропиламино;
для гидрокси-/2-4C/алкиламино: 2-гидроксиэтиламино, 3-гидроксипропиламино и 4-гидроксибутиламино;
для /2-4C/алканоилокси-/2-4C/алкиламино: 2-ацетоксиэтиламино, 2-пропионилоксиэтиламино, 2-бутирилоксиэтиламино и 3-ацетоксипропиламино;
для /1-4C/алкокси-/2-4C/алкиламино: 2-метоксиэтиламино, 2-этоксиэтиламино, 3-метоксипропиламино и 3-этоксипропиламино;
для карбокси-/1-4C/алкиламино: карбоксиметиламино, 1-карбоксиэтиламино, 2-карбоксиэтиламино и 3-карбоксипропиламино;
для /1-4C/алкоксикарбонил-/1-4C/алкиламино: метоксикарбонилметиламино, этоксикарбонилметиламино, 1-метоксикарбонилэтиламино, 2-метоксикарбонилэтиламино, 2-этоксикарбонилэтиламино и 3-метоксикарбонилпропиламино;
для карбамоил-/1-4C/алкиламино: карбамоилметиламино, 1-карбамоилэтиламино, 2-карбамоилэтиламино и 3-карбамоилпропиламино;
для N-/1-4C/алкилкарбамоил-/1-4C/алкиламино: N-метилкарбамоилметиламино, N-этилкарбамоилметиламино, 2-/N-метилкарбамоил/этиламино, 2-/N-этилкарбамоил/этиламино и 3-/N-метилкарбамоил/пропиламино;
для N, N-ди-[/1-4C/алкил] -карбамоил-1-4C/алкиламино: N,N-диметилкарбамоилметиламино, N-этил-N-метилкарбамоилметиламино, N,N-диэтилкарбамоилметиламино, 2-/N,N-диметилкарбамоил/этиламино, 2-/N,N-диэтилкарбамоил/этиламино и 3-/N,N-диметилкарбамоил/пропиламино;
для амино-/2-4C/алкиламино: 2-аминоэтиламино, 3-аминопропиламино и 4-аминобутиламино;
для /1-4C/алкиламино-/2-4C/алкиламино: 2-метиламиноэтиламино, 2-этиламиноэтиламино, 2-пропиламиноэтиламино, 3-метиламинопропиламино, 3-этиламинопропиламино и 4-метиламинобутиламино;
для ди-[/1-4C/алкил] амино-/2-4C/алкиламино: 2-диметиламиноэтиламино, 2-/N-этил-N-метиламино/этиламино, 2-диэтиламиноэтиламино, 2-дипропиламиноэтиламино, 3-диметиламинопропиламино, 3-диэтиламинопропиламино и 4-диметиламинобутиламино;
для фенил-/1-4C/алкиламино: бензиламино, фенетиламино и 3-фенилпропиламино;
для фенокси-/2-4C/алкиламино: 2-феноксиэтиламино и 3-феноксипропиламино;
для анилино-/2-4C/алкиламино: 2-аналиноэтиламино и 3-анилинопропиламино;
для фенилтио-/2-4C/алкиламино: 2-фенилтиоэтиламино и 3-фенилтиопропиламино;
для /1-4C/алкоксикарбониламино: метоксикарбониламино, этоксикарбониламино и пропоксикарбониламино;
для /1-4C/алкилсульфониламино: метилсульфониламино, этилсульфониламино и пропилсульфониламино;
для галоген-/2-4C/алканоиламино: 2-хлорацетамидо, 2-бромацетамидо, 3-хлорпропионамидо и 3-бромпропионамидо;
для гидрокси-/2-4C/алканоиламино: 2-гидроксиацетамидо, 3-гидроксипропионамидо и 4-гидроксибутирамидо;
для /1-4C/алкокси-/2-4C/алканоиламино: 2-метоксиацетамидо, 2-этоксиацетамидо, 2-пропоксиацетамидо, 3-метоксипропионамидо, 3-этоксипропионамидо и 4-метоксибутирамидо;
для карбокси-/2-4C/алканоиламино: 2-карбоксиацетамидо, 3-карбоксипропионамидо и 4-карбоксибутирамидо;
для /1-4C/алкоксикарбонил-/2-4C/алканоиламино: 2-метоксикарбонилацетамидо, 2-этоксикарбонилацетамидо, 3-метоксикарбонилпропионамидо и 3-этоксикарбонилпропионамидо;
для карбамоил-/2-4C/алканоиламино: 2-карбамоилацетамидо, 3-карбамоилпропионамидо и 4-карбамоилбутирамидо;
для N-/1-4C/алкилкарбамоил-/2-4C/алканоиламино: 2-/N-метилкарбамоил/ацетамидо, 2-/N-этилкарбамоил/ацетамидо, 3-/N-метилкарбамоил/пропионамидо, 3-/N-этилкарбамоил/пропионамидо и 4-/N-метилкарбамоил/бутирамидо;
для N,N-ди-[/1-4C/алкил]-карбамоил-/2-4C/алканоиламино: 2-/N,N-диметилкарбамоил/ацетамидо, 2-/N-этил-N-метилкарбамоил/ацетамидо, 2-/N, N-диэтилкарбамоил/ацетамидо, 3-/N, N-диметилкарбамоил/пропионамидо, 3-/N,N-диэтилкарбамоил/пропионамидо и 4-/N,N-диметилкарбамоил/бутирамидо;
для амино-/2-4C/алканоиламино: 2-аминоацетамидо, 3-аминопропионамидо и 4-аминобутирамидо;
для /1-4C/алкиламино-/2-4C/алканоиламино: 2-метиламиноацетамидо, 2-этиламиноацетамидо, 2-пропиламиноацетамидо, 3-метиламинопропионамидо, 3-этиламинопропионамидо и 4-метиламинобутирамидо;
для ди-[/1-4C/алкил]амино-/2-4C/алканоиламино: 2-диметиламиноацетамидо, 2-/N-этил-N-метиламино/ацетамидо, 2-диэтиламиноацетамидо, 3-диметиламинопропионамидо, 3-диэтиламинопропионамидо и 4-диметиламинобутирамидо.
Если R1 представляет /1-3C/алкилендиокси, атомы кислорода в каждой такой группе занимают смежные положения в хиназолиновом кольце.
Приемлемые значения для заместителей, которые могут находиться в фенильном кольце, если R1 представляет бензамидо или бензолсульфонамидо, R2 представляет бензамидо, или в заместителе R1, который содержит анилино, фенокси или фенильную группу, включают, например;
для галогена: фтор, хлор и бром;
для /1-4C/алкила: метил, этил и пропил,
для /1-4C/алкокси: метокси, этокси и пропокси.
Приемлемым значением для R2, если он представляет галоген, является фтор, хлор, бром или йод, а если он представляет /2-4C/алканоил, таким значением является, например, ацетил, пропионил или бутирил.
Подходящей фармацевтически приемлемой солью производного хиназолина по настоящему изобретению является, например, соль присоединения кислоты производного хиназолина, которое является достаточно основным, образуемая неорганической кислотой, в частности хлористо-водородной, бромисто-водородной, серной, фосфорной, трифторуксусной, лимонной или малеиновой кислотой. Кроме того подходящую фармацевтически приемлемую кислоту производного хиназолина по настоящему изобретению, которое является достаточно кислотным, представляет соль щелочного металла, например, соль натрия или калия, соль щелочно-земельного металла, например, соль кальция или магния, соль аммония или соль, образуемая органическим основанием, которая позволяет получить физиологически приемлемый катион, в частности соль, образуемая метиламином, диметиламином, триметиламином, пиперидином, морфолином или трис-/2-гидроксиэтил/амином.
Определенные новые соединения по настоящему изобретению включают, например, производные хиназолина формулы I или их фармацевтически приемлемые соли с учетом вышеуказанных исключений, в которой;
(a) m означает 1 или 2 и R1 независимо от других элементов представляет гидрокси, /1-4C/алкоксикарбонил, /1-4C/алкил, /1-4C/алкокси или /1-3C/алкилендиокси; а n и R2 имеют значения, указанные выше или в этом разделе в отношении определенных новых соединений по настоящему изобретению:
(b) m означает 1 или 2 и R1 независимо от других элементов представляет гидрокси, амино, /1-4C/алкоксикарбонил, /1-4C/алкил, /1-4C/алкокси, /1-3C/алкилендиокси, галоген-/1-4C/алкил (за исключением трифторметила), /1-4C/алкиламино-/1-4C/алкил, ди-[/1-4C/алкил]амино-/1-4C/алкил, пиперидино-/1-4C/алкил, морфолино-/1-4C/алкил, пиперазин-1-ил-/1-4C/алкил, гидрокси-/2-4C/алкилтио-/1-4C/алкил, гидрокси-/2-4C/алкокси, /1-4C/алкокси-/2-4C/алкокси, /1-4C/алкоксикарбонил-/1-4C/алкокси, карбамоил-/1-4C/алкокси, /1-4C/алкиламино-/2-4C/алкокси, ди-[/1-4C/алкил]амино-/2-4C/алкокси, гидрокси-/2-4C/алкиламино, /1-4C/алкокси-/2-4C/алкиламино, /1-4C/алкиламино-/2-4C/алкиламино, ди-[/1-4C/алкил]амино-/2-4C/алкиламино, /2-4C/алканоиламино, гидрокси-/2-4C/алканоиламино или /1-4C/алкокси-/2-4C/алканоиламино; а n и R2 имеют значения, указанные выше или в этом разделе в отношении определенных новых соединений по настоящему изобретению
(c) m означает 1 или 2 и R1 независимо от других элементов представляет гидрокси, /1-4C/алкокси, /1-3C/алкилендиокси, гидрокси/2-4C/алкокси, /1-4C/алкокси-/2-4C/алкокси, /1-4C/алкоксикарбонил-/1-4C/алкокси, карбамоил-/1-4C/алкокси или ди-[/1-4C/алкил]амино-/2-4C/алкокси; а n и R2 имеют значения, указанные выше или в этом разделе в отношении определенных новых соединений по настоящему изобретению;
(d) m означает 1 или 2 и R1 независимо от других элементов представляет амино, гидрокси-/2-4C/алкиламино, /1-4C/алкокси-/2-4C/алкиламино, ди-[/1-4А/алкил] амино-/2-4C/алкиламино, /2-4C/алканоиламино, гидрокси-/2-4C/алканоиламино или /1-4C/алкокси-/2-4C/алканоиламино; а n и R2 имеют значения, указанные выше или в этом разделе в отношении определенных новых соединений по настоящему изобретению;
(e) m означает 1, 2 или 3 и R1 независимо от других элементов представляет гидрокси, амино, карбокси, уреидо, /1-4C/алкоксикарбонил, гидроксиамино, трифторметокси, /1-4C/алкил, /1-4C/алкокси, /1-3C/алкилендиокси, /1-4C/алкиламино, ди-[/1-4C/алкил] амино, пиперидин, морфолино, пиперазин-1-ил, 4-/1-4C/алкилпиперазин-1-ил, /1-4C/алкилтио, галоген-/1-4C/алкил (за исключением трифторметила), /1-4C/алкокси-/1-4C/алкил, /1-4C/алкиламино-/1-4C/алкил, ди-[/1-4C/алкил] амино-/1-4C/алкил, пиперидино-/1-4C/алкил, морфолино-/1-4C/алкил, пиперазин-1-ил-/1-4C/алкил, гидрокси-/2-4C/алкокси-/1-4C/алкил, /1-4C/алкокси-/2-4C/алкокси-/1-4C/алкил, /1-4C/алкилтио-/1-4C/алкил, гидрокси-/2-4C/алкилтио-/1-4C/алкил, анилино-/1-4C/алкил, фенилтио-/1-4C/алкил, циано-/1-4C/алкил, галоген-/2-4C/алкокси, гидрокси-/2-4C/алкокси, /1-4C/алкокси-/2-4C/алкокси, /1-4C/алкоксикарбонил-/1-4C/алкокси, карбамоил-/1-4C/алкокси, /1-4C/алкиламино-/2-4C/алкокси, ди-[/1-4C/алкил] амино-/2-4C/алкокси, /1-4C/алкокси-/2-4C/алканоилокси, фенил-/1-4C/алкокси, фенокси-/2-4C/алкокси, анилино-/2-4C/алкокси, пиперидино-/2-4C/алкокси, морфолино-/2-4C/алкокси, пиперазин-1-ил-/2-4C/алкокси, гидрокси-/2-4C/алкиламино, /1-4C/алкокси-/2-4C/алкиламино, /1-4C/алкиламино-/2-4C/алкиламино, ди-[/1-4C/алкил]амино-/2-4C/алкиламино, /2-4C/алканоиламино, бензамидо, 3-фенилуреидо, 2-оксопирролидин-1-ил, галоген-/2-4C/алканоиламино, гидрокси-/2-4C/алканоиламино, /1-4C/алкокси-/2-4C/алканоиламино или /1-4C/алкоксикарбонил-/2-4C/алканоиламино; а n и R2 имеют значения, указанные выше или в этом разделе в отношении определенных новых соединений по настоящему изобретению;
(f) m означает 1 или 2 и R1 независимо от других элементов представляет гидрокси, амино, уреидо, /1-4C/алкоксикарбонил, трифторметокси, /1-4C/алкил, /1-4C/алкокси, /1-3C/алкилендиокси, /1-4C/алкиламино, ди-[/1-4C/алкил]амино, пиперидино, морфолино, /1-4C/алкилтио, галоген-/1-4C/алкил (за исключением трифторметила), циано-/1-4C/алкил, галоген-/2-4C/алкокси, гидрокси-/2-4C/алкокси, /1-4C/алкокси-/2-4C/алкокси, карбамоил-/1-4C/алкокси, /1-4C/алкокси-/2-4C/алканоилокси, фенил-/1-4C/алкокси, анилино-/2-4C/алкокси, /1-4C/алкокси-/2-4C/алкиламино, /2-4C/алканоиламино, галоген-/2-4C/алканоиламино, 3-фенилуреидо, 2-оксопирролидин-1-ил или /1-4C/алкокси-/2-4C/алканоиламино; а n и R2 имеют значения, указанные выше или в этом разделе для определенных новых соединений по настоящему изобретению;
(g) n означает 1 или 2 и R2 независимо от других элементов представляет водород, галоген, трифторметил, нитро, циано, /1-4C/алкил, ди-[/1-4C/алкил] амино или /1-4C/алкилтио; а m и R1 имеют значения, указанные выше или в этом разделе для определенных новых соединений по настоящему изобретению;
(h) n означает 1 или 2 и R2 независимо от других элементов представляет галоген, трифторметил или /1-4C/алкил; а m и R1 имеют значения, указанные выше или в этом разделе для определенных новых соединений по настоящему изобретению, или
(i) n означает 1 или 2 и R2 независимо от других элементов представляет водород, гидрокси, галоген, трифторметил, амино, нитро, циано или /1-4C/алкил; а m и R1 имеют значения, указанные выше или в этом разделе для определенных новых соединений по настоящему изобретению.
Предпочтительным соединением по настоящему изобретению является производное хиназолина формулы I, в которой m означает 1 или 2 и R1 независимо от других элементов представляет гидрокси, метил, этил, метокси, этокси или метилендиокси;
n означает 1 и R2 представляет водород, фтор, хлор, бром, йод, метил или этил;
или его фармацевтически приемлемая соль присоединения кислоты; за исключением того, что в объем этого изобретения не входят 4-анилино-6-метилхиназолин или его хлористо-водородная соль и 4-анилино-6,7-диметоксихиназолин или его хлористо-водородная соль.
Другим предпочтительным соединением по настоящем изобретению является производное хиназолина формулы I, в которой (R1)m представляет 6-гидрокси, 7-гидрокси, 6,7-дигидрокси, 6-метил, 7-метил, 6-метокси, 7-метокси, 6,7-диметокси или 6,7-метилендиокси; и
(R2) n представляет 3'-хлор, 3'-бром или 3'-метил; или его фармацевтически приемлемая соль присоединения кислоты.
Особенно предпочтительным соединением по настоящему изобретению является следующее производное хиназолина формулы I или его фармацевтически приемлемая соль присоединения кислоты:
6,7-диметокси-4-/3'-метиланилино/хиназолин,
6,7-диметокси-4-/3'-хлоранилино/хиназолин,
6,7-диметокси-4-/3'-броманилино/хиназолин,
6,7-метилендиокси-4-/3'-метиланилино/хиназолин,
7-метокси-4-/3'-метиланилино/хиназолин,
7-гидрокси-4-/3'-метиланилино/хиназолин,
6-метил-4-/3'-метиланилино/хиназолин или
7-метоксикарбонил-4-/3'-метиланилино/хиназолин.
Еще одним предпочтительным соединением по настоящему изобретению является производное хиназолина формулы I, в которой m означает 1 или 2 и R1 независимо от других элементов означает гидрокси, амино, метоксикарбонил, этоксикарбонил, метил, этил, метокси, этокси, метилендиокси, дибромметил, диметиламинометил, пиперазин-1-илметил, 2-гидркосиэтилтиометил, 2-гидроксиэтокси, 3-гидроксипропокси, 2-метоксиэтокси, 2-этоксиэтокси, 3-метоксипропокси, 3-этоксипропокси, метоксикарбонилметокси, этоксикарбонилметокси, карбамоилметокси, 2-диметиламиноэтокси, 2-диэтиламиноэтокси, 2-гидроксиэтиламино, 3-гидроксипропиламино, 2-метоксиэтиламино, 2-этоксиэтиламино, 3-метоксипропиламино, 3-этоксипропиламино, 2-диметиламиноэтиламино, 2-диэтиламиноэтиламино, 3-диметиламинопропиламино, 3-диэтиламинопропиламино, ацетамидо, пропионамидо, 2-метоксиацетамидо или 2-этоксиацетамидо;
n означает 1 или 2 и R2 независимо от других элементов представляет фтор, хлор, бром, трифторметил, метил или этил;
или его фармацевтически приемлемая соль.
Еще одним предпочтительным соединением по настоящему изобретению является производное хиназолина формулы I, в которой (R1)m представляет 6-гидрокси, 7-гидрокси, 6,7-дигидрокси, 6-амино, 7-амино, 6-метил, 6,7-диметил, 7-метокси, 6,7-диметокси, 6-гидрокси-7-метокси, 7-гидрокси-6-метокси, 6,7-метилендиокси, 6-/2-гидроксиэтилтиометил/, 7-/2-гидроксиэтокси/-6-метокси, 6,7-ди-/2-гидроксиэтокси/, 6-метокси-7-/2-метоксиэтокси/, 7-карбамоилметокси-6-метокси, 7-/2-диметиламиноэтокси/-6-метокси, 6-/2-метоксиэтиламино/, 6-ацетамидо или 7-/2-метоксиацетамидо/, а (R2)n представляет 4'-фтор, 3'-хлор, 3'-бром, 3'-метил, 3'-трифторметил или 4'-фтор-3'-трифторметил; или его фармацевтически приемлемая соль присоединения кислоты.
Еще одним предпочтительным соединением по настоящему изобретению является производное хиназолина формулы I, в которой (R1)m представляет 6-амино, 7-амино, 6-/2-метоксиэтиламино/, 6-ацетамидо или 7-/2-метоксиацетамидо/, а (R2)n представляет 3'-хлор, 3'-метил или 3'-трифторметил;
или его фармацевтически приемлемая соль присоединения кислоты.
Еще одним особенно предпочтительным соединением по настоящему изобретению является следующее производное хиназолина формулы I или его фармацевтически приемлемая соль присоединения кислоты:
6,7-диметокси-4-/3'-трифторметиланилино/хиназолин,
6-гидрокси-7-метокси-4-/3'-метиланилино/хиназолин,
7-гидрокси-6-метокси-4-/3'-метиланилино/хиназолин,
7-амино-4-/3'-метиланилино/хиназолин,
6-амино-4-/3'-метиланилино/хиназолин,
6-амино-/4-/3'-хлоранилино/хиназолин,
6-ацетамидо-/4-/3'-метиланилино/хиназолин,
6-/2-метоксиэтиламино/-4-/3'-метиланилино/хиназолин,
7-/2-метоксиацетамидо/-4-/3'-метиланилино/хиназолин,
7-/2-гидроксиэтокси/-6-метокси-4-/3'-метиланилино/хиназолин или 7-/2-метоксиэтокси/-6-метокси-4-/3'-метиланилино/хиназолин.
Еще одним предпочтительным соединением по настоящему изобретению является производное хиназолина формулы I, в которой m означает 1, 2 или 3 и R1 независимо от других элементов представляет гидрокси, амино, уреидо, метоксикарбонил, этоксикарбонил, гидроксиамино, трифторметокси, метил, этил, метокси, этокси, пропокси, изопропокси, бутокси, метилендиокси, этилендиокси, метиламино, этиламино, диметиламино, диэтиламино, пиперидино, морфолино, метилтио, этилтио, бромметил, дибромметил, метоксиметил, пиперидинометил, морфолинометил, пиперазин-1-илметил, метоксиэтоксиметил, метилтиометил, 2-гидроксиэтилтиометил, анилинометил, фенилтиометил, цианометил, 2-бромэтокси, 2-гидроксиэтокси, 3-гидроксипропокси, 2-метоксиэтокси, 2-этоксиэтокси, 3-метоксипропокси, 3-этоксипропокси, метоксикарбонилметокси, этоксикарбонилметокси, карбамоилметокси, 2-диметиламиноэтокси, 2-диэтиламиноэтокси, 2-метоксиацетокси, бензилокси, 2-анилиноэтокси, 2-пиперидиноэтокси, 2-морфолиноэтокси, 2-/пиперазин-1-ил/этокси, 2-гидроксиэтиламино, 3-гидроксипропиламино, 2-метоксиэтиламино, 2-этоксиэтиламино, 3-метоксипропиламино, 3-этоксипропиламино, 2-диметиламиноэтиламино, 2-диэтиламиноэтиламино, 3-диметиламинопропиламино, 3-диэтиламинопропиламино, ацетамидо, пропионамидо, бензамидо, 3-фенилуреидо, 2-хлорацетамидо, 2-оксопирролидин-1-ил, 2-гидроксиацетамидо, 2-метоксиацетамидо или 2-этоксиацетамидо;
n означает 1 или 2 и R2 независимо от других элементов представляет водород, фтор, хлор, бром, трифторметил, нитро, циано, метил или этил;
или его фармацевтически приемлемая соль.
Еще одним предпочтительным соединением по настоящему изобретению является производное хиназолина формулы I, в которой (R1)m представляет 6-гидрокси, 7-гидрокси, 6,7-дигидрокси, 6-амино, 7-амино, 6-уреидо, 6-трифторметокси, 6-метил, 6,7-диметил, 6-метокси, 7-метокси, 6,7-диметокси, 6,7-диэтокси, 6-гидрокси-7-метокси, 7-гидрокси-6-метокси, 6-амино-7-метокси, 6-амино-7-метилтио, 5-амино-6,7-диметокси, 6-метокси-7-изопропокси, 6,7-метилендиокси, 6,7-этилендиокси, 6-диметиламино, 6-метоксиметил, 6-/2-метоксиэтоксиметил/, 6-цианометил, 7-/2-гидроксиэтокси/-6-метокси, 6,7-ди-/2-гидроксиэтокси/, 6-/2-метоксиэтокси/, 6-метокси-7-/2-метоксиэтокси/, 6,7-ди-/2-метоксиэтокси/, 7-/2-бромэтокси/-6-метокси, 7-бензилокси-6-метокси, 6-/2-метоксиэтиламино/, 6-ацетамидо, 6-/2-хлорацетамидо/, 6-/2-метоксиацетамидо/ или 7-/2-метоксиацетамидо/, и (R2)n, представляет водород, 4'-фтор, 3'-хлор, 3'-бром, 3', 4'-дихлор, 4'-фтор-3'-хлор, 3'-трифторметил, 4'-фтор-3'-трифторметил, 3'-нитро, 3'-нитро-4'-хлор, 3'-нитро-4'-фтор или 3'-метил; или его фармацевтически приемлемая соль присоединения кислоты.
Еще одним особенно предпочтительным соединением по настоящему изобретению является следующее производное хиназолина формулы I или его фармацевтически приемлемая соль присоединения кислоты:
4-/3'-хлор-4'-фторанилино/-6,7-диметоксихиназолин,
4-/3',4'-дихлоранилино/-6,7-диметоксихиназолин,
6,7-диметокси-4-/3'-нитроанилино/хиназолин,
6,7-диэтокси-4-/3'метиланилино/хиназолин,
6-метокси-4-/3'-метиланилино/хиназолин,
4-/3'-хлоранилино/-6-метоксихиназолин,
6,7-этилендиокси-4-/3'-метиланилино/хиназолин,
6-амино-7-метокси-4-/3'-метиланилино/хиназолин,
4-/3'-метиланилино/-6-уреидохиназолин или
6-/2-метоксиэтоксиметил/-4-/3'-метиланилино/хиназолин.
Еще одним предпочтительным соединением по настоящему изобретению является производное хиназолина формулы I, в которой (R1)m представляет 6-гидрокси, 7-гидрокси, 6,7-дигидрокси, 6-амино, 7-амино, 6-уреидо, 6-трифторметокси, 6-метил, 6,7-диметил, 6-метокси, 7-метокси, 6,7-диметокси, 6,7-диэтокси, 6-гидрокси-7-метокси, 7-гидрокси-6-метокси, 6-амино-7-метокси, 6-амино-7-метилтио, 5-амино-6,7-диметокси, 6-метокси-7-изопропокси, 6,7-метилендиокси, 6,7-этилендиокси, 6-метиламино, 7-метиламино, 6-диметиламино, 6-амино-7-метиламино, 6-метоксиметил, 6-бромметил, 6-/2-метоксиэтоксиметил/, 6-цианометил, 6-метилтиометил, 6-фенилтиометил, 7-/2-гидроксиэтокси/-6-метокси, 6,7-ди/2-гидроксиэтокси/, 6-/2-бромэтокси/, 6-/2-метоксиэтокси/, 6-метокси-7-/2-метоксиэтокси/, 6,7-ди-/2-метоксиэтокси/, 7-/2-бромэтокси/-6-метокси, 7-бензилокси-6-метокси, 6-/2-метоксиэтиламино/, 6-ацетамидо, 6-бензамидо. 6-/2-хлорацетамидо/, 6-/2-метоксиацетамидо/ или 7-/2-метоксиацетамидо/, и (R2)n представляет водород, 4'-фтор, 3'-хлор, 3'-бром, 3',4'-дихлор, 4'-фтор-3'-хлор, 3'-трифторметил, 4'-фтор-3'-трифторметил, 3'-нитро, 3'-нитро-4'-хлор, 3'-нитро-4'-фтор или 3'-метил;
или его фармацевтически приемлемая соль присоединения кислоты.
Еще одним особенно предпочтительным соединением по настоящему изобретению является следующее производное хиназолина формулы I или его фармацевтически приемлемая соль присоединения кислоты:
6,7-ди-/2-метоксиэтокси/-4-/3'-метиланилино/хиназолин,
6-диметиламино-4-/3'-метиланилино/хиназолин или
6-бензамидо-4-/3'-метиланилино/хиназолин.
Производное хиназолина формулы I или его фармацевтически приемлемую соль можно получить с помощью любого известного способа, предназначенного для получения соединений, имеющих аналогичную химическую структуру. Приемлемый способ, например, рассматривается в заявке на патент Великобритании N 2033894. Способы, используемые для получения производного хиназолина формулы I или его фармацевтически приемлемой соли, представляют еще один аспект настоящего изобретения и иллюстрируются следующими примерами, в которых, если нет специального указания, R1, m, n и R2 имеют значения указанные выше для производного хиназолина формулы I. Необходимые исходные материалы можно получить с помощью стандартных методов органический химии. Получение таких исходных материалов описывается в прилагаемых примерах, не ограничивающих объем изобретения. Альтернативно необходимые исходные материалы можно получить в соответствии с процедурами, которые аналогичны рассматриваемым в этой заявке и хорошо известны специалисту в области органической химии.
(a) Взаимодействие хиназолина формулы (III) приводимой ниже), в которой Z представляет замещаемую группу, с анилином формулы IV в присутствии приемлемого основания.
Приемлемой замещаемой группой Z является, например, галоген, алкокси, арилокси или сульфонилоксигруппа, в частности хлор, бром, метокси, фенокси, метансульфонилокси или толуол-парасульфонилокси-группа.
Приемлемым основанием является, например, органическое аминовое основание, такое как пиридин, 2,6-лутидин, коллидин, 4-диметиламинопиридин, триэтиламин, морфолин, N-метилморфолин или диазабицикло-[5.4.0]унден-7-ен либо карбонат или гидроксид щелочного или щелочно-земельного металла, например, карбонат натрия, карбонат калия, карбонат кальция, гидроксид натрия или гидроксид калия.
Эта реакция предпочтительно осуществляется в присутствии приемлемого инертного растворителя или разбавителя, например, алканола или сложного эфира, такого как метанол, этанол, изопропанол или этилацетат, галогенированный растворитель, в частности метиленхлорид, хлороформ или тетрахлорметан, простой эфир, такой как тетрагидрофуран или 1,4-диоксан, ароматический растворитель, такой как толуол, или биполярный апротонный растворитель, такой как N,N-диметилформамид, N,N-диметилацетамид, N-метилпирролидин-2-он или диметилсульфоксид. Эта реакция обычно осуществляется при температуре в интервале от 10 до 150oC, предпочтительно в интервале от 20 до 80oC.
В результате выполнения этого способа производное хиназолина формулы I можно получить в виде свободного основания или альтернативно в виде соли, образуемой кислотой формулы H-Z, в которой Z имеет указанное выше значение. При необходимости получения свободного основания из соли эту соль можно обработать приемлемым основанием, указанным выше, с использованием известного метода.
(b) Для получения соединений формулы I, в которой R1 или R2 представляет собой гидрокси, производится расщепление производного хиназолина формулы I, в которой R1 или R2 представляет /1-4C/алкокси.
Реакция расщепления может осуществляться с помощью любого из многочисленных методов, предназначенных для этой цели. Эта реакция может осуществляться путем обработки производного хиназолина (1-4C/алкилсульфидом щелочного металла, таким как этантиолат натрия, или диарилфосфидом щелочного металла, таким как дифенилфосфид лития. Альтернативно реакция расщепления может осуществляться путем обработки производного хиназолина тригалогенидом бора или алюминия, таким как трибромид бора. Такие реакции предпочтительно осуществляются в присутствии приемлемого инертного растворителя или разбавителя, указанного выше, и при соответствующей температуре, приведенной в прилагаемых примерах.
(c) Для получения соединений формулы I, в которой R1 или R2 представляет /1-4C/алкилсульфинильную или /1-4C/алкилсульфонильную группу, производится окисление производного хиназолина формулы I, в которой R1 или R2 представляет /1-4C/алкилтиогруппу.
Приемлемым окислителем является любое вещество, применяемое для окисления тиогруппы в сульфинил и/или сульфонил, например, перекись водорода, перкислота (например, 3-хлорпероксибензойная или пероксиуксусная кислота), пероксисульфат щелочного металла (например, пероксимоносульфат калия), триоксид хрома или газообразный кислород в присутствии платины. Окисление обычно производится в мягких условиях при использовании необходимого стехиометрического количества окислителя с целью уменьшения вероятности чрезмерного окисления и разрушения других функциональных групп. Эта реакция обычно осуществляется в приемлемом растворителе или разбавителе, таком как метиленхлорид, хлороформ, ацетон, тетрагидрофуран или трет-бутилметиловый эфир, при температуре в интервале от -25 до 50oC, обычно при температуре окружающей среды, то есть в интервале от 15 до 35oC. При необходимости получения соединения, содержащего сульфинильную группу, также можно использовать более слабый окислитель, например, метапериодат натрия или калия, обычно в полярном растворителе, таком как уксусная кислота или этанол. При необходимости получения соединения формулы I, содержащего /1-4C/алкилсульфонильную группу, его можно получить путем окисления соответствующего /1-4C/алкилсульфинильного соединения, а также соответствующего /1-4C/алкилтиосоединения.
(d) Для получения соединений формулы 1, в которой R1 представляет амино, производят восстановление производного хиназолина формулы I, в которой R1 представляет собой нитро.
Восстановление может производиться с помощью любого из многочисленных методов, предназначенных для этой цели. Восстановление может осуществляться путем гидрогенизации раствора нитросоединения в инертном растворителе или разбавителе, указанном выше, в присутствии соответствующего металлического катализатора, такого как палладий или платина. Другим приемлемым восстановителем является активированный металл, например, активированное железо (получаемое путем промывки железного порошка) разбавленным раствором такой кислоты, как хлористо-водородная кислота). Таким образом, восстановление может производиться путем нагрева смеси нитросоединения и активированного металла в приемлемом растворе или разбавителе, таком как смесь воды и спирта, например, метанола или этанола, до температуры в интервале от 50 и 150oC, обычно при температуре около 70oC.
(e) Для получения соединений формулы I, в которой R1 представляет /2-4C/алканоиламино или замещенную /2-4C/алканоиламиногруппу, уреидо, 3-фенилуреидо или бензамидо, либо R2 представляет ацетамидо или бензамидо, производят ацилирование производного хиназолина формулы I, в которой R1 или R2 представляет аминогруппу.
Приемлемым ацилирующим агентом является любое вещество, предназначенное для ацилирования аминогруппы в ациламиногруппу, например, ацилгалогенид, в частности /2-4C/алканоилхлорид или бромид, либо бензоилхлорид или бромид, обычно в присутствии приемлемого основания, указанного выше, ангидрида алкановой кислоты или смешанного ангидрида, например, ангидрида /2-4C/алкановой кислоты, такого как уксусный ангидрид или смешанный ангидрид, получаемый в результате взаимодействия алкановой кислоты с /1-4C/алкоксикарбонилгалогенидом, например, /1-4C/алкоксикарбонилхлоридом, в присутствии приемлемого основания, указанного выше. Для получения соединений формулы I, в которой R1 представляет уреидо или 3-фенилуреидо, используется соответствующий ацилирующий агент, например, цианат, такой как цианат щелочного металла, в частности цианат натрия, или изоцианат, такой как фенилизоцианат. Ацилирование обычно производится в приемлемом инертном растворителе или разбавителе, указанном выше, при температуре в интервале от -30 до 120oC, обычно при температуре окружающей среды.
(f) Для получения соединений формулы I, в которой R1 представляет /1-4C/алкокси или замещенный /1-4C/алкокси либо R1 представляет /1-4C/алкиламино или замещенную /1-4C/алкиламиногруппу, производят алкилирование производного хиназолина формулы I, в которой F1 представляет гидрокси или аминогруппу, предпочтительно в присутствии приемлемого основания, указанного выше.
Приемлемым алкилирующим агентом является любое вещество, предназначенное для алкилирования гидроксильной группы в алкоксильную группу или замещенную алкоксильную группу либо для алкилирования аминогруппы в алкиламиногруппу или замещенную алкиламиногруппу, например, в алкилгалогенид или замещенный алкилгалогенид, в частности в /1-4C/алкилхлорид, бромид или йодид или в замещенный /1-4C/алкилхлорид, бромид или йодид, в присутствии приемлемого основания, указанного выше, в приемлемом инертном растворителе или разбавителе, указанном выше, при температуре в интервале от 10 до 140oC, обычно при температуре окружающей среды.
(g) Для получения соединений формулы I, в которой R1 представляет карбоксильный заместитель или заместитель, включающий карбоксильную группу, производят гидролиз производного хиназолина формулы I, в которой R1 представляет /1-4C/алкоксикарбонильный заместитель или заместитель, включающий /1-4C/алкоксикарбонильную группу.
Гидролиз может производиться в щелочных условиях, рассматриваемых в прилагаемых примерах.
(h) Для получения соединений формулы I, в которой R1 представляет амино-, окси-, тио- или цианозамещенный /1-4C/алкильный заместитель производится взаимодействие производного хиназолина формулы I, в которой R1 представляет /1-4C/алкильный заместитель, включающий замещаемую группу, указанную выше, с соответствующим амином, спиртом, тиолом или цианидом, предпочтительно в присутствии приемлемого основания, указанного выше.
Эта реакция предпочтительно осуществляется в приемлемом инертном растворителе или разбавителе, указанном выше, при температуре в интервале от 10 до 100oC, обычно при температуре окружающей среды.
При необходимости получения фармацевтически приемлемой соли производного хиназолина формулы I производят взаимодействии указанного соединения с приемлемой кислотой в соответствии с известной процедурой.
Многие указанные здесь промежуточные соединения являются новыми, например, соединения формулы II и представляют еще один аспект настоящего изобретения. Кроме того некоторые исходные материалы, предназначенные для использования в варианте способа (d), описанном выше, а именно соединения формулы I, в которой m означает 2 или 3 и одна из групп R1 представляет нитро, являются не только новыми, но и активными ингибиторами тирозинкиназы рецепторов. Поэтому эти соединения составляют еще один аспект настоящего изобретения.
Как указывалось выше, производное хиназолина по настоящему изобретению обладает противораковым действием, которое является следствием ингибирующей активности этого соединения в отношении тирозинциназы рецепторов. Эти свойства можно определить с помощью одного или несколько методов, представленных ниже:
(a) Лабораторный анализ, позволяющий определить способность испытуемого соединения в отношении ингибирования тирозинкиназы рецепторов. Тирозинкиназу рецепторов получали в частично очищенном виде из клеток A-431 (выделенных из раковой опухоли наружных женских половых органов) с помощью методов, описанных Карпентером и др., J. Biol. Chem. 1979, 254, 4884, Кохеном и др., J. Biol, Chem. , 1982, 257, 1523 и Брауном и др., J. Biol, Chem., 1984, 259, 2051.
Клетки A-431 выращивали до их слияния в модифицированной по способу Дульбекко среде Игла (DMEM), содержащей 5% фетальной телячьей сыворотки (FCS). Полученные клетки гомогенизировали в гипотоническом буфере, содержащем борат и этилендиаминтетрауксусную кислоту, с pH 10,1. Гомогенат центрифугировали с градиентом 400 в течение 10 минут при температуре 0-4oC. Надосадочную жидкость центрифугировали с градиентом, равным 25000, в течение 30 минут при температуре 0-4oC. Осажденный материал суспендировали в 30 ммолях буфера Гепеса с pH 7,4, содержащего 5% глицерина, 4 ммоля бензамидина и 1% тритона X-100, перемешивали в течение 1 часа при температуре 0-4oC и вновь центрифугировали с градиентом, равным 100000, в течение 1 часа при температуре 0-4oC. Надосадочную жидкость, содержащую тирозинкиназу рецепторов в растворенном виде, хранили в жидком азоте.
При проведении испытания 40 мкл полученного таким образом раствора фермента добавляли к 400 мкл смеси, содержащей 150 ммолей буфера Гепеса с pH 7,4, 500 мкмолей ортованадата натрия, 0,1% тритона X-100, 10% глицерина, 200 мкл воды, 80 мкл 25 ммолей дитиотреитола и 80 мкл смеси 12,5 ммолей хлорида марганца, 125 ммолей хлорида магния и дистиллированной воды. Таким образом получали раствор фермента, предназначенный для испытания.
Каждое испытуемое соединение растворяли в диметилсульфоксиде (DMSO), в результате чего было получено 50 ммолей раствора, который разбавляли 50 ммолями буфера Гепеса, содержащего 0,1% тритона X-100, 10% глицерина и 10% диметилсульфоксида, с образованием 500 мкмолей раствора. Смешивали равные объемы этого раствора и раствора фактора роста эпидермиса (EGF, 20 мкг/мл).
[γ- 32P]ATP /3000 Ci/ммоль, 250 мк Ci/ разбавляли до объема, равно 2 мл, путем добавления раствора аденозин-5'-трифосфата (100 мкмолей) в дистиллированной воде. Добавляли равный объем 4 мг/мл раствора пептида Arg-Arg-Leu-IIe-Glu-ASp-AIa-GIu-Tyr-AIa-AIa-Arg-GIy в смеси 40 ммолей буфера Гепеса с pH 7,4, 0,1% тритона X-100 и 10% глицерина.
Раствор смеси испытуемого соединения и фактора роста эпидермиса (5 мкл) добавляли к раствору фермента (10 мкл) и инкубировали полученную смесь при температуре 0-4oC в течение 30 минут. Добавляли смесь аденозин-5'-трифосфата (ATP) и пептида (10 мкл), после чего инкубировали полученную смесь при температуре 25oC в течение 10 минут. Реакцию фосфорилирования завершали путем добавления 5% трихлоруксусной кислоты (40 мкл) и бычьего сывороточного альбумина (BSA; 1 мг/мл, 5 мкл). Эту смесь оставляли для выставления в течение 30 минут при температуре 4oC, а затем центрифугировали. Аликвоту (40 мкл) надосадочной жидкости помещали на полоску фосфоцеллюлозной бумаги "Ватман p 81". Эту полоску промывали в 75 ммолях фосфорной кислоты (4x10 мл) и промокали до сухого состояния. Радиоактивность фильтровальной бумаги измеряли при помощи жидкостного сцинтилляционного счетчика (последовательность A). Последовательность реакции повторяли при отсутствии фактора роста эпителия (последовательность B) и еще раз при отсутствии испытуемого соединения (последовательность реакции C).
Ингибирование тирозинкиназы (RTK) рецепторов высчитывали следующим образом: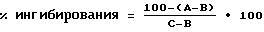
Степень ингибирования затем определяли в зависимости от концентраций испытуемого соединения с целью установления концентрации 50% ингибирования (IC50 мM).
(b) Лабораторный анализ, позволяющий определить способность испытуемого соединения в отношении ингибирования роста клеток носоглоточной раковой опухоли линии KB.
Клетки KB высевали в лунки с плотностью 1•104-1,5•104 клеток на лунку и выращивали в течение 24 часов в модифицированной по способу Дульбекко среде Игла с добавлением 5% фетальной телячьей сыворотки (на полосках из древесного угля). Рост клеток определяли после инкубирования в течение 3 дней по степени метаболизма тетразолиевого красителя МТТ с образованием голубоватой окраски. Затем рост клеток определяли в присутствии фактора роста эпидермиса (100 нг/мл) или в присутствии фактора роста эпидермиса (100 нг/мл) и испытуемого соединения при использовании различных концентраций. Затем высчитывали значение концентрации 50% ингибирования (IC50).
(c) Анализ в живом организме, производимый в отношении группы самцов крыс, который позволяет определить способность испытуемого соединения (обычно вводимого перорально в виде измельченной в шаровой мельнице суспензии в 0,5% полисорбате) ингибировать рост гепатоцита вызываемого введением фактора роста TGFa (вводимого подкожно в количестве 400 мг/кг обычно два раза через 3 и 7 часов после введения испытуемого соединения).
В контрольной группе крыс введение TGFa вызывало в среднем 5-кратную стимуляцию роста репатоцита.
Роста клеток у контрольных и подопытных животных определяли следующим образом.
На следующее утро после введения испытуемого соединения (или 0,5% полисорбата в контрольной группе) животным вводили бромдеоксиуридин (BrdU; интраперитонеально в количестве 100 мг/кг). Через четыре часа животных умерщвляли и удаляли у них печень. Делали срезы каждой печени и определяли поглощение BrdU с помощью обычного иммуногистохимического метода, аналогичного методу, описанному на страницах 267 и 268 статьи Голдсуорти и др. в книге "Пролиферация клеток, вызываемая химическим путем: Оценка факторов риска", Вилей-Лисс инк. 1991, страницы 253-284.
Последующие испытания производили при использовании различных доз испытуемых соединений с целью определения дозы агента, приводящей к 50%-ному эффекту. (ED50) при ингибировании пролиферации гепатоцита, исходя из исследования замедления поглощения BrdU.
Хотя фармакологические свойства соединений формулы 1 изменяются в зависимости от изменения структуры, активность, присущую соединениям формулы I, можно продемонстрировать при следующих концентрациях или дозах в результате выполнения одного или нескольких представленных выше испытаний (а), (b) и (c);
Испытание (а): IC50 достигается в интервале дозирования 0,0005- 1 мкМ
Испытание (b): IC50 достигается в интервале дозирования 0,01-10 мкМ
Испытание (с): ED50 достигается в интервале дозирования 1-100 мг/кг
Так, например, для 6,7-диметокси-4-/3'-метиланилино/-хиназолина было получено значение IC50, равное 0,005 ммкмоля, в испытании (а), значение IC50, равное 0,05 мкмоля, в испытании (b) и значение ED50 < 5 мг/кг в испытании (c); для 6,7-диметокси-4-/3'-трифторметиланилино/хиназолина было получено значение IC50, равное 0,01 мкмоля, в испытании (а) и значение IC50, равное 0,3 мкмоля, в испытании (b); для 6-амино-4-/3'-метиланилино/хиназолина было получено значение IC50, равное 0,055 мкмоля, в испытании (а), значение IC50, равное 1 мкмолю, в испытании (b) и значение ED50 < 5 мг/кг в испытании (c); для 6-ацетамидо-4-/3'-метиланилино/хиназолина было получено значение IC50, равное 0,01 мкмоля, в испытании (а) и значение IC50, равное 0,65 мкмоля, в испытании (b); для 7-/2-гидроксиэтокси/6-метокси-4-/3'-метиланилино/ хиназолина было получено значение IC50, равное 0,005 мкмоля, в испытании (а) и значение IC50, равное 0,14 мкмоля, в испытании (b).
Как указывалось выше, соединение 4-анилино-6,7-диметоксихиназолина является известным и обладает бронхолитическими и-или гипотензивными свойствами. Нет указания на то, что другие производные хиназолина, исключенные из объема настоящего изобретения, обладают фармакологическими свойствами.
В соответствии с еще одним аспектом настоящего изобретения предусматривается фармацевтический состав, включающий производное хиназолина формулы I или его фармацевтически приемлемую соль, указанные выше, или производное хиназолина, выбираемое из 4-/4'-гидроксианилино/-6-метоксихиназолина, 4-/4'-гидроксианилино/-6,7-метилендиоксихиназолина, 4-/4'-гидроксианилино/-6,7-метилендиоксихиназолина, 4-/4'-гидроксианилино/-6,7,8-триметоксихиназолина, 6-амино-4-/4'-аминоанилино/хиназолина и 4-анилино-6-метилхиназолина или его хлористо-водородной соли, вместе с фармацевтически приемлемым разбавителем или носителем.
Этот состав может иметь форму, приемлемую для перорального введения, например, в виде таблетки или капсулы, для парентерального введения (включающего внутривенные, подкожные, внутримышечные, интраваскулярные инъекции или вливания) в виде стерильного раствора, суспензии или эмульсии, для местного применения в виде мази или крема или для ректального введения в виде суппозитория.
Вышеуказанные составы можно изготовить известными способами с использованием обычных наполнителей.
Хиназолин обычно вводят теплокровному животному в виде унифицированной дозы, составляющей 5-5000 мг на кв. метр площади тела указанного животного, то есть примерно 0,1-100 мг/кг, и это количество обычно представляет терапевтически эффективную дозу. Унифицированная лекарственная форма, такая как таблетка или капсула, обычно содержит 1-250 мг активного ингредиента. Предпочтение отдается суточной дозе, составляющей 1-50 мг/кг. Однако суточная доза обычно изменяется в зависимости от состояния больного, способа введения и серьезности заболевания, подлежащего лечению. Оптимальная доза определяется лечащим врачом.
Еще одним аспектом настоящего изобретения предусматривается производное хиназолина формулы I, указанное выше, которое предназначено для лечения человека или животного лекарственными методами.
Мы установили, что соединения по настоящему изобретению и соединения, исключенные из объема настоящего изобретения, обладают противораковыми свойствами, которые являются результатом ингибирующего действия в отношении тирозинкиназы рецепторов.
В соответствии с этим аспектом настоящего изобретения предусматривается использование производного хиназолина формулы I или его фармацевтически приемлемой соли, указанных выше, или производного хиназолина, выбираемого из 4-/4'-гидроксианилино/-6-метоксихиназолина, 4-/4'-гидроксианилино/-6,7-метилендиоксихиназолина, 4-/4'-гидроксианилино/-6,7,8-триметоксихиназолина, 6-амино-4-/4'-аминоанилино/-хиназолина, 4-анилино-6-метилхиназолина или его хлористо-водородной соли, для изготовления лекарственного средства, предназначенного для лечения рака у такого теплокровного животного, как человек.
В соответствии с еще одним аспектом настоящего изобретения предусматривается способ достижения противоракового действия у теплокровного животного, такого как человек, нуждающегося в таком лечении, который включает введение указанному животному эффективного количества производного хиназолина, указанного выше,
Как указывалось выше, величина дозы, необходимой для предупреждения или лечения определенного ракового заболевания, будет изменяться в зависимости от состояния больного, способа выделения и серьезности заболевания. Унифицированная доза обычно составляет 1-100 мг/кг, предпочтительно 1-50 мг/кг.
Лечение ракового заболевания, рассмотренное выше, может производиться только производным хиназолина по настоящему изобретению или может дополнительно включать применение одного или нескольких других противораковых средств, которые представляют, например, митотические ингибиторы, в частности, винбластин; алкилирующие средства, в частности цис-платин, карбоплатин и циклофосфамид; антиметаболиты, в частности 5-фторурацил, цитозинарабинозид и гидроксимочевина, или один из предпочтительных антиметаболитов, рассматриваемых в заявке на Европейский патент N 239362, такой как N-{5-[N-/3,4-дигидро-2-метил-4-оксохиназолин-6-илметил/-N-метиламино -2-теноил}-L-глутаминовая кислота; интеркалирующие антибиотики, такие как адриамицин и блеомицин; ферменты, например, аспарагиназу; ингибиторы топоизомеразы, в частности этопозид; модификаторы биологической реакции, например интерферон; и антигормоны, например антиэстрогены, такие как "НОЛВАДЕКС" (тамоксифен), или антиандрогены, такие как "КАЗОДЕКС" /4'-циано-3-/4-фторфенилсульфонил/-2-гидрокси-2-метил-3' -/трифторметил/пропионанилид/. Совместное лечение может производиться путем одновременного, последовательного или раздельного введения отдельных лекарственных средств, используемых для лечения. В соответствии с этим аспектом настоящего изобретения предусматривается фармацевтическое средство, включающее производное хиназолина формулы I, указанное выше, или производное хиназолина, выбираемое из 4-/4'-гидроксианилино/-6-метоксихиназолина, 4-/4'-гидроксианилино/-6,7-метилендиоксихиназолина, 6-амино-4-/4'-аминоанилино/хиназолина, 4-анилино-6-метилхиназолина или его хлористо-водородной соли и 4-аналино-6,7-диметоксихиназолина или его хлористо-водородной соли, и дополнительное противораковое средство, указанное выше, для совместного лечения ракового заболевания.
Как указывалось выше, производное хиназолина по настоящему изобретению является эффективным противораковым средством, активность которого является следствием ингибирующего действия в отношении тирозинкиназы рецепторов. Считается, что производное хиназолина по настоящему изобретению обладает широким диапазоном противораковых свойств, так как тирозинкиназа рецепторов имеет непосредственное отношение ко многим раковым заболеваниям, таким как лейкоз, рак молочной железы, легкого, толстой кишки, прямой кишки, желудка, предстательной железы, мочевого пузыря, поджелудочной железы и яичника. Таким образом, предполагается, что производное хиназолина по настоящему изобретению будет обладать противораковой активностью в отношении этих раковых заболеваний. Кроме того ожидается, что хиназолин по настоящему изобретению обладает активностью в отношении ряда лейкозов, злокачественных лимфоматозов и плотных опухолей, таких как карциномы и саркомы в таких тканях, как печень, почка, предстательная железа и поджелудочная железа.
Настоящее изобретение далее иллюстрируется следующими примерами, не ограничивающими объем изобретения, в которых, если нет специального указания:
(1) выпаривания производили путем ротационного выпаривания в условиях вакуума, а обработку выполняли после удаления остаточных твердых веществ, таких как осушители, посредством фильтрования;
(II) все операции выполняли при температуре окружающей среды, то есть в интервале от 18 до 25oC, в атмосфере такого инертного газа как аргон;
(III) хроматографию на колонках (в соответствии с испарительным методом) и жидкостную хроматографию среднего давления (MPLC) выполняли на силикагеле "Мерк Кизельгель" (N 9385) или на силикагеле с обращенной фазой "Мерк ликропреп RP-18" (N 9303), представленном фирмой Е.Мерк, Дарштадт, Германия;
(IV) величины выхода приведены только для иллюстрации и необязательно представляют максимальные значения;
(V) температуры плавления не корректировались и определялись с помощью прибора для автоматического измерения температуры плавления "Меттлер SP62", прибора с масляной баней или прибора с нагревательной пластиной Коффлера;
(VI) структуры конечных продуктов формулы I определяли с помощью спектроскопии ядерного магнитного резонанса (ЯМР) (обычно протонного) и масс-спектрометрии; величины химического сдвига для спектроскопии протонного магнитного резонанса измеряли по δ -шкале химических сдвигов мультиплетность пиков показывали следующим образом: с., синглет; д., дублет; т., триплет; м. , мультиплет;
(VII) промежуточные соединения полностью не характеризовались и их чистоту определяли с помощью тонкослойной хроматографии (TLC), анализа методом инфракрасной спектроскопии (IR) или ядерного магнитного резонанса;
(VIII) использовались следующие сокращения:
DMF N,N-диметилформамид,
DMA N,N-диметилацетамид,
THF тетрагидрофуран.
Пример 1.
Смесь 4-хлор-6,7-диметоксихиназолина (0,3 г) 3-метиланилина (0,143 г) и изопропанола (5 мл) перемешивали и нагревали до температуры кипения с обратным холодильником в течение 1 ч. Полученную смесь охлаждали до температуры окружающей среды. Осадок отфильтровывали и промывали холодильным изопропанолом и простым диэтиловым эфиром. Таким образом была получена хлористо-водородная соль 6,7-диметокси-4-/3'-метиланилино/хиназолина (0,226 г, 51%), температура плавления 248-249oC.
Спектр ЯМР: (CD3SOCD3) 2,36(с, 3H), 3,99(с, 3H), 4,02(с, 3H), 7,13(д, 1H), 7,38(с, 1H), 7,39(т, 1H), 7,49(с, 2H), 8,34(с, 1H), 8,80(с, 1H).
Элементный анализ:
обнаружено: C 61,4, H 5,4, N 12,5
высчитано для C17H13N3O2 • HCl: C 61,4, H 5,4; N 12,7%
4-Хлор-6,7-диметоксихиназолин, используемый в качестве исходного материала, получали следующим образом:
Смесь 4,5-диметоксиантраниловой кислоты (19,7 г) и формамида (10 мл) перемешивали и нагревали до температуры 190oC в течение 5 часов. Эту смесь охлаждали до 80oC добавляли воду (50 мл). Полученную смесь выдерживали при температуре окружающей среды в течение 3 часов. Осадок отделяли, промывали водой и сушили. Таким образом был получен 6,7-диметоксихиназолин-4-он (3,65 г).
Смесь порции (2,06 г) материала, полученного таким образом, тионилхлорида (20 мл) и N,N-диметилформамида (1 капля) перемешивали и нагревали до температуры кипения с обратным холодильником в течение 2 часов. Полученную смесь выпаривали, а остаток распределяли между этилацетатом и насыщенным водным раствором бикарбоната натрия. Органическую фазу промывали водой, сушили (MgSO4) и выпаривали. Остаток очищали посредством хроматографии на колонках с использованием в качестве элюента смесей метиленхлорида и этилацетата с возрастающей полярностью. Таким образом был получен целевой исходный материал (0,6 г, 27%).
Пример 2.
Выполняли процедуру, описанную в примере 1, за исключением того, что вместо 3-метиланилина использовали соответствующий анилин, а вместо 4-хлор-6,7-диметоксихиназолина применяли соответствующий замещенный 4-хлорхиназолин. Таким образом в виде хлористо-водородных солей были получены соединения, описанные в таблице I, соответствие структур которых было подтверждено спектроскопией протонного магнитного резонанса и элементным анализом.
Примечания к табл. I:
a. Для этого продукта были получены следующие результаты элементного анализа:
обнаружено: C 48,3, H 3,6, N 10,4
высчитано для C16H14BrN3O2 • HCl: C 48,4, H 3,8, N 10,6%.
и следующие данные спектра ЯМР: (CD3SOCD3) 4,0 (с, 3H), 4,22(с, 3H), 7,36(с, 1H), 7,5(м, 2H), 7,76(м, 1H), 8,02(м, 1H), 8,35(с, 1H), 8,66(с, 1H).
b. Для этого продукта были получены следующие результаты элементного анализа:
обнаружено: C 60,3, H 4,3, N 13,3
высчитано для C16H13N3O2 • 1,08 HCl: C 60,2, H 4,4, N 13,2%.
и следующие данные спектра ЯМР (CD3SOCD3) 2,36 (с, 3H), 6,37(с, 2H), 7,13(д, 2H), 7,35(т, 1H), 7,37(с, 1H), 7,49(м, 2H), 8,28(с, 1H), 8,78(с, 1H).
4-Хлор-6,7-метилендиоксихиназолин, используемый в качестве исходного материала, получали из 4,5-метилендиоксиантраниловой кислоты с помощью таких же методов, которые описаны в части примера 1, посвященной получению исходных материалов.
c. 4-Хлор-7-метоксихиназолин, используемый в качестве исходного материала, получали из 4-метоксиантраниловой кислоты с помощью таких же методов, которые описаны в части примера 1, посвященной получению исходных материалов.
d. Реакционную смесь нагревали до температуры кипения с обратным холодильником в течение 2 часов. При охлаждении смеси до комнатной температуры не происходило выделения осадка. Эту смесь выливали в воду (50 мл) по каплям добавляли насыщенный водный раствор гидроксида аммония. Образовавшийся осадок отделяли, промывали водой и сушили. Таким образом был получен 7-метоксикарбонил-4-/3'-метиланилино/хиназолин, выход которого составил 47%.
Для этого продукта были, получены следующие результаты элементного анализа:
обнаружено: C 69,8, H 5,2, N 13,9
высчитано для C17H15N3O2: C 69,6, H 5,2, N 14,3%.
и следующие характеристические данные спектра ЯМР: (CD3SOCD3) 2,36(с, 3H), 3,95(с,3H), 6,98(д,1H), 7,29(т,1H), 7,67(м,2H), 8,08(м,1H), 8,29(д,1H), 8,68(с,1H), 8,70(с,1H).
4-Хлор-7-метоксикарбонилхиназолин, используемый в качестве исходного материала, получали следующим образом:
В соответствии с процедурой, описанной в первом абзаце той части примера 1, которая посвящена получению исходных материалов, 4-карбоксиантраниловую кислоту (14,2 г) подвергали взаимодействию с формамидом, что позволило получить 7-карбоксихиназолин-4-он (8,5 г). Смесь порции (4 г) материала, полученного таким образом, метанола (40 мл) и концентрированной серной кислоты (2 мл) перемешивали и нагревали до температуры кипения с обратным холодильником в течение 6 часов. Полученную смесь охлаждали до температуры окружающей среды и отделяли осадок. Таким образом был получен 7-метоксикарбонилхиназолин-4-он (5,7 г).
Смесь порции (0,5 г) материала, полученного таким образом, фосфорилхлорида (2 мл) и N,N-диметилформамида (1 капля) перемешивали и нагревали до температуры кипения с обратным холодильником в течение 2 часов. Полученную смесь выпаривали с образованием 4-хлор-7-метоксикарбонилхиназолина, который использовали без дальнейшей очистки.
Пример 3
Смесь 4-хлор-6-метилхиназолина (0,5 г), 3-метиланилина (0,33 г) и изопропанола (10 мл) перемешивали и нагревали до температуры кипения с обратным холодильником в течение 1 часа. Полученную смесь охлаждали до температуры окружающей среды. Осадок отфильтровывали и промывали холодным изопропанолом и простым диэтиловым эфиром. Таким образом был получен 6-метил-4-/3'-метиланилино/хиназолин (0,61 г, 76%), температура плавления 243 - 245oC.
Спектр ЯМР: (CD3SOCD3) 2,38 (c, 3H), 2,57 (c, 3H), 7,1 - 8,0 (м, 6H), 8,77 (с, 1H), 8,88 (c, 1H).
Элементный анализ:
обнаружено: C 67,0, H 5,5, N 14,5
высчитано для C16H15N3•HCl: C 67,2, H 5,6, N 14,7%.
4-Хлор-6-метилхиназолин, используемый в качестве исходного материала, получали следующим образом:
Смесь 6-метилхиназолин-4-она (10 г, J.Med.Chem. 1989, 32, 847), фосфорилхлорида (12,5 мл), N,N-диметиланилина (14,25 мл) и толуола (150 мл) перемешивали и нагревали до температуры кипения с обратным холодильником в течение 2,5 часов. Эту смесь выливали на лед, органический слой отделяли, промывали водой, сушили (MgSO4 ) и выпаривали. Таким образом был получен целевой исходный материал в виде твердого вещества (10,4 г, 93%), которое использовали без дальнейшей очистки.
Пример 4
Смесь 7-метокси-4-/3'-метиланилино/хиназолина (0,106 г), этантиолата натрия (0,336 г) и N,N-диметилформамида (5 мл) перемешивали и нагревали до температуры 140oC в течение 4 часов. Полученную смесь выпаривали, а остаток очищали посредством хроматографии на колонках с использованием в качестве элюента смеси воды, метанола и трифторуксусной кислоты с объемным отношением 45: 55:0,2. Таким образом был получен 7-гидрокси-4-/3'метиланилино/хиназолин (0,068 г, 41%), температура плавления 52 - 60oC.
Элементный анализ:
обнаружено: C 51,6, H 3,6, N 10,3
высчитано для C15H13N3O•1,4 CF3CO2H: C 52,0, H 3,5, N 10,2%.
Пример 5
В соответствии с процедурой, описанной в примере 4, 6,7-диметокси-4-/3'-хлоранилино/хиназолин подвергали взаимодействию с этантиолатом натрия, что позволило получить 6,7-дигидрокси-4-/3'-хлоранилино/хиназолин, выход которого составил 68%, температура плавления 233 - 235oC.
Элементный анализ:
обнаружено: C 46,3 H 2,7, N 10,0
высчитано для C14H10CIN3O2 • 1.18 CF3CO2H: C 46,6 H 2,7, N 10,0%
Пример 6
Выполняли процедуру, описанную в примере 1, за исключением того, что вместо 3-метиланилина использовали соответствующий анилин, а вместо 4-хлор-6,7-диметоксихиназолина применяли соответствующий замещенный 4-хлорхиназолин. Таким образом в виде хлористо-водородных солей были получены соединения, описанные в таблице II, соответствие структур которых было подтверждено спектроскопией протонного магнитного резонанса и элементным анализом.
Примечания к табл. II.
а. Для этого продукта были получены следующие результаты элементного анализа:
обнаружено: C 52,9, H 4,0, N 10,6
высчитано для C17H14F3N3O2•HCl•0,1(CH3)2CHOH: C 53,0, H 4,0, N 10,7%.
и следующие характеристические данные спектра ЯМР: (CD3 SOCD3) 4,0 (с, 3H), 4,03 (с, 3H), 7,37 (с, 1H), 7,64 (д, 1H), 7,73 (т, 1H), 8,09 (д, 1H), 8,16 (с, 1H), 8,39 (с, 1H), 8,89 (с, 1H), 11,59 (широкий синглет, 1H).
b. Для этого продукта были получены следующие результаты элементного анализа:
обнаружено: C 50,3, H 3,7, N 9,9
высчитано для C17H13F4N3O2•HCl•5EtOH: C 50,7, H 3,6, N 9,9% и следующие характеристические данные спектра ЯМР: (CD3 SOCD3) 4,0 (с, 3H), 4,03 (с, 3H), 7,37 (с, 1H), 7,65 (т, 1H), 8,1 - 8,25 (м, 2H), 8,44 (с, 1H), 8,89 (с, 1H), 11,76 (с, 1H).
c. Этот продукт, первоначально полученный в виде хлористо-водородной соли, следующим образом превращали в соответствующее свободное основание. Эту соль распределяли между этилацетатом и 1 н. водным раствором гидроксида натрия. Органическую фазу промывали рассолом, сушили (MgSO4) и выпаривали. Образовавшийся материал растирали в порошок под слоем этилацетата. Таким образом было получено целевое свободное основание, температура плавления 227 - 230oC.
Спектр ЯМР: (CD3SOCD3) 3,94 (с, 3H), 3,98 (с, 3H), 7,16 - 7,25 (м, 3H), 7,7 - 7,8 (м, 3H), 8,40 (с, 1H), 9,5 (с, 1H).
Элементный анализ:
обнаружено: C 64,1, H 4,7, N 13,8
высчитано для C16H14FN3O2: C 64,2, H 4,7, N 14,0%.
d. К реакционной смеси добавляли два эквивалента триэтиламина, а затем производили ее нагрев до температуры кипения с обратным холодильником в течение 3 часов. Полученную смесь охлаждали до температуры окружающей среды и распределяли между метиленхлоридом и водой. Органическую фазу сушили (MgSO4) и выпаривали. Остаток перекристаллизовывали из изопропанола с образованием целевого продукта.
e. Для этого продукта были получены следующие результаты элементного анализа:
обнаружено: C 70,7, H 6,3, N 14,3
Высчитано для C17H17N3•0,7HCl: C 70,7, H 6,15, N 14,5%. и следующие характеристические данные спектра ЯМР: (CD2SOCD3) 2,36 (с, 3H), 2,5 (с, 6H), 7,1 - 7,7 (м, 5H), 8,56 (с, 1H), 8,77 (с, 1H),
4-Хлор-6,7-диметилхиназолин, используемый в качестве исходного материала, получали из 4,5-диметилантраниловой кислоты (Acta Chemica Scand., 1967, 21, 983) в соответствии с методами, описанными в той части примера 1, которая посвящена получению исходных материалов.
f. Для этого продукта были получены следующие результаты элементного анализа:
обнаружено: C 58,2, H 5,9, N 10,6
высчитано для C16H14ClN3•1,3HCl•0,8/CH3/2CHOH: C 58,2, H 5,8, N 11,0% и следующие характеристические данные спектра ЯМР: (CD3SOCD3) 2,5 (с, 6H), 7,37 (м, 1H), 7,51 (т, 1H), 7,73 (с, 1H), 7,78 (м, 1H), 7,96 (т, 1H), 8,74 (м, 1H), 8,92 (с, 1H), 11,5 (Широкий синглет, 1H).
g. Для этого продукта были получены следующие результаты элементного анализа:
обнаружено: C 41,4, H 3,4, N 9,1
высчитано для C16H13BrN3•HCl•1,1 H2O: C 41,4, H 3,5, N 9,1% и следующие характеристические данные спектра ЯМР: (CD3SOCD3) 2,38 (с, 3H), 7,18 (д, 1H), 7,40 (т, 1H), 7,49 (м, 2H), 7,51 (с, 1H), 7,94 (д, 1H), 8,29 (м, 1H), 8,91 (с, 1H), 9,10 (д, 1H), 11,7 (с, 1H).
4-Хлор-6-дибромметилхиназолин, используемый в качестве исходного материала, получали следующим образом:
Смесь 4-хлор-6-метилхиназолина (7,3 г) (полученного в результате взаимодействия 6-метил-4-оксо-3,4-дигидрохиназолина (заявка на Европейский патент N 86304148.9) с тионилхлоридом), N-бромсукцинимида (7,32 г), дибензоилпероксида (0,1 г) и тетрахлорметана (200 мл) перемешивали и нагревали до температуры кипения с обратным холодильником в течение 6 часов. Полученную смесь выпаривали, а остаток очищали посредством хроматографии на колонках с использованием в качестве элюента смесей метиленхлорида и этилацетата с возрастающей полярностью. Таким образом по очереди были получены 4-хлор-6-дибромметилхиназолин (0,5 г) и 6-бромметил-4-хлорхиназолин (4 г).
Пример 7
Формиат аммония (3,6 г) добавляли к перемешанной смеси 4-/3'-метиланилино/-7-нитрохиназолина (4 г), катализатора, представляющего 10% палладированный уголь (0,4 г), и этанола, после чего полученную смесь перемешивали при температуре окружающей среды в течение 3 часов. Эту смесь фильтровали, а фильтрат выпаривали. Остаток распределяли между метиленхлоридом и водой. Органическую фазу сушили (MgSO4) и выпаривали. Остаток перекристаллизовывали из этанола. Таким образом был получен 7-амино-4-/3'-метиланилино/хиназолин (3,39 г), температура плавления 196-197oC.
Спектр ЯМР: (CD3SOCD3) 2,32 (с, 3H), 5,96 (широкий синглет, 2H), 6,7-6,9 (м, 3H), 7,23 (т, 1H), 7,6 (м, 2H), 8,21 (д, 1H), 8,38 (с, 1H).
Элементный анализ:
обнаружено: C 69,1, H 6,8, N 19,0
высчитано для C15H14N4•C2H5OH: C 69,1, H 6,8, N 18,9%.
4-/3'-метиланилино/-7-нитрохиназолин, используемый в качестве исходного материала, получали следующим образом:
В соответствии с процедурой, описанной в той части примера 1, которая посвящена получению исходных материалов, 4-нитроантраниловую кислоту превращали в 4-хлор-7-нитрохиназолин. Выполняли процедуру, описанную в примере 1, за исключением того, что реагенты перемешивали вместе при температуре окружающей среды в течение 20 минут, 4-хлор-7-нитрохиназолин подвергали взаимодействию с 3-метиланилином, что позволило получить 4-/3'-метиланилино/-7-нитрохиназолин.
Пример 8
В соответствии с процедурой, описанной в примере 7, производили восстановление 4-/3'-метиланилино/-6-нитрохиназолина с образованием 6-амино-4-/3'-метиланилино/хиназолина, выход которого составил 43%, температура плавления 205-206oC.
Спектр ЯМР (CD3SOCD3) 2,32 (с, 3H), 5,6 (широкий синглет, 2H), 6,8 (д, 1H), 7,2-7,7 (м, 6H), 8,34 (с, 1H).
Элементный анализ:
обнаружено: C 71,7, H 5,7, N 22,4
высчитано для C15H14N4: C 72,0, H 5,6, N 22,4%.
4-/3'-метиланилино/-6-нитрохиназолин, используемый в качестве исходного материала, получали следующим образом:
В соответствии с процедурой, описанной в первом абзаце той части примера 1, которая посвящена получению исходных материалов, 5-нитроантраниловую кислоту подвергали взаимодействию с формамидом, что позволило получить 6-нитрохиназолин-4-он, выход которого составил 82%, температура плавления 268-271oC.
Смесь 6-нитрохиназолин-4-она (10 г), пентахлорида фосфора (16,4 г) и фосфорилхлорида (20 мл) нагревали до температуры кипения с обратным холодильником в течение 2 часов. Полученную смесь охлаждали до температуры окружающей среды и добавляли гексан (700 мл). Эту смесь выстаивали при 0oC в течение 16 часов. Осадок отделяли и распределяли между хлороформом (700 мл) и водой (550 мл). Водный слой подщелачивали добавлением 2 н. водного раствора гидроксида натрия и экстрагировали хлороформом (2х200 мл). Соединенные органические растворы сушили (MgSO4) и выпаривали. Таким образом был получен 4-хлор-6-нитрохиназолин (1,6 г), который использовали без дальнейшей очистки.
К смеси 4-хлор-6-нитрохиназолина (0,25 г) и изопропанола (5 мл) добавляли 3-метиланилин (0,139 г), после чего полученную смесь перемешивали и нагревали до температуры кипения с обратным холодильником в течение 2 часов. Эту смесь охлаждали до температуры окружающей среды и выпаривали. Остаток очищали посредством хроматографии на колонках с использованием в качестве элюента смесей гексана и этилацетата с возрастающей полярностью. Таким образом было получено масло, которое затвердевало при растирании под слоем смеси простого диэтилового эфира и изопропанола. В результате был получен 4-/3'-метиланилино/-6-нитрохиназолин (0,09 г, 26%), температура плавления 248-249oC.
Масс-спектр: (P+1) m/e 281.
Элементный анализ:
обнаружено: C 64,0, H 4,5, N 18,6
высчитано для C15H12N4O2• 0,25/CH3/2CHOH: C 64,1, H 4,8, N 18,9%.
Пример 9
В соответствии с процедурой, описанной в примере 7, производили восстановление 4-/3'-хлоранилино/-6-нитрохиназолина, что позволило получить 6-амино-4-/3'-хлоранилино/хиназолин, выход которого составил 18% температура плавления >150oC (разлагается).
Спектр ЯМР: (CD3SOCD3) 7,27 (м, 1H), 7,39 (д, 1H), 7,45 (м, 2H), 7,66 (д, 1H), 7,74 (д, 1H), 7,97 (т, 1H), 8,60 (с, 1H).
Элементный анализ:
обнаружено: C 56,4, H 4,5, N 18,4
высчитано для C14H11ClN4•0,5HCl• 0,5H2O: C 56,4, H 4,2, N 18,8%.
4-/3'-Хлоранилино/-6-нитрохиназолин, используемый в качестве исходного материала, получали следующим образом:
Триэтиламин (2,53 г) и 3-хлоранилин (3,35 г) по очереди добавляли к перемешанной смеси 4-хлор-6-нитрохиназолина (5 г) и изопропанола (40 мл). Полученную смесь перемешивали и нагревали до температуры 80oC в течение 1 часа. Эту смесь охлаждали до температуры окружающей среды, осадок отделяли и промывали простым диэтиловым эфиром. Таким образом был получен целевой исходный материал (5,09 г). Температура плавления 272-274oC.
Пример 10
В соответствии с процедурой, описанной в примере 7, производили восстановление 6-нитро-4-/3'-трифтометиланилино/хиназолина, что позволило получить 6-амино-4-/3'-трифторметиланилино/хиназолин, выход которого составил 38%, температура плавления 190-192oC.
Спектр ЯМР: (CD3SOCD3) 5,7 (широкий синглет, 2H), 7,28 (м, 1H), 7,38 (д, 1H), 7,40 (д, 1H), 7,6 (м, 2H), 8,23 (д, 1H), 8,35 (с, 1H), 8,42 (с, 1H).
Элементный анализ:
обнаружено: C 57,4, H 3,6, N 17,6
высчитано для C15H11F3N4•0,5H2O: C 57,5, H 3,8, N 17,9%.
6-Нитро-4-/3'-трифтометиланилино/хиназолин, используемый в качестве исходного материала, получали следующим образом:
Триэтиламин (3,46 г) и 3-трифторметиланилин (3,46 г) по очереди добавляли к перемешанной смеси 4-хлор-6-нитрохиназолина (4,5 г) и изопропанола (30 мл). Полученную смесь нагревали до 80oC в течение 1 часа. Эту смесь охлаждали до температуры окружающей среды и распределяли между метиленхлоридом и водой. Органическую фазу сушили (MgSO4) и выпаривали. Остаток очищали посредством хроматографии на колонках с использованием в качестве элюента смесей метиленхлорида и этилацетата с возрастающей полярностью. Таким образом был получен целевой исходный материал (1,76 г), температура плавления 206-207oC.
Пример 11
Уксусный ангидрид (0,204 г) добавляли к перемешанному раствору 6-амино-4-/3'-метиланилино/хиназолина (0,5 г) в N,N-диметилацетамиде (5 мл), после чего эту смесь перемешивали при температуре окружающей среды в течение 24 часов. Полученную смесь выпаривали, а остаток перекристаллизовывали из смеси изопропанола, ацетона и воды с соотношением 4:1:2. Таким образом был получен 6-ацетамидо-4-/3'-метиланилино/хиназолин (0,413 г).
Спектр ЯМР: (CD3SOCD3) 2,12 (с, 3H), 2,33 (с, 3H), 6,93 (д, 1H), 7,28 (т, 1H), 7,6 (м, 2H), 7,73 (д, 1H), 7,84 (м, 1H), 8,49 (с, 1H), 8,64 (д, 1H), 9,68 (с, 1H).
Элементный анализ:
обнаружено: C 69,6, H 5,5, N 19,1
высчитано для C17H16N4O: C 69,8, H 5,5, N 19,2%.
Пример 12
В соответствии с процедурой, описанной в примере 11, 6-амино-4-/3'-хлоранилино/хиназолин подвергали взаимодействию с уксусным ангидридом, что позволило получить 6-ацетамидо-4-/3'-хлоранилино/хиназолин, выход которого составил 50%, температура плавления 260-262oC.
Спектр ЯМР: (CD3SOCD3) 2,13 (с, 3H), 7,13 (м, 1H), 7,39 (т, 1H), 7,8 (м, 3H), 8,03 (с, 1H), 8,56 (с, 1H), 8,66 (д, 1H), 9,87 (широкий синглет, 1H), 10,24 (широкий синглет, 1H).
Элементный анализ:
обнаружено: C 61,2, H 4,1, N 18,0
высчитано для C16H13ClN4O: C 61,4, H 4,2, N 17,9%.
Пример 13
2-Метоксиацетилхлорид (0,094 г) добавляли к перемешанному раствору 7-амино-4-/3'-метиланилино/-хиназолина (0,206 г) в N,N- диметилацетамиде (4 мл). Полученную смесь перемешивали и нагревали до 100oC в течение 1 часа. Эту смесь охлаждали до температуры окружающей среды и выливали в смесь метиленхлорида и воды. Смесь подщелачивали до pH 9, добавляя разбавленный водный раствор гидроксида натрия. Органический слой сушили (MgSO4) и выпаривали. Остаток очищали посредством хроматографии на колонках с использованием в качестве элюента сначала смеси метиленхлорида и этанола с соотношением 100: 1, а затем смесей метиленхлорида и этанола с возрастающей полярностью. Таким образом был получен 7-/2-метоксиацетамидо/-4-/3'-метиланилино/хиназолина (0,085 г), температура плавления 222oC.
Спектр ЯМР: (CD3SOCD3) 2,34 (с, 3H), 3,42 (с, 3H), 4,08 (с, 2H), 6,9 - 7,9 (м, 4H), 8,21 (д, 1H), 8,48 (д, 1H), 8,52 (с, 1H), 9,6 (с, 1H), 10,2 (с, 1H).
Элементный анализ:
обнаружено: C 66,6, H 5,6, N 17,0
высчитано для C18H18N4O2• 0,1 H2O: C 66,7 H 5,6, N 17,3%
Пример 14
В соответствии с процедурой, описанной в примере 13, за исключением того, что реакционную смесь перемешивали при температуре окружающей среды, а не нагревали до 100oC, 6-амино-/4-/3'-хлоранилино/хиназолин подвергали взаимодействию с 2-метоксиацетилхлоридом, что позволило получить 6-/2-метоксиацетамидо/-4-/3'-хлоранилино/хиназолин, выход которого составил 41%, температура плавления 177 - 180oC.
Спектр ЯМР: (CD3SOCD3) 3,44 (с, 3H), 4,09 (с, 2H), 7,17 (м, 1H), 7,44 (т, 1H), 7,8 (м, 2H), 8,0 (м, 2H), 8,61 (с, 1H), 8,71 (д, 1H), 9,9 (с. 1H), 10,05 (с, 1H).
Элементный анализ:
обнаружено: C 59,7, H 4,4 N 16,2
высчитано для C18H18N4O2: C 59,6, H 4,4, N 16,3%.
Пример 15
Бензолсульфонилхлорид (0,158 г) добавляли к перемешанной смеси 7-амино-4-/3'-метиланилино/хиназолина (0,2 г), триэтиламина (0,181 г) и метиленхлорида (10 мл), предварительно охлажденной до 3oC. Полученную смесь оставляли для нагревания до температуры окружающей среды и перемешивали в течение 16 часов. Эту смесь выпаривали, а остаток очищали посредством хроматографии на колонках с использованием в качестве элюента смесей метиленхлорида и этилацетата с возрастающей полярностью. Таким образом был получен 7-бензолсульфонамидо-4-/3'-метиланилино/хиназолин (0,05 г), температура плавления 180 - 185oC (разлагается).
Элементный анализ:
обнаружено: C 61,5, H 4,8, N 13,4
высчитано для C21H18N4O2S• H2O: C 61,7, H 4,4, N 13,7%
Пример 16
2-Бромэтанол (0,109 г) добавляли к смеси 7-амино-4-/3'-метиланилино/хиназолина (0,2 г), карбоната калия (0,218 г) и N,N-диметилацетамида (6 мл). Полученную смесь перемешивали и нагревали до 110oC в течение 1 часа. Периодически добавляли остальные порции 2-бромэтанола (3х0,109 г), после чего смесь нагревали до 10oC в течение 5 ч. Эту смесь выпаривали, а остаток очищали посредством хроматографии на колонках с использованием в качестве элюента смесей метиленхлорида и этанола с возрастающей полярностью. Полученный таким образом продукт подвергали дальнейшей очистке посредством хроматографии на колонках с обращенной фазой при использовании в качестве элюента сначала смеси метанола, воды и трифторуксусной кислоты с соотношением 25: 75:0,2, а затем смеси таких же растворителей с отношением 50:50:0,2. Таким образом был получен 7-/2-гидроксиэтиламино/-4-/3'-метиланилино/хиназолин (0,027 г).
Спектр ЯМР (CD3SOCD3) 2,36 (с, 3H), 3,77 (т, 2H), 4,34 (т, 2H), 6,8 - 7,5 (м, 7H), 8,37 (д, 1H), 8,61 (с, 1H), 10,79 (с, 1H).
Пример 17
В соответствии с процедурой, описанной в примере 16, 6-амино-4-/3'-метиланилино/хиназолин подвергали взаимодействию с 2-бромметилметиловым эфиром, что позволило получить 6-/2-метоксиэтиламино/-4-/3'-метиланилино/хиназолин, выход которого составил 20%, температура плавления 163 - 167oC.
Спектр ЯМР: (CD3SOCD3+CD3CO2D) 2,39 (с, 3H), 3,36 (с, 3H), 3,44 (т, 2H), 3,63 (т, 2H), 7,17 (д, 1H), 7,4 - 7,7 (м, 6H), 8,6 (с, 1H).
Элементный анализ:
обнаружено: C 56,4, H 5,0, N 13,1
высчитано для C18H20N4O•CF3CO2H: C 56,8, H 5,0, N 13,3%
Пример 18
В соответствии с процедурой, описанной в примере 7, производили восстановление 7-/3-диметиламинопропиламино/-4-/3'-метиланилино/ -6-нитрохиназолина, что позволило получить 6-амино-7-/3-диметиламинопропиламино/-4-/3'-метиланилино/хиназолин, выход которого составил 56%, температура плавления 60 - 66oC.
Спектр ЯМР (CD3SOCD3) 1,84 (м, 2H), 2,28 (с, 6H), 2,30 (с, 3H), 2,31 (м, 2H), 3,23 (м, 2H), 6,58 (с, 1H), 6,81 (д, 1H), 7,19 (т, 1H), 7,31 (с, 1H), 7,63 (м, 2H), 8,24 (с, 1H).
Элементный анализ:
обнаружено: C 66,5, H 7,6, N 22,8
высчитано для C20H26N6•0,66 H2O: C 66,3, H 7,6, N 23,2%.
7-/3-Диметиламинопропиламино/-4-/3'-метиланилино/-6- нитрохиназолин, используемый в качестве исходного материала, получали следующим образом:
Смесь 4-хлорантраниловой кислоты (17,2 г) и формамида (10 мл) перемешивали и нагревали до 130oC в течение 45 минут и до 175oC в течение 75 минут. Полученную смесь охлаждали до 100oC и добавляли 2/2-этоксиэтокси/этанол (50 мл). Образовавшийся раствор выливали в смесь (250 мл) воды со льдом. Осадок отделяли, промывали водой и сушили. Таким образом был получен 7-хлорхиназолин-4-он (15,3 г, 85%).
Порцию (6 г) полученного таким образом материала добавляли частями к перемешанной смеси концентрированной серной кислоты (12 мл) и дымящей азотной кислоты (12 мл). Полученную смесь нагревали до 110oC в течение 30 минут. Эту смесь охлаждали до температуры окружающей среды и выливали на лед. Твердое вещество отделяли, промывали водой и сушили. Таким образом был получен 7-хлор-6-нитрохиназолин-4-он (6,89 г, 92%).
Смесь порции (4 г) полученного таким образом материала, тионилхлорида (30 мл), фосфорилхлорида (5 мл) и N,N-диметилформамида (10 капель) перемешивали и нагревали до температуры кипения с обратным холодильником в течение 4 часов. Полученную смесь выпаривали. Смесь образовавшегося остатка, 3'-метиланилина (1,89 г) и изопропанола (25 мл) перемешивали и нагревали до температуры кипения с обратным холодильником в течение 2 часов. Полученную смесь фильтровали, твердое вещество промывали изопропанолом и простым диэтиловым эфиром. Таким образом был получен 7-хлор-4-/3'-метиланилино/-6-нитрохиназолин (3,74 г, 67%), температура плавления 271 - 274oC.
Спектр ЯМР: (CD3SOCD3) 2,37 (с, 3H), 7,13 (д, 1H), 7,47 (т, 1H), 7,57 (м, 2H), 8,20 (с, 1H), 8,83 (с, 1H), 9,72 (с, 1H).
3-Диметиламинопропиламин (2,44 г) добавляли к перемешанному раствору порции (0,75 г) полученного таким образом материала в N,N-диметилацетамида (20 мл). Эту смесь нагревали до 70oC в течение 1 часа и до 90oC в течение еще одного часа. Полученную смесь выпаривали. Остаток растирали под водой с образованием твердого вещества. Твердое вещество растворяли в горячем метаноле. Добавляли воду и охлаждали раствор. Образовавшийся остаток отделяли и сушили. Таким образом был получен 7-/3-диметиламинопропиламино/-4-/3'- метиланилино/-6-нитрохиназолин (0,47 г, 52%), температура плавления 112 - 118oC.
Спектр ЯМР: (CD3SOCD3) 1,61 (м, 2H), 2,2 - 2,3 (3 синглета, 9H), 2,39 (т, 2H), 3,39 (м, 2H), 6,93 (с, 1H), 6,96 (д, 1H), 7,27 (т, 1H), 7,61 (с, 1H), 7,63 (д, 1H), 8,36 (т, 1H), 8,42 (с, 1H), 9,50 (с, 1H), 10,07 (широкий синглет, 1H).
Пример 19
Смесь 6,7-диметокси-4-/3'-метиланилино/хиназолина (4 г), этантиолата натрия (9,8 г) и N,N-диметилформамида (100 мл) перемешивали и нагревали до 80oC в течение 6 часов. Полученную смесь охлаждали и выливали в смесь этилацетата с водой. Эту смесь подкисляли до pH 7, добавляли разбавленный водный раствор хлористо-водородной кислоты. Органическую фазу сушили (MgSO4) и выпаривали. Остаток очищали посредством хроматографии на колонках с использованием в качестве элюента смесей метиленхлорида и метанола с возрастающей полярностью. Полученное масло растирали под слоем простого диэтилового эфира с образованием твердого вещества. Таким образом был получен 7-гидрокси-6-метокси-4-/3'-метиланилино/хиназолин (1,02 г), температура плавления 139 - 149oC.
Спектр ЯМР: (CD3SOCD3) 2,35 (с, 3H), 3,97 (с, 3H), 6,90 (м, 1H), 7,05 (с, 1H), 7,26 (м, 1H), 7,5 - 7,7 (м, 2H), 7,84 (с, 1H), 8,39 (с, 1H), 9,34 (широкий синглет, 1H).
Элементный анализ:
обнаружено: C 66,5, H 5,7, N 13,7
высчитано для C16H15N3O2• 0,15 Et2O•0,5 H2O: C 66,3, H 5,5, N 14,0.
Пример 20
Смесь 6,7-диметокси-4-/3'-метиланилино/хиназолина (4 г), этантиолата натрия (9,8 г) и N,N-диметилформамида (100 мл) перемешивали и нагревали до 80oC в течение 3 часов. Полученную смесь охлаждали до температуры окружающей среды и подкисляли до pH 4, добавляя ледяную уксусную кислоту. Смесь выпаривали, а остаток очищали посредством хроматографии на колонках с использованием в качестве элюента смесей метиленхлорида и метанола с возрастающей полярностью. Таким образом был получен 6-гидрокси-7-метокси-4-/3'-метиланилино/хиназолин (0,3 г), температура плавления 265 - 267oC.
Спектр ЯМР: (CD3SOCD3) 2,32 (с, 3H), 3,97 (с, 3H), 6,90 (м. 1H), 7,15 - 7,30 (м, 2H), 7,66 (м, 2H), 7,80 (с, 1H), 8,41 (с, 1H), 9,24 (широкий синглет, 1H), 9,53 (широкий синглет, 1H).
Элементный анализ:
обнаружено: C 65,2, H 5,2, N 14,0
высчитано для C16H15N3O2 • 0,67 H2O: C 65,5, H 5,6, N 14,3%
Пример 21
Этилбромацетат (0,033 г) по каплям добавляли к перемешанной смеси 7-гидрокси-6-метокси-4-/3'-метиланилино/хиназола (0,05 г), карбоната калия (0,074 г) и N,N-диметилформамида (1 мл). Полученную смесь перемешивали при температуре окружающей среды в течение 1 часа. Смесь выпаривали, а остаток очищали посредством хроматографии на колонках с использованием в качестве элюента смесей метиленхлорида и этилацетата с возрастающей полярностью. Таким образом был получен 7-/этоксикарбонилметокси/-6-метокси-4-/3'-метиланилино/-хиназолин (0,051 г), температура плавления 165 - 168oC.
Спектр ЯМР: (CD3SOCD3) 1,24 (т, 3H), 2,35 (с, 3H), 3,99 (с, 3H), 4,99 (кв., 2H), 4,33 (с, 2H), 6,9 - 7,9 (м, 6H), 8,43 (с, 1H), 9,40 (с, 1H).
Элементный анализ:
обнаружено: C 64,8, H 5,9, N 10,9
высчитано для C20H21N3O4 • 0,2 H2O: C 64,7, H 5,8, N 11,3%.
Пример 22
Выполняли процедуру, описанную в примере 21, за исключением того, что вместо этилбромацетата использовали 2-йодацетамид. Таким образом был получен 7-/карбамоилметокси/6-метокси-4-/3'-метиланилино/хиназолин, выход которого составил 91%, температура плавления 214 - 222oC.
Спектр ЯМР: (CD3SOCD3) 2,35 (с, 3H), 3,99 (с, 3H), 4,65 (с, 2H), 6,9 - 7,9 (м, 6H), 8,45 (с, 1H).
Элементный анализ:
обнаружено: C 47,8, H 4,9, N 11,9
высчитано для C18H18N4O3 • 0,1 HI: C 47,5, H 4,8, N 12,3%
Пример 23
Смесь 7-гидрокси-6-метокси-4-/3'-метиланилино/хиназолин (0,556 г), 2-бромэтанола (0,153 г), карбоната калия (0,819 г) и N,N-диметилформамида (10 мл) перемешивали и нагревали до 80oC в течение 3 ч. Смесь выпаривали, а остаток очищали посредством хроматографии на колонках с использованием в качестве элюента смесей этилацетата и метанола с соотношением 19 : 1. Полученный продукт подвергали дальнейшей очистке посредством хроматографии с обращенной фазой с использованием в качестве элюента смеси этанола, воды и трифторуксусной кислоты с соотношением 50 : 50 : 0,2. Таким образом был получен 7-/2-гидроксиэтокси/-6-метокси-4-/3'-метиланилино/хиназолин (0,154 г), температура плавления 122 - 124oC.
Спектр ЯМР: (CD3SOCD3) 2,35 (м, 3H), 3,81 (м, 2H), 3,97 (с, 3H), 4,17 (т, 2H), 6,9 - 7,9 (м, 6H), 8,45 (с, 1H).
Элементный анализ:
обнаружено: C 52,9 H 4,9, N 8,7
высчитано для C18H19N3O3 • 1,1 CF3CO2H • 0,5 H2O: C 52,7, H 4,6, N 9,1%
Пример 24
Выполняли процедуру, описанную в примере 21, за исключением того, что вместо этилбромацетата использовали 2-бромэтилметиловый эфир и реакционную смесь перемешивали при температуре окружающей среды в течение 16 часов. Таким образом был получен 6-метокси-7-/2-метоксиэтокси/-4-/3'-метиланилино/хиназолин в виде бесцветного масла. Полученное масло растворяли в этилацетате (2 мл) и добавляли насыщенный раствор хлороводорода в простом этиловом эфире. Таким образом была получена хлористо-водородная соль целевого продукта, выход которого составил 73%, температура плавления 211 - 227oC.
Спектр ЯМР: (CD3SOCD3) 2,35 (с, 3H), 3,34 (с, 3H), 3,78 (кв., 2H), 4,01 (с., 3H), 4,31 (с., 2H), 6,9 - 7,6 (м., 5H), 8,23 (с., 1H), 8,75 (с., 1H).
Элементный анализ:
обнаружено: C 61,2, H 6,0, N 10,9
высчитано для C19H21N3O3 • 0,9 HCl: C 61,2, H 5,9, N 11,3%
Пример 25
Смесь 7-/этоксикарбонилметокси/-6-метокси-4-/3'-метиланилино/хиназолина (0,262 г), 2 н. водного раствора гидроксида натрия (2 мл) и 1,4-диоксана (2 мл) перемешивали при температуре окружающей среды в течение 3 часов. Полученную смесь подкисляли путем добавления 2 н. водного раствора хлористо-водородной кислоты, после чего кислотность уменьшали при pH 6, добавляя водный раствор гидроксида аммония. Осадок отделяли и сушили. Таким образом был получен 7-/карбоксиметокси/-6-метокси-4-/3'-метиланилино/хиназолин (0,159 г), температура плавления 215 - 222oC.
Спектр ЯМР: (CD3SOCD3) 2,34 (с, 3H), 3,95 (с, 3H), 4,33 (с., 2H), 6,9 - 7,9 (м., 6H), 8,41 (с., 1H).
Элементный анализ:
обнаружено: C 53,5, H 5,0, N 10,5
высчитано для C18H16NaN3O4 • 2,3 H2O: C 53,6, H 5,1, N 10,4%
Пример 26
Смесь 7-/2-гидроксиэтокси/-6-метокси-4- /3'-метиланилино/хиназолина (0,23 г), N,N-диметилформамида (1 капля) и тионилхлорида (5 мл) нагревали до температуры кипения с обратным холодильником в течение 2 часов. Полученную смесь выпаривали.
Остаток растворяли в N, N-диметилформамиде (3 мл), после чего раствор насыщали газообразным диметиламином. Полученный раствор перемешивали и нагревали до 100oC в течение 3 часов. Смесь выпаривали, а остаток очищали посредством хроматографии на колонках с обращенной фазой, используя в качестве элюента смеси метанола, воды и трифторуксусной кислоты с соотношением 50:50: 0,2. Таким образом был получен 7-/2-диметиламиноэтокси/-6-метокси-4-/3'-метиланилино/хиназолин (0,24 г), температура плавления 97 - 100oC.
Спектр ЯМР: (CD3SOCD3) 2,37 (с., 3H), 2,93 (с., 6H), 3,66 (т., 2H), 3,98 (с., 3H), 4,57 (т., 2H), 7,1 - 8,2 (м., 6H), 7,78 (с., 1H), 10,82 (с., 1H).
Элементный анализ:
обнаружено: C 46,4 H 4,2, N 8,8%
высчитано для C20H24N4O2 • 2,6 CF3CO2H: C 46,6, H 4,1, N 8,6%.
Пример 27
2-Йодэтанол (0,327 мл) добавляли к смеси 6,7-дигидрокси-4-/3'-метиланилино/хиназолина (0,534 г), карбоната калия (1,1 г) и N,N-диметилацетамида (10 мл). Полученную смесь перемешивали при температуре окружающей среды в течение 18 часов. Эту смесь выпаривали, а остаток очищали посредством хроматографии на колонках с обращенной фазой, используя в качестве элюента смесь метанола, воды и трифторуксусной кислоты с соотношением 50:50:0,2. Таким образом был получен 6,7-ди-/2-гидроксиэтокси/-4-/3'-метиланилино/хиназолин (0,049 г), температура плавления 96 - 102oC.
Спектр ЯМР: (CD3SOCD3) 2,37 (с., 3H), 3,85 (м., 4H), 4,23 (м., 4H), 7,05 - 7,55 (м., 5H), 8,06 (с., 1H), 8,76 (с., 1H), 10,78 (широкий синглет, 1H).
Элементный анализ:
обнаружено: C 49,2, H 4,5, N 7,9
высчитано для C19H31N4O4 • 1,6 CF3CO2H: C 49,5, H 4,2, N 7,8%.
6,7-Дигидрокси-4-/3'-метиланилино/хиназолин, используемый в качестве исходного материала, получали с достижением 77% выхода из 6,7-диметокси-4-/3'-метиланилино/хиназолина в соответствии с процедурой, описанной в примере 4.
Пример 28
Раствор 6-бромметил-4-/3'-метиланилино/хиназолина в N,N-диметилформамиде (3 мл) насыщали газообразным диметиламином, после чего образовавшийся раствор перемешивали при температуре окружающей среды в течение 16 часов. Полученную смесь выпаривали, а остаток очищали посредством хроматографии на колонках с использованием в качестве элюента смеси метиленхлорида и метанола с соотношением 17 : 3. Образовавшееся твердое вещество (0,308 г) подвергали дальнейшей очистке с помощью хроматографии на колонках с обращенной фазой, используя в качестве элюента смесь воды, метанола и трифторуксусной кислоты с соотношением 3:2:0,01. Таким образом был получен 6-диметиламинометил-4-/3'-метиланилино/хиназолин (0,172 г), температура плавления 174 - 177oC.
Спектр ЯМР: (CD3SOCD3) 2,35 (с., 3H), 2,85 (с., 6H), 4,47 (с., 2H), 7,0 - 8,1 (м., 6H), 8,66 (д., 1H), 8,85 (с., 1H).
Элементный анализ:
обнаружено: C 49,2, H 4,2, N 10,4
высчитано для C18H20N4 • 2,25 CF3CO2H: C 49,2, H 4,1, N 10,2%
Пример 29
В соответствии с процедурой, описанной в примере 28, 6-бромметил-4-хлорхиназолин подвергали взаимодействию с 3-метиланилином, после чего образовавшийся продукт подвергали взаимодействию с пиперазином. Таким образом был получен 4-/3'-метиланилино/-6-/пиперазин-1-илметил/хиназолин, выход которого составил 45%, температура плавления 175 - 178oC.
Спектр ЯМР: (CD3SOCD3) 2,38 (с., 3H), 2,73 (м., 4H), 3,17 (м., 4H), 3,86 (с., 2H), 7,1-8,1 (м., 6H), 8,66 (д., 1H), 8,90 (с., 1H).
Элементный анализ:
обнаружено: C 43,0, H 3,7, N 9,0
высчитано для C20H23N5 • 3,9CF3CO2H : C 42,0, H 3,5, N 9,0
Пример 30.
В соответствии с процедурой, описанной в примере 28, 6-бромметил-4-хлорхиназолин (0,5 г) подвергали взаимодействию с 3-метиланилином (0,204 г). Смесь образовавшегося продукта и натриевой соли 2-меркаптоэтанола (полученной в результате взаимодействия 2-меркаптоэтанола (0,38 г) с гидридом натрия (60% дисперсия в минеральном масле, 0,17 г) в N,N-диметилацетамиде (5 мл) перемешивали при температуре окружающей среды в течение 2 часов. Эту смесь выпаривали, а остаток очищали посредством хроматографии на колонках с обращенной фазой, используя в качестве элюента смесь метанола, воды и трифторуксусной кислоты с соотношением 11:9:0,04. Таким образом был получен 6-/2-гидроксиэтилтиометил/-4-/3'-метиланилино/хиназолин (0,38 г), температура плавления 93 - 94oC.
Спектр ЯМР: (CD3SOCD3) 2,37 (c., 3H), 2,52 (м., 2H), 3,56 (м., 2H), 3,98 (с., 2H), 7,1 - 8,1 (м., 6H), 8,60 (д., 1H), 8,84 (с., 1H).
Элементный анализ:
обнаружено: C 54,1, H 4,5, N 9,3
высчитано для C18H19N3 OS • 1,1CF3CO2H: C 53,8, H 4,5, N 9,3%.
Пример 31
Смесь 7-метоксикарбонил-4-/3'-метиланилино/хиназолина (1,3 г) и 2 н. водного раствора гидроксида натрия (10 мл) перемешивали и нагревали до 40oC в течение 4 часов. Полученную смесь охлаждали до температуры окружающей среды и подкисляли до pH 6, добавляя ледяную уксусную кислоту. Осадок отделяли, промывали водой и сушили. Таким образом был получен 7-карбокси-4-/3'-метиланилино/хиназолин (1,16 г), температура плавления > 280oC.
Спектр ЯМР: (CD3SOCD3) 2,36 (с., 3H), 6,98 (д., 1H), 7,29 (т., 1H), 7,66 (м. , 2H), 8,18 (м., 1H), 8,28 (д., 1H), 8,64 (с., 1H), 8,66 (д., 1H), 9,88 (с., 1H).
Элементный анализ:
обнаружено: C 67,3, H 4,8, N 14,8
высчитано для C16H13N3O2 • 0,3 H2O: C 67,3, H 4,8, N 14,7%
Пример 32.
Этилхлорформиат (0,146 г) и триэтиламин (0,162 г) по очереди добавляли к перемешанной смеси 7-карбокси-4-/3'-метиланилино/хиназолина (0,3 г) и тетрагидрофурана (5 мл). Эту смесь перемешивали при температуре окружающей среды в течение 1 часа. Добавляли борогидрид натрия (0,123 г) и перемешивали смесь при температуре окружающей среды в течение 2 часов. Полученную смесь подкисляли, добавляли 2 н. водной раствор хлористо-водородной кислоты, и выпаривали. Остаток растворяли в воде и экстрагировали метиленхлоридом. Водную фазу подщелачивали до pH 9 путем добавления насыщенного водного раствора гидроксида аммония и экстрагировали этилацетатом. Органическую фазу сушили (MgSO4) и выпаривали. Остаток очищали посредством хроматографии на колонках с использованием в качестве элюента смесей метиленхлорида и метанола с возрастающей полярностью. Таким образом был получен 7-гидроксиметил-4-/3'-метиланилино/хиназолин (0,125 г), температура плавления 175 - 177oC.
Спектр ЯМР (CD3SOCD3) 2,35 (с., 3H), 4,70 (д., 2H), 5,45 (т., 1H), 6,96 (д., 1H), 7,2 - 7,7 (м., 5H), 8,50 (с., 1H), 8,57 (с., 1H), 9,64 (с., 1H).
Элементный анализ:
обнаружено: C 72,2, H 5,8, N 15,8
высчитано для C16H15N3O: C 72,4, H 5,7, N 15,8%
Пример 33
В соответствии с процедурой, описанной в примере 11, 6-амино-4-/3'-трифторметиланилино/хиназолин подвергали взаимодействию с уксусным ангидридом, что позволило получить 6-ацетамидо-4-/3'-трифторметиланилино/хиназолин, выход которого составил 87%, в виде твердого вещества.
Спектр ЯМР: (CD3SOCD3) 2,14 (с., 3H), 7,45 (д., 1H), 7,64 (т., 1H), 7,78 (д. , 1H), 7,87 (м., 1H), 8,18 (д., 1H), 8,26 (с., 1H), 8,60 (с., 1H), 8,73 (д., 1H).
Элементный анализ:
обнаружено: C 58,7, H 3,9, N 16,1
высчитано для C17H13F3N4O: C 59,0, H 3,8, N 16,5%.
Пример 34.
В соответствии с процедурой, описанной в примере 1, соответствующий замещенный 4-хлорхиназолин подвергали взаимодействию с соответствующим анилином, что позволило получить в виде хлористо-водородных солей соединения, приведенные в таблице III, соответствие структур которых было подтверждено спектроскопией протонного магнитного резонанса и элементным анализом.
Примечания к табл. III:
а. Для этого продукта были получены следующие результаты элементарного анализа:
обнаружено: C 63,1, H 5,2, N 13,5
высчитано для C16H15N3O • 1,1 HCl: C 62,9, H 5,3, N 13,8%
и следующие характеристические данные спектра ЯМР (CD3SOCD3) 2,37 (с., 3H), 4,01 (с., 3H), 7,16 (д., 1H), 7,38 (м., 1H), 7,52 (с., 2H), 7,73 (м., 1H), 7,94 (д., 1H), 8,43 (д.,1H), 8,84 (с., 1H), 11,63 (с., 1H).
4-Хлор-6-метоксихиназолин, используемый в качестве исходного материала, получали из 5-метоксиантраниловой кислоты в соответствии с процедурами, описанными в части примера 1, посвященной получению исходных материалов.
5-Метоксиантраниловую кислоту, используемую в качестве исходного материала, получали следующим образом:
Смесь 5-хлор-2-нитробензойной кислоты (60,5 г) и тионилхлорида (113 мл) перемешивали и нагревали до температуры кипения с обратным холодильником в течение 4 часов. Полученную смесь выпаривали. Образовавшееся вещество добавляли к раствору, полученному путем добавления натрия (15,2 г) к метанолу (250 мл). Эту смесь нагревали до температуры кипения с обратным холодильником в течение 4 часов. Смесь выпаривали, а остаток распределяли этилацетатом и водой. Органический слой сушили (MgSO4) и выпаривали. Остаток очищали посредством хроматографии на колонках с использованием в качестве элюента смесей метиленхлорида и метанола с возрастающей полярностью. Таким образом был получен метил-5-метокси-2-нитробензоат в виде масла (22,5 г).
Смесь полученного таким образом материала, катализатора, представляющего 10% палладированный уголь (2,1 г), этанола (200 мл) и формиата аммония (25,2 г) перемешивали и нагревали до 70oC в течение 2 часов. Смесь фильтровали, а фильтрат выпаривали. Остаток распределяли между метиленхлоридом и разбавленным водным раствором бикарбоната натрия. Органический слой сушили (MgSO4) и выпаривали с образованием метил-2-амино-5-метоксибензоата (15,2 г).
Смесь полученного таким образом материала, 2 н. водного раствора гидроксида натрия (150 мл) и 1,4-диоксана (50 мл) перемешивали и нагревали до 40oC в течение 3 часов. Выпаривали в целом весь 1,4-диоксан, водный остаток подкисляли до pH 4 путем добавления концентрированной хлористо-водородной кислоты и экстрагировали раствор этилацетатом. Органическую фазу сушили (MgSO4) и выпаривали с образованием 5-метоксиантраниловой кислоты (14,1 г).
b. Реакционную смесь нагревали до температуры кипения с обратным холодильником в течение 3 часов. Для этого продукта были получены следующие результаты элементного анализа:
обнаружено: C 55,4, H 4,0, N 12,8
высчитано для C15H12ClN3O • 1,1 HCl: C 55,2, H 4,0, N 12,9%
и следующие характеристические данные спектра ЯМР: (CD3SOCD3) 4,02 (с., 3H), 7,37 (м., 1H), 7,53 (м., 1H), 7,67 (м., 2H), 7,95 (м., 2H), 8,51 (д., 1H), 8,91 (с., 1H), 11,62 (с., 1H).
c. В качестве необходимого хиназолина использовали 6-ацетокси-4-хлорхиназолин и реакционную смесь нагревали до температуры кипения с обратным холодильником в течение 2,5 часов. Для этого продукта были получены следующие результаты
элементного анализа:
обнаружено: C 58,6, H 5,3, N 13,4
высчитано для C15H13N3O • 1HCl • 1H2O : C 58,9 H 5,2, N 13,7%.
и следующие характеристические данные спектра ЯМР: (CD3SOCD3) 2,36(с., 3H), 7,14(д. , 1H), 7,36(т., 1H), 7,41(д., 1H), 7,41(д., 2H), 7,72(м., 1H), 7,90(д., 1H), 8,07(д., 1H), 8,78(с., 1H), 10,42(с., 1H), 11,22(с.. 1H).
6-Ацетокси-4-хлорхиназолин, используемый в качестве исходного материала, получали следующим образом:
В соответствии с процедурой, описанной в части примера 1, посвященной получению исходных материалов, 5-гидроксиантраниловую кислоту превращали в 6-гидроксихиназолин-4-он. К смеси 6-гидроксихиназолин-4-она (2 г), триэтиламина (1,37 г) и N,N-диметилформамида (60 мл) по каплям добавляли уксусный ангидрид (1,38 г). Полученную смесь перемешивали при температуре окружающей среды в течение 1 часа. Эту смесь выпаривали с образованием 6-ацетоксихиназолин-4-она, который подвергали взаимодействию с тионилхлоридом в соответствии с процедурой, описанной в части примера 1, посвященной получению исходных материалов.
d. Для этого продукта были получены следующие результаты элементного анализа:
обнаружено: C 54,1, H 3,7 N 11,7
высчитано для C16H12F3N3O • 1HCl: C 54,0 H 3,7 N 11,8%
и следующие характеристические данные спектра ЯМР: (CD3SOCD3) 2,37(с., 3H), 7,17(с. , 1H), 7,38(т., 1H), 7,51(д., 2H), 8,07(м., 2H), 8,91(м., 2H), 11,45(с., 1H).
4-Хлор-6-трифторметоксихиназолин, используемый в качестве исходного материала, получали из 5-трифторметокcиантраниловой кислоты в соответствии с процедурами, описанными в части примера 1, посвященной получению исходных материалов.
e. Реакционную смесь нагревали до температуры кипения с обратным холодильником в течение 2 часов. Для этого продукта были получены следующие результаты элементного анализа:
обнаружено: C 51,7, H 3,7, N 11,1
высчитано для C16H13ClFN3O2 • 1 HCl: C 51,9, H 3,8, N 11,4%
и следующие характеристические данные спектра ЯМР: (CD3SOCD3) 4,01(с., 3H), 4,04(с.,3H), 7,45(с.,1H), 7,59(т.,1H), 7,84(м.,1H), 8,1(м.,1H), 8,51(с. ,1H), 8,93(с.,1H), 11,74(с.,1H).
f. Реакционную смесь нагревали до температуры кипения с обратным холодильником в течение 2 часов. Для этого продукта были получены следующие характеристические данные спектра ЯМР: (CD3SOCD3) 4,04(с.,3H), 4,08(с.,3H), 7,35(с. , 1H), 7,91(с.,1H), 8,03(д.,1H), 8,18(м.,1H), 8,47(д.,1H), 8,74(с., 1H), 9,93(с.,1H).
g. Реакционную смесь нагревали до температуры кипения с обратным холодильником в течение 2 часов. Для этого продукта были получены следующие результаты элементного анализа:
обнаружено: C 49,7, H 3,7, N 11,0
высчитано для C16H13Cl2N3O2 1 HCl: C 49,7, H 3,65, N 10,9%
и следующие характеристические данные спектра ЯМР: (CD3SOCD3) 4,01(с., 3H), 4,04(с. , 3H), 7,36(с. , 1H), 7,74(м.,1H), 7,83(м.,1H), 8,17(д.,1H), 8,38(с.,1H), 8,19(с.,1H), 11,55(с.,1H).
h. Реакционную смесь нагревали до температуры кипения с обратным холодильником в течение 2 часов. Для этого продукта были получены следующие данные элементного анализа:
обнаружено: C 53,1, H 4,2, N 15,3
высчитано для C16H14N4O4 • 1HCl: C 53,0, H 4,2, N 15,4% и следующие характеристические данные спектра ЯМР: (CD3SOCD3) 4,0(с.,3H), 4,04(с.,3H), 7,37(с. , 1H), 7,75(т.,1H), 8,11(м.,1H), 8,40(с.,1H), 8,74(м.,1H), 8,88(с., 1H), 11,58(с.,1H).
i. Реакционную смесь нагревали до температуры кипения с обратным холодильником в течение 3 часов. Для этого продукта были получены следующие результаты элементного анализа:
обнаружено: C 59,1 H 5,0, N 12,7
высчитано для C16H15N3O2 • 1 HCl • 0,35H2O: C 59,3, H 5,2, N 13,0%
и следующие характеристические данные спектра ЯМР: (CD3SOCD3) 3,99(с., 3H), 4,02(с. , 3H), 7,1-7,6(м.,4H), 7,68-7,75(м.,2H), 8,43(с.,1H), 8,80(с., 1H).
j. Реакционную смесь нагревали до температуры кипения с обратным холодильником в течение 2 часов. Для этого продукта были получены следующие результаты элементного анализа:
обнаружено: C 48,3 H 3,5, N 13,5
высчитано для C16H13CIN4O4 • 1HCl: C 48,4, H 3,5, N 14,1%
и следующие характеристические данные спектра ЯМР:(CD3SOCD3) 4,01(с., 3H), 4,05(с. , 3H), 7,34(с. , 1H), 7,86(д.1H), 7,88(д.,1H), 8,23(м..1H), 8,48(с.,1H), 8,64(д.,1H), 8,94(с.,1H), 11,87(с.,1H).
k. Для этого продукта были получены следующие результаты элементного анализа:
обнаружено: C 50,7, H 3,4, N 14,2
высчитано для C16H13FN4O4 • 1 HCl: C 50,5, H 3,7, N 14,7%
и следующие характеристические данные спектра ЯМР: (CD3SOCD3) 4,0(с., 3H), 4,04(с. , 3H), 7,40(с. , 1H), 7,71(м.,1H), 8,29(м.,1H), 8,50(с.,1H), 8,65(м.,1H), 8,92(с.,1H), 11,9(широкий синглет, 1H).
Пример 35
3-Метиланилин (0,123 г) по каплям добавляли к перемешанному раствору 6-бромметил-4-хлорхиназолина (0,3 г) в N,N-диметилформамида (3 мл). Полученную смесь перемешивали при температуре окружающей среды в течение 2 часов. Добавляли простой диэтиловый эфир (10 мл) и отделяли осадок. Таким образом был получен 6-бромметил-4-/3'-метиланилино/хиназолин, выход которого составил 32%, температура плавления > 260oC (разлагается).
Спектр ЯМР: (CD3SOCD3) 2,37(с.,3H), 4,98(с.,2H), 7,17(д.,1H), 7,39(т., 1H), 7,53(м. , 2H), 7,95(д. , 1H), 8,15(м.,1H), 8,93(с.,1H), 8,96(д..1H), 11,59(широкий синглет, 1H).
Элементный анализ:
Обнаружено: C 56,5, H 4,6, N 12,3
высчитано для C16H14BrN3 • 0,25 HCl: C 56,9, H 4,3, N 12,4%.
6-Бромметил-4-хлорхиназолин, используемый в качестве исходного материала, получали так, как описано в примечании g к таблице II примера 6.
Пример 36
В соответствии с процедурой, описанной в примере 7, производили восстановление 6,7-диметокси-4-/3'-метиланилино/-5-нитрохиназолина, что позволило получить 5-амино-6,7-диметокси-4-/3'-метиланилино/хиназолин, который очищали посредством хроматографии на колонках с использованием в качестве элюента смесей метиленхлорида и этилацетата с возрастающей полярностью. Таким образом был получен целевой продукт, выход которого составил 55%, температура плавления 181-182oC.
Спектр ЯМР: (CD3SOCD3) 2,30(с.,3H), 3,70(с.,3H), 3,86(с.,3H), 6,51(с., 1H), 6,86(д.,1H), 7,10(м.,2H), 7,19(т., 1H), 7,90(с.,1H).
Элементный анализ
обнаружено: C 65,4, H 5,9, N 17,6
высчитано для C17H18N4O2 • 0,15 H2O: C 65,2, H 5,8, N 17,9%.
6,7-Диметокси-4-/3'-метиланилино/-5-нитрохиназолин, используемый в качестве исходного материала, получали следующим образом:
6,7-Диметоксихиназолин-4-он (10 г) порциями добавляли к перемешанной смеси концентрированной серной кислоты (30 мл) и дымящей азотной кислоты (30 мл), которую предварительно охлаждали до 0oC. Полученную смесь перемешивали при температуре окружающей среды в течение 1 часа. Эту смесь выливали в смесь воды со льдом (500 мл). Осадок отделяли, промывали водой и сушили. Таким образом был получен 6,7-диметокси-5-нитрохиназолин-4-он (9,51 г).
В соответствии с процедурами, описанными в примере 1, полученное соединение превращали в 6,7-диметокси-4-/3'-метиланилино/-5-нитрохиназолин, выход которого составил 71%, температура плавления 151-155oC.
Спектр ЯМР: (CD3SOCD3) 2,30(с.,3H), 3,86(с.,3H), 4,02(с.,3H), 6,75(м., 2H), 6,88(д.,1H), 7,22(т.,1H), 7,28(с.,1H), 7,85(с.,1H).
Пример 37
В соответствии с процедурой, описанной в примере 7, за исключением того, что реакционную смесь нагревали до 70oC в течение 2 часов, производили восстановление 4-/3-метиланилино/ -7-метилтио-6-нитрохиназолина с образованием 6-амино-4-/3'-метиланилино/-7-метилтиохиназолина, который очищали посредством хроматографии на колонках с использованием в качестве элюента смесей метиленхлорида и этилацетата с возрастающей полярностью. Таким образом был получен целевой продукт, выход которого составил 22%, температура плавления 217-218oC.
Спектр ЯМР: (CD3SOCD3) 2,33(с.,3H), 2,59(с.,3H), 5,34(широкий синглет, 2H), 6,90(д. , 1H), 7,24(т. , 1H), 7,44(c.,1H), 7,50(с.,1H), 7,63(с.,2H), 8,47(с.,1H).
Элементный анализ:
обнаружено: C 64,8, H 5,4, N 18,7
высчитано для C16H16N4S: C 64,8, H 5,4, N 18,9%
4-/3'-метиланилино/-7-метилтио-6-нитрохиназолин, используемый в качестве исходного материала, получали следующим образом:
Смесь 4-хлорантраниловой кислоты (17,2 г) и формамида (10 мл) перемешивали и нагревали до 130oC в течение 45 минут и до 175oC в течение 75 минут. Полученную смесь охлаждали до 100oC и добавляли 2-/2-этоксиэтокси/этанол (50 мл). Образовавшийся раствор выливали в смесь (250 мл) воды со льдом. Осадок отделяли, промывали водой и сушили. Таким образом был получен 7-хлор-хиназолин-4-он (15,3 г, 85%).
После повторного выполнения этой реакции 7-хлорхиназолин-4-он (30 г) порциями добавляли к перемешанной смеси концентрированной серной кислоты (60 мл) и дымящей азотной кислоты (60 мл), которую предварительно охлаждали до 0oC. Эту смесь перемешивали при температуре окружающей среды в течение 1 часа, а затем нагревали до 110oC в течение 30 минут. Смесь охлаждали до температуры окружающей среды и выливали в смесь воды со льдом (1 л). Осадок отделяли, промывали водой и сушили. Таким образом был получен 7-хлор-6-нитрохиназолин-4-он (38,1 г).
В соответствии с процедурами, описанными в примере 1, полученный материал превращали в 7-хлор-4-/3'-метиланилино/-6-нитрохиназолин, выход которого составил 59%, температура плавления 271-274oC.
Порцию (0,9 г) полученного таким образом вещества растворяли в N, N-диметилацетамида (15 мл). Добавляли метантиолат натрия (0,44 г) и перемешивали смесь при температуре окружающей среды в течение 1 часа. Эту смесь подкисляли, добавляя ледяную уксусную кислоту. Смесь выпаривали, а остаток растирали под слоем метиленхлорида. Полученное твердое вещество распределяли между метиленхлоридом и разбавляли водным раствором гидроксида аммония. Органический слой сушили (MgSO4) и выпаривали с образованием 4-/3'-метиланилино/-7-метилтио-6-нитрохиназолина (0,473 г), температура плавления 230-231oC.
Спектр ЯМР: (CD3SOCD3) 2,33 (c.,3H), 2,63 (c.,3H), 6,97 (д.,1H), 7,28 (т.,1H), 7,61 (с., 1H), 7,63 (м.,2H), 8,63 (с.,1H), 9,70 (с.,1H).
Элементный анализ:
обнаружено: C 58,6, H 4,6, N 17,2
высчитано для C16H14N4O2S: C 58,8, H 4,3, N 17,1%
Пример 38
Смесь 7-метокси-4/3'-метиланилино/6-нитрохиназолина (0,4 г), катализатора, представляющего 10% палладированный уголь (0,06 г), N, N-диметилформамида (5 мл) и этанола (20 мл) перемешивали при атмосферном давлении, создаваемом водородом, в течение 5 часов. Смесь фильтровали, а фильтрат выпаривали. Остаток очищали посредством хроматографии на колонках из силикагеля с обращенной фазой, используя в качестве элюента смеси метанола, воды и трифторуксусной кислоты и возрастающей полярностью. Таким образом по очереди были получены 6-гидрокси-амино-7-метокси-4-/3'-метиланилино/хиназолин (0,038 г), температура плавления 130-147oC.
Спектр ЯМР: (CD3SOCD3) 2,35 (с., 3H), 4,02 (с., 3H), 7,12 (д., 1H), 7,19 (с., 1H), 7,34 (т.,1H), 7,48 (м., 2H), 8,10 (с., 1H), 8,70 (с., 1H)/
Элементный анализ:
обнаружено: C 44,0, H 3,5, N 10,5
высчитано для C16H16N4O2•1H2O•2CF3CO2H: C 44,3, H 3,7, N 10,7% 6-амино-7-метокси-4-/3'-метиланилино/хиназолин (0,049 г), температура плавления 85-95oC.
Спектр ЯМР: (CD3SOCD3) 2,36(с.,3H), 4,03 (с.,3H), 7,12 (д., 1H), 7,18(с. ,1H), 7,35 (т.,1H), 7,45 (м., 2H), 7,62 (с.1H), 8,69(с.1H).
Элементный анализ:
обнаружено: C 52,3, H 4,0, N 13,0
высчитано для C16H16N4O•1,3CF3CO2H: C 52,1, H 4,0, N 13,1%.
7-Метокси-4-/3'-метиланилино/-6-нитрохиназолин, используемый в качестве исходного материала, получали следующим образом:
7-Хлор-4-/3'-метиланилино/-6-нитрохиназолин (0,35 г) порциями добавляли к раствору метилата натрия в метаноле (полученному путем добавления натрия (0,055 г) к метанолу ( 5 мл)). Эту смесь перемешивали и нагревали до температуры кипения с обратным холодильником в течение 1 часа. Добавляли вторую порцию натрия (0,069 г) и нагревали смесь до температуры кипения с обратным холодильником в течение 5 часов. Смесь выпаривали, а остаток очищали посредством хроматографии на колонках из силикагеля с обращенной фазой, используя в качестве элюента сначала смесь воды, метанола и трифторуксусной кислоты с соотношением 50: 50:0,2, а затем смеси воды, метанола и трифторуксусной кислоты с убывающей полярностью. Таким образом был получен 7-метокси-4-/3 '-метиланилино-6-нитрохиназолин (0,81 г), температура плавления 149-154oC.
Пример 39
1,2-Дибромэтан (10,9 г) добавляли к перемешанной смеси 7-гидрокси-6-метокси-4-/3'-метиланилино/хиназолина (2,5 г), карбоната калия (3,69 г) и N, N-диметилформамида (60 мл). Полученную смесь перемешивали при температуре окружающей среды в течение 30 минут, а затем нагревали до 80oC в течение 2 часов. Смесь выпаривали, а остаток распределяли между метиленхлоридом и водой. Органическую фазу сушили (MgSO4) выпаривали. Остаток очищали посредством хроматографии на колонках с использованием в качестве элюента смесей метиленхлорида и метанола с возрастающей полярностью. Таким образом был получен 7-/2-бромэтокси/-6-метокси-4-/3'-метиланилино/хиназолин (2,8 г), температура плавления 86-89oC.
Спектр ЯМР: (CD3SOCD3) 2,35 (с., 3H), 3,89 (т., 2H), 3,99 (c., 3H), 4,51 (т.,2H), 7,21 (с.,1H), 7,28(т., 1H), 7,58 (с., 1H), 7,62 (д., 1H), 7,88 (с., 1H), 8,46 (с., 1H), 8,94 (д.,1H), 9,46 (с., 1H).
Элементный анализ:
обнаружено: C 55,7, H 5,9, N 11,9
высчитано для C18H18BrN3O2•0,9 DMF: C 55,5, H 5,6, N 11,7%
Пример 40
Смесь 7-/2-бромэтокси/-6-метокси-4-/3'-метиланилино/хиназолина (0,25 г) и анилина (4 мл) перемешивали при температуре окружающей среды в течение 16 часов. Полученную смесь выпаривали, а остаток очищали посредством хроматографии на колонках с использованием в качестве элюента смесей метиленхлорида и этилацетата с возрастающей полярностью. Таким образом был получен 7-/2-анилиноэтокси/6-метокси-4-/3'-метиланилино/хиназолин (0,169 г), температура плавления 160-162oC.
Спектр ЯМР: (CD3SOCD3) 2,35 (с., 3H), 3,51 (м., 2H), 3,97 (с., 3H), 4,30 (т. , 2H), 6,58 (т., 1H), 6,66 (д.,2H), 6,94 (д., 1H), 7,12 (т., 2H), 7,20 (с., 1H), 7,28(т.,1H), 7,58 (с., 1H), 7,63 (д., 1H), 7,87 (с., 1H), 8,48 (с. , 1H), 9,50(с., 1H).
Элементный анализ:
обнаружено: С 69,6, H 6,2, N 13,6
высчитано для C24H24N4O2• 0,75 H2O: C 69,6, H 6,2, N 13,5%
Пример 41
Смесь 7-/2-бромэтокси/-6-метокси-4-/3'-метиланилино/-хиназолина (0,25 г) и морфолина (4 мл) перемешивали при температуре окружающей среды в течение 4 часов. Полученную смесь выпаривали, а остаток распределяли между метиленхлоридом и разбавленным водным раствором бикарбоната натрия. Органическую фазу сушили (MgSO4) и выпаривали. Остаток растирали под слоем простого диэтилового эфира с образованием 6-метокси-4-/3'-метиланилино/-7-/2-морфолиноэтокси/хиназолина (0,198 г), температура плавления 168-170oC.
Спектр ЯМР: (CD3SOCD3) + CD3CO2D) 2,35 (с., 3H), 3,15 (т., 4H), 3,81 (т. , 4H), 3,96 (с., 3H), 6,93 (д., 1H), 7,21 (с., 1H), 7,26 (т., 1H), 7,58 (с., 1H), 7,63 (д., 1H), 7,84 (с., 1H), 8,44(с., 1H), 9,58(с.,1H).
Элементный анализ:
обнаружено: C 64,3, H 6,9, N 13,8
высчитано для C22H26N4O3•0,9 H2O: C 64,3, H 6,8, N 13,6%,
Пример 42
2-Метоксиацетилхлорид (0,085 г) добавляли к перемешанному раствору 7-гидрокси-6-метокси-4-/3'-метиланилино/хиназолина (0,2 г) в N, N-диметилацетамида (1 мл), после чего смесь перемешивали при температуре окружающей среды в течение 16 часов. Добавляли вторую порцию 2-метоксиацетилхлорида (0,085 г) и нагревали смесь до 45oC в течение 3 часов. Полученную смесь охлаждали до температуры окружающей среды и добавляли этилацетат (5 мл). Осадок отделяли, промывали этилацетатом и простым диэтиловым эфиром, а затем сушили в условиях вакуума. Таким образом был получен 6-метокси-7-/2-метоксиацетокси/-4/3'-метиланилино/хиназолин (0,218 г), температура плавления 215-219oC.
Спектр ЯМР: (CD3SOCD3) 2,37 (с. , 3H), 3,43 (с., 3H), 4,06 (с., 3H), 4,45(с. , 2H), 7,16(д. , 1H), 7,33 (с.,1H), 7,38(т., 1H), 7,52(м., 2H), 8,83(с., 1H), 8,62(с., 1H).
Элементный анализ:
обнаружено: C 53,5, H 5,8, N 10,0
высчитано для C19H19N3O4•1HCl•2H2O: C 53,5, H 5,6, N 9,9%
Пример 43
Смесь 6-амино-4-/3'-метиланилино/хиназолина (0,25 г), бензоилхлорида (0,148 г), триэтиламина (2 мл) и N,N-диметилформамида (2 мл) перемешивали и нагревали до 100oC в течение 3 часов. Добавляли еще одну порцию бензоилхлорида (0,296 г) и нагревали смесь до 100oC в течение еще 3 часов. Полученную смесь охлаждали до температуры окружающей среды и распределяли между метиленхлоридом и водой. Органическую фазу сушили (MgSO4) и выпаривали. Остаток очищали посредством хроматографии на колонках с использованием в качестве элюента смесей метиленхлорида и этилацетата с возрастающей полярностью Таким образом был получен 6-бензамидо-4-/3'-метиланилино/хиназолин (0,142 г), температура плавления 243 - 245oC.
Спектр ЯМР: (CD3SOCD3) 2,34 (с., 3H), 6,95 (д., 1H), 7,27 (м., 1H), 7,6 (м. , 5H), 7,79 (д., 1H), 8,01 (м., 1H), 8,04 (м., 2H), 8,52 (с., 1H), 8,90 (д., 1H), 9,80 (с., 1H), 10,55 (с., 1H).
Элементный анализ:
обнаружено: C 73,2, H 5,0, N 15,4
высчитано для C22H18N4O•0,25 H2O: C 73,6, H 5,2, N 15,6%.
Пример 44
Смесь 6-амино-4-/3'-метиланилино/хиназолина (0,75 г), метил-3-хлорформилпропионата (0,451 г), триэтиламина (0,303 г) и толуола (6 мл) перемешивали и нагревали до температуры кипения с обратным холодильником в течение 4 часов. Эту смесь выпаривали, а остаток очищали посредством хроматографии на колонках, используя в качестве элюента смеси метиленхлорида и метанола с возрастающей полярностью. Таким образом был получен 6-/3-метоксикарбонилпропионамидо/-4-/3'-метиланилино/хиназолин (0,46 г), температура плавления 202 - 203oC.
Спектр ЯМР: (CD3SOCD3) 2,34(с.,3H), 2,68 (м., 4H), 3,61(с., 3Н), 6,95 (д. , 1H), 7,26 (т., 1H), 7,6 (с., 2H), 7,74 (д., 1H), 7,84 (м., 1H), 8,52 (с., 1H), 8,70 (д., 1H), 9,8 (с., 1H), 10,3 (с., 1H).
Элементный анализ:
обнаружено: C 65,3, H 5,5, N 14,8
высчитано для C20H20N4O3: C 65,2, H 5,5, N 15,0%
Пример 45
Смесь 6-амино-4-/3'-метиланилино/хиназолина (0,5 г), метил-4-хлорбутирата (1 мл) и триэтиламина (0,55 мл) перемешивали и нагревали до 100oC в течение 4 часов. Полученную смесь охлаждали от температуры окружающей среды и распределяли между метиленхлоридом и водой. Органический слой сушили (MgSO4) и выпаривали. Остаток очищали посредством хроматографии на колонках, используя в качестве элюента смеси метиленхлорида и метанола с отношением 20: 1. Таким образом был получен 6-/3-метоксикарбонилпропиламино/-4-/3'-метиланилино/хиназолин (0,32 г).
Спектр ЯМР: (CD3SOCD3) 1,92 (м., 2H), 2,34 (с., 3H), 3,23 (м., 4H), 3,61 (с. , 3H), 6,22 (т., 1H), 6,93 (д., 1H), 7,18 (д., 1H), 7,25 (м., 1H), 7,29 (т., 1H), 7,6 (с., 1H), 7,65 (д., 1H), 8,43 (с., 1H), 9,25 (с., 1H).
Смесь полученного таким образом материала и простого дифенилового эфира (0,5 мл) перемешивали и нагревали до 160oC в течение 3 часов. Полученную смесь охлаждали до температуры окружающей среды и распределяли между метиленхлоридом и водой. Органическую фазу сушили (MgSO4) и выпаривали. Остаток очищали посредством хроматографии на колонках с использованием в качестве элюента смеси метиленхлорида и метанола с соотношением 20:1. Таким образом был получен 4-/3'-метиланилино/-6-/2-оксопирролидин-1-ил/хиназолин (0,053 г), температура плавления 212 - 215oC.
Спектр ЯМР: (CD3SOCD3) 2,15 (м., 2H), 2,35 (с., 3H), 2,59 (т., 2H), 4,01 (т., 2H), 7,02 (д., 1H), 7,30 (т., 1H), 7,6 (м., 2H), 7,8 (д., 1H), 8,24 (д. , 1H), 8,55 (с., 1H), 8,60 (м., 1H), 9,88 (с., 1H).
Элементный анализ:
обнаружено: C 64,8, H 5,0, N 14,9
высчитано для C19H18N4O•0,75CH2Cl2•0,5H2O: C 64,4, H 5,4, N 14,6
Пример 46
Фенилизоцианат (0,193 г) добавляли к перемешанной смеси 6-амино-4-/3'-метиланилино/хиназолина (0,39 г) и тетрагидрофурана (15 мл), которую предварительно охлаждали до -2oC. Полученную смесь перемешивали при температуре 5oC в течение 10 минут, а затем оставляли для нагревания до температуры окружающей среды. Смесь выпаривали, а остаток очищали посредством хроматографии на колонках, используя в качестве элюента смесь метиленхлорида и метанола с соотношением 20:1. Таким образом был получен 4-/3'-метиланилино/-6-/3-фенилуредо/хиназолин (0,335 г), температура плавления 224 - 226oC.
Спектр ЯМР: (CD3SOCD3) 2,34 (с., 3H), 6,94 (д., 1H), 7,01 (м., 1H), 7,28 (м. , 2H), 7,30 (т., 1H), 7,51 (м., 2H), 7,62 (м., 2H), 7,73 (д., 1H), 7,92 (м. , 1H), 8,46 (д., 1H), 8,49 (с., 1H), 8,90 (с., 1H), 8,94 (с., 1H), 9,75 (с., 1H)
Элементный анализ:
обнаружено: C 65,2, H 5,5, N 17,2
высчитано для C22H19N5O•2H2O: С 65,2, H 5,7, N 17,3%.
Пример 47
Раствор цианата натрия (0,195 г) в воде (3 мл) добавляли к перемешанному раствору 6-амино-4-/3'-метиланилино/хиназолина (0,25 г) в воде (5 мл) и уксусной кислоте (0,1 мл). Полученную смесь перемешивали при температуре окружающей среды в течение 2 часов. Смесь выпаривали, а остаток очищали посредством хроматографии на колонках из силикагеля с обращенной фазой, используя в качестве элюента сначала смесь метанола, воды и трифторуксусной кислоты с соотношением 30:70:0,2, а затем такую же смесь с соотношением 45: 55: 0,2. Таким образом был получен 4-/3'-метиланилино/-6-уреидохиназолин (0,047 г), температура плавления > 230oC (разлагается).
Спектр ЯМР: (CD3SOCD3) 2,36 (с., 3H), 6,18 (с., 2H), 7,12 (д., 1H), 7,36 (м. , 1H), 7,48 (м., 2H), 7,79 (д., 1H), 8,01 (м., 1H), 8,65 (д., 1H), 8,75 (с., 1H), 9,11 (с., 1H), 11,12 (с., 1H).
Элементный анализ:
обнаружено: C 48,8, H 4,1, N 15,4
высчитано для C16H15N5O•1H2O•1,3CF3CO2H: C 48,6, H 4,0, N 15,2%.
Пример 48
Бензохлорид (0,378 г) добавляли к перемешанной смеси 7-гидрокси-6-метокси-4-/3'-метиланилино/хиназолин (0,281 г), карбоната калия (0,414 г) и N, N-диметилацетамида (4 мл). Полученную смесь перемешивали при температуре окружающей среды в течение 10 минут, а затем нагревали до 60oC в течение 1 часа. Смесь выпаривали, а остаток очищали посредством хроматографии на колонках, используя в качестве элюента сначала метиленхлорид, а затем смесь метиленхлорида и метанола с соотношением 100:3. Таким образом был получен 7-бензилокси-6-метокси-4-/3'-метиланилино/хиназолин (0,225 г), температура плавления 203 - 205oC.
Спектр ЯМР: (CD3SOCD3) 2,34 (с., 3H), 3,97 (с., 3H), 5,28 (с., 2H), 6,93 (д., 1H), 7,27 (т., 1H), 7,28 (с., 1H), 7,22 - 7,55 (м., 5H), 7,58 (с., 1H), 7,63 (д., 1H), 7,87 (с., 1H), 8,44 (с., 1H), 9,41 (с., 1H).
Элементный анализ:
обнаружено: C 74,0, H 5,8, N 11,1
высчитано для C23H21N3O2: C 74,4, H 5,7, N 11,3%
Пример 49
Изопропилбромид (0,246 г) добавляли к перемешанной смеси 7-гидрокси-6-метокси-4-/3'-метиланилино/хиназолина (0,281 г), карбоната калия (0,414 г) и N, N-диметилацетамида (3 мл). Полученную смесь перемешивали при температуре окружающей среды в течение 30 минут, а затем нагревали до 70oC в течение 1 часа. Эту смесь распределяли между этилацетатом и водой. Органическую фазу сушили (MgSO4) и выпаривали с образованием 7-изопропокси-6-метокси-4-/3'-метиланилино/хиназолина (0,28 г), температура плавления 218 - 221oC.
Спектр ЯМР: (CD3SOCD3) 1,36 (д., 6H), 2,34 (с., 3H), 3,94 (с., 3H), 4,83 (м. , 1H), 6,94 (д., 1H), 7,17 (с., 1H), 7,27 (т., 1H), 7,57 (с., 1H), 7,64 (д., 1H), 7,82 (с., 1H), 8,43 (с., 1H).
Элементный анализ:
обнаружено: C 69,4, H 6,7, N 12,0
высчитано для C19H21N3O2•0,3H2O•0,1EtOAC: C 69,0, H 6,6, N 12,4%
Пример 50
Этилйодид (0,624 г) добавляли к перемешанной смеси 6,7-дигидрокси-4-/3'-метиланилино/хиназолина (0,534 г), карбоната калия (0,828 г) и N,N-диметилацетамида (10 мл). Полученную смесь нагревали до 50oC в течение 2 часов. Добавляли вторую порцию этилйодида (0,624 г) и нагревали смесь до 60oC в течение 2 часов. Смесь выпаривали, а остаток очищали посредством хроматографии на колонках, используя в качестве элюента сначала метиленхлорид, а затем смеси метиленхлорида и метанола с возрастающей полярностью. Таким образом был получен, 6,7-диэтокси-4-/3'-метиланилино/хиназолин (0,26 г), температура плавления 178 - 180oC.
Спектр ЯМР: (CD3SOCD3) 1,43 и 1,44 (2 триплета, 6H), 2,34 (с., 3H), 4,2 (м. , 4H), 6,92 (д., 1H), 7,14 (с., 1H), 7,26 (т., 1H), 7,57 (с., 1H), 7,63 (д., 1H), 7,82 (с., 1H), 8,42 (с., 1H).
Элементный анализ:
обнаружено: C 69,1, H 6,6, N 12,2
высчитано для C19H21N3O2•0,48H2O: C 68,7, H 6,6, N 12,6%.
Пример 51.
2-Бромэтилметиловый эфир (0,834 г) добавляли к перемешанной смеси 6,7-дигидрокси-4-/3'-метиланилино/хиназолина (0,534 г), карбоната калия (0,828 г) и N,N'-диметилацетамида (10 мл). Полученную смесь перемешивали при температуре окружающей среды в течение 16 часов. Смесь выпаривали, а остаток распределяли между этилацетатом и водой. Органический слой сушили (MgSO4) и выпаривали. Остаток очищали посредством хроматографии на колонках с использованием в качестве элюента смесей метиленхлорида и метанола с возрастающей полярностью. Полученную смолу растворяли в этилацетате (4 мл) и подкисляли, добавляя насыщенный раствор хлороводорода в простом диэтиловом эфире. Осадок отделяли. Таким образом была получена хлористо-водородная соль 6,7-ди-/2-метоксиэтокси/-4-/3'-метиланилино/хиналозина (0,292 г), температура плавления 218-220oC.
Спектр ЯМР: (CD3SOCD3) 2,34 (с., 3H), 3,36 (с., 6H), 3,75-3,8 (м., 4H), 4,1-4,5 (м. , 4H), 7,14 (д., 1H), 7,37 (д., 1H), 7,40 (с., 1H), 7,48 (м., 2H), 8,35 (с., 1H), 8,79 (с., 1H).
Элементный анализ:
обнаружено: C 59,8, H 6,4, N 9,9
высчитано для C21H25N3O4 • 1HCI: C 60,0, H 6,2, N 10,0%
Пример 52
1,2-Дибромэтан (0,376 г) добавляли к перемешанной смеси 6,7-дигидрокси-4-/3'-метиланилино/хиназолина (0,524 г), карбоната калия (0,828 г) и N, N-диметилацетамида (20 мл). Полученную смесь нагревали до 100oC в течение 30 минут. Смесь выпаривали, а остаток очищали посредством хроматографии на колонках с использованием в качестве элюента смесей метиленхлорида и этилацетата с возрастающей полярностью. Таким образом был получен 6,7-этилендиокси-4-/3'-метиланилино/хиназолин (0,23 г), температура плавления 223-226oC.
Спектр ЯМР: (CD3SOCD3) 2,34 (с., 3H), 4,40 (с., 4H), 7,14 (д., 1H), 7,17 (с. , 1H), 7,26 (т., 1H), 7,66 (м., 2H), 8,10 (с., 1H), 8,34 (с., 1H), 9,38 (с., 1H).
Элементный анализ:
обнаружено: C 67,5, H 5,1, N 13,0
высчитано для C17H15N3O2 • 0,33H2O • 0,25EtOAc: C 67,2, H 5,5, N 13,1%
Пример 53
Смесь 6-бромметил-4-/3'-метиланилино/хиназолина (0,415 г) и морфолина (2 мл) перемешивали и нагревали до 60oC в течение 2 часов. Полученную смесь охлаждали до температуры окружающей среды и отделяли осадок. Образовавшееся твердое вещество распределяли между метиленхлоридом и водой. Органическую фазу промывали рассолом, сушили (MgSO4) и выпаривали. Таким образом был получен 6-морфолинометил-4-/3'-метиланилино/хиназолин (0,195 г), температура плавления 191-193oC.
Спектр ЯМР: (CD3SOCD3) 2,34 (с., 3H), 2,49 (т., 4H), 3,62 (т., 4H), 3,69 (с. , 2H), 6,96 (д.,1H), 7,29 (т., 1H), 7,69 (м., 2H), 7,74 (д., 1H), 7,85 (м., 1H), 8,45 (с., 1H), 8,55 (с., 1H), 9,71 (с., 1H).
Элементный анализ:
обнаружено: C 71,2, H 6,8, N 16,2
высчитано для C20H22N4O: C 71,2, H 6,6, N 16,6%.
Пример 54
Смесь 6-бромметил-4-/3'-метиланилино/хиназолина (0,3 г), анилина (0,085 г) и N,N-диметилацетамида (5 мл) перемешивали и нагревали до 80oC в течение 2 часов. Полученную смесь выпаривали, а остаток очищали посредством хроматографии на колонках с использованием в качестве элюента смесей метиленхлорида и метанола с возрастающей полярностью. Таким образом был получен 6-анилинометил-4-/3'-метиланилино/хиназолин в виде масла (0,254 г), которое растворяли в этилацетате. Добавляли насыщенный раствор хлороводорода в простом диэтиловом эфире и отделяли образовавшийся осадок. Таким образом был получен дигидрохлорид-6-анилинометил-4-/3'-метиланилино/хиназолина, температура плавления 216-221oC.
Спектр ЯМР: (CD3SOCD3) 2,30 (с., 3H), 4,45 (с., 2H), 6,6 (т., 1H), 6,7 (д. , 2H), 7,05 (д., 1H), 7,08 (д., 1H), 7,10 (д., 1H), 7,31 (м., 1H), 7,5 (м., 2H), 7,88 (д., 1H), 8,06 (м., 1H), 8,83 (с., 1H), 9,02 (с., 1H).
Элементный анализ:
обнаружено: C 60,4, H 5,8, N 12,9
высчитано для C22H20N4 • 2HCI • 1,33H2O: C 60,4, H 5,6, N 12,8%
Пример 55
Метилат натрия (0,073 г) добавляли к перемешанной смеси 6-бромметил-4-/3'-метиланилино/хиназолина (0,3 г) и метанола (5 мл). Полученную смесь перемешивали при температуре окружающей среды в течение 2 часов. Смесь выпаривали, а остаток очищали посредством хроматографии на колонках с использованием в качестве элюента смесей метиленхлорида и этилацетата с возрастающей полярностью. Таким образом был получен 6-метоксиметил-4-/3'-метиланилино/хиназолин в виде смолы (0,045 г).
Спектр ЯМР: (CD3SOCD3) 2,36 (с., 3H), 3,39 (с., 3H), 4,62 (с., 2H), 7,07 (д. , 1H), 7,35 (т., 1H), 7,58 (с., 2H), 7,82 (д., 1H), 7,92 (д., 1H), 8,65 (с., 1H), 8,76 (с., 1H).
Пример 56
Смесь 6-бромметил-4-/3'-метиланилино/хиназолина (0,5 г) и 2-метоксиэтанола (2,5 мл) перемешивали и нагревали до 80oC в течение 2 часов. Полученную смесь охлаждали до температуры окружающей среды и распределяли между метиленхлоридом и водой. Органическую фазу промывали рассолом, сушили (MgSO4) и выпаривали. Остаток очищали посредством хроматографии на колонках с использованием в качестве элюента смесей метиленхлорида и этилацетата с возрастающей полярностью. Таким образом был получен 6-/2-метоксиэтоксиметил/4-/3'-метиланилино/хиназолин в виде масла (0,211 г).
Спектр ЯМР: (CD3SOCD3) 2,34 (с., 3H), 3,27 (с., 3H), 3,53 (м., 2H), 3,63 (м., 2H), 4,67 (с., 2H), 6,96 (д., 1H), 7,28 (т., 1H), 7,7 (м., 2H), 7,8 (м. , 2H), 8,5 (с., 1H),8,57 (с., 1H), 9,8 (с., 1H).
Элементный анализ:
обнаружено: C 68,5, H 6,8, N 12,5
высчитано для C19H21N3O2: C 68,6, H 6,7, N 12,6%.
Пример 57
Метантиолат натрия (0,141 г) добавляли к перемешанной смеси 6-бромметил-4-/3'-метиланилино/хиназолина (0,6 г), триэтиламина (0,203 г) в N,N-диметилформамида (2 мл). Полученную смесь перемешивали при температуре окружающей среды в течение 4 часов. Смесь выпаривали, а остаток очищали посредством хроматографии на колонках с использованием в качестве элюента смесей метиленхлорида и этилацетата с возрастающей полярностью. Таким образом было получено масло, которое растирали под слоем смеси гексана и простого диэтилового эфира, что позволило получить 4-/3'-метиланилино/-6-метилтиометилхиназолин (0,205 г), температура плавления 134-136oC.
Спектр ЯМР: (CD3SOCD3) 2,01 (с., 3H), 2,34 (с., 3H), 3,88 (с., 2H), 6,97 (д. , 1H), 7,28 (т., 1H), 7,6 (м., 2H), 7,75 (д., 1H), 7,83 (м., 1H), 8,45 (д., 1H), 8,58 (с., 1H), 9,8 (Широкий синглет, 1H).
Элементный анализ:
обнаружено: C 69,7, H 5,8, N 14,2
высчитано для C17H17N3S • 0,1C6H14: C 69,5, H 6,1, N 13,8%
Пример 58
Триэтиламин (0,1 мл) добавляли к перемешанной смеси 6-бромметил-4-/3'-метиланилино/хиназолина (0,33 г), бензолтиола (0,11 г) и N,N-диметилацетамида (2 мл). Полученную смесь перемешивали при температуре окружающей среды в течение 5 часов. Эту смесь выпаривали, а остаток очищали посредством хроматографии на колонках с использованием в качестве элюента смесей метиленхлорида и этилацетата с возрастающей полярностью. Таким образом был получен 4-/3'-метиланилино/-6-фенилтиометилхиназолин (0,155 г), температура плавления 145-148oC.
Спектр ЯМР: (CD3SOCD3) 2,34 (с., 3H), 4,41 (с., 2H), 6,96 (д., 1H), 7,24 (т. , 1H), 7,3 (с., 5H), 7,65 (м., 2H), 7,72 (д., 1H), 7,86 (м., 1H), 8,54 (д., 1H), 8,55 (с., 1H), 9,73 (с., 1H).
Элементный анализ:
обнаружено: C 73,7, H 5,3, N 11,5
высчитано для C22H19N3S: C 73,9, H 5,4, N 11,8%.
Пример 59
Сукцинилдихлорид (0,207 г) добавляли к смеси 6-амино-4-/3'-метиланилино/хиназолина (0,33 г), триэтиламина (0,128 г) и толуола (5 мл). Полученную смесь перемешивали и нагревали до температуры кипения с обратным холодильником в течение 2 часов. Смесь выпаривали, а остаток очищали посредством хроматографии на колонках с использованием в качестве элюента смесей метиленхлорида и метанола с возрастающей полярностью. Таким образом был получен 4-/3'-метиланилино/-6-/2,5-диоксопирролидин-1-ил/хиназолин (0,082 г), температура плавления >150oC.
Спектр ЯМР: (CD3SOCD3) 2,34 (с., 3H), 2,90 (с., 4H), 6,98 (д., 1H), 7,28 (т. , 1H), 7,61 (д., 2H), 7,75 (м., 1H), 7,88 (д., 1H), 8,50 (д., 1H), 8,64 (с., 1H), 9,95 (с., 1H).
Элементный анализ:
обнаружено: C 64,9, H 5,2, N 15,2
высчитано для C19H16N4O2•0,4HCl• 0,4CH3OH: C 64,8, H 5,0, N 15,6%.
Пример 60
3-Хлорацетилхлорид (0,473 г) добавляли к смеси 6-амино-4-/3'-метиланилино/хиназолина (1 г), триэтиламина (0,423 г) и N,N-диметилформамида (5 мл). Полученную смесь перемешивали и нагревали до 50oC в течение 2 часов. Полученную смесь выпаривали, а остаток очищали посредством хроматографии на колонках с использованием в качестве элюента смесей метиленхлорида и метанола с возрастающей полярностью. Таким образом был получен 6-/2-хлорацетамидо/-4-/3'-метиланилино/хиназолин (0,775 г), температура плавления >290oC.
Спектр ЯМР: (CD3SOCD3) 2,32 (с., 3H), 4,33 (с., 2H), 6,94 (д., 1H), 7,25 (т. , 1H), 7,6 (м., 2H), 7,75 (д., 1H), 7,84 (м., 1H), 8,50 (с., 1H), 8,68 (д., 1H), 9,80 (с., 1H), 10,57 (с., 1H).
Элементный анализ:
обнаружено: C 62,6, H 4,5, N 17,1
высчитано для C17H15ClN4O: C 62,5, H 4,6, N 17,1%.
Пример 61
Цианборогидрид натрия (0,2 г) порциями добавляли к смеси 6-амино-4-/3'-метиланилино/хиназолина (0,5 г), формальдегида (37% раствор в воде, 0,8 мл) и ацетонитрила (15 мл). Полученную смесь перемешивали при температуре окружающей среды в течение 45 минут. Эту смесь нейтрализовали путем добавления ледяной уксусной кислоты и выпаривали. Остаток распределяли между метиленхлоридом и 2 н. водным раствором гидроксида натрия. Органическую фазу сушили (MgSO4) и выпаривали. Остаток очищали посредством хроматографии на колонках с использованием в качестве элюента смесей метиленхлорида и метанола с возрастающей полярностью. Таким образом был получен 6-диметиламино-4-/3'-метиланилино/хиназолин (0,237 г), температура плавления >200oC (разлагается).
Спектр ЯМР: (CD3SOCD3) 2,33 (с., 3H), 3,06 (с., 6H), 6,95 (д., 1H), 7,26 (т. , 1H), 7,41 (с., 1H), 7,48 (д., 1H), 7,6 (м., 2H), 7,65 (д., 1H), 8,37 (с., 1H), 9,5 (с., 1H).
Элементный анализ:
обнаружено: C 71,2, H 6,3, N 19,4
высчитано для C17H18N4•0,4H2O: C 71,5, H 6,6, N 19,6%.
Пример 62
В соответствии с процедурой, описанной в примере 39, за исключением того, что вместо N, N-диметилформамида использовали N,N-диметилацетамид и реакционную смесь нагревали до 80oC в течение 4 часов, 6-гидрокси-4-/3'-метиланилино/хиназолин подвергали взаимодействию с 1,2-дибромэтаном, что позволило получить 6-/2-бромэтокси/-4-/3'-метиланилино/хиназолин, выход которого составил 47%, температура плавления 129-135oC.
Спектр ЯМР: (CD3SOCD3) 2,35 (с., 3H), 3,92 (т., 2H), 4,52 (т., 2H), 6,95 (д. , 1H), 7,28 (т., 1H), 7,53 (м., 1H), 7,63 (м., 2H), 7,74 (д., 1H), 7,96 (д., 1H), 8,49 (с., 1H), 9,52 (с., 1H).
Элементный анализ:
обнаружено: C 57,5, H 4,2, N 11,5
высчитано для C17H16BrN3O: C 57,0, H 4,5, N 11,7%.
Пример 63
Выполняли процедуру, описанную в примере 62, за исключением того, что вместо 1,2-дибромэтана использовали 2-бромэтилметиловый эфир. Таким образом был получен 6-/2-метоксиэтокси/-4-/3'-метиланилино/хиназолин, выход которого составил 52%, температура плавления 177-179oC.
Спектр ЯМР: (CD3SOCD3) 2,35 (с., 3H), 3,36 (с., 3H), 3,76 (т., 2H), 4,29 (т. , 2H), 6,95 (д., 1H), 7,28 (м., 1H), 7,51 (м., 1H), 7,62 (с., 1H), 7,65 (д., 1H), 7,72 (д., 1H), 7,95 (д., 1H), 8,49 (с., 1H).
Элементный анализ:
обнаружено: C 69,4, H 6,2, N 13,2
высчитано для C18H19N3O2•0,1H2O: C 69,4, H 6,2, N 13,5%.
Пример 64
Газообразный диметиламин вводили в перемешанный раствор 6-/2-бромэтокси/-4-/3'-метиланилино/хиназолина (0,237 г) в N,N-диметилацетамиде (5 мл), после чего полученную смесь перемешивали при температуре окружающей среды в течение 16 часов. Смесь выпаривали, а остаток очищали посредством хроматографии на колонках с использованием в качестве элюента смесей метиленхлорида и метанола с возрастающей полярностью. Таким образом была получена бромисто-водородная соль 6-/2-диметиламиноэтокси/-4-/3'- метиланилино/хиназолина (0,177 г) температура плавления 83-86oC.
Спектр ЯМР: (CD3SOCD3) 2,35 (с., 3H), 2,5 (с., 6H), 3,09 (т., 2H), 4,35 (т. , 2H), 6,96 (д., 1H), 7,29 (м., 1H), 7,50 (м., 1H), 7,62 (м., 2H), 7,64 (д., 1H), 7,98 (д., 1H), 8,49 (с., 1H), 9,54 (с., 1H).
Элементный анализ:
обнаружено: C 56,6, H 5,9, N 13,6
высчитано для C19H22N4O•1HBr: C 56,6, H 5,7, N 13,9%.
Пример 65
Цианид натрия (0,121 г) и триэтиламин (0,303 г) по очереди добавляли к смеси 6-бромметил-4-/3'-метиланилино/хиназолина (0,3 г) и N,N-диметилацетамида (5 мл). Полученную смесь перемешивали при температуре окружающей среды в течение 16 часов. Смесь выпаривали, а остаток очищали посредством хроматографии на колонках с использованием в качестве элюениа смесей метиленхлорида и этилацетата с возрастающей полярностью. Таким образом был получен 6-цианометил-4-/3'-метиланилино/хиназолин в виде твердого вещества (0,084 г).
Спектр ЯМР: (CD3SOCD3) 2,34 (с., 3H), 4,24 (с., 2H), 6,98 (д., 1H), 7,29 (т., 1H), 7,61 (м., 2H), 7,83 (с., 2H), 8,56 (с., 1H), 8,62 (с., 1H).
Элементный анализ:
обнаружено: C 72,7, H 4,9, N 19,6
высчитано для C17H14N4•0,33H2O: C 72,8, H 5,2, N 20,0%.
Пример 66
Ди-/1-имидазолил/кетон (0,421 г) добавляли к смеси 7-карбокси-4-/3'-метиланилино/хиназолина (0,558 г) тетрагидрофурана (40 мл) и N,N-диметилформамида (20 мл). Полученную смесь перемешивали и нагревали до 40oC в течение 90 минут. Смесь охлаждали до 5oC и в течение 40 минут вводили в эту смесь диметиламин. Смесь выпаривали, а остаток растирали под водой. Образовавшееся твердое вещество отделяли и сушили. Таким образом был получен 7-/N, N-диметилкарбамоил/-4-/3'-метиланилино/хиназолин (0,55 г), температура плавления 207-209oC.
Спектр ЯМР: (CD3SOCD3 + CD3CO3D) 2,35 (с., 3H), 2,96 (с., 3H), 3,07 (с., 3H), 7,04 (д., 1H), 7,32 (т., 1H), 7,63 (м., 1H), 7,66 (с., 2H), 7,82 (д., 1H), 8,60 (д., 1H), 8,64 (с., 1H).
Элементный анализ:
обнаружено: C 69,6, H 5,8, N 18,1
высчитано для C18H18N4O•0,2H2O: C 69,8, H 5,9, N 18,1%.
Пример 67
В соответствии с процедурой, описанной в примере 1, 4-хлор-6-морфолинохиназолин подвергали взаимодействию с 3-метиланилином, что позволило получить хлористо-водородную соль 4-/3'-метиланилино/-6-морфолинохиназолина, выход которой составил 76%, температура плавления 276-278oC.
Спектр ЯМР: (CD3SOCD3) 2,38 (с., 3H), 3,41 (м., 4H), 3,82 (м., 4H), 7,18 (д. , 1H), 7,38 (м., 1H), 7,48 (с., 1H), 7,50 (д., 1H), 7,87 (с., 2H), 8,08 (с., 1H), 8,75 (с., 1H).
Элементный анализ:
обнаружено: C 63,9, H 6,0, N 15,4
высчитано для C18H20N4O•1HCl C 64,1, H 5,9, N 15,8%.
4-Хлор-6-морфолинохиназолин, используемый в качестве исходного материала, получали следующим образом:
Смесь 5-хлор-2-нитробензойной кислоты (20,2 г) и морфолина (50 мл) перемешивали и нагревали до температуры кипения с обратным холодильником в течение 3 часов. Полученную смесь выпаривали. Добавляли воду (100 мл) и подкисляли смесь до pH 2, вводя в нее концентрированную хлористо-водородную кислоту. Осадок отделяли, промывали водой и сушили. Таким образом была получена 2-нитро-5-морфолинобензойная кислота (24,3 г).
Смесь порции (10 г) полученного материала, катализатора, представляющего 10% палладированный уголь (1 г), и N,N-диметилацетамида (150 мл) нагревали до 40oC и перемешивали в атмосфере водорода в течение 4 часов. Смесь фильтровали, а фильтрат выпаривали. Остаток растирали под слоем простого диэтилового эфира с образованием 5-морфолиноантраниловой кислоты (6,05 г).
Смесь порции (5,5 г) полученного материала и формамида (20 мл) перемешивали и нагревали до 170oC в течение 4 часов. Полученную смесь охлаждали до температуры окружающей среды, осадок отделяли, по очереди промывали формамидом, этилацетатом и простым диэтиловым эфиром и сушили. Таким образом был получен 6-морфолинохиназолин-4-он (4,8 г), температура плавления 270 - 273oC.
Фосфорилхлорид (0,664 г) добавляли к перемешанной смеси 6-морфолинохиназолина (0,5 г), N,N-диметиланилина (0,471 г) и толуола (10 мл). Полученную смесь нагревали до температуры кипения с обратным холодильником в течение 1 часа. Смесь охлаждали до температуры окружающей среды, разбавляли толуолом (25 мл) и экстрагировали разбавленным водным раствором хлорида аммония. Органическую фазу сушили (MgSO4) и выпаривали. Остаток очищали посредством хроматографии на колонках, используя в качестве элюента смеси метиленхлорида и этилацетата с возрастающей полярностью. Таким образом был получен 4-хлор-6-морфолинохиназолин в виде твердого вещества (0,52 г).
Пример 68
Смесь 4-хлор-6,7-диметоксихиназолина (0,449 г), 1,3-фенилендиамина (0,433 г) и тетрагидрофурана (16 мл) перемешивали и нагревали до температуры кипения с обратным холодильником в течение 20 часов. Полученную смесь охлаждали до температуры окружающей среды. Осадок отделяли, промывали простым диэтиловым эфиром и сушили. Таким образом, была получена хлористо-водородная соль 4-/3'-аминоанилино/- 6,7-диметоксихиназолина (0,367 г), температура плавления 242 - 243oC.
Спектр ЯМР: (CD3SOCD3) 3,97 (с., 3H), 4,0 (с., 3H), 6,64 (м., 1H), 6,95 (д. , 1H), 7,02 (д., 1H), 7,16 (т., 1H), 7,87 (с., 1H), 8,25 (с., 1H), 8,72 (с., 1H), 10,99 (широкий синглет, 1H).
Элементный анализ:
обнаружено: C 57,6, H 5,0, N 16,4
высчитано для C16H16N4O2•1HCl •0,1H2O:C 57,4, H 5,2, N 16,7%.
Пример 69
В соответствии с процедурой, описанной в примере 68, 4-хлор-6,7- диметоксихиназолин подвергали взаимодействию с 3-аминофенолом, что позволило получить 4-/3'-гидроксианилино/-6,7-диметоксихиназолин, выход которого составил 92%, температура плавления 256 - 257oC.
Спектр ЯМР: 3,98 (с., 3H), 4,02 (с., 3H), 6,75 (м., 1H), 7,12 (д., 1H), 7,14 (д. , 1H), 7,25 (т., 1H), 7,42 (с., 1H), 8,37 (с, 1H), 8,80 (с., 1H), 9,5 (широкий максимум, 1H), 11,4 (широкий синглет, 1H).
Элементный анализ:
обнаружено: C 57,1, H 4,8, N 12,1
высчитано для C16H15N3O3•1HCl •0,25H2O: C 56,8, H 4,9, N 12,4%
Пример 70
Смесь 4-хлор-6-пиперидинохиназолина (0,371 г), 3,4-дихлоранилина (0,243 г), изопропанола (3 мл) и тетрагидрофурана (4 мл) перемешивали и нагревали до температуры кипения с обратным холодильником в течение 3 часов. Полученную смесь охлаждали до комнатной температуры. Осадок отделяли, промывали тетрагидрофураном и простым диэтиловым эфиром и сушили. Таким образом была получена хлористо-водородная соль 4-/3',4'- дихлоранилино/-6-пиперилинохиназолина (0,331 г, 54%), температура плавления >280oC.
Спектр ЯМР: (CD3SOCD3) 1,68 (м., 6H), 3,49 (м., 4H), 7,7 - 8,0 (м., 5H), 8,13 (с., 1H), 8,81 (с., 1H).
Элементный анализ:
обнаружено: C 56,4 H 4,7, N 13,6
высчитано для C19H18Cl2N4• 0,9 HCl: C 56,3, H 4,7, N 13,8%
4-Хлор-6-пиперидинохиназолин, используемый в качестве исходного материала, получали следующим образом: т
Смесь 5-хлор-2-нитробензойной кислоты (13,7 г), пиперидина (27 мл) и N, N-диметилацетамида (100 мл) перемешивали и нагревали до 120oC в течение 18 часов. Полученную смесь выпаривали. Остаток растворяли в воде и подщелачивали полученный раствор до pH 10, добавляя 2 н. водный раствор гидроксида натрия. Раствор экстрагировали этилацетатом. Водный слой подкисляли до pH 2, добавляя концентрированную хлористо-водородную кислоту, и экстрагировали этилацетатом. Органический слой сушили (MgSO4) и выпаривали с образованием 2-нитро-5- пиперидинобензойной кислоты (16,25 г), температура плавления 130 - 140oC.
Смесь порции (10 г) полученного материала, катализатора, представляющего 10% палладированный уголь (1 г), и N,N- диметилацетамида (150 мл) нагревали до 40oC и перемешивали в атмосфере водорода в течение 4 часов. Смесь фильтровали, а фильтрат выпаривали. Таким образом была получена 5-пиперидиноантраниловая кислота в виде масла (12,1 г), которую использовали без дальнейшей очистки.
Смесь полученного материала и формамида (50 мл) перемешивали и нагревали до 170oC в течение 90 минут. Полученную смесь охлаждали до температуры окружающей среды. Осадок отделяли, промывали формамидом и простым диэтиловым эфиром и сушили. Таким образом был получен 6-пиперидинохиназолин-4-он (5,95 г), температура плавления 160 - 166oC.
Фосфорилхлорид (5,37) добавляли к перемешанной смеси 6-пиперидинохиназолина (4 г), N,N-диметиланилина (3,81 г) и толуола (70 мл). Полученную смесь нагревали до температуры кипения с обратным холодильником в течение 2 часов. Смесь охлаждали до температуры окружающей среды, разбавляли толуолом (80 мл) и экстрагировали разбавленным водным раствором хлорида аммония. Органическую фазу сушили (MgSO4) и выпаривали. Остаток очищали посредством хроматографии на колонках с использованием в качестве элюента смесей метиленхлорида и этилацетата с возрастающей полярностью. Таким образом был получен 4-хлор-6-пиперидинохиназолин в виде твердого вещества (2,01 г).
Пример 71
Смесь 7-метиламино-4-/3'-метиланилино/-6-нитрохиназолина (1 г), катализатора, представляющего 10% палладированный уголь (0,1 г), и N,N-диметилацетамида (20 мл) перемешивали и нагревали до 50oC в атмосфере водорода в течение 3 часов. Полученную смесь охлаждали до температуры окружающей среды и фильтровали. Фильтрат выпаривали, а остаток распределяли между метиленхлоридом и водным раствором гидроксида аммония. Органическую фазу сушили (MgSO4) и выпаривали. Остаток очищали посредством хроматографии на колонках с использованием в качестве элюента смеси метиленхлорида и метанола с возрастающей полярностью. Таким образом был получен 6-амино-7- метиламино-4-/3'-метиланилино/хиназолин (0,056 г, 6%), температура плавления 229 - 232oC.
Спектр ЯМР: (CD3SOCD3) 2,31 (c., 3H), 2,86 (д., 3H), 5,10 (широкий синглет, 2H), 5,98 (широкий синглет, 1H), 6,65 (с., 1H), 6,84 (д. 1H), 7,20 (м., 1H), 7,32 (с. , 1H), 7,60 (д. , 1H), 7,62 (с, 1H), 8,29 (с., 1H), 9,10 (широкий синглет, 1Н).
Элементный анализ:
обнаружено: C 65,9, H 5,8 N 23,8
высчитано для C16H17N5•0,1H2O •0,15CH2Cl2: C 66,2, H 5,9, N 23,7%
7. Метиламино-4-/3'-метиланилино/-6-нитрохиназолин, используемый в качестве исходного материала, получали следующим образом:
Смесь 7-хлор-4-/3'-метиланилино/-6-нитрохиназолина (10,5 г), раствора метиламина в этаноле (30% отношение веса к объему; 100 мл) и этанола (100 мл) перемешивали при температуре окружающей среды в течение 16 часов. Полученную смесь выпаривали с образованием целевого исходного материала, который использовали без дальнейшей очистки.
Пример 72
Трет-бутилнитрит (0,051 г) добавляли к смеси 6-амино-4-/3'- метиланилино/-7-морфолинохиназолина (0,167 г) и N,N-диметилформамида (5 мл), которую предварительно нагревали до 65oC. Полученную смесь нагревали до 65oC в течение 30 минут. Добавляли вторую порцию (0,051 г) трет-бутилнитрита и перемешивали смесь при температуре окружающей среды в течение 65 часов. Смесь выпаривали, а остаток очищали посредством хроматографии на колонках с обращенной фазой, используя в качестве элюента смесь метанола, воды и трифторуксусной кислоты с отношением 60:40:0,2. Таким образом был получен 4-/3,-метиланилино/-7-морфолинохиназолин (0,066 г, 41%), температура плавления 227 - 229oC.
Спектр ЯМР: (CD3SOCD3) 2,33 (с., 3H), 3,50 (м., 4H), 3,82 (м., 4H), 6,93 (д. , 1H), 7,14 (д., 1H), 7,56 (д., 1H), 7,57 (с., 1H), 7,59 (м., 1H), 8,49 (д., 1H), 8,75 (с., 1H), 10,93 (широкий синглет, 1H).
6-Амино-4-/3'-метиланилино/-7-морфолинохиназолин, используемый в качестве исходного материала, получали следующим образом:
Смесь 7-хлор-4-/3'-метиланилино/-6-нитрохинзолина (1 г) и морфолина (0,306 мл) перемешивали и нагревали до 70oC в течение 3 часов. Смесь выпаривали, а остаток растирали под слоем метиленхлорида. Таким образом был получен 4-/3'-метиланилино/-7- морфолино-6-нитрохиназолин (1,02 г), температура плавления 212 - 215oC.
Спектр ЯМР: (CD3SOCD3) 2,34 (с., 3H), 3,11 (т., 4H), 3,74 (т., 4H), 6,97 (д. , 1H), 7,28 (т. 1H), 7,31 (с., 1H), 7,62 (с., 1H), 7,64 (д., 1H), 8,58 (с., 1H), 9,19 (с.. 1H), 9,90 (широкий синглет), 1H).
Элементный анализ:
обнаружено: C 55,7, H 16,4, N 4,7
высчитано для C19H19N5O3 • 0,73CH2Cl2: C 55,4, H 16,4, N 4,6%.
В соответствии с процедурой, описанной в примере 70, за исключением того, что реакцию осуществляли при температуре окружающей среды, производили восстановление 4-/3'-метиланилино/-7-морфолино-6-нитрохиназолина с образованием 6-амино-4-/3'-метиланилино-7-морфолинохиназолина, выход которого составил 48%, температура плавления 211 - 213oC.
Спектр ЯМР: (CD3SOCD3) 2,32 (с., 3H), 2,98 (м., 4H), 3,84 (м., 4H), 5,24 (широкий синглет, 2H), 6,92 (д., 1H), 7,18 (с., 1H), 7,25 (т., 1H), 7,52 (с. , 1H), 7,62 (д., 2H), 8,38 (с, 1H), 9,37 (широкий синглет, 1H).
Элементный анализ:
обнаружено: C 67,7, H 6,4, N 20,5
высчитано для C19H21N5O: C 68,0, H 6,3, N 20,9%
Пример 73
В соответствии с процедурой, описанной в примере 1, за исключением того, что реакционную смесь нагревали до температуры кипения с обратным холодильником в течение 2 часов, соответствующий 4-хлор-хиназолин подвергали взаимодействию с соответствующим анилином, что позволило получить хлористо-водородные соли (если нет специального указания) соединений, приведенных в таблице IV, соответствие структур которых было подтверждено спектроскопией протонного магнитного резонанса и элементным анализом.
Примечания к табл. IV:
а. Этот продукт, первоначально полученный в виде хлористо-водородной соли, превращали в свободное основание следующим образом.
Соль обрабатывали смесью метиленхлорида и 1 н. водного раствора гидроксида натрия. Полученную смесь фильтровали, отделенное твердое вещество промывали смесью метиленхлорида и метанола с соотношением 10:1 и сушили. Таким образом было получено целевое свободное основание, температура плавления > 240oC.
Спектр ЯМР: (CD3SOCD3) 3,97 (с., 3H), 4,0 (с., 3H), 7,22 (с., 1H), 7,55 (м. , 1H), 7,62 (м., 1H), 7,83 (с., 1H), 8,16 (м., 1H), 8,38 (м., 1H), 8,56 (с.,1H), 9,67 (широкий синглет, 1H).
Элементный анализ:
обнаружено: C 66,0, H 4,6, N 18,0
высчитано для C17H14N4O2 • 0,2H2O: C 65,9, H 4,7, N 18,1%.
b. Для этого продукта были получены следующие результаты элементного анализа:
обнаружено: C 58,3, H 5,0, N 11,2
высчитано для C18H17N3O3 • 1HCl • 0,5H2O: C 58,6, H 5,2, N 11,4%.
и следующие характеристические данные спектра ЯМР: 2,62 (с., 3H), 3,99 (с. , 3H), 4,04 (с.. 3H), 7,43 (с., 1H), 7,62 (м., 1H), 7,90 (м., 1H), 8,05 (м. , 1H), 8,29 (м. , 1H), 8,47 (с., 1H), 8,84 (с., 1H), 11,74 (широкий синглет, 1H).
c. Этот продукт, первоначально полученный в виде хлористо-водородной соли, превращали в свободное основание следующим образом.
Соль распределяли между этилацетатом и 1 н. водным раствором гидроксида натрия. Органическую фазу промывали рассолом, сушили (MgSO4) и выпаривали. Остаток очищали посредством хроматографии на колонках, используя в качестве элюента смеси метиленхлорида и метанола с соотношением 19:1. Таким образом было получено целевое свободное основание, температура плавления > 240oC.
Спектр ЯМР: (CD3SOCD3) 3,82 (с., 6H), 7,05 - 7,35 (м., 3H), 7,72 (с., 1H), 8,21 (с., 1H), 9,34 (широкий синглет, 1H).
Элементный анализ:
обнаружено: C 60,6, H 4,1, N 13,4
высчитано для C16H13F2N3O2: C 60,6, H 4,1, N 13,2%.
d. Для этого продукта были получены следующие результаты элементного анализа:
обнаружено: C 67,8, H 6,9, N 15,3
высчитано для C20H22N4•1,03HCl: C 67,4, H 6,5, N 15,7%
и следующие характеристические данные спектра ЯМР: (CD3SOCD3) 1,63 (м., 6H), 2,35 (с., 3H), 3,45 (м., 4H), 7,13 (д., 1H), 7,36 (м., 1H), 7,45 (м., 2H), 7,75 (д. , 1H), 7,84 (м. . 1H), 8,69 (с., 1H), 8,88 (д., 1H), 11,2 (широкий синглет, 1H).
Пример 74
Смесь 4-хлор-6,7-диметоксихиназолина (0,674 г), 1,2-фенилендиамина (0,649 г) и тетрагидрофурана (24 мл) перемешивали и нагревали до температуры кипения с обратным холодильником в течение 40 часов. Полученную смесь охлаждали до температуры окружающей среды. Осадок отделяли, промывали простым диэтиловым эфиром и сушили. Таким образом была получена хлористо-водородная соль 4-/2'-аминоанилино/-6,7-диметоксихиназолина (0,83 г, 83%), температура плавления 241 - 243oC.
Спектр ЯМР: (CD3SOCD3) 3,98 (с., 6H), 6,68 (м., 1H), 6,87 (д., 1H), 7,12 (м. , 2H), 7,40 (с. , 1H), 8,29 (с., 1H), 8,68 (с., 1H), 11,05 (широкий синглет, 1H).
Элементный анализ:
обнаружено: C 57,9, H 5,2, N 16,6
высчитано для C16H16N4O2 • 1HCl: C 57,7, H 5,15, N 16,8%.
Пример 75
В соответствии с процедурой, описанной в примере 74, 4-хлор-6,7-диметоксихиназолин подвергали взаимодействию с 1,4-фенилендиамином, в результате чего была получена хлористо-водородная соль 4-/4'-аминоанилино/-6,7-диметоксихиназолина, выход которой составил 85%, температура плавления 274 - 276oC.
Спектр ЯМР: (CD3SOCD3) 3,95 (с., 3H), 3,98 (с., 3H), 6,75 (д., 2H), 7,35 (с. , 1H), 7,38 (д. , 2H), 8,25 (с., 1Н), 8,67 (с., 1H), 11,05 (широкий синглет, 1H).
Элементный анализ:
обнаружено: C 57,6, H 5,0, N 16,9
высчитано для C16H16N4O2 • 1HCl: C 57,7, H 5,15, N 16,8%.
Пример 76
Цианборогидрид натрия (0,13 г) добавляли к смеси 6-амино-4-/3'-метиланилино/хиназолина (0,5 г), формальдегида (37% раствор в воде, 0,16 мл) и N, N-диметилацетамида (5 мл). Полученную смесь перемешивали при температуре окружающей среды в течение 1 часа. Эту смесь нейтрализовали добавлением ледяной уксусной кислоты. Смесь выпаривали, а остаток очищали посредством хроматографии на колонках с использованием в качестве элюента смесей метиленхлорида и метанола с возрастающей полярностью. Таким образом был получен 6-метиламино-4-/3'-метиланилино/хиназолин. (0,15 г, 28%), температура плавления 99 - 102oC.
Спектр ЯМР: (CD3SOCD3) 2,34 (с., 3H), 2,85 (д., 3H), 6,32 (кв., 1H), 6,96 (д. , 1H), 7,20 (д., 1H), 7,28 (м., 2H), 7,54 (д., 1H), 7,6 (м., 2H), 8,48 (с., 1H), 9,52 (широкий синглет, 1H).
Элементный анализ:
обнаружено: C 70,8, H 5,9, N 20,5
высчитано для C16H16N4 • 0,4H2O: C 70,7, H 6,2, N 20,6%
Пример 77
Смесь 6-амино-4-/3'-метиланилино/хиназолина (0,05 г), бензальдегида (0,02 мл) и метанола (5 мл) перемешивали и нагревали до температуры кипения с обратным холодильником в течение 1 часа. Полученную смесь охлаждали до температуры окружающей среды и порциями добавляли борогидрид натрия (0,0076 г). Смесь перемешивали при температуре окружающей среды в течение 16 часов. Смесь выпаривали, а остаток очищали посредством хроматографии на колонках с использованием в качестве элюента смеси метиленхлорида и этилацетата с соотношением 4: 1. Таким образом был получен 6-бензиламино-4-/3'-метиланилино/хиназолин (0,068 г).
Спектр ЯМР: (CD3SOCD3) 2,35 (с., 3H), 4,36 (д, 1H), 6,67 (т., 1H), 6,93 (д., 1H), 7,2 - 7,7 (м., 1H), 8,33 (с., 1H), 9,26 (широкий синглет, 1H).
Элементный анализ:
обнаружено: C 77,3, H 6,1, N 16,0
высчитано для C22H20N4 • 0,125H2O: C 77,1, H 5,9, N 16,4%
Пример 78
N, N-Диметилацетамид (3 мл) насыщали газообразным диметиламином и добавляли 6-,2-хлорацетамидо/-4-/3'-метиланилино/хиназолин (0,2 г). Полученную смесь перемешивали при температуре окружающей среды в течение 18 часов. Смесь выпаривали, а остаток очищали посредством хроматографии на колонках, используя в качестве элюента смеси метиленхлорида и метанола с возрастающей полярностью. Таким образом был получен 6-/2-диметиламиноацетамидо/-4-/3'-метиланилино/хиназолин (0,127 г, 62%), температура плавления 146 - 148oC.
Спектр ЯМР: (CD3SOCD3) 2,32 (с., 9H), 3,14 (с., 2H), 6,94 (д, 1H), 7,26 (т. , 1H), 7,65 (м., 2H), 7,75 (д., 1H), 8,13 (м., 1H), 8,53 (с.. 1H), 8,61 (д., 1H), 9,64 (широкий синглет, 1H), 9,89 (широкий синглет, 1H).
Элементный анализ:
обнаружено: C 67,7, H 6,5, N 20,6
высчитано для C19H21N5O: C 68,0, H 6,3, N 20,9%
Пример 79
В соответствии с процедурой, описанной в примере 11, хлористо-водородную соль 4-/3'-аминоанилино/-6,7-диметоксихиназолина подвергали взаимодействию с уксусным ангидридом. Неочищенный продукт очищали посредством хроматографии на колонках с использованием в качестве элюента смеси метиленхлорида, метанола и аммиака с соотношением 150 : 8 : 1. Таким образом был получен 4-/3'-ацетамидоанилино/-6,7-диметоксихиназолин, выход которого составил 47%, температура плавления 252 - 255oC.
Спектр ЯМР: (CD3SOCD3) 2,06 (с, 3H), 3,94 (с., 3H), 3,96 (с., 3H), 7,18 (с. . 1H), 7,27 - 7,35 (м., 2H), 7,45 (м., 1H), 7,87 (с., 1H), 8,06 (с, 1H), 8,45 (с., 1H), 9,5 (широкий синглет, 1H), 9,9 (широкий синглет, 1H).
Элементный анализ:
обнаружено: C 62,9, H 5,5, N 16,1
высчитано для C18H18N4O3 • 0,25H2O: C 63,1, H 5,4, N 16,3%.
Пример 80
Смесь хлористо-водородной соли 4-(3'-аминоанилино)-6,7-диметоксихиназолина (0,083 г), бензоилхлорида (0,042 г), триэтиламина (0,101 г) и N,N-диметилформамида (1,5 мл) перемешивали при температуре окружающей среды в течение 20 часов. Полученную смесь выпаривали, а остаток очищали посредством хроматографии на колонках с использованием в качестве элюента смеси метиленхлорида, метанола и аммиака с соотношением 100 : 8 : 1. Таким образом был получен 4-(3'-бензамидоанилино)-6,7-диметоксихиназолин (0,15 г, 15%), температура плавления 239 - 242oC.
Спектр ЯМР: (CD3SOCD3) 3,92 (с., 3H), 3,96 (с., 3H), 7,18 (с., 1H), 7,34 (т., 1H), 7,45 - 7,63 (м., 5H), 7,87 (с., 1H), 7,96 (м., 2H), 8,26 (т., 1H), 8,45 (с., 1H), 9,52 (широкий синглет, 1H), 10,29 (широкий синглет, 1H).
Элементный анализ:
обнаружено: C 65,9 H 5,3 N 13,0
высчитано для C23H20N4O3 • 0,3CH3OH • 0,75H2O: C 66,1 H 5,4 N 13,2%
Пример 81
Ниже иллюстрируются типичные фармацевтические лекарственные формы, содержащие соединение формулы 1 или его фармацевтически приемлемую соль (далее соединение X, такое как соединение примеров 1 - 80), которые предназначены для предупреждения или лечения раковых заболеваний у людей.
(a) Таблетки I - мг/таблетка
Соединение X - 100
Лактоза (Европейская фармакопея) - 182,75
Натрий-кроскармеллоза - 12,0
Маисовый крахмал в виде пасты (паста 5% отношением веса к объему) - 2,25
Стеарат магния - 3,0
(b) Таблетки II - мг/таблетка
Соединение X - 50
Лактоза (Европейская фармакопея) - 223,75
Натрий-кроскармеллоза - 6,0
Маисовый крахмал - 15,0
Поливинилпирролидон (паста с 5% отношением веса к объему) - 2,25
Стеарат магния - 3,0
(c) Таблетки III - мг/таблетка
Соединение X - 1,0
Лактоза (Европейская фармакопея) - 93,25
Натрий-кроскармеллоза - 4,0
Маисовый крахмал в виде пасты (паста с 5% отношением веса к объему - 0,75
Стеарат магния - 1,0
(d) Капсулы - мг/капсула
Соединение X - 10
Лактоза (Европейская фармакопея) - 488,5
Стеарат магния - 1,5
(e) Состав для инъекций I - (50 мг/мл)
Соединение X - 5,0% отношение веса к объему
1 М раствор гидроксида натрия - 15,0% объемное отношение
0,1 М раствор хлористо-водородной кислоты (для доведения показателя pH до 7,6)
Полиэтиленгликоль 400 - 4,5% отношение веса к объему
Вода для инъекций - до 100%
(f) Состав для инъекций II - (10 мг/мл)
Соединение X - 1,0% отношение веса к объему
Фосфат натрия (Британская фармакопея) - 3,6% отношение веса к объему
0,1 М раствор гидроксида натрия - 15,0% объемное отношение
Вода для инъекций - до 100%
(g) Состав для инъекций III - (1 мг/мл, с буфером до pH 6)
Соединение X - 0,1% отношение веса к объему
Фосфат натрия (Британская фармакопея) - 2,26% отношение веса к объему
Лимонная кислота - 0,38% отношение веса к объему
Полиэтиленгликоль 400 - 3,5% отношение веса к объему
Вода для инъекций - до 100%.
Примечание:
Вышеуказанные составы можно получить обычными способами, которые хорошо известны в фармакологии. На таблетки (a) - (c) может наноситься энтеросолюбильное покрытие с помощью известных методов, например, покрытие из ацетофталата целлюлозы.

Производные хиназолина формулы I (значения радикалов указаны в п.1 формулы изобретения) обладают ингибированием рецепторов тирозинкиназы. 4 с. и 7 з.п. ф-лы, 1 ил., 1 табл.

в которой m означает 1, 2 или 3;
каждый R1 независимо представляет собой гидрокси, амино, карбокси, карбамоил, уреидо, (1-4С)алиоксикарбонил, N-(1-4С)алкилкарбамоил, N,N-ди[(1-4С)алкил] карбамоил, гидроксиамино, трифторметокси, (1-4С)алкил, (1-4С)алкокси, (1-3С)алкилендиокси, (1-4С)алкиламино, ди-[(1-(1-4С)алкил]амино, пирролидин-1-ил, пиперидино, морфолино, пиперазин-1-ил, 4-(1-4С)алкилпиперазин-1-ил, (1-4С)алкилтил, галогено-(1-4С)алкил (кроме трифторметила), гидрокси-(1-4С)алкил, (1-4С)алкокси-(1-4С)алкил, амино-(1-4С)алкил, (1-4С)алкиламино-(1-4С)алкил, ди-[(1-4С)алкил]амино-(1-4С)алкил, пиперидино-(1-4С)алкил, морфолино-(1-4С)алкил, пиперазин-1-ил-(1-4С)алкил, 4-(1-4С)алкилпиперазин-1-ил-(1-4С)алкил, гидрокси-(2-4С)алкокси-(1-4С)алкил, (1-4С)алкокси-(2-4С)алкокси-(1-4С)алкил, (1-4С)алкилтио-(1-4С)алкил, гидрокси-(2-4С)алкилтио-(1-4С)алкил, анилино-(1-4С)алкил, фенилтио-(1-4С)алкил, циано-(1-4С)алкил, галогено-(2-4С)алкокси, гидрокси-(2-4С)алкокси, (1-4С)алкокси-(2-4С)алкокси, карбокси-(1-4С)алкокси, (1-4С)алкоксикарбонил-(1-4С)алкокси, карбамоил-(1-4С)алкокси, амино-(2-4С)алкокси, (1-4С)алкиламино-(2-4С)алкокси, ди[(1-4С)алкил] амино-(2-4С)алкокси, (1-4С)алкокси-(2-4С)алканоилокси, фенил-(1-4С)алкокси, анилино-(2-4С)алкокси, пиперидино-(2-4С)алкокси, морфолино-(2-4С)алкокси, пиперазин-1-ил-(2-4С)алкокси, 4-(1-4С)алкилпиперазин-1-ил(2-4С)алкокси, гидрокси-(2-4С)алкиламино, (1-4С)алкокси-(2-4С)алкиламино, амино-(2-4С)алкиламино, (1-4С)алкиламино-(2-4С)алкиламино, ди-[(1-4С)алкил] амино-(2-4С)алкиламино, фенил-(1-4С)алкиламино, (2-4С)алканоиламино, бензамидо, бензолсульфонамидо, 3-фенилуреидо, 2-оксопирролидин-1-ил, 2,5-диоксопирролидин-1-ил, галогено-(2-4С)алканоиламино, гидрокси-(2-4С)алканоиламино, (1-4С)алкокси-(2-4С)алканоиламино, (1-4С)алкоксикарбонил-(2-4С)алканоиламино, амино-(2-4С)алканоиламино, (1-4С)алкиламино-(2-4С)алканоиламино или ди-[(1-4С)алкил] амино-(2-4С)алканоиламино;
n означает 1 или 2;
R2 независимо представляет собой водород, гидрокси, галогено, трифторметил, амино, нитро, циано, (1-4С)алкил или (1-4С)алкокси,
или их фармацевтически приемлемые соли;
за исключением того, что в объем настоящего изобретения не входят 4-(4'-гидроксианилино)-6-метоксихиназолин, 4-(4'-гидроксианилино)-6,7-метилендиоксихиназолин, 4-(4'-гидроксианилино)-6,7,8-триметоксиханазолин, 6-амино-4-(4'-аминоанилино)хиназолин, 4-анилино-6-метилхиназолин или его хлористоводородная соль и 4-анилино-6,7-диметоксихиназолин или его хлористоводородная соль, 4-(4'-метоксианилино)-8-метокси-хиназолин, 4-(4'-хлоранилино)-8-метоксихиназолин, 8-гидрокси-4-(4'-метоксианилино)хиназолин и 4-(4'-хлоранилино)-8-гидроксихиназолин.
4-(3'-хлор-4'-фторанилино)-6,7-диметоксихиназолин,
4-(3',4'-дихлоранилино)-6,7-диметоксихиназолин,
6,7-диметокси-4-(3'-нитроанилино)хиназолин,
6,7-диметокси-4-(3'-метиланилино)хиназолин,
6-метокси-4-(3'-метиланилино)хиназолин,
4-(3'-хлоранилино)-6-метоксихиназолин,
6,7-этилендиокси-4-(3'-метиланилино)хиназолин,
6-амино-7-метокси-4-(3'-метиланилино)хиназолин,
4-(3'-метиланилино)-6-уреидохиназолин и
6-(2-метоксиэтоксиметил)-4-(3'-метиланилино)хиназолин.
6,7-ди(2-метоксиэтокси)-4-(3'-метиланилино)хиназолин,
6-диметиламино-4-(3'-метиланилино)хиназолин и
6-бензамидо-4-(3'-метиланилино)ханазолин.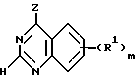
в которой Z представляет замещаемую группу;
R1 и m имеют любое из значений, определенных в п.1,
с анилином формулы IV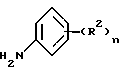
где R2 и n имеют значения, определенные в п.1,
с последующим, необязательным, выполнением следующих стадий:
а) расщепляют полученное соединение формулы I, в которой R1 или R2 представляет (1-4C)алкокси, для получения соединений формулы I, в которой R1 или R2 представляет гидрокси;
в) ацилируют производное хиназолина формулы I, в которой R1 представляет амино, для получения соединений формулы I, в которой R1 представляет (2-4С)алканоиламино или замещенную (2-4С)алканоиламиногруппу, как определено в п.1, уреидо, 3-фенилуреидо или бензамидо;
с) алкилируют производное хиназолина формулы I, в которой R1 представляет гидрокси или амино, для получения соединений формулы I, в которой R1 представляет (1-4С)алкокси или замещенный (1-4С)алкокси, как определено в п. 1, либо R1 представляет (1-4С)алкиламино или замещенную (1-4С)алкиламиногруппу, как определено в п.1;
d) гидролизуют производное хиназолина формулы I, в которой R1 представляет (1-4С) алкоксикарбонильный заместитель или заместитель, включающий (1-4C)алкоксикарбонильную группу, как определено в п.1, для получения соединений формулы I, в которой R1 представляет карбоксильный заместитель или заместитель, включающий карбоксильную группу, как определено в п.1;
е) производное хиназолина формулы I, в которой R1 представляет (1-4С)алкил, имеющий замещаемую группу, взаимодействуют с соответствующим амином, спиртом, тиолом или цианидом, для получения соединений формулы I, в которой R1 представляет амино, окси-, тио- или цианозамещенный (1-4С)алкил, и, при необходимости, получения фармацевтически приемлемой соли производного хиназолина формулы I взаимодействуют указанное соединение с приемлемой кислотой в соответствии с известным способом.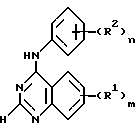
или их фармацевтически приемлемых солей,
где R2, m и n имеют значения, определенные в п.1;
R1 означает аминогруппу.
отличающийся тем, что восстанавливают соединение общей формулы I, где R1 означает нитрогруппу, а значение R2, m и n указаны в п.1, и при необходимости получения фармацевтически приемлемой соли производного хиназолина формулы I взаимодействуют указанное соединение с приемлемой кислотой в соответствии с известным способом.
Приоритет по пунктам:
по п. 1: m означает 1 или 2; R1 - гидрокси, амино, карбокси, (1-4С)алкоксилкарбонил, (1-4С)алкил, (1-4С)алкокси, (1-3С)алкилендиокси, (1-4С)алкиламино, ди-[(1-4С)алкил] амино, (1-4С)алкилтио, гидрокси-1-(1-4С)алкил, (1-4С)алкокси-(1-4С)алкил, амино-(1-4С)алкил, (1-4С)алкиламино-(1-4С)алкил, ди-[(1-4С)алкил] амино-(1-4С)алкил, гидрокси-(2-4С)алкокси, (1-4С)алкокси-(2-4С)алкокси, карбокси-(1-4С)алкокси), (1-4С)алкоксикарбонил-(1-4С)алкокси, (2-4С)алканоиламино, бензамидо, бензолсульфонамидо; n означает 1 или 2; R2 - водород, гидрокси, галогено, трифторметил, амино, нитро, циано, (1-4С)алкил или (1-4С)алкокси - 20.01.92;
по п.9, кроме стадий b), с), d) и е) - 20.01.92;
по п.1: m означает 3, R1 - карбамоил, уреидо, N-(1-4С)алкилкарбамоил, N, N-ди-[(1-4С)алкил)] карбамоил, галогено-(1-4С)алкил, пиперидино-(1-4С)алкил, морфолино-(1-4С)алкил, пиперазин-1-ил(1-4С)алкил, 4-(1-4С)алкилпиперазин-1-ил-(1-4С)алкил, гидрокси-(2-4С)алкокси-(1-4С)алкил, (1-4С)алкокси-(2-4С)алкокси-(1-4С)алкил, (1-4С)алкилтио-(1-4С)алкил, гидрокси-(2-4С)алкилтио-(1-4С)алкил, галоген-(2-4С)алкокси, карбамоил-(1-4С)алкокси, амино-(2-4С)алкокси, (1-4С)алкиламино-(2-4С)алкокси, ди-[(1-4С)алкио]амино-(2-4С)алкокси, гидрокси-(2-4С)алкиламино, (1-4С)алкокси-(2-4С)алкиламино, амино-(2-4С)алкиламино, (1-4С)алкиламино-(2-4С)алкиламино, ди-[(1-4С)алкио] амино-(2-4С)алкиламино, галоген-(2-4С)алканоиламино, гидрокси-(2-4С)алканоиламино, (1-4С)алкокси-(2-4С)алканоиламино, (1-4С)алкоксикарбонил-(2-4С)алканоиламино, амино-(2-4С)алканоиламино, (1-4С)алкиламино-(2-4С)алканоиламино или N, N-ди-[(1-4С)алкил] амино-(2-4С)алканоиламино - 26.06.92;
по п.9, кроме стадии а), и по п.10 - 26.06.92;
по п.1: R1 гидроксиламино, трифторметокси, пирролидин-1-ил, пиперидино, морфолино, пиперазин-1-ил, 4-(1-4С)алкилпиперазин-1-ил, анилино-(1-4С)алкил, фенилтио-(1-4С)алкил, циано-(1-4С)алкил, (1-4С)алкокси(2-4С)алканоилокси, фенил-(1-4С)алкокси, анилино-(2-4С)алкокси, пиперидино-(2-4С)алкокси, морфолино-(2-4С)алкокси, пиперазин-1-ил(2-4С)алкокси, 4-(1-4С)алкилпиперазин-1-ил-(2-4С)алкокси, фенил-(1-4С)алкиламино, 3-фенилуреидо, 2-оксопирролидин-1-ил, 2,5-диоксопирролидин-1-ил, и по п.11 - 12.11.92.
| SU, 1194257 A, 1985 | |||
| GB, 2033894, 1980 | |||
| US, 3985749 A, 1976 | |||
| EP, 0520722 A1, 30.12.92 | |||
| WO, 90/08130 A1, 1990 | |||
| Машковский М.Д | |||
| Лекарственные средства | |||
| - М.: Медицина, 1988, ч.2, с.448. |
Авторы
Даты
1999-03-10—Публикация
1993-01-19—Подача