Изобретение относится к усиливающим проникание при трансдермальном употреблении фармацевтическим композициям, предназначенным для человека или более низших животных при лечении различных заболеваний.
Нижеследующие патенты, выданные в 1976 - 1984 гг. на имя Раджадхиакша, описывают способы и композиции, использующие 1-алкилазациклогептан-2-оны и их гомологи для усиления проникания фармакологически активных веществ через кожу человека и животных: патенты США NN 3989816, 4316893, 4405616 и 4444762.
Статья Stoughtor, Arch. Derm. 118, 464-477 (1982), относящаяся к 1-додецилазациклогептан-2-ону, где это соединение именуется как "озон", рассматривает его способность усиливать проникание при накожном употреблении.
Купер, патенты США NN 4557934 и 4537776, описывает предназначенные для местного употребления композиции нестероидных противовоспалительных соединений, противовирусных средств, противокашлевых препаратов и других лекарственных средств, содержащие этанол, некоторые гликоли, пирролидон, 1-(2-гидроксиэтил)-аза-циклопентан-2-он и 1 - 35% 1-додецилазациклогептан-2-она (озона).
Купер, J. Pharm. Sci. 73, 1153-1156 (1984) описывает способ усиления транспорта неполярных молекул, типа молекул салициловой кислоты, через кожу путем добавления жирных спиртов или жирных кислот в трансдермальные препараты в различных гликолевых растворителях.
Quhter и Barry, J. Pharm. Pharmacol. 36, 7P (1984), сообщают, что олеиновая кислота и озон усиливают дермальное проникание препаратов флурбипрофена в пропиленгликоле и других растворителях.
Патент EP N 43738 описывает бинарную, усиливающую дермальное проникание, среду для противовоспалительных средств, содержащую C3-4 диол, сложный диолэфир или простой диолэфир, и нарушающее клеточную оболочку соединение, выбранное из группы, включающей низшие алкилэфиры C12-14 - жирных кислот, лаурилацетат и миристилацетат.
Patel et al. , Joum. Soc. Cosmetic. Chem. 36, 303-311 (1985) отмечают, что пропиленгликоль, общераспространенное составляющее известных фармацевтических препаратов для трансдермального применения, вызывает раздражение и/или сенсибилизацию, когда его концентрация превышает 10%.
Патент США N 4572909, выданный 25 февраля 1986 г., описывает амлодипин-2-/(2-аминоэтокси)метил/-4-(2-хлор-фенил)-3-этоксикарбонил-5-метоксикарбонил-6-метил-1,4-дигидропиридин и его соли и их применение в качестве противоишемических и противогипертонических средств.
Патент США N 3591584 описывает пироксикам-4-гидрокси-2-метил-N-2-пиридинил-2Н-1,2-бензотиазин-3-карбоксамида 1,1-диоксид, и его применение в качестве противовоспалительного или анальгетического средства.
Соответствующие про-лекарственные формы пироксикама описываются в патентах США NN 4309427 и 4563452.
Патент США N 4188390 описывает диоксазосин-4-амино-2-/4-(1,4-бензодиоксан-2-карбонил)пиперазин-1-ил/- 6,7-диметоксихиназолин, и его применение в качестве регулятора сердечно-сосудистой системы, особенно при лечении гипертонии.
Применение глипизида, 1-циклогексил-3-/п-/2-(5- метилпиразинкарбоксамидо)этил/-фенилсульфонил/мочевины, в качестве противодиабетического средства описывается в патенте США N 3669966.
В соответствии с настоящим изобретением описываются новые, эффективные, усиливающие трансдермальное проникание фармацевтические композиции для трансдермального употребления на людях или низших животных. Композиции согласно изобретению могут включать любое из широкого множества фармакологически активных соединений или их про-лекарственных форм. Тем самым, предлагаемые композиции включают безопасное и эффективно действующее количество фармакологически активного соединения или его про-лекарственной формы, водно-этанольный растворитель, содержащий 15 - 75% этанола по объему, и 0,01 - 5% (мас./об.) усилителя проникания, выбранного из группы, включающей 1-алкилазациклогептан-2-он, где указанный алкил имеет 8 - 16 атомов углерода, и цис-олефиновое соединение формулы
CH3(CH2)xCH = CH(CH2)yR3
где
R3 представляет собой CH2OH, CH2NH2 или COR4, а R4 представляет собой OH или (C1-4)алкокси, x и y, каждый, является целым числом от 3 до 13, а сумма x и y равна от 10 до 16. Особенно неожиданным явлением для изобретения является то, что для заданного фармакологически активного соединения или про-лекарственной формы существует определенная концентрация этанола в указанном диапазоне, в котором трансдермальное проникание является оптимальным. Так, особенно предпочтительная композиция согласно изобретению имеет концентрацию этанола в пределах 10% концентрации, которая дает оптимальное трансдермальное проникание для этого конкретного фармакологически активного соединения или про-лекарственной формы. В пределах всего диапазона 15 - 75% концентрации этанола обеспечивается обычно заметно улучшенное трансдермальное проникание в сравнении с уровнями содержания этанола, выходящими за указанный диапазон, а в случае других растворителей, известных в данной области техники как полезные для применения в трансдермальных препаратах, более ограниченным диапазоном является "окно", в пределах которого трансдермальное проникание является наиболее выгодным.
Хотя настоящее изобретение полезно для композиций, содержащих широкое множество фармакологически активных соединений и про-лекарственных форм, оно особенно целесообразно для композиций, используемых при лечении человека или низших животных, страдающих от ревматических или воспалительных состояний, ишемической болезни сердца, особенно стенокардии, гипертонии или диабета.
Особенно полезные фармацевтически активные соединения или про-лекарственные формы для композиций согласно изобретению включают метилсалицилат, салициловую кислоту, ибупрофен, пироксикам и про-лекарственные формы пироксикама, и их фармацевтически допустимые катионные и кислото-присоединительные соли, для лечения ревматических или воспалительных состояний. Особенно полезными про-лекарственными формами пироксикама являются соединения формулы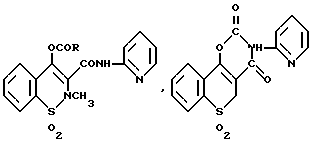
и их фармацевтически приемлемые кислотно-аддитивные соли, где R - C1-9 - алкил который может быть прямоцепочечным или разветвленным алкилом, CH(R1)OOOR2, R1 представляет собой H или C1-3-алкил, а R2 представляет собой C1-4-алкил или C1-4-алкокси.
Другими предпочтительными композициями согласно изобретению, полезными для лечения ишемической болезни сердца, особенно стенокардиии или же гипертонии у человека или низших животных при необходимости такого лечения, являются композиции, использующие амлодипин, который описан в патенте США N 4572909, включаемом в материалы заявки для справки.
Дальнейшими предпочтительными композициями согласно изобретению являются композиции, включающие безопасное и эффективно действующее количество глипизида для лечения диабетических состояний. Это фармацевтически активное соединение и его применение для лечения диабетических состояний известно из патента США N 3669966, который включен в материалы заявки справочно. Еще одной группой предпочтительных композиций согласно изобретению являются композиции, использующие безопасное и эффективно действующее количество доксазосина, пригодного в предпочтительном варианте способа согласно изобретению для лечения гипертонии. Соединение и его противогипертонические применения описаны в патенте США N 4188390, материалы которого включены со справочными целями в настоящую заявку.
Сложноэфирные про-лекарственные формы пироксикама описаны в патенте США N 4309427. Патент США N 4563452 описывает указанные оксазино/5,6-с/ 1,2-бензотиазиновые про-лекарственные формы пироксикама. Каждый из указанных патентов включен со справочными целями в материалы настоящей заявки.
Особенно предпочтительными усилителями проникания, полезными в композициях согласно изобретению, являются цис-моноэноевые кислоты формулы
CH3(CH2)xCH = CH(CH2)yCOOH
где
x и y - определены выше, а указанные 1-алкилаза-циклогептан-2-оны имеют алкил с 10-14 атомами углерода. Особенно предпочтительными членами этого класса усилителей проникания являются цис-9-тетрадецененоевая кислота, цис-6-пентадеценовая кислота, цис-6-гексадеценовая кислота, цис-9-гексадеценовая кислота, олеиновая кислота, цис-6-октадеценовая кислота, цис-11-октадеценовая кислота, цис-12-октадеценовая кислота, цис-5-эйкозеновая, цис-9-эйкозеновая, цис-11-эйкозеновая, цис-14-эйкозеновая кислота, 1-децилазациклогептан-2-он, 1-додецилазациклогептан-2-он и 1-тетрадецилазациклогептан-2-он.
Наиболее предпочтительными конкретными усилителями проникания благодаря их эффективности и легкодоступности являются олеиновая кислота (цис-9-октадеценовая кислота), цис-11-октадеценовая кислота (цис-вакценовая кислота), и 1-додецилазациклогептан-2-он, именуемый также как озон.
Предпочтительный диапазон концентрации этанола для обеспечения оптимального трансдермального потока физиологически активных соединений и их про-лекарственных форм в композициях согласно изобретению составляет от 20 до 60% по объему.
Особенно предпочтительный диапазон концентраций для усилителей проникания согласно изобретению составляет от 0,1 до 1,0% мас./об. и особенно от 0,25 до 0,5% мас./об. по причине эффективности и отсутствия раздражения.
Как упоминалось выше, композиции согласно изобретению полезны для лечения ревматических или воспалительных состояний путем использования фармацевтических композиций согласно изобретению, включающих безопасное и эффективно действующее количество фармакологически активного соединения, выбранного среди метилсалицилата, салициловой кислоты, ибупрофена, пироксикама и про-лекарственных форм пироксикама.
Композиции согласно изобретению полезны для лечения ишемической болезни сердца или гипертонии, с использованием безопасного и эффективно действующего количества амлодипина, для лечения диабета - с использованием безопасного и эффективно действующего количества глипизида, и для лечения гипертонии - с использованием подобным образом доксазосина.
Под безопасным и эффективно действующим количеством фармакологически активного соединения или про-лекарственной формы для применения в фармацевтических композициях согласно изобретению имеется в виду количество, которое обеспечивает терапевтически полезные кровяные и/или местные уровни содержания активного соединения при трансдермальном способе употребления. Терапевтически полезными уровнями индивидуальных фармакологически активных соединений и про-лекарственных форм являются общеизвестные в данной области техники как полезные для каждого из таких соединений. Указанные фармацевтические композиции могут приобретать множество форм, например, быть в виде раствора, геля или суспензии активного соединения или про-лекарственной формы.
В качестве про-лекарственной формы физиологически активного соединения в данном контексте имеется в виду структурно родственное соединение или производное активного соединения, которое поглощается телом человека или низшего животного, где оно преобразуется в целевое физиологически активное соединение. Само по себе про-лекарственная форма может обладать слабой целевой активностью или вообще ее не иметь.
В рамках здравых медицинских соображений количество заданного физиологически активного соединения или используемой про-лекарственной формы может колебаться в зависимости от излечиваемого конкретного состояния, тяжести состояния, длительности лечения, характера используемого соединения, состояния пациента и других факторов в пределах конкретных знаний и опыта наблюдающего пациента врача.
В то время, как фармацевтические композиции согласно изобретению могут использовать широкое множество физиологически активных соединений или их про-лекарственных форм, полезных для лечения, например, грибковых и бактериальных инфекций, воспалительных состояний, боли, ишемической болезни сердца, включая стенокардию и гипертонию, аллергических состояний и диабета, предпочтительная группа физиологически активных соединений включает метилсалицилат, салициловую кислоту, ибупрофен, пироксикам и вышеупомянутые про-лекарственные формы пироксикама, из которых все характеризуются полезностью для лечения ревматических и воспалительных состояний, амлодипин для лечения ишемической болезни сердца, особенно стенокардии, или гипертонии, глипизид для лечения диабета и доксазосин для лечения гипертонии.
Дозировочные формы для фармацевтических композиций согласно изобретению могут включать растворы, лосьоны, мази, кремы, гели, свечи, препараты для устойчивого выделения с ограничением скорости и устройства для этого.
В дополнение к необходимому этанолу, воде и усилителю проникания для композиций согласно изобретению, типичные дозировочные формы могут включать инертные носители, такие как гелеобразующие материалы, минеральное масло, эмульгаторы, бензиловый спирт и тому подобное. Конкретные иллюстрации некоторых таких препаратов приведены ниже в примерах.
Фармацевтически приемлемые соли вышеупомянутых физиологически активных соединений включают как катионные соли соединений, содержащих кислотную группу, такую как группы карбоновой кислоты, так и кислотно-аддитивные соли соединений, содержащих атом азота.
Под физиологически приемлемыми катионными солями имеются в виду соли, образованные нейтрализацией свободной карбоновокислотной группы физиологически активных соединений, например, салициловой кислоты и ибупрофена. Нейтрализация осуществляется контактированием соединений, содержащих карбоновую кислоту, с основанием фармацевтически приемлемого металла, аммиаком или амином. Примерами таких металлов являются натрий, калий, кальций и магний. Примерами таких аминов являются N-метил-глюкамин и этаноламин.
Термин фармацевтически приемлемые кислотно-аддитивные соли означает соли, образованные между свободной аминовой группой вышеупомянутых физиологически активных соединений (например, пироксикама, амлодипина и доксазосина) и фармацевтически приемлемой кислоты. Примерами таких кислот являются уксусная, бензойная, бромистоводородная, хлористоводородная, лимонная, фумаровая, малеиновая, янтарная, виннокаменная кислоты, бензолсульфокислота, п-толуолсульфокислота и метансульфокислота.
Образцы кожи для изучения проникания
Бесшерстных мышей-самцов, возрастом 8 - 16 недель забивали путем смещения позвонков в шейном отделе. Участок брюшинной кожи на полную толщину вырезали хирургическим путем и устанавливали между двумя идентичными диффузионными полу-ячейками (составляемые ячейки получали у фирмы "Кроун гласс Ко". г. Соммервилл шт. Нью-Джерси, США), имеющими площадь поверхности 1,0 см2. Затем участки кожи гидратировали в течение 18 часов изотоническим буфером по Соренсену (0,067М фосфата натрия, pH 7,38) до проведения экспериментов. Человеческую кожу, взятую при хирургических операциях или аутопсии, срезали дерматомом толщиной 400 мкм и гидратировали тем же путем.
Листки Stratum corneum получали из свиной или человеческой кожи обработкой трипсином. Так, образцы кожи на полную толщину срезали на терматоме до толщины 350-400 мкм, расправляли стороной Stratum corneum вверх на фильтровальной бумаге, насыщенной 0,5% сырого трипсина (тип II, производства фирмы "Сигма кемикал", г. Сент-Луи, шт. Монтана, США) в фосфатобуферном солевом растворе, pH 7,4. После выдерживания в течение нескольких часов при 37oC слой Stratum corneum отслаивали с подлежащих слоев, промывали в соево-трипсиновом ингибиторе и нескольких сменах дистиллированной воды и расправляли на проволочной сетке для сушки. Образцы хранили в эксикаторе при комнатной температуре до употребления.
Пример 1. Изучение трансдермального проникания амлодипина.
Кожу бесшерстных мышей, которую гидратировали в течение 18 ч в изотоническом буфере по Соренсену (pH 7,38), устанавливали в диффузионной ячейке. Подходящую донорную и приемную фазы помещали для замещения гидратационного раствора. Непрерывное перемешивание в каждой полуячейке обеспечивалось магнитными стержневыми мешалками с приводом синхронным электродвигателем на скорости 300 об/мин. Диффузионные ячейки устанавливали в термостате и выдерживали при 37oC с использованием разветвленной системы циркуляции воды в течение всего эксперимента. С 60 - 90-минутными интервалами приемник, содержащий около 3,0 мл, снимали и анализировали с помощью ВЭЖХ на амлодипин. Приемную камеру пополняли свежим раствором для замещения материала, израсходованного на анализ. Количество амлодипина, перенесенного за единицу времени, рассчитывали и указывали как стационарный поток.
Донорные/приемные растворы амлодипина
Во всех экспериментах использовали бензолсульфонат амлодипина, т.е. бензолсульфонат 2/(2-аминоэтокси)метил/-4-(2-хлорфенил)-3- этоксикарбонил-5-метоксикарбонил-6-метил-1,4-дигидропиридина. Готовили водно-этальные растворы, содержащие 55, 30 и 20% этанола по объему в 0,01M ацетатного буфера, pH 5. К порции этих растворов добавляли достаточное количество олеиновой кислоты для получения концентрации 0,25% об./об. (0,224% мас./об.). К другим порциям добавляли озон до концентрации 0,5% об./об. Растворимость амлодипина бензолсульфоната при 25oC определяли для каждой среды с тем, чтобы можно было использовать 80% насыщенный раствор лекарственного средства в качестве донорной фазы. В приемном отделении использовали эквивалент донорного раствора, без лекарственного средства или усилителя проникания (олеиновой кислоты или озона).
Анализ на амлодипин
Анализ на амлодипин выполнялся с помощью высокоэффективной жидкостной хроматографии (ВЭЖХ) с УФ-детектированием на 240 нм. Подвижной фазой был 6 мМ 1-октан-натрийсульфонат, 42% (об./об.) ацетонитрил и 1% (об./об.) тетрагидрофуран в 0,1 М двузамещеннонатрийортофосфатном буфере, доведенном до pH 3,0 85% (мас./об.) ортофосфорной кислотой. Расход выдерживали на уровне 1,0 мл/мин при 32oC. Все образцы и стандарты разбавляли не менее 1:1 подвижной фазой до инъекции. Кривые калибровки высоты пиков были линейные, с пределом детектирования приблизительно 0,05 мкг/мл.
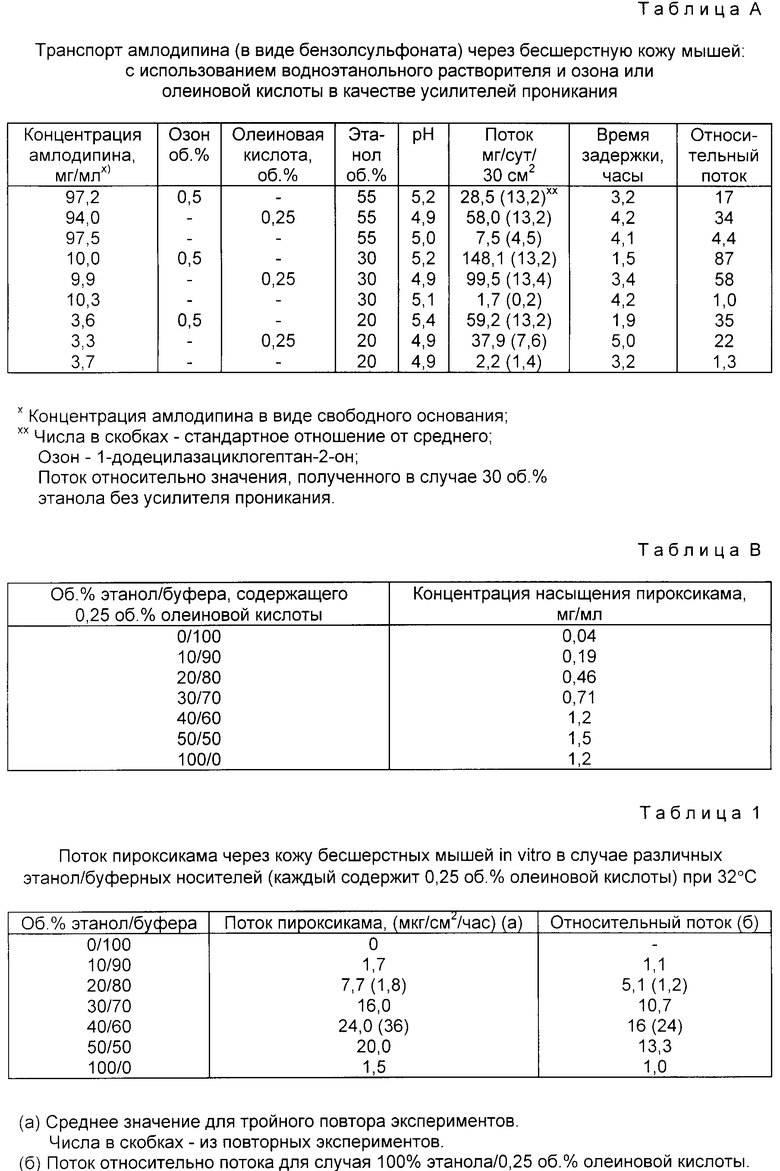
Результаты изучения сведены в табл. A.
Обсуждение
Максимальный поток амлодипина достигается в случае 30% этанола с озоном или олеиновой кислотой в качестве усилителя проникания. Это верно, несмотря на тот факт, что 30%-ная этанольная среда содержала приблизительно в 10 раз меньше лекарственного средства, чем 55%-ная этанольная среда. Соответственные скорости потоков для 30%-ных этанольных носителей, содержащих озон и олеиновую кислоту были 87- и 58-кратными, по сравнению с тем же носителем, не содержащим усилителем проникания. Время до установления стационарного потока, т.е. время задержки, для амлодипина из олеинокислотных носителей колеблется от 3,4 до 5,0 ч. Время задержки для озоновых носителей составило лишь 1,5 - 3,2 ч. Различие во времени задержки между двумя группами усилителей проникания сочтено незначительным.
Пример 2. Изучение трансдермального потока
Поток пироксикама in vitro измеряли из этанол/буферных носителей, содержащих 0,25 об.% (0,224% мас./об.) олеиновой кислоты. Использованным буфером был буфер Соренсена, pH 7,3 - 7,4 (буфер приготовлен из 3,68 моногидрата двузамещенного фосфата натрия, 15,15 г однозамещенного динатрийфосфата, 8,80 г хлорида натрия, с разбавлением до 2000 мл деионизованной водой), все эксперименты проводились при 32oC. Образцы кожи бесшерстных мышей или человеческой кожи устанавливали между двумя половинами того же диффузионного аппарата, что и при изучении амлодипина. Буфер вводили лишь в камеру (приемник) в контакте с внутренней стороной кожи. Донорная камера, в контакте с наружной стороной кожи, заполнялась подходящим этанол/буферным носителем, содержащим 0,25 об. % олеиновой кислоты и избыток пироксикама. Концентрация насыщения пироксикама в каждом из этанол/буферных носителей, содержащих 0,25 об.% при расчете по данным ВЭЖХ-анализа, приведена в табл. B.
Количество пироксикама, транспортируемого через кожу для каждого носителя определяли ВЭЖХ-анализом образцов, периодически отбираемых из приемника в течение 72 ч. Результаты, полученные на коже бесшерстных мышей и человеческой коже, сведены в табл. 1 и 2.
Высокоэффективная жидкостная хроматография (ВЭЖХ) в качестве аналитического средства проводилась с использованием реверснофазной колонки C18-микробондапак (фирма "Уотерс хроматографи", г. Милтон, шт. Массачусетс).
Подвижная фаза: 40 : 40 : 15 : 15 об./об.
0,1 М двузамещенный фосфат калия (pH 3,0) метанол, ацетонитрил, тетрагидрофуран, расход 1 мл/мин.
Детектор: ультрафиолетовый, 313 нм, типа LDC "Милтон Рой Спектромонитор D".
Инжектор: автоотбор/автоинжекция, инъекция по 10 мкл.
При повторении указанной процедуры, но с насыщенными растворами пироксикама в этаноле, буфером и этанол/буферными растворами, содержащими 20, 30, 40 и 40 об. % этанола, причем каждый носитель содержал 0,25 об. % (0,23% мас./об.) 1-додецилазациклогептан-2-она (озон), скорости потока через участки кожи бесшерстных мышей имели значения, приведенные в табл. 3.
Пример 3. Трансдермальный поток про-лекарственных форм пироксикама
Готовили два насыщенных раствора 1,1-диоксида 4-н-бутирилокси-2-метил-N-2-пиридил-2H, 1,2-бензотиазин-3-карбоксамида (н-бутирокислотный эфир пироксикама) в 55 этанола/45 буфера Соренса, pH 7,3 (по объему). Один из растворов доводили олеиновой кислотой до 0,224 мас./об. (0,25 об.%). Скорость потока через кожу бесшерстных мышей измеряли для двух растворов с помощью ВЭЖХ-анализа на пироксикам в приемной ячейке тем же методом, что и в случае пироксикама. Результаты приведены в табл. C.
При использовании 1,1-диоксида-4-н-пентаноилокси-2-метил-N-2 пиридил-2Н-1,2-бензотиазин-3-карбоксамида вместо указанного н-бутиратного сложного эфира пироксикама в указанной методике получали результаты, приведенные в табл. D.
Пример 4. Корреляция влияния различных жирных кислот на усиление проникания салициловой кислоты, ИК-спектральных данных и результатов дифференциальной сканирующей калориметрии с использованием свиного stratum corneum
Листочки stratum corneum готовили из свиной кожи трипсиновой обработкой. Так, образцы свиной кожи на полную толщину разрезали на дерматоме до слоев толщиной 350 мкм и распределяли, слоем stratum corneum вверх, на фильтровальной бумаге, насыщенной 0,5% сырым трипсином в фосфатобуферном солевом растворе при pH 7,4 (буфер Соренсена). По прошествии нескольких часов при 37oC stratum corneum отслаивали, промывали в соево-трипсиновом ингибиторе, водой и сушили на воздухе. Образцы хранили в эксикаторе при комнатной температуре до употребления. Перед употреблением образцы сухой кожи известной массы инкубировали 2 ч в 0,15 М растворе подходящей жирной кислоты в этаноле, образцы затем промывали около 10 с в этаноле, расправляли по проволочной сетке, сушили в эксикаторе и сухие образцы вновь взвешивали. Образцы stratum corneum затем держали несколько суток в камере при 22oC, 95%-ной относительной влажности, в течение которых образцы stratum corneum уравновешивали на уровне содержания влаги около 30 мас.%.
ИК - спектральные данные
Инфракрасные спектры получали на ИК-спектрометре (Модель "Аналект ГХ-6200", фирма "Лазер пресижн", г. Ирвин, Калифорния) преобразования Фурье (ИКПФ), снабженном охлаждаемым жидким азотом ртутнокадмийтеллуридным детектором. Для исключения потерь воды гидратированные образцы герметизировали между окнами из сульфида цинка при поддержании при 22oC и относительной влажности 95%. Герметизированные образцы помещали в спектрометр, где получали в среднем 127 проходов сканирования за шесть минут для каждой из обработок жирной кислотой. Преобразованные в цифровую форму данные переводили в ЭВМ ("Эпл IIe") для определения частоты и ширины полос поглощения антисимметричных колебаний растяжения для группы C-H. Благодаря цифровому характеру ИКПФ-прибора, поглощение и частотные данные существуют лишь в виде дискретных приращений. В случае использованного прибора точное значение любой точки частоты может быть определено с точностью, не превышающей 2,7 см-1 Пиковая частота оценивается с гораздо более высокой точностью благодаря использованию алгоритма центра тяжести для представленных в цифровом виде данных, как это описано в работе Cameron et al., Applied Spectr., 36, 245-250 (1982).
Дифференциальная сканирующая калориметрия (ДСК)
Дифференциальный сканирующий калориметр (модель "Микрокэл МС-1", фирма "Микрокэл", г. Амхерст, шт. Массачусетс) использован на скорости сканирования 0,75oC/мин. Для ДСК-измерений комбинировали продублированные образцы с каждого из описанных ИКПФ-экспериментов. В альтернативе, образцы stratum corneum известной массы (около 20 мг) обрабатывали жирной кислотой описанным выше путем. Обработанные образцы гидратировали несколько суток при относительной влажности 95%, 22oC и повторно взвешивали. Результаты свидетельствуют о приблизительно 30% по массе заборе воды безотносительно к использованной жирной кислоте.
Метод потоков
Листочки вырезанной до толщины 350 мкм свиной кожи устанавливали между двумя половинами диффузионной ячейки с обращением стороны stratum corneum к донорному отделению, которое содержит 1,0 мл насыщенной салициловой кислоты в этаноле (0,31 г/мл) + 105 распадов в минуту/мл 14C-меченой салициловой кислоты. Затем добавляли подходящую жирную кислоту для доведения окончательной концентрации до 0,15 М. Приемное отделение содержит 1,0 мл буфера Соренсена, pH 7,4. Оба отделения перемешивали с помощью магнитной мешалки и выдерживали при 32oC.
Периодически из приемной части диффузионной ячейки выбирали пробы, смешивали со сцинтилляционной смесью ("Сцинтизол", фирма "Изолэбс", Инк. г. Акрон, шт. Огайо) и счет вели в течение нескольких минут в жидкостном сцинтилляционном счетчике (модель "Марк III-6881",фирма "Тракор аналитикл", г. Элк-Гроув-Виллидж", шт.Иллинойс). Вслед за начальным времени задержки около 6 ч, количество появляющейся на приемной стороне салициловой кислоты было линейным времени на протяжении эксперимента (стандартное время 24-48 ч). Линейный анализ методом наименьших квадратов этих данных позволяет определить скорость появления салициловой кислоты в приемнике (р/мин в час). Это значение поделенной на удельную активность салициловой кислоты в насыщенном растворе (приблизительно 300 р/мин на мг) и площадь экспонированной кожи 0,2 см2 дает поток (мг/см2/в час). Пробы, взятые с донорной стороны в начале и в конце эксперимента, содержали, в пределах погрешности эксперимента, одно и то же количество салициловой кислоты.
р/мин = распадов в минуту
р/мин = число счетов фотонов в минуту/эффективность счета
Таким образом, на протяжении всего эксперимента на донорной стороне поддерживалась постоянная концентрация проникающего вещества.
Результаты всех трех экспериментов приведены в табл. 4.
Изменения спектральных, тепловых и потоковых характеристик в сводном виде после обработки свиного stratum corneum жирными кислотами длиной 18 атомов углерода. Результаты ИК и ДСК-анализа получены на образцах, гидратированных до 30 мас.%-ного содержания воды. В случае мононенасыщенных кислот, форма (цис-транс) и положение вдоль углеродной цепи каждого изомера приведены в скобках. Каждое значение дает среднюю величину для минимум двух образцов.
Олеиновая и цис-вакценовая кислоты дают, каждая, максимум ИК-поглощения на 2920 см-1, тогда как насыщенная стеариновая кислота и две транс-кислоты дают более низкие значения (около 2918 - 2919), как и в контроле. Хотя разности между группами жирных кислот меньше цифрового разрешения прибора (2,7 см-1, метод центра тяжести для определения пиковой частоты обеспечивает достаточную точность для несложной оценки разностей менее 1,0 см-1 по представленным в цифровой форме данным. Кроме того, некоторые из экспериментов повторены трижды со стандартной погрешностью средней величины менее 0,5 см-1. Таким образом, несмотря на малость, изменения пиковой частоты после обработки Stratum corneum олеиновой и цис-вакценовой кислотой, по сравнению с другими, являются значительными.
Из ДСК-данных видно также, что две цис-жирные кислоты дают пониженные максимумы переходов по сравнению со стеариновой кислотой, двумя транс-жирными кислотами и контролем. Можно видеть также, что цис-жирные кислоты дают более широкий пик (отношение ширины пика к его высоте), чем другие. Данные свидетельствуют также о том, что с увеличением расстояния между двойной связью и карбоксильной группой происходит большее снижение Tm.
Потоковые показатели для олеиновой кислоты также значительно больше, чем для стеариновой кислоты, этанольного контроля и элаидиновой кислоты. Разность в потоковых показателях даже еще выше для цис-вакценовой кислоты по сравнению с контролем и транс-вакценовой кислотой. Таким образом, приведенные ИК- и ДСК-результаты говорят о высокой степени корреляции со скоростью потока.
Пример 5. Корреляция температуры плавления липидов по данным ДСК с концентрацией этанола в водных носителях, содержащих олеиновую кислоту
Используя приведенную методику определения температуры липидного перехода в образцах свиного stratum corneum по данным дифференциальной сканирующей калориметрии, получали температуру плавления. Tm для stratum corneum в различных растворах этанол/ буфер Соренсена, каждый из которых содержит 0,25 об. % олеиновой кислоты (0,22 мас.%/об.). Результаты сведены в табл. E.
В тех же условиях образцы stratum corneum в одном лишь буфере Соренсена (без этанола или олеиновой кислоты) дают Tm 64oC. Stratum corneum в носителе, содержащем 40/60 по объему этанола/буфера без олеиновой кислоты также дает Tm 64oC.
Приведенные результаты свидетельствуют о том, что содержащие 20-70 об.% этанола носителя, и особенно содержащие 30-60% этанола, обладают уникальной способностью нарушать Stratum corneum, что является свойством, указывающим на усиление трансдермального потока.
Пример 6. По методике примера 2, но используя насыщенные растворы метилсалицилата и ибупрофена, 2-(4-изобутилфе-нил)пропионовую кислоту, вместо пироксикама, в растворах этанол/буфер Соренсена, каждый из которых содержит 0,25 об. % олеиновой кислоты, получают следующие показатели относительного потока через кожу бесшерстных мышей, приведенные в табл. F и G.
Пример 7. Трансдермальный поток доксазосина через кожу бесшерстных мышей
Донорные растворы получали растворением доксазосина в виде свободного основания в 30 об.% этаноле/буфере (0,1 М ацетата натрия, pH 5), содержащем 0,5% (по объему) 1- додецилазациклогептан-2-она (озон) и указанного количества метансульфокислоты (мезилат). Использовали четыре разных концентрации доксазосина в интервале от 2,2 до 8,95 мг/мл в носителях, содержащих либо 1,3, либо 2,2 мг/мл мезилата. Контроль без озона включен для случая наивысшей концентрации донора. Приемные растворы содержат только 30 об.% этанол/буфер.
Анализ по доксазосину проводили с использованием жидкостной хроматографии высокого давления с УФ-детектированием на 246 нм. Подвижная фаза состояла из 6 мМ 1-октан-натрийсульфоната, 35 об.% ацетонитрила и 1 об.% тетрагидрофурана в 0,1 М дизамещенно-натрийортофосфатном буфере. Окончательное значение pH доводили до pH 3,0 85%-ный (мас./об.) ортофосфорной кислотой. Во время анализа расход выдерживали на уровне 1,3 мл/мин через колонку C18 "Нова-Пак" (фирма "Уотерс") (15 см, частицы 3 мкм), термостатированную при 38oC. Все пробы (и стандарты) разбавляли минимум 1:1 подвижной фазой перед инъекцией. Кривые калибровки высоты пиков были линейными, при пределе детектирования приблизительно 0,05 мкг/мл.
Как и в последующих экспериментах с глипизидом, скорости потоков рассчитывали по данным ВЭЖХ. Результаты приведены в табл. H.
Обсуждение
Поток in vitro колебался от 12 до 59 мг/сут/30 см2 в зависимости от конкретной донорной концентрации доксазосина. Зависимость между потоком и донорной концентрацией является очевидно линейной и не зависит от мезилата. Наивысшая изученная концентрация (т. е. 8,95 мг/мл) представляет собой растворимость при насыщении доксазосин-мезилата в 30% этанол/буфере (0,1 М ацетата, pH 5) и лимитирует скорость транспортировки при 25oC. Контрольный (без озона) донорный носитель дает поток 0,6 мг/сут/30 см2 что приблизительно в 100 раз меньше, чем для соответствующего носителя с озоном.
В тех же условиях, что и приведенные выше, донорный раствор 2,40 мг/мл доксазосина в виде свободного основания (без мезилата) в 55 об.% этанол/буфере, содержащем 3 об.% озона дает поток 46,2 мг/сут/30 см2.
Пример 8. Трансдермальный поток глипизида через кожу бесшерстных мышей
Трансдермальный поток растворов глипизида, 1-цикло-гексил-3-[[р-[2-(5-метилпиразинкарбоксамидо)этил]фенил]- сульфонил]] мочевины в 20,30 и 55% (по объему) этаноле с использованием озона, N-додецил-1-азациклогептан-2-она, в качестве усилителя проникания. Каждый носитель испытывали с 0,5 об.% озона 7 или без него при pH около 9 в 0,01 М трио-буфере. В приемном отделении использовали эквивалент донорного раствора без глицизида или озона.
Анализ на глипизид производился с помощью ВЭЖХ с УФ-детектированием на 228 нм. Подвижная фаза состояла из 41 об.% ацетонитрила в 0,1 М дизамещенно-натрийфосфатном буфере. Окончательно pH доводили до 4,0 добавлением 85%-ный (мас. /об. ) фосфорной кислоты. Расход подвижной фазы поддерживали на уровне 1,0 мл/мин через колонку "Нова-Пак" (фирма "Уотерс") (15 см с размером частиц 3 мкм) при 32oC. Все пробы разбавляли минимум 1:1 подвижной фазой перед инъекцией. Кривые калибровки высоты пиков были линейными, предел детектирования около 0,05 мкг/мл. По результатам ВЭЖХ-анализа рассчитывали количество глипизида, прошедшего через кожу бесшерстных мышей за единицу времени, и его указывали как стационарный поток. Результаты приведены в свободном виде в табл. I.
Обсуждение
Транспорт in vitro глипизида через кожу бесшерстных мышей составляет от 30,8 до 101,4 мг/сут/30 см2. Увеличение концентрации лекарства не обязательно ведет к усилению потока. Наивысший поток наблюдался в 30%-ном этаноле, содержащем 0,5 об.% озона. Хотя концентрация лекарства в этом носителе составляет лишь половину концентрации в случае 55%-ного этанольного носителя, скорость транспортировки приблизительно в 3,5 раза выше. Аналогичное явление отмечено в примере 1 для амлодипина.
Пример 9. Препараты в виде раствора готовили следующим образом:
A.
Олеиновая кислота или - 0,25 г
Озон - 0,50 г
Амлодипин-бензолсульфонат - 1,0 г
Этанол - 30,0 мл
Вода - До 100 мл
довести до pH 5,0 гидроксидом натрия
B.
Олеиновая кислота или - 0,25 г
Озон - 0,50 г
Доксазосин-мезилат - 0,90 г
Этанол - 30,0 мл
Вода - До 100 мл
NaOH для доведения pH до 5,0
C.
Олеиновая кислота или - 0,25 г
Озон - 0,50 г
Цис-11-октадеценовая кислота - 0,75 г
Пироксикам - 1,0 г
Этанол - 40,0 мл
Вода - До 100 мл
D.
Олеиновая кислота или - 0,25 г
Озон - 0,50 г
Глипизид - 0,80 г
Этанол - 30,0 мл
Вода - До 100 мл
NaOH - До pH 9
E.
Цис-9-тетрадеценовая кислота - 2,0 г
Цис-6-пентадеценовая кислота - 5,0 г
Цис-6-гексадеценовая кислота или - 1,5 г
Цис-9-гексадеценовая кислота - 0,1 г
Активный ингредиент - 1,0 - 3,0 г
Этанол - 15 - 75 мл
Вода - До 100 мл
Пример 10. Нижеследующее является иллюстративными препаратами - гелями, имеющими состав согласно изобретению: (карбопол-940 представляет собой полимер полиакриловой кислоты производства фирмы "Б.Ф. Гудрич Ко.").
A.
Олеиновая кислота или - 0,25 г
Озон - 0,50 г
Карбопол 940 - 0,7 г
Бензиловый спирт - 1,0 г
Диизопронаоламин - 1,1 г
Гидроксиэтилцеллюлоза - 0,4 г
Пироксикам - 1,0 г
Этанол - 30,0 мл
Вода - До 100 мл
Ингредиенты смешивают, подогревают с перемешиванием для достижения диспергирования и оставляют охлаждаться до комнатной температуры.
B.
Олеиновая кислота или - 0,25 г
Озон - 0,50 г
Карбопол 940 - 0,7 г
Бензиловый спирт - 1,0 г
Диизопропаноламин - 1,1 г
Гидроксиэтилцеллюлоза - 0,4 г
Амлодипин-бензосульфонат - 1,0 г
Этанол - 35 мл
Вода - До 100 мл
Ингредиенты обрабатывают как в п. A, с образованием целевого геля.
При использовании 0,8 г глипизида или 1,0 г и бупрофена, 3,0 г салициловой кислоты и 0,9 г доксазосина-мезилата вместо амлодипина-бензолсульфоната в указанном выше препарате аналогично получают удовлетворительные гели.
C.
Усилитель проникания - 0,01 - 5,0 г
Карбопол-940 - 1,0 г
Бензиловый спирт - 1,0 г
Диизопропаноламин - 1,0 г
Гидроксиэтилцеллюлоза - 0,5 г
Этанол - 15 - 75 мл
Метилсалицилат - 10 г
Вода - До 100 мл.
Усилители проникания включают олеиновую кислоту, цис-6-октадеценовую, цис-11-октадеценовую, цис-12-октадеценовую, цис-5-эйкосеновую, цис-9-эйкосеновую, цис-11-эйкосеновую и цис-14-эйкосеновую кислоты, 1-децилазациклогептан-2-он, 1-додецилазациклогептан-2-он и 1-тетрадецилазациклогептан-2-он, цис-9-октадеценил-амин, цис-11-октадецениламин, цис-14-эйкосениламин, цис-9-тетрадецениловый спирт, цис-11-октадецениловый спирт, этилолеат, этил-цис-5-эйкосеноат, метил-цис-12-октадеценоат, изопропил-цис-9-гексадеценоат и н-бутил-цис-9-тетрадеценоат.
Пример 11. Нижеследующие препараты являются иллюстративными для гидрофильных мазей в качестве дозировочных форм композиций согласно изобретению.
A.
Олеиновая кислота или - 0,25 г
Озон - 0,50 г
ПЭГ 4000 - 17,2 г
Про-лекарственная форма - пироксикам-4-(1-этокси-карбонилэтил)карбониловый сложный эфир - 1,2 г
Этанол - 30 мл
Вода - До 100 мл
B.
Олеиновая кислота - 0,25 г
Активный ингредиент - 1-5 г
ПЭГ 4000 - 17,0 г
ПЭГ 400 - 17,0 г
Этанол - 15 - 55 мл
Вода - До 100 мл
ПЭГ-400 - коммерческий полиэтиленгликоль молекулярной массой 380-420. ПЭГ 4000 - коммерческий полиэтиленгликоль молекулярной массой 3000 - 3700.
Активные ингредиенты включают метилсалицилат, салициловую кислоту, ибупрофен, пироксикам, амлодипин-бензолсульфонат, доксазосин-мезилат и глипизид.
Область использования: изобретение относится к области фармацеи. Сущность изобретения: фармацевтическая композиция для трансдермального применения содержит фармакологически активное соединение или его пролекарство, водно-спиртовой растворитель, содержащий 15-75 об.% этанола и усилитель проникновения, представляющий собой 1-алкилзациклогептан-2-он с С8-16 или цисолефиновое соединение формулы (1) СНз/СН2/х СН=СН/СН2/у СООН, где Х и у представляют собой каждый число от 4 до 10, а сумма Х и У составляет от 10 до 16 в количестве 0,01-5 об.%. Данная система обладает усиленным проникновением. 7 з.п.ф-лы, 11 табл.
CH3 (CH2)X CH = CH (CH2)Y COOH,
где X и Y - каждый число от 4 до 10, а x + y - 10 - 16 в количестве 0,01 - 5 об.%.
| US, патент 4557934, кл | |||
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
Авторы
Даты
1998-03-27—Публикация
1991-12-23—Подача