Настоящее изобретение относится к ингибированию уменьшения трансдермального движения агента посредством ингибирования закрытия путей. В частности, настоящее изобретение относится к способу ингибирования уменьшения трансдермального движения агента, который доставляется через кожу или образец которого отбирается через кожу, в течение длительного периода времени, при котором доставка или отбор образцов сопровождается нарушением целостности по меньшей мере слоя кожи stratum corneum с формированием путей, через которые агент проходит посредством совместной доставки или совместного отбора образцов с определенным количеством по меньшей мере одного агента, препятствующего заживлению, при котором количество агента, препятствующего заживлению, является эффективным в отношении ингибирования уменьшения трансдермального движения агента, по сравнению с вариантом, когда доставка или отбор образцов происходят в практически идентичных условиях, за исключением отсутствия агента (агентов), препятствующего (препятствующих) заживлению.
Лекарственные средства обычно вводят перорально или путем инъекции. К сожалению, многие лекарственные средства являются полностью неэффективными или радикально понижают свою эффективность при пероральном введении, поскольку они не всасываются или испытывают неблагоприятные воздействия еще до попадания в кровоток и, таким образом, не обладают желаемой активностью. С другой стороны, прямая инъекция лекарственного средства в кровоток, хотя и гарантирует отсутствие изменений лекарственного средства при введении, является трудоемкой, неудобной и дискомфортной процедурой, что иногда способствует несоблюдению пациентом схемы и режима лечения. Трансдермальная доставка лекарственных средств предлагает улучшения в данной области. Однако во многих случаях скорость доставки или движения многих агентов посредством пассивного потока через кожу слишком ограничена, чтобы быть терапевтически эффективной.
Один способ увеличения трансдермального движения агентов основывается на приложении электрического тока через поверхность тела, называемом «электротранспортом». «Электротранспорт» обычно относится к прохождению благоприятно действующего агента, например лекарственного средства или предшественника лекарственного средства, через поверхность тела, такую как кожа, слизистые оболочки, ногти и т.п., где агент индуцируется или усиливается приложением электрического потенциала. Электротранспорт агентов через поверхность тела может достигаться различными способами. Один широко применяемый электротранспортный процесс, ионофорез, заключается в электрически индуцированном транспорте заряженных ионов. Электроосмос, другой тип электротранспортного процесса, заключается в движении растворителя с агентом через мембрану под влиянием электрического поля. Электропорация, еще один тип электротранспорта, заключается в прохождении агента через поры, формируемые приложением к мембране электрического импульса (импульсов) высокого напряжения. Во многих случаях могут наблюдаться более одного из указанных процессов одновременно, в различной степени. Соответственно, термин «электротранспорт» в данном документе трактуется в самом широком смысле этого слова, включая электрически индуцированный или усиленный транспорт по меньшей мере одного заряженного или незаряженного агента или их смесей, независимо от конкретного механизма или механизмов, посредством которых агент действительно транспортируется. Электротранспортная доставка обычно увеличивает движение агента во время трансдермальной доставки.
Другой способ увеличения движения агента включает предварительное воздействие на кожу благоприятного агента или совместную доставку с благоприятным агентом, усилителем проницаемости кожи. Вещество, усиливающее проницаемость кожи, при нанесении на поверхность тела, через которую доставляется агент, усиливает его движение через нее, так же, как при повышении избирательной проницаемости и/или проницаемости поверхности тела, создавая гидрофильные пути через поверхность тела, и/или уменьшая разложение агента во время транспорта. Указанная методология обычно применяется, когда лекарственное средство доставляется трансдермально путем пассивной диффузии.
Было предпринято также много попыток механического проникновения через кожу или нарушения целостности, создавая, таким образом, проходы в кожу с целью усиления трансдермального движения агента. Некоторые из наиболее ранних попыток усиления трансдермального движения лекарственного средства включали нанесение на кожу царапин (например, наждачной бумагой) или соскабливание полосок кожи для разрыва stratum corneum. Позднее были попытки прокалывать или надрезать кожу через stratum corneum с помощью крохотных прокалывающих/режущих элементов. См., например, патенты США №№ 5879326, выданный Godshall et al., 3814097, выданный Ganderton et al., 5279544, выданный Gross et al., 5250023, выданный Lee et al., 3964482, выданный Gerstel et al., переуступленный патент 25637, выданный Kravitz et al., и РСТ публикации №№ WO 96/37155, WO 96/37256, WO 96/17648, WO 97/03718, WO 98/11937, WO 98/00193, WO 97/48440, WO 97/48441, WO 97/48442, WO 98/00193, WO 99/64580, WO 98/28037, WO 98/29298 и WO 98/29365. Указанные устройства используют колющие элементы различной формы и размеров для прокалывания самого внешнего слоя (т.е. stratum corneum) кожи. Колющие элементы, описанные в указанных ссылках, обычно располагаются перпендикулярно на тонкой плоской детали, такой как тампон или листок. Колющие элементы или микровыступы в некоторых из данных устройств крайне малы по размеру, у некоторых измерения (т.е. длина и ширина) составляют приблизительно лишь 25-400 мкм, а толщина микровыступов - приблизительно лишь 5-50 мкм. Указанные крошечные колющие/режущие элементы соответственно осуществляют маленькие микропроколы/микроразрезы в stratum corneum для усиления трансдермальной доставки через них агента.
В настоящее время установлено, что на человеческой коже пути, созданные микропроколами/микроразрезами, быстро закрываются и герметизируются, благодаря естественным процессам заживления кожи. Хотя указанный процесс в настоящее время еще не до конца понятен, полагают, что он тесно связан с заживлением ран. Заживление ран представляет собой сложный феномен, в котором участвует множество биологических процессов. Самое первое событие, которое имеет место в течение первых минут в процессе заживления раны, представляет собой формирование фибринового сгустка. Помимо этого, во время ранней фазы заживления раны высвобождается или генерируется множество провоспалительных медиаторов. Высвобождение данных факторов запускает миграцию кератиноцитов, лейкоцитарную инфильтрацию, пролиферацию фибробластов, что приводит к распаду белков, синтезу белков и ремоделированию тканей. В конце данного процесса достигается восстановление кожного барьера. В некоторых случаях усиление трансдермального движения агента, создаваемое указанными путями, полностью прекращается через несколько часов после формирования указанных путей. Таким образом, существует потребность в способе, который может предотвратить или по меньшей мере замедлить процессы естественного заживления кожи, чтобы обеспечить трансдермальное движение агентов через микроразрезы/микропроколы в течение более длительных периодов времени (например, приблизительно более одного часа), когда используется методика доставки с помощью микропрокалывающих элементов.
Настоящее изобретение удовлетворяет указанную и родственные ей потребности.
Настоящее изобретение относится к способу ингибирования уменьшения трансдермального движения агента, который доставляется через кожу или образец которого отбирается через кожу, в течение длительного периода времени, при котором трансдермальное движение сопровождается нарушением целостности по меньшей мере слоя кожи stratum corneum. Конкретно было установлено, что посредством совместной доставки или совместного отбора образцов в присутствии по меньшей мере одного агента, препятствующего заживлению, закрытие путей в коже, сформированных благодаря нарушению целостности слоя кожи stratum corneum, можно ингибировать, ингибируя, таким образом, и уменьшение трансдермального движения агента.
Соответственно, в первом аспекте настоящее изобретение относится к способу ингибирования уменьшения трансдермального движения агента, который доставляется через кожу или образец которого отбирается через кожу, в течение длительного периода времени, при котором доставка сопровождается нарушением целостности (например, путем пункций) по меньшей мере слоя кожи stratum corneum, для формирования множества путей, через которые проходит агент; указанный способ включает совместную доставку или совместный отбор образцов агента с определенным количеством по меньшей мере одного агента, препятствующего заживлению, при котором указанное количество указанного агента, препятствующего заживлению, является эффективным для ингибирования уменьшения трансдермального движения указанного агента по сравнению с доставкой или отбором образцов указанного агента в практически идентичных условиях, исключая отсутствие указанного агента (агентов), препятствующего заживлению.
Во втором аспекте настоящее изобретение относится к способу трансдермальной доставки агента в течение продолжительного периода времени, который включает
(i) формирование множества разрывов, проходящих через слой кожи stratum corneum, для образования путей, через которые проходит агент, и
(ii) помещение резервуара в условия, позволяющие передачу агента, в отношении микроразрывов, образованных на стадии (i); указанный резервуар включает агент и количество по меньшей мере одного агента, препятствующего заживлению, в котором указанное количество указанного агента, препятствующего заживлению, является эффективным в отношении ингибирования уменьшения трансдермального движения указанного агента по сравнению с доставкой указанного агента в практически идентичных условиях, исключая отсутствие указанного агента (агентов), препятствующего заживлению.
В третьем аспекте настоящее изобретение относится к способу трансдермального отбора образцов агента в течение продолжительного периода времени, который включает
(i) формирование множества разрывов, проходящих через слой кожи stratum corneum, для образования путей, через которые проходит агент, и
(ii) помещение резервуара в условия, позволяющие передачу агента, в отношении микроразрывов, образованных на стадии (i); указанный резервуар включает количество по меньшей мере одного агента, препятствующего заживлению, в котором указанное количество указанного агента, препятствующего заживлению, является эффективным в отношении ингибирования уменьшения трансдермального движения указанного агента, по сравнению с отбором образцов указанного агента в практически идентичных условиях, исключая отсутствие указанного агента (агентов), препятствующего заживлению.
В указанных выше способах по меньшей мере слой кожи stratum corneum проколот, рассечен или как-либо иначе поврежден (например, абразивами или соскабливанием полосок), и, наиболее предпочтительно по меньшей мере слой кожи stratum corneum перфорирован с помощью устройства для перфорации кожи, имеющего множество микровыступов, которые могут проникать сквозь stratum corneum кожи, с формированием множества путей, через которые проходит агент и агент, препятствующий заживлению. Агент (агенты), препятствующий заживлению, доставляется либо до доставки или отбора образца агента, либо до и во время трансдермального движения агента; либо во время трансдермального движения агента; либо во время и после трансдермального движения агента.
В указанных выше способах предпочтительно агент (агенты), препятствующий заживлению, выбирают из группы, состоящей из антикоагулянтов, противовоспалительных агентов, агентов, которые ингибируют миграцию клеток, и осмотических агентов, в количестве, эффективном для генерирования в растворе осмотического давления, превышающего 2000 килопаскалей, предпочтительно превышающего приблизительно 3000 килопаскалей, при 20°С, или их смесей.
Предпочтительно антикоагулянт выбирают из группы, состоящей из гепарина с молекулярной массой от 3000 до 12000 дальтон, пентозанполисульфата, лимонной кислоты, цитратных солей, EDTA и декстранов с молекулярной массой от 2000 до 10000 дальтон.
Предпочтительно противовоспалительный агент выбирают из группы, состоящей из гидрокортизона натрийфосфата, бетаметазона натрийфосфата и триамцинолона натрийфосфата.
Предпочтительно агент, который ингибирует миграцию клеток, выбирают из группы, состоящей из ламинина и родственных ему пептидов.
Предпочтительно осмотический агент представляет собой биологически совместимую соль, такую как хлорид натрия, или нейтральное соединение, такое как глюкоза, или цвиттерионовое соединение, такое как глицин, имеющее достаточно высокую концентрацию, чтобы обеспечить в растворе осмотическое давление, превышающее 2000 килопаскалей, предпочтительно более приблизительно 3000 килопаскалей.
Предпочтительно агент, который доставляется трансдермально, представляет собой макромолекулярный агент, выбранный из группы, состоящей из полипептидов, белков, олигонуклеотидов, нуклеиновых кислот и полисахаридов.
Предпочтительно полипептиды и белки выбирают из группы, состоящей из десмопрессина, лютеинизирующего релизинг-гормона (LHRH) и аналогов LHRH (например, гозерелина, лейпролида, бузерелина, трипторелина), РТН, кальцитонина, интерферона-α, интерферона-β, интерферона-γ, фолликулостимулирующего гормона (FSH), hGH, инсулина, инсулинотропина и эритропоэтина.
Предпочтительно олигонуклеотид выбирают из группы, состоящей из ISIS 2302, ISIS 15839 и других фосфоротиолированных олигонуклеотидов и других метоксиэтилфосфоротиолированных олигонуклеотидов, а полисахарид выбирают из группы, состоящей из низкомолекулярного гепарина, имеющего молекулярную массу от 3000 до 12000 дальтон, и пентозанполисульфата.
Предпочтительно агент, образец которого отбирают трансдермально, представляет собой аналит организма. Предпочтительно аналитом организма является глюкоза.
Предпочтительно агент и агент (агенты), препятствующий заживлению, доставляются трансдермально путем пассивной диффузии и/или путем электротранспорта.
В четвертом аспекте настоящее изобретение относится к устройству для трансдермальной доставки агента в течение продолжительного периода времени; указанное устройство включает
(i) элемент, имеющий множество прокалывающих кожу микровыступов, для формирования множества микроразрезов, проходящих через слой кожи stratum corneum, для образования путей, через которые проходит агент, и
(ii) резервуар, включающий агент и количество по меньшей мере одного агента, препятствующего заживлению, в котором указанное количество указанного агента, препятствующего заживлению, является эффективным в отношении ингибирования уменьшения трансдермального движения указанного агента, по сравнению с доставкой указанного агента в практически идентичных условиях, исключая отсутствие указанного агента (агентов), препятствующего заживлению.
В пятом аспекте настоящее изобретение относится к устройству для трансдермального отбора образцов агента в течение продолжительного периода времени; указанное устройство включает
(i) элемент, имеющий множество прокалывающих кожу микровыступов для формирования множества микроразрезов, проходящих через слой кожи stratum corneum, для образования путей, через которые проходит агент, и
(ii) резервуар, включающий количество по меньшей мере одного агента, препятствующего заживлению, в котором указанное количество указанного агента, препятствующего заживлению, является эффективным в отношении ингибирования уменьшения трансдермального движения агента, по сравнению с отбором образцов агента в практически идентичных условиях, исключая отсутствие указанного агента (агентов), препятствующего заживлению.
В шестом аспекте настоящее изобретение относится к набору для трансдермальной доставки или отбора образцов агента в течение продолжительного периода времени; указанный набор включает
(i) устройство со множеством микровыступов, для формирования микроразрезов, проходящих через слой кожи stratum corneum, для образования путей, через которые проходит агент, и
(ii) аппликатор для помещения указанного первого элемента указанного устройства на кожу с целью формирования указанных повреждений.
Предпочтительно агент (агенты), препятствующий заживлению, выбирают из группы, состоящей из антикоагулянтов, противовоспалительных агентов, агентов, которые ингибируют миграцию клеток, и осмотических агентов, в количестве, эффективном для генерирования в растворе осмотического давления, превышающего приблизительно 2000 килопаскалей, предпочтительно превышающего приблизительно 3000 килопаскалей, при 20°С, или их смесей.
Предпочтительно антикоагулянт выбирают из группы, состоящей из гепарина с молекулярной массой от 3000 до 12000 дальтон, пентозанполисульфата, лимонной кислоты, цитратных солей, EDTA и декстранов с молекулярной массой от 2000 до 10000 дальтон.
Предпочтительно противовоспалительный агент выбирают из группы, состоящей из гидрокортизона натрийфосфата, бетаметазона натрийфосфата и триамцинолона натрийфосфата.
Предпочтительно агент, который ингибирует миграцию клеток, выбирают из группы, состоящей из ламинина и родственных ему пептидов.
Предпочтительно осмотический агент представляет собой биологически совместимую соль, такую как хлорид натрия, или нейтральное соединение, такое как глюкоза, или цвиттерионовое соединение, такое как глицин, имеющее достаточно высокую концентрацию, чтобы обеспечить в растворе осмотическое давление, превышающее приблизительно 2000 килопаскалей, предпочтительно превышающее приблизительно 3000 килопаскалей.
Предпочтительно агент, который доставляется трансдермально, представляет собой макромолекулярный агент, выбранный из группы, состоящей из полипептидов, белков, олигонуклеотидов, нуклеиновых кислот и полисахаридов.
Предпочтительно полипептиды и белки выбирают из группы, состоящей из десмопрессина, лютеинизирующего релизинг-гормона (LHRH) и аналогов LHRH (например, гозерелина, лейпролида, бузерелина, трипторелина), РТН, кальцитонина, интерферона-α, интерферона-β, интерферона-γ, фолликулостимулирующего гормона (FSH), hGH, инсулина, инсулинотропина и эритропоэтина.
Предпочтительно олигонуклеотид выбирают из группы, состоящей из ISIS 2302, ISIS 15839 и других фосфоротиолированных олигонуклеотидов и других метоксиэтилфосфоротиолированных олигонуклеотидов, а полисахарид выбирают из группы, состоящей из низкомолекулярного гепарина, имеющего молекулярную массу от 3000 до 12000 дальтон, и пентозанполисульфата.
Предпочтительно агент, образец которого отбирают трансдермально, представляет собой аналит организма. Предпочтительно аналитом организма является глюкоза.
Настоящее изобретение далее будет описано более подробно со ссылкой на прилагаемые чертежи.
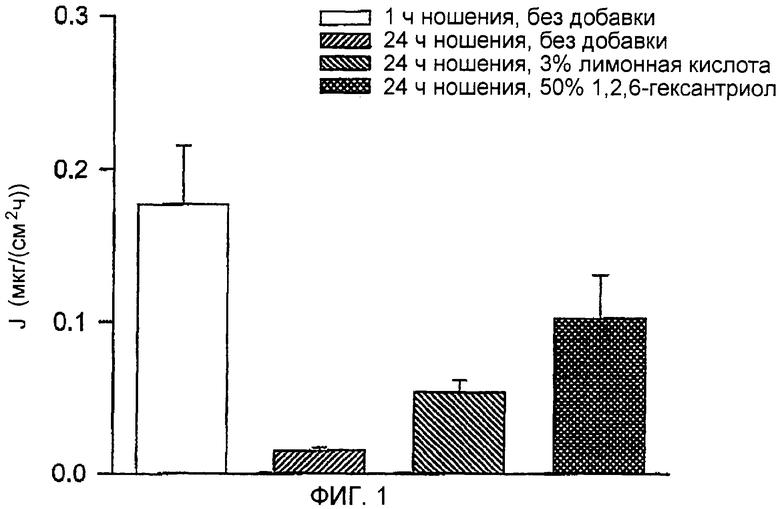
ФИГ.1 представляет собой график влияния ингибиторов закрытия путей на пассивное трансдермальное движение пентозанполисульфата.
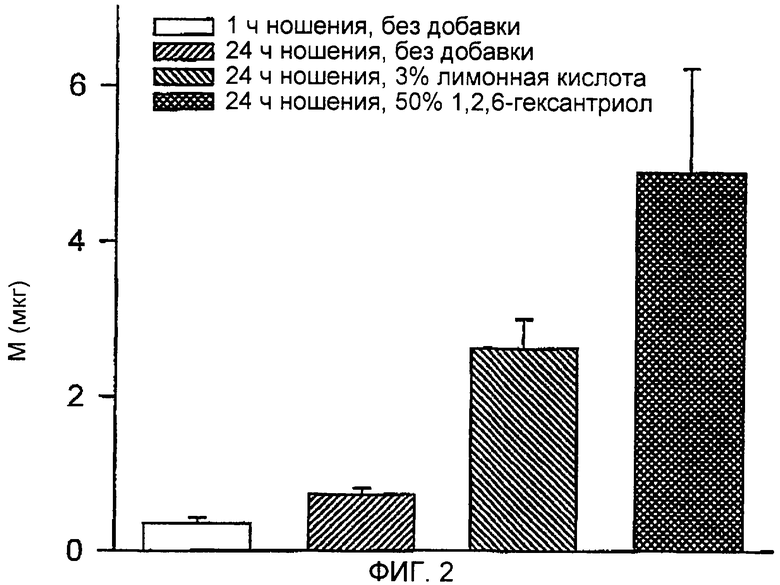
ФИГ.2 представляет собой график влияния ингибиторов закрытия путей на пассивную трансдермальную доставку пентозанполисульфата.
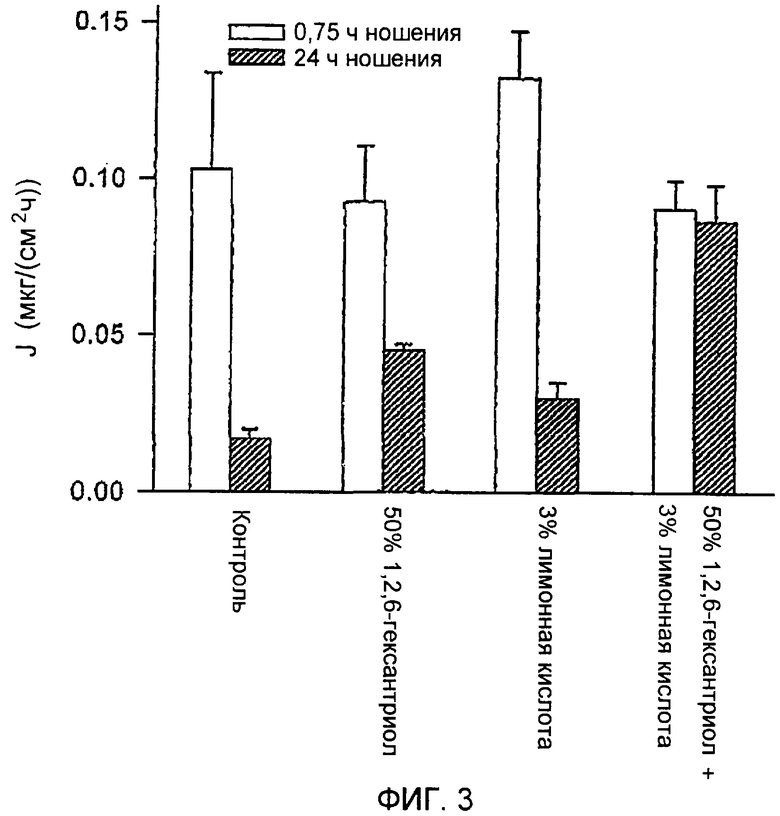
ФИГ.3 представляет собой график влияния ингибиторов закрытия путей на пассивное трансдермальное движение пентозанполисульфата.
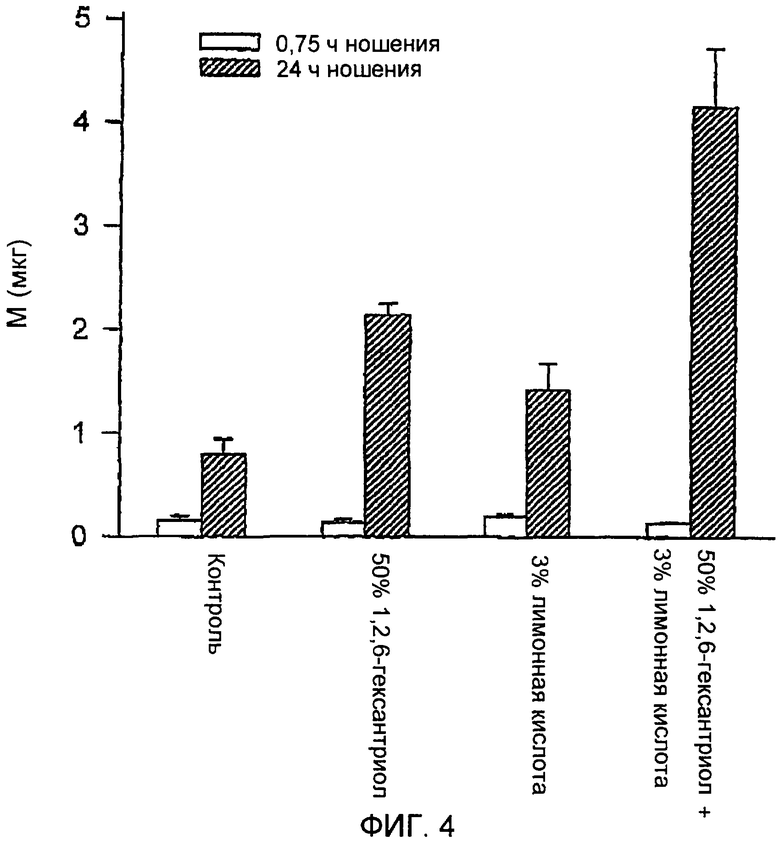
ФИГ.4 представляет собой график влияния ингибиторов закрытия путей на пассивную трансдермальную доставку пентозанполисульфата.
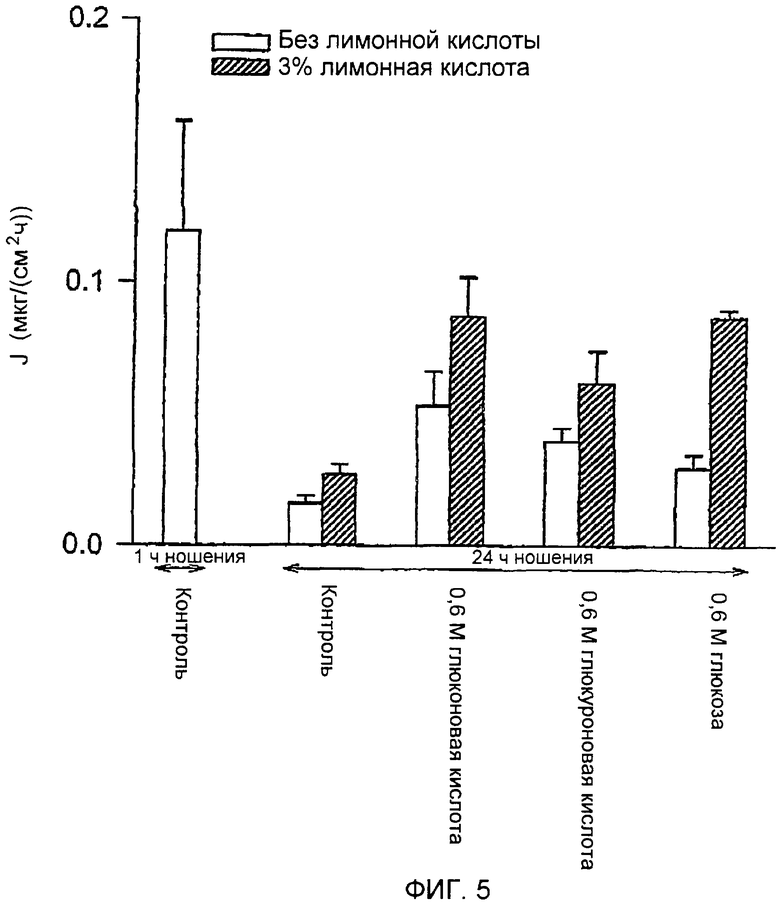
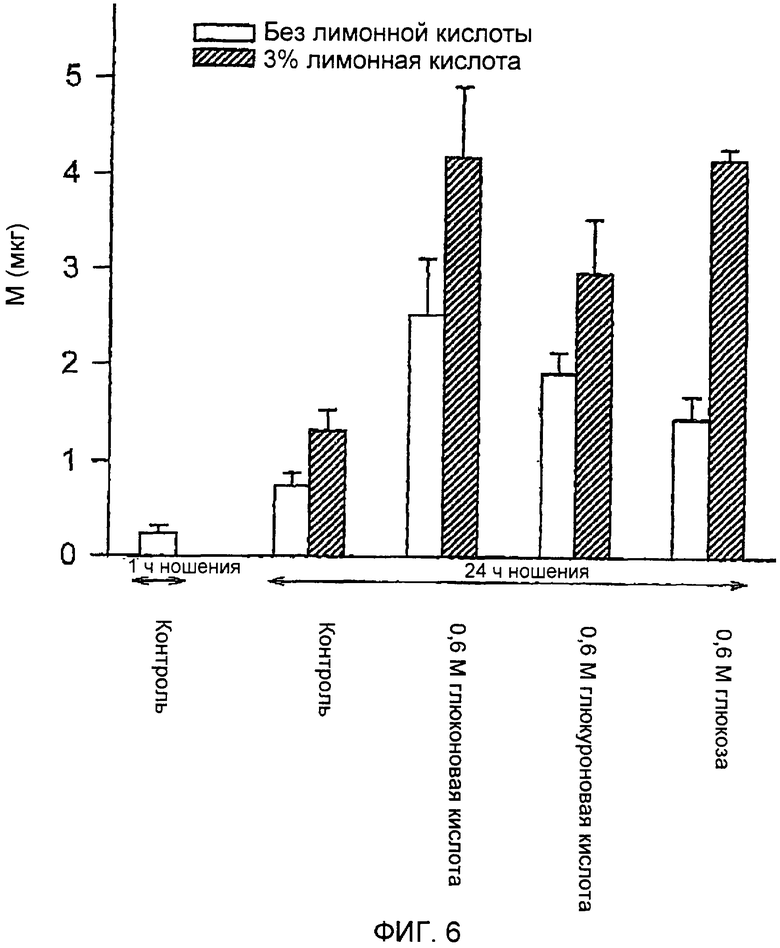
ФИГ.5 представляет собой график влияния ингибиторов закрытия путей на пассивную трансдермальную доставку пентозанполисульфата.
ФИГ.6 представляет собой график влияния ингибиторов закрытия путей на пассивную трансдермальную доставку пентозанполисульфата.
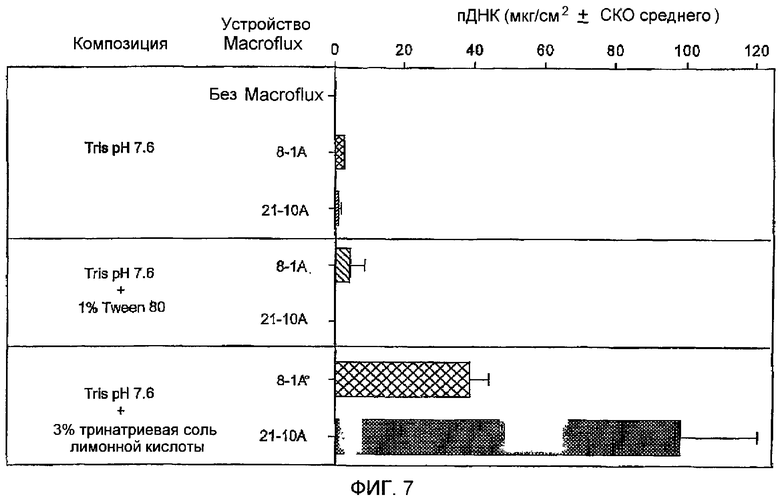
ФИГ.7 представляет собой график влияния ингибиторов закрытия путей на пассивную трансдермальную доставку ДНК.
ФИГ.8 представляет собой схематическое боковое изображение устройства для трансдермальной доставки или отбора образцов агента согласно настоящему изобретению.
Определения
Если не указано иное, следующие термины, употребляемые в настоящей заявке, имеют следующие значения.
Термин «трансдермальное движение» означает скорость прохождения любого агента в кожу и через кожу индивидуума или скорость прохождения любого агента через кожу индивидуума наружу.
Термин «трансдермальный» означает доставку или извлечение агента через кожу.
Термин «путь» означает проходы, сформированные в stratum corneum кожи путем нарушения ее целостности, что позволяет усилить трансдермальное движение агента. Целостность stratum corneum кожи может быть нарушена способами, хорошо известными специалистам, такими как обработка наждачной бумагой, соскабливание полосками, нанесение микропорезов и т.п. Другие способы описаны в патентах США №№ 6022316, 5885211 и 5722397, описание которых целиком включено в настоящий документ в качестве ссылок. Предпочтительно проходы формируются путем нарушения целостности кожи с помощью устройства, имеющего множество микровыступов, прокалывающих stratum corneum, что создает микроразрезы в stratum corneum.
Термин «микровыступ», используемый в настоящем документе, относится к очень маленьким элементам, прокалывающим stratum corneum, которые обычно имеют длину менее 500 микрометров, предпочтительно менее 250 микрометров, которые проникают через stratum corneum. С целью проникновения через stratum corneum микровыступы предпочтительно имеют длину по меньшей мере 50 микрометров. Микровыступам можно придавать любую форму, такую как иглы, полые иглы, лезвия, шпильки, дыроколы и их комбинации.
Термин «множество микровыступов», используемый в настоящем документе, относится к множеству микровыступов с упорядоченным расположением, которые предназначены для прокалывания stratum corneum. Множество микровыступов можно сформировать путем гравировки лезвий на тонком листке и заворачивания каждого лезвия наружу по отношению к плоскости пластинки, чтобы образовать конфигурацию, показанную на ФИГ.8. Множество микровыступов можно сформировать также другими способами, такими как соединение множества полосок, имеющих микровыступы по кромке каждой полоски. Множество микровыступов может включать полые иглы, которые инъецируют жидкую композицию. Примеры множеств микровыступов описаны в патенте США № 5879326, выданном Godshall et al., 3814097, выданном Ganderton et al., 5279544, выданном Gross et al., 5250023, выданном Lee et al., 3964482, выданном Gerstel et al., переуступленном патенте 25637, выданном Kravitz et al., и РСТ публикациях №№ WO 96/37155, WO 96/37256, WO 96/17648, WO 97/03718, WO 98/11937, WO 98/00193, WO 97/48440, WO 97/48441, WO 97/48442, WO 98/00193, WO 99/64580, WO 98/28037, WO 98/29298 и WO 98/29365, каждый из которых включен в настоящий документ в качестве ссылки.
Термин «пролонгированная доставка», используемый в настоящем документе, означает период доставки, который длится по меньшей мере полчаса, предпочтительно от нескольких часов до приблизительно 24 часов, более предпочтительно приблизительно от 8 до 24 часов.
Термин «совместная доставка», используемый в настоящем документе, означает, что агент (агенты), препятствующий заживлению, вводят трансдермально до доставки агента; до и во время трансдермального движения агента во время трансдермального движения агента и/или во время и после трансдермального движения агента.
Термин «совместный отбор образцов», используемый в настоящем документе, означает, что агент (агенты), препятствующий заживлению, вводят трансдермально до отбора образца агента посредством трансдермального движения; до и во время трансдермального движения агента во время трансдермального движения агента и/или во время и после трансдермального движения агента.
Для целей трансдермальной доставки термин «агент», используемый в настоящем документе, относится к агенту, лекарственному средству, соединению, композиции вещества или их смеси, которые оказывают некоторое фармакологическое, часто благоприятное, действие. Он используется в своей широчайшей интерпретации как любое фармацевтически приемлемое вещество, которое можно доставлять в живой организм для получения желательного, обычно благоприятного, эффекта. Обычно это включает терапевтические агенты во всех главных терапевтических областях, включая, без ограничения, противоинфекционные агенты, такие как антибиотики и противовирусные агенты; анальгетики, такие как фентанил, суфентанил и бупренорфин, и анальгетические комбинации; анестетики; анорексики; антиаритмические агенты; противоартритные агенты; антиастматические агенты, такие как тербуталин; противосудорожные агенты; антидепрессанты; противодиабетические агенты; агенты против диареи; антигистаминные агенты; противовоспалительные агенты; препараты против мигрени; препараты против кинетозов, такие как скополамин и ондансетрон; агенты против тошноты; агенты против новообразований; лекарственные средства против паркинсонизма; противозудные агенты; антипсихотические агенты; жаропонижающие агенты; спазмолитики, включая действующие на желудочно-кишечный тракт и мочевыводящую систему; антихолинергические агенты; симпатомиметические агенты; ксантиновые производные; сердечно-сосудистые препараты, включая блокаторы кальциевых каналов, такие как нифедипин; бета-агонисты, такие как добутамин и ритодрин; бета-блокаторы; антиаритмики; антигипертензивные агенты, такие как атенолол; ингибиторы АПФ, такие как ранитидин; диуретики; вазодилататоры, включая общие, коронарные, периферические и церебральные; стимуляторы центральной нервной системы; препараты против кашля и простуды; противозастойные агенты; диагностические агенты; гормоны, такие как паратиреоидные гормоны; снотворные агенты; иммунодепрессанты; мышечные релаксанты; парасимпатолитики; парасимпатомиметики; простагландины; белки; пептиды; психостимулирующие агенты; вакцины; седативные агенты и транквилизаторы.
Настоящее изобретение является особенно пригодным для контролируемой доставки пептидов, полипептидов, белков или других макромолекул, которые трудно доставлять трансдермально из-за их больших размеров. Указанные макромолекулярные вещества обычно имеют молекулярную массу по меньшей мере около 300 дальтон и чаще в пределах приблизительно от 300 до 40000 дальтон. Примеры полипептидов и белков, которые можно доставлять в соответствии с настоящим изобретением, включают, без ограничения, LHRH, аналоги LHRH (такие как гозерелин, лейпролид, бузерелин, трипторелин, гонадорелин, нафарелин и лейпролид), GHRH, GHRF, инсулин, инсулинотропин, кальцитонин, октреотид, эндорфин, TRH, NT-36 (химическое наименование: N-[[(s)-4-оксо-2-азетидинил]карбонил]-L-гистидил-L-пролинамид), липрецин, гормоны гипофиза (например, HGH, HMG, HCG, десмопрессина ацетат и т.п.), фолликулярные лютеоиды, α-ANF, фактор роста, такой как релизинг-фактор (GFRF), β-MSH, GH, соматостатин, брадикинин, соматотропин, фактор роста, полученный из тромбоцитов, аспарагиназу, блеомицина сульфат, химопапаин, холецистокинин, хорионический гонадотропин, кортикотропин (АСТН), эритропоэтин, эпопростенол (ингибитор агрегации тромбоцитов), глюкагон, гирудин и аналоги гирудина, такие как гирулог, гиалуронидазу, интерлейкин-2, менотропины (урофоллитропин (FSH) и LH), окситоцин, стрептокиназу, активатор тканевого плазминогена, урокиназу, вазопрессин, десмопрессин, аналоги АСТН, ANP, ингибиторы клиренса ANP, антагонисты ангиотензина II, агонисты антидиуретического гормона, антагонисты антидиуретического гормона, антагонисты брадикинина, CD4, цередазу, CSI, энкефалины, фрагменты FAB, супрессоры пептида IgE, IGF-1, нейротрофические факторы, колониестимулирующие факторы, агонисты паратиреоидного гормона, антагонисты паратиреоидного гормона, антагонисты простагландинов, пентижетид, белок С, белок S, ингибиторы ренина, тимозин альфа-1, тромболитики, TNF, PTH, гепарин с молекулярной массой от 3000 до 12000 дальтон, вакцины, аналоги антагониста вазопрессина, интерферон-α, -β и -γ, антитрипсин альфа-1 (рекомбинантный) и TGF-бета.
Следует понимать, что в композицию агента в способе по настоящему изобретению можно включать более одного агента и что использование термина "агент" никоим образом не исключает использования двух или более указанных агентов или лекарственных средств.
Агенты могут иметь различные формы, такие как свободные основания, кислоты, заряженные или незаряженные молекулы, компоненты молекулярных комплексов или нераздражающие, фармакологически приемлемые соли. Также можно использовать простые производные агентов (такие как эфиры, сложные эфиры, амиды и т.п.), которые легко гидролизуются рН, ферментами и т.п. в организме. В резервуаре для лекарственного средства агенты могут быть в растворе, в суспензии или представлять собой их комбинацию. Альтернативно агент может находиться в форме множества частиц.
Количество агента, которое используется в устройстве для доставки, будет представлять собой такое количество, которое необходимо для доставки терапевтически эффективного количества агента для достижения желаемого результата. На практике данное количество будет широко варьировать в зависимости от конкретного агента, участка доставки, тяжести состояния и желаемого терапевтического эффекта. Таким образом, определение конкретных пределов для терапевтически эффективного количества агента, использующегося в способе, является непрактичным.
Для целей трансдермального отбора образцов термин «агент», который используется в настоящем документе, относится к аналитам организма, подлежащим отбору. Термин «аналит», который используется в настоящем документе, означает любой химический или биологический материал или соединение, подходящее для прохождения через биологическую мембрану с помощью методики, изложенной в настоящем изобретении, или с помощью ранее известной методики, о концентрации или активности в организме которого индивидуум может пожелать узнать. Глюкоза является конкретным примером аналита, поскольку она представляет собой сахар, подходящий для прохождения через кожу, и индивидуумы, например, страдающие диабетом, могут хотеть знать уровни глюкозы в своей крови. Другие примеры аналитов включают, без ограничения, такие соединения как натрий, калий, билирубин, мочевина, аммиак, кальций, свинец, железо, литий, салицилаты, спирт, разрешенные вещества, запрещенные лекарственные средства и т.п.
Термин «терапевтическое» количество или скорость относится к количеству или скорости агента, необходимым для получения желаемого фармакологического, часто благоприятного, результата.
Термин «пассивная» трансдермальная доставка употребляется в настоящем документе для описания прохождения агента через поверхность тела, например кожу, путем пассивной диффузии. Обычно устройства для пассивной доставки имеют резервуар, который содержит высокую концентрацию лекарственного средства. Устройство помещают в контакте с поверхностью тела на продолжительный период времени, и оно позволяет лекарственному средству диффундировать из резервуара в организм пациента, в котором концентрация лекарственного средства намного ниже. Главной движущей силой при пассивной доставке лекарственного средства является градиент концентраций лекарственного средства вдоль кожи. При данном типе доставки лекарственное средство достигает кровотока путем диффузии через слои кожи. Предпочтительными агентами для пассивной доставки являются гидрофобные неионные агенты, что предполагает, что лекарственное средство должно диффундировать через липидные слои кожи.
Термин «электротранспорт» употребляется в настоящем документе для описания прохождения вещества, например лекарственного средства или пролекарства, через поверхность тела или мембрану, такую как кожа, слизистые оболочки или ногти, индуцированного по меньшей мере частично, приложением электрического поля через поверхность тела (например, кожу). Широко распространенный электротранспортный процесс, ионофорез, включает электрически индуцированный транспорт терапевтических агентов в форме заряженных ионов. Ионизируемые терапевтические агенты, например, в форме соли, которая при растворении образует заряженные ионы агента, являются предпочтительными для ионофоретической доставки, поскольку заряженные ионы агента движутся посредством электромиграции в пределах приложенного электрического поля. Электроосмос, другой тип электротранспортного процесса, включает движение жидкости, содержащей растворенный в ней заряженный и/или незаряженный терапевтический агент, через биологическую мембрану (например, кожу) под действием электрического поля. Другой тип электротранспорта, электропорация, включает образование временно существующих пор в живой биологической мембране с помощью приложения к ней импульсов высокого напряжения и доставку через них терапевтического агента. Однако во всех упомянутых электротранспортных процессах до некоторой степени может наблюдаться более одного такого процесса одновременно. Соответственно, термин «электротранспорт» используется в настоящем документе в самом широком смысле этого слова и включает электрически индуцированный или усиленный транспорт по меньшей мере одного агента, который может иметь заряд, т.е. находиться в форме ионов, или не иметь заряда, или их смесей, независимо от конкретных механизмов, посредством которых агент транспортируется на самом деле.
Термин «агент, препятствующий заживлению» означает агент, который в отдельности или в комбинации действует таким образом, что предотвращает или уменьшает естественные процессы заживление кожи, предотвращая, таким образом, закрытие путей, образованных нарушениями ее целостности, такими как микропроколы/микроразрезы в stratum corneum кожи. Примеры подходящих агентов, препятствующих заживлению, включают, без ограничения
(1) осмотические агенты, которые включают нейтральные соединения, такие как глюкоза, соли, такие как хлорид натрия, и цвиттерионовые соединения, такие как аминокислоты.
Композиция (как таковая или повторно растворенная сухая композиция) должна иметь осмотическое давление, превышающее приблизительно 2000 килопаскалей, и более предпочтительно превышающее приблизительно 3000 килопаскалей, при 20°С. Осмотическое давление рассчитывается из следующего отношения:
П=iMRT,
где i представляет собой фактор Вант-Гоффа, М представляет собой молярность растворенного вещества, R представляет собой универсальную газовую постоянную (8,314 J K-1 моль-1), а Т представляет собой температуру в градусах Кельвина.
Для нейтральных соединений i равен 1, а концентрация при 2000 кПа составляет 0,8 М; приблизительно при 3000 кПа она составляет 1,2 М.
Нейтральные соединения включают
(а) органические растворители, такие как диметилсульфоксид,
(b) кислоты в нейтральном состоянии, такие как борная кислота и т.п.,
(с) эфирные спирты и полимеры оксида этилена, включающие по меньшей мере одну спиртовую группу и имеющие молекулярную массу в пределах от 92 до 500.
Соединения данной группы включают этоксидигликоль, диэтиленгликоль, дипропиленгликоль, триэтиленгликоль, PEG-4, PEG-6, PEG-8 и PEG-9 и т.п.;
(d) алифатические спирты, включающие две спиртовые группы, такие как пропиленгликоль и бутандиол, и т.п.;
(е) алифатические спирты, включающие три спиртовые группы, такие как глицерин и 1,2,6-гексантриол, и т.п.;
(f) четырехатомные спирты, такие как эритритол и треитол, и т.п.;
(g) пятиатомные спирты, такие как адонит, ксилит и арабит, и т.п.;
(h) шестиатомные спирты, такие как сорбит, маннит, галактит, и т.п.;
(i) алифатические соединения, включающие одну кетоновую или альдегидную группу и по меньшей мере две спиртовые группы. Соединения данной группы включают дезоксирибозу, рибулозу, ксилулозу, псикозу, сорбозу и т.п.;
(j) циклические полиолы, такие как инозит, и т.п.;
(k) моносахариды, такие как апиоза, арабиноза, ликсоза, рибоза, ксилоза, дигитоксоза, фукоза, кверцитол, хиновоза, рамноза, аллоза, альтроза, фруктоза, галактоза, глюкоза, гулоза, гамамелоза, идоза, манноза, тагатоза, и т.п.;
(l) дисахариды, такие как сахароза, трегалоза, примевероза, вицианоза, рутиноза, сциллабиоза, целлобиоза, гентиобиоза, лактоза, лактулоза, мальтоза, мелибиоза, софороза и тураноза, и т.п.
Для солей с i=2 концентрация соли приблизительно при 2000 кПа составляет около 0,4 М; приблизительно при 3000 кПа она составляет около 0,6 М. Указанные соли включают хлорид натрия, солевые формы уксусной кислоты, пропионовой кислоты, гликолевой кислоты, пировиноградной кислоты, гидракриловой кислоты, молочной кислоты, пивалиновой кислоты, бета-гидроксимасляной кислоты, глицериновой кислоты, сорбиновой кислоты, миндальной кислоты, атролактиновой кислоты, троповой кислоты, хинной кислоты, глюкуроновой кислоты, глюконовой кислоты, гулоновой кислоты, глюкогептоновой кислоты, бензиловой кислоты, аммония, моноэтаноламина, диэтаноламина, аминометилпропандиола, трометамина, триэтаноламина, галактозамина и глюкозамина.
Для солей с i=3 концентрация соли приблизительно при 2000 кПа составляет около 0,3 М; приблизительно при 3000 кПа она составляет около 0,4 М. Указанные соли включают солевые формы фосфорной кислоты, малоновой кислоты, фумаровой кислоты, малеиновой кислоты, янтарной кислоты, тартроновой кислоты, щавелево-уксусной кислоты, яблочной кислоты, альфа-кетоглутаровой кислоты, цитрамалевой кислоты и винной кислоты.
Для солей с i=4 концентрация соли приблизительно при 2000 кПа составляет около 0,2 М; приблизительно при 3000 кПа она составляет около 0,3 М. Указанные соли включают солевые формы аконитовой кислоты, лимонной кислоты и изолимонной кислоты.
Для цвиттерионовых соединений i равен приблизительно 1, а концентрация при приблизительно 2000 кПа составляет около 0,8 М; приблизительно при 3000 кПа она составляет около 1,2 М.
Цвиттерионовые соединения включают аминокислоты, такие как глицин, аланин, пролин, треонин и валин, диаминокислоты, такие как глицилглицин, буферы, такие как 4-морфолинпропансульфоновая кислота (MOPS), (2-{[трис(гидроксиметил)метил]амин}-1-этансульфоновая кислота (TES), 4-(2-гидроксиэтил)-1-пиперазинэтансульфоновая кислота (HEPES), моногидрат β-гидрокси-4-(2-гидроксиэтил)-1-пиперазинпропансульфоновой кислоты (HEPPSO), трицин, бицин, CHES и CAPS и т.п.
(2) Антикоагулянты, такие как лимонная кислота, цитратные соли (например, цитрат натрия), декстрансульфат-натрий, EDTA, пентозанполисульфат, олигонуклеотиды, аспирин, низкомолекулярный гепарин и лиаполат натрия.
(3) Противовоспалительные агенты, такие как соль динатрийфосфат-21 бетаметазона, динатрийфосфат-21 триамцинолона ацетонида, гидрохлорид гидрокортамата, соль динатрийфосфат-21 гидрокортизона, соль динатрийфосфат-21 метилпреднизолона, соль натрийсукцинат-21 метилпреднизолона, динатрийфосфат параметазона, соль натрийсукцинат-21 преднизолона, соль натрийсульфобензоат-21-m преднизолона, гидрохлорид 21-диэтиламиноацетат преднизолона, натрийфосфат преднизолона, гидрохлорид 21-диэтиламиноацетата преднилидена, динатрийфосфат-21 ацетонида триамцинолона; солевая форма НПВП, таких как аспирин или другие салицилаты, бромфенак, диклофенак, дифлунизал, этодолак, фенопрофен, ибупрофен, индометацин, кетопрофен, кеторолак, меклофенамат, мефенамовая кислота, напроксен, оксапрозин, пироксикам, сулиндак, толметин, и противовоспалительные пептиды, такие как антифламмин 1 и антифламмин 2.
(4) Агенты, которые влияют на клеточную миграцию, такие как ламинин и родственные ему пептиды, и фибронектин и родственные ему пептиды.
Пределы концентрации для антикоагулянтов, противовоспалительных агентов и агентов, ингибирующих клеточную миграцию, составляют от 0,1 до 10% в композиции.
Главные барьерные свойства кожи, такие как резистентность к диффузии лекарственных средств, связаны с самым внешним слоем кожи, т.е. со stratum corneum. Внутренняя часть, т.е. подлежащие слои эпидермиса, обычно включает три слоя, называемые stratum granulosum, stratum malpighii и stratum germinativum. Через указанные слои резистентность к транспорту или адсорбции агента очень мала или вообще отсутствует. Следовательно, чтобы усилить трансдермальное движение, микровыступы, используемые для создания путей на поверхности тела, в соответствии с настоящим изобретением, должны проникнуть только через stratum corneum, чтобы агент был трансдермально доставлен или отобран его образец, при малой или отсутствующей резистентности со стороны кожи.
Предпринималось множество попыток механического проникновения или нарушения целостности кожи для создания, таким образом, проходов в кожу, чтобы усилить трансдермальное движение.
Однако проходы, созданные микропроколами/микроразрезами, быстро закрываются и герметизируются с помощью естественных процессов заживления кожи. Соответственно, усиление трансдермального движения агента, обеспечиваемое указанными проходами, полностью прекращается через несколько часов после создания данных путей. Настоящее изобретение ингибирует уменьшение трансдермального движения агента из-за закрытия путей после их создания.
В одном из вариантов осуществления настоящего изобретения кожу обрабатывают с помощью устройства, содержащего множество микровыступов, для формирования маленьких надрезов, прорезей или отверстий, называемых путями, в наиболее внешнем слое поверхности тела, с ограниченной глубиной. Микровыступам можно придавать различные формы, такие как иглы, полые иглы, лезвия, шпильки, дыроколы и их комбинации. Резервуар для доставки или отбора образцов агента помещают в контакт с предварительно обработанным участком поверхности тела для доставки или отбора образцов агента. Резервуар для доставки или отбора образцов агента содержит агент (агенты), препятствующий заживлению, который доставляется совместно с агентом. Указанный агент, препятствующий заживлению, предотвращает или по меньшей мере ингибирует закрытие путей и, следовательно, ингибирует уменьшение трансдермального движения агента, который доставляют или образцы которого отбирают. Альтернативно резервуар с агентом, препятствующим заживлению, и резервуар для доставки или отбора образцов агента могут представлять собой разные резервуары.
ФИГ.8 иллюстрирует пластырь для трансдермальной доставки или отбора образцов 10, включающий множество микровыступов 12, резервуар 14 и клейкий подкладочный слой 16, а также непроницаемый подкладочный слой 18. Хотя резервуар 14 был показан дистальной стороной по отношению к коже микровыступов 12, следует понимать, что резервуар может также быть расположен в других положениях. Например, резервуар 14 может быть снабжен дискретным слоем проксимально по отношению к коже или дистально по отношению к коже относительно основного листка, который поддерживает микровыступы 12. Резервуар 14 может быть снабжен покрытиями для микровыступов и/или резервуар может быть снабжен покрытиями для других частей пластыря 10. Хотя настоящее изобретение описано как включающее агент и агент, препятствующий заживлению, следует понимать, что агент и агент, препятствующий заживлению, могут располагаться в одном и том же резервуаре или в разных резервуарах устройства.
Устройство по настоящему изобретению можно использовать в связи с доставкой агента, отбором образцов агента или и тем, и другим. В частности, устройство по настоящему изобретению используется в связи с трансдермальной доставкой лекарственного средства, трансдермальным отбором образцов аналита или и с тем, и с другим. Устройства для трансдермальной доставки для применения по настоящему изобретению включают, без ограничения, пассивные устройства, электротранспортные устройства, осмотические устройства и устройства, работающие под давлением. Устройства для трансдермального отбора образцов для применения по настоящему изобретению включают, без ограничения, пассивные устройства, реверсивные электротранспортные устройства, устройства, работающие под отрицательным давлением, и осмотические устройства. Трансдермальные устройства по настоящему изобретению можно использовать в комбинации с другими способами увеличения движения агента, такими как усилители проницаемости кожи.
ПРИМЕРЫ
Следующие препараты и примеры приводятся для более полного понимания и практического осуществления специалистами настоящего изобретения. Они не должны рассматриваться как ограничивающие объем настоящего изобретения, а служат лишь для иллюстрации и представления настоящего изобретения.
Пример 1
Уменьшение движения лекарственного средства изучалось на трех моделях лекарственных средств, обладающих различными свойствами в отношении электрического заряда: пентозанполисульфат (PPS), соединение с большим отрицательным электрическим зарядом, DECAD, синтетический модельный декапептид, несущий два положительных электрических заряда при рН 5,5, и инулин, нейтральный полисахарид. Указанные соединения не проникают в значительной степени через кожу без использования усилителей проникновения или физического повреждения кожного барьера.
В данном эксперименте PPS, DECAD и инулин доставлялись путем пассивной диффузии через пути в коже, сформированные предварительной обработкой устройством со множеством микровыступов. Предварительная обработка включает помещение устройства со множеством микровыступов на кожу с силой, достаточной для создания множества микропроколов/микроразрезов через stratum corneum кожи. Устройство со множеством микровыступов затем удаляют с кожи, а затем поверх созданных путей помещают одну из форм устройства для доставки агента или резервуар с агентом с целью воздействия на доставку агента или отбор образцов. Предварительную обработку использовали вместо интегрированной системы, поскольку закрытие путей, как оказалось, наблюдается быстрее и более воспроизводимым образом после предварительной обработки, чем в случае, когда микровыступы оставляют на коже во время доставки лекарственного средства. Концентрация PPS была ниже концентрации, которая требуется для противосвертывающего эффекта. Все лекарственные средства растворяли в воде, а растворы превращали в гель с помощью 2% гидроксиэтилцеллюлозы. Концентрация PPS, DECAD и инулина составляла 0,1 мг/мл, 13 мг/мл и 2,5 мг/мл соответственно. PPS и DECAD получали радиоактивную метку тритием. Инулин получал радиоактивную метку 14С.
У бесшерстных морских свинок (HGP) кожу одного бока вручную билатерально растягивали на время наложения системы. Наложение множества микровыступов осуществляли с помощью ударного аппликатора. Накладываемая система включала пенопластовое двойное липкое кольцо (диаметр 3,8 см, толщина 0,16 см) с резервуаром площадью 2 см2 посередине, содержавшим множество микровыступов, имеющих площадь 2 см2, и включала пластинку из нержавеющей стали толщиной 0,025 мм, лезвия трапециевидной формы, изогнутые под углом приблизительно 90° к плоскости пластинки; микровыступы имели длину 545 микрометров и плотность расположения микровыступов 72 микровыступа/см2. После наложения силу растяжения ослабляли. Липкое кольцо оставалось приклеенным к коже, а устройство со множеством микровыступов удаляли. Композицию лекарственного средства (350 мкл) помещали в отделение для лекарственного средства и наносили подкладочную мембрану на липкую внешнюю поверхность кольца, чтобы герметизировать систему. На каждую композицию лекарственного средства использовали в общей сложности по шесть HGP. Через 1 час и 24 часа после наложения у 3 HGP из каждой группы системы удаляли, а оставшееся лекарственное средство смывали с кожи. Количество лекарственного средства, которое за указанные интервалы времени проникло через кожу, определяли путем измерения экскреции радиоактивности с мочой, в течение двух дней после удаления пластыря, и корригировали его по процентной доле, экскретированной после в/в инъекции (более ранние исследования показали, что для 3H-PPS, 3H DECAD и 14С инулина процентная доля, экскретированная через два дня после инъекции, составляла 32%, 65% и 94% соответственно). Результаты (таблица I) показывают, что между 1 часом и 24 часами движение лекарственного средства уменьшалось по меньшей мере на один порядок для всех лекарственных средств, что указывает на по меньшей мере частичное закрытие путей, сформированных проколами кожи с помощью микровыступов.
Движение модельных лекарственных средств после предварительной обработки устройством со множеством микровыступов
Пример 2
Ингибирование спадения путей с помощью химических агентов изучали после предварительной обработки кожи устройством со множеством микровыступов и нанесения композиции, содержавшей агент, на 24 часа. Количественное определение осуществляли путем оценки импрегнации путей красителем.
У HGP кожу одного бока вручную билатерально растягивали на время наложения. Наложение устройства со множеством микровыступов осуществляли с помощью ударного аппликатора. Накладываемая система включала пенопластовое двойное липкое кольцо (диаметр 3,8 см, толщина 0,16 см) с резервуаром площадью 2 см2 посередине, содержавшим множество микровыступов, имеющих площадь 2 см2, и включала пластинку из нержавеющей стали толщиной 0,025 мм, лезвия трапециевидной формы, изогнутые под углом приблизительно 90° к плоскости пластинки. Микровыступы имели длину 545 микрометров и плотность расположения микровыступов 72 микровыступа/см2. После наложения силу растяжения ослабляли. Липкое кольцо оставалось приклеенным к коже, а устройство со множеством микровыступов удаляли. Композицию (350 мкл), содержавшую испытуемое соединение в воде и необязательно желирующий агент (гидроксиэтилцеллюлоза (НЕС) с концентрацией 2% или силикагель с концентрацией 50%), помещали в резервуар для лекарственного средства и наносили подкладочную мембрану на липкую внешнюю поверхность кольца, чтобы герметизировать систему. На противоположную сторону морской свинке накладывали вторую систему, содержавшую другую композицию. Через двадцать четыре часа после наложения, по три системы из каждой группы удаляли, а оставшуюся композицию смывали с кожи. Кожу окрашивали 1% раствором метиленового синего. Избыток краски тщательно удаляли тампонами, смоченными 70% изопропиловым спиртом, и фотографировали участок. Фотографии оценивали с помощью балльной системы, от 0 до 5 баллов; 5 баллов присуждалось, если поглощение краски наблюдалось немедленно после наложения устройства со множеством микровыступов, а 0 баллов присуждалось, если поглощение краски наблюдалось после 24 ч контакта с контрольной композицией. Количество баллов 0,5 или более считалось значимым. Изучались различные осмотические агенты, антикоагулянты, противовоспалительные агенты, желирующие агенты, а также гели с различными значениями рН и различные добавки (таблица II). Среди осмотических агентов, наиболее эффективными агентами оказались полиол 1,2,6-гексантриол, глюкуроновая кислота, полимер оксида этилена и диэтиленгликоля, пятиатомный спирт адонит, шестиатомный спирт сорбит, полиол-амин трометамин и моносахарид глюкоза. Среди антикоагулянтов лимонная кислота, EDTA, а также декстран 5000 были наиболее эффективными агентами в отношении предотвращения закрытия путей. Противовоспалительные агенты динатрийфосфат бетаметазона, а также натриевая соль кетопрофена продемонстрировали достоверный эффект. Кератолитический агент салициловая кислота также оказывала влияние на закрытие путей. Низкий рН также ингибировал закрытие путей. Поверхностно-активные вещества (анионные, катионные и неионные) в нераздражающих концентрациях действия не оказывали. Инертные агенты не предотвращали закрытия путей. Участки, на которые воздействовали глицерином и лимонной кислотой, также окрашивались индийскими чернилами для подтверждения того, что пути были открыты для соединений большего размера.
Ингибирование закрытия путей химическими агентами по оценке с метиленовым синим после предварительной обработки устройством со множеством микровыступов
Пример 3
Пентозанполисульфат (PPS), соединение с высоким отрицательным электрическим зарядом, не проникает в значительной степени через кожу без использования усилителей проникновения или физического разрушения кожного барьера. В данном эксперименте, PPS доставлялся путем пассивной диффузии через пути в коже, созданные устройством со множеством микровыступов. Концентрация PPS была ниже концентрации, которая требуется для ингибирования спадения путей (см. таблицу II). Таким образом, при концентрации, которая использовалась в данном эксперименте, PPS вел себя как лекарственное средство, не имеющее никакой активности в отношении закрытия путей. Целью данного эксперимента было показать, что ингибиторы спадения путей, идентифицированные в примере 2, также улучшали движение лекарственных средств через кожу in vivo.
Всем морским свинкам кожу одного бока вручную билатерально растягивали на время наложения системы. Наложение устройства со множеством микровыступов осуществляли с помощью ударного аппликатора. Накладываемая система включала пенопластовое двойное липкое кольцо (диаметр 3,8 см, толщина 0,16 см) с гидрогелем, содержавшим лекарственное средство, имеющим площадь контакта с кожей 2 см2 в середине, содержавшей устройство со множеством микровыступов, имеющее площадь 2 см2, и включала пластинку из нержавеющей стали толщиной 0,025 мм, лезвия трапециевидной формы, изогнутые под углом приблизительно 90° к плоскости пластинки; микровыступы имели длину 545 мкм и плотность расположения микровыступов 72 микровыступа/см2. После наложения силу растяжения ослабляли. Липкое кольцо оставалось приклеенным к коже, а устройство со множеством микровыступов удаляли. Гидрогель, содержавший 3Н-PPS в воде (концентрация PPS 0,1 мг/мл, 2% НЕС, 350 мкл), помещали в отделение для лекарственного средства и накладывали пластиковое покрытие на липкую внешнюю поверхность кольца, чтобы герметизировать систему. Дополнительные группы HGP обрабатывали точно так же, за исключением того, что композиция содержала 3% тринатриевую соль лимонной кислоты или 50% 1,2,6-гексантриола). Через 1 и 24 ч после наложения по три системы из каждой группы удаляли, а оставшееся лекарственное средство смывали с кожи. Количество лекарственного средства, которое за указанные интервалы времени проникло через кожу, определяли путем измерения экскреции трития с мочой (более ранние исследования показали, что у HGP 32% трития, выделенного из 3H-PPS, инъецированного внутривенно, экскретируются с мочой). Результаты, представленные на ФИГ.1, показывают, что между 1 часом и 24 часами движение лекарственного средства уменьшалось приблизительно в 12 раз, что указывает на закрытие путей. Лимонная кислота и 1,2,6-гексантриол ингибировали указанное уменьшение движения. Движение в присутствии 1,2,6-гексантриола между 1 часом и 24 часами уменьшалось менее чем в 2 раза. Общее транспортированное количество возрастало приблизительно в 4 и 7 раз в присутствии лимонной кислоты и 1,2,6-гексантриола соответственно по сравнению с контролями, как показано на ФИГ.2.
Пример 4
Второй эксперимент выполняли с PPS. Условия были идентичны условиям, описанным в примере 3, за исключением того, что устройство со множеством микровыступов имело более короткие лезвия, длиной 194 микрометров, и более высокую плотность расположения микровыступов (190 микровыступов/см2). Концентрация PPS составляла 0,16 мг/мл и все еще была ниже концентрации, которая требовалась для спадения путей. Оценку осуществляли через 45 мин, вместо 1 ч. Кроме того, дополнительные группы животных получали композицию, содержащую смесь 3% тринатриевой соли лимонной кислоты и 50% 1,2,6-гексантриола. Как и в предыдущем примере, результаты, представленные на ФИГ.3, показывают, что между 0,75 и 24 ч движение резко уменьшалось, демонстрируя закрытие путей. Использованная добавка не влияла на движение PPS через 45 мин, что указывает на отсутствие у нее свойств усиления проникновения и что пути значимо не закрывались в течение этого периода времени. Через 24 часа лимонная кислота и 1,2,6-гексантриол достоверно ингибировали уменьшение движения. Движение в присутствии смеси тринатриевой соли лимонной кислоты и 1,2,6-гексантриола приводило к полному ингибированию уменьшения движения PPS, наблюдавшегося между 45 мин и 24 ч. Общие количества транспортированного PPS показаны на ФИГ.4. Эффект, наблюдавшийся в присутствии 3% тринатриевой соли лимонной кислоты и 50% 1,2,6-гексантриола, был более выражен, чем в присутствии добавки. Этот факт, возможно, является показателем того, что данные два агента являются эффективными в отношении разных механизмов заживления ран (лимонная кислота, возможно, предотвращает образование сгустка крови, в то время как 1,2,6-гексантриол, возможно, предотвращает другой процесс регенерации, такой как миграция кератиноцитов).
Пример 5
С PPS был выполнен дополнительный эксперимент. Условия были идентичны условиям, описанным в примере 4. Натриевую соль глюконовой кислоты, натриевую соль глюкуроновой кислоты и глюкозу оценивали в концентрации 0,6 М, в присутствии или в отсутствие 3% лимонной кислоты. Как и в предыдущем примере, результаты, представленные на ФИГ.5, показывают, что между 1 часом и 24 часами движение резко уменьшалось, демонстрируя закрытие путей. Через 24 часа все соединения и комбинации достоверно увеличивали движение PPS. Общие количества транспортированного PPS показаны на ФИГ.6. Эти результаты подтверждают выводы, представленные в примере 4, и показывают, что более низкие концентрации агентов, препятствующих заживлению, все равно являются очень эффективными в отношении ингибирования закрытия путей, сформированных микровыступами.
Пример 6
На бесшерстных морских свинках (HGP) были выполнены исследования, касающиеся осуществимости с помощью Macroflux пассивной внутрикожной доставки вакцины из плазмидной ДНК (pCMV-AYW-Hbs-Mkan), которая кодирует поверхностный антиген гепатита В [HbsAg]. Всем морским свинкам кожу одного бока вручную билатерально растягивали на время наложения системы. Наложение устройства со множеством микровыступов осуществляли с помощью ударного аппликатора. Накладываемая система включала пенопластовое двойное липкое кольцо (диаметр 2,5 см, толщина 0,08 см) с резервуаром площадью 1 см2 посередине.
Использовали одну из двух конфигураций устройства со множеством микровыступов. Описание двух множеств дано в таблице III. Каждая конфигурация имела общую площадь поверхности 2 см2, а активную общую площадь поверхности лезвий 1 см2.
Таблица III
Множество микровыступов выбранного типа приклеивали к липкому пенопласту и покрывали дно резервуара (после наложения множество микровыступов находится в контакте с кожей). После наложения силу растяжения ослабляли, а устройство со множеством микровыступов оставляли in situ. Жидкую композицию (90 мкл), содержавшую 3,5 мг/мл вакцины из плазмидной ДНК в буфере (TRIS 5 мМ, рН 7,6), помещали в резервуар для лекарственного средства и наносили подкладочную мембрану на липкую внешнюю поверхность кольца, чтобы герметизировать систему. Других HGP обрабатывали так же, за исключением того, что композиция содержала 1% Tween 80 или 3% тринатриевую соль лимонной кислоты, помимо плазмидной ДНК и буфера TRIS. Через 1 час после наложения по две системы из каждой группы удаляли, а оставшуюся композицию смывали с кожи. Количество лекарственного средства, которое проникло в кожу за указанное время, определяли с помощью биопсии задействованного участка кожи на полную толщину, диаметром 6 мм. Биоптаты растворяли в переваривающем буфере (додецилсульфат натрия/протеиназа К) и содержание относящейся с эксперименту ДНК оценивали с помощью полимеразной цепной реакции (PCR) с последующим электрофорезом продукта PCR. В эксперимент была включена группа положительного контроля, которая состояла из животных, получавших 10 мкг плазмидной ДНК посредством внутрикожной инъекции. Отрицательные контроли представляли собой животных, которым наносили на кожу плазмидную ДНК без использования устройства со множеством микровыступов. Результаты показали, что плазмидная ДНК может успешно доставляться с помощью устройств со множеством микровыступов путем пассивной доставки (ФИГ.7). Плазмидную ДНК не обнаруживали в коже в случаях, когда плазмидную ДНК наносили на кожу без использования устройства со множеством микровыступов (отрицательные контроли). Сравнение между группами показало, что наиболее эффективная композиция содержала тринатриевую соль лимонной кислоты. Через один час в присутствии тринатриевой соли лимонной кислоты доставлялось более чем в 10 раз больше плазмидной ДНК по сравнению с контрольной композицией. Достоверного усиления доставки плазмидной ДНК в композициях, содержавших Tween 80, не наблюдалось. При использовании лимонной кислоты применение устройства со множеством микровыступов 21-10А приводило к увеличению количества доставленной плазмидной ДНК в 2,5 раза по сравнению с устройством со множеством микровыступов 8-1А, что согласуется с большим количеством выступов в устройстве 21-10А.
Пример 7
Примеры 2-6 показывают, что лекарственные средства, представляющие интерес, могут усиливать свое движение с помощью совместной доставки ингибиторов закрытия путей. В частности, было показано, что соединения, обладающие свойствами антикоагулянтов, являются эффективными в отношении предотвращения закрытия путей. Если указанные соединения могут предотвращать спадение путей и, следовательно, продлевать время доставки молекул лекарственных средств, очевидно, что, если они доставляются в концентрациях, достаточно высоких, чтобы локально проявлять свою противосвертывающую активность, они будут продлевать и свою собственную доставку. Эксперименты по доставке с лекарственными средствами, обладающими свойствами антикоагулянтов, выполнялись на животных HGP c использованием PPS и фосфоротиолированного олигонуклеотида ISIS 2302. PPS представляет собой лекарственное средство, которое используется при лечении воспалительных состояний, таких как интерстициальный цистит, а фосфоротиолированный олигонуклеотид ISIS 2302 представляет собой десенсибилизирующее лекарственное средство по отношению к мРНК, кодирующей молекулу ICAM1, и обладает противовоспалительными свойствами. Обе молекулы имеют высокий отрицательный электрический заряд и не проникают через кожу в значительной степени, без использования усилителей проникновения или физического повреждения кожного барьера.
С использованием PPS в концентрации 300 мг/мл общая доза 6,5±1,1 мг была доставлена за 24 часа у HGP из системы площадью 2 см2 пассивной предварительной обработки, идентичной той, которая была описана в примере 3 (наложение выполнялось вручную, с использованием устройства со множеством микровыступов, имеющего площадь 2 см2 и включающего пластинку из нержавеющей стали толщиной 0,025 мм, лезвия трапециевидной формы, изогнутые под углом приблизительно 90° к плоскости пластинки; микровыступ имел длину 430 мкм и плотность расположения микровыступов 190 микровыступов/см2). Доза, экскретированная с мочой (2 мг), как было установлено, была более чем на 85% интактной. Это контрастирует с пероральным введением PPS, когда 300 мг суточная доза имеет биодоступность от 1 до 3% (от 3 до 9 мг всасывается). Помимо этого, после пероральной доставки менее 5% всосавшейся дозы было обнаружено интактной в моче, что указывает на то, что трансдермальное введение PPS с использованием устройства со множеством микровыступов эффективно обходит печень.
С PPS были выполнены дополнительные эксперименты с целью испытания альтернативных способов доставки. С PPS в концентрации 50 мг/мл была доставлена общая доза 1,9±0,1 за 4 часа посредством электротранспорта с током 100 мкА/см2 и с использованием устройства со множеством микровыступов, имеющего площадь 2 см2 и включающего пластинку из нержавеющей стали толщиной 0,025 мм, лезвия трапециевидной формы, изогнутые под углом приблизительно 90° к плоскости пластинки; микровыступы имели длину 480 мкм и плотность расположения микровыступов 241 микровыступ/см2. Для сравнения с тем же устройством со множеством микровыступов и той же концентрацией PPS общая доза из трансдермального устройства со множеством микровыступов с интегрированным резервуаром для лекарственного средства, с предварительной обработкой устройством со множеством микровыступов и последующим наложением резервуара для лекарственного средства составила 2,2±0,2 мг и 1,4±0,2 мг соответственно. В совокупности данные результаты показывают, что PPS можно эффективно доставлять через кожу в течение продолжительных периодов времени, возможно, благодаря его противосвертывающим свойствам.
Фосфоротиолированный олигонуклеотид ISIS 2302 доставляли в течение 24 часов с использованием устройства со множеством микровыступов, имеющего площадь 2 см2, длину микровыступов 480 мкм и плотность расположения микровыступов 241 микровыступ/см2. Оценивали эффект концентрации лекарственного средства, предварительной обработки устройством со множеством микровыступов, по сравнению с интегрированным воздействием и пассивной доставкой по сравнению с электротранспортом. Результаты, суммированные в таблице IV, показывают, что данное соединение может эффективно доставляться через кожу в течение продолжительных периодов времени, возможно, благодаря его противосвертывающим свойствам.
Трансдермальная доставка ISIS 2302
Общая доза доставки (мг)
Лекарственные средства, представляющие интерес, которые можно было бы доставлять в терапевтических уровнях с использованием технологии микровыступов, в течение продолжительных периодов времени (т.е. 24 часа), и без помощи вспомогательных веществ, которые предотвращают спадение путей, включают все соединения, обладающие противосвертывающими свойствами во время локальной доставки и имеющие молекулярную массу более приблизительно 2000. Указанные соединения включают пентозанполисульфат, олигонуклеотиды, низкомолекулярный гепарин, гирудин и аналоги гирудина, такие как гирулог.
Специалисты оценят тот факт, что настоящее изобретение можно осуществлять в других конкретных формах без отступления от его идеи или существенного характера. Представленные выше варианты осуществления настоящего изобретения, таким образом, во всех смыслах рассматриваются как иллюстративные, а не ограничивающие его. Объем настоящего изобретения, как указано скорее в прилагаемой формуле изобретения, чем в предшествующем описании, и все изменения, которые происходят в пределах его смысла и эквивалентности, также охватывается настоящим изобретением.
| название | год | авторы | номер документа |
|---|---|---|---|
| УСТРОЙСТВО ДЛЯ ТРАНСДЕРМАЛЬНОЙ ДОСТАВКИ ЛЕКАРСТВЕННЫХ СРЕДСТВ, ИМЕЮЩЕЕ МИКРОВЫСТУПЫ С ПОКРЫТИЕМ | 2001 |
|
RU2282468C2 |
| ЛЕКАРСТВЕННОЕ СРЕДСТВО И СИСТЕМА ДЛЯ ЧРЕСКОЖНОГО ВВЕДЕНИЯ ЛЕКАРСТВЕННОГО ВЕЩЕСТВА | 2005 |
|
RU2410130C2 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ ДЛЯ ТРАНСДЕРМАЛЬНОГО ПРИМЕНЕНИЯ | 1991 |
|
RU2107515C1 |
| СПОСОБ ТРАНСДЕРМАЛЬНОГО ВВЕДЕНИЯ ПОЛИПЕПТИДОВ В ОРГАНИЗМ | 2011 |
|
RU2462265C1 |
| Способ получения средства с трансдермальным проникновением | 1987 |
|
SU1836078A3 |
| ГИДРОФИЛЬНЫЕ БИОЛОГИЧЕСКИ СОВМЕСТИМЫЕ АДГЕЗИВНЫЕ КОМПОЗИЦИИ И ИХ ПРИМЕНЕНИЕ | 2006 |
|
RU2411045C2 |
| СПОСОБ ЛЕЧЕНИЯ АКНЕ УСТРОЙСТВОМ ДЛЯ ПРОКАЛЫВАНИЯ РОГОВОГО СЛОЯ | 2006 |
|
RU2414257C2 |
| МИКРОЭМУЛЬСИОННЫЕ КОМПОЗИЦИИ ДЛЯ СОЗДАНИЯ ТРАНСДЕРМАЛЬНЫХ И ТРАНСМУКОЗАЛЬНЫХ ФОРМ ФАРМАЦЕВТИЧЕСКИХ СРЕДСТВ И КОСМЕТИЧЕСКИХ ПРЕПАРАТОВ И СПОСОБ ИХ ПОЛУЧЕНИЯ | 2012 |
|
RU2481822C1 |
| ТРАНСДЕРМАЛЬНАЯ СИСТЕМА ДОСТАВКИ ДОНЕПЕЗИЛА | 2017 |
|
RU2779471C2 |
| МАССИВЫ МИКРОИГЛ И СПОСОБЫ ИХ ПОЛУЧЕНИЯ И ИСПОЛЬЗОВАНИЯ | 2017 |
|
RU2750904C2 |

Изобретение относится к медицине и касается способа ингибирования уменьшения трансдермального движения агента, который доставляется через кожу или образец которого отбирается через кожу, в течение длительного времени, при котором доставка агента или отбор его образцов сопровождается нарушением целостности по меньшей мере слоя кожи stratum corneum с формированием путей, через которые проходит агент. Осуществление способа достигается посредством использования при доставке или отборе агента (первого агента) определенного количества по меньшей мере одного агента, препятствующего заживлению. Используют такое количество агента, препятствующего заживлению, которое эффективно в отношении ингибирования уменьшения трансдермального движения первого агента, по сравнению с движением первого агента при практически идентичных условиях, за исключением отсутствия указанного по меньшей мере одного агента, препятствующего заживлению. Предлагаются также устройство для осуществления способа и набор для наложения устройства. 3 н. и 45 з.п. ф-лы, 4 табл., 8 ил.
формирование повреждений по меньшей мере в слое кожи stratum corneum, для образования множества путей, при котором повреждения кожи представляют собой микроразрезы, вызванные одним или более прокалывающих stratum corneum микровыступов;
вызывание движения первого агента и по меньшей мере одного агента, препятствующего заживлению, через указанные пути; при котором количество указанного агента, препятствующего заживлению, который двигается через указанные пути, является эффективным для ингибирования уменьшения трансдермального движения указанного первого агента, по сравнению с движением указанного первого агента при практически идентичных условиях, за исключением отсутствия указанного по меньшей мере одного агента, препятствующего заживлению.
| WO 9748440 A1, 24.12.1997 | |||
| Малая медицинская энциклопедия | |||
| Очаг для массовой варки пищи, выпечки хлеба и кипячения воды | 1921 |
|
SU4A1 |
| Под ред | |||
| акад | |||
| РАМН В.И.Покровского | |||
| - М.: Медицина, 1996, с.373 «Пиявка медицинская» | |||
| WO 9703718 A1, 06.02.1997 | |||
| US 5879326 A1, 09.03.1999 | |||
| Гирудотерапия и гирудофармакотерапия | |||
| Под ред | |||
| акад | |||
| Никонова Г.И | |||
| - М., 1996, с.82 | |||
| ТРАНСДЕРМАЛЬНАЯ КОМПОЗИЦИЯ ДЛЯ МЕСТНОГО ВВЕДЕНИЯ ТЕРАПЕВТИЧЕСКИ И/ИЛИ ПРОФИЛАКТИЧЕСКИ АКТИВНОГО АГЕНТА, ЛЕНТА ИЛИ ПОВЯЗКИ ДЛЯ ТРАНСДЕРМАЛЬНОЙ ДОСТАВКИ | 1992 |
|
RU2117490C1 |
Авторы
Даты
2006-03-27—Публикация
2001-09-06—Подача