Изобретение относится к медицине, конкретно к клинической фармакологии, и может быть использовано для лечения ишемического повреждения мозга.
Известны препараты, улучшающие кровоснабжение мозга (кавинтон, папаверин, эуфиллин и др.), но они недостаточно эффективны при ишемии; их лечебное действие обусловлено, главным образом, расширением мозговых сосудов. Кроме того, кавинтон - наиболее популярный избирательный церебральный вазодилататор у больных с цереброваскулярными расстройствами активирует гликолиз в мозговой ткани [2]. Вместе с тем известно, что сама ишемия органа приводит к резкому дефициту не только кровоснабжения, но и трофики ткани - накопление окисленных продуктов обмена веществ преимущественно молочной кислоты, что в свою очередь инактивирует ферменты и приводит к дальнейшим расстройствам обмена веществ.
Известно лечебное применение янтарнокислого аммония в качестве противосудорожного средства в конце прошлого века. Однако в последующие годы и в настоящее время ЯА в медицине в качестве лечебного препарата не применяется, хотя было предложено использование ЯА в эксперименте для оптимизации энергетического обмена у старых животных [1]. По неопубликованным данным Института биофизики РАН (М.Н. Кондрашова и соавт.) ЯА повышает работоспособность экспериментальных животных, увеличивая продолжительность бега на горизонтальном третбане с фиксированной скоростью движения ленты. Противоишемические свойства ЯА в литературе не описаны.
Целью изобретения является повышение эффективности лечения больных с ишемией мозга.
Поставленная цель достигается применением ЯА в качестве корректора нарушений кровоснабжения и метаболизма мозга при церебральной ишемии.
Авторы впервые установили экспериментально заявляемые свойства ЯА.
1. Оценку эффективности янтарнокислого аммония в сравнении с янтарной кислотой и кавинтоном (препарат с избирательным влиянием на мозговое кровообращение) проводили в условиях профилактического и лечебного введения препаратов на модели циркуляторной ишемии мозга крыс (перевязка двух общих сонных артерий).
Эксперименты выполнены на крысах-самцах линии Вистар. Профилактическое введение внутрь исследуемых препаратов производили ежедневно в течение 7 дней. Последнее введение производили за 1 ч до создания ишемии. С лечебной целью препараты вводили внутрь однократно через час после создания ишемии. Защитное действие оценивали по степени выраженности судорог и выживаемости животных через 24 ч после перевязки артерий.
В контрольной группе к 4-му часу ишемии у большинства животных развивались генерализованные судороги, в течение первых суток гибель крыс составляла 75-80% (табл. 1). ЯА при курсовом профилактическом введении в дозе 50 мг/кг повысил число выживших животных в 3 раза по сравнению с контролем. Сходный эффект получен при введении кавинтона. Профилактическое введение янтарной кислоты не оказывало защитного действия.
При лечебном применении исследуемых соединений наилучший эффект получен при введении янтарнокислого аммония в дозе 100 мг/кг: к концу первых суток ишемии выживаемость крыс по сравнению с контрольной группой возросла в 2 раза. Как профилактическое, так и лечебное введение янтарнокислого аммония и янтарной кислоты сопровождалось снижением интенсивности судорожных приступов и значительно уменьшало их продолжительность. Кавинтон, напротив, повышал судорожную активность животных при обеих схемах введения.
Таким образом, на модели острой ишемии головного мозга крыс ЯА существенно превосходит эффект кавинтона, особенно при лечебном введении.
2. Влияние янтарнокислого аммония на общий мозговой кровоток, кислородное снабжение мозга и системное артериальное давление в условиях острой транзитной ишемии мозга исследовали на крысах линии Вистар. Объемную скорость мозгового кровотока (ОМК) регистрировали методом водородного клиренса с помощью торцевого платинового электрода, который имплантировали в область сагитального синуса. 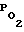 в ткани мозга регистрировали полярографически с электродов, расположенных в области теменной коры. Регистрацию системного артериального давления (САД) осуществляли датчики от физиологического комплекса "Салют". Острую транзиторную ишемию мозга вызывали окклюзией обеих сонных артерий в течение 120 мин с последующей рециркуляцией. Янтарнокислый аммоний в дозе 50 мг/кг с профилактической целью вводили за 30 мин до создания ишемии, с лечебной - на 30-й минуте ишемии мозга.
в ткани мозга регистрировали полярографически с электродов, расположенных в области теменной коры. Регистрацию системного артериального давления (САД) осуществляли датчики от физиологического комплекса "Салют". Острую транзиторную ишемию мозга вызывали окклюзией обеих сонных артерий в течение 120 мин с последующей рециркуляцией. Янтарнокислый аммоний в дозе 50 мг/кг с профилактической целью вводили за 30 мин до создания ишемии, с лечебной - на 30-й минуте ишемии мозга.
В контрольной группе животных 2-х часовая окклюзия общих сонных артерий сопровождалась снижением относительно исходного фона 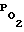 в коре до 40% и ОМК более чем на 50%. В постишемическом периоде развивалось состояние постишемической гипоперфузии и гипооксигенации мозга (табл. 2, 3), что свидетельствует о гипоксии мозговой ткани.
в коре до 40% и ОМК более чем на 50%. В постишемическом периоде развивалось состояние постишемической гипоперфузии и гипооксигенации мозга (табл. 2, 3), что свидетельствует о гипоксии мозговой ткани.
Профилактическое введение ЯА за 30 мин до создания ишемии приводило к статически достоверному снижению 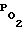 , САД (табл. 2, 3) и уменьшению ОМК на 1-5 минутах (табл. 3). Во время ишемии не было отмечено достоверных различий исследуемых показателей в опытной и контрольной группах. Однако в постишемическом периоде наблюдалось хорошо выраженное статически достоверное предупреждение ЯА гипооксигенации и гипоперфузии мозга (табл. 2, 3).
, САД (табл. 2, 3) и уменьшению ОМК на 1-5 минутах (табл. 3). Во время ишемии не было отмечено достоверных различий исследуемых показателей в опытной и контрольной группах. Однако в постишемическом периоде наблюдалось хорошо выраженное статически достоверное предупреждение ЯА гипооксигенации и гипоперфузии мозга (табл. 2, 3).
Лечебное введение ЯА, также как и профилактическое, не приводило к существенному облегчению ишемического периода, но способствовало восстановлению кровотока и кислородного снабжения мозга в реперфузионный период (табл. 2, 3).
Таким образом, ЯА при его профилактическом и лечебном введении предупреждает развитие постишемической гипоперфузии и гипооксигенации мозга, что указывает на антигипоксические свойства препарата. По нашим данным последний эффект частично зависит от ослабления препаратом сродства гемоглобина к O2 за счет повышения содержания в эритроцитах 2,3-дифосфоглицерата - основного метаболита, определяющего аффинитет гемоглобина к кислороду.
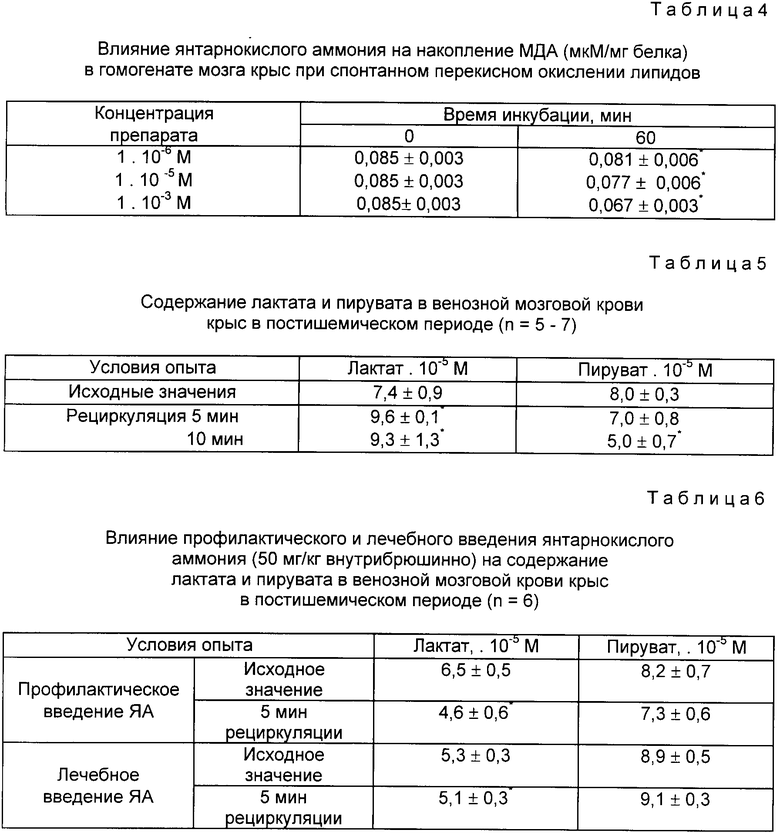
3. Влияние янтарнокислого аммония на перекисное окисление липидов исследовали в опытах in vitro по накоплению вторичного продукта перекисного окисления липидов (ПОЛ) - малонового альдегида (МДА) в ткани мозга. Инкубацию гомогената проводили в течение 1 ч при 37oC и постоянном встряхивании.
Как видно из табл. 4, ЯА в конечной концентрации 1•10-6, 1•10-5 и 1•10-3 М ограничивает накопление МДА в гомогенате мозга крыс при спонтанном перекисном окислении липидов, проявляя антиоксидантное действие.
4. Влияние янтарнокислого аммония на содержание лактата и пирувата в венозной мозговой крови при ишемии мозга исследовали в опытах на наркотизированных беспородных крысах. Циркулярную гипоксию мозга создавали перевязкой обеих сонных артерий на 60 мин с последующей рециркуляцией. Кровь, оттекающую от мозга, забирали из венозного синуса после трепанации черепа. В крови определяли содержание лактата и пирувата. Янтарнокислый аммоний (50 мг/кг внутрибрюшинно) инъецировали при профилактическом введении за 30 мин до перевязки сонных артерий, при лечебном - на 30-й минуте ишемии. Изменения содержания метаболитов под влиянием ЯА исследовали на 5-й минуте рециркуляции.
Установлено, что во время ишемии лактацидемия не наблюдалась, а через 5 мин после рециркуляции содержание лактата в крови повышалось, значимых изменений в содержании пирувата не отмечено. На 15-й мин рециркуляции содержание лактата оставалось на повышенном уровне по сравнению с исходными значениями, содержание пирувата снижалось (табл. 5). Следовательно, в условиях нашего эксперимента лактацидоз в оттекающей от мозга крови крыс не возникал во время ишемии, но наступал в период рециркуляции. Это послужило основанием оценить влияние янтарнокислого аммония на содержание лактата и пирувата в крови в постишемическом периоде.
Профилактическое введение ЯА сопровождалось снижением содержания лактата в мозговой крови по сравнению с исходным уровнем, статистически значимых изменений в содержании пирувата не отмечено (табл. 6).
При лечебном введении ЯА (на 30 минуте ишемии) содержание лактата в оттекающей от мозга крови умеренно снижалось по сравнению с исходными значениями, содержание пирувата не изменялось (табл. 6).
Следовательно, янтарнокислый аммоний обладает антиацидотическим действием, которое в большей степени проявляется при профилактическом введении препарата.
5. Влияние янтарнокислого аммония на мозговой кровоток в условиях хронической ишемии изучено на крысах-самцах линии Вистер. Спустя 7 суток после вживления электродов в области правой и левой теменной коры под легким эфирным наркозом создавали ишемию головного мозга путем полной перевязки левой сонной артерии и ограничения кровотока по правой сонной артерии до 50% от исходного уровня (под контролем расходомера крови MFV-1100). Локальный мозговой кровоток регистрировали методом водородного клиренса с электрохимической генерацией водорода. ЯА (50 мг/кг, перорально) вводили за час до регистрации локального мозгового кровотока (ЛМК), начиная с момента создания ишемии, ежедневно в течение 10 дней.
У бодрствующих крыс контрольной группы максимальное снижение уровня ЛМК было зарегистрировано на 4-5 сутки после создания ишемии головного мозга (табл. 7). В дальнейшем наблюдалась тенденция к восстановлению мозгового кровотока, eровень которого, однако, оставался сниженным и к 10 сут наблюдения за животными.
В группе животных, получавших ЯА, изменения ЛМК были более умеренными. Начальное, менее резкое по сравнению с контролем падение ЛМК в первые сутки в дальнейшем не углублялось, сменялось отчетливой тенденцией к восстановлению (табл. 7). На 10 сутки после создания ишемии головного мозга ЛМК у этой группы животных восстанавливался практически полностью.
Таким образом, курсовое введение ЯА способствует восстановлению кровоснабжения мозга в условиях его хронической ишемии.
6. Влияние янтарнокислого аммония на энергетический обмен головного мозга при церебральной ишемии исследовано на крысах-самцах линии Вистар. Неполную генерализованную ишемию мозга моделировали перевязкой у крыс под эфирным наркозом на 3,5 ч обеих сонных артерий. Контролем служила группа ложнооперированных животных. Препарат вводили животным внутрибрюшинно за 1 ч до перевязки сонных артерий в дозе 50 мг/к.
Митохондрии (МХ) мозга выделяли методом дифференциального центрифугирования с использованием разработанных нами приемов, позволяющих хорошо сохранить нативное состояние органелл (Кондрашова М.П. и соавт., 1987).
Энергетический обмен головного мозга крыс при развитии циркуляторной ишемии, вызванной перевязкой обеих сонных артерий, начиная с 3,5 ч ишемии, характеризуется, как нами показано ранее, угнетением сукцинат-зависимого дыхания МХ головного мозга вследствие развития ингибирования сукцинатдегидрогеназы оксалоацетатом, сопровождающимся при углублении патологии разобщением окислительного фосфорилирования.
Введение крысам ЯА препятствовало развитию истощения сукцинат-зависимого звена энергопродукции головного мозга. В частности, не развивалось отмеченное к 3,5 ч ишемии снижение скорости контролируемого (v4п) и фосфорилирующего (v3) дыхания; показатель v3 даже превышал таковой в контрольной группе ложнооперированных животных. Соответственно выше, чем в группе контрольных и ишемизированных животных, возрастали показатели диапазона дыхательной активности МХ (v3-v4п; v3-v4o). В соответствии с величинами скоростей дыхания изменялось и время фосфорилирования добавленной АДФ - препарат не только ограничивал его увеличение при ишемии, но и снижал ниже чем в контрольной группе животных.
Таким образом, янтарнокислый аммоний оказывает выраженное влияние на энергетический обмен головного мозга крыс при церебральной ишемии, препятствуя развитию ингибирования сукцинат-зависимой энергопродукции МХ.
Результаты проведенных экспериментов показывают, что ЯА на модели острой ишемии мозга обладает более выраженным защитным действием по сравнению с кавинтоном. Противоишемический эффект ЯА обусловлен: увеличением кровоснабжения мозга, антигипоксическим и антиацидотическим действием; препарат нормализует сукцинат-зависимую энергопродукцию митохондрий мозга.
| название | год | авторы | номер документа |
|---|---|---|---|
| ПРОТИВОВОСПАЛИТЕЛЬНОЕ СРЕДСТВО | 1994 |
|
RU2118161C1 |
| ПРОИЗВОДНЫЕ β- ГИДРОКСИЭТИЛАМИНИЙНИКОТИНАТА, ПРОЯВЛЯЮЩИЕ ПРОТИВОИШЕМИЧЕСКУЮ АКТИВНОСТЬ | 1993 |
|
RU2124502C1 |
| СПОСОБ МОДЕЛИРОВАНИЯ ИШЕМИИ ГОЛОВНОГО МОЗГА С ЯВЛЕНИЯМИ МЕЖПОЛУШАРНОЙ АСИММЕТРИИ | 1993 |
|
RU2083000C1 |
| Магния бис-(2-аминоэтансульфокислоты)-бутандиоат, обладающий антигипоксической, нейропротекторной и гипокоагуляционной активностью | 2017 |
|
RU2671982C1 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, ПРЕДНАЗНАЧЕННАЯ ДЛЯ ЛЕЧЕНИЯ ЗАБОЛЕВАНИЙ ЦЕНТРАЛЬНОЙ И ПЕРИФЕРИЧЕСКОЙ НЕРВНОЙ СИСТЕМЫ СОСУДИСТОГО, ТРАВМАТИЧЕСКОГО, ТОКСИЧЕСКОГО, ГИПОКСИЧЕСКОГО И АУТОИММУННОГО ГЕНЕЗА | 2010 |
|
RU2445106C1 |
| ЛЕКАРСТВЕННАЯ КОМПОЗИЦИЯ | 2001 |
|
RU2213562C2 |
| СРЕДСТВО ДЛЯ ЛЕЧЕНИЯ СЕРДЕЧНО-СОСУДИСТЫХ ЗАБОЛЕВАНИЙ | 2014 |
|
RU2555335C9 |
| СРЕДСТВО ДЛЯ ЛЕЧЕНИЯ НАРУШЕНИЙ МОЗГОВОГО КРОВООБРАЩЕНИЯ И ТРАВМ ГОЛОВНОГО МОЗГА | 2012 |
|
RU2554502C9 |
| ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ, СОДЕРЖАЩИЕ S-АМЛОДИПИНА НИКОТИНАТ И ИХ ПРИМЕНЕНИЕ В ЛЕЧЕНИИ ЦЕРЕБРОВАСКУЛЯРНЫХ НАРУШЕНИЙ | 2012 |
|
RU2516922C2 |
| 2-ЭТИЛ-6-МЕТИЛ-3-ГИДРОКСИПИРИДИНИЙГИДРОКСИБУТАНДИОАТ, ОБЛАДАЮЩИЙ ПРОТИВОИШЕМИЧЕСКОЙ, ЦЕРЕБРОПРОТЕКТОРНОЙ, НЕЙРОТРОПНОЙ И ЛИПИДРЕГУЛИРУЕМОЙ АКТИВНОСТЯМИ, ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ И ЛЕКАРСТВЕННОЕ СРЕДСТВО | 2008 |
|
RU2377237C1 |


Изобретение относится к клинической фармакологии и может быть использовано для лечения ишемического повреждения мозга. С целью повышения эффективности лечения больных с ишемией мозга предлагается использовать известное вещество янтарнокислый аммоний по новому назначению - в качестве корректора нарушений кровоснабжения и метаболизма мозга. Противоишемический эффект янтарнокислого аммония обусловлен увеличением кровоснабжения мозга, антигипоксическим и антиацидотическим действием; препарат нормализует сукцинат-зависимую энергопродукцию митохондрий мозга. 7 табл.
Применение янтарнокислого аммония в качестве корректора нарушений кровоснабжения и метаболизма мозга при центральной ишемии.
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| SU, авторское свидетельство, 1090405, кл | |||
| Устройство для сортировки каменного угля | 1921 |
|
SU61A1 |
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| Машковский М.Д | |||
| Лекарственные средства | |||
| -М.: Медицина, 1993, изд.12, ч.1, с.505. | |||
Авторы
Даты
1998-04-10—Публикация
1994-11-22—Подача