По изобретению новые полипептиды являются высокоэффективными активаторами плазминогена и поэтому с большим успехом могут применяться в качестве тромболитических средств.
Активаторы плазминогена играют важную роль при лечении обусловленных фибрином закупорок сосудов, например, при инфаркте миокарда, эмболии легочной артерии и т.п.
Приблизительно с начала 50-х годов известно, что в моче человека содержится по меньшей мере один протеолитический фермент, который способствует превращению плазминогена в плазмин, т.е. в фермент, который вызывает расщепление фибрина в растворимые полипептиды и соответственно растворение обусловленных фибрином закупорок. Этот активатор плазминогена был назван урокиназой, которая как выяснилось позднее существует в виде различных форм, в том числе и в форме предшественника известного приблизительно с середины 70-х годов зимогена проурокиназы, он имеет одноцепочечную структуру и называется также scu-PA (активатор плазминогена типа урокиназы с одноцепной структурой). Проурокиназа scu-PA состоит из 411 аминокислот и в природе гликолизируется по аминокислотному остатку в положении 302. Молекулярный вес (Mr) scu-PA указан в литературе как приблизительно 54.000 дальтон.
В 1977 Nolan и др. (Biochim, biophys. Acta, 496, 384-400) установили наличие в культурах клеток человека профермента урокинаты, молекулярный вес которого соответствовал молекулярному весу известной низкомолекулярной формы урокиназы (31.500 дальтон), а позднее Wijngaards и др. (Thrombosis Res., 42, (1986), 749-760) и Pijken и др. (Thrombosis Res., 42, (1986), 761-768) сообщили о наличии в культурах клеток обезьян проурокиназы размером 30 килодальтон, ее очистке и фибринолитических свойствах. В 1986г. Stump и др. сообщили (J. Biol. Chem., 261, 17120-17126), что в надосадочных жидкостях клеточной линии опухоли человека CALU-3 (АТСС, НТВ 55) содержится одноцепочечная проурокиназа, которая имеет молекулярный вес (Mr) около 32.000 дальтон и для отличия от высокомолекулярной проурокиназы ("scu-PA 54k") была обозначена "scu-PA 32k"/ Форма scu-PA 32k соответствует scu-PA 54k без 143 N - концевых аминокислот (от Ser1 до Glu143) и гликозилируется в том же положении.
В опубликованной под N 247674 Al европейской заявке на патент описывают получение scu-PA 32k из питательной среды клеточной линии CALU-3 (АТСС, НТВ 55) и из питательной среды трансфектированных плазмидами pSVscu-PA-32k и pSV5DHFR CHO - клеток (клеток яичника китайского хомячка). Там же упоминается, но не раскрывается возможность получения scu-PA 32k с использованием генетически измененных микроорганизмов.
В европейской заявке на патент 92182 A2 (1983, C 12 N 15/00) описано получение кодирующей низкомолекулярную урокиназу (с мол. вес. около 33.000 дальтон) ДНК и соответствующих плазмид, а также их экспрессию в E.coli K12 294 (АТСС, 31446) с образованием негликозилированного протеина с молекулярным весом около 33.000 дальтон и с указанной там последовательностью аминокислот, которая соответствует области 133 - 411 аминокислотного остатка scu-PA 54k.
О некоторых свойствах негликозилированного продукта, который включает аминокислоты 136-411, сообщали в 1987г. Gunz-lev и др. (Thrombosis and Haemostasis, 58 (1987), 216)
Полипептиды с активностью проурокиназы scu-PA 32k, которые содержат дополнительную по отношению к нативной форме область последовательности 136 - 143 остатка или ее фрагменты и в которых в случае необходимости (в зависимости от природы N - конца) аминокислота в положении 156 (Arg) изменена, их получение путем экспрессии соответствующих плазмид в E.coli K12 JM105 и последующего преобразования первично формирующихся внутриклеточных телец включения, описаны в опубликованном европейском патенте 312941 A2.
Изобретение относится к новым применяемым в терапии в качестве активаторов плазминогена полипептидам следующей общей формулы (соответствуют структурной схеме на фиг. 1):
Ser-X1-X2-rscu-PA143-411
где rscu-РА143-411 означает негликозилированную область последовательности аминокислот от 143 (Glu) до 411 (LeuOH) остатка scu-PA 54k, X1 - Acn, Pro или Ser и
X2 - или простая связь, или Glu или Pro-Glu или Pro-Pro-Glu или Glu-Leu-His-Leu-Leu-Gln-Val-Pro-Ser-Asn.
Предпочтительно X1 представляет Asn или Ser, особенно предпочтительно Ser. X2 предпочтительно обозначает или простую связь, или Glu, или Pro-Glu или Pro-Pro-Glu.
В предпочтительном варианте полипептид имеет формулу
Ser-Ser-Pro-Pro-Glu-rscu-PA143-411 (Iа)
где
rscu-PA143-411 имеет такое же значение, как указано выше.
Новые соединения формулы I показывают ярко выраженную специфичность относительно лизиса фибринозных сгустков, т. е. активируют плазминоген в присутствии фибрина, но не превращают или слабо превращают циркулирующий плазминоген в плазмин. Таким образом достигается то, что фибринозные сгустки растворяются, в то время как нежелательное в терапии разрушение факторов свертывания крови и других протеинов благодаря плазмину происходит не в такой степени, как при использовании неспецифических активаторов плазминогена. Новые полипептиды формулы I, в противоположность scu-PA 54k или его негликозилированной протеиновой части ("Заруплазе"), отличается повышенной приблизительно в 1,7 раза специфической амидолитической активностью (измеренной при помощи хромогенного субстрата пироGlu-Gly-Arg-p-нитроанилида после превращения в двухцепочечные активаторы плазминогена в присутствии плазмина). Если измеряют непосредственно фибринолитическую активность на фибринагаровой пластинке, новые соединения формулы I по сравнению с scu-PA 54k показывают повышенную в 2,5-3 раза эффективность (площадь зоны лизиса в мм2 на мг). Кроме того, новые полипептиды формулы I в противоположность scu-PA 54k или Заруплазе не могут связываться специфически связывающими клеточными рецепторами урокиназы и дезактивироваться. Таким образом, они более продолжительное время находятся в циркуляции, оказывая свое терапевтическое действие.
Благодаря более сильному по сравнению с обычными фибринолитическими средствами специфическому фибринолитическому действию и благодаря лучшей возможности биосинтеза на месте действия достигают более надежной лизистерапии при более низких дозах и с меньшими побочными действиями, выражающимися в кровотечениях.
Для эффективного и надежного тромболиза при закупорках артериальных сосудов, особенно при инфарктах миокарда, терапевтически эффективная разовая доза для взрослого пациента составляет приблизительно до 15 мг соединения формулы I. Для сравнения можно привести, например, данные из работы Bode и др. (Am. J. Cordiol. 61, (1988), 971-973), согласно которым при помощи 74 мг гликозилированного scu-PA 54k достигался успешный тромболиз только в 55% случаев, причем действие столь высоких доз было по существу неспецифичным и могло сопровождаться по данным многих исследователей, вредным побочным влиянием на гемостатическую систему.
Новые ценные соединения формулы I получают рекомбинантной ДНК-технологией. Для этого были созданы новые плазмиды настоящего изобретения, экспрессия которых в подходящих бактериальных хозяевах и последующее протеинхимическое превращение получаемого с высокими выходами неактивного продукта дает новые соединения формулы I.
Как в большинстве случаев экспрессии эвкариотических протеинов в бактериях, полипептидные цепи соединений формулы I образуют в хозяйской клетке в форме так называемых "тел включения", которые обозначаются здесь также как "белок-предшественник". После промежуточного выделения этот первичный продукт протеинхимическим путем должен быть возвращен к правильной третичной структуре требуемого продукта. Полученное таким путем соединение формулы I можно затем переводить (например, добавкой плазмина) в соответствующее двухцепочечное негликозилированное низкомолекулярное производное урокиназы, ферментативная активность которого может служить мерой для образованного количества соединения формулы I. Определить "выход" белка-предшественника или соединения формулы I и тем самым эффективность экспрессии можно например при помощи денситометрической оценки электрофоретического разделения в геле.
Плазмиды по изобретению в предпочтительном варианте отличаются тем, что их оперон имеет регулируемый в данном случае синтетический промотор, действующий как место связывания рибосом Shine-Dalgarno-последовательность, стартовый кодон, синтетический структурный ген, кодирующий соединение формулы I, и следующий за ним терминатор. Наиболее предпочтительно включение двух следующих друг за другом терминаторов, в частности trp A и/или otet A/orf α -из Nh10 (cp. Schollmeier и др. Nucl. Acids Res., 13, (1986), 4227-4237). В качестве регулируемого промотора, в частности, может быть использован Trp-промотор или Tac-промотор.
У плазмид по изобретению расстояние между Shine-Dalgarno-последовательностью и стартовым кодоном составляет обычно 6-12, предпочтительно 8-10 нуклеотидов.
При конструировании вводимого в плазмиды по изобретению структурного гена в него встраивают триплеты предпочтительного кодирования соответствующих аминокислот, приведенные ниже (при этом в структурном гене указанные кодоны не должны быть представлены одновременно для всех аминокислот).
Аминокислота - Кодон
Аргинин - CGT
Лейцин - CTG
Валин - GTT
Глицин - GGT
С другой стороны, при построении структурного гена целесообразно, по возможности, избегать применения следующих (см. ниже) кодонов для соответствующих им аминокислот (при этом снова эти кодоны не должны быть введены одновременно для всех аминокислот).
Аминокислота - Кодон
Изолейцин - ATA
Валин - GTC
Пролин - CCC
Лизин - AAG
Аргинин - AGG, ACA, CGG, CGA
Глицин - GGA, GGG
Благодаря этому выбору кодонов для отдельных аминокислот в структурном гене и благодаря указанным выше признакам контролирующей области в значительной степени предотвращается образование стабильных вторичных структур между структурным геном и регуляторной областью.
Для получения кодирующих соединения формулы I синтетических структурных генов прежде всего синтезируют одноцепочечные олигонуклеотидные отрезки размером 40-80 оснований. Целесообразно получить их в количестве 1 мкмоль по методу неподвижной фазы Adams и др. J. Am. Chem. Soc., 105, (1983), 661-663, при помощи синтезатора ДНК (Mode 11 Biosearch 8600 фирмы New Brunswick Scientifc Co).
Из групп по 4-9 этих олигонуклеотидных цепей получают затем двунитевые фрагменты длиной приблизительно 200 нуклеотидов, образованные фрагменты вставляют затем в подходящие линеаризированные носители. Дальнейший принцип действия вытекает из приведенных далее примеров.
Использованные в данной заявке сокращения имеют следующие значения:
bp: пары оснований;
DE 52: анионообменник фирмы Whatman;
EDTA: этилендиаминтетрауксусная кислота;
IPTG: изопропил- β -D-тиогалактопиранозид;
PA: активатор плазминогена;
PAGE: полиакриламидгельэлектрофорез;
PU: Ploug units;
SDS: додецилсульфат натрия;
S.D. - Sequenz: Shine-Dalgarno-последовательность;
Tris-HCl: трисгидроксиметиламинометан-гидрохлорид;
Tween-80: полиэтиленоксид (20) сорбитанмоноолеат;
TMAC: тетраметиламмонийхлорид.
Для конструирования плазмид по изобретению преимущественно используют коммерческую плазмиду pBR 322 (4363 Bp.). Предпочтительно из нее удаляют nic/bom-область и/или ген резистентности к тетрациклину. При этом полного удаления названного гена не требуется. Достаточно, если это осуществляется в такой степени, что плазмида больше не придает резистентности к тетрациклину трансформированным с ее мощностью штаммам бактерий. Благодаря этим мерам (удаление nic/bom-области и по меньшей мере части гена резистентности к тетрациклину получают так называемую "высокобезопасную плазмиду".
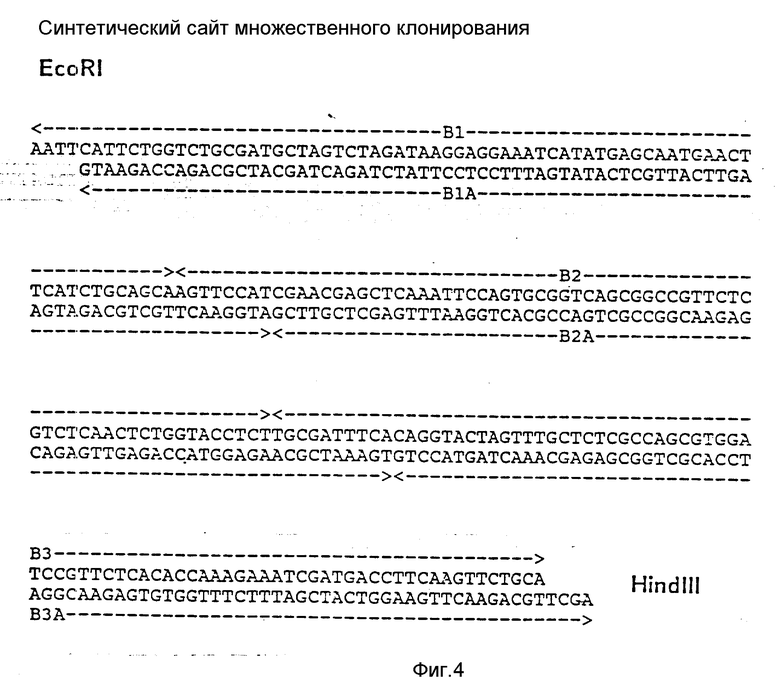
Предпочтительная стратегия для конструирования плазмид по изобретению на основе модифицированной плазмиды pBR 322 (или другой из названных ниже известных плазмид) предусматривает в качестве следующей операции введение синтетического сайта множественного клонирования между сайтами расщепления EcoRI и Hind III (фиг. 4). Места расщепления выбирают произвольно за исключением последовательности между Xba I и Nde I, которая содержит участок связывания с рибосомой (Shine-Dalgarno-последовательность) из Xyl оперона 5'-AAGGAG-3' B. Subtilis, (Wilhelm и др. Nucl. Res., 13, (1985), 5717-5722) и необходимое расстояние между S.D. - последовательностью и стартовым кодоном ATG. Следующие за S.D. - последовательностью основания GAAAT связаны с Nde l-сайтами CATATG. Таким образом, расстояние между S.D. - последовательностью и ATG составляет 8 пар оснований. Расстояния между отдельными сайтами расщепления участка множественного клонирования должны были иметь длину по меньшей мере около 20 нуклеотидов, в результате чего облегчается удаление промежуточных фрагментов.
При помощи участка множественного клонирования в плазмиду вводят сайты, которые целесообразно далее использовать для введения отдельных последовательностей структурного гена, кодирующего соединение формулы I, предпочтительно, начиная от C-конца протеина, т.е. от 3'-конца ДНК-цепочки получаемого структурного гена, а также для встройки, например, синтетического или выделенного из другой плазмиды, или коммерческого Trp- или Tac-промотора.
Аналогичным образом можно в качестве базовой плазмиды использовать и другие известные формы, которые имеют уникальные Eco R1- и Hind III-сайты, как например, pUC 9, pUC 12, pUC 13, pUC 18, pUC 19 и другие.
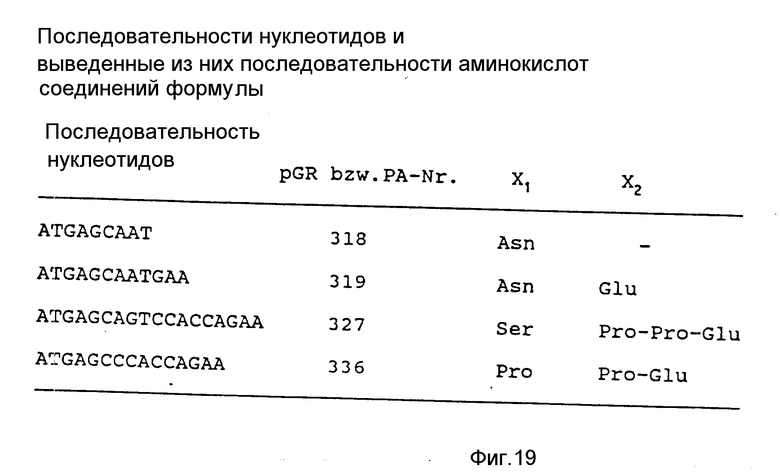
В частности, получают плазмиду pGR Tac 06 (пример 1 и фиг. 15). Эта плазмида кодирует соединение формулы I, в которой X1 представляет ASn, а X2 обозначает последовательность Glu-Leu-His-Leu-Leu-Gln-Val-Pro-Ser-Asn- (фиг. 16).
Это соединение обозначается ниже как "PA/06".
Эту последовательность кодируют от нуклеотидов между Nde 1 и Xba 1, для которых были выбраны произвольно кодоны для N-конечных аминокислот scu- PA 54k. Эту последовательность аминокислот прерывают от Leu-Leu для Pst 1 места среза.
Экспрессированный, например, в E.coli-протеин PA/06 после повторной укладки цепи показывает неожиданно высокую фибринолитическую активность в пробе на фибрин-агаровой пластинке.
Если в плазмиде pGR Tac 06 заменяют Tac-промотор между сайтами Eco R1 и Xba 1 синтетическим Trp-промотором (фиг. 17), то получают плазмиду pGR Trp 06.
Трансформированные при помощи pGR Trp 06 клетки E.coli K12 JM 103 (ATCC 39 403) после индукции индолакриловой кислотой также продуцируют протеин, который после лизиса клеток и ренатурации телец-включения проявляет фибринолитическую активность в пробе на фибрин-агаровой пластинке.
Другие плазмиды по изобретению можно получать из описанных выше в результате извлечения Eco R1 и Hind III-вставки с синтетическим структурным геном и всеми единицами регуляции и встраивания ее затем в другую, особенно способную к автономному размножению в E.coli, плазмиду, предварительно расщепленную Eco R1 и Hind III. В принципе, таким же образом, но при использовании рестрикции Eco R1 и Xba 1, можно также заменять Trp-промотор на Tac-промотор (и наоборот) в одной из плазмид по изобретению.
Плазмиды по изобретению с удлиненным расстоянием между Shine-Dalgaruo-последовательностью и стартовым кодоном ATG можно получать в результате того, что сконструированную как описано выше плазмиду, в которой упомянутое расстояние составляет, например, 8 нуклеотидов, разрезают Nde 1, наращивают последовательность и затем лигируют образующиеся новые концы с образованием плазмиды по изобретению, в которой расстояние между S.D.-последовательностью и стартовым кодоном составляет, например, 10 нуклеотидов.
При конструировании структурных генов, которые кодируют соединения формулы I, предпочитают такие последовательности нуклеотидов, которые в 5'-положении несут кодон для метионина, сопровождаемый кодоном для серина. При экспрессии этого структурного гена получают вследствие неустойчивости связи Met-Ser соответствующее соединение формулы I с серином в качестве N-концевой аминокислоты. Подходящие 5'-концы структурных генов для соединений формулы I следующие:
(Met) Ser Asn-
ATG, AGC AAT
(Met) Ser Asn Glu-
ATG, AGC AAT GAA
(Met) Ser Pro Pro Glu-
ATG, AGC CCA CCA GAA
(Met) Ser Ser Pro Pro Glu-
ATG, AGC AGT CCA CCA GAA
(Met) Ser Asn Glu Leu His Leu Leu Gln Val Pro Ser
Asn-ATG, AGC AAT GAA CTT CAT CTG CAG CAA GTT CCA TGC
AAC
Трансформированные плазмидами по изобретению бактерии дают очень высокий уровень экспрессии. Трансформация подходящих компетентных организмов-хозяев осуществляется известным образом. Для экспрессии плазмид по изобретению особенно подходящими организмами-хозяевами являются штаммы вида E. coli и родственных энтеробактерий, такие, как штаммы Pseudomonas, Salmonella, Enterobacter, Klebsiella или Serratia.
Предпочтительными организмами-хозяевами являются штаммы вида E.coli, в частности E.coli GRT-1, и особенно штаммы E.coli подгруппы K12, как, например, E.coli K12 JM101 (ATCC 33876), E.coli K12 JM103 (ATCC 39403, E.coli K12 JM105 (DSM 4162), E.coli K12 MM 294 (ATCC 33625), E.coli K12-ATCC 31446 или также E.coli K12 DHI (ATCC 33849).
Протеканию экспрессии в E.coli-экспрессионных системах, которые содержат Tac-промотор, можно способствовать, например, добавкой лактозы или отводом глюкозы, но предпочтительно - добавкой изопропил- β -D-тиогалактопиранозида (IPTG). Однако, если в плазмиде существует Trp-промотор, то индукция происходит предпочтительно с индолакриловой, индолакрилуксусной или индолакрилпропионовой кислотой. Разумеется, можно также использовать и другие известные индукторы.
После индукции и достижения определенной плотности культуры клетки центрифугируют, а осадок от центрифугирования после суспендирования в водно-солевом растворе переносят в гомогенизатор. После повторного центрифугирования в осадок выпадает предшественник соединения формулы I вместе с нерастворимыми в воде осколками клеток и т.д. В результате обработки раствором гуанидингидрохлорида протеин переводится в раствор и обрабатывается "окислительно-восстановительной системой" (содержащей, например, восстановленный и окисленный глютатион), благодаря чему происходит восстановление природной конформации, т.е. образованию искомого соединения формулы I. Последнее находится в этом случае в реакционной смеси в растворенной форме и может быть выделено в чистом виде с помощью обычных операций очистки (например, хроматографии и последующей лиофилизации).
Для аналитических целей ферментируют трансформированные с исследуемой плазмидой штаммы E. coli и после достижения заданной оптической плотности клеточной суспензии индуцируют подходящим индуктором экспрессию соответствующего первоначального протеина. После соответствующего периода ферментации отбирают аликвоты и осажденные из них клетки разрушают затем при помощи лизозима (1 мг лизозима на 1 мл 50 мМ трис-HCl-буферного раствора, pH 8,0, 50 мМ ЕДТА и 15% сахарозы). Гомогенат подвергнутых лизису клеток растворяют в 4 - 5 М гуанидингидрохлориде и после разбавления добавкой восстановителя (глютатион, меркаптоэтанол, или цистеин до концентрации 1,2-М по гуанидингидрохлориду на несколько часов подвергают в присутствии кислорода воздуха ренатурации (см. также например, Winkler и др. в Biochem. 25, (1986), 4041 - 4045). Полученное таким путем одноцепочечное соединение формулы I добавкой плазмина превращают в соответствующее двухцепочечное производное полипептида, активность которого определяют затем при помощи хромогенного субстрата pyroGlu-Gly-Arg-p-нитроанилида, расщепляемого только двухцепочечной активной урокиназой. Эту активацию исследуемого соединения формулы I производят при помощи плазмина в 50 мМ трис-буфере с 12 мМ хлористым натрием, 0,02% Tween 80 при pH 7,4 и 37oC. Отношение испытываемого вещества к плазмину должно составлять приблизительно 100 - 1500 к 1 в пересчете на молярность или примерно 8.000 - 36.000 к 1, в пересчете на единицы фермента. Тест-инкубация происходит в 50 мМ трис-буфере с 38 мМ хлористым натрием при pH 8,8 в присутствии 0,36 мкМ апротинина (для торможения плазмина) и 0,27 мМ субстрата при 37oC. В зависимости от содержания в пробе соединения формулы I после 5 - 60-минутного инкубирования останавливают реакцию добавкой 50%-ной уксусной кислоты и измеряют экстинкцию при 405 нм. По данным изготовителя субстрата (Каби Фитрум, Швеция) при этом принципе работы изменение экстинкции 0,05 в минуту при 405 нм соответствует активности урокиназы 25 Ploug-единиц/мл стандартного раствора.
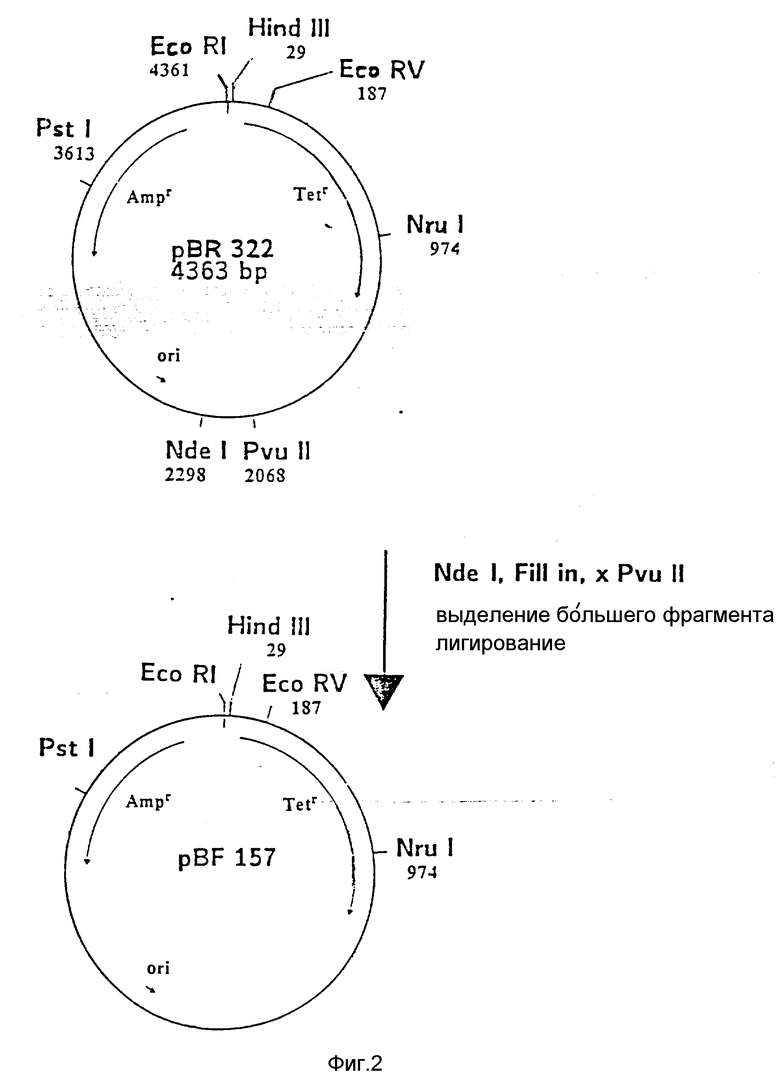
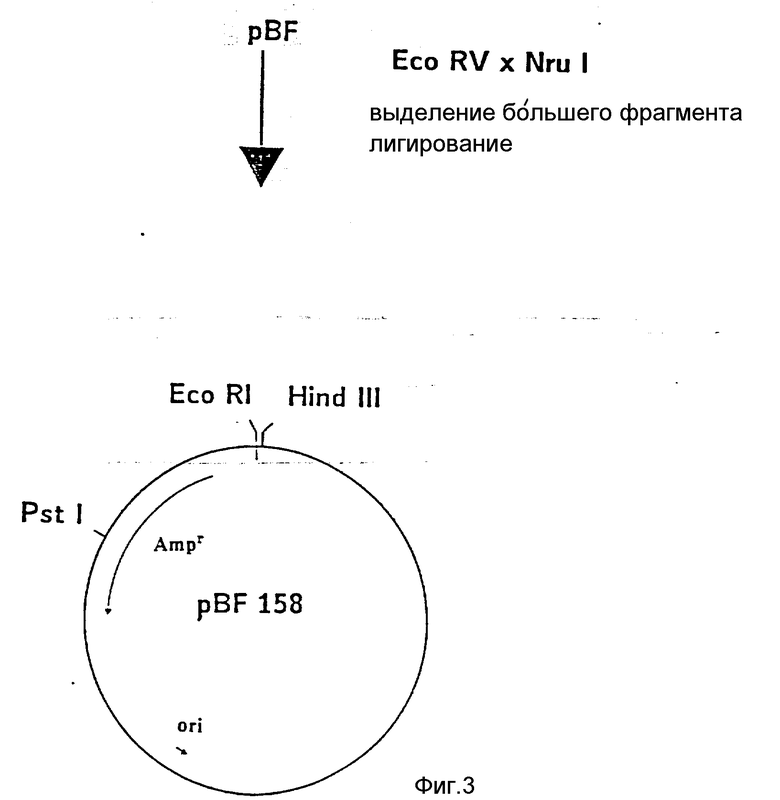
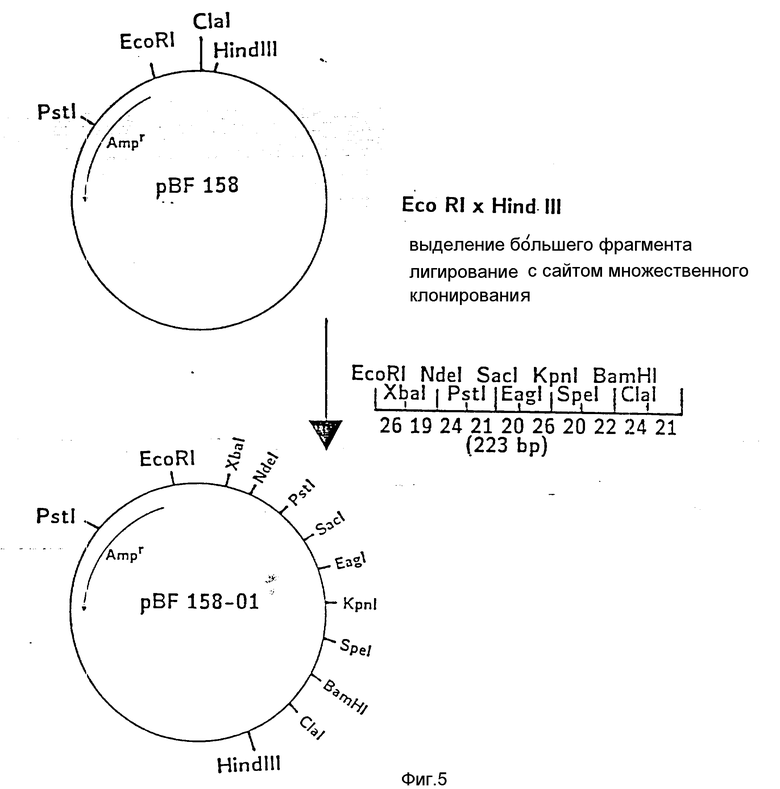
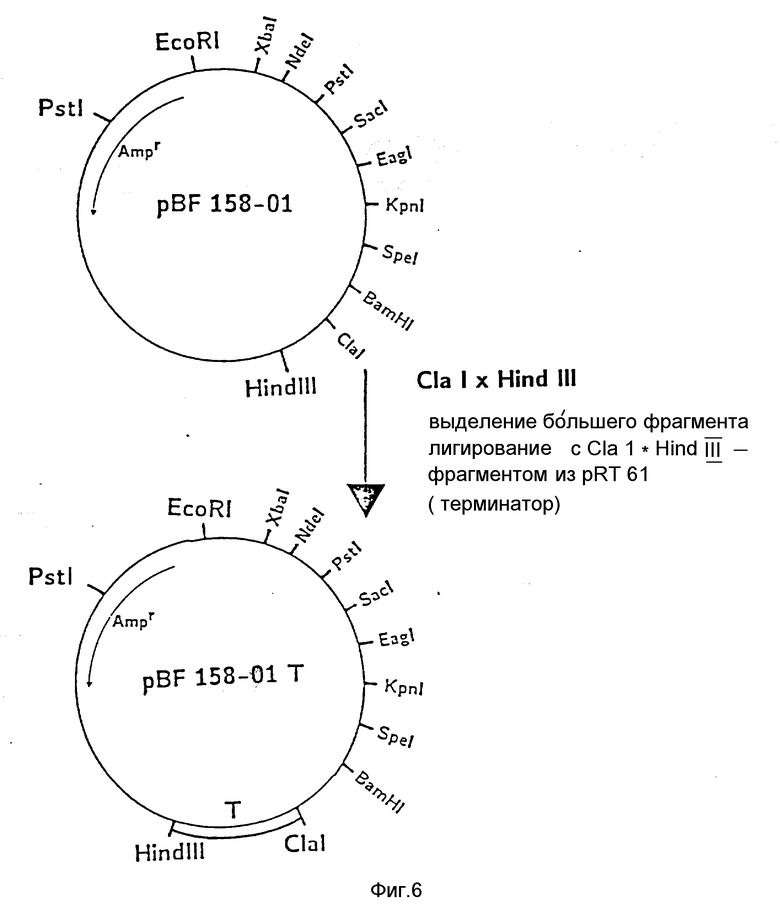
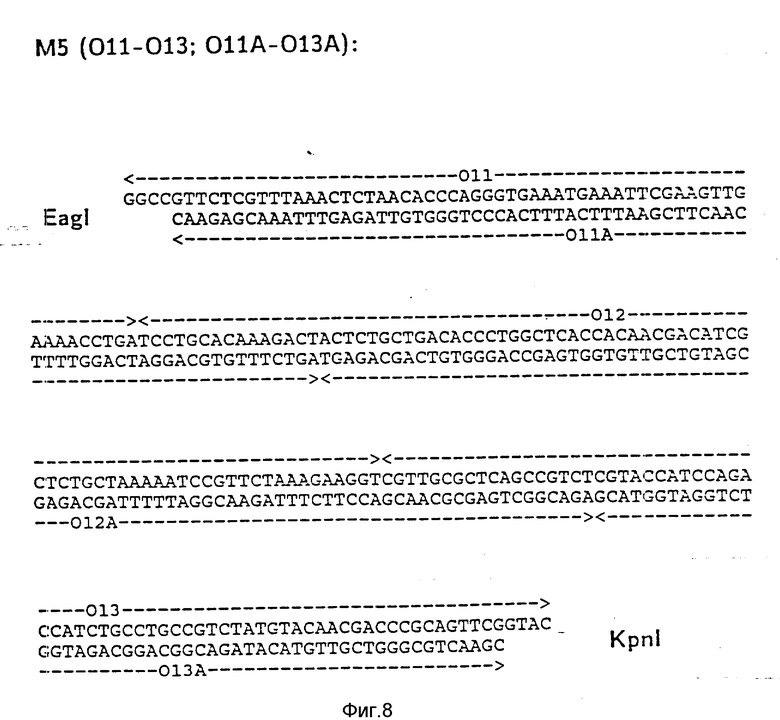
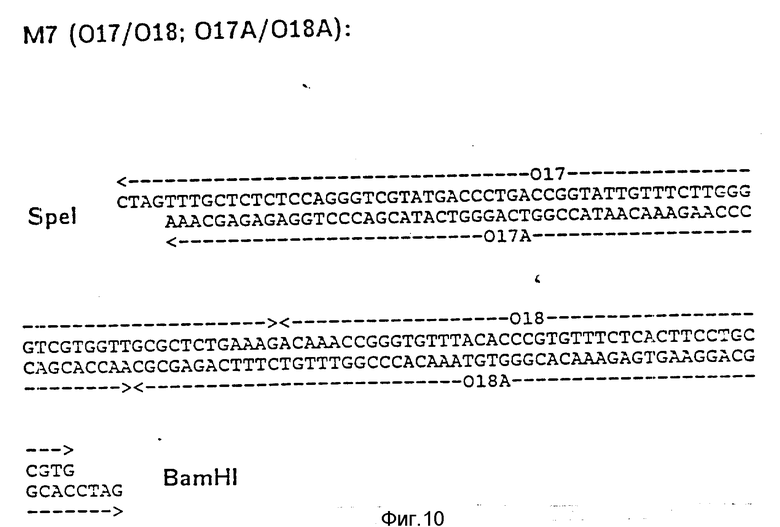
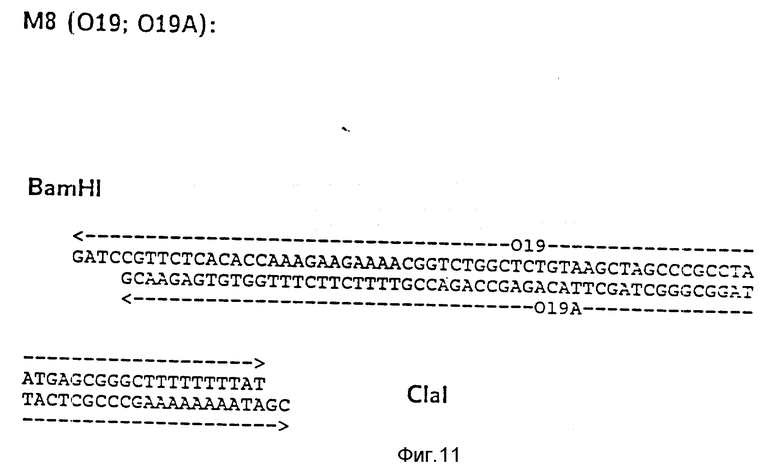
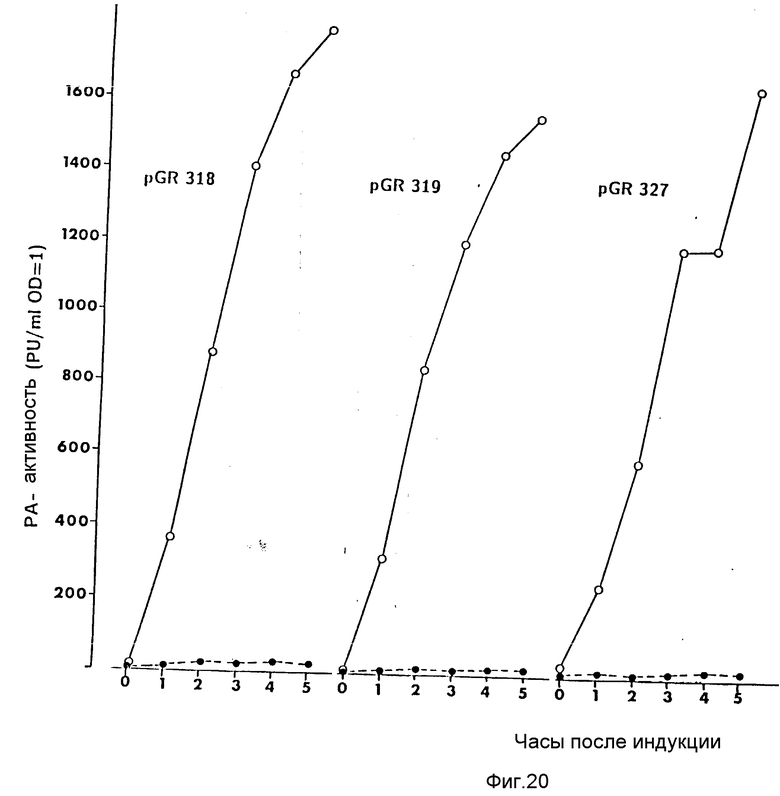
На фиг. 1 показана схема структуры соединений формулы I с указанием необходимых для поддержания конформации дисульфидных мостиков; на фиг.2 и 3 - конструирование плазмиды pBF 158 из плазмиды pBR 322, при этом руг за другом удаляют nic/bom-область и большую часть гена резистентности к тетрациклину; на фиг.4 - последовательность нуклеотидов синтетического сайта множественного клонирования; на фиг.5 - конструирование плазмиды pBF 158-01, показано встраивание синтетического сайта множественного клонирования в плазмиду pBF 158 между сайтами расщепления Eco RI и Hind III; на фиг.6 - конструирование плазмиды pBF 158-01, фрагмент Cla I - Hind III заменяют соответствующим фрагментом "T" из плазмиды pRT 61 (см. Jorgensen и др. J. Bacteriol., 138, 1978, 705-714), в которой содержится tet A/orf α -терминатор из Тп10 (см. Sohollmeier и др. Nucl. Acids Res., 13, (1985), 4227-4237); на фиг.7-11 - последовательности нуклеотидов синтетических фрагментов для кодирующего гена (их встройка при образовании структурного гена для соединений формулы I в плазмиду по изобретению, на примере pBF 158-01, T описана в примере 1d и показана на фиг.12-14; на фиг.12-14 - конструирование плазмиды pBF 158-02 T - pBF 158-06 путем встраивания олигонуклеотидных фрагментов M 4 - M 8; на фиг. 15 - плазмида pGR Tac 06, полученная из pBF 158-06 T встройкой Tac - просмотра между сайтами рестрикции Eco RI и Xba I (пример 1); на фиг.16 - последовательность нуклеотидов между сайтами рестрикции NleI и Sac I в pGR Tac 06 и выведенная последовательность аминокислот, нумерация аминокислот соответствует фиг.1; на фиг.17 - последовательность нуклеотидов синтетического Тгр-промотора; на фиг.18 - уровни экспрессии для соединения формулы I (по фиг. 16) или для предшествующего ему протеина в трансформированном при помощи плазмиды pGR Tac 06 штамме E.coli JM 103, осуществляемой под контролем Tac-промотора, в зависимости от времени индукции IPTG в момент времени О. Указанная определенная при помощи хромогенного субстрата активность в Ploug-единицах на 1 мл ферментационной среды с оптической плотностью 1 при 578 нм после (°----°) и без (⊙ ---⊙) воздействия плазмина перед тестом. Величины представляют средние значения из ферментационных смесей; на фиг.19 - последовательности нуклеотидов и выведенные последовательности аминокислот соединений формулы (Met)-Ser-X1-X2-rscu PA143-411, метионины в скобках отщепляются в E.coli; на фиг.20 - уровни экспрессии для соединений формулы I или их предшественников в штамме E.coli K12 JM 103, трансформированном pGR 318, pGR 319 или pGR 327, т.е. контролем Тгр-промотора. Индукция происходила в момент времени О с индолакриловой кислотой. Указана определенная при помощи хромогенного субстрата активность в Ploug-единицах на 1 мл ферментационной среды с оптической плотностью 1 при 578 нм после (°----°) и без (⊙ ---⊙) воздействия плазмина перед тестом.
Примененные в примерах осуществления рестриктазы имеются в продаже (см. например Nachr. Chem. Teohn. Nab. 35, 939, 1987).
Использованные в примерах питательные среды также имеются в продаже.
Пример 1. Конструирование плазмиды pGR TAC 06 для экспрессии соединения формулы I (фиг.16) с синтетически геном под контролем Tac-промотора.
а) Конструирование плазмиды pBF 158.
Из плазмиды pBR 322 (Фармация, N 27-4902, 4363 bp) удаляют nic/bom-область, которая находится между основаниями 2207 и 2263 (см. Winnacker, Gene und kione, VCH, Weinheim, 1985, стр. 298), следующим образом (ср. также фиг. 2 и 3): pBR 322 расщепляют Nde I при основании 2998 и тем самым линеаризируют. Выступающие концы заполняют и получают тупые концы (см. Maniatis и др. "Molecular Cloning", Cold Spring Harbor/lab, 1982). После этого делают разрез PvuII при основании 2068, и оба конца оставшейся части pBR 322 обычным методом лигируют Т4-лигазой. Затем лигированной смесью трансформируют компетентные клетки E.coliK12 Jm 103 (ATCC 39403) (см. Hanahan, "DNA Cloning" v. I, IRLPress, Oxfrd, 1985, 109-135). Трансформированные клетки культивируют в среде в присутствии 150 мкг ампициллина/мл. Из полученных клонов выбирают те, которые содержат плазмиду pBF 157, отличающуюся от исходной плазмиды pBR 322 меньшими (на 230 нуклеотидов),
а) PstI - BspM II-, b) PstI - BaI I-, c) PstI - Ava I-фрагментами. Оба уникальных сайта рестрикции (Pvu II и Nde I), характерные для pBR 322, в плазмиде pBF 157 отсутствуют. ii) Из pBF 157 удаляют большую часть гена резистентности к тетрациклину обработкой Eco RVu Nru I и последующим сшиванием образующихся концов. После трансформирования E.coli K12 JM 103 и культивирования клеток на среде с 150 мкг ампициллина/мл получают клоны, из которых выбирают такие, которые содержат плазмиду pBF 158. Последняя на 787 нуклеотидов меньше, чем pBF 157, и отличается, кроме того, отсутствием BamHI-сайта. Трансформация штаммов бактерий при помощи pBR 158 не придает последним резистентности к тетрациклину.
б) Конструирование pBF 158-01, встройка синтетического сайта множественного клонирования.
Из pBF 158 обработкой Eco P1 x Hind III удаляют фрагмент размером 31 нуклеотид и в "разрез" вводят последовательность синтетического сайта множественного клонирования (фиг.4). После трансформации лигирующей смесью E. coli K12 JM 103 и культивирования в среде с 150 мкг ампициллина/мл выбирают такие клоны, которые содержат плазмиду pBF 158-01. Последняя отличается от pBF 158 дополнительными уникальными сайтами рестрикции Xba I, Nde I, Sac I; Eag I, Kpn. Spe I и вторым сайтом Pst I (фиг.5).
Между Xa I и Nde I расположена Shine-Dalgarno-последовательность из оперона XyI B.subtilis (см. Ihelm и др. цитированное место)
c) Конструирование pBF 158-01, T, встраивание терминатора транскрипции.
Из pBF 158-01 удаляют Cla I-Hind III фрагмент сайта клонирования и изменяют Cla I - Hind III фрагментом из pRT 61 (см. Jorgensen и др. цитированное место), в котором содержится tet A/orf α терминатор из Tn 10 (Schollmeier и др. цитированное место)
После трансформации штамма E.cоli K12 JM 103 и культивирования в среде с 150 мкг ампициллина/мл выбирают те клоны, которые содержат плазмиду pBF 158-01 T. Последняя отличается от pBF 158-01 большим (на 297 нуклеотидов) ClfI - Hind III - фрагментом (фиг.6).
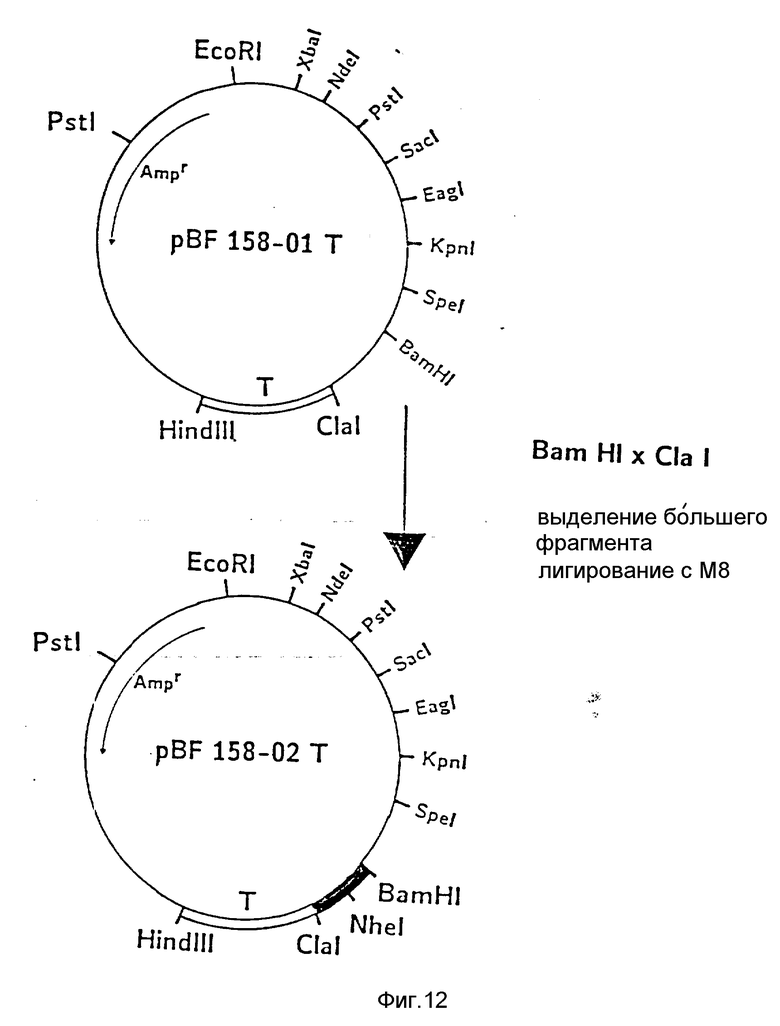
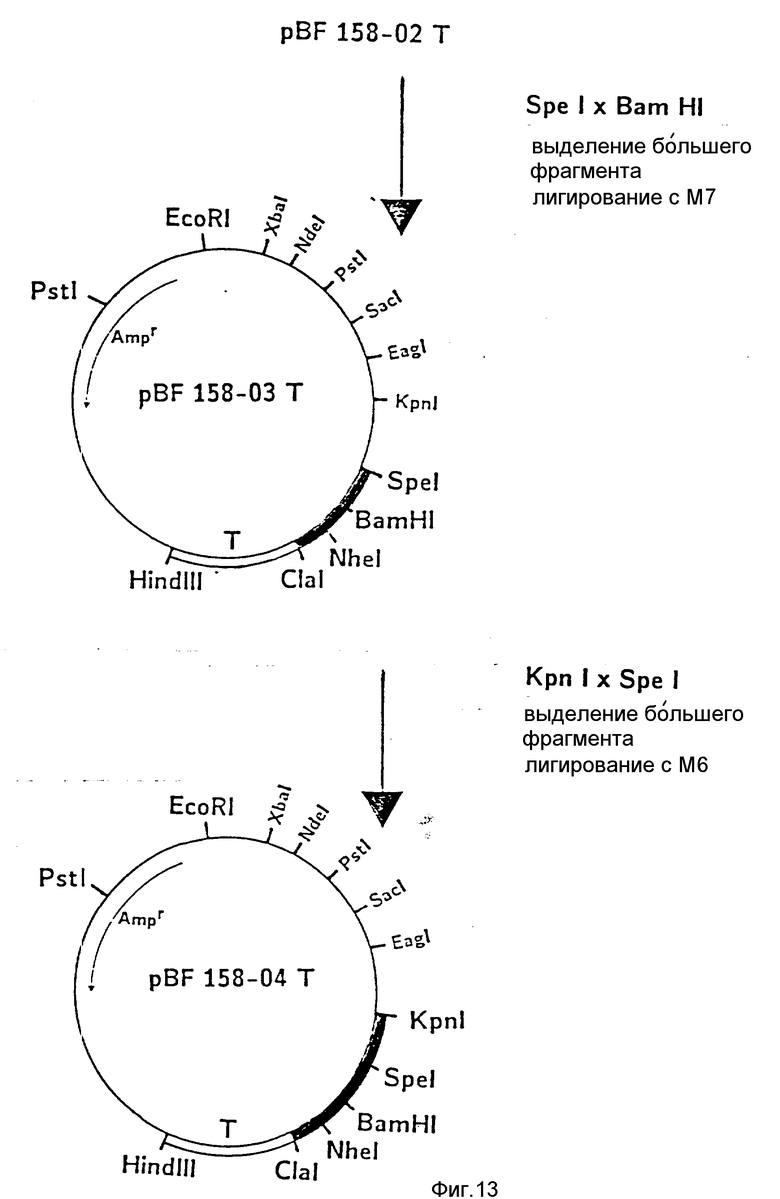
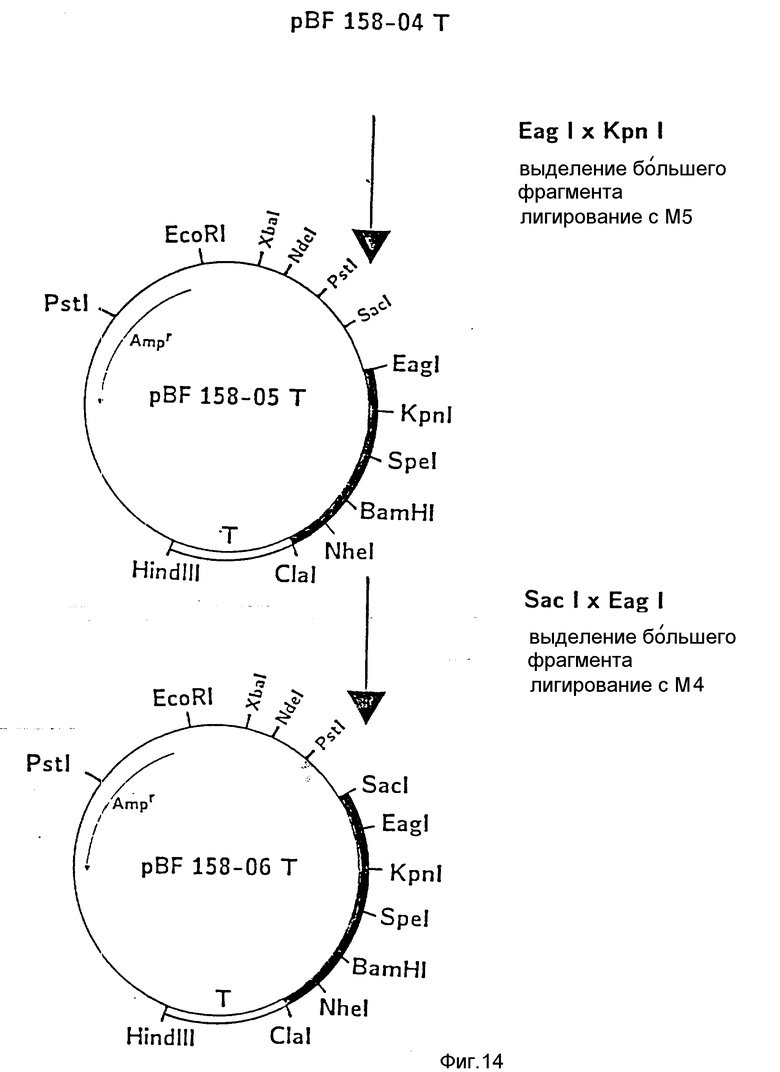
d) Последовательное включение синтетических фрагментов M 4- V 8 для кодирующего гена, конструирование плазмид pBF 158-02T - pBF 158-06T.
Все синтетические фрагменты описаны на фиг.7-11. Их вводят как фрагменты длиной около 200 нуклеотидов в соответствующие векторы. Для этого векторы расщепляют соответствующими рестриктазами и в результате электрофореза в агарозе, электроэлюции и очистки через ДЕ 52 отделяют от удаляемого фрагмента. После этого осуществляют лигирование с соответствующим синтетическим двухцепочечным фрагментом при помощи T4-лигазы, трансформацию E.coli K12 Jm 103 (фиг.12-14) и отбор на содержащей ампицилин среде.
I) Лигирование фрагмента M8 между BamHI и Cla I в плазмиде pBF 158-01 T.
Образуется плазмида pBF 158-02 T.
Олигонуклеотид 019 соответствует C-концевой последовательности соединения формулы I.
За стоп-кодоном ТAA находится сайт Nde I и последовательность trpA терминатора (см. Shristie и др. P.N.A.S. 78, (1981), 4180-4184) до Cla I.
II) Лигирование фрагмента M7 между Spe I и BamHI в плазмиде pBF 158-02 T.
Образуется плазмида pBF 158-03 T.
III) Лигирование фрагмента M6 между Kpn I и Spe I в плазмиде pBF 158-04 T.
Образуется pBF 158-04 T.
IV) Лигирование фрагмента M5 между Eag I и Kpn I в плазмиде pBF 158-04 T.
Образуется плазмида pBF 158-05 T.
V) Лигирование M4 между Sac I и Eag I в плазмиде pBF 158-05 T.
Образуются pBF 158-06 T.
Из полученных клонов I - V выбирают такие, которые отличаются от предшествующей формы наличием встроенного нового фрагмента в проверенной правильной ориентации
e) Конструирование плазмиды pGR Tac 06, встройка Tac промотора,
Плазмиду pBf 158-06 T рестрицируют Eco RI и Xba I. Образующийся фрагмент длиной 26 нуклеотидов отделяют препаративным электрофорезом в геле агарозы, остальную часть плазмиды элюируют электроэлюцией и затем очищают через ДЕ 52.
Из плазмиды ptac SDT (DSM 5018)выделяют Eco RI - Xba I - фрагмент, который содержит Tac-промотор. Для этого ptac SDT рестрицируют Eco RI и Xba I и отделяют фрагмент препаративным электрофорезом в геле агарозы. Фрагмент элюируют нагреванием до 65oC в ацетатно-аммонийном буфере с SDS, pH 8,0 из механически измельченного полиакриламида и очищают многократной экстракцией с фенолом, который насыщен 1 M трисом, pH 8.
Оба полученных таким путем фрагмента "сшивают" обычным образом Т4-лигазой и трансформируют лигирующей смесью E.coli K12 JM 103. После культивирования на среде с 150 мкг ампициллина/мл выбирают клоны, которые после добавки IPTC продуцируют белок-предшественник соединения формулы I (фиг. 16) "PA/06". Эти клоны содержат плазмиду pGR Tac 06.
Тест с экспрессией
I) Ферментация
Трансформирование при помощи плазмиды pGP Tac 06 клетки E.coli K12 JM 103 ферментируют в среде, состоящей из 38 мМ сульфата аммония, 56 мМ фосфатного буфера с pH 7,0, 1 мМ сульфата магния, 1% дрожжевого экстракта, 1% глюкозы и содержащей 150 мг ампициллина на литр, и индуцируют при помощи 0,5 мМ IPTC экспрессию предшественника соединения PA/06.
Перед индукцией и каждый час после индукции (всего 6 ч) отделяют центрифугированием клетки и в клеточной суспензии (1 мл) с оптической плотностью 1 при 578 нм определяют уровень экспрессии.
II) Укладка белковой цепи соединения PA/06, его расщепление до соответствующего двухцепочного соединения и измерение PA-активности.
Отделенные центрифугированием клетки разрушают лизоцимом, и гомогенат подвергнутых лизису клеток обрабатывают дальше, как это было описано выше.
Уровни экспрессии для соединения PA/06 или предшествующего протеина, определенные по измерению активности соответствующей двухцепочечной формы активатора плазминогена, показаны на фиг. 18. Эта активность наблюдается только в присутствии плазмина (см. фиг. 18), следовательно, соединение PA/06 (как и его предшественник) экспрессируется в виде одной цепочки.
Пример 2. Конструирование плазмиды экспрессии pGR Tгр 06.
Описанная De Boer и др. в RNAS, 80, (1983), 21-25 последовательность Tгр промотора переносится до Xba I - сайта и удлиняется на 5'-конце последовательностью 5'-AATTCTGAAT-3'. В результате этого формируется сайт Eco RI - (фиг. 17, фрагмент M I). Отдельные цепочки 021 и 021 A собирают и лигируют с рестрицированной Eco R1 и Xba I плазмидой pGR Tac 06. После трансформации E. coli K12 JM103 и культирования на среде с 150 мг ампициллина/мл выбирают те клоны, которые содержат pGR Tгр 06. Плазмида pGR Tгр 06 отличается от всех вышеописанных векторов тем, что трансформированные штаммы E. coli экспрессируют предстадийный протеин соединения PA/06 после добавки индолакриловой кислоты.
Пример 3. а) Конструирование плазмиды pGR 318
Плазмиду pGR Tгр 06 разрезают Nde I и Sac I. Образующийся фрагмент длиной 58 bp, который принадлежал сайту множественного клонирования, отделяют препаративным электрофорезом в геле агарозы, остальную часть плазмиды элюируют электроэлюцией и затем очищают через DE 52.
Этот фрагмент лигируют с синтетическим олигонуклеотидом 18 5' - T ATG AGC AAT GAG CT-3'.
AC TGG TTA C лигируют обычным образом с помощью T4-лигазы, трансформируют продуктом E.coli K12 и культивируют на содержащей ампициллин среде. Выбирают те клоны, которые после добавки индолакриловой кислоты продуцируют агрегированный протеин для соединения "PA 318". Эти клоны содержат плазмиду pGR 318, которая кодирует соединение формулы I "PA 318" с указанной на фиг. 19 последовательностью аминокислот.
b) Тест с экспрессией.
E. coli K12 JM 103 после трансформации плазмидой pGR 318 ферментируют как описано в примере 1. Индукцию осуществляют при оптической плотности 2-3 при 578 нм, добавляя 62 мг индолакриловой кислоты на 1 л ферментационной среды.
Перед индукцией и каждый час после индукции в течение всего 5 ч клетки 1 мл клеточной суспензии с оптической плотностью 1 при 578 нм отделяют центрифугированием и используют для испытания нормы экспрессии.
После ренатурации экспрессированного протеина (см. пример 1) определяют амидолитическую активность соединения PA 318 перед и после обработки плазмином. Результаты представлены на фиг. 20. Очевидно, что достигнут такой же уровень экспрессии, что и с плазмидой pGR Tac 06 и что амидолитическую активность можно обнаружить только после расщепления плазмидом. Следовательно, соединение формулы I PA 318 также экспрессируется в E.coli K12 c pGR 318 в форме одноцепочечного предшественника.
с) Выделение, очистка и протеинхимическая характеристика.
Для выделения, очистки и протеинхимической характеристики осуществляют ферментацию 1 л при контролируемых условиях pH и температуры (pH 7,0, 37oC). Эти условия позволяют достигать конечных плотностей культуры до 20 оптических ед. (при 578 нм). После окончания экспрессии (около 5-6 ч) центрифугируют 50 мл суспензии клеток, снова суспендируют осадок клеток в 40 мл K2O и разрушают в гомогенизаторе высокого давления. После центрифугирования осадок, который содержит весь неактивный протеин тел включения, растворяют в 100 мл 5 М гуанидингидрохлорида, 40 мМ цистеина, 1 мМ КДТА (с установленной PH 8,0) и разбавляют 400 мл 25 мМ трис-буферного раствора, pH 9,0. При доступе или воздействии кислорода воздуха реакция восстановления конформации заканчивается приблизительно через 12 ч.
Соединение PA 318 выделяют и очищают методом хроматографии. Анализом N-концевой последовательности были доказаны, во-первых, одноцепочечность и, во-вторых, правильная структура N-конца.
Пример 4. а) Конструирование плазмиды экспрессии pGR 319.
Плазмиду pGR Tгр 06 расщепляют как описано в примере 3a, Nde I и Sac I и выделяют большой фрагмент.
Этот фрагмент лигируют с синтетическим олигонуклеотидом 19 5' - TATG AGC AAT GAA GAG CT-3.
AC TCG TTA CTTT C обычным образом с помощью T4-лигазы, трансформируют продуктом E.coli K12 и культивируют на содержащей ампициллин среде. Выбирают такие клоны, которые после добавки индолакриловой кислоты продуцируют первоначальный протеин для соединения формулы I "PA 319". Эти клоны содержат плазмиду pGR 319, которая кодирует соединения PA 319 с указанной на фиг. 19 последовательностью аминокислот.
b) Тест с экспрессией.
E. coli K12, трансформированные при помощи плазмиды pGR 319, ферментируют, индуцируют и затем собирают пробы для испытания как описано в примере 3b.
Выделение, очистка и протеинхимическая характеристика осуществляется как описано в примере 3c.
Ренатурация соединения "PA 319" и определение уровня экспрессии производятся как описано в примере 3b. Результаты показаны на фиг. 20. Видно, что уровень экспрессии сходен с уровнем экспрессии плазмиды pCP Tac 06 и что амидолитическая активность может быть выявлена только после расщепления при помощи плазмина. Следовательно, PA 319 экспрессируется в E.coli K12 с плазмидой pGR 319 (в виде белка предшественника), как одна полипептидная.
Пример 5. А) Конструирование плазмиды экспрессии pGR 327.
Плазмиду pGR Tгр 06 разрезают как описано в примере 3a, Nde I и Sac I и выделяют большой фрагмент.
Этот фрагмент лигируют с синтетическим олигонуклеотидом
5' - TATG AGC AGT CCA CCA GAA GAG CT - 3'
AC TCG TCA GGT CCT CTT C
обычным образом с помощью T4-лигазы и трансформируют продуктом E.coli K12. Селекция и выбор клонов производятся как описано в примере 3a. Выбранные клоны содержат плазмиду pGR 327, которая кодирует соединения формулы I "PA 327" с указанной на фиг. 19 последовательностью аминокислот.
б) Тест с экспрессией.
E. coli K12 с плазмидой pGR 327 ферментируют и испытывают уровень экспрессии как описано в примере 3b. Результаты представлены на фиг. 20. Видно, что уровень экспрессии по сравнению с уровнем экспрессии плазмиды pGR Tac 06 (примерно такой же и что активность может быть определена только после расщепления плазмином. Следовательно, соединение "PA 327" экспрессируется E. coli K12 с плазмидой pGR 327 (в виде предшественника) как одна цепочка. Выделение, очистка и протеинхимическая характеристика производились, как описано в примере 3c.
Пример 6. Плазмиду pGR Tгр 06 разрезают как описано в примере 3a, Nde I и SacI и выделяют большой фрагмент.
Этот фрагмент лигируют с синтетическим олигонуклеотидом 46
5'-TATG AGC CCA CCA GAA GAG CT -3'
AC TCG GGT CCT CTT C
обычным образом с помощью T4-лигазы и трансформируют продуктом E.coli K12 JM 105. Селекция и выбор клонов производятся как описано в примере 3a. Выбранные клоны содержат плазмиду pGR 336, которая кодирует соединение формулы I "PA 336" с указанной на фиг. 19 последовательностью аминокислот.
E.coli K12 JM 105 трансформируют плазмидой pGR 336, затем ферментируют и после индукции определяют уровень экспрессии как описано в примере 3b. Из первично полученного протеина получают соединение PA 336 (последовательность аминокислот указана на фиг. 19) как одноцепочечный протеин. Уровень экспрессии сравним с уровнем, полученным при экспрессии другого протеина, кодируемого плазмидой pGR Tac 06.






Изобретение относится к биотехнологии и позволяет получить полипептиды, используемые в качестве плазминогенных активаторов, имеющие высокую удельную амидолитическую и фибринолитическую активность. При получении полипептида со свойствами проурокиназы проводят трансформацию штамма E.coli рекомбинантной плазмидой, включающей фрагмент ДНК, кодирующий целевой продукт. Отбирают трансформанты. Культивируют их в оптимальных для накопления рекомбинантного полипептида условиях. Отделяют и проводят реактивацию экспрессированного продукта. При получении плазмиды для экспрессии полипептида в клетках энтеробактерий объединяют оперон с регулируемым промотором последовательности связывания с рибосомой Шайн-Дальгарно, инициирующий кодон, фрагмент ДНК, кодирующий целевой полипептид, один или два терминатора, располагаемых за указанным фрагментом. Для объединения используют плазмиду pBR 322, из которой удалены nic / bom область и/или часть резистентного к тетрациклину гена. В последнюю между сайтами E coRI и Hind III вводят сайт множественного клонирования, предназначенный для встраивания терминатора транскрипции, фрагмента ДНК, кодирующего целевой полипептид и синтетического Tr p - промотора. Получают полипептиды общей формулы Met - Ser - x1 - x2 - rscu РА 143-411. rscu РА 143-411 представляет область последовательности аминокислот 143 (Glu-411 (LeuOH) из scu PA 54к. x1 означает одну из аминокислот Asn, Pro или Ser, а x2 представляет собой простую связь или Glu, или Pro - Glu, или Pro - Pro - Glu, или Glu - Leu - His - Leu - Leu - Gln - Val - Pro - Ser. 4 с. и 7 з.п. ф-лы, 20 ил.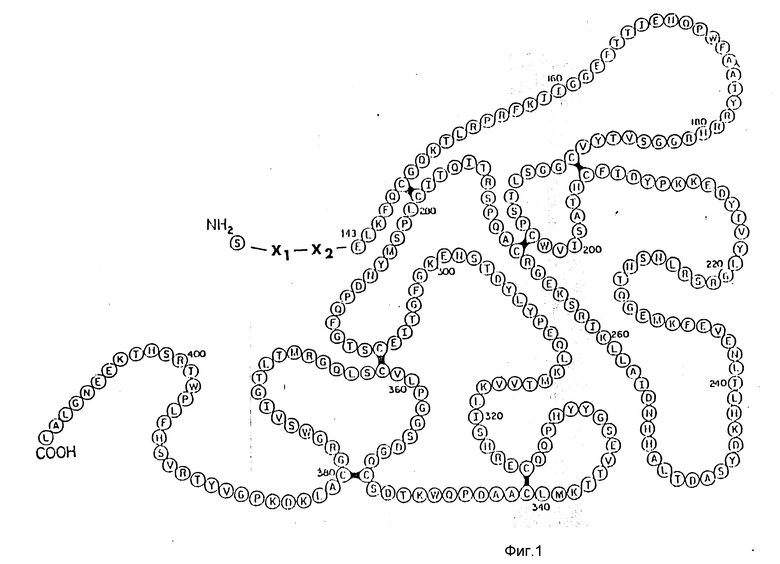
Met - Ser - X1 - X2 - rscu PA 143 - 411,
где rscu РА 143 - 411 представляет область последовательности аминокислот 143(Glu) - 411 (LeuOH) из scu РА 54 к;
X1 - одна из аминокислот, Asn, Pro и Ser;
X2 - простая связь, или Glu, или Pro - Glu, или Pro - Pro - Glu, или Glu - Leu - His - Leu - Leu - Gln - Val - Pro - Ser - Asn,
проявляющий по сравнению с scu РА 54 к более высокую удельную амидолитическую активность, замеренную с помощью хромогенного субстрата пиро- Glu - Gly - Arg - p - нитроанилид после преобразования в двухцепочечные активаторы плазминогена посредством плазмина и более высокую фибринолитическую активность, замеренную на фибриноагарной пластине и не содержит N-концевого остатка Met.
Ser - Ser - Pro - Pro - Glu - rscu - РА 143 - 411,
где rscu РА 143 - 411 - негликозилированная область последовательностей аминокислот от 143 (Glu) до 411 (Leu OH) из scu - РА 54 к.
| EP, патент, 0092182, кл | |||
| Способ гальванического снятия позолоты с серебряных изделий без заметного изменения их формы | 1923 |
|
SU12A1 |
Авторы
Даты
1998-04-10—Публикация
1992-01-09—Подача