Изобретение относится к бифункциональным вариантам урокиназы с улучшенными фибринолитическими свойствами и ингибирующим тромбин действием, применяемым при получении этих полипептидов плазмидам, а также тромболитическим средствам, которые в качестве биологически активного вещества содержат бифункциональный вариант урокиназы.
Важным свойством человеческой крови является способность закрывать повреждения кровеносного русла путем образования тромбов. Свертывание крови вызывается рядом содержащихся в крови ферментов, которые в так называемом каскаде свертывания в конце концов приводят к тому, что фермент тромбин, протеин-предшественник фибриногена, превращается в фибрин. Под влиянием тромбоцитов, эритроцитов и других составных частей крови фибрин полимеризуется в месте повреждения с образованием тромба.
Сверх того кровь содержит также ряд ферментов, которые противодействуют свертыванию и обеспечивают кровоток после регенерации стенок сосудов. Самым важным ферментом для тромболиза является плазмин, который протеолитически воздействует на фибринную нить и благодаря этому вызывает растворение тромбов. Плазмин образуется за счет протеолитического расщепления неактивного протеин-предшественника плазминогена. Активирование вызывается активаторами плазминогена путем протеолитического расщепления плазминогена. Известны два эндогенных человеческих активатора плазминогена: урокиназа, находящийся в моче активатор плазминогена, и тканевый активатор плазминогена.
Инфаркт сердца и инфаркт головного мозга тесно связаны с патологическим образованием тромбов. В случае обеих форм инфаркта при определенных условиях образуются - чаще всего вследствие артериосклеротических изменений артерий - тромбы на стенках сосудов. Эти тромбы нарушают кровоток в артериях так, что ткань не может более в достаточной степени снабжаться кислородом. При инфаркте сердца это приводит к частичному или полному некрозу миокарда. Соответственно, блокада церебральных артерий приводит к тяжелым повреждениям ткани головного мозга.
Для терапии пациентов с инфарктом используют активаторы плазминогена в качестве тромболитических средств, которые инициируют разрушение тромбов за счет плазмина. В настоящее время для терапии доступны стрептокиназа, APSAC (Anisolated Plasminogen Streptokinase Activator Complex), двунитевая урокиназа (УК), рекомбинантная однонитевая урокиназа (рекомбинантная проурокиназа) и тканевый активатор плазминогена (tPA) [Collen und Lijnen, Blood, 78, 3114-3124 (1991)]. В случае стрептокиназы речь идет о протеине гемолитических стрептококков. Стрептокиназа активирует плазминоген тем, что она образует комплекс с плазминогеном и благодаря этому переводит плазминоген в активную конформацию. Этот комплекс сам превращает свободный плазминоген в плазмин, который затем снова расщепляет связанный со стрептокиназой плазминоген. Дальнейшим развитием форм стрептокиназы является APSAC, получаемое in vitro соединение из стрептокиназы и человеческого плазминогена. На основании химической модификации активного центра плазминогена APSAC обладает повышенным, по сравнению со стрептокиназой, биологическим периодом полураспада.
Урокиназа представляет собой человеческий протеин, который можно получать из мочи в двух формах в качестве протеолитически активного протеина, как: высокомолекулярная урокиназа (ВУК) и низкомолекулярная урокиназа (НУК) [Stump et al. , J. Biol. Chem. 261. 1267-1273 (1986)]. ВУК и НУК являются двунитевыми молекулами. Урокиназа образуется в виде однонитевой урокиназы (проурокиназа) в различных тканях и ее можно обнаружить в незначительных количествах в качестве профермента в человеческой крови [Wun et al., J. Biol. Chem. , 257, 3276-3283 (1982)]. Активированная форма проурокиназы в виде ВУК имеет молекулярный вес 54 килодальтона и состоит из трех доменов: амино-концевого домена фактора роста, спирали и серин-протеаза-домена [Gunzler et al. , Hoppe-Seyler's Z. Physiol. Chem., 363, 1155-1165 (1982); Steffens et al. , Hoppe-Seyler's Z. Physiol. Chem., 363, 1043-1058 (1982)]. Хотя проурокиназа и плазминоген существуют в виде проферментов, проурокиназа на основании своей собственной активности в состоянии превращать плазминоген в активный плазмин. Полную активность этот активатор плазминогена получает, однако, лишь после того, как образовавшийся плазмин со своей стороны расщепляет проурикиназу между 158лизином и 159изолейцином [Lijnen et al., J. Biol. Chem. , 261, 1253-1258 (1986)]. Получение урокиназы путем генной инженерии в Escherichia coli впервые описано Heyneker (Proceedings of the IVth International Symposium on Genetics of Industrial Microorganisms 1982). Негликозилированная проурокиназа (Saruplase) получается при применении синтетического гена [Brigelius-Flohe et al. Appl. Microbiol. Biotech. 36, 640-649 (1992)].
Тканевый активатор плазминогена представляет собой находящийся в крови и в ткани протеин с молекулярным весом 72 килодальтона. Этот активатор плазминогена состоит из 5 доменов: амино-концевого пальцевидного домена, домена ростового фактора, спирали 1, спирали 2 и серин-протеаза-домена. В противоположность проурокиназе tPA, лишь благодаря связыванию с фибрином, становится способным расщеплять плазминоген. Как и проурокиназа, tPA переводится в активную форму путем катализированного плазмином расщепления между спиралью 2 и серин-протеаза-доменом. При этом тканевый активатор плазминогена связывается с фибрином, но не с фибриногеном, благодаря чему плазминоген специфически активируется по отношению к тромбу. В противоположность двунитевой урокиназе, далее, избегают общего активирования плазминогена [Collen und Lijnen, Blood 78, 3114-3124 (1991)].
С начала восьмидесятых годов оказалось эффективным активное лечение инфаркта миокарда с помощью тромболитических средств. Рядом исследований показано, что лечение пациентов с инфарктом сердца с помощью стрептокиназы, APSAC, УК, рекомбинантной проурокиназы или tPA приводит к отчетливо сниженной смертности по сравнению с пациентами, которых не лечат таким образом.
Для того чтобы повысить эффективность этих веществ в терапии, при применении методов генной инженерии получен ряд производных тканевого активатора плазминогена и проурокиназы. Наряду с повышенной фибринолитической активностью и уменьшением побочных действий, основной интерес представляет разработка форм, которые пригодны для применения в виде больших пилюлей (Bolus). Обзор о попытках улучшения активаторов плазминогена опубликован в Thrombosis and Haemostasis 66, 88-110 (1991), a также в Trends in Biotech. 9, 86-90 (1991). Для того чтобы повысить эффективность активаторов плазминогена в лизисной терапии и в особенности увеличить их биологический период полураспада, получают варианты делеции и замещения тканевого активатора плазминогена, у которых, например, удаляют пальцевидный домен или домен фактора роста, или серин-протеаза-домен заменяют на серин-протеаза-домен урокиназы [Collen et al., Thromb. Haemostasis 65, 174-180 (1991); Fromage et al., Fibrinolysis 5, 187-190 (1991); Lu et al., Blood 78, 125-131 (1991)]. Фактически оказалось, что делеция пальцевидного домена и домена фактора роста повышает биологический период полураспада tPA-варианта [Lijnen und Collen, Thromb. Haemostasis 66, 94-95 (1991)]. Вариант делеции и замещения, который состоит из обоих сукрутиновых (извитых) доменов tPA и серин-протеаза-домена УК, на основании явно более продолжительного периода полураспада при тромболизе превосходит первоначальный, то есть неизмененный, активатор плазминогена. Эти варианты активаторов плазминогена, однако, обладают только незначительной специфичностью по отношению к фибрину [Lu et al., Blood 78, 125-131 (1991)].
Предпринимались различные попытки получить активаторы плазминогена с повышенной специфичностью по отношению к фибрину. Для того чтобы снизить опасность кровотечений такого рода биологически активные вещества должны активировать по возможности исключительно плазминоген вблизи тромба, однако, не вызывать системное активирование плазминогена. Так, например, известен вариант tPA, при котором спираль 1 заменена спиралью 2 первоначальной молекулы. Этот вариант, правда, обладает повышенным сродством к N-концевым лизиновым остаткам, но не к фибрину. На животной модели этот вариант, в отношении тромболиза, оказался не эффективнее, чем первоначальный тканевый активатор плазминогена [Collen et al., Thromb. Haemostasis 65, 174-180 (1991)] . Другие известные варианты, которые состоят из слияний специфических к тромбу антител с активаторами плазминогена, на животной модели оказались эффективнее, чем первоначальные активаторы плазминогена [Lijnen und Collen, Thromb. Haemostasis 66, 88-110 (1991)]. Очень высокой специфичностью по отношению к фибрину обладает активатор плазминогена, выделенный из летучей мыши Desmodus retundus [Gardell et al. , J. Biol. Chem. 264. 17947-17952 (1989)] . Этот активатор плазминогена в опытах на животных показывает улучшенный по сравнению с tPA тромболиз при увеличенном периоде полураспада и уменьшенном системном активировании плазминогена [Gardell et al., Circulation 84, 244-253 (1991); Mellott et al., Arterioscl. Thromb. 12, 212-221 (1992)].
Успех лечения пациентов с инфарктом с помощью активаторов плазминогена, однако, зависит не только от тромболиза, но также и от того, насколько можно предотвратить новую закупорку открытых кровеносных сосудов. Результаты различных исследований указывают на то, что связанный в тромбах тромбин при тромболизе снова высвобождается в виде активного фермента и может вызывать новую закупорку сосудов [Szczeklik et al., Arteriosci. Thromb. 12, 548-553 (1992); Eisenberg, Circulation 84, 2601-2603 (1991)]. Действительно, действие тромболитических средств улучшается за счет одновременного или предварительного введения ингибитора тромбина-гепарина. Также, благодаря введению Argatroban, Hirugen или протеина C, можно уменьшить появление новых закупорок в лизисной терапии [Schneider, Thromb. Res. 64, 677-689 (1990); Yao et al., Am. Physiol. 262 (Heart Circ. Physiol. 31, H 374 - H 379 (1992); Gruber et al., Circulation 84, 2454-2462 (1991)]. Кроме того, известно, что смертность пациентов с инфарктом сердца значительно снижается благодаря предыдущему введению гепарина и последующему введению проурокиназы по сравнению с контрольной группой (введение проурокиназы без предыдущего введения гепарина) [Tebbe et al., Z. Kardiol. 80, Suppl.3, 32 (1991)].
Одним из самых эффективных ингибиторов тромбина является выделенный из медицинской пиявки Hirudo гирудин, который с помощью своей карбокси-концевой половины специфически связывается с так называемым местом анионной связи тромба. Определенные аминокислоты амино-концевой половины молекулы гирудина закрывают доступ к "карману" связывания с субстратом тромбина [Rydel et al., Science 249, 277-280 (1990)]. Кроме того, известно, что тромбин также можно ингибировать меньшими производными гирудина, причем в особенности нужно отметить Hirulog-молекулы, описанные Maraganore et al. в Biochemistry 29, 7095-7101 (1990), [Krstenansky et al., J. Med. Chem. 30, 1688-1691 (1987); Yue et al., Protein Engineering 5, 77-85 (1992)].
Применение гирудина в сочетании с активатором плазминогена для лечения тромботически обусловленных сосудистых заболеваний описывается в европейских патентных заявках EP 328957 и EP 365468. Терапевтическое применение производных гирудина в комбинации с тромболитическим средством известно из международной заявки WO 91/01142.
Тромбин можно ингибировать также благодаря пептиду, который производится от амино-концевой последовательности человеческого рецептора тромбина [Vu et al., Nature 253, 674-677 (1991)]. Рецептор тромбина в амино-концевой области содержит связывающую тромбин последовательность с соседним местом расщепления для тромбина. Связывающая тромбин область рецептора по структуре очень похожа на карбокси-концевую область гирудина. Рецептор активируется тромбином тем, что последовательность рецептора расщепляется. На основании сродства между рецептором и тромбином фрагмент рецептора с областью связывания и модифицированным местом расщепления действует как ингибитор тромбина.
Также тромбин можно ингибировать за счет пептида, который производится от аминокислот 41-57 гемадина [Strube et al., J. Biol. Chem. 268, 8590-8595 (1993)].
Положенная в основу изобретения задача заключается в разработке биологически активных веществ для лечения тромботически обусловленных закупорок сосудов, которые в течение очень короткого времени вызывают полный тромболиз и одновременно предотвращают новую закупорку сосудов после, прежде всего, успешного тромболиза. Далее с помощью этих биологически активных веществ нужно избегать системного активирования плазминогена.
В настоящее время найдено, что предъявляемым к таким биологически активным веществам высоким требованиям удовлетворяют определенные бифункциональные варианты урокиназы.
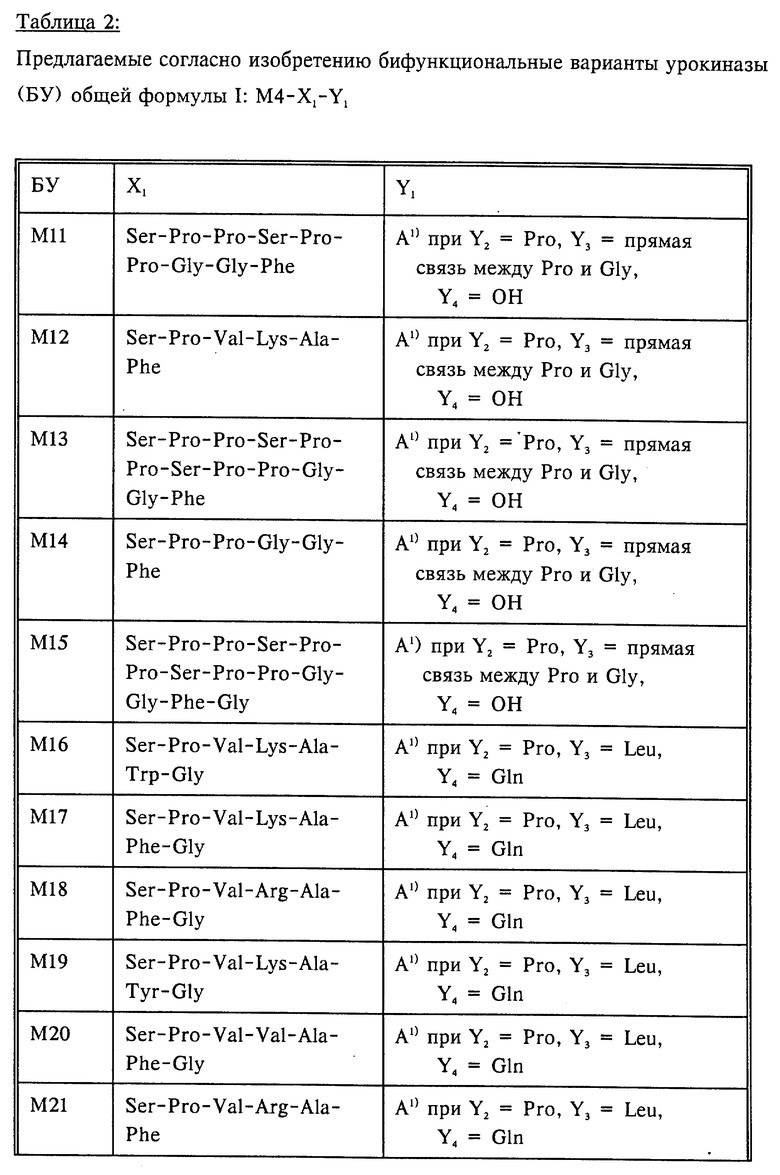
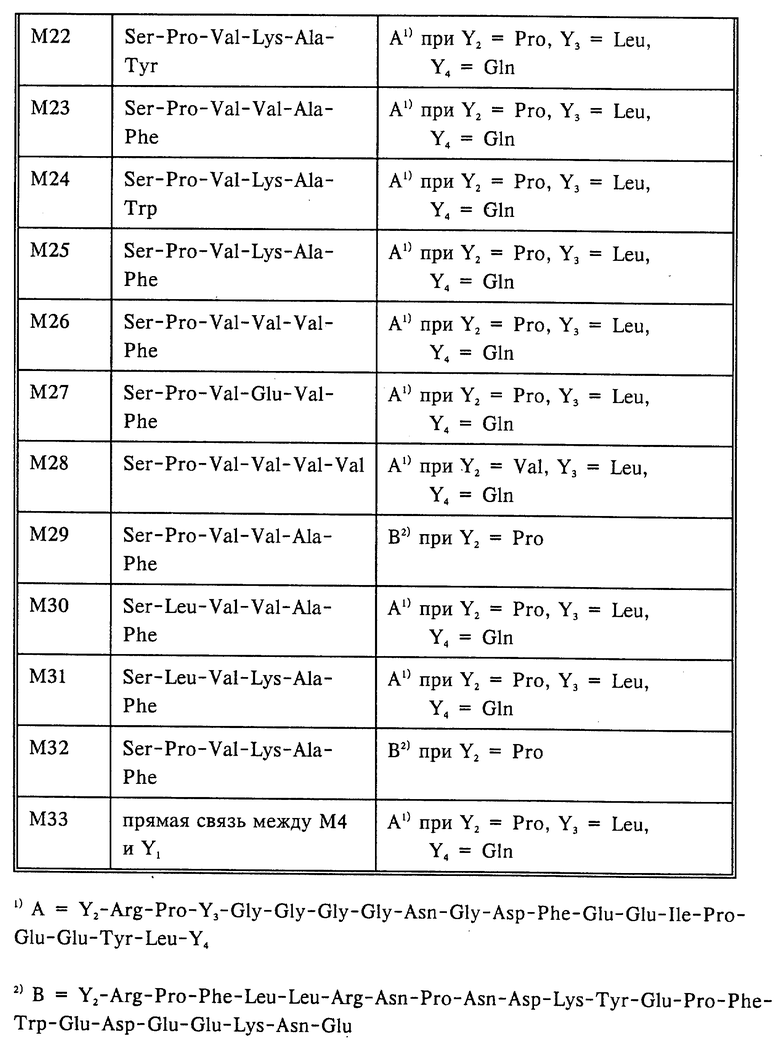
Поэтому предметом изобретения являются бифункциональные варианты урокиназы общей формулы I
M4-X1-Y1,
где M4 обозначает аминокислотную последовательность 47Ser - 411Leu негликозилированной проурокиназы согласно фиг.1;
X1 обозначает прямую связь между M4 и Y1, или пептид с последовательностью
Ser-Pro-Pro-Ser-Pro-Pro-Gly-Gly-Phe,
или
Ser-Pro-Pro-Ser-Pro-Pro-Ser-Pro-Pro-Gly-Gly-Phe,
или
Ser-Pro-Pro-Ser-Pro-Pro-Ser-Pro-Pro-Gly-Gly-Phe-Gly,
или
пептидную последовательность общей формулы II
Ser-X2-X3-X4-X5-X6-X7
причем X2 обозначает Pro или Leu, X3 обозначает Val или Pro, X4 обозначает Lys, Val, Arg, Gly или Glu, X5 обозначает Ala, Val, Gly, Leu или Ile, X6 обозначает Phe, Trp, Tyr или Val и X7 обозначает Gly, либо обозначает прямую связь между X6 и Y1;
и
Y1 обозначает пептид с последовательностью
Y2-Arg-Pro-Y3-Gly-Gly-Gly-Gly-Asn-Gly-Asp-Phe-Glu- Glu-Ile-Pro-Glu-Glu-Tyr-Leu-Y4
или
Y2-Arg-Pro-Phe-Leu-Leu-Arg-Asn-Pro-Asn- Asp-Lys-Tyr-Glu-Pro-Phe-Trp-Glu-Asp-Glu-Glu -Lys-Asn-Glu
или
Y2-Arg-Pro-Ser-Ser-Glu-Phe-Glu-Glu-Phe-Glu-Ile-Asp-Glu- Glu-Glu-Lys
где Y2 обозначает Pro или Val; Y3 обозначает Leu либо прямую связь между Pro и Gly; и Y4 обозначает Gln, либо гидроксильную группу.
В бифункциональных вариантах урокиназы общей формулы I, в которой Y1 обозначает пептид с последовательностью
Y2-Arg-Pro-Y3-Gly-Gly-Gly-Gly-Asn-Gly-Asp-Phe-Glu- Glu-Ile-Pro-Glu-Glu-Tyr-Leu-Y4,
где Y2 обозначает Pro или Val; Y3 обозначает Leu, либо обозначает прямую связь между Pro и Gly; Y4 обозначает Gln, либо обозначает гидроксильную группу, X1 предпочтительно обозначает пептидную последовательность общей формулы II
Ser-X2-X3-X4-X5-X6-X7
где X2 обозначает Pro или Leu; X3 обозначает Val; X4 обозначает Arg; X5 обозначает Ala, Val или Gly; X6 обозначает Phe, Trp, Tyr или Val; и X7 обозначает Gly, либо обозначает прямую связь между X6 и Y1. В этих бифункциональных вариантах урокиназы особенно предпочтительны пептидные последовательности общей формулы II, в которых X2 обозначает Pro или Leu; X3 обозначает Val; X4 обозначает Lys или Val; X5 обозначает Ala или Val; X6 обозначает Phe, Trp или Tyr; и X7 обозначает Gly, либо обозначает прямую связь между X6 и Y1; и прежде всего такие, в которых X7 обозначает прямую связь между X6 и Y1.
В бифункциональных вариантах урокиназы общей формулы I, где Y1 обозначает пептид с последовательностью
Y2-Arg-Pro-Phe-Leu-Leu-Arg-Asn-Pro-Asn-Asp-Lys-Tyr-Glu- Pro-Phe-Trp-Glu-Asp-Glu-Glu-Lys-Asn-Glu
где Y2 обозначает Pro или Val; X1 обозначает предпочтительно пептидную последовательность общей формулы II
Ser-X2-X3-X4-X5-X6-X7
где X2 обозначает Pro или Leu; X3 обозначает Val; X4 обозначает Lys или Val; X5 обозначает Ala или Val; X6 обозначает Phe или Trp; и X7 обозначает прямую связь между X6 и Y1.
По сравнению с известными активаторами плазминогена и известными смесями из активатора плазминогена и ингибитора тромбина предлагаемые согласно изобретению бифункциональные варианты урокиназы отличаются более сильным фибринолитическим действием, связанным с непредусматриваемо хорошими, ингибирующими тромбин, свойствами. Кроме того, предлагаемыми согласно изобретению полипептидами неожиданно в явно меньших количествах потребляется фибриноген плазмы. Следовательно, значительно более высокая специфичность по отношению к фибрину, в особенности также по сравнению с известными смесями активатора плазминогена и ингибитором тромбина, способствует тому, что на способность к свертыванию крови оказывается только незначительное влияние и сводится к минимуму опасность неконтролируемых кровотечений как возможного осложнения системного разрушения фибриногена. Высокая специфичность по отношению к фибрину предлагаемых согласно изобретению вариантов урокиназы, таким образом, делает возможным введение лечебного средства с явно сниженным риском кровотечения по сравнению с введением известных тромболитических средств.
Бифункциональные варианты урокиназы общей формулы I токсикологически безопасны, так что их как таковые в пригодных фармацевтических композициях можно вводить пациентам с обусловленными тромбозом закупорками сосудов.
Другим предметом изобретения поэтому являются тромболитические средства, которые в качестве биологически активного вещества содержат бифункциональный вариант урокиназы общей формулы I.
Для лечения тромботически обусловленной закупорки сосудов, например, инфаркта сердца, инфаркта головного мозга, периферической острой закупорки артерий, эмболии легочной артерии и глубоких тромбозов вен ног и тазовых вен, необходимы 0,1-1 мг/кг предлагаемого согласно изобретению полипептида. Бифункциональные варианты урокиназы можно вводить внутривенно и в особенности путем инъекций.
Предлагаемые согласно изобретению тромболитические средства наряду с по меньшей мере одним бифункциональным вариантом урокиназы содержат вспомогательные вещества, например, носители, растворители, разбавители, красители и связующие. Выбор вспомогательных веществ, а также используемых количеств этих веществ зависит от того, как должно вводиться лекарственное средство, и не вызывает у специалиста никаких проблем.
Получение бифункциональных вариантов урокиназы осуществляют с помощью способов генной инженерии. Предметом изобретения поэтому являются также плазмиды, используемые при получении бифункциональных вариантов урокиназы общей формулы I, оперон которых содержит регулируемый промотор, активную в качестве места связывания рибосом Shine-Dalgarno-последовательность, стартовый кодон, синтетический структурный ген для бифункционального варианта урокиназы общей формулы I и ниже структурного гена - один или два терминатора.
В качестве регулируемого промотора в особенности пригоден trp-промотор или tac-промотор. В качестве терминатора предпочтительно используется trp-A-терминатор и/или tet A/orf-L-терминатор из Tn 10.
В контрольной области предлагаемой согласно изобретению плазмиды расстояние между Shine-Dalgarno-последовательностью и стартовым кодоном составляет 6-12, предпочтительно 8-10, нуклеотидов.
Экспрессия предлагаемой согласно изобретению плазмиды осуществляется в штаммах Escherichia coli, в особенности штаммах Escherichia coli группы K 12, например, E. coli K 12 JM 101 (ATCC 33876), E.coli K 12 JM 103 (ATCC 39403), E. coli K 12 JM 105 (DSM 4162) и E.coli K 12 DH 1 (ATCC 33849). В бактериальной клетке предлагаемые согласно изобретению бифункциональные варианты урокиназы общей формулы I образуются с высоким выходом в тельцах-включениях, в которых протеин находится в денатурированной форме. После изолирования телец-включений денатурированный протеин под воздействием редокс-системы протеинохимически образует складчатую желательную третичную структуру.
Примеры
1) Получение, выделение и очистка предлагаемых согласно изобретению бифункциональных вариантов урокиназы
а) Осуществление клонирования
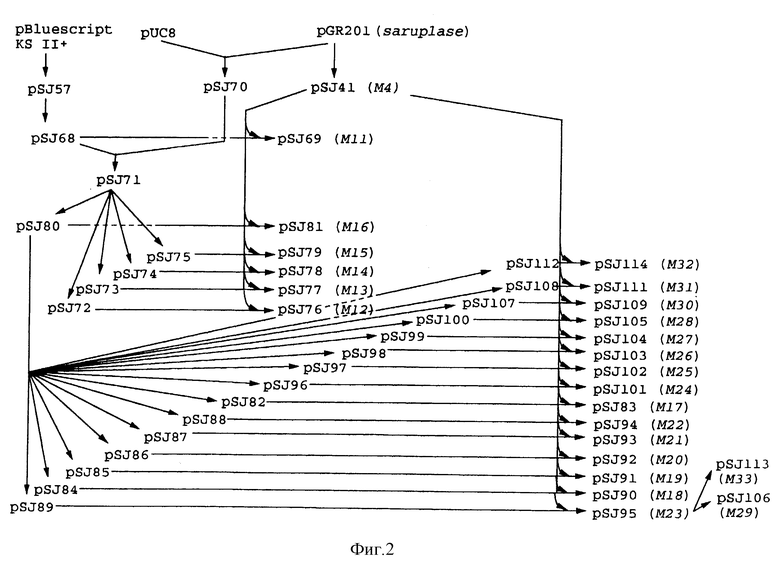
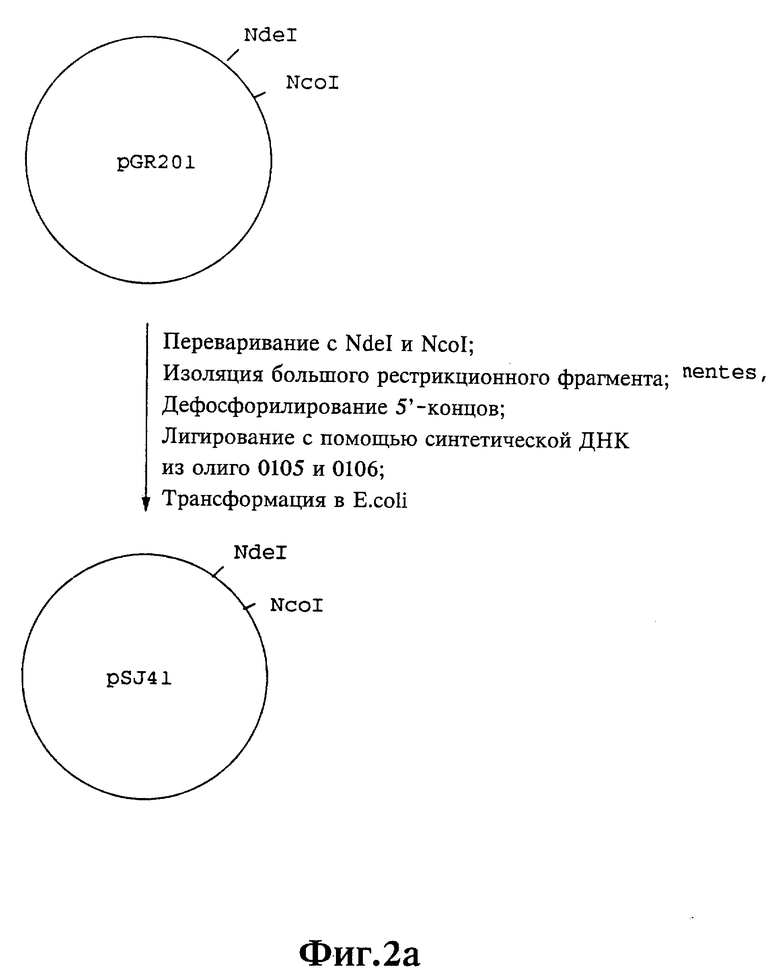
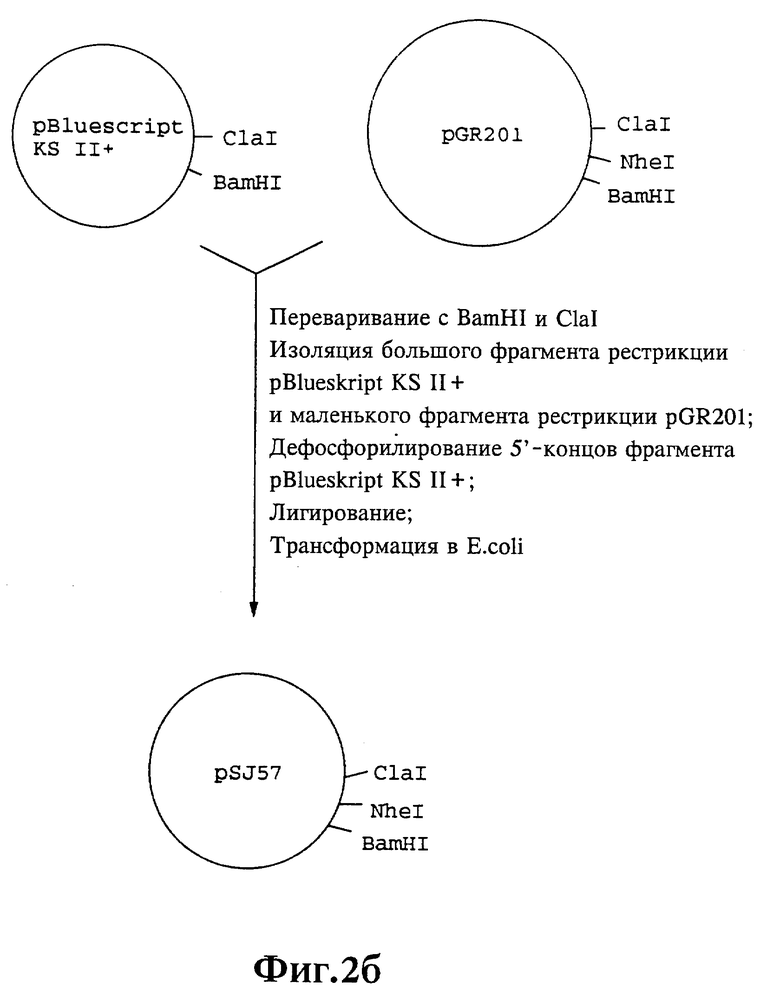
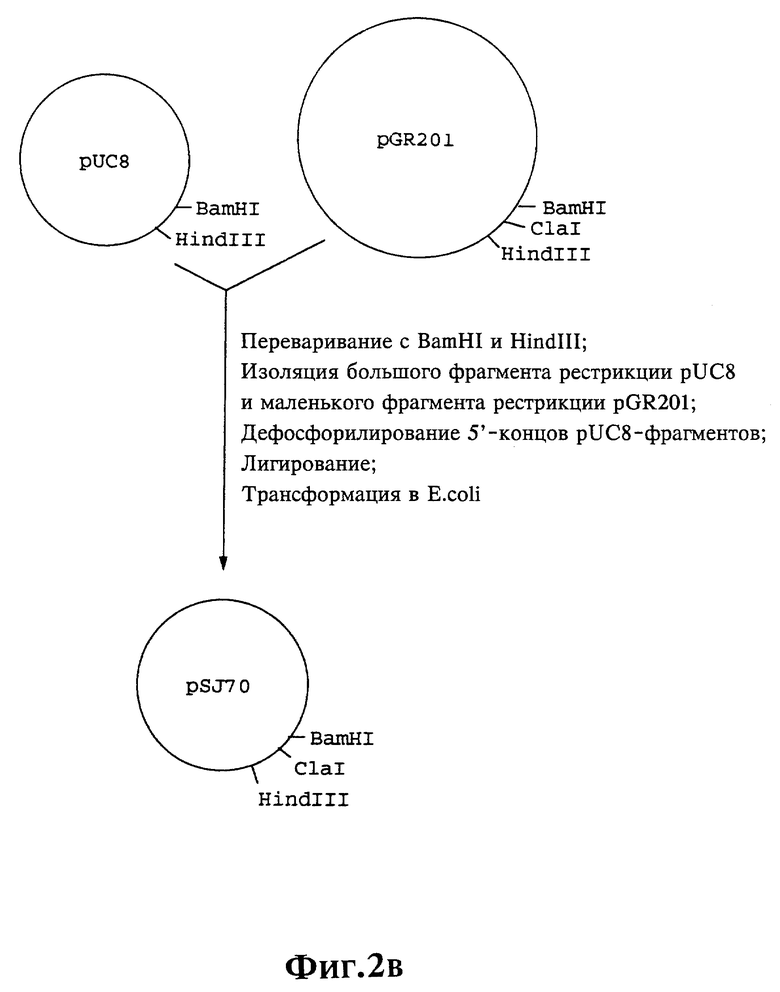
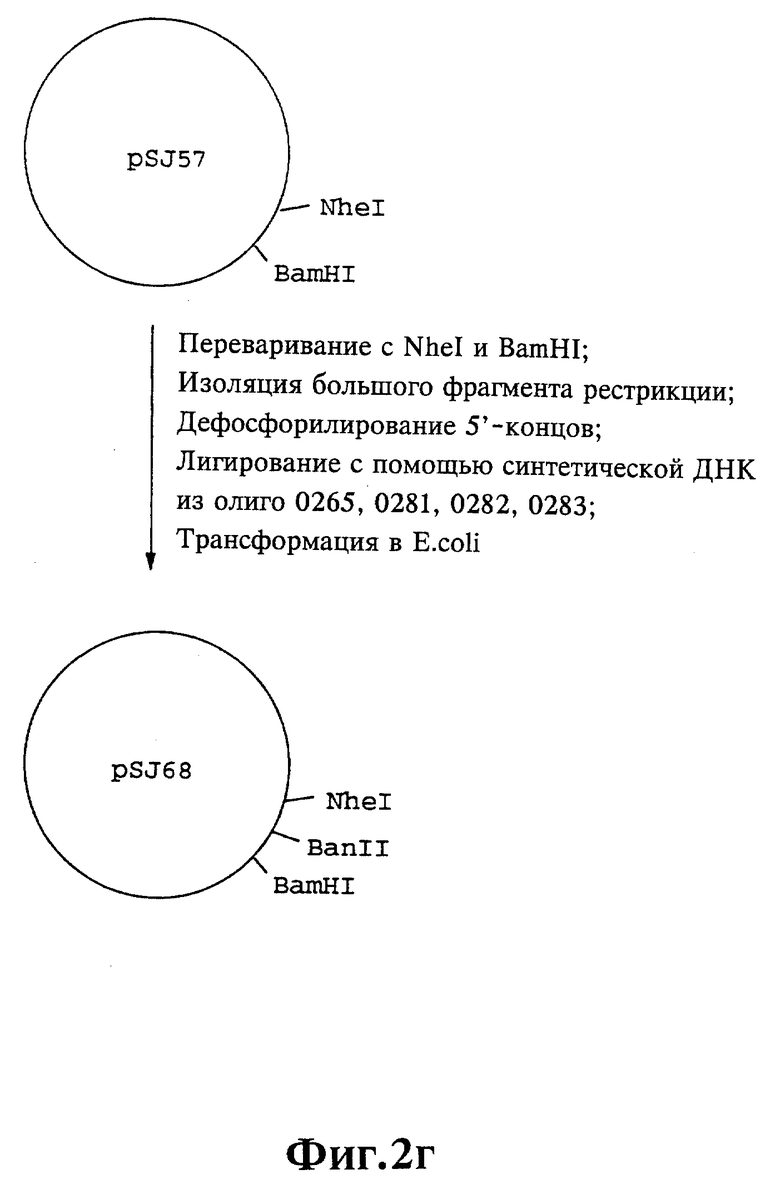
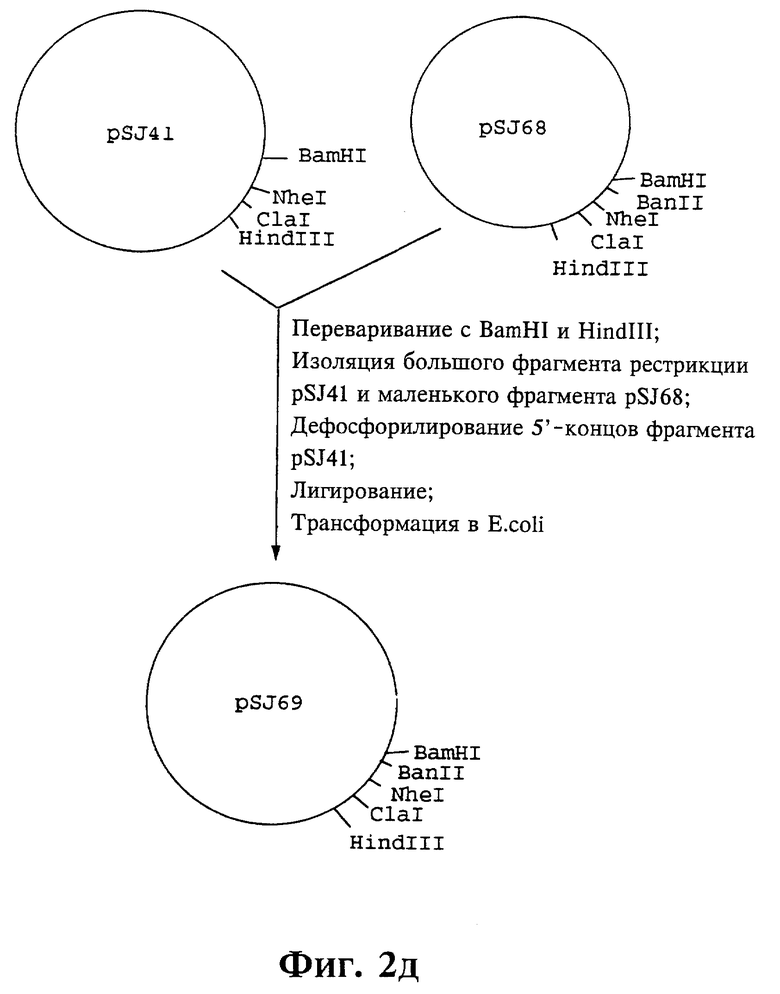
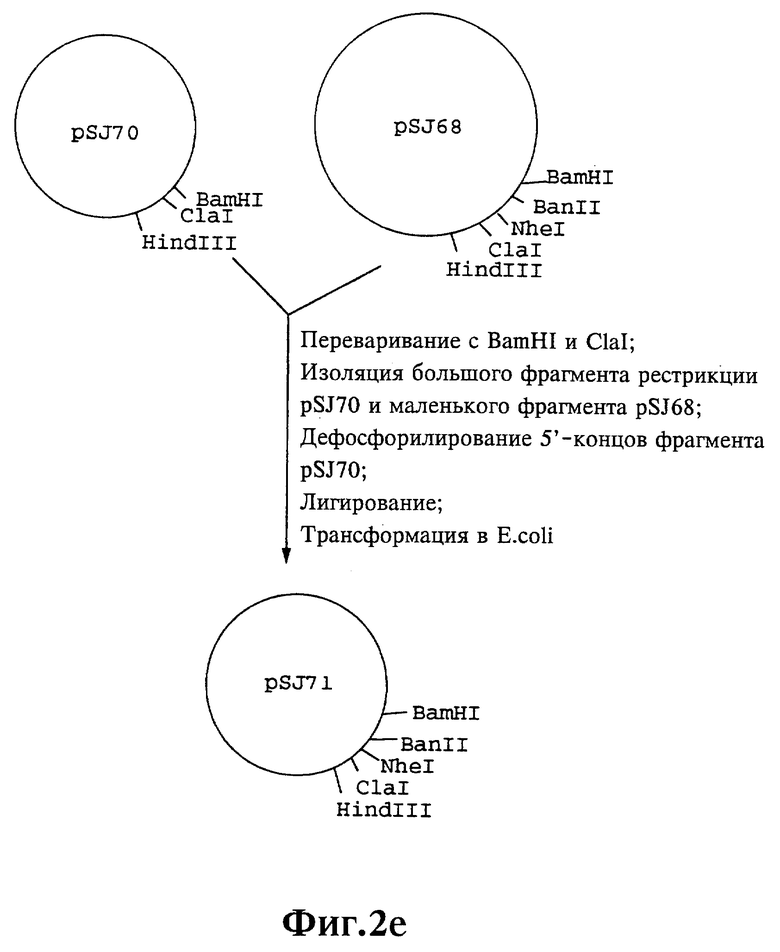
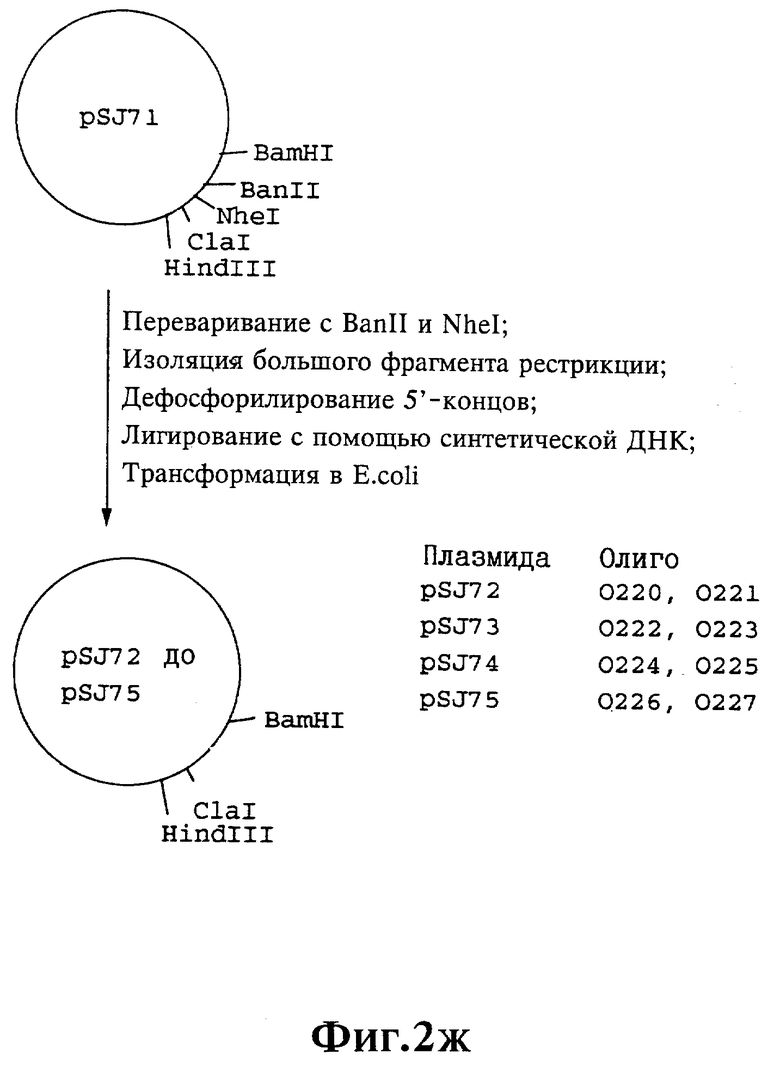
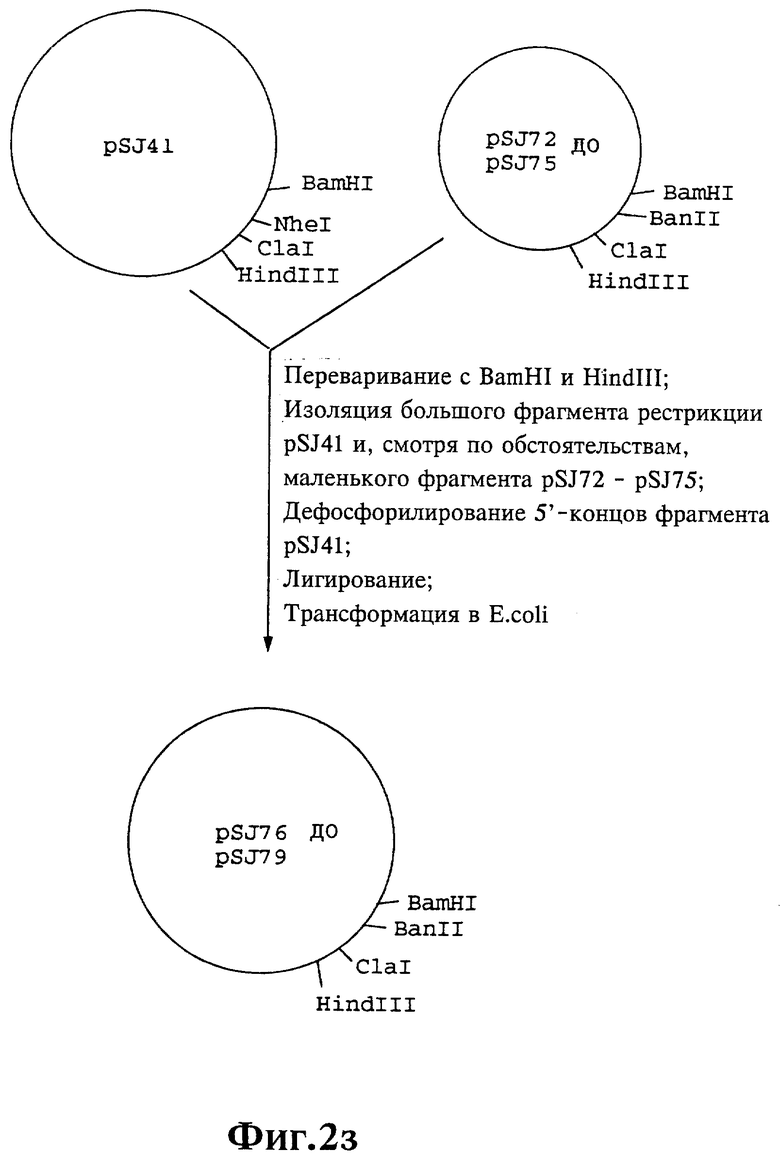
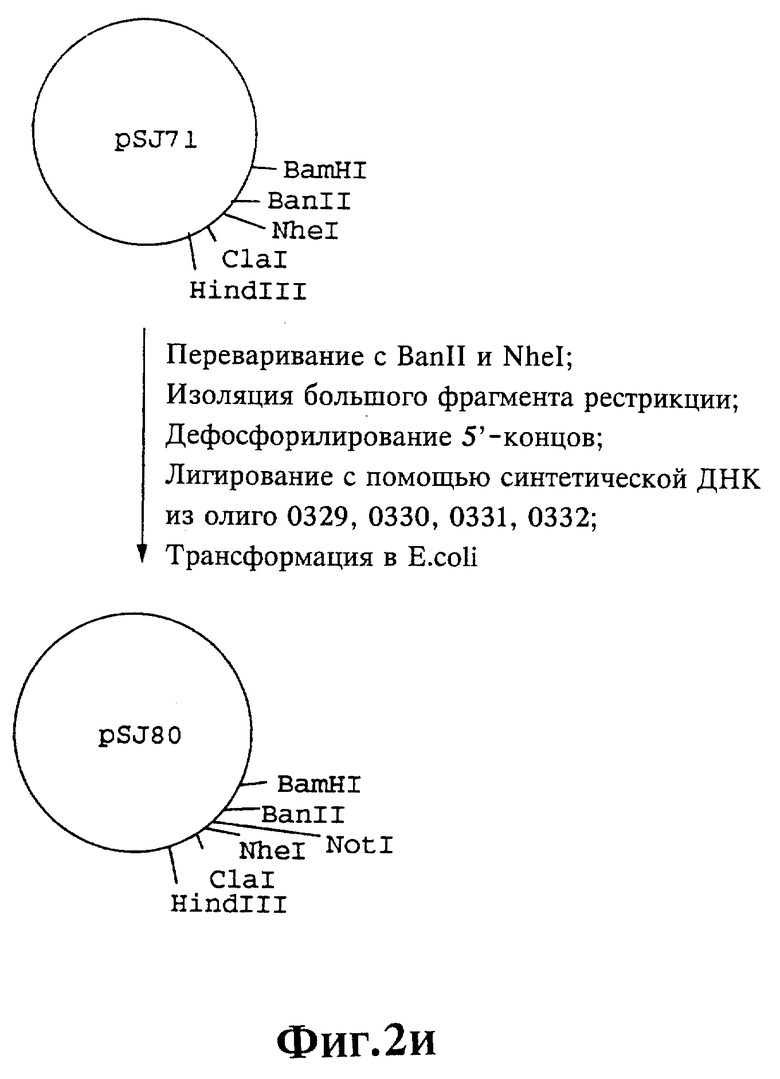
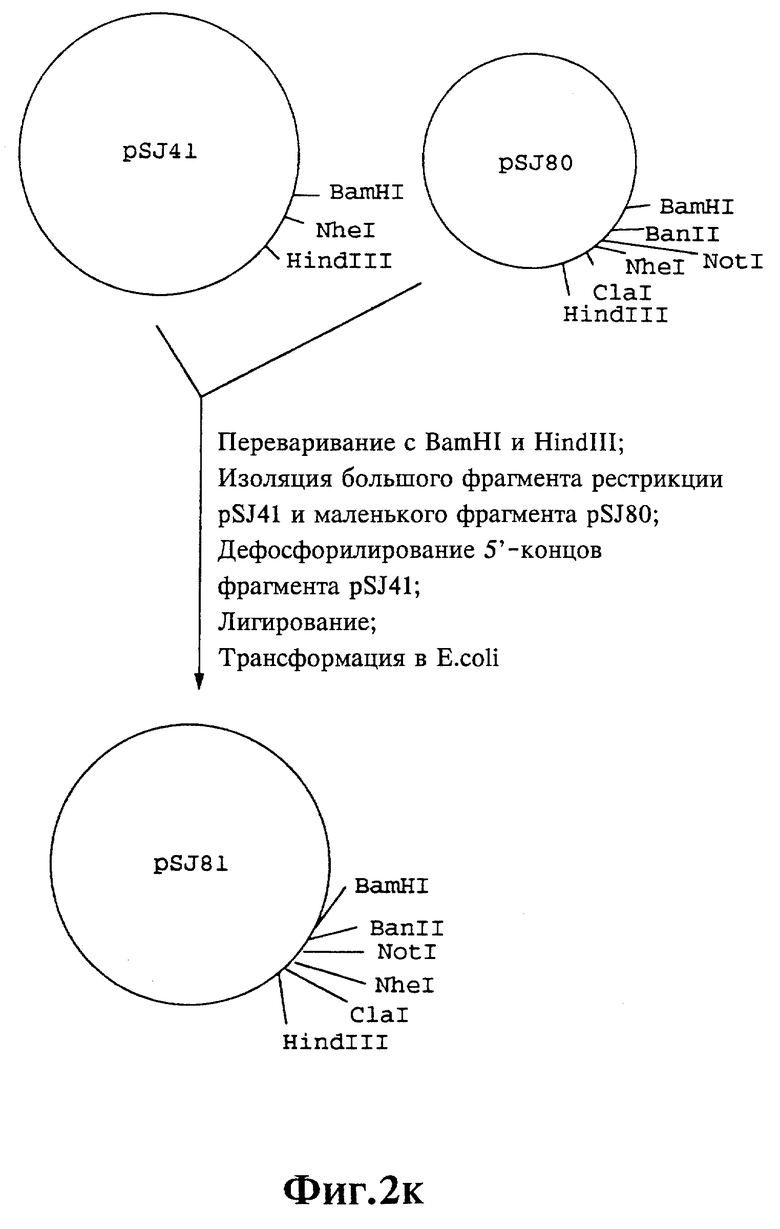
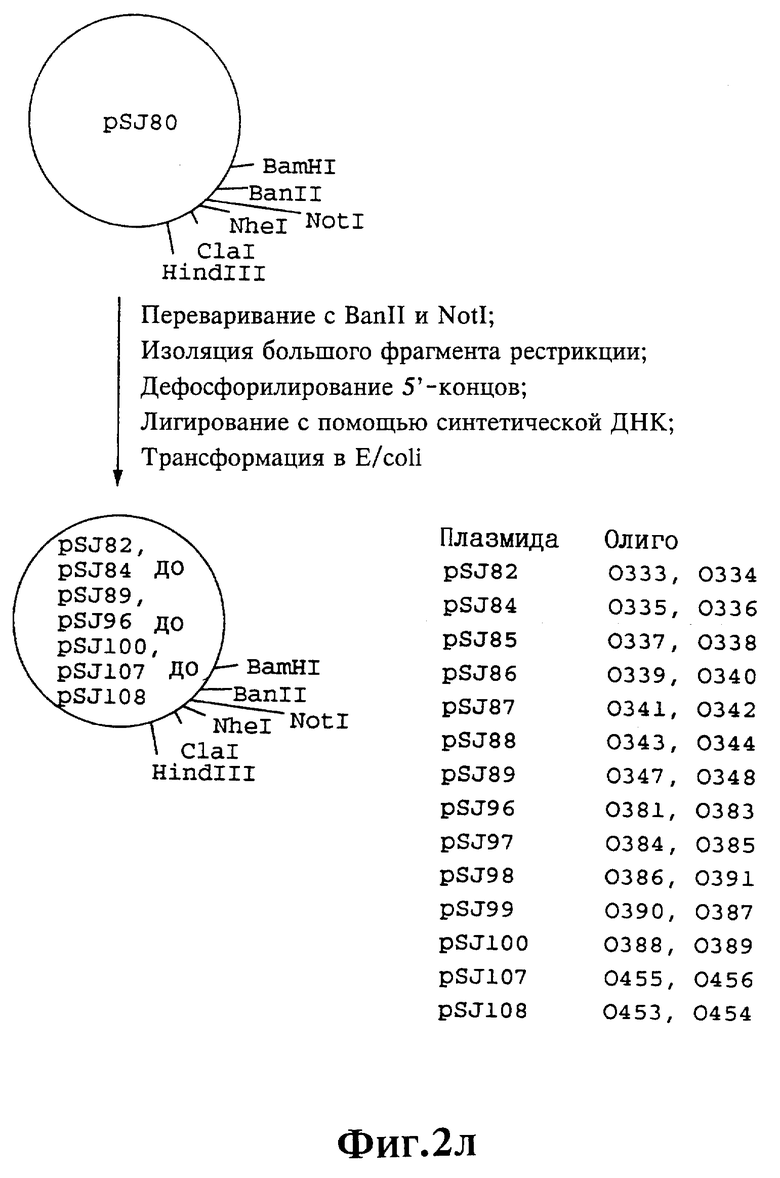
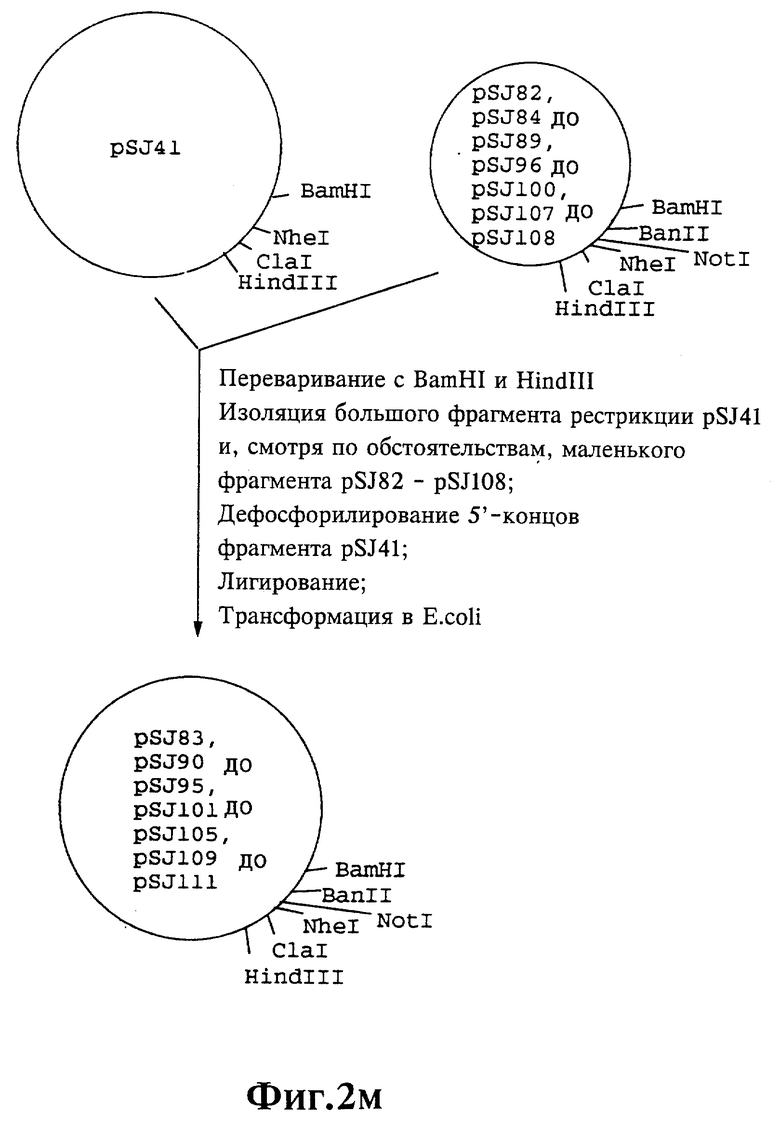
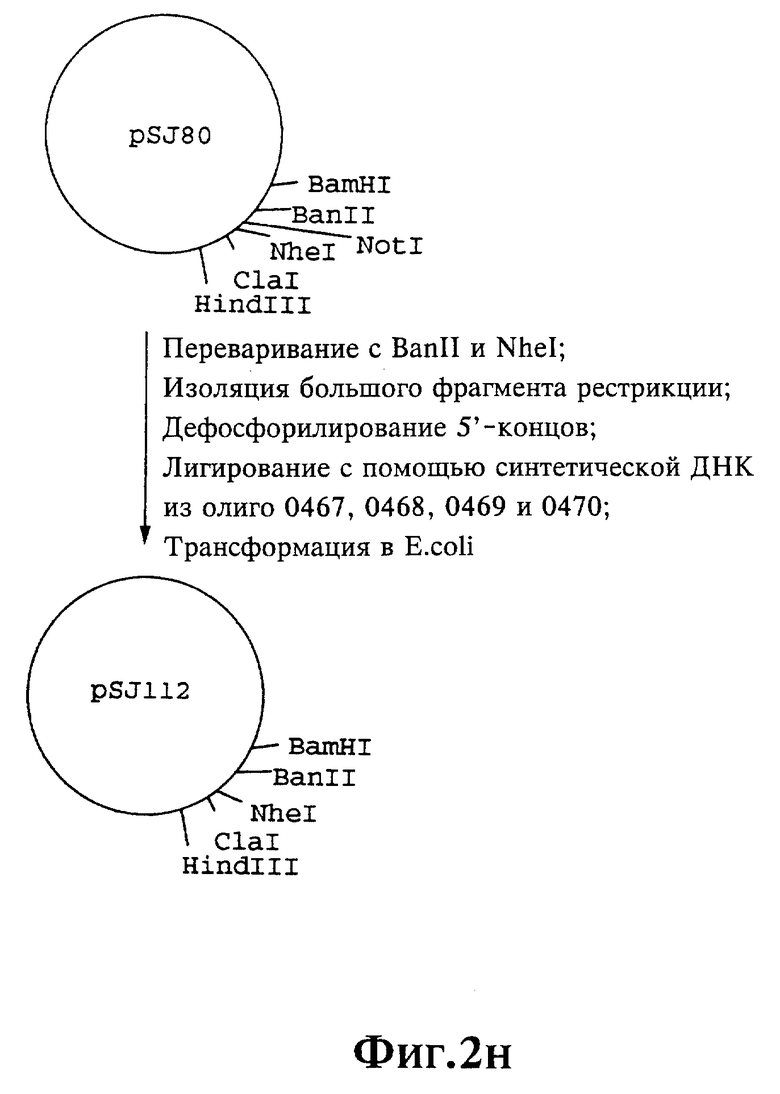
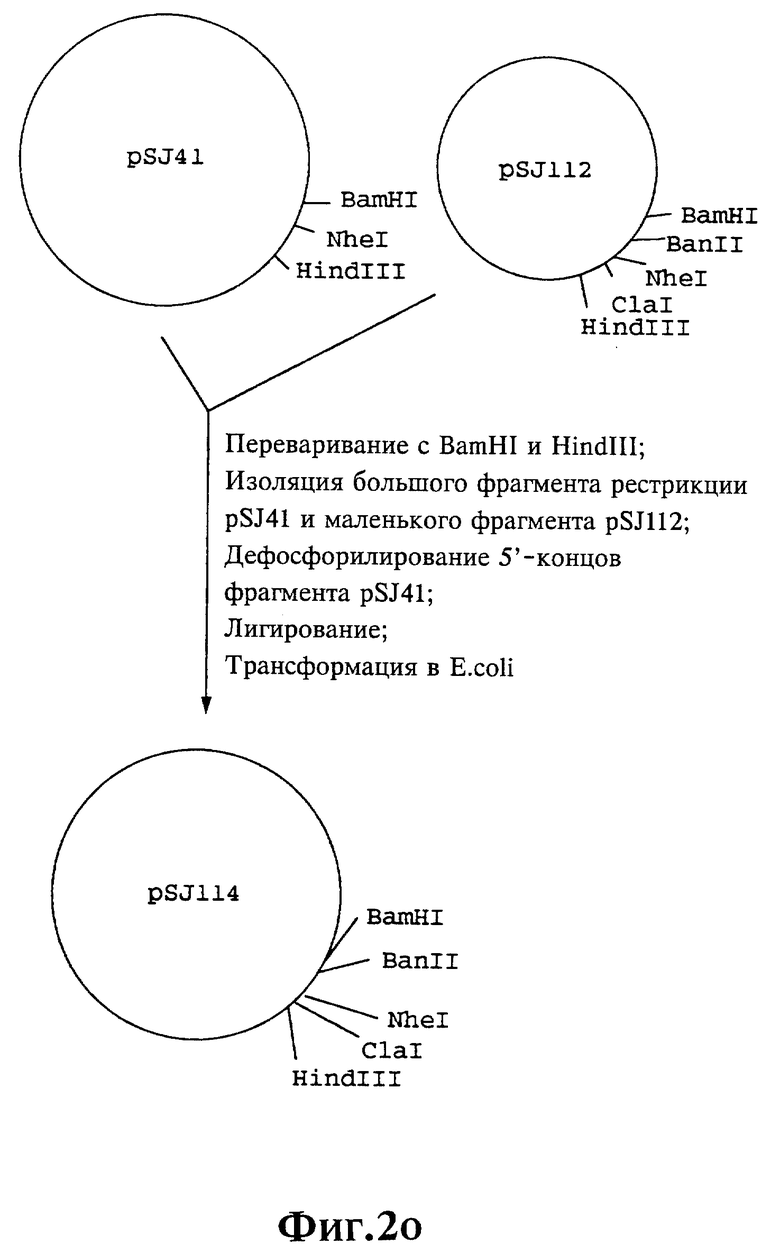
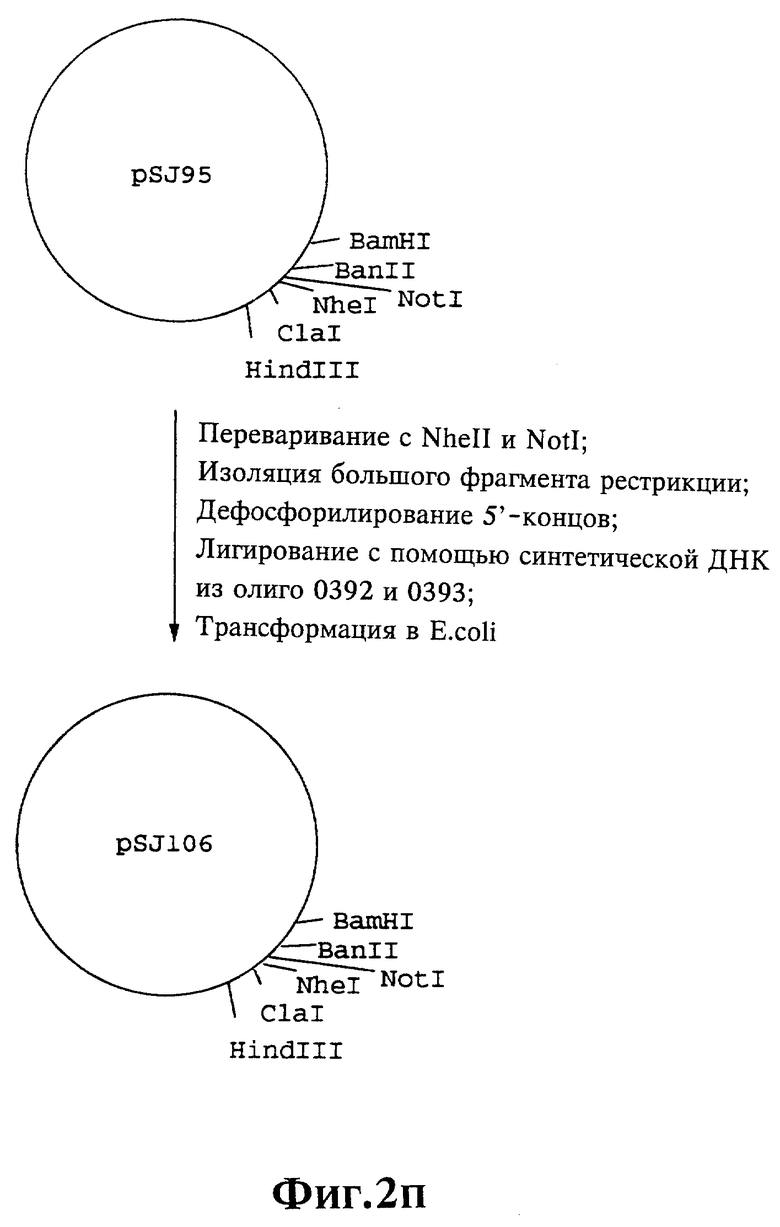
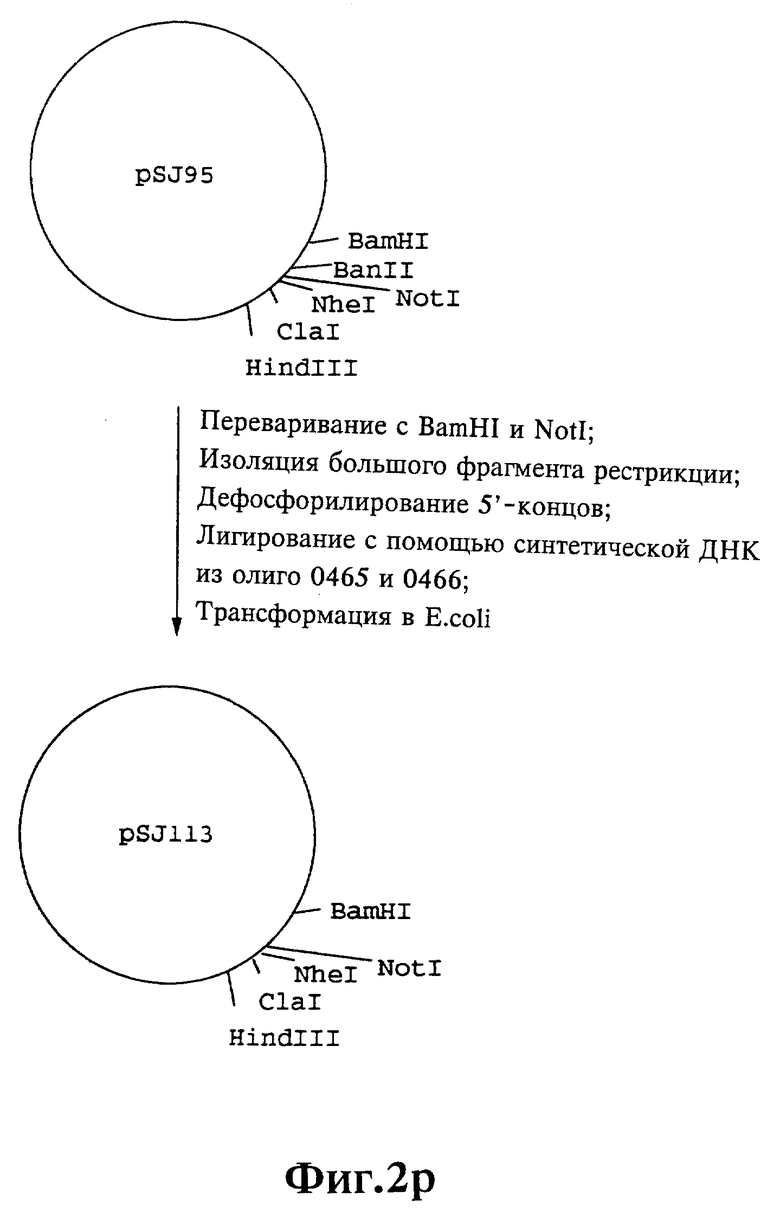
Плазмиды экспрессии для получения с помощью генной инженерии предлагаемых согласно изобретению полипептидов в Escherichia coli получают известным образом. Последовательность отдельных стадий получения представлена на фиг. 2 и 2a - 2p. Исходными продуктами для получения плазмиды являются плазмиды pBlueskript KS II+ (фирма Stratagene, Гейдельберг), pUC8 (фирма Pharmacia, Фрайбург) и pGR201. pGR201 идентична плазмиде pBF160, описанной в европейском патенте ЕР 408 945 и Appl. Microbiol. Biotechn. 36, 640-649 (1992). Рестрикционные эндонуклеазы BanII, BamHI, ClaI, HindIII, NcoI, NdeI, NheI и NotI, а также модифицирующие ДНК ферменты, как щелочная фосфотаза, T4-лигаза, T4-киназа и T7-полимераза, выпускаются фирмами Pharmacia, Stratagene, Boehringer (Маннхайм) и Gibco (Эггенштейн). Изменения плазмид во время их получения контролируют путем рестрикционного анализа и ДНК-секвенирования. ДНК-секвенирование осуществляют по методикам изготовителя с помощью набора реактивов фирмы Pharmacia. При получении плазмид используют различные олигодезоксирибонуклеотиды (олиго), последовательности которых вместе с относящимися к ним обозначениями указаны в таблице 1.
Олигодезоксирибонуклеотиды готовят в детритилированной форме в 0,1 мкмоль-масштабе с помощью синтезатора (модель 391) фирмы Applied Biosystems (Вайтерштадт) по указаниям изготовителя при применении b-цианоэтилзащищенных диизопропиламинофосфоамидитов. По 100 пмоль олигодезоксирибонуклеотида фосфолируют в 50 мМ три(гидроксиметил)аминометане/HCl (Трис/HCl), 10 мМ хлорида магния и 5 мМ дитиотреитола при значении pH 7,5 с помощью ферментной единицы T4-киназы в присутствии 10 мМ аденозинтрифосфата и затем в том же буфере преобразуют в двунитевые молекулы ДНК. Полученные синтетические двунитевые молекулы ДНК очищают с помощью гель-электрофореза на полиакриламидном геле (5% полиакриламида) и затем используют в лигировании с соответственно приготовленными плазмидами. Приготовление плазмид путем переваривания с помощью рестрикционных ферментов, выделения соответствующих фрагментов рестрикции и дефосфорилирования 5'-концов, последующее лигирование и превращение в E.coli K 12 JM 103, а также, как и все остальные генно-инженерные работы осуществляют известным образом и представленным в работе Sambrook et al в "Molecular Cloning: A Laboratory Manual", 2-е издание, Cold Spring Harbor Laboratory Press, Cold Spring Harbour, USA, 1989.
б) Получение покоящихся культур и ферментация
Рекомбинантные плазмиды экспрессии pSJ69, pSJ76, pSJ77, pSJ78, pSJ79, pSJ81, pSJ83, pSJ90, pSJ91, pSJ92, pSJ93, pSJ94, pSJ95, pSJ101, pSJ102, pSJ103, pSJ104, pSJ105, pSJ106, pSJ109, pSJ111, pSJ114 и pSJ113 вносят в E. coli K 12 JM 103 (ATCC 39403) и помещают на стандарт - I-агар (150 мг/л ампициллина) (Sambrook et al. "Molecular Cloning: A Laboratory Manual"). Соответственно, отдельную колонию каждой трансформации культивируют в стандарт I-среде (pH 7,0; 150 мг/л ампициллина) при 20oC вплоть до оптической плотности (ОП) = 1 при 578 нм, по 5 порций по 2 мл в качестве покоящейся культуры при добавке диметилсульфоксида (ДМСО) (конечная концентрация 7,5%), замораживают в жидком азоте и хранят при -70oC. Для получения бифункциональных вариантов урокиназы, соответственно, 1 мл каждой покоящейся культуры суспендируют в 20 мл стандарт I-среды (pH 7,0; 150 мг/л ампициллина) и культивируют при 37oC до ОП = 1 при 578 нм.
Затем общее количество полученной культуры суспендируют в 1 л стандарт I-среды (pH 7,0; 150 мг/л ампициллина) и ферментируют в колбах при встряхивании при 37oC. Индукцию осуществляют путем добавки 2 мл раствора индолакриловой кислоты (60 мг в 2 мл этанола) при ОП 0,5-1 при 578 нм.
в) Испытание экспрессии
Для испытания (проверки) скорости экспрессии (Ploug-единиц на ОП на мл) непосредственно перед индукцией и каждый час после индукции (в целом 6 часов) клетки, соответственно, 1 мл суспензии клеток с ОП = 1 при 578 нм, отделяют центрифугированием. Отделенные центрифугированием клетки переводят в растворимую форму с помощью лизоцима [1 мг лизоцима на мл в 15 50 мМ Трис-HCl-буфере, pH 8,0, 50 мМ этилендиаминтетрауксусной кислоты (ЭДТК) и 15 объемных % сахарозы]. Лизированные клетки растворяют в 4-5 М растворе гуанидинийгидрохлорида и после разбавления до 1,2 М гуанидинийгидрохлорида при добавке восстановителя (глутатион или цистеин) в течение 2-5 часов подвергают реакции образования складчатой структуры [Winkler et al., Biochemistry 25, 4041-4045 (1986)]. Полученные однонитевые бифункциональные варианты урокиназы путем добавки плазмина превращают в соответствующие двунитевые варианты урокиназы, активность которых определяется с помощью хромогенного субстрата пиро-Glu-Gly-Arg-p-нитроанилида, который расщепляется только двунитевыми активными урокиназами. Активирование предлагаемых согласно изобретению бифункциональных вариантов урокиназы с помощью плазмина осуществляют в 50 мМ Трис/HCl-буфере, 12 мМ хлориде натрия, 0,02% твина 80 при pH 7,4 и 37oC. Соотношение бифункционального варианта урокиназы к плазмину составляет примерно 100-1500: 1, в расчете на молярность, или примерно 8000-36000:1, в расчете на ферментные единицы. Тест-инкубацию осуществляют в 50 мМ Трис/HCl-буфере и 38 мМ хлориде натрия при pH 8,8 в присутствии 0,36 мкМ апротинина (для ингибирования плазмина) и 0,27 мМ субстрата пиро-Glu- Gly-Arg-р-нитроанилида при 37oC. В зависимости от концентрации бифункционального варианта урокиназы реакцию прекращают после инкубации в течение 5-60 минут путем добавления 50%-ной уксусной кислоты и измеряют экстинкцию при 405 нм. Согласно указаниям изготовителя субстрата (Kabi Vitrum, Швеция) при этом способе работы изменение экстинкции на 0,05 в минуту при 405 нм соответствует активности урокиназы Ploug-единиц на мл тест-раствора. Предлагаемые согласно изобретению бифункциональные варианты урокиназы обладают удельными активностями 120000-155000 Ploug-единиц на мг очищенного протеина. Содержание протеина в растворах определяется с помощью ВСА-теста фирмы Pierce.
г) Выделение и очистка
Спустя 5-6 часов после индукции заканчивается осуществленная при описанных в пункте 1б) условиях ферментация (плотность 5-6 ОП при 578 нм). Клетки отделяют центрифугированием. Осадок клеток снова суспендируют в 200 мл воды и переводят в растворимую форму в гомогенизаторе высокого давления. После нового центрифугирования осадок, который содержит все количество однонитевого бифункционального варианта урокиназы, растворяют в 500 мл 5М гуанидинийгидрохлорида, 40 мМ цистеина, 1 мМ ЭДТК при значении pH 8,0 и разбавляют с помощью 2000 мл 25 мМ Трис/HCl с значением pH 9,0. Реакция образования складчатой структуры заканчивается спустя примерно 12 часов.
Полученные бифункциональные варианты урокиназы после добавления 8 г силикагеля полностью связываются с силикагелем путем перемешивания в течение 2-х часов. Содержащий вышеуказанные варианты урокиназы силикагель отделяют и промывают ацетатным буфером (pH 4,0). Варианты урокиназы элюируют с помощью 0,5 М тетраметиламмонийхлорида (ТМАХ) в 0,1 М ацетатном буфере (pH 4,0). После двух хроматографических разделений (колонка с хелатом меди и катионообменником) варианты урокиназы получают в чистой форме. Благодаря анализу путем N-концевого секвенирования обнаруживают, во-первых, наличие однонитевой структуры и, во-вторых, желательную амино-концевую последовательность. Протеинохимическое охарактеризовывание измененной карбокси-концевой области отдельных вариантов достигается согласно модифицированному CNBr-расщеплению протеина (растворенного в 1 мл 90%-ной муравьиной кислоты и 1 мл гепта-фтормасляной кислоты) путем расщепления пептидной цепи после триптофановых остатков. Карбокси-концевой пептид перед анализом на секвенирование отделяют с помощью ЖХВД (жидкостная хроматография высокого давления) и очищают.
Все выделенные и указанные в таблице 2 бифункциональные варианты урокиназы в прямом тесте на активность с хромогенным субстратом для урокиназы не показывают никакой или имеют только очень незначительную активность (менее 1200 Ploug-единиц на мг очищенного протеина). Лишь после расщепления с помощью плазмина (условия указаны в пункте 1в)) достигается активность фермента 120000-155000 Ploug-единиц на мг очищенного протеина. Все варианты урокиназы соответственно этому выражаются в E.coli K12 JM103 в виде однонитевых протеинов.
2) Фармакологические исследования
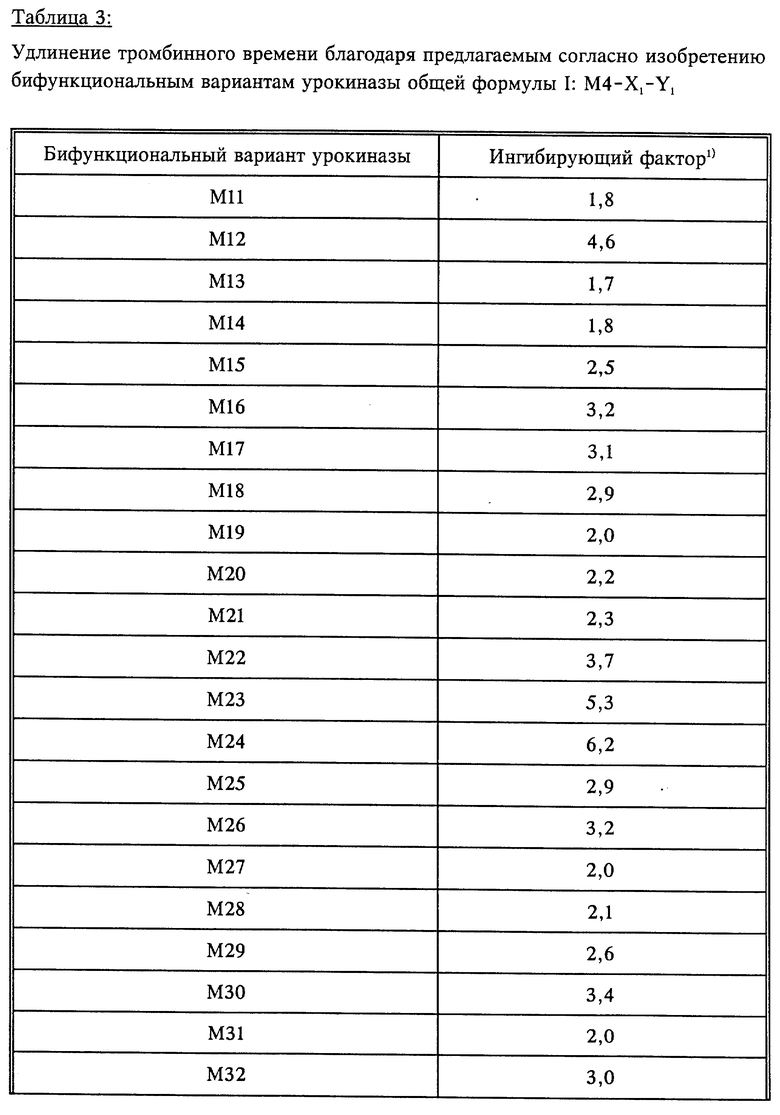
Определение ингибирующего тромбин действия
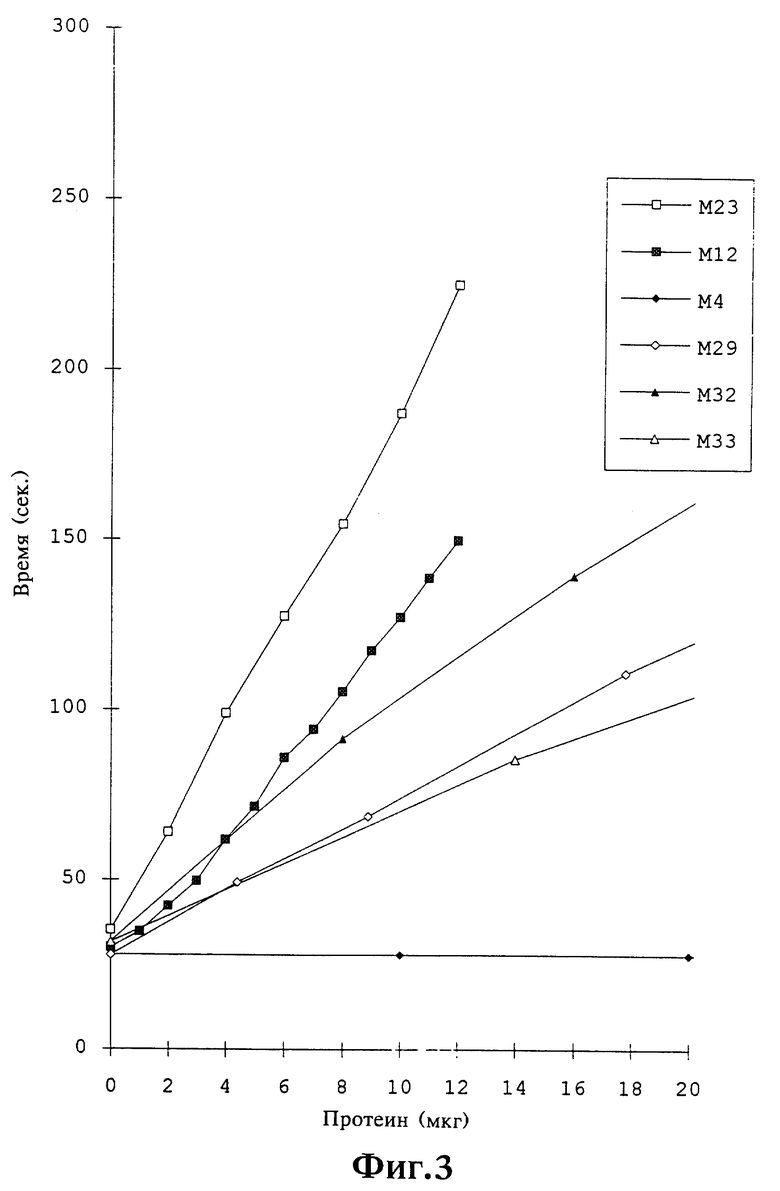
Ингибирующая активность предлагаемых согласно изобретению вариантов урокиназы определяется путем измерения тромбинного времени тем, что 200 мкл 1:10 разбавления человеческой цитратной плазмы в верональном буфере смешивают с 50 мкл раствора тромбина (0,2 единицы) и 50 мкл водного раствора, содержащего 0,5-50 мкг бифункционального варианта урокиназы. Затем измеряют время вплоть до образования нити фибрина. В таблице 3 указаны измеренные ингибирующие факторы, которые указывают на удлинение тромбинного времени в присутствии, соответственно, 10 мкг предлагаемого согласно изобретению бифункционального варианта урокиназы. Также определяли зависящее от концентрации удлинение тромбинного времени, графически представлено на фиг.3 для бифункциональных вариантов урокиназы M2, M23, M29, M32, M33 и в качестве сравнения для M4. В противоположность предлагаемым согласно изобретению бифункциональным вариантам урокиназы время вплоть до свертывания не удлиняется ни за счет M4, то есть для амино-кислотной последовательности 47Ser-411Leu негликозилированной проурокиназы согласно фиг.1, ни за счет негликозилированной проурокиназы (Saruplase), ни за счет самой НУК при дозе 1 мг.
Фармакологические свойства бифункциональных вариантов урокиназы M12 и M23 в эксперименте на животных
На фармакологической модели in vivo испытывают действие бифункциональных вариантов урокиназы M12 и M23 на тромболиз артериальной закупорки сосудов по сравнению с Saruplase (негликозилированная проурокиназа). Для этой цели находящимся под наркозом кроликам во временно изолированный, длиной примерно 1 см сегмент феморальной артерии локально через боковую ветвь путем инъекции вводят тромбин и маркированный с помощью 125J человеческий фибриноген. Благодаря этому образуется тромб, который приводит к полной закупорке сосуда. Размер образовавшегося тромба определяют за счет инкорпорированной радиоактивности человеческого фибрина с помощью экстракорпорального гамма-детектора. Электромагнитное измерение кровотока и учет радиоактивности тромба осуществляют непрерывно в течение всего периода опыта. Таким образом, фибринолитическое действие количественно определяют как в виде реперфузии закупоренного за счет тромба сосуда, так и также за счет разрушения радиоактивно маркированного инкорпорированного фибрина тромба. Перед введением предлагаемых согласно изобретению бифункциональных вариантов урокиназы, а также спустя 30, 60 и 90 минут после введения вариантов урокиназы отбирают пробы крови, в которых определяют концентрацию фибриногена в плазме. Вводят по 6 мг/кг M2, M23 и Saruplase в виде внутривенных инъекций. Так как M12 и M23 в противоположность Saruplase обладают дополнительным антикоагулирующим действием, то в 4-й опытной группе Saruplase комбинируют с антикоагулянтом гепарином (150 ед/кг внутривенно). Размер групп составляет соответственно 6 животных.
В течение 90-минутной продолжительности опыта тромболиз маркированного фибрина тромба составляет 46±11% для M12; 43±12% для M23; 22±5% для Saruplase и 39±15% для комбинации Saruplase-гепарин. Введение в виде больших пилюль M12 и M23 у всех 6 животных приводит к открытию закупоренного тромбом сосуда; путем введения Saruplase у 5 из 6 животных и путем введения Saruplase с гепарином у 4 из 6 животных сосуд реперфундируется. Максимальная высота потока реперфузии (в % от исходного значения) составляет 95±10% для M12 и 82±9% для M23 и значительно отличается от максимальной высоты потока реперфузии 43±12% для Saruplase. Максимальная высота потока реперфузии 58±8% при обработке с помощью Saruplase и гепарина находится между результатами для M12 и M23, с одной стороны, и Saruplase, с другой стороны, и по обеим сторонам различается незначительно. Полное фибринолитическое действие определяется как площадь реперфузионного потока (в % от исходного потока) в течение продолжительности опыта 90 минут. Этот общий эффект составил 4,502±1,127%•мин для M12 и 4,270±885%•мин для M23 и для обоих, предлагаемых согласно изобретению вариантов урокиназы, был значительно больше чем значение 1,519±643%•мин для Saruplase. С помощью комбинированной обработки Saruplase-гепарином получили общий эффект 2,217±761%•мин, который незначительно лучше, чем в случае обработки с помощью одной Saruplase, и явно ниже результатов, полученных с M12 и M23. Результаты представлены в таблице 4.
Неожиданно было найдено, что как после введения M12, так и после введения M23 концентрации фибриногена в плазме снижаются значительно меньше, чем после введения Saruplase. Результаты представлены в таблице 5.
Результаты показывают, что предлагаемые согласно изобретению бифункциональные варианты урокиназы M12 и M23 растворяют артериальные тромбы, которые вызывают полную закупорку сосуда, и снова идет кровоток через сосуды, в которых был тромб. Это действие достигается за счет одноразового введения M12, соответственно, M23 животным, которым не вводили гепарин. Неожиданно это более сильное по сравнению с Saruplase фибринолитическое действие M12 и M23 оказалось связано с меньшим потреблением фибриногена плазмы. Это означает, что M12 и M23 обладают значительно более высокой специфичностью к фибрину по сравнению с Saruplase. Лучшее сохранение фибриногена в плазме за счет M12 и M23 по сравнению с Saruplase означает, что способность к свертыванию крови лучше сохраняется и тем самым уменьшается опасность неконтролируемых кровотоков как возможного осложнения системного разрушения фибриногена. M12 и M23 в отношении риска гемостазологических побочных действий тем самым должны быть безопаснее, чем Saruplase.
| название | год | авторы | номер документа |
|---|---|---|---|
| НЕГЛИКОЗИЛИРОВАННЫЙ ПОЛИПЕПТИД СО СВОЙСТВАМИ ПРОУРОКИНАЗЫ, СПОСОБ ЕГО ПОЛУЧЕНИЯ, РЕКОМБИНАНТНАЯ ПЛАЗМИДНАЯ ДНК ДЛЯ ЭКСПРЕССИИ ПОЛИПЕПТИДА И СПОСОБ ЕЕ ПОЛУЧЕНИЯ | 1992 |
|
RU2108387C1 |
| БИФУНКЦИОНАЛЬНЫЙ ПЕПТИД | 2013 |
|
RU2639573C2 |
| РЕКОМБИНАНТНЫЙ ПОЛИПЕПТИД, СПОСОБ ИНГИБИРОВАНИЯ АГРЕГАЦИИ ТРОМБОЦИТОВ, РЕКОМБИНАНТНАЯ ПЛАЗМИДНАЯ ДНК (ВАРИАНТЫ), РЕКОМБИНАНТНЫЙ ШТАММ E.COLI (ВАРИАНТЫ), СПОСОБ ПОЛУЧЕНИЯ ПОЛИПЕПТИДА | 1991 |
|
RU2109816C1 |
| ТРОМБОЛИТИКИ ДЛЯ ВНУТРИСОСУДИСТЫХ ТРОМБОВ | 2020 |
|
RU2822136C1 |
| ЛИОФИЛИЗИРОВАННЫЕ ДНК-СОСТАВЫ ДЛЯ УВЕЛИЧЕННОЙ ЭКСПРЕССИИ ПЛАЗМИДНОЙ ДНК | 2009 |
|
RU2470995C2 |
| Способ получения рекомбинантной плазмидной ДНК и способ получения зимогенной формы белка С человека | 1991 |
|
SU1838411A3 |
| БИФУНКЦИОНАЛЬНЫЕ СВЯЗЫВАЮЩИЕ ПОЛИПЕПТИДЫ | 2019 |
|
RU2806747C2 |
| СПОСОБ ПОЛУЧЕНИЯ ЗИМОГЕННОЙ ФОРМЫ ЧЕЛОВЕЧЕСКОГО БЕЛКА С | 1989 |
|
RU2018535C1 |
| РЕКОМБИНАНТНЫЙ ПОЛИПЕПТИД СО СВОЙСТВАМИ ПЛАЗМИНОГЕНА ЧЕЛОВЕКА ПРЕВРАЩАТЬСЯ ПРИ АКТИВАЦИИ В ПЛАЗМИН, КОТОРЫЙ КАТАЛИЗИРУЕТ РАСЩЕПЛЕНИЕ ФИБРИНА, ФРАГМЕНТ ДНК, КОДИРУЮЩИЙ ПОЛИПЕПТИД, РЕКОМБИНАНТНАЯ ПЛАЗМИДНАЯ ДНК ДЛЯ ЭКСПРЕССИИ ПОЛИПЕПТИДА И ТРАНСФОРМИРОВАННАЯ КЛЕТКА Escherichia coli - ПРОДУЦЕНТ ПОЛИПЕПТИДА | 2009 |
|
RU2432397C2 |
| СПОСОБ ПОЛУЧЕНИЯ БИФУНКЦИОНАЛЬНЫХ БЕЛКОВ И ИХ ПРОИЗВОДНЫХ | 2018 |
|
RU2795970C2 |







Охарактеризован бифункциональный вариант урокиназы, а также способ его получения. Бифункциональный вариант урокиназы может быть использован в качестве тромболитического средства. 8 c. и 6 з.п.ф-лы, 19 ил., 5 табл.
M4-X1-Y1
где M4 обозначает аминокислотную последовательность 47Ser - 411Leu негликозилированной проурокиназы согласно фиг.1;
X1 обозначает прямую связь между M4 и Y1 или пептид с последовательностью Ser-Pro-Pro-Ser-Pro-Pro-Gly-Gly-Phe, или Ser-Pro-Pro-Ser-Pro-Pro-Ser-Pro-Pro-Gly-Gly-Phe, или Ser-Pro-Pro-Ser-Pro-Pro-Ser-Pro-Pro-Gly-Gly-Phe-Gly, или обозначает пептидную последовательность общей формулы II
Ser-X2-X3-X4-X5-X6-X7,
причем X2 обозначает Pro или Leu; X3 обозначает Val или Pro; X4 обозначает Lys, Val, Arg, Gly или Glu; X5 обозначает Ala, Val, Gly, Leu или Ile; X6 обозначает Phe, Trp, Tyr или Val; X7 обозначает Gly или обозначает прямую связь между X6 и Y1;
Y1 обозначает пептид с последовательностью Y2-Arg-Pro-Y3-Gly-Gly-Gly-Gly-Asn-Gly-Asp-Phe-Glu-Glu-Ile-Pro-Glu-Glu-Tyr-Leu-Y4, или Y2-Arg-Pro-Phe-Leu-Leu-Arg-Asn-Pro-Asn-Asp-Lys-Tyr-Glu-Pro-Phe-Trp-Glu-Asp-Glu-Glu-Lys-Asn-Glu, или Y2-Arg-Pro-Ser-Ser-Glu-Phe-Glu-Glu-Phe-Glu-Ile-Asp-Glu-Glu-Glu-Lys, где Y2 обозначает Pro или Val;
Y3 обозначает Leu или обозначает прямую связь между Pro и Gly;
Y4 обозначает Gln или обозначает гидроксильную группу.
| СПОСОБ ПОВЫШЕНИЯ УСТОЙЧИВОСТИ УРОКИНАЗЫ К НАГРЕВАНИЮ | 1993 |
|
RU2061043C1 |
| US 3930944 A, 06.01.76 | |||
| КОРРЕЛЯЦИОННЫЙ ДИСКРИМИНАТОР ВРЕМЕНИ ЗАДЕРЖКИ | 2003 |
|
RU2246133C2 |
Авторы
Даты
1999-12-27—Публикация
1994-07-12—Подача