Изобретение направлено на решение задачи получения трансгенных животных, относится к области биотехнологии, генетической инженерии животных, экспериментальной и молекулярной биологии, может быть использовано в экспериментальной медицине, ветеринарии и племенном животноводстве.
Для получения трансгенных животных в настоящее время широко применяется способ, включающий в себя введение генетического материала в извлеченные из организма зиготы при помощи микроинъекции [1]. К недостаткам этого способа относятся его большая трудоемкость, необходимость извлечения зигот из животного и применение сложных микроинъекционных процедур на дорогостоящем оборудовании. Неоднократно предпринимались попытки разработать способ получения трансгенных животных без участия микроинъекции [2-5].
Так, например, известен способ получения трансгенных животных при помощи добавления ДНК к клеткам ранних эмбрионов животных в составе липосом, которые переносят генетический материал внутрь клеток ранних эмбрионов животных, и инкубации с ними [2]. Этот способ не включает в себя обычно применяемую для получения трансгенных животных микроинъекцию и имеет следующие общие с заявляемым способом получения трансгенных животных черты: включение генетического материала в искусственную конструкцию (липосому), переносящую генетический материал, добавление этой конструкции к эмбрионам и инкубацию с этой конструкцией. Инкубация с конструкцией, переносящей генетический материал в клетки эмбрионов, осуществляется in vitro. Такой способ не предполагает каких-либо специальных средств для узнавания клеток эмбрионов и для транспорта генетического материала в клеточное ядро; после слияния липосомы с клеточной мембраной доставляемый генетический материал оказывается в цитоплазме и проникает в клеточное ядро случайным образом.
Другой способ немикроинъекционного получения трансгенных животных предполагает использование рекомбинантных вирусов для переноса генетического материала в клетки ранних эмбрионов животных [3]. В этом случае генетический материал включается в рекомбинантный вирусный геном и в его составе в структуру вируса, переносящего генетический материал - приготовленную для переноса генетического материала конструкцию. Узнавание клеток ранних эмбрионов животных и транспорт в эти клетки происходит за счет вирусных детерминант. Инкубация с конструкцией, переносящей генетический материал в клетки эмбрионов, также осуществляется in vitro. Этот способ получения трансгенных животных является наиболее близким аналогом заявляемого способа, имеющим следующие общие с ним существенные признаки: включение генетического материала в конструкцию (вирус), переносящую генетический материал, добавление этой структуры к эмбрионам и инкубацию с этой структурой [3]. К недостаткам этого способа получения трансгенных животных относятся ограниченный размером вирусного генома размер переносимого генетического материала, ограниченная вирусными детерминантами возможность узнавания клеток-мишеней и относительная сложность конструирования рекомбинантных вирусов.
Технический результат, достигаемый изобретением, состоит в устранении указанных недостатков, т. е. расширении возможностей способа (в увеличении диапазона размеров вводимого генетического материала), в повышении экономичности способа, в возможности вводить различный генетический материал на основе применения одних и тех же компонентов.
Предлагаемый способ получения трансгенных животных позволяет получать трансгенных животных при помощи последовательного включения генетического материала в состав искусственной конструкции, переносящей генетический материал в клетки ранних эмбрионов животных, добавления этой конструкции к ранним эмбрионам и инкубации конструкции, содержащей генетический материал, с ранними эмбрионами млекопитающих. В предлагаемом способе используется искусственная конструкция, в состав которой входят: компонент для проникновения в клетки ранних эмбрионов животных, компонент для внутриклеточного транспорта и компонент для проникновения конструкции в клеточное ядро.
В качестве компонента для проникновения в клетки ранних эмбрионов животных в предлагаемом способе используется интернализуемый (эндоцитируемый) лиганд. Однако к настоящему времени только для немногих эндоцитируемых лигандов показано их наличие на поверхности клеток ранних эмбрионов и существование рецептор-опосредуемого эндоцитоза (интернализации) в клетках ранних эмбрионов животных. Правильный выбор интернализуемого лиганда для проникновения в клетки ранних эмбрионов является, поэтому, необходимым условием получения трансгенных животных данным способом. Таким лигандом, рецепторы к которому присутствуют на клетках эмбрионов, начиная со стадии зиготы, является инсулин [6, 7]. Показано, что ДНК-переносящие конструкции с использованием инсулина могут быть успешно применены для трансформации как клеток в культуре [8] , так и соматических клеток in vivo [9], однако до настоящего момента не имеется сведений о применении инсулина, и других лигандов как компонентов для обеспечения проникновения в клетки ранних эмбрионов животных. Наличие инсулиновых рецепторов на клетках эмбрионов, начиная с самых ранних стадий развития, делает возможным применение инсулина в качестве компонента для переноса генов не только в соматические клетки взрослого организма, но и для переноса генов в клетки ранних эмбрионов. Применение для получения трансгенных животных других подобных конструкций, приготовляемых на основе, например, асиалоорозомукоида и трансферрина, как компонентов для проникновения в клетки, [10-14] не представляется оправданным, поскольку рецепторы к этим интернализуемым лигандам присутствуют в соматических клетках (в наибольшем числе в клетках печени) и нет данных об их наличии в клетках ранних эмбрионов. Комплекс вышеизложенных фактов обусловил применение в предлагаемом способе получения трансгенных животных инсулина в качестве компонента для проникновения внутрь эмбриональной клетки.
В качестве компонента для транспорта конструкции, переносящей генетический материал внутри клеток, мы использовали аденовирус, который способен обеспечить транспорт содержимого из эндосом. Наличие в составе конструкции компонентов, которые способны вызывать выход содержимого из кислых эндоцитозных компартментов, способно значительно облегчить процесс транспорта генетического материала по направлению к месту его доставки - ядру [15]. В качестве компонентов, способных вызывать выход содержимого из кислых эндоцитозных компартментов, могут быть использованы различные вирусы [16-18], либо же амфипатические полипептиды [18]. Ранее было показано, что аденовирусы являются наиболее эффективными компонентами для транспорта конструкции через эндосомальную мембрану при трансфекции in vitro и на соматических клетках [18]. На основании известных к настоящему моменту сведений было не очевидно, однако, что аденовирусы можно применять для транспорта конструкции, переносящей генетический материал, в клетках ранних эмбрионов при получении трансгенных животных.
Для достижения наибольшей эффективности способа необходимо также использовать и средства для проникновения генетического материала в ядро клетки, поскольку при применяемой в данном способе схеме генетический материал в составе конструкции после того, как его протранспортируют внутрь клетки и, затем, внутри клетки через эндосомальную мембрану, оказывается в цитоплазме. В качестве компонента для проникновения в ядро в данном способе был использован инсулин, для которого показано проникновение в ядра различных клеток [19, 20].
Компоненты конструкции, переносящей генетический материал, объединены между собой и с генетическим материалом за счет ковалентных и нековалентных взаимодействий. Например, компонент для проникновения конструкции внутрь клетки ковалентно присоединяется к поликатиону, который нековалентно связывается с генетическим материалом; компонент для транспорта конструкции внутри клетки ковалентно соединяется с биотином, биотин нековалентно присоединяется со стрептавидином, ковалентно присоединенным к поликатиону, который нековалентно взаимодействует с генетическим материалом.
В существующих к настоящему времени способах создания трансгенных животных (как с помощью микроинъекции, так и в способах без применения микроинъекции) предполагается стадия извлечения ранних эмбрионов из организма животного-донора. В заявляемом способе появляется возможность обойтись без этой процедуры. Предлагаемый способ получения трансгенных животных может быть осуществлен как при инкубации ранних эмбрионов с требуемым генетическим материалом в составе переносящей его конструкции in vitro, так и без извлечения эмбрионов из организма животного при добавлении конструкции непосредственно в половые пути, и инкубации с конструкцией, переносящей генетический материал, непосредственно в живом организме.
Поскольку эндоцитируемые инсулиновые рецепторы присутствуют начиная с самой ранней стадии эмбрионального развития, способ дает возможность получения трансгенных животных при добавлении генетического материала к ранним эмбрионам на разных стадиях развития.
На фиг. 1 представлена электрофореграмма ПЦР анализа ДНК из эмбрионов кролика после трансформации in vitro на стадии 2-х клеток: 1 - буфер; 2 - 7 - ДНК из тканей эмбрионов через 51 час после трансформации конструкцией при концентрации 5 нМ, 8 - среда отмывки эмбрионов, 9 - 14 - ДНК из тканей эмбрионов через 51 час после трансформации конструкцией при концентрации 0,5 нМ, 16-17 ДНК плазмиды pGL2.
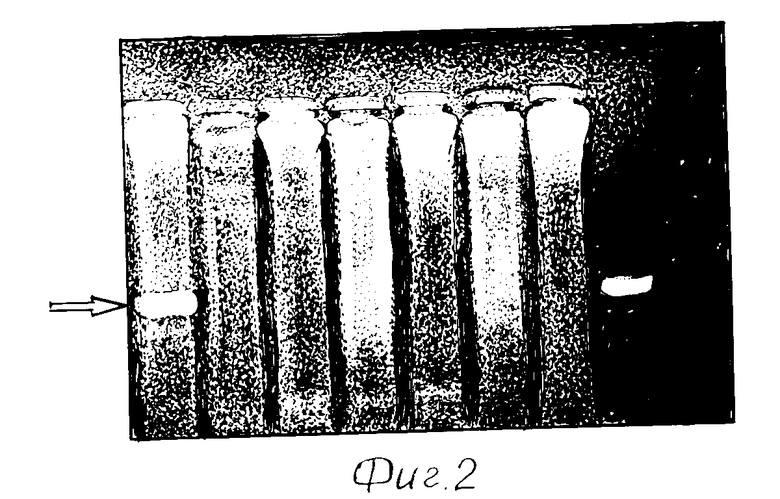
На фиг. 2 представлена электрофореграмма образцов тканей мыши после ПЦР-анализа: 1, 3,5 - ДНК из тканей эмбрионов 19 дня развития, подвергшихся трансформации in vivo; 2, 4, 6 - ДНК из плаценты эмбрионов 1,3,5, соответственно; 7 - контрольный эмбрион, не подвергавшийся трансформации; 8 - ДНК pGL2; 9 - раствор для выделения ДНК. Стрелкой указана полоса амплифицированного фрагмента.
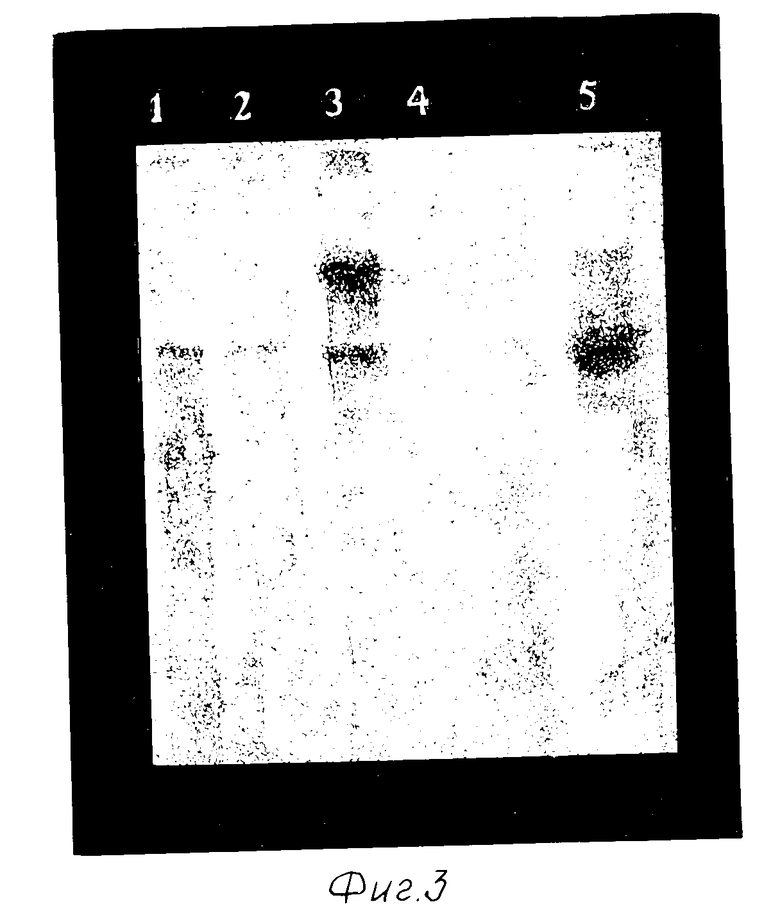
На фиг. 3 представлена гибридизация зонда с ДНК, выделенной из тканей мышей: 1 - плазмида pGL2, 1 нг; 2 - плазмида pGL2, 0,1 нг; 3,4 - ДНК из эмбрионов 15 дня развития; 5 - ДНК, выделенная из ткани матки.
Пример 1. Включение генетического материала в состав конструкции, переносящей генетический материал.
В качестве генетического материала для получения трансгенных животных были использованы плазмиды pGL2-Control Vector, (pGL2, "Promega") pVK28VP7d и pVK28VP7r.
Плазмиды были включены в состав конструкций, переносящих генетический материал, общей схемы: инсулин-полилизин-плазмида- полилизин-стрептавидин-биотин-аденовирус. В качестве аденовируса были использованы аденовирус человека 5 (штаммы dl-312 и AD5-neo), утиный аденовирус EDS-76 и аденовирус кур CELO.
Для включения инсулина в состав конструкции, переносящей генетический материал, бычий инсулин (Sigma) был ковалентно присоединен к полилизину с молекулярной массой 80 или 90 кД (Sigma) [8,21,22] при помощи N-оксисукцинимидного эфира 3-(2-пиридилдитио)пропионовой кислоты (SPDP, Sigma). Включение аденовирусов в состав конструкций было осуществлено посредством их биотинилирования при помощи N-оксисукцинимидного эфира биотинамидокапроата (N-OC-AK-биотин, Sigma) и присоединения к стрептавидину (Sigma или Molecular Probes), ковалентно присоединенного к полилизину с молекулярной массой 80 или 90 кД.
Инсулин-полилизин, синтез и очистка. Бычий инсулин (Sigma) был иодирован 125I при помощи иодогена (Pierce) [23], полилизин метили [14C]-динитрофторбензолом или [35S]-метящим реагентом (Amersham). Синтез и очистку коньюгата инсулин-полилизин проводили как описано [8]. Вкратце: цитраконированный бычий [125I] -инсулин был ковалентно присоединен к [14C]-полилизину при помощи бифункционального сшивающего реагента SPDP по схеме Юнга с авторами [24]. Полученный коньюгат был очищен гель-фильтрацией на колонке с сефакрилом S-300 (Pharmacia), после чего цитраконильные группы были удалены. Молярное содержание инсулина и полилизина в коньюгате, определенное по соотношению радиоактивных иода и серы, составляло от 4 до 10 остатков инсулина на 1 полилизин в различных партиях синтезированного препарата.
Стрептавидин-полилизин, синтез и очистка. Стрептавидин был присоединен к полилизину при помощи SPDP аналогично синтезу инсулин-полилилизина и очищен на сефакриле S-300 (Pharmacia). Молярное соотношение полилизина к стрептавидину было от 1-2 в зависимости от партии.
Биотинилирование и очистка аденовирусов: биотинилирование аденовирусов человека и птиц (EDS-76 и CELO) проводили при помощи N-OC-AK-биотина в CsCl (1,35 г/мл); очистку биотинилированных вирусов проводили диализом против 0,15 M NaCl, 25 mM HEPES, pH 7,5.
Получение конструкции, переносящей генетический материал: конструкцию получали последовательными добавлениями стрептавидин-полилизина, плазмиды и инсулин-полилизина к биотинилированному аденовирусу и инкубациями в течение 30 мин при 25oC.
Пример 2. Перенос генетического материала в клетки ранних эмбрионов in vitro.
Для проверки возможности переноса генетического материала в клетки ранних эмбрионов при помощи конструкции, переносящей генетический материал, были использованы предимплантационные эмбрионы мышей (линия Balb/c), кроликов (породы Шиншилла) и овец (Романовская порода) разных стадий развития. Конструкцию, приготовленную в 0,15 M NaCl, смешивали с средой M2 в соотношении 1:3. Эмбрионы инкубировали в этой среде (300 мкл) под слоем минерального масла в течение 3 ч при 37oC, после чего отмывали в среде M2 и культивировали в среде M16 при 37oC при 5% CO2, отмывали средой M2 (10 -12 отмывок в каплях объемом 300 - 500 мкл) и проводили анализ.
Анализ наличия в эмбрионах перенесенного генетического материала:
Получение материала для полимеразной цепной реакции (ПЦР) из эмбрионов предимплантационных стадий проводили, разрушая эмбрионы замораживанием - оттаиванием в гипотонической среде в общем объеме 12 мкл с последующей обработкой протеиназой K (Serva).
Полимеразную цепную реакцию проводили в общем объеме 25 мкл в инкубационном буфере, содержащем 67 mM Tris-HCl pH 8,8; 15 nM (NH4)2SO4, 2mM MgCl2, 170 мкг/мл BSA, 200 мкМ dATP, dCTP, dTTP, dGTP, 1,25 единицы Taq-полимеразы, по 1 мкМ каждого из олигонуклеотидных праймеров.
Анализ наличия в эмбрионах перенесенного генетического материала проводили методом ПЦР с использованием праймеров GL (Promega) при ведении в эмбрионы плазмиды pG12 и специально синтезированных олигонуклеотидов следующего состава: direct - 5'-CTGGAGAGGAATTGGACATATCCG, reverse - 5' - CCATCAACAACATCAACTATCGCC в качестве праймеров для выявления в реакции ПЦР нуклеотидной последовательности поверхностного антигена ротавируса свиней VP7 (pVK28VP7). Электрофорез аликвот полученных образцов проводили в 2%-ном агарозном геле. Для проверки специфичности фрагмента, синтезированного в полимеразной цепной реакции, ДНК из агарозного геля переносили на нейлоновый фильтр (HYBOND N+) и гибридизировали с [32P]-меченным зондом, в качестве контроля были использованы среды после отмывки эмбрионов, а также эмбрионы, которые были инкубированы в среде M2 с добавкой 0,15 M NaCl (3:1). Фотография типичного электрофореза представлена на фиг.1.
Эксперименты, проведенные на различных видах животных, показали, что конструкции, переносящие генетический материал, описанные в примере 1, способны переносить генетический материал в клетки эмбрионов различных предимплантационных стадий in vitro. Полученные данные позволяют утверждать, что перенос генетического материала в эмбрионы успешно проходит на различных стадиях развития.
Результаты переноса генетического материала при помощи конструкции, переносящей генетический материал, суммированы в табл. 1.
Пример 3. Получение трансгенных животных при переносе генетического материала в ранние эмбрионы in vivo.
Для возможности получения трансгенных животных при помощи добавления генетического материала in vivo в составе конструкции, доставляющей генетический материал, были проведены опыты на мышах линий Balb/c и SHK.
Введение конструкции с чужеродным геном проводили на беременных самках мышей в интервале 78-108 ч после оплодотворения, когда эмбрионы находятся на стадиях морулы или бластоцисты. Конструкцию, переносящую генетический материал, приготовленную, как описано в примере 1, вводили интравагинально при помощи зонда длиной около 0,5 см в среде M2, в объеме 50 - 100 мкл.
Выделение ДНК из тканей эмбрионов проводили по Маниатису [25], гомогенизируя ткани в 50 мМ трис-HCl, pH 8, 100 mM NaCl, 100 mM ЭДТА, 1% додецил сульфат Na, протеиназа K, 50 мкг/мл, с последующей экстракцией фенол-хлороформом.
Анализ наличия в тканях перенесенного генетического материала проводили при помощи метода ПЦР и блот-гибридизации, как это описано в примере 2. Фотография типичного электрофореза представлена на фиг.2.
Проведенные эксперименты показали возможность получения трансгенных животных непосредственно при введении конструкции, переносящей генетический материал, в организм животных и инкубации эмбрионов с конструкцией непосредственно в полости организма (табл.2).
Включение перенесенного генетического материала в геном подтверждается блот-гибридизацией зонда с выделенной из тканей ДНК, обработанной рестриктазами HindIII и Eco RI (фиг.3).
Таблица 2. In vivo введение генетического материала в клетки эмбрионов ранних стадий развития при помощи конструкции, переносящей генетический материал.
Источники информации.
1. Mammalian development. A practical approach. Ed. M. Monk, IRL Press, Oxford - Washington, 1987.
2. Rottmann OJ; Stratowa C; Hornstein M; Hughes J Tissue specific expression of hepatitis B surface antigen in mice following liposome--mediated gene transfer into blastocysts. Zentralbl. Veterinarmed [A], v. 32, 676-82, 1985.
3. van der Putten H; Botteri FM; Miller AD; Rosenfeld MG; Fan H; Evans RM; Verma IM. Efficient insertion of genes into the mouse germ line via retroviral vectors. Proc. Natl. Acad. Sci. USA, v. 82, 6148-52, 1985.
4. Kim T; Leibfried-Rutledge ML; First NL. Gene transfer in bovine blastocysts using replication-defective retroviral vectors packaged with Gibbon ape leukemia virus envelopes. Mol. Reprod. Dev., v. 35, 105-13, 1993.
5. Boris-Lawrie K. A., Temin H.M. Recent advances in retrovirus vector technology. Current Opinion in Genetics and Development, v. 3, 102-109, 1993.
6. Heyner S, Rao LV, Jarett L, Smith R.M. Preimplantation mouse embryos internalize maternal insulin via receptor-mediated endocytosis: pattern of uptake and functional correlatins. Dev Biol., v. 134, 48-58, 1989.
7. Harvey MB, Kaye PL. Visualization of insulin receptors on mouse preembryos. Reprod Fertil Dev., v.3, 9-15, 1991.
8. Rosenkranz A.A., Yachmenev S.V., Jans D.A., Serebryakova N.V., Murav'ev V.I., Peters R., and Sobolev A.S. Receptor-mediated endocytosis and nuclear transport of a transfecting DNA construct. Exp. Cell Res., v. 199, 323-329, 1992.
9. Способ генетической трансформации молочной железы животного и устройство для введения генетического материала в молочный проток молочной железы животного. Соболев А.С., Розенкранц А.А. Никитин В.А. Патент RU 2025487, кл. C 12 N, A 61 D, 1994.
10. Wu G.Y., Wu C.H. Evidence for gene delivery to Hep G2 hepatoma cells in vitro Biochemistry, v.27, 887-892, 1987.
11. Wu G.Y. Wilson J.W., Wu C.H. Targeting genes delivery and persisten expression of a foreign gene driven by mammalian regulatory elements in vivo. J. Biol Chem. v. 264, 16985-16987, 1989.
12. Wagner E. , Zenke M., Cotten M., Beug H., Birnstiel M.L. Transferrin-polycation conjugates as carriers for DNA uptake into cells. Proc. Natl. Acad. Sci. USA, v. 87, 3410-3414, 1990.
13. Neue protein-polykation-konjugate. Birnstiel M.L., Cotten M., Wagner E., EP 0388785, 1990.
14. Gao L. , Wagner E. , Cotten M., Agarwal S., Harris C., Romer M., Miller L. , Hu P.C., and Curiel D. Direct in vivo gene transfer to airway epithelium employing adenovirus-polylysine-DNA complexes. Hum. Gene. Ther., v. 4, 17-24, 1993.
15. Guy J., Drabeck D., Antoniou M. Delivery of DNA into mammalian cells by receptor-mediated endocytosis and gene therapy. Mol. Biotechnology, v. 3, 237-248, 1995.
16. Curiel D.T., Agarwal S., Wagner E., Cotten M. Adenovirus anhancement of transferrin-polylysine-mediated gene devivery. Pros. Natl. Acad. Sci. USA, v. 88, 8850-8854, 1991.
17. Zauner W. , Blaas D., Kuechler E., Wagner E. Rhinovirus -mediated endosomal release of transfection complexes. J. Virology, v. 69, 1085-1092, 1995.
18. Wagner E., Cotten M., Zatloukal K., Plank C., Birnstiel M.L., Oberhauser B., Schmidt W.G.M. Zusammensetzung fuer das einbringen von nucleinsaure-komplexen in hohere eucariotishe zellen. EP 0 545 016 Al, 1993.
19. Smith R.M., Jarret L. Partial characterization of mechanism of insulin accumulation in H35 hepatoma cell nuclei. Diabetes, v. 39, p. 683-689, 1990.
20. Burwen S.J., Jones A.L. The association of polypeptide hormones and growth factors with the nuclei of target cells. Trends Biochem. Sci., v. 12, p. 159-162, 1987.
22. Розенкранц А.А., Ячменев С.В., Соболев А.С. Использование искусственных конструкций для селективного переноса генетического материала в клетки человека путем рецептор-опосредуемого эндоцитоза. Докл. акад. наук СССР, т. 312, 493-494, 1990.
23. Markwell M. A. K. A new solid state reagent to iodinate proteins. Anal. Biochem., v. 125, p. 427-432, 1982.
24. Jung G., Kohnlein W., Luders G. Biological activity of the antitumor protein neocarcinostatin coupled to a monoclonal antibody by N-succinimidyl-3-(2-pyridyldithio)-propionate. Biochem. Biophys. Res. Commun., v. 101, p. 599-606 (1981).
25. Маниатис Т. , Фрич Э., Сэмбрук Дж. Молекулярное клонирование.-М.; Мир, 1990.
Использование: биотехнология, генетическая инженерия животных, экспериментальная и молекулярная биология, экспериментальная медицина, ветеринария и племенное животноводство. Сущность изобретения: способ получения трансгенных животных, состоящий в том, что доставляемый в клетки ранних эмбрионов животных генетический материал включают в конструкцию, имеющую компонент для проникновения конструкции внутрь клетки, компонент для транспорта конструкции внутри клетки и компонент для проникновения конструкции в клеточное ядро, добавляют к эмбрионам животных на ранней стадии развития и инкубируют с ранними эмбрионами животных. 9 з.п. ф-лы, 3 ил., 2 табл.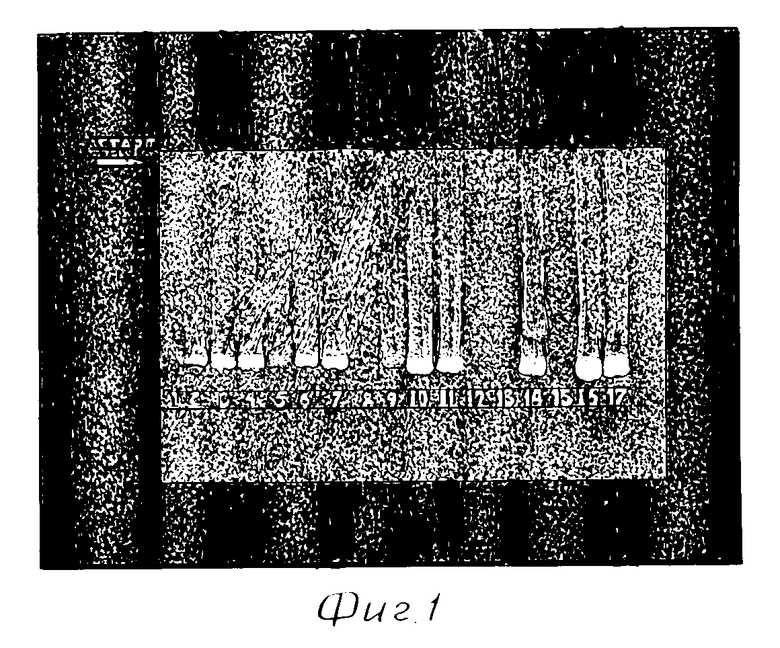
| Mammalian development | |||
| Apractical approach | |||
| Ed.M.Monk, JRL Press, Oxford-Washington, 1987 | |||
| Rottmann OJ; Stratowa C; Hornstein M; Hughes J Tisseu specific expression of hepatitis B surface antigen in mice following liposome- mediated gene transfer into blastocysts, Lentralbl | |||
| Veterinarmed [A], v | |||
| Способ образования коричневых окрасок на волокне из кашу кубической и подобных производных кашевого ряда | 1922 |
|
SU32A1 |
| Vander Putten H; Botteri F.M.; Miller A.D.; Rosenfeld M.G.; Fan H.; Evans R.M.; Verma J.M.; Efficient insertion of genes into the mouse germ line via retroviral vectors | |||
| Proc | |||
| Natl | |||
| Acad | |||
| Sci | |||
| USA, 82, 6148 - 52, 1985. | |||
Авторы
Даты
1998-04-20—Публикация
1996-10-28—Подача