Изобретение относится к медицине, а именно к лечению онкологических заболеваний.
Известны в качестве модификаторов противоопухолевой терапии следующие химические средства (вещества).
1. Гипоксические радиосенсибилизаторы - производные 2- нитроимидазола (метронидазол, мизонидазол, этанидазол, пимонидазол), которые, имитируя эффекты молекулярного кислорода, усиливают цитотоксическое действие ионизирующего излучения и таким образом увеличивают эффективность лучевой терапии опухолей [1 и 2]; эти вещества также способны в условиях гипоксии повышать цитотоксичность некоторых алкилирующих противоопухолевых препаратов [3 и 4].
Недавно синтезирован и апробирован в эксперименте и клинике новый гипоксический радиосенсибилизатор АК-2123, производное 3-нитротриазола, обладающее как радио-, так и химиосенсибилизирующей активностью [5 и 6].
2. Глюкоза, при внутривенной инфузии которой искусственно создается состояние гипергликемии, позволяет селективно интенсифицировать процесс гликолиза в опухоли и благодаря этому снизить внутриопухолевый pH; искусственная гипергликемия существенно улучшает результаты лучевой и химиотерапии [7 и 8].
3. Гидралазин (1-гидразинфталазина гидрохлорид) - гипотензивный препарат, который за счет снижения артериального давления способен тормозить локальный кровоток в опухоли, что способствует повышению эффективности ряда противоопухолевых препаратов и локальной гипертермии [9 и 10].
4. Амилорид (3,5-диамино-6-хлоро-N-(диаминометилен)пиразинкарбоксамид) - диуретик, который ингибирует Na+/H+-антипорт и тем самым снижает внутриклеточный pH, повышая эффективность термохимиотерапии [11 и 12].
5. Нигерицин - антибиотик, который способствует обмену внутриклеточного калия на внеклеточный водород, что приводит к снижению внутриклеточного pH, и благодаря этому усиливает противоопухолевый эффект алкилирующих препаратов, активных при низком pH [13].
6. Пентоксифиллин (трентал, 3,7-диметил-1-(5-оксогексил)ксантин) вазоактивный препарат, который способен улучшать оксигенацию опухолевой ткани и повышать тем самым противоопухолевый эффект лучевой терапии [14 и 15], при этом показано также, что пентоксифиллин усиливает противоопухолевое действие ряда алкилирующих препаратов [16].
7. Никотинамид улучшает оксигенацию опухолевой ткани, увеличивая благодаря этому эффективность лучевой терапии [17], при этом показано также, что никотинамид повышает чувствительность опухоли к химиотерапевтическим препаратам [18].
8. Верапамил (изоптин, 5-[(3,4-диметоксифенэтил)-метиламино]-2- (3,4-диметокси-фенил)-2-изопропилвалеронитрила гидрохлорид) - сосудорасширяющий и антиаритмический препарат; он подавляет активность P-гликопротеина, усиливающего резистентность опухолей к химиотерапевтическим препаратам; благодаря этому свойству верапамил способен повышать эффективность противоопухолевой химиотерапии [19].
9. SR-4233 (3- амино-1,2,4-бензотриазин-1,4-диоксид) - вещество, которое оказывает цитотоксическое действие на клетки в состоянии гипоксии; оно повышает противоопухолевый эффект ряда алкилирующих препаратов [20-22].
В качестве модификаторов противоопухолевой терапии используют также физические воздействия (методы), а именно
(10) гипертермию - локальную, заключающуюся в повышении температуры опухолевой ткани до 42 - 43oC, и общую, заключающуюся в повышении температуры тела больного до 41 - 41,5oC [23 и 24].
Наиболее близок к предлагаемому модификатору по принципу действия и эффективности амилорид (п. 4).
Общий недостаток известных средств и методов модификации противоопухолевой терапии, за исключением искусственной гипергликемии, состоит в том, что их действие на опухоль не селективно. Кроме того, всем им присущи индивидуальные недостатки. В частности, амилорид (прототип) вызывает гиперкалиемию и может привести к развитию мегалобластной анемии [25], а искусственная гипергликемия противопоказана при сахарном диабете, гипертонической болезни III степени и недостаточности функции почек.
Задача изобретения - отыскание новых эффективных модификаторов противоопухолевой терапии, проявляющих свое действие селективно, при относительно низком pH, который присущ опухоли и может быть дополнительно снижен с высокой избирательностью с помощью искусственной гипергликемии.
Сущность изобретения заключается в том, что в качестве модификатора противоопухолевой терапии используют комплексы (хелаты) органокобальта(III) с тридентатными основаниями Шиффа, схематической формулы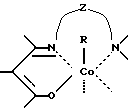
где
R - алкил, в том числе функционально замещенный. Общие формулы предлагаемых модификаторов I-VIII приведены ниже.
Комплексы этого типа были впервые получены в работах [26-28]. Ранее было предложено использовать некоторые из них в качестве инициаторов эмульсионной полимеризации [28].
При этом было установлено, что эти комплексы разлагаются под действием протонов в очень мягких условиях: в слегка кислых растворах (при pH < 7) и обычных температурах (0 - 40oC), эффективно генерируя свободные радикалы [29]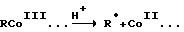
Таким образом, они являются pH-зависимыми источниками алкильных свободных радикалов, которые, как известно, способны повреждать или расщеплять биомолекулы, такие как углеводы и нуклеиновые основания и кислоты [30]. Вероятно, что модифицирующий эффект этих комплексов осуществляется путем повреждения структуры ДНК опухолевых клеток и (или) ингибирования репарации молекул ДНК, поврежденных в результате действия известного противоопухолевого препарата или излучения высокой энергии.
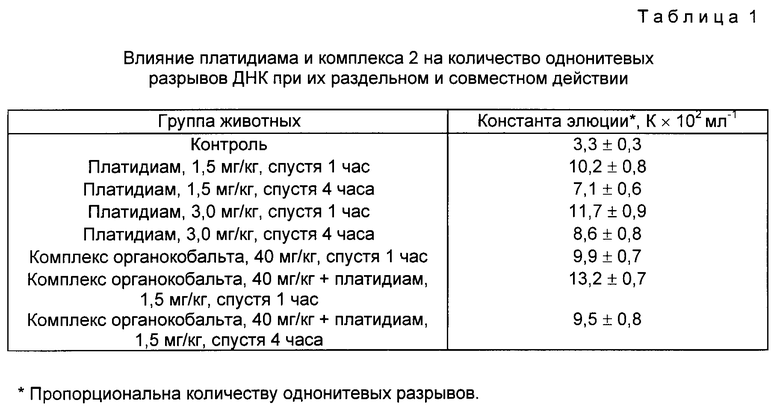
Авторы показали, что комплексы органокобальта не только тормозят восстановление однонитевых разрывов ДНК, вызванных цис-платиной (платидиамом), но и сами способны повреждать ДНК. Исследование было проведено на карциноме Герена (объем опухолей 1,0 см3). Определение количества однонитевых разрывов ДНК осуществляли с помощью метода щелочной элюции. Полученные результаты приведены в табл. 1. Эти данные позволяют предположить, что модифицирующий эффект комплексов органокобальта(III) с тридентатными основаниями Шиффа обусловлен их способностью вызывать однонитевые разрывы ДНК и ингибировать восстановление однонитевых разрывов ДНК, происходящих в результате воздействия цитотоксическими агентами.
Примеры.
Список комплексов органокобальта в примерах приведен в табл. 2.
Модели онкологических заболеваний:
трансплантированная карцинома Герена у крыс,
трансплантированная саркома 45 у крыс,
трансплантированная лейкемия L1210 у мышей.
Схемы терапии:
1) вводили раствор комплекса;
2) вводили раствор комплекса и осуществляли инфузию 20%-ного раствора глюкозы;
3) вводили раствор комплекса в сочетании с химиотерапией (платидиамом);
4) вводили раствор комплекса и осуществляли локальную гипертермию;
5) вводили раствор комплекса в сочетании с термохимиотерапией, т.е. химиотерапией (платидиамом) и локальной гипертермией;
6) вводили раствор комплекса и осуществляли лучевую терапию.
Результаты испытаний, в каждом из которых использовали по нескольку групп животных, резюмированы в виде табл. 3 - 6. Они показывают, что предлагаемые модификаторы значительно усиливают противоопухолевый эффект известных цитостатических агентов. Использование этих комплексов позволяет существенно снизить дозу химиотерапевтического препарата - платидиама, или интенсивность физического воздействия - локальной гипертермии без потери эффективности лечения, а в ряде случаев даже с ее увеличением. Таким образом, удается уменьшить общетоксическое действие этих цитостатических агентов на организм.
При введении рассматриваемых комплексов в дозах, оказывающих модифицирующий эффект, не наблюдалось побочных явлений, которые требовали бы прекращения применения этих модификаторов или всей схемы терапии.
Таким образом, использование предлагаемых модификаторов значительно повышает эффективность известных методов противоопухолевой терапии и позволяет существенно снизить дозировку цитостатических препаратов или интенсивность физических воздействий.
Литература.
1. J. Overgaard et al., Int. J. Radiat. Oncol. Biol. Phys., 1989, 16, 1065-1068.
2. G. Adams et al., Radiotherapy and Oncology, 1991, Suppl. 20, 85-91.
3. I. Tannock, Br. J. Cancer, 1980, 42, 861-870.
4. S. Fujimoto et al., Br. J. Cancer, 1988, 58, 42-45.
5. A. Garcia-Angulo et al., Int. J. Radiat. Oncol. Biol. Phys., 1992, 22, 589-591.
6. S.P. Osinsky et al., Exp. Oncology, 1994, 16, 61-66.
7. M. von Ardenne. Krebs-Mehrschritt-Therapie. Berlin, 1970.
8. Жаврид Э.А. и др. Гипертермия и гипергликемия в онкологии.- Киев: Наукова думка, 1987.
9. M. Horsman et al., Int. J. Hyperthermia, 1989, 5, 123 - 126.
10. P. Quinn et al., Br. J. Cancer, 1992, 66, 323 - 330.
11. J. Miyakoshi et al., Cancer Res., 1986, 46, 1840 - 1843.
12. S. Kim et al.. Int. J. Radiat. Oncol. Biol. Phys., 1991, 20, 541 - 549.
13. E. Jahde et al., Cancer Chemother. Pharmacol., 1991, 27, 440 - 444.
14. D. Honess et al., Radiotherapy and Oncology, 1993, 28, 208 - 218.
15. S. Kim et al., Int. J. Radiat. Oncol. Biol. Phys., 1993, 25, 61-65.
16. B. Dezube et al., Cancer Res., 1990, 50, 6806-6810.
17. M. Horsman, Radiotherapy and Oncology, 1991, 23, 79-80.
18. S. Masunaga et al., Int. J. Radiat. Oncol. Biol. Phys., 1993, 27, Suppl. 1, 306.
19. J. Ford et al., Pharmacol. Rev., 1990, 42, 155-199.
20. T. Herman et al., Cancer Res., 1990, 50, 5055-5059.
21. S. Holden et al., J. Natl. Cancer Inst., 1992, 84, 187-193.
22. L. Skarsgard et al., Br. J. Cancer, 1993, 68, 681-683.
23. J. Overgaard et al., Int. J. Radiat. Oncol. Biol. Phys., 1989, 16, 535-549.
24. Proc. of the 6th Congress on Hypothermic Oncology. 1992, vol. 1; 1993, vol. 2.
25. Браунвалд Е. и др. Внутренние болезни.- М.: Медицина, 1995, т. 5, с. 403.
26. I. Ya. Levitin et al., J. Organometal. Chem., 1987, 330,161-178.
27. I. Ya. Levitin et al., Inorg. Chim. Acta, 1985, 100, 65-77.
28. Патент РФ по заявке N 4939599/04 от 29.05.1991, Левитин И.Я. и др.
29. Левитин И.Я. и др., Металлоорганическая химия, 1990, 3, 865 - 875.
30. C. G. Riordan et al., J. Amer. Chem. Soc., 1994, 116, 2189 - 2190 и цит. там работы.
| название | год | авторы | номер документа |
|---|---|---|---|
| Способ комбинированного лечения немелкоклеточного рака легкого III стадии с использованием термохимиолучевой терапии | 2017 |
|
RU2654612C1 |
| СПОСОБ ЛЕЧЕНИЯ БОЛЬНЫХ МЕСТНО-РАСПРОСТРАНЕННЫМ РАКОМ ГЛОТКИ | 2005 |
|
RU2289364C1 |
| СПОСОБ ПРОГНОЗИРОВАНИЯ ВОЗНИКНОВЕНИЯ МЕСТНЫХ РЕЦИДИВОВ У БОЛЬНЫХ РАКОМ МОЛОЧНОЙ ЖЕЛЕЗЫ В ПОСЛЕОПЕРАЦИОННОМ ПЕРИОДЕ | 2014 |
|
RU2540168C1 |
| СПОСОБ КОМБИНИРОВАННОГО ЛЕЧЕНИЯ МЕСТНОРАСПРОСТРАНЕННОГО РАКА ПРЯМОЙ КИШКИ | 2010 |
|
RU2447914C1 |
| СПОСОБ КОМБИНИРОВАННОГО ЛЕЧЕНИЯ ОПЕРАБЕЛЬНОГО НЕМЕЛКОКЛЕТОЧНОГО РАКА ЛЕГКОГО III СТАДИИ | 2015 |
|
RU2590866C1 |
| Способ комбинированного лечения немелкоклеточного рака легких II-III стадии | 2017 |
|
RU2636869C1 |
| СПОСОБ КОМБИНИРОВАННОГО ЛЕЧЕНИЯ МЕСТНОРАСПРОСТРАНЕННОГО НЕМЕЛКОКЛЕТОЧНОГО РАКА ЛЕГКОГО | 2007 |
|
RU2372901C2 |
| ИЗЛУЧАТЕЛЬ СВЧ-ЭНЕРГИИ ДЛЯ НАГРЕВА ТКАНЕЙ ТЕЛА ЧЕЛОВЕКА | 2006 |
|
RU2324509C2 |
| СПОСОБ ИНТЕРСТИЦИАЛЬНОЙ, ВЫСОКОМОЩНОСТНОЙ БРАХИТЕРАПИИ МЕСТНО-РАСПРОСТРАНЕННЫХ ОПУХОЛЕЙ МАЛОГО ТАЗА, ИМЕЮЩИХ ЛАТЕРАЛЬНУЮ ИНВАЗИЮ В СТЕНКУ МАЛОГО ТАЗА | 2019 |
|
RU2719935C2 |
| ПРОТИВООПУХОЛЕВОЕ СРЕДСТВО БЕНЗАМИД | 2003 |
|
RU2257894C1 |

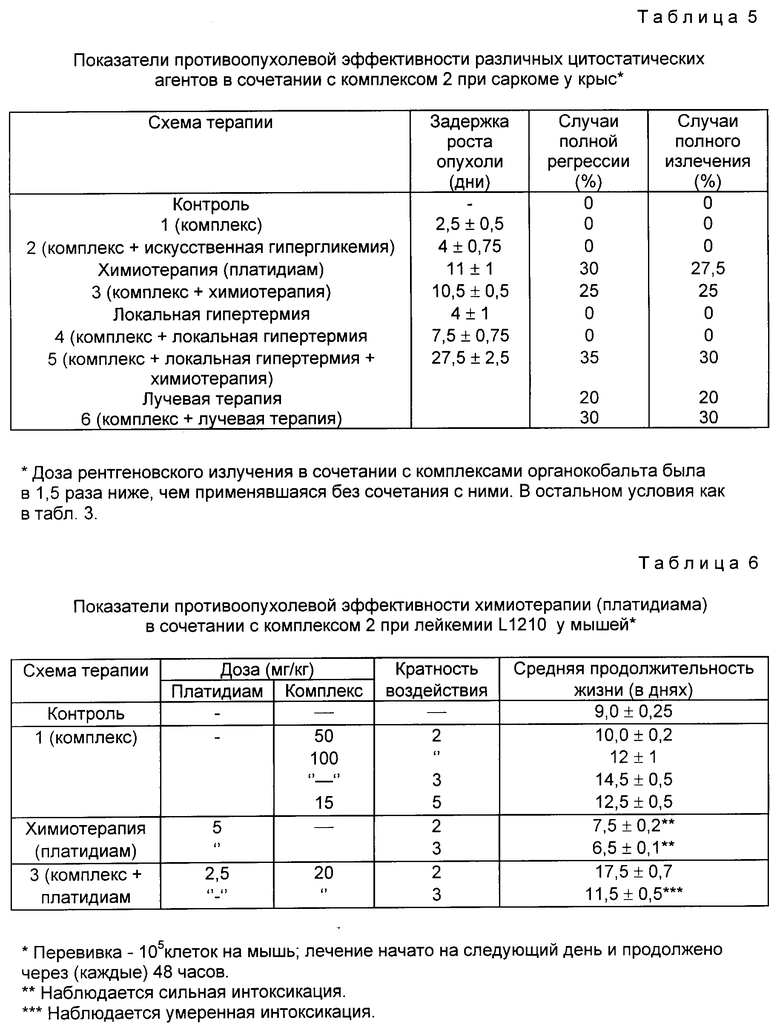
Предложено новое средство для лечения онкологических заболеваний. Средство является модификатором противоопухолевой терапии и представляет собой комплексы органокобальта (III) с тридентатными основаниями Шиффа общей формулы (I)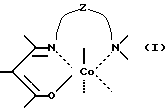
Соединение данной формулы повышает эффективность известных методов противоопухолевой терапии и позволяет существенно снизить дозировку цитопатических препаратов или интенсивность физических воздействий. 6 табл.
Применение комплексов органокобальта (III) c тридентатными основаниями Шиффа общих формул I - VIII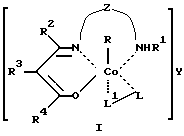
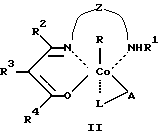
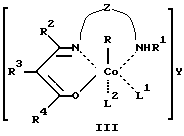
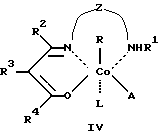
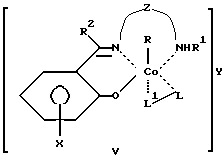
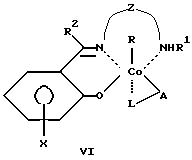
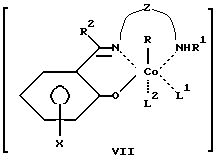
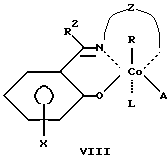
где R, R2 - алкил, в том числе функционально замещенный;
R1 - H или алкил, в том числе функционально замещенный;
R3 - H, или алкил, или арил, в том числе функционально замещенные;
R4 - алкил или арил, в том числе функционально замещенные;
X - заместители, в том числе функциональные группы;
Z - двух- или трехзвенная алифатическая цепь, в том числе с алкильными или арильными боковыми группами, в том числе функционально замещенными;
L, L1, L2 - нейтральный монодентатный лиганд, например, азотистое основание;
A - однозарядный анионный монодентатный лиганд, например гидроксил, галогенид- или роданид-ион;
L - L' - нейтральный бидентатный хелатирующий лиганд, например диамин;
L - A - однозарядный анионный бидентатный хелатирующий лиганд, например анион из аминокислоты, пептида или βальдегидо- или кетоенола;
Y - противоион (однозарядный анион), например галогенид- или ацетат-ион,
в качестве модификаторов для противоопухолевой терапии.
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| Levitin Ja | |||
| et al | |||
| Template synthesis of organocobalt chelates with tridentate Schift bases | |||
| Способ восстановления хромовой кислоты, в частности для получения хромовых квасцов | 1921 |
|
SU7A1 |
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| Levitin Ja | |||
| et al | |||
| Substitution of Bi-and Monodentate Lewis Basses in Organocjbalt (II) Complex holding a tridentate Ligand: routes to novel series of organocobalt compound | |||
| "Inorganica Chimica Acta", Lousanne,1985, v | |||
| Облицовка комнатных печей | 1918 |
|
SU100A1 |
| Разборное приспособление для накатки на рельсы сошедших с них колес подвижного состава | 1920 |
|
SU65A1 |
| Переносная печь для варки пищи и отопления в окопах, походных помещениях и т.п. | 1921 |
|
SU3A1 |
| Браунвальд Е | |||
| и др | |||
| Внутренние болезни | |||
| - М., 1995, т | |||
| Кипятильник для воды | 1921 |
|
SU5A1 |
| Способ включения усилителя в трансляцию | 1923 |
|
SU403A1 |
Авторы
Даты
1998-05-27—Публикация
1995-02-23—Подача