Изобретение относится к некоторым замещенным пуриновым арабинозидам и их приемлемым с физиологическим точки зрения производным, в частности сложным эфирам и их использованию с целью лечения некоторых ДНК-вирусных заболеваний.
Вирус Варицелла-герпес зостер (ВВЗ), который вызывает ветрянку и опоясывающий лишай, является ДНК-вирусом семейства герпес. Ветряная оспа является основным заболеванием, вызываемым ВВЗ у хозяина без иммунной реакции; в общем случае оно является неострым заболеванием маленьких детей, которое проявляется в виде лихорадки и чесоточной сыпи. Герпес зостер (опоясывающий лишай) является рецидивной формой заболевания, имеющего место у взрослых, которые ранее подвергались инфицированию вирусом варицелла-зостер. Клинические симптомы этой инфекции характеризуются невралгией и везикулярной кожной сыпью, которая имеет одностороннее и кожное распределение. Распространение воспаления может привести к параличу или судорогам и коме, если в последующем развивается менингит.
У пациентов с иммунодефицитом этот вирус может распространяться, вызывая серьезные, часто фатальные заболевания. Причиной иммунодефицита могут быть лекарственные препараты, используемые при лечении пациентов с трансплантатом или при лечении злокачественных неоплазм, или заболевания такие, как СПИД, которые разрушают иммунную систему, в результате чего пациент становится уязвимым для инфекций, которые в других случаях не являлись бы столь опасными.
Цитомегаловирус (ЦМВ) является еще одним вирусом семейства герпес. Инфекция может быть приобретена в детстве или в молодости и в плоде, причем внутриматочное заражение является видимо самой распространенной формой заражения, но до 90% врожденных инфекций являются асимптоматичными при родах. Предварительное заражение матери в течение беременности рассматривается в общем случае в качестве наибольшего риска для неродившегося ребенка в то время, как повторная активация инфекций плода является в общем случае клинически редкой. Клинические эффекты простираются от смерти и тяжелого заболевания (микроцефалия, увеличение печени или селезенки, желтуха, задержка умственного развития) через прекращение заболевания к его быстрому развитию, восприимчивости к легочным и ушным инфекциям, до отсутствия очевидным эффектов заболевания. У молодых людей инфекция может протекать незамеченной или проявляться в виде лихорадки, вызванной воспалением желез, подобно заболеванию, полученному в результате близкого физического контакта.
Серьезные инфекции могут также иметь место в результате реактивации "дремлющего" вируса у пациентов с неэффективной иммунной системой, как это описано для ВВЗ-инфекцией. Такие инфекции приводят к более высокой заболеваемости и смертности от воспаления оболочки глаза, воспаления легких и кишечно-желудочных расстройств.
Было установлено, что некоторые пурин-арабино нуклеазиды, описанные подробно ниже, отличающиеся присутствием группы, замещенных в2- и 6-позициях пуринового кольца, обладают высокой активностью против вирусных инфекций человека, в частности, тех, которые вызваны вирусом варицелла зостер (ВВЗ) или цитомегаловирусом (ЦМВ).
Некоторое замещенные пурин-арабино нуклеозиды, в частности 9- β D-арабинофуранозил-6-метокси-9H-пурин, 9- β D-арабинофуранозил-6-пирролидино-9H-пурин, 9- β D-арабинофуранозил-6-метиламино-9H-пурин и 9- β D-арабинофуранозил-6-диметиламино-9H-пури, которые описаны ниже, при их применении для лечения ВВЗ и ЦИВ-инфекций описаны ранее в J. Org. Chem., том 27, 3274-9 (1962); Carner Treatment Rep, 60(10) 1567-84 (1976); Tetrahedron, 40 (4), 709-13, (1984); Canada, J. Biochem., 43 (1), 1 - 15, (1965); J. med. Chem. 12, 498-504, (1969); J. Biol, Chem., 251 (13), 4055-61, (1976); Ann.n.J. acad., Sci, 284, 81-90, (1977); в Европейском патенте 002192; патентах США N 3666856, 4371613, 3758684.
Таким образом, в соответствии с первым аспектом настоящего изобретения предлагается соединение формулы (I)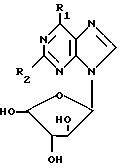
где
R1 - представляет галоген (например, хлор или йод), C1-5алкоксигруппу (например, метокси или этокси); галоген-замещенный C1-5алкокси (например, трифторэтокси); амино-группу, которая является одно- или двузамещенной C1-5алкилом (например, метилом или этилом), C1-5алкилом, замещенным одним или несколькими атомами фтора (например, 2-фторэтилом или 2,2,2-трифторэтилом), или C3-6циклоалкилом (например, циклопропилом) или амино-составляющей кольца, содержащей 4 - 7 атомов углерода, и, возможно, двойной связью (например, пирролидино) и/или, кроме того, атомом азота; R2 - представляет водород, галоген или амино; и его приемлемые с физиологической точки зрения производные для лечения или профилактики вирусных инфекций у человека, вызванных ВВЗ или ЦМВ.
Изобретение включает также соединения формулы (I), в которой R2 является водородом, а R1 - метокси, пиперидино или пирролидино, и когда R2 является амино, а R1 является хлором, и их приемлемые с фармацевтической точки зрения производные для использования в медицинской терапии.
В приведенной формуле (I) алкильными группами (включая группы в алкокси, алкиламино или диалкиламино-группах) в предпочтительном варианте являются метильные, этильные или пропильные группы.
Предпочттельными соединениями формулы (I) являются соединения, в которых:
(a) R2 является водородом;
(b) R1 является C1-5 алкокси, особенно метокси; или
(c) R1 является C1-5 алкиламино, особенно диметиламино; или
(d) R1 является галогеном, особенно йодом.
Следующие соединения являются предпочтительными соединениями в соответствии с настоящим изобретением ввиду их сильной противовирусной активности против ВВЗ или ЦМВ,
1) 9- β -D-арабинофуранозил-6-метиламино-9H-пурин,
2) 9- β -D-арабинофуранозил-6-диметиламино-9H-пурин,
3) 9- β -D-арабинофуранозил-6-метокси-9H-пурин,
4) 9- β -D-арабинофуранозил-6-этокси-9H-пурин,
5) 9- β -D-арабинофуранозил-6-йод-9H-пурин,
6) 9- β -D-арабинофуранозил-6-амино-9H-йодпурин,
7) 9- β -D-арабинофуранозил-6-пирролидино-9H-пурин,
8) 9- β -D-арабинофуранозил-2-хлор-6-метиламино-9H-пурин,
9) 9- β -D-арабинофуранозил-6-циклопропиламино-9H-пурин,
10) 9- β -D-арабинофуранозил-6-этилметиламино-9H-пурин,
11) 9- β -D-арабинофуранозил-2-амино-6-метокси-9H-пурин,
12) 9- β -D-арабинофуранозил-2-амино-6-н-пропокси-9H-пурин.
Из приведенных выше соединений соединения 2, 3 и 5 являются наиболее предпочтительными. Настоящее изобретение включает также новые соединения формулы (1) и их приемлемые с физиологической точки зрения производные, в частности соединения 4, 5, 6, 8, 9, 10, 11 и 12, перечисленные выше.
В соответствии со вторым аспектом настоящего изобретения предлагаются новые соединения общей формулы 1(а):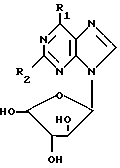 ,
,
в которой
R1 представляет галоген (например, хлор или йод), C1-5алкокси-группу (например, метокси или этокси); галоген-замещенную C1-5алкокси (например, трифторэтокси), амино-группу, которая является одно- или двузамещенной C1-5алкокси (например, метилом или этилом), C1-5алкилом, замещенным одним или несколькими атомами фтора (например, 2-фторэтилом или 2,2,2-трифторэтилом/или C3-6циклоалкилом (например, циклопропилом), или амино-составляющей кольца, содержащей 4-7 атомов углерода, и, возможно, двойной связью (например, пирролидино), и/или, кроме того, атомом азота; R2 представляет водород, галоген или амино при условии, что, когда R2 является водородом, R1 не является хлором, метокси, метиламино, этиламино, диметиламино, пиперидино или пиррлидино, а когда R2 является амино, R1 не является хлором или метиламино; и их приемлемые с физиологической точки зрения производные, отличные от 2', 3', 5'-триацетатных и трибензиловых производных соединений формулы I(а), в которой R1 является хлором или фтором, когда R2 является хлором, фтором, водородом или амино.
Изобретение, кроме того, включает соединения формулы I(а) для использования в медицинской терапии, в частности для лечения вирусных инфекций человека, вызванных ВВЗ или ЦМВ.
В соответствии с еще одним аспектом изобретения предлагаются приемлемые с фармацевтической точки зрения производные соединений формулы (I), а именно любые приемлемые с фармацевтической точки зрения простые эфиры, соли, сложные эфиры или соли таких сложных эфиров, или любое другое соединение, которое после применения к человеку способно дать (непосредственно или косвенно) соединение формулы (I), или его противовирусный метаболит или остаток.
Приемлемые с фармацевтической точки зрения сложные эфиры вышеупомянутых соединений формулы (I) являются особенно предпочтительными, так как они способны обеспечить высокие концентрации основного соединения в плазме пациента после стоматического применения. В соответствии с настоящим изобретением, в частности, предлагается в качестве предпочтительного класса новые соединения приемлемых с фармацевтической точки зрения сложных эфиров соединения 3, образованного в результате этерификации 2'-, 3'- и/или 5'-окси группы арабино-сахарной составляющей.
Особенно предпочтительными производными соединений формулы (I) являются сложные моно- ди-или три- эфиры арабино-сахарного остатка, замещенные в 2'-, 3'- и 5'-позициях вышеупомянутого остатка.
К таким предпочтительным сложным эфирам относятся сложные эфиры, в которых некарбонильную составляющую группы сложного эфира выбирают из алкила с линейной или разветвленной цепью (например, н-пропил, третичн.-бутил, н-бутил), алкоксиалкила (например, метоксиметила), аралкила (например, бензила), арилоксиалкила, (например, феноксиметила), арила (например, фенила), может быть замещенного галогеном, C1-4 алкилом или C1-4алкокси, нитро или амино; сложные эфиры сульфонатов такие, как алкилсульфонил; или алкиларилсульфонил (например, метансульфонил или толилсульфонилсульфонил); сложные эфиры аминокислот, например, -валил); и моно-, ди- или трифосфатные сложные эфиры. К приемлемым с фармацевтической точки зрения солям этих сложных эфиров относятся соли натрия, калия, ПР4 +, где Р = H или C1-6 алкилом, и присоединенные соли кислот. В приведенных выше группах сложного эфира алкильные группы (включая группы в группе алкокси) содержат от 1 до 12 атомов углерода, а арильные группы являются в предпочтительном варианте фенилом.
Следующие сложные эфиры и простые эфиры являются предпочтительными новыми соединениями, являющимися предметом настоящего изобретения:
13) 9-(5-0-бензоил- β -D-арабинофуранозил)-6-метокси-9H-пурин,
14) 6-метокси-9-[5-0-(4-метилфенилсульфонил)- β -D-арабинофуранозил]-9H-пурин,
15) 6-метокси-9-(5-0-метилсульфонил)- β -D-арабинофуранозил]- 9H-пурин,
16) 9-[5-0-(4-метилбензоил)- β -D-арабинофуранозил]-6-метокси- 9H-пурин,
17) 9-[5-0-(4-хлорбензоил)- β -D-арабинофуранозил]-6-метокси- 9H-пурин,
18) 9-[5-0-(4-метоксибензоил)- β -D-арабинофуранозил]-6- метокси-9H-пурин,
19) 6-метокси-9-(5-0-фенилацетил- β -D-арабинофуранозил)-9H- пурин,
20) 5-метокси-9-(5-0-фенилоксиацетил- β -D-арабинофуранозил) -9H-пурин,
21) 6-метокси-9-(5-0-метоксиацетил- β -D-арабинофуранозил) -9H-пурин,
22) 9-[5-0-(4-нитробензоил)- β -D-арабинофуранозил)-6-метокси- 9H-пурин,
23) 6-метокси-9-(5-0-пентаноил- β -D-арабинофуранозил) -9H-пурин,
24) 9-[5-0-(4-аминобензоил)- β -D-арабинофуранозил)-6-метокси- 9H-пурин,
25) 6-метокси-9-[5-0-пропионил- β -D-арабинофуранозил) -9H-пурин,
26) 9-(5-0-бутаноил- β -D-арабинофуранозил)-6-метокси-9H-пурин,
27) 9-[5-0-(2,2диметилпропионил)- β -D-арабинофуранозил)-6- метокси-9H-пурин,
28) 9-[5-0-ацетил β -D-арабинофуранозил)-6-метокси-9H-пурин,
29) 6-метокси-9-[5-0-(2-метилпропионил)- β -D-арабинофуранозил) -9H-пурин,
30) 6-метокси-9-[2-0-(2,2-диметилпропионил)- β -D- арабинофуранозил)-9H-пурин,
31) 6-метокси-9-[(2,3,5-три-0-ацетил)- β -D-арабинофуранозил)- 9H-пурин,
32) 6-метокси-9-(2-0-пентаноил- β -D-арабинофуранозил)-9H- пурин,
33) 9-(2-0-бутаноил- β -D-арабинофуранозил)-6-метокси-9H- пурин,
34) 6-метокси-9-[2-0-(2-метилпропионил- β -D-арабинофуранозил] -9H-пурин,
35) 9-(3-0-бензоил- β -D-арабинофуранозил)-6-метокси-9H- пурин,
36) 9-(2,3-ангидро- β -D-ликсофуранозил)-6-метоксипурин,
37) 6-метокси-9-[(2-0-(4-метоксибензоил))- β -D-арабинофуранозил]-9H- пурин,
38) 6-метокси-9-[(2-0-(4-метилбензоил))- β -D-арабинофуранозил]-9H-пурин,
39) 9-[2-0-(4-хлорбензоил)- β -D-арабинофуранозил]-6-метокси- 9H-пурин,
40) 6-метокси-9-[3,5-0-(1,1,3,3-тетраизопропил-1,3-дисилоксан-1,3 -диил)- β -D-арабинофуранозил]-9H-пурин,
41) 6-метокси-9-[2-0-(2-аминобензоил)- β -D-арабинофуранозил]- 9H-пурин,
42) 6-метокси-9-[2-(4-метилбензоил)-3,5-0-(1,1,3,3- тетраизопропилдисилоксан-1,3-диил)- β -D-арабинофуранозил]-9H- пурин,
43) 6-метокси-9-[2-(4-метоксибензоил)-3,5-0-(1,1,3,3- тетраизопропилдисилоксан-1,3-диил)- β -D-арабинофуранозил]-9H-пурин,
44) 9-[2-(4-хлорбензоил)-3,5-0-(1,1,3,3-тетраизопропилдисилоксан -1,3-диил)- β -D-арабинофуранозил]-6-метокси-9H-пурин,
45) 5'-фосфатный сложный моноэфир 9- β -D-арабинофуранозил-6- диметиламин-9H-пурин,
46) 6-метоксипурин арабинозид 5'-монофосфат,
47) 6-метоксипурин арабинозид 5'-трифосфат.
Особенно предпочтительными являются соединения 16, 24 и 32.
Пуриновые нуклеозиды формулы (I) и их производные в дальнейшем именуются как соединения, являющиеся предметом изобретения, или активные ингредиенты.
В соответствии с еще одним предпочтительным аспектом настоящего изобретения предлагается использование соединения, являющегося предметом изобретения, с целью получения медицинского препарата для лечения или профилактики вирусных инфекций человека, вызванных ВВЗ или ЦМВ.
Кроме того, в соответствии с изобретением предлагается способ лечения или профилактики ВВЗ и ЦМВ инфекций у человека, который заключается в применении к упомянутому человеку эффективного количества предложенного соединения.
Способ, указанный выше, включает ингибирование репликации ВВЗ или ЦМВ-вирусов в клетке-хозяине млекопитающих, который содержит применение эффективного количества для ингибирования репликации вируса соединения формулы (I) или его приемлемого с фармацевтической точки зрения производного к инфицированным клеткам.
Примеры клинических заболеваний, вызванных ВВЗ и ЦМВ инфекциями, которые могут быть обработаны в соответствии с изобретением, включают заболевания, которые были перечислены выше.
Соединения формулы (I) и их приемлемые с фармацевтической точки зрения производные (в дальнейшем именуемые вместе как активные ингредиенты) могут быть применены любым способом, соответствующим заболеванию; к таким способам относятся стоматический, прямокишечный способы, через нос, местный способ (включая буккальный и под язык), влагалищный и парентеральный (включая подкожный, внутримышечный, внутривенный внутрикожный, и эпидуральный) способы. Предпочтительный способ может варьироваться в зависимости, например, от состояния больного.
Для каждого из вышеуказанных использований и указаний количество требующего активного ингредиента (как он определен выше) будет зависеть от различных факторов, включающих серьезность заболевания, подлежащего лечению, и совместимость с реципиентом, и будет большей степени зависеть от решения лечащего врача. В общем случае, однако, для каждого из таких применений и указаний соответствующая эффективная доза будет изменяться в области от 0,1 до 250 мг на килограмм веса тела реципиента в день, в предпочтительном варианте в области от 0,1 до 100 мг на килограмм веса тела в день, а наиболее предпочтительном варианте от 1 до 20 мг на килограмм веса тела в день; оптимальная доза составляет примерно 15 мг на килограмм веса тела в день (если не оговорено противное, все веса активного ингредиента рассчитаны для основного соединения формулы (I); для его солей и сложных эфиров эти числа должны быть увеличены пропорционально). Искомую дозу в предпочтительном варианте разбивают на две, три, четыре или более поддоз, которые применяют через соответствующие промежутки времени на протяжении дня. Такие поддозы могут быть применены в формах единичных доз, например, содержащих от 5 до 1000 мг, в предпочтительном варианте от 20 до 500 мг, а в наиболее предпочтительном варианте от 100 до 400 мг активного ингредиента на форму единичной дозы.
Несмотря на то, что можно применять только активные ингредиенты, в предпочтительном варианте их применяют в фармацевтических формах. Формы (композиции) в соответствии с изобретением содержат по крайней мере один активный ингредиент, как он определен выше, вместе с одним или несколькими приемлемыми носителями его, а также, возможно, другие терапевтические ингредиенты. Носитель (носители) должен быть "приемлемым" в том смысле, что он должен быть совместимым с другими ингредиентами композиции и не должен оказывать неблагоприятное воздействие на реципиента.
К вышеупомянутым формам относятся формы, пригодные для стоматического, прямокишечного применения, применения через нос, местного (включая буккального и под щеку) применения, влагалищного или парентерального (включая подкожное, внутримышечное, внутривенное, внутрикожное и эпидуральное) применение. Такие формы могут быть изготовлены в форме единичной дозы и могут быть получены любым хорошо известным приемом в область фармацевтики. К таким приемам относится стадия приведения в контакт активного ингредиента с носителем, который включает один или несколько вспомогательных ингредиентов. В общем случае такие формы получают при помощи равномерного и тщательного перемешивания активного ингредиента с жидкими носителями или тонко измельченными твердыми носителями, или с тем и другим, а затем придают смеси необходимую форму.
Формы в соответствии с изобретением для стоматического применения могут иметь вид дискретных единиц таких, как капсулы, пилюли или таблетки, каждая из которых содержит заранее определенное количество активного ингредиента; как порошок ил гранулы; как раствор или суспензия в водной жидкости или неводной жидкости; или как жидкая эмульсия типа масло в воде или жидкая эмульсия типа вода в масле. Активному ингредиенту может быть также придана форма шарика, лекарственной кашки или пасты.
Таблетка может быть получена при помощи прессования или формовки, возможно с использованием одного или нескольких вспомогательных ингредиентов. Прессованные таблетки могут быть получены при помощи прессования, использованием соответствующего устройства, активного ингредиента в свободно текущей форме такой, как порошок или гранулы, может быть смешанного со связывающим агентом (например, повидоном, желатином, оксипропилметил целлюлозой), смазывающим материалом, инертным разбавителем, консервирующим агентом, разрыхляющим агентом (например, гликоллат крахмал натрием, сшитым повидоном, сшитой натрий карбоксиметил целлюлозой), поверхности-активным или диспергирующим агентом. Формованные таблетки могут быть изготовлены при помощи формования в соответствующем устройстве смеси порошкообразного соединения, смоченного инертным жидким разбавителем. Таблетки могут быть покрыты оболочкой или снабжены бороздкой, ей может быть придана такая форма, которая обеспечивала бы медленное или контролируемое высвобождение активного ингредиента, используя, например, оксипропилметилцеллюлозу в варьируемых пропорциях, чтобы обеспечить необходимый профиль высвобождения.
При инфицировании глаза или других внешних тканей, например рта и кожи, композиции в предпочтительном варианте применяют в виде местных мазей или кремов, содержащих активный ингредиент в количестве, например, от 0,075 до 20 в/в%, в предпочтительном варианте от 0,2 до 15 в/в%, а в наиболее предпочтительном варианте от 0,5 до 10 в/в%. Если вышеупомянутой формой является мазь, активные ингредиенты могут быть использованы вместе либо с парафиновой, либо со смешивающейся с водой основой мази. В качестве альтернативы активные ингредиенты могут быть использованы для изготовления крема на основе масла в воде.
Если это необходимо, водная фаза крема может включать, например, по крайней мере 50 в/в% многоатомного спирта, а именно спирта, содержащего две и более гидроксильные группы такого, как пропилен гликоль, бутан-1,3-диол, маннит, сорбит, глицерин и полиэтилен гликоль, и их смеси. Местные формы могут при желании содержать соединение, которое увеличивает поглощение или проникновение активного ингредиента через кожу или другие пораженные области. Примеры таких агентов, ускоряющих проникновение через кожу, включает диметилсульфоокись и связанные с ней аналоги.
Масляная фаза эмульсий в соответствии с изобретением может быть сформирована из известных ингредиентов при помощи известного приема. Несмотря на то, что эта фаза может содержать только эмульгатор (известный также под другим названием эмульгент), в предпочтительном варианте она содержит смесь по крайней мере одного эмульгатора с жиром или маслом, или с тем и другим. В предпочтительном варианте гидрофильный эмульгатор включается вместе с лиофильным эмульгатором, который действует как стабилизатор. В предпочтительном варианте она также включает вместе масло и жир. Вместе эмульгатор (эмульгаторы) со стабилизатором (стабилизаторами) или без него образуют так называемый эмульгирующий воск и этот воск вместе с маслом и/или жиром образует так называемую эмульгирующую основу мази, которая образует диспергированную в масле фазу крема.
Эмульгаторы и стабилизаторы эмульсии, пригодные для использования в форме в соответствии с изобретением, включают Твин 60, Спэн 80, кетостеариловый спирт, миристиловый спирт, моно-стеарат глицерила и лаурил сульфат натрия.
Выбор соответствующих масел или жиров для композиции основан на достижении необходимых косметических свойств, так как растворимость активного соединения в большинстве масел, подобных тем, что используются в формах фармацевтических эмульсий, очень низка. Так крем в предпочтительном варианте должен быть нежирным, не оставляющим пятен и смываемым продуктом, имеющим соответствующую консистенцию, которая позволяла бы избежать вытекания из труб или других контейнеров. Можно использовать одно- или двухосновные алкиловые сложные эфиры с линейной или разветвленной цепью такие, как ди-изоадипат, изоцетил стеарат, пропилен гликолевый сложный диэфир жирных кислот кокосового ореха, изопропил миристат, децил олеат, изопропил палминат, тутил стеарат, 2-этилгексил палминат или смесь сложных эфиров с разветвленной цепью, известная как Кродамол КАП, причем последние три являются предпочтительными сложными эфирами. Они могут быть использованы отдельно или в комбинации, в зависимости от необходимых свойств. В качестве альтернативы можно использовать липиды с высокой температурой точки плавления такие, как белый мягкий парафин и/или жидкий парафин, или другие минеральные масла.
Композиции, пригодные для местного применения к глазам, включают также глазные капли, в которых активный ингредиент растворен или суспендирован в соответствующем носителе, в частности водном растворителе для активного ингредиента. Активный ингредиент в предпочтительном варианте содержится в таких формах в концентрации от 0,5 до 20%, в предпочтительном варианте от 0,5 до 10%, например, в концентрации примерно 1,5 в/в%.
Композиции, пригодные для местного применения в ротовой полости, включает лепешки, содержащие активный ингредиент в приятной на вкус основе, в общем случае в сахаре и акации или трагаканте; пастилки, содержащие активный ингредиент в инертной основе такой, как желатин и глицерин, или сахар и акация; микстуру для ротовой полости, содержащую активный ингредиент в соответствующем жидком носителе.
Композиции для прямокишечного применения могут иметь форму суппозиториев на подходящей основе, содержащей, например, кокосовое масло или салицилат.
Композиции, предназначенные для применения через нос, в которых носитель является твердым веществом, включают крупный порошок, имеющий размер частиц, например, 20 - 500 мкм, который применяют при помощи быстрого вдыхания через носовую полость из контейнера с порошком, который придерживают вблизи носа. К подходящим композициям, в которых носитель является жидкость, для применения, например, в форме аэрозоля для носа или капель для носа, относятся водные или масляные растворы активного ингредиента.
Формы, предназначенные для влагалищного применения, могут иметь вид пессариев, тампонов, кремов, гелей, паст, пен или аэрозолей, содержащих наряду с активным ингредиентом носителя, применение которых в этой области техники хорошо известно.
Формы, предназначенные для парентерального применения, включают водные и неводные стерильные растворы для инъекций, которые могут включать антиоксиданты, буферные материалы, бактериостаты и растворенные вещества, которые придают форме изотонные свойства относительно крови предполагаемого реципиента; водные и неводные стерильные суспензии, которые могут включать суспендирующие агенты и загущающие агенты. Эти формы могут иметь вид единичной дозы или нескольких доз, например герметически закрытые ампулы и пузырьки, и могут храниться в высушенных замораживанием (лиофилизованных) условиях, требующих добавления только стерильного жидкого носителя, например, воды для инъекций непосредственно перед использованием. Неподготовленные растворы и суспензии для инъекций могут быть получены из стерильных порошков, гранул и таблеток того типа, что были описаны выше.
Предпочтительными формами единичной дозы являются формы, содержащие ежедневную дозу или единичную ежедневную поддозу, как она была определена выше, или соответствующие ее доли активного ингредиента.
Должно быть ясно, что наряду с ингредиентами, перечисленными выше, формы, являющиеся предметом изобретения, могут включать другие агенты, применение которых в зависимости от типа формы хорошо известно, например агенты, предназначенные для стоматического применения, могут включать придающие приятный вкус агенты.
В соответствии с изобретением предлагается способ получения соединения формулы I(а) или его приемлемого с фармацевтической точки зрения производного, в частности, его сложного эфира, заключающийся в взаимодействии соединения формулы (II)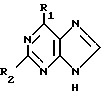
в которой
R1 и R2 уже были определены выше, с соединение формулы (III)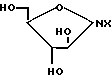
в которой
X представляет пиримидиновое или пуриновое основание отличное от соединения формулы (II), либо
B. взаимодействие соединения формулы (IV):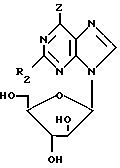
в которой
Z является замещаемой группой, а R2 уже был определен выше, с соединением, способным ввести необходимую группу в 6-позиций; и, возможно, последующее или одновременное с этим в том случае, когда полученным в результате соединения является соединение формулы (I), превращение его в его приемлемое с фармацевтической точки зрения производное, превращение его в другое, приемлемое с фармацевтической точки зрения, производное соединения формулы (I).
Что касается способа A, то X в предпочтительном варианте является урациловым основанием. Эта реакция может быть осуществлена, например, при помощи обработки соединений формул II и III ферментом таким, как фермент фосфорилаза, например уридин фосфорилаза или пурин нуклеозид фосфорилаза, или их смесью в предпочтительном варианте в присутствии фосфатной соли при pH 5,0-9,0 и температуре от 15 до 90oC, в предпочтительном варианте - от 40 до 60oC.
Что касается процедуры B, то она может, быть осуществлена в соответствии с процедурой, описанной Рейстом и др., в J.Org. Chem. 27 (1962), c. 3274-3279. Соответствующей замещаемой группой является атом галогена, например хлора, реакцию в предпочтительном варианте осуществляют в органическом растворителе, например абсолютном метаноле с агентом, способным обеспечить необходимую группу в 6-позиции, например, соответствующим амином в случае, когда R1 представляет алкил- или диалкиламиногруппу.
Приемлемые с физиологической точки зрения сложные эфиры и соли соединений формулы (I) могут быть получены при помощи известных приемов, например сложные эфиры могут быть получены при помощи этерификации основного соединения с использованием подходящего ацил галида или ангидрида. В качестве альтернативы сложные эфиры могут быть получены при помощи замещения соответствующей замещаемой группы, например галида подходящей карбоновой кислотой, или при помощи разрыва соответствующего ангидронуклеозида основного соединения при помощи подходящей карбоновой кислоты или ее соли.
Пример 1. 9- β -D-арабинофуранозил-6-метиламино-9H-пурин.
6-Тиол-9- β -D-арабинофуранозил)9-H-пурин (Рейст Е.Дж. и др., J.Org, Chem, 27 (1962), с. 3274-3279) (0,35 ммоль, 100 мг) и 5 мл абсолютного метанола соединяли и охлаждали до температуры - 10oC, обеспечивая при этом защиту от влаги. В течение 2 мин через суспензию осторожно барботировали газообразный хлор. Полученный в результате раствор перемешивали в течение 5 мин при температуре - 10oC, затем через хлодный раствор в течение 15 мин барботировали сухой азот до тех пор, пока не будет удален избыточный хлор. В реакционную смесь добавляли 2 мл 40%-ного водного раствора метиламина, которую затем нагревали в автоклаве из нержавеющей стали при температуре 115oC, поддерживаемой в течение 4,5 ч. Реактор охлаждали до 0oC и содержимое выпаривали до сухого состояния, обеспечивая 88%-ный выход соединения, указанного в заголовке примера. После рекристаллизации в воде проба имела температуре точки плавления 201,5 - 202,5oC.
Результаты анализа: рассчитано для C11H13N5O4:
Рассчитано: C 47,0; H 5,38; N 24,9.
Найдено: C 47,2; H 5,72; N 25,2.
Пример 2. 9- β -D-арабинофуранозил-6-диметиламинопурин.
6-диметиламинопурин (Сигма Кэмикэл Ко., Сент-Луис, МО) (6,4 ммоль, 1,04 г) и урацил арабинозид (Торренс, П.Ф., и др. J. Med. Chem., 22(3) (1979), с. 316 - 319 (8 ммоль, 1,96 г) соединяли в 0,412 л 5 мМ раствора фосфата калия, pH 8,0, с 0,02% азида калия. Добавляли очищенную пурин нуклеозид фосфорилазу (3260 ед. ) и уридин фосфорилазу (810 ед.), и раствор перемешивали при температуре 35oC. Через 59 дней реакцию подвергали лиофилизации. Остаток суспендировали в 250 мл воды и перемешивали при комнатной температуре в течение 1 ч. Твердые материалы отделяли фильтрацией и фильтрат хранили при температуре 3oC. Через 72 ч осадок собирали и соединяли с предыдущей лепешкой. Все это добавляли в 100 мл 95%-ного этанола в воде, нагревали до кипения и фильтровали. Растворитель удаляли под вакуумом, а остаток подвергали хроматографии на смоле типа БИОРад П-2 в 30% н-пропанол/вода (об./об.), один раз используя колонну размером 7,5•90 см и еще два раза колонну 5•90 см. В результате этой процедуры получали 0.12 г 6-диметиламинопурин 9- β -D-арабинофуранозида в форме 0,5 гидрата.
Результаты анализа: рассчитано для C12H17N5O4 • 0,5 H20.
Рассчитано: C 47,36; H 5,96; N 23,01
Найдено: C 47,23; H 5,59; N 22,75
ЯМР- и масс-спектры согласуются с такой структурой.
Пример 3. 9- β -D-арабинофуранозил-6-метоксипурин.
6-метоксипурин (фирма Сигма Кэмикэл Ко., Сент-Луис, МО), (6,6 ммоль, 1 г) и урацил арабинозид (Торренс, П.Ф. и др., J. Med. Chem., 22(3) (1979)) (10,1 ммоль, 2,45 г) суспендировали в 575 мл 10 мМ фосфата калия, 0,04%-ном растворе азида калия, pH 7,8, содержащем 10% н-пропанола (об./об.). Добавляли очищенную уридин фосфорилазу (560 м.е.) и пурин нуклеозид фосфорилазу (10000 м. е.) (Кренитцкий, Т.Э. и др. Biochemistry, 20, с. 3615, 1981 и патент США N 4381444) и раствор перемешивали при температуре 35oC. Тридцать дней спустя реакцию фильтровали. Фильтрат подщелачивали до pH 10,5 при помощи гидрата окиси аммония и подвергали хроматографии на колонне 2,5x7 см, содержащей смолу Доуекс-1-формиат. Смолу элюировали 30% н-пропанол/вода (об. /об. ). Фракции, содержащие продукт, соединяли, а растворитель удаляли под вакуумом. Смолу растворяли в 30% н-пропанол/вода (об./об.) и подвергали хроматографии на колонне типа Био-Рад П-2 (7,5x90 см). Содержащие продукт фракции соединяли и после лиофилизации получали 0,922 г 6-метоксипурин-9- β -D-арабинофуранозида в виде дигидрата.
Результаты анализа: рассчитано для C11H14N4O5•2H2O.
Рассчитано: C 41,51; H 5,70; N 17,70
Найдено: C 41,46; H 5,74; N 18,13
ЯМР- и масс-спектры согласуются с такой структурой.
Пример 4. 9- β -D-арабинофуранозил-6-этоксипурин.
6-Этоксипурин (Фирма Сигма Кэмикэл Ко., Сент-Луис, МО) (3,05 ммоль, 0,5 г) и урацил арабинозид (6,09 ммоль, 1,48 г) суспендировали в 100 мл 10 мМ фосфата калия, 0,04%-ний раствор азида калия при pH 7,4. Добавляли очищенную уридин фосфорилазу (6000 м. е.) и пурин нуклеозид фосфорилазу (8400 м.е.) (Кренитцкий, Т. Э. , и др., Biochemistry, 20, с. 3615, 1981 и патент США N 4381444) и суспензию перемешивали при температуре 35oC.
Через 168 ч добавляли еще 18000 ед. уридинфосфорилазы и 75600 единиц пурин нуклеозид фосфорилазы. Через семь дней реакцию фильтровали, а фильтрат подвергали хроматографии на колонне, содержащей смолу Доуекс-1-гидроксид (2,5x8 см). Колонну элюировали смесью 90% метанол/вода (об./об.). Фракции, содержащие продукт, соединяли, а растворитель удаляли под вакуумом. Остаток растворяли в 30%-ном н-пропаноле и воде (об./об) и подвергали хроматографии на колонне, содержащей БиоРад P-2 (5x90 см). Продукт элюировали смесью 30% н-пропанол/вода (об./об). Фракции, содержащие продукт, соединяли, а растворитель удаляли под вакуумом, в результате чего получали 0,363 г 6-этоксипурин-9- β -D-арабинофуранозида, который идентифицировали как 0,3 гидрат.
Результаты анализа: рассчитано для C12H16N4O5•0,3 H2O.
Рассчитано: C 47,78; H 5,55; N 18,57
Найдено: C 47,99; H 5,54; N 18,40
ЯМР- и масс-спектры согласуются с этой структурой.
Пример 5. 9- β -D-арабинофуранозил-6-йодпурин.
6-Йодпурин (фирма Сигма Кэмикэл Ко., Сент-Луис, МО) (4 ммоль, 1 г) растворяли в 16 мл 1,2-диметоксиэтана при нагревании. Добавляли пятьдесят миллилитров раствора урацил арабинозида (10,1 ммоль) в 10 мМ фосфата калия, 0,04%-ный раствор азида калия, pH 7,4. Добавляли очищенную уридин фосфарилазу (6800 м.е.) и пурин нуклеозид фосфорилазу (12000 м.е.) и реакцию перемешивали при температуре 35oC. Через 21 день добавляли еще 4800 единиц уридин фосфорилазы и 20000 единиц пурин нуклеозид фосфорилазы. Через девяносто дней реакцию фильтровали, а растворитель удаляли под вакуумом. Остаток растворяли в 100 мл воды, нагревали паром, а затем фильтровали. Фильтрат подвергали хроматографии на колонне, содержащей смолу КСАД-2 (5x35 см). Эту колонну элюировали 2 л воды, а затем 2 л этанола. Фракции, содержащие продукт, соединяли, а растворитель удаляли под вакуумом. Остаток растворяли в 30% н-пропанол/вода (об./об.) и подвергали хроматографии на колонне типа Сефадекс Г-10 (5x90 см). Эту колонну элюировали смесью 30% н-пропанол/вода (об./об.). Фракции, содержащие продукт, соединяли и после удаления растворителя под вакуумом получали 0,253 г 6-йодпурин-9- β -D-арабинофуранозида, который идентифицировали как 1,5 гидрат.
Результаты анализа: рассчитано для C10H11IN4O4•1,5 H2O:
Рассчитано: C 26,65; H 3,48; N 13,83; I 31,32
Найдено: C 29,43; H 3,53; N 13,66; J 31,20
ЯМР- и масс-спектр согласуются с такой структурой.
Пример 6. 9- β -D-арабинофуранозил-2-амино-6-йодпурин.
2-Амино-6-йодпурин (фирма Сигма Кэмикэл, Сент-Луис, МО) (25,5 ммоль, 6,75 г) и урацил арабинозид (61,9 ммоль, 15,1 г) соединяли в 0,31 л 10 мМ фосфата калия, pH 6,9, с 0,02% азида калия. Добавляли очищенную пурин нуклеозид фосфорилазу (17000 ед.) и уридин фосфорилазу (2000 ед.), и раствор перемешивали при температуре 37oC. Через 18 дней добавляли еще 5700 единиц уридин фосфорилазы. Через пятьдесят семь дней реакцию фильтровали, а фильтрат подвергали хроматографии на колонне, содержащей смолу КСАД-2 (8x11 см). Продукт элюировали последовательным градиентом этанол/вода (об./об.) следующим образом: 0,35 л 10%; 1 л 20%; 1 л 50%; 0,2 л 95%. Фракции, содержащие продукт, соединяли, а этанол удаляли под вакуумом. Остаток растворяли в 30% н-пропанол/вода (об./об.) и подвергали хроматографии на колонне 7,6x90 см, содержащей смолу Био-Рад П-2. В результате получали 1,1 г 2-амино-6-йодпурин-9- β -D-арабинофуранозида в виде 0,5 гидрата.
Результаты анализа: рассчитано для C10H12N5O4•0,5 H2O;
Рассчитано: C 29,87; H 3,26; N 17,41
Найдено: C 29,86; H 3,29; N 17,39
ЯМР- и масс-спектры подтверждали эту структуру.
Пример 7. 9- β -D-арабинофуранозил-6-пирролидинопурин.
6-Пирролидинопурин (фирма Сигма Кэмикэл К., Сент-Луис. МО) (2,6 ммоль) 0.5 г и урацил арабинозид (5,29 ммоль, 1,29 г) суспендировали в 100 мл 10 мМ фосфата калия, 0,04%-ном растворе азида калия при pH 7,4. Добавляли очищенную уридин фосфорилазу (6000 м.е.) и пурин нуклеозид фосфорилазу (8400 м.е.) (Кренитцкий, Т. А. и др., Biochemistry, 20, с. 3615 (1981) и патент США N 4381444), и суспензию перемешивали при температуре 35oC. Через двадцать дней реакцию фильтровали и фильтрат подвергали хроматографии на колонне, содержащей смолу Доуекс-1-гидроксид (2,5x8 см). Продукт элюировали из колонный при помощи смеси 90% метанол/вода (об./об). Фракции, содержащие продукт, соединяли, а растворитель удаляли под вакуумом. Остаток растворяли в 50 мл 30% н-пропанола и воды (об./об.) и подвергали хроматографии на колонне типа БиоРад П-2 (5x90 см). Продукт элюировали с использованием 30% н-пропанол/вода (об. /об. ). Фракции, содержащие продукт, соединяли, а растворитель удаляли под вакуумом, в результате чего получали 0,573 г 6-пирролидинопурин-9- β -D-арабинофуранозида.
Результаты анализа: рассчитано для C14H19N5O4:
Рассчитано: C 52,33; H 5,96; N 21,79
Найдено: C 52,60; H 6,09; N 21,51
ЯМР- и масс-спектры подтверждают структуру.
Пример 8. 9- β - D-арабинофуранозил-2-хлор-6-метиламинопурин.
Раствор 2,6-дихлор-2', 3', 5'-три-O-бензил-9( β -D-арабинофуранозил)-пурина (Келлер, Ф. и др., J. Org, Chem., 32, стр. 1644 (1967); Монтгомери, Дж. Э. и Хьюсон, К. Дж., J. Med. Chem 12, с. 498 (1967)) (5,92 г, 10 ммоль) в бензоле (35 мл раствора, 0,6 г метиламина на 10 мл бензола) выдерживали при комнатной температуре в герметически закрытом автоклаве в течение 4 дней. Реактор охлаждали льдом, открывали и содержимое фильтровали, чтобы удалить хлоргидрат метиламина. Растворитель удаляли под вакуумом, в результате чего получали масло, которое соединяли с маслом реакции с тем же количествами, но проведенной при температуре 125oC. Общий вес составлял 11,4 г. В результате тонкослойной хроматографии (ТСХ) устанавливали, что материал представляет собой смесь исходного материала, моно- и диметиламино соединений. Масло подвергали хроматографии на 285 г силикагеля, используя 30% ацетона и 70% циклогексана (объемы). Компоненты, вытекающие ниже исходного материала (ТСХ, силикагель, 3:7, ацетон-циклогексан), а растворитель удаляли под вакуумом. Выход: 4,8 г 2-хлор-6-метиламино-2', 3', 5'-ти-O-бензил-9-( β -D-арабинофуранозил)пурина в виде масла. Порцию 1,1 г этого материала в 40 мл 2-метоксиэтанола добавляли в хлорид палладия (0,87 г), который предварительно восстанавливали в аппарате Парра. Смесь подвергали гидрогенизации при давлении 50 фунтов/кв.дюйм (3,515 кг/см2) в течение 30 мин в атмосфере водорода, которую заменяли после первых 15 мин. Катализатор удаляли фильтрацией через слой Целита и промывали метанолом. Фильтрат нейтрализовали добавлением Доуекс-1 (HCO3).
Смолу удаляли фильтрацией и промывали метанолом. Фильтрат выпаривали под вакуумом, а остаток растирали с хлороформом. Сырой продукт промывали горячей водой, растворяли в горячем метаноле, фильтровали, охлаждали и твердое вещество собирали. В результате кристаллизации из кипящей воды получали продукт в виде гидрата.
Выход: 44,5 мг; температура точки плавления: 224-225oC.
Результат анализа: рассчитано для C11H14N5O4CI•H2O:
Рассчитано: C 39,58; N 20,98; H 4,84
Найдено: C 39,27; N 20,83; H 5,16
Пример 9. 9- β -D-арабинофуранозил-6-циклопропиламинопурин.
6-Циклопропиламинопурин (полученный при помощи нуклеофильного замещения группы хлора на 6-хлорпурине (фирма Сигма Кэмикэлз Ко., Сент-Луис, МО) с использованием циклопропиламина в ацетонитриле) (2,85 ммоль, 0,5 г) и урацил арабинозид (Торренс, П. Ф. и др., J. Med. Chem., 22(3) (1979), с. 316-319) (5,71 ммоль, 1,39 г) суспендировали в 100 мл 10 мМ фосфата калия, 0,04%-ного раствора азида калия с pH 7,4. Добавляли очищенную уридин фосфорилазу (6000 м.е.) и пурин нуклеозид фосфорилазу (8400 м.е.) (Кренитцкий и др., Biochemistry, 20, с. 3615, 1981 и патент США N 381444), и суспензию перемешивали при температуре 35oC. Через 120 ч реакцию фильтровали и фильтрат подвергали хроматографии на колонне, содержащей смолу Доуекс-1-гидроксид (2,5x10 см). Колонну элюировали смесью 90% метанол/вода (об./об.). Фракции, содержащие продукт, соединения, а растворитель удаляли под вакуумом. Остаток растворяли в 30% н-пропаноле и воде (об./об.) и подвергали хроматографии на БиоРад П-2 (5x90 см). Колонну элюировали 30% н-пропинол/вода (об/об). Осадок из реакции подвергали рекристаллизации из горячего метанола, в результате чего получали 0,0,52 г, соединения, которое идентифицировали как моногидрат 6-циклопропиламинопурин-9- β -D-арабинофуранозида. Фильтрат после рекристаллизации подвергали хроматографии на смоле БиоРад П-2 (5x90 см), как это было описано выше. Фракции, содержащие продукт, из обеих колонн соединяли, а растворитель удалили под вакуумом, в результате чего получали 0,342 г 6-циклопропиламинопурин-9- β -D-арабинофуранозида, который имел форму 0,8 гидрата с 0,3 C3H8O.
Результаты анализа: рассчитано для C13H17N5O4•1H2O;
Рассчитано: C 48,00; H 5,89; N 21,53
Найдено: C 48,05; H 5,89; N 21,55
ЯМР- и масс-спектры подтверждают эту структуру.
Пример 10. 9- β -D-арабинофуранозил-6-этил/метил/аминопурин
6-Этил(метил)аминопурин получали при помощи нуклеофильного замещения группы хлора на 6-хоррпурине (фирма Сигма Кэмекэлз, Сент-Луис, МО) при помощи 6-этил(метил)амина в ацетонитриле. 6-этил(метил)аминопурин (2,8 ммоль, 0,5 г) и урацил арабинозид (5,6 ммоль, 1,38 г) суспендировали в 575 мл 10 мМ фосфата калия, 0,04%-ном растворе азида калия, pH 7,4, содержащем 10% н-пропанола (об/об). Добавляли очищенную уридин фосфорилазу (6000 м.е.) и пурин нуклеозид фосфорилазу (8400 м.е.). (Кренитцкий и др., Biochemistry, 20, с. 3615, 1981 и патент США N 4381444), и раствор перемешивали при температуре 37oC. Через девятнадцать дней раствор фильтровали и фильтрат подвергали хроматографии на колонне 2,5x13 см, содержащий смолу Доуекс-1-гидроксид. Смолу элюировали смесью 90% метанол/вода (об/об). Фракции, содержащие продукт, соединяли и растворитель удаляли под вакуумом. Остаток растворяли в 30% н-пропанол/вода (об/об) и подвергали хроматографии на колонне типа БиоРад П-2 (7,5x90 см). Содержащие продукт фракции соединяли и после лиофилизации получали 0,680 г 6-этил(метил)аминопури-9- β -D-арабинофуранозида.
Результаты анализа: рассчитана для C13H19N5O4:
Рассчитано: C 50,48; H 6,19; N 22,64
Найдено: C 50,36; H 6,25; N 22,52
ЯМР- и масс-спектры согласуются с такой структурой.
Пример 11. 9- β -D-арабинофуранозил-2-амино-6-метоксипурин.
2-Амино-6-метоксипурин (полученный при помощи нуклеофильного замещения группы хлора на 2-амино-6-хлорпурине (фирма Сигма Кэмикэлз, Сент-Луис, МР) при помощи метанола с гидридом натрия в тетрагидрофуране (6,4 ммоль, 1,05 г) соединяли с 35 мл раствора урацил арабинозида (7,04 ммоль, 1,75 г) в 10 мМ фосфате калия и 7%-ном н-пропаноле (об/об). pH обеспечивали на уровне 6,75. Добавляли очищенную пурин нуклеозид фосфорилазу (18000 ед.) и уридин фосфорилазу (1020 ед. ), и раствор инкубировали при температуре 37oC. Через 26 дней реакцию фильтровали и фильтрат подвергали хроматографии на колонне из смолы Дуоекс-1-формиат (2x7 см) после доведения pH до 10,5 с использованием концентрированного гидрата окиси аммония. Колонну элюировали с использованием 7% смеси н-пропанол/вода (об/об), и фракции, содержащие продукт, соединяли, а растворитель удаляли под вакуумом. Остаток экстрагировали 25 мл воды и фильтрат отделяли от твердого материала центрифугированием. Верхний слой после выдерживания при окружающей температуре давал кристаллы 2-амино-6-метокси-9- β -D-арабинофуранозида, которые давали после сушки под вакуумом 0,327 г продукта.
Результаты анализа: рассчитано для C11H15N5O5:
Рассчитано: C 44,44; H 5,09; N 23,56
Найдено: C 44,49; H 5,13; N 23,52
ЯМР- и масс-спектры подтверждали эту структуру.
Пример 12. 9- β -D-арабинофуранозил-6-н-пропоксипурин
6-н-Пропоксипурин (5,6 ммоль, 1 г, фирма Сигма Кэмикэлз, Сент-Луис, МО) соединяли с 545 мл раствора урацил арабинозида (10,1 ммоль) в 10 мМ фосфата калия и 7%-ном н-пропаноле (об/об). Добавляли очищенную уридин фосфорилазу (680 м.е.) и пурин нуклеозид фосфорилазу (12000 м.е.), и реакцию перемешивали при температуре 35oC. Реакцию фильтровали через 59 дней и фильтрат хранили при температуре 3oC в течение 20 ч. Полученный в результате осадок собирали центрифугированием, растворяли в 30% н-пропанол/вода (об/об) и подвергали хроматографии на колонне из Доуекс-1-формиата (2,5x5 см) после того, как pH обеспечивали на уровне 10,5 с использованием концентрированного раствора гидрата окиси аммония. Колонну элюировали смесью 30% н-пропанол/вода (об/об) и фракции, содержащие продукт, соединяли и растворитель удаляли под вакуумом. Остаток растворяли в н-пропаноле и подвергали хроматографии на колонне, содержащей БиоРад П-2 (5x90 см). Колонну элюировали при помощи 30% н-пропанол/вода (об/об). Содержащие продукт фракции соединяли и после удаления растворителя под вакуумом остаток растворяли в воде и подвергали хроматографии на колонне, содержащей БиоРад П-2 (5x90 см). Колонну элюировали водой. Содержащие продукт фракции соединяли и после лиофилизации получали 0,758 г 6-н-пропоксипурин-9- β -D-арабинофуранозида в форме моногидрата.
Данные анализа: рассчитано для C13H18N4O5•1,0 H2O:
Рассчитано: C 47,56; H 6,14; N 17,06
Найдено: C 47,63; H 6,13; N 17,11
ЯМР- и масс-спектры согласуются с этой структурой.
Пример 13. 9-(5-O-бензоил- β -D-арабинофуранозил)-6-метокси-9H-пурин.
9-( β -D-арабинофуранозил)-6-метокси-9H-пурин из примера 3 (0,283 г, 1,0 ммоль) растворяли в безводном диметилацетамиде (5,0 мл), быстро охлаждали до 4oC и добавляли бензоил хлорид (0,155 г, 1,1 ммоль). Смесь перемешивали в течение 24 ч в атмосфере аргона, затем давали возможность медленно нагреться до комнатной температуре. Затем при комнатной температуре добавляли еще 1,1 эквивалента бензоил хлорида и перемешивание продолжали еще в течение 24 ч. Реакцию быстро прерывали, сливая на 50 мл смеси лед-вода, экстрагировали с использованием CHCI3 (3x30 мл) и органические экстракты сушили (сульфат магния). Остаток после выпаривания подвергали очистке при помощи оперативной хроматографии на силикагеле (25,0 г, 2,5x15 см) последовательным градиентом от CHCI3 до CHCI3: ацетон/1: 1. Фракции, содержащие продукт с Rf = 0,21 (силикагель, CHCl3: ацетон (1:1)) соединяли, в результате чего получали 92 мг целевого соединения: температура точки плавления: 202-204oC.
Результаты анализа: рассчитано для C18H18N4O6:
Рассчитано: C 55,96; H 4,70; N 14,50
Найдено: C 56,04; H 4,74; N 14,40
ЯМР- и масс-спектр подтверждают приведенную выше структуру.
Пример 14 6-Метокси-9-[5-0-(4-метилфенилсульфонил) - β -D-арабинофуранозил]-9H-пурин.
4-Толуолсульфонил хлорид (0,312 г, 1,63 ммоль) сразу же после рекристаллизации и 9- β -D-арабинофуранозил)-6-метокси-9H-пурин из примера 3 (0,308 г, 1,09 ммоль) суспендировали в безводном ацетонитриле (25 мл), охлажденном до 3oC в ледяной ванне, и добавляли пиридин (5,0 мл), чтобы растворить нуклеозид. Раствор перемешивали в атмосфере аргона при температуре 3oC в течение 1 ч. Затем выдерживали при температуре -15oC в течение 42 ч. Реакцию быстро прекращали добавлением 5%-ного NaHCO3 (3 мл), выпаривали до приблизительно 10 мл, затем снова выпаривали с 95%-ным этанолом. Остаток абсорбировали на минимальном количестве силикагеля и добавляли в колонну на силикагеле для оперативной хроматографии (25,0 г 2,5x15 см) в CH2Cl2:MeOH (15:1). В результате элюирования таким растворителем (450 мл) затем CH2Cl2:MeOH (10:1, 550 мл) получали три УФ-абсорбирующих материала. Фракции, содержащие материал с Rf=0,42 (силикагель, CH2Cl2:MeOH (10:1), собирали, а затем подвергали очистке на трех последовательных пластинках из силикагеля для препаративной хроматографии, первую с использованием CH2Cl2:MeOH (10:1) и ацетон: CH2Cl2 (1: 1) на следующих двух пластинках, чтобы получить 88 мг целевого материала в виде прозрачного стекла: температура точки плавления: 177-181oC.
Результаты анализа: рассчитано для C18H20N4O7S•0,15H2O:
Рассчитано: C 49,23; H 4,66; N 12,76
Найдено: C 49,28; H 4,71; N 12,71
ЯМР- и масс-спектры согласуются с такой структурой.
Пример 15. 6-Метокси-9-(5-0-метилсульфонил- β - D-арабинофуранозил)-9H-пурин.
9- β -D-арабинофуранозил)-6-метокси-9H-пурин из примера 3 (0,600 г, 2,13 ммоль) суспендировали в сухом ацетонитриле (40 мл) и добавляли безводный пиридин (8 мл). Колбу охлаждали до -3oC в ванне лед-соль и добавляли метан сульфонил хлорид (0,16 мл, 2,13 ммоль). Через 25 мин раствор быстро охлаждали водой (3 мл) и концентрировали до объема 10 мл, затем несколько раз выпаривали с несколькими добавлениями этанола, выдерживая температуру в области ниже 38oC в течение всего времени. Остаточный пиридин удаляли вакуумным насосом. Остаток наносили на колонну из силикагеля для оперативной хроматографии (25,0 г, 2,5х15см), уравновешенную в CH2Cl2:MeON (15:1). Эту колонну сначала элюировали 150 мл этого растворителя, а затем при помощи CH2Cl2:MeOH (10: 1, 450 мл). Фракции, содержащие материал с Rf=0,34 (силикагель, CH2Cl2: MeOH (10: 1), давали 0,448 г продукта (57%) в виде белой пены: температура точки плавления: 177 - 181oC (разлож.).
Результаты анализа: рассчитано для C12H16N4O7Si•0,5H2O:
Рассчитано: C 39,02; H 4,64; N 15,17
Найдено: C 39,02; H 4,66; N 15,08
ЯМР- и масс-спектры подтверждают эту структуру.
Пример 16. 9-[5-0-(4-Метилбензоил- β -D-арабинофуранозил]-6-метокси-9H-пурин.
9-( β -D-арабинофуранозил)-6-метокси-9H-пурин из примера 3 (0,283 г, 1,0 ммоль) суспендировали в безводном ацетонитриле (10,0 мл), добавляли пиридин (2,3 мл), чтобы получить полное растворение, затем добавляли 4-метил-бензоил хлорид (0,170 г, 1,1 ммоль). Смесь перемешивали при комнатной температуре в течение 24 ч в атмосфере аргона, реакцию быстро прекращали добавлением изопропанола (5 мл) и выпаривали до сухого состояния, а затем снова выпаривали с этанолом (2х20 мл). Далее остаток подвергали очистке с использованием оперативной хроматографии на силикагеле (25,0 г 2,5х15 см) при помощи последовательного градиента от CHCl3 до CHCl3:ацетон, 1:1. Фракции, содержащие продукт с Rf= 0,41 (силикагель, CHCl3 : ацетон (1:1)) соединяли, в результате чего получали 132 мг целевого соединения. Температура точки плавления: 127-128oC.
Результаты анализа: рассчитано для C19H20N4O6•0,5 H2O:
Рассчитано: C 55,74; H 5,17; N 13,69
Найдено: C 55,48; H 5,36; N 13,64
ЯМР- и масс-спектры подтверждали вышеупомянутую структуру.
Пример 17. 9-[5-0-(4-Хлорбензоил)- β -D-арабинофуранозил]-6-метокси-9H-пурин
9- β -D-Арабинофуранозил)-6-метокси-9H-пурин из примера 3 (0,283 г, 1,0 ммоль) суспендировали в безводном ацетонитриле (10,0 мл), затем добавляли пиридин (2,3 мл), чтобы получить полное растворение, и 4-хлор-бензоил хлорид (0,193 г, 1,1 ммоль). Смесь перемешивали при комнатной температуре в течение 24 ч в атмосфере аргона, быстро прекращали реакцию добавлением изопропанола (5 мл) и выпаривали до сухого состояния, затем снова выпаривали с этанолом (2х10 мл). Остаток далее подвергали очистке при помощи оперативной хроматографии на силикагеле (25,0 г, 2,5х15 см) с использованием последовательного градиента от CHCl3 до CHCl3: ацетон (1:1). Фракции, содержащие продукт с Rf= 0,37 (силикагель, CHCl3: ацетон (1:1)), соединяли, в результате чего получали 105 мг целевого соединения: температура точки плавления: 122-124oC.
Результаты анализа: рассчитано для C18H17ClN4O6•0,5 H2O;
Рассчитано: C 50,30; H 4,22; N 13,04
Найдено: C 50,20; H 4,28; N 12,94.
ЯМР- и масс-спектры подтверждали приведенную выше структуру.
Пример 18. 9-[5-0-(4-метоксибензоил)- β - D-арабинофуранозил]-6-метокси-9H-пурин
9-( β -D-арабинофуранозил)-6-метокси-9H-пурин из примера 3 (0,283 г, 1,0 ммоль) суспендировали в безводном ацетонитриле (10,0 мл), добавляли пиридин (2,3 мл), чтобы осуществить полное растворение, затем добавляли 4-метокси-бензоил-хлорид (1,1 ммоль). Смесь перемешивали при комнатной температуре в течение 24 ч в атмосфере аргона и реакцию быстро прекращали добавлением изопропанола (5 мл) и выпаривали до сухого состояния, затем снова выпаривали с этанолом (2х10 мл). Остаток затем подвергали очистке с использованием оперативной хроматографии на силикагеле (25,0 г, 2,5х15 см) использованием последовательного от CHCl3 до CHCl3:ацетон (1:1). Фракции, содержащие продукт с Rf=0,30 (силикагель, CHCl3: ацетон (1:1)) соединяли, чтобы получить 110 мг целевого соединения: температура точки плавления: 195-197oC.
Результаты анализа: рассчитано для C19H20N4O7•0,25 H2O.
Рассчитано: C 52,22; H 4,91; N 13,31
Найдено: C 54,22; H 4,94; N 13,30
ЯМР- и масс-спектры были согласованы с такой структурой.
Пример 19. 6-метокси-9-(5-0-фенилацетал- β - D-арабинофуранозил)-9H-пурин
9-( β -D-арабинофуранозил)-6-метокси-9H-пурин из примера 3 (0,300 г, 1,06 ммоль) суспензировали в ацетонитриле (25 мл), затем добавляли безводный пиридин (5 мл). Раствор охлаждали до 3oC в ледяной ванне и добавляли фенилацетат хлорид (0,20 мл, 1,5 ммоль). После перемешивания при температуре 3oC в течение одного часа раствор охлаждали до -15oC и выдерживали при этой температуре 40 ч. Реакцию быстро прекращали добавление 5%-ного NaHCO3 (3 мл), концентрировали до 10 мл, а затем выпаривали при добавлении несколько раз этанола. Остаток переносили в смесь CH2Cl2:MeOH (15:1) и наносили на колонну из силикагеля для оперативной хроматографии (25,0 г, 2,5х15 см), расположенную в том же растворителе, элюировали 500 мл этого же растворителя, затем смесью (15:1) CH2Cl2: метанол (15:1, 500 мл). Фракции с Rf=0,38 (силикагель, 10: 1, CH2Cl2:метанол) давали 0,128 г сырого продукта с примесями, имеющими более высокие Rf. В результате последующей очистки при помощи препаративной тонкослойной хроматографии с использованием CH2Cl2:MeOH (10:1), а затем при помощи второй пластинки с использованием смеси ацетон: CH2Cl2 (1:1) получали 0,102 г целевого продукта в виде белой пены: температура точки плавления: 74-75oC.
Результаты анализа: рассчитано для C19H20N4O6•0,1 H2O;
Рассчитано: C 56,74; H 5,06; N 13,93
Найдено: C 56,74; H 5,11; N 13,90
ЯМР- и масс-спектры согласуются с вышеупомянутой структурой.
Пример 20. 6-метокси-9-(5-O-фенилоксиацетил- β -D-арабинофуранозил)-9H-пурин
9-( β -D-арабинофуранозил)-6-метокси-9H-пурин из примера 3 (0,322 г, 1,14 ммоль) суспендировали в сухом ацетонитриле (25 мл), затем добавляли безводный пиридин (5 мл). Раствор охлаждали до 3oC в ледяной ванне и добавляли феноксиацетил хлорид (0,24 мл, 1,7 ммоль). После перемешивания в течение двух часов при температуре 3oC реакцию быстро прекращали 5%-ным раствором NaHCO3 (2 мл), концентрировали до объема 10 мл и выпаривали после нескольких добавлений этанола. Остаток подвергали обработке на оперативном хроматографе на силикагеле (25,0 г, 2,5 x 15 см) в смеси CH2Cl2: метанол (15 : 1). В результате элюирования 400 мл этого растворителя, затем смесью 10 : 1 CH2Cl2: метанол (500 мл) и 9 : 1 CH2Cl2: метанол (200 мл) получали 0,213 г сырого продукта. Этот материал подвергали рекристаллизации из метанола, после чего получали 0,101 г (20%) белого кристаллического материала: температура точки плавления 193 - 195oC.
Результаты анализа: рассчитано для C19H20H4O7 • 0,05 H2O.
Рассчитано: C 54,69; H 4,85; N 13,43
Найдено: C 54,69; H 4,89; N 13,40
ЯМР- и масс-спектры подтверждаются вышеуказанную структуру.
Пример 21. 6-метокси-9-(5-O-фенилоксиацетил- β -D-арабинофуранозил)-9H-пурин
9-( β -D-арабинофуранозил)-6-метокси-9H-пурин из примера 3 (0,300 г, 1,06 ммоль) суспендировали в ацетонитриле (25 мл), а затем добавляли безводной пиридин (5 мл). Раствор охлаждали до -3oC в ванне лед-соль и добавляли метоксиацетил хлорид (0,10 мл, 1,1 ммоль). После перемешивания в ванне лед-соль в течение двух часов реакцию прекращали 5%-ным NaHCO3 (2 мл), объем концентрировали до 10 мл, а затем выпаривали после нескольких добавлений этанола. Остаток наносился на силикагель колонны для оперативной хроматографии (25,0 г, 2,5 x 15 см), содержащейся в 10 : 1 смеси CH2Cl2 : MeOH. В результате элюирования 500 мл этого растворителя, затем 9 : 1 смесью CH2Cl2 : MeOH (300 мл) получали 0,086 г сырого продукта. Этот материал подвергали рекристаллизации из MeOH и воды, после чего получали 0,035 г (9,3%) белых кристаллов: температура точки плавления: 137 - 139oC.
Результаты анализа: рассчитано для C14H18H4O7 • 0,5 H2O.
Рассчитано: C 46,28; H 5,27; N 15,42
Найдено: C 46,33; H 5,27; N 15,37
ЯМР- и масс-спектры подтверждаются вышеуказанную структуру.
Пример 22. 9-[5-O-(4-Нитробензоил)- β -D-арабинофуранозил]-6-метокси-9H-пурин
9-( β -D-арабинофуранозил)-6-метокси-9H-пурин из примера 3 (0,283 г, 1,0 ммоль) суспендировали в безводном ацетонитриле (10,0 мл), добавляли пиридин (2,3 мл), чтобы осуществить полное растворение, затем 4-нитро-бензоил хлорид (0,205 г, 1,1 ммоль). Смесь перемешивали при комнатной температуре в течение 24 ч в атмосфере аргона, реакцию быстро прекращали добавлением изопропанола (5 мл) и выпаривали до сухого состояния, затем еще два раза выпаривали с этанолом (2 x 10 мл). Остаток затем подергали очистке с использованием оперативной хроматографии на силикагеле (25,0 г, 2,5 x 15 см) и последовательного градиента от CHCl3 до CHCl3: ацетон (1 : 1). Фракции, содержащие продукт с Rf = 0,37 (силикагель, CHCl3:ацетон (1 : 1)) соединяли, в результате чего получали 105 мг целевого соединения, температура точки плавления 202 - 203oC.
Результаты анализа: рассчитано для C18H17H5O8;
Рассчитано: C 50,12; H 3,97; N 16,24
Найдено: C 50,21; H 4,02; N 16,16
ЯМР- и масс-спектры подтверждают вышеуказанную структуру.
Пример 23. 6-Метокси-9-(5-O-пентаноил- β -D-арабинофуранозил)-9H-пурин
9-( β -D-арабинофуранозил)-6-метокси-9H-пурин из примера 3 (0,852 г, 3,01 ммоль) суспендировали в сухом ацетонитриле (75 мл) и добавляли сухой пиридин (15 мл). Раствор охлаждали в ванне лед/вода и добавляли пентаноил хлорид (0,4 мл, 3,31 ммоль). Реакцию быстро прекращали спустя два часа добавлением 3 мл метанола и выпаривали до прозрачного вязкого масла. Остаток подвергали очистке с использованием оперативной хроматографии на силикагеле и последовательного градиента от CHCl3 до CHCl3 : MeOH (9 : 1). Продукт с выходом 330 мг содержал примеси соответствующего сложного 2'-эфира (см. пример 32) и неизвестный материал с более низким Rf. Затем остаток подвергают очистке при помощи обращенно-фазовой препаративной жидкостной хроматографии (высоко эффективной) (ВЭЖХ) (Аллтех C18, 10 мм x 25 мм, размер части 10 мкм 70% H2O : 30% CH3CN, 4,0 мл/мин), приготавливая раствор 10 мг/мл в том же растворителе с объемом впрыскивания 1,0 мл. Остаток снова выпаривали с ацетоном, в результате его получали 260 мг белой ломкой пены (24%): температура точки плавления: 85 - 95oC.
Результаты анализа: рассчитано для C16H22H4O6 • 0,05 (CH3)2CO • 0,55 H2O:
Рассчитано: C 51,16; H 6,22; N 14,78
Найдено: C 50,98; H 6,03; N 14,63
ЯМР- и масс-спектры подтверждают вышеуказанную структуру.
Пример 24. 9-[5-O-(4-Аминобензоил- β -D-арабинофуранозил)]-6-метокси-9H-пурин
9-[5-O-(4-Нитробензоил)- β -D-арабинофуранозил] -6-метокси-9H-пурин из примера 22 (0,350 г, 0,81 ммоль) суспендировали в этаноле (100,0 мл) и добавляли 10%-ный палладий на углероде (0,100 мл). После попеременной откачки и заполнения системы водородом реакцию встряхивали на установке Парра под давлением 50 фунтов на кв.дюйм (3,515 кг/см2) в течение трех часов. Затем смесь фильтровали через Целит и фильтрат выпаривали до сухого состояния. Остаток после выпаривания суспендировали в метаноле и фильтровали, чтобы получить целевое соединение в виде белого твердого вещества (0,285 г, 88%): температура точки плавления: 198 - 200oC.
Результаты анализа: рассчитано для C18H19H5O6 • 0,3 H2O:
Рассчитано: C 53,15; H 4,86; N 17,22
Найдено: C 52,96; H 4,64; N 17,07
ЯМР- и масс-спектры подтверждают вышеуказанную структуру.
Пример 25. 6-Метокси-9-(5-O-пропионил- β -D-арабинофуранозил)-9H-пурин
9-( β -D-Арабинофуранозил)-6-метокси-9H-пурин из примера 22 (0,847 г, 3,0 ммоль) суспендировали в безводном ацетонитриле (30,0 мл) и добавляли пиридин (9 мл), чтобы осуществить полное растворение. После охлаждение до 5oC добавляли пропионил хлорид (0,305 г 3,3 ммоля) и смесь перемешивали в течение ночи в атмосфере аргона при одновременном нагревании до 13oC. После прекращения реакции изопропанолом (5 мл) и выпаривания до сухого состояния, дополнительного выпаривания с этанолом (2•10 мл) остаток подвергали очистке с использованием оперативной хроматографии на силикалеге (25,0 г, 2,5•15 см) и последовательного градиента от ChCl3 до CHCl3: ацетон (1:1). Фракции, содержащие продукт с Rf=0,38 (силикагель, CHCl3: ацетон (1:1), соединяли и этот материал снова подвергали очистке с использованием хроматографии на силикагеле под давлением среды (тандем колонн, 1,5•25,0 см и 1,5•100,0 см; CHCl3: ацетон (3:1), в результате чего получали 0,114 г целевого соединения в виде белого твердого вещества: температура точки плавления: 62-64oC.
Результаты анализа: рассчитано для C14H18N4O6•0,5 CH3OH:
Рассчитано: C 50,68; H 5,76; N 15,25
Найдено: C 50,72; H 5,80; N 15,28
ЯМР- и масс-спектры подтверждают указанную выше структуру.
Пример 26. 9-(5-0-Бутаноил- β -D-арабинофуранозил)-6-метокси-9H-пурин
9- β -D-Арабинофуранозил)-6-метокси-9H-пурин из примера 3 (0,874 г, 3,0 ммоль) суспендировали в безводном ацетонитриле (30,0 мл) и добавляли пиридин (9,0 мл), чтобы осуществить полное растворение. После охлаждения до 5oC добавляли бутирил хлорид (0,352 г, 3,3 ммоль) и смесь перемешивали в течение ночи в атмосфере аргона при одновременном нагревании до 13oC. После прекращения реакции изопропанолом (5 мл) и выпаривания до сухого состояния, последующих выпариваний с этанолом (2•10 мл) остаток подвергали очистке с использованием оперативной хроматографии на силикагеле (25,0 г, 2,5•15 см) и последовательного градиента от CHCl3 до CHCl3: ацетон (1:1). Фракции, содержащие продукт с Rf=0,38 (силикагель, CHCl3:ацетон (1:1), соединяли. Этот материал подвергали очистке еще раз с использованием хроматографии при давлении среды на силикагеле (тандем колонн, 1,5•25,0 см и 1,5 • 100,0 см; CHCl3: ацетон (2:1), в результате чего получали 267 мг целевого соединения в виде белого твердого вещества: температура точки плавления 108-110oC.
Результаты анализа для C15H20N4O6:
Рассчитано: C 51,13; H 5,72; N 15,90
Найдено: C 51,21; H 5,73; N 15,81
ЯМР- и масс-спектр подтверждали указанную структуру.
Пример 27.
9-[5-0-(2,2-Диметилпропионил)- β -D-арабинофуранозил]-6-метокси-9H-пурин
9-( β -D-арабинофуранозил)-6-метокси-9H-пурин из примера 3 (0,850 г, 3,01 ммоль) суспендировали в сухом ацетонитриле (75 мл) и добавляли пиридин (15 мл). Раствор охлаждали до 3oC в ледяной ванне и добавляли 2,2-диметил пропионил хлорид (0,41 мл, 3,3 ммоль). После перемешивания при температуре 3oC в течение шести часов реакцию быстро прекращали с использованием MeOH(2 мл), концентрировали до объема 10 мл, а затем несколько раз выпаривали после нескольких добавлений этанола. Остаток наносили на колонну для оперативной хроматографии на силикагеле (20,0 г, 2,5•12,0 см), помещенную в CH2Cl2: MeOH (10: 1). В результате элюирования с использованием 300 мл этого растворителя получали 0,464 г исходного материала и 0,553 г сырого продукта. В результате еще одной очистки при помощи оперативной хроматографии (двуокись кремния, 2,5• 10,0 см), элюируя градиентом от CH2Cl2 до MeOH в CH2Cl2 (1:9), получали 0,419 г (38%) прозрачного стекла: температура точки плавления: 73-76oC.
Результаты анализа для C16H22N4O6•0,5 H2O.
Рассчитано: C 51,19; H 6,18; N 14,93
Найдено: C 51,43; H 6,06; N 14,91
ЯМР- и масс-спектр согласуются с указанной выше структурой.
Пример 28. 9-(5-0-Ацетил- β -D-арабинофуранозил)-6-метокси-9H-пурин
9-( β -D-арабинофуранозил)-6-метокси-9H-пурин из Примера 3 (0,850 г, 3,01 ммоль) суспендировали в сухом ацетонитриле (75 мл), затем добавляли безводный пиридин (15 мл). Раствор охлаждали до 3oC в ледяной ванне и добавляли ацетил хлорид (0,24 мл, 3,4 ммоль). После перемешивания в ванне лед/соль в течение получаса реакцию прерывали метанолом (2 мл), концентрировали до объема 10 мл, затем выпаривали несколько раз после нескольких добавлений этанола. Остаток подвергали очистке с использованием оперативной хроматографии на силикагеле (25,0 г, 2,5•15 см), элюируя смесью CH2Cl2:MeOH (10: 1, 300 мл), чтобы получить в результате 0,710 г сырого продукта. Вторая колонна (25,0 г, 2,5•15 см) после элюирования смесью CH2Cl2: MeOH (15:1) давала 0,610 г прозрачного стекла, которое все-таки содержало небольшое количество примесей с более высокими Rf. Последующая очистка продукта при помощи препаративной тонкокослойной хроматографии с использованием CH2Cl2: MeOH (9: 1), затем при помощи загрузки плоских слоев на колонну для оперативной хроматографии (20,0 г, 2,5•12 см) в CH2Cl2 получали целевой продукт в виде белой пены (0,308 г, 31%): температура точки плавления: 64-67oC.
Результаты анализа для C13H16N4O6•0,5 H2O:
Рассчитано: C 46,85; H 5,14; N 16,81
Найдено: C 47,04; H 5,12; N 16,72
ЯМР- и масс-спектры находились в согласии со структурой.
Пример 29 6-Метокси-9[5-O-(2-метилпропионил)- β -D-арабинофуранозил]-9H-пурин.
9-( β -D-арабинофуранозил)-6-метокси-9H-пурин из примера 3 (0,500 г, 1,77 ммоль) суспендировали в сухом ацетонитриле (25 мл), добавляли безводный пиридин (5 мл). Раствор охлаждали до 3oC в ледяной ванне и добавляли изобутирил хлорид (0,21 мл, 2,0 ммоля). После перемешивания при температуре 3oC в течение трех часов реакцию быстро прекращали при помощи MeOH (2 мл), концентрировали до объема 10 мл, а затем выпаривали несколько раз после нескольких добавлений этанола. Остаток наносили на колонну для оперативной хроматографии на силикагеле (25,0 г, 2,5•15 см), помещенную в CH2Cl2: MeOH (10: 1). После элюирования с использованием 300 мл этого растворителя получали 0,167 г исходного материала и 0,221 г сырого продукта. В результате последующей очистки при помощи препаративной токнослойной хроматографии с CH2Cl2: MeOH (9: 1), последующей загрузки плоских слоев на колонну для оперативной хроматографии на силикагеле (16,0 г, 2,5•10 см), помещенную в CH2Cl2, колонну элюировали градиентом MeOH в CH2Cl2, в результате чего получали 0,127 г прозрачного стекла (20%): температура точки плавления 68-71oC.
Результаты анализа: для C15H20N4O6•0,25 H1O: 0,05 MeOH.
Рассчитано: C 50,43; H 5,82; N 15,63
Найдено: C 50,49; H 5,83; N 15,62
ЯМР- масс-спектры подтвердили указанную структуру.
Пример 30. 6-Метокси-9-[2-0-(2,2-диметилпропионил)- β -D-арабинофуранозил]-9H-пурин.
9-( β -D-арабинофуранозил)-6-метокси-9H-пурин из примера 3 (298,5 мг, 1,06 ммоль), 4-диметиламинопиридин (1, мг, 10 мкмоль), ацетонитрил (20 мл) и пиридин (5 мл) добавляли в трехгорлую колбу с круглым дном, снабженную термометром, клапаном для подачи аргона, магнитной мешалкой, холодильником и рубашкой. Добавляли триметилуксусный ангидрид (0,22 мл, 1,06 ммоль) и раствор нагревали до температуры 40oC до 26 ч. Реакцию быстро прекращали в этот момент добавлением 2 мл воды и выпаривали до прозрачного масла. Остаток подвергали очистке при помощи оперативной хроматографии на силикагеле с использованием последовательности градиентов от CHCl3 до CHCl3: MeOH (9:1). Этот материал далее подвергали очистке с использованием препаративной тонкослойной хроматографии и CHCl3: MeOH (9:1), а затем выпаривали с треххлористым углеродом и ацетоном, в результате чего получали 90 мл белой хрупкой пены.
Результаты анализа для C16H22N4O6 • 0,05 (CH3)2CO - 0,45 CCl4.
Рассчитано: C 45,47; H 5,13; N 12,78
Найдено: C 45,67; H 5,27; N 12,67
ЯМР- и масс-спектры подтверждают вышеупомянутую структуру
Пример 31. 6-Метокси-9-[2,3,5-три-O-ацетил)- β -D-арабинофуранозил]-9H-пурин.
9-( β -D-арабинофуранозил)-6-метокси-9H-пурин из примера 3 (1,009 г, 3,57 ммоль), 4-миметиламинопиридин (0,0098 г, 80 мкмоль), триэтиламин (0,59 мл, 4,2 ммоль) и безводный ацетонитрил (52 мл) добавляли в трехгорлую колбу с круглым дном, снабженную термометром, входом для аргона, магнитной мешалкой и сухой ванной лед/ацетон. После того, как белый раствор охлаждали до температуры -20oC, добавляли уксусный ангидрид (2,5 мл, 25,4 ммоль). Раствор мгновенно становился прозрачным. Через 5 мин реакцию прекращали добавлением MeOH (5 мл) и выпаривали до прозрачного вязкого масла. В результате обработки с использованием оперативной хроматографии на силикагеле с градиентом CHCl3 и MeOH получали продукт в виде прозрачного вязкого масла. При помощи растворения этого материала в минимальном количестве ацетона, разбавления водой и лиофилизации выделяли 1,03 г (71%) продукта в виде белого порошка.
Результаты анализа для C17H20N4O8:
Рассчитано: C 50,00; H 4,94; N 13,72
Найдено: C 49,80; H 5,09; N 13,50
ЯМР- и масс-спектры подтверждали вышеуказанную структуру.
Пример 32. 6-Метокси-9-(2-0-пентаноил- β -D-арабинофуранозил]-9H-пурин
Метод 1.
9-( β -D-арабинофуранозил)-6-метокси-9H-пурин из примера 3 (283 мг, 1,0 ммоль), ацетонитрил (20 мл) и пиридин (5 мл) добавляли в трехгорлую колбу с круглым дном, снабженную термометром, клапаном для подачи аргона и магнитной мешалкой. Добавляли валерьяновый ангидрид (0,2 мл, 1,0 ммоль) и раствор перемешивали при температуре 20oC в течение трех часов. Реакцию быстро прекращали водой (2 мл) и выпаривали до прозрачного масла, затем очищали с использованием оперативной хроматографии на двуокиси кремния и последовательности градиентов от CHCl3 до CHCl3 : MeOH (9:1). В результате получали 110 кг сложного 2'-эфира с примесями сложного 5'-эфира (см. пример 23), материал с меньшим Rf. Этот материал далее подвергали очистке при помощи препаративной тонкослойной хроматографии на двуокиси кремния с CHCl3 : MeOH (9:1) и совместного выпаривания с ацетоном, в результате чего получали 70 мг сложного 2'-эфира в виде прозрачного стекла.
Результаты анализа для C16H22N4O6 • 0,5(CH3)2CO.
Рассчитано: C 53,16; H 6,37; N 14,17
Найдено: C 52,89; H 6,37; N 13,96
ЯМР- и масс-спектры согласуются с указанной структурой.
Метод 2.
5-Метокси-9-[3,5-0-(1,1,3,3-тетраизопропилдисилоксан-1,3-диил)- β -D-арабинофуранозил] -9H-пурин из примера 40 (2,5 г, 4,8 ммоль) добавляли в колбу с круглым дном емкостью 250 мл вместе с 4-диметиламинопиридином (0,06 г, 0,47 ммоль). Добавляли сухой ацетонитрил (30 мл) и триэтиламин (2,65 мл), и через воронку для непрерывной подачи загружали ацетонитрил (20 мл) и пентановый ангидрид (1,13 мл, 5,7 ммоль). Реакционную смесь охлаждали до 3oC в ледяной ванне в потоке аргона. Медленное добавление раствора пентанового ангидрида осуществляли в течение 2 ч. Затем реакционную смесь обрабатывали метанолом (10 мл), концентрировали при пониженном давлении. Остаток переносили в CHCl3 (200 мл) и экстрагировали водой (2 • 50 мл). Соединенные водные слои снова экстрагировали CHCl3 (25 мл) и соединенные органические слои сушили (сульфат магния), фильтровали и концентрировали, в результате чего получали 3,44 г сырого продукта.
Сырой 6-метокси-9-[2-0-пентаноил-3,5-O-(1,1,3,3- тетраизопропилдисилоксан-1,3-диил)- β -D-арабинофуранозил]-9H-пурин растворяли в тетрагидрофуране (120 мл) и воде (3 мл). Раствор охлаждали до 3oC в ледяной ванне и добавляли 1,0 М раствор фторида тетрабутиламмония в тетрагидрофуране (6,0 мл). Через 1,5 ч добавляли насыщенный раствор хлорида аммония (2 мл) и реакционную смесь непосредственно пропускали на очистительную колонну из силикагеля (5,0 • 8,0 см), находящуюся в хлороформе. Колонну элюировали хлороформом (200 мл), затем смесью 1:1 ацетон : хлороформ (400 мл) и все фракции, содержащие продукт, соединяли и концентрировали. Финальную очистку осуществляли на колонне для оперативной хроматографии на силикагеле (5,0 • 15 см), элюировали последовательным градиентом ацетона в CHCl3, в результате чего получали 1,17 г (67%) прозрачного липкого стекла с примесями пентановой кислоты:
Результаты анализа для C16H22N4O6 • 0,2 C5H10O2.
Рассчитано: C 52,79; H 6,25; N 14,48
Найдено: C 52,97; H 6,38; N 14,60
Пример 33. 9-(2-O-Бутаноил- β -D-арабинофуранозил)-6-метокси- 9H-пурин
9-( β -D-арабинофуранозил)-6-метокси-9H-пурин из примера 3 (283 мг, 1,0 ммоль), ацетонитрил (20 мл) и сухой пиридин (5 мл) добавляли в трехгорлую колбу с круглым дном, снабженную термометром, входом для аргона, магнитной мешалкой, и охлаждали до температуры 4oC. Добавляли масляный ангидрид (170 л, 1,0 ммоль) и раствор перемешивали при 5oC в течение 6 ч в атмосфере аргона. В этот элемент реакцию прекращали добавлением 2 мл воды и выпаривали до прозрачного масла. Реакционную смесь подвергали очистке при помощи оперативной хроматографии с использованием последовательного градиента от CHCl3 до 1:1 CHCl3 : ацетон. Этот материал далее подвергали очистке при помощи препаративной тонкослойной хроматографии на силикагеле с использованием смеси 9:1 CHCl3 : MeOH, в результате чего получали 90 мг сложного 2'-эфира в виде прозрачного масла.
Результаты анализа для C15H20H4O6 • 0,3 H2O:
Рассчитано: C 50,36; H 5,80; N 15,66
Найдено: C 50,36; H 5,81; N 15,66
ЯМР- и масс-спектры соответствовали вышеуказанной структуре.
Пример 34. 6-Метокси-9-[2-O-(2-метилпропионил)- β -D-арабинофуранозил] -9H-пурин.
9-( β -D-арабинофуранозил]-9H-пурин из примера 3 (290,0 мг, 1,03 ммоль), ацетонитрил (20 мл) и пиридин (5 мл) добавляли в трехгорлую колбу с круглым дном, снабженную термометром, входом для аргона, магнитной мешалкой, холодильником и рубашкой. Добавляли изомасляный ангидрид (170 л, 1,0 ммоль) и раствор нагревали рубашкой до температуры 30oC четыре часа. Реакцию быстро прекращали в этот момент добавлением 2 мл воды и выпаривали до прозрачного масла. Остаток подвергали очистке при помощи оперативной хроматографии на силикагеле с использованием последовательности градиентов от CHCl3 до CHCl3 : MeOH (9:1). Фракции, содержащие продукт с Rf = 0,54 (силикагель, CHCl3 : MeOH, 20:1), далее подвергали очистке при помощи препаративной тонкослойной хроматографии на силикагеле с CHCl3 : MeOH (9:1). В результате получали 90,0 мг сложного 2'-эфира в виде прозрачного стекла.
Результаты анализа для C15H20N4O6 • 0,1 C3H6O.
Рассчитано: C 51,31; H 5,80; N 15,64
Найдено: C 51,41; H 5,81; N 15,72
ЯМР- и масс-спектры подтверждали вышеуказанную структуру.
Пример 35. 9-(3-O-Бензоил- β -D-арабинофуранозил)-6-метокси- 9H-пурин.
9-(2,3-Ангидро- β -D-ликосфуранозил)-6-метокси-9H-пурин (по поводу получения см. пример 36) (0,264 г, 1,0 ммоль) растворяли в безводном этаноле (20,0 мл), нагревали до дефлегмации и добавляли бензоат аммония (0,209 г, 1,5 ммоль) в атмосфере аргона. Дополнительно 1,5 ммоль бензоата аммония добавляли через 24 и 35 ч. Реакцию выпаривали до сухого состояния через 48 ч при дефлегмации. Остаток после выпаривания подвергали очистке с использованием оперативной хроматографии на силикагеле (25,0 г, 21,5 • 15 см) и смеси CHCl3 : ацетон (3:1). Фракции, содержащие продукт с Rf = 0,52 (силикагель, CHCl3 : ацетон (1:1) соединяли, в результате чего получали 138 мг целевого соединения. Температура точки плавления: 180 - 182oC.
Результаты анализа для C18H18N4O6:
Рассчитано: C 55,96; H 4,70; N 14,50
Найдено: C 55,90; H 4,71; N 14,44
ЯМР- и масс-спектры подтверждали вышеуказанную структуру.
Пример 36. 9-(2,3-Ангидро- β -D-ликсофуранозил)-6-метоксипурин.
Трифенилфосфин (5,902 г, 22,5 ммоль) растворяли в 1,4-диоксане (138 мл) и нагревали до температуры 70oC. В раствор добавляли 9-( β -D-арабинофуранозил)-6-метокси-9H-пурин из примера 3 (4,234 г, 15,0 ммоль), смесь перемешивали в течение 10 мин и по каплям в течение 10 мин добавляли диэтилазодикарбоксилат (3,919 г, 22,5 ммоль) в 1,4-диоксане (50 мл). Реакцию перемешивали при температуре 70oC в течение 1 ч, охлаждали до комнатной температуры и выпаривали до высоковязкого коричневого масла. Этот материал подвергали очистке на оперативной хроматографии на силикагеле (188,0 г, 5,0 • 21,0 см), элюируя смесью CHCl3 : ацетон (5 : 1, 3,6 л) и CHCl3 : ацетон (3 : 1, 2,0 л). Фракции, содержащие материал с Rf = 0,24 (двуокись кремния, CHCl3 : ацетон, 1 : 1), соединяли и выпаривали до сухого состояния. Остаток далее очищали с использованием оперативной хроматографии на двуокиси кремния (250,0 г, 6,0 • 28,0 см), элюируя при помощи E OAc, в результате чего получали 2,452 г (62%) целевого соединения в виде белой пены: температура точки плавления 144 - 145,5oC.
Результаты анализа для C11H12H4O4 • 0,25 H3H6O • 0,05 CHCl3:
Рассчитано: C 49,78; H 4,80; N 19,68
Найдено: C 49,80; H 4,95; N 19,87
ЯМР- и масс-спектры подтверждали указанную структуру.
Пример 37. 6-Метокси-9-[(2-O-(4-метоксибензоил))- β -D-арабинофуранозил] -9H-пурин.
6-Метокси-9-[2-(4-метоксибензоил)-3,5-O-(1,1,3,3- тетраизопропилдисилоксан-1,3-диил)- β -D-арабинофуранозил]-9H-пурин (по поводу получения см. пример 43 ниже) (0,86 г, 1,3 ммоль) растворяли в ТГФ (40 мл) и добавляли воду (1 мл). Раствор охлаждали до 3oC и добавляли 1,0 М раствор фторида тетрабутиламмония в ТГФ (6,3 мл). Через 30 мин добавляли дополнительно 5 мл воды, реакцию уменьшали на половину и пропускали непосредственно через колонну из силикагеля для оперативной хроматографии (25,0 г, 2,5 • 15 см), расположенную в CH2Cl2. Колонну элюировали CH2Cl2 (200 мл), затем смесью CH2Cl2 : MeOH (20 : 1, 400 мл) и все фракции, содержащие материал с Rf = 0,20 /силикагель, CH2Cl2 : MeOH /20 : 1//, соединяли, в результате чего получали 0,570 г белой пены. Финальную очистку осуществляли на колонне для оперативной хроматографии на силикагеле /5,0 • 15 см/, расположенной в CHCl3. После элюирования последовательным градиентом ацетона в хлороформе получали 0,325 г (60%) продукта в виде белой пены: температура точки плавления 71 - 75oC.
Результаты анализа, рассчитанные для C19H20H4O7 • 0,3 CHCl3 • 0,25 C3H6O:
Рассчитано: C 51,60; H 4,71; N 12,00
Найдено: C 51,56; H 4,70; N 11,95
ЯМР- и масс-спектры согласования с указанной структурой.
Пример 38. 6-Метокси-9-[(2-O-(4-метилбензоил))- β -D-арабинофуранозил] -9H-пурин.
6-Метокси-9-[(2-O-(4-метилбензил)-3,5-O-(1,1,3,3-тетраизопропил дисилоксан-1,3-диил)- β -D-арабинофуранозил]-9H-пурин (по поводу получения см. пример 42) (0,85 г, 1,3 ммоль) растворяли в ТГФ (40 мл) и воде (1 мл). Раствор охлаждали до 3oC и добавляли 1,0 М раствор фторида тетрабутиламмония в ТГФ (5,0 мл). Через 30 мин добавляли дополнительно 5 мл воды, реакционный объем уменьшали на половину и пропускали непосредственно через колонну из силикагеля для оперативной хроматографии (20,0 г, 2,5 • 12 см), расположенную в CH2Cl2. Колонну элюировали с использованием CH2Cl2 (200 мл), затем смесью CH2Cl2 : MeOH (15 : 1, 400 мл) и все фракции, содержащие материал с Rf = 0,20 (двуокись кремния, CH2Cl2 : MeOH (20 : 1)), соединяли. Сырой продукт наносили на вторую колонну из силикагеля для оперативной хроматографии (25,0 г, 2,5 • 18 см), расположенную в смеси ацетон: CH2Cl2 (1 : 1). В результате элюирования тем же растворителем получали 0,633 г продукта, который затем подвергали очистке при помощи препаративной тонкослойной хроматографии (двуокись кремния, ацетон: CH2Cl2 (1 : 1)) и оперативной хроматографии (25,0 г, 2,5 • 15 см). Колонну элюировали последовательностью градиентов ацетона в CHCl3, в результате чего получали 0,243 г (47%) прозрачного стекла: температура точки плавления 69 - 73oC.
Результаты анализа, рассчитанные для C19H20N4O6 • 0,4 CH3H6O • 0,25 CHCl3:
Рассчитано: C 54,17; H 5,03; N 12,36
Найдено: C 54,00; H 5,08; N 12,30
ЯМР- и масс-спектр подтверждали вышеуказанную структуру.
Пример 39. 9-[2-O-(4-Хлорбензоил)- β -D-арабинофуранозил]-6-метокси-9H-пурин.
9-[2-(4-хлорбензоил)-3,5-O-(1,1,3,3-тетраизопропилдисилоксан- 1,3-диил)- β -D-арабинофуранозил]-6-метокси-9H-пурин (по поводу получения см. пример 44 ниже) (1,07 г, 1,7 ммоль) растворяли в ТГФ (40 мл) и воде (1 мл). Раствор охлаждали до температуры 3oC и добавляли 1,0 М раствор фторида тетрабутил аммония в ТГФ (5,0 мл). Через 30 мин добавляли еще 5 мл воды и реакционную смесь пропускали непосредственно через колонну из силикагеля для оперативной хроматографии (20,0 г, 2,5 • 12 см), расположенную в CH2Cl2. Эту колонну элюировали CH2Cl2 (200 мл), затем смесью CH2Cl2 : MeOH (20 : 1, 400 мл) и все фракции, содержащие материал с Rf = 0,20 (двуокись кремния, CH2Cl2 : MeOH (20 : 1)), соединяли. Сырой продукт наносили на колонну из силикагеля для оперативной хроматографии (30,0 г, 2,5 • 18 см), расположенную в смеси ацетон: CHCl3 (1 : 1). После элюирования тем же растворителем получали 0,269 г продукта, который дополнительно подвергали очистке с использованием препаративной тонкослойной хроматографии (двуокись кремния, ацетон: CHCl3 (2 : 3)) и оперативной хроматографии (25,0 г, 2,5 • 15 см). Колонную элюировали последовательностью градиентов ацетона в CHCl3. Аналитическую пробу получали при помощи переноса продукта в безводный простой эфир и осаждения петролейным эфиром (40 - 60oC) и лиофилизации осадка, в результате чего получали 0,082 г (12%) белого порошка: температура точки плавления: 76 - 81oC.
Результаты анализа, рассчитанного для C18H17N4O6Cl • 1,20 H2O • 0,35 C3H6O:
Рассчитано: C 49,45; H 4,68; N 12,11
Найдено: C 49,78; H 4,38; N 11,88
ЯМР- и масс-спектры подтверждают вышеуказанную структуру.
Пример 40 6-Метокси-9-[3,5-O-(1,2,3,3- тетраизопропил-1,3-дисилоксан-1,3-диил)- β -D-арабинофуранозил]-9H-пурин
9-( β -D-арабинофуранозил)-6-метокси-9-H-пурин из примера 3 (1,0 г, 3,54 ммоль) и имидазол (0,965 г, 14,2 ммоль) растворяли в сухом диметилформамиде (10 мл), и раствор охлаждали до температуры 3oC. Затем добавляли 1,3-дихлор-1,1,3,3-тетраизопропилдисилоксан (1,35 мл, 3,90 ммоля) и смесь перемешивали в атмосфере аргона в течение трех часов. Затем реакцию прекращали добавлением воды (1 мл) и концентрировали при пониженном давлении. Остаток разделяли между этилацетатом (150 мл) и водой (50 мл), и слой этилацетата сушили (сульфат аммония), фильтровали и концентрировали. Сырой продукт переносили в этилацетат и подвергали очистке с использованием оперативной хроматографии на силикагеле (25,0 г, 2,5 • 15 см) в этилацетате. Из фракции с Rf = 0,70 (двуокись кремния, этилацетат) получали 1,48 г (80%) целевого материала в виде белого твердого вещества.
УФмакс: EtOH : 248,4 нм.
ЯМР- и масс-спектры подтверждали вышеупомянутую структуру.
Пример 41. 6-Метокси-9-[2-O-(2-аминобензоил)- β -D-арабинофуранозил]-9H-пурин.
9-( β -D-арабинофуранозил)-6-метокси-9H-пурин из примера 3 (0,283 г, 1,0 ммоль), ацетонитрил (15 мл), n-карбоксиантраниловый ангидрид (0,189 г, 1,1 ммоль) и бикарбонат натрия (84 мг, 1,0 ммоль) добавляли в трехгорлую колбу с круглым дном, снабженную термометром, входом для аргона, магнитной мешалкой, холодильником и рубашкой для подогрева. Суспензию дефлегмировали в течение 3,5 ч, а затем добавляли второй эквивалент п-карбоксиантранилового ангидрида. После дефлегмации еще в течение одного часа реакцию охлаждали до комнатной температуры, фильтровали и фильтрат выпаривали до пенистого стекла. Остаток подвергали очистке с использованием оперативной хроматографии на силикагеле и последовательного градиента от CHCl3 до 9:1 смеси CHCl3 : MeOH. В результате получали 53,1 мг сложного 2'-эфира в виде хрупкого стекла: температура точки плавления 91-93oC.
Результаты анализа, рассчитанные для C18H19N5O5 • 0,3 H2O • 0,2 CH4O:
Рассчитано: C 52,90; H 4,98; N 16,95
Найдено: C 53,23; H 4,98; N 17,21
ЯМР- и масс-спектры согласуются с вышеуказанной структурой.
Пример 42. 6-Метокси-9[2-0-(4-метилбензоил)-3,5-0-(1,1,3,3- тетраизопропилдисилоксан-1,3-диил)- β -D-арабинофуранозил]-9H-пурин
6-Метокси-9-3,5-0-(1,1,3,3-тетраизопропилдисилоксан-1,3-диил)- β -D-арабинофуранозил] -9H-пурин из примера 40 (1,0 г 1,9 ммоль) добавляли в 100 мл трехгорлую колбу с круглым дном с 4-диметиламинопиридином (0,02 г, 0,16 ммоль), ацетонитрилом (25 мл) и триэтиламином (0,4 мл) и раствор охлаждали в ледяной ванне до температуры 3oC на 5 мин. Добавляли толуол хлорид (0,30 мл, 2,3 ммоль) и смесь перемешивали три часа при температуре 3oC. Затем добавляли дополнительное количество триэтиламина (0,5 мл) и толуол хлорида (0,5 мл), и смесь нагревали до комнатной температуры. Через семь часов смесь обрабатывали метанолом (2 мл), концентрировали при пониженном давлении и остаток наносили на колонну из силикагеля для оперативной хроматографии (2,5 • 15 см) в CH2Cl2. Колонну элюировали смесью CH2Cl2 : MeOH (10:1, 400 мл), в результате чего получали 0,90 г (74%) целевого продукта:
Анализ, рассчитанный для C31H46N4O7Si2:
Рассчитано: C 57,92; H 7,21; N 8,71
Найдено: C 57,69; H 7,43; N 8,40
ЯМР- и масс-спектр подтверждают вышеуказанную структуру.
Пример 43. 6-Метокси-9-[2-0-(4-метилбензоил)-3,5-2(1,1,3,3- тетраизопропилдисилоксан-1,3-диил)- β -D-арабинофуранозил]-9H-пурин
6-метокси-9-[3,5-0-(1,1,3,3-тетраизопропилдисилоксан-1,3-диил)- β -D-арабинофуранозил] -9H-пурин из примера 40 (1,0 г, 1,9 ммоль) добавляли в 100 мл колбу с колбу с круглым дном с 4-диметиламинопиридином (0,02 г, 0,16 ммоль), ацетонитрилом (25 мл) и триэтиламином (0,4 мл), затем добавляли анизоилхлорид (0,35 мл, 2,5 ммоль). Через четыре часа при комнатной температуре реакционную смесь обрабатывали метанолом (2 мл) и концентрировали при пониженном давлении. Остаток наносили на колонну из силикагеля для оперативной хроматографии (25,0 г, 2,5 • 15 см) в CH2Cl2 : MeOH (20 : 1). В результате элюировали тем же растворителем, получали 0,930 г (74%) целевого продукта:
Анализ, рассчитанный для C31H46N4O8Si2 • 0,35 H2O:
Рассчитано: C 55,97; H 7,08; N 8,42
Найдено: C 56,02; H 7,01; N 8,32
Пример 44. 9-[2-0-(4-Хлорбензоил)-3,5-O-(1,1,3,3- тетраизопропилдисилоксан-1,3-диил)- β -D-арабинофуранозил]-6-метокси -9H-пурин.
6-Метокси-9-[3,5-O-(1,1,3,3-тетраизопропилдисилоксан-1,3-диил)- β -D-арабинофуранозил] -9H-пурин из примера 40 (1,0 г, 1,9 ммоль) добавляли в 250 мл колбу с круглым дном с 4-диметиламинопиридином (0,02 г, 0,16 ммоль), ацетонитрилом (25 мл) и триэтиламином (0,4 мл) и раствор охлаждали в ледяной ванне при температуре 3oC в течение 5 мин. Добавляли 4-хлорбензоил хлорид (0,31 мл, 2,5 ммоль) и реакционную смесь удаляли из ледяной ванны. После выдерживания в течение восьми часов при комнатной температуре раствор обрабатывали MeOH (3 мл) и концентрировали при пониженном давлении. Остаток переносили в CH2Cl2 и наносили на колонну из силикагеля для оперативной хроматографии (25,0 г, 2,5 • 15 см) в таком же растворителе. Колонну элюировали при помощи CH2Cl2 (200 мл), затем смесью CH2Cl2 : MeOH (20 : 1, 400 мл), в результате чего получали 1,05 г (82%) продукта, однородность которого подтвреждали с использованием тонкослойной хроматографии (двуокись кремния CH2Cl2 : MeOH (20:1, Rf = 0,44):
Анализ, рассчитанный для C30H43N4O7ClSi2:
Рассчитано: C 54,32; H 6,53; N 8,45
Найдено: C 54,48; H 6,72; N 8,28
Пример 45. 5'-Монофосфатный сложный эфир 9- β -D-арабинофуранозил-6-диметиламин-9H-пурина.
5'-Монофосфатный сложный эфир 9- β -D-арабинофуранозил-6- диметиламин-9H-пурина синтезировали при помощи переноса концевой фосфатной группы 5'-трифосфата аденозина (АТФ) в 5'-OH-группу-9- β -D-арабинофуранозил-6-диметиламин-9H-пурина, катализируемого тимидинкиназой (ТК), выделенной из вируса варицелла зостер (ВВЗ) (Файф, Molecular Pharmac, 21, стр. 432, 1982).
В 0,5 мл 0,02 М буфера трис-оксиметил/аминометил-HCl, pH 7,5, добавляли 50 нмоль 9- β -D-арабинофуранозил-6-диметиламин-9H-пурина, 55 нмоль АТФ (фирма Сигма Кэмикэлз, Сент-Луис, МО), 55 нмоль MgCl2 и 0,005 т.е. ТК ВВЗ. Раствор инкубировали при температуре 21oC в течение 2,5 ч, а затем фильтровали через фильтр "Центрикон 10") (УМ-мембрана с отсечкой молекулярного веса 10К, полученная от фирмы Амикон Инк., Дэнвер, МА), чтобы удалить протеин. Продукт анализировали на диапазон поглощения в ультра-фиолетовом свете с использованием анионо-обменной тонкослойной хроматографии, который варьировался с Rf, общим для монофосфата.
Пример 46. Арабинозид 5'-монофосфат-6-метоксипурина.
Нуклеозид, 6-метоксипурин арабинозид, 1,5 г (4,9 ммоль) растворяли в 15 мл триэтилфосфата и 4,8 мл триэтиламина. Этот раствор охлаждали до -10oC. При перемешивании добавляли 0,91 мл оксихлорида фосфата. Через 10 мин добавляли дополнительное количество (0,3 мл) оксихлорида фосфора. Еще через 10 мин реакцию прерывали добавлением 100 мл охлажденного льдом 0,5 М раствора триэтиламина в воде. Все указанные выше реагенты получали от фирмы Алдрич.
Компоненты окончательной реакционной смеси разделяли при помощи ионообменной хроматографии на ОАЕ-Сефадекс (фирма Фармация). Компоненты элюировали градиентом 50 мМ-1М бикарбоната аммония. 5'-Монофосфат 6-метоксипурин арабинозида составлял только примерно 10% от материала, элюированного из колонны. Чтобы удалить неорганические ортофосфаты из соединения, использовали ионнообменную хроматографию на смоле БиоРад АГ-1Х8 с последовательным градиентом 100 мМ-750 мМ бикарбоната аммония. Фракции, содержащие это соединение, выпаривали один раз под вакуумом, чтобы удалить избыточное количество бикарбоната аммония, затем подвергали лиофилизации.
6-Метокси арабинозид 5'-монофосфат получали с 3%-ным выходом (0,14 ммоль, 50 мг). УФ-спектр (макс 250 нм и мин 221 нм при pH 7) и отношение основание/фосфат (1,00/1,08) находились в согласии со структурой соединения. Оно может быть расщеплено в нуклеозид с использованием щелочной фосфатазы и 5'-нуклеотидазы.
Пример 47. 6-Метоксипурин арабинозид 5'-трифосфат.
5'-Монофосфат 6-метоксипурин арабинозида из примера 46 (36 мг, 93 Ммоль) растворяли в 2 мл гексаметилфосфорамида. Добавляли карбонилдиимидазол (82 мг, 506 мкмоль) и смесь перемешивали в течение 2 ч при комнатной температуре. Добавляли метанол (0,032 мл, 800 мкмоль) и смесь перемешивали в течение 20 мин. Добавляли пирофосфат трибутиламмония (220 мг, 470 мкмоль от фирмы Сигма), который предварительно растворяли 1,5 мл гексаметилфосформида, и смесь перемешивали в течение 18 ч при комнатной температуре. Реакцию прекращали добавление 50 мл воды. Все вышеупомянутые реагенты получали от фирмы Алдрич, если не указано противное. 5'-Трифосфат подвергали очистке с использованием ионообменной хроматографии на QAE Сефадекс (фирма Фармация), элюируя последовательным градиентом 50 мМ-800 мМ бикарбоната аммония. Фракции, содержащие соединения, выпаривали один раз под вакуумом, чтобы удалить избыток бикарбоната аммония, затем снова растворяли в воде и выдерживали замороженным при температуре -20oC.
5'-трифосфат 6-метиксипурин арабинозида получали с 60% выходом (57 мкмоль, 30 мг). УФ-спектр (макс 250 нм и мин 223 нм при pH 7) и отношение основание/фосфат (1,00/3,10) находились в согласии со структурой соединения. Оно может быть расщеплено в нуклеозид при помощи щелочной фосфатазы и в монофосфат при помощи фосфодиэстеразы 1.
Пример 48. 6-Диметиламино-9-[(2-0-валерил)- β -D-арабинозил]- 9H-пурин.
6-Диметиламинопурин арабинозид (0,501 г, 1,67 ммоль) растворяли в 20 мл пиридина и 20 мл ДМФ. Температуру раствора доводили до 4oC и медленно добавляли валерьяновый ангидрид (0,43 мл, 2,17 ммоль, фирма Алдрич Кэмикэл Ко., Милуоки, ВИ), растворенный в 5 мл пиридина и 5 мл ДМФ. Температуру раствора обеспечивали на уровне 40oC и через 2 ч растворитель удаляли под вакуумом. Остаток обрабатывали на колонне из силикагеля для оперативной хроматографии, 4,8 • 20 см при помощи 150 мл каждой из следующих смесей дихлорметана : метанола (об/об) : 100:0, 98:2, 96:4, 94:6, 92:8, 90:10. Фракции, содержащие продукт, собирали и после лиофилизации получали 0,195 г 6-диметиламино-9-(2-0-валерил- β -D-арабинозил)-9H-пурина: ТСХ Rf = 0,55 (силикагель, 9:1 (дихлорметан:метанол).
Анализ для C17H25N5O5 • 0,5 H2O:
Рассчитано: C 52,57; H 6,75; N 18,03
Найдено: C 52,61; H 6,77; N 17,99
ЯМР- и масс-спектры согласуются с вышеуказанной структурой.
Пример 49. 6-Диметиламино-9-(2,3,5-триацетил- β -D-арабинозил)-9H-пурин.
6-Диметиламинопурин арабинозид (3,00 г, 10,0 ммоль) растворяли в 20 мл ацетонитрила и уравновешивали при температуре 4oC 45 мл пиридина. В реакционную смесь по каплям добавляли ацетил хлорид (2,85 мл, 40,08 ммоль, фирма Алдрич Кемикэл Ко., Милуоки, ВИ) в 7 мл ацетонитрила. Через 5 ч растворитель удаляли под вакуумом при температуре ниже 45oC, а остаточный материал обрабатывали высоковакуумным насосом в течение 24 ч. Высушенный остаток далее подвергали обработке с использованием оперативной хроматографии на колонне из силикагеля, 4,8х25 см с использованием смеси 9:1 (дихлорметан/метанол). Фракции, содержащие продукт, собирали и после лиофилизации получали 0,445 г 6-диметиламино-9-(2,3,5-триацетил- β -D-арабинозил)-9-пурина: ТСХ Rf = 0,61 (силикагель, 9:1 (дихлорметанметанол)).
Анализ, рассчитанный для C18H23N5O7:
Рассчитано: C 51,30; H 5,50; N 16,62
Найдено: C 51,40; H 5,55; N 16,54
ЯМР- и масс-спектры подтверждают вышеуказанную структуру.
Пример 50. Композиции в форме таблеток
Получали композиции А и В (см. табл. 1) при помощи влажного гранулирования ингредиентов с раствором повидона, затем добавляли стеарат магния и смесь прессовали.
Таблетки получали из указанных ингредиентов (C) при помощи влажного гранулирования и последующей прессовки. При альтернативном получении Повидон Б. Ф. можно заменить Поливилпирролидоном.
Приводимые ниже композиции D и E получали при помощи прямой прессовки смешанных ингредиентов. Лактоза в композиции E имеет тип для прямой прессовки (фирма Дейри Крест - "Зепарокс").
Композиции D (мг/капсулу)
Активный ингредиент - 250
Предварительно желатинизированный крахмал НФ15 - 150
Итого - 400
Композиция E мг/капсулу
Активный ингредиент - 250
Лактоза - 150
Авицел - 100
Итого - 500
Композиция F (для регулируемого высвобождения композиции).
Композицию получали при помощи влажного гранулирования ингредиентов (см. ниже) с раствором повидона, а затем добавляли стеарат магния и прессовали мг/таблетку:
(a) Активный ингредиент - 500
(b) Оксипропилметилцеллюлоза (Метоцел К4М Премиум) - 112
(c) Лактоза Б.Ф. - 53
(d) Повидон Б.Ф. - 28
(e) Стеарат магния - 7
Итого - 700
Высвобождение лекарственного препарата имеет место в течение примерно 6-8 ч и заканчивается после 12 ч
Пример 51. Композиции в форме капсулы.
Композиция А.
Композицию в форме капсулы получали при помощи смещения ингредиентов из композиции 1 в примере 50, и заполнения смесью жесткой желатиновой капсулы, состоящей из двух частей. Композицию B получали аналогично.
Композиция B (мг/капсулу)
(a) Активный ингредиент - 250
(b) Лактоза Б.Ф. - 143
(c) Гликоллат натрий крахмал - 25
(d) Стеарат магния - 2
Итого - 420
Композиция C (мг/капсулу)
(a) Активный ингредиент - 250
(b) Макрогол 4000 Б.Ф. - 350
Итого - 600
Капсулы получали расплавлением Макрогола 4000 Б.Ф., диспергированием активного ингредиента в расплаве и заполнением расплавом жестких желатиновых капсул, состоящих из двух частей.
Композиции 1 (мг/капсулу)
Активный ингредиент - 250
Лицитин - 100
Арахисовое масло - 100
Итого - 450
Капсулы получали дипергированием активного ингредиента в лецитине и арахисовом масле и заполнением дисперсией мягких, эластичных желатиновых капсул.
Композиция E (Регулирование высвобождение).
Следующую композицию для капсулы с регулируемым высвобождением получали при помощи экструзии ингредиентов a, b и c с использованием экструдера, затем из полученного материала получали шарики и сушили. Высушенные шарики затем покрывали оболочкой (d), регулирующей высвобождение, которую помещали в жесткую желатиновую капсулу, состоящую из двух частей (мг/капсулу).
(a) Активный ингредиент - 250
(в) Микрокристаллическая целлюлоза - 125
(c) Лактоза Б.Ф. - 125
(d) Этилцеллюлоза - 13
Итого - 513
Пример 52. Офтальмологический раствор
Активный ингредиент - 0,5
Хлорид натрия, аналитического сорта - 0,9
Тиомерсал - 0,001 г
Очищенная вода - До 100 мл
pH обеспечивается на уровне - 7,5
Пример 53 Композиция для инъекций
Активный ингредиент - 0,200 г
Стерильный, не содержащий пирогенов фосфатный буфер (pH 9,0) - До 10 мл
Активный ингредиент растворяли в большей части фосфатного буфера (35-40oC), затем доводили до необходимого объема и фильтровали через стерильный микропористый фильтр в 10 мл стеклянный пузырек янтарного цвета (тип 1), который закрывали стерильной пробкой и герметичной крышкой.
Пример 54. Внутримышечная инъекция
Активный ингредиент - 0,20 г
Бензиловый спирт - 0,10 г
Гликофурол 75 - 1,45 г
Вода для инъекций - До 3,00 мл
Активный ингредиент растворяли в гликофуроле. Затем добавляли бензиловый спирт и осуществляли растворение, затем добавляли воду до 3 мл. Затем смесь фильтровали через стерильный микропористый фильтр и герметически закрывали в стерильные 3 мл стеклянные пузырьки янтарного цвета (типа 1).
Пример 55. Сиропная суспензия
Активный ингредиент - 0,25 г
Раствор сорбита - 1,50 г
Глицерин - 2,00 г
Диспергируемая целлюлоза - 0,075 г
Бензоат натрия - 0,005 г
Вкусовое вещество, Пич 17.42.3169 - 0,0125 мл
Очищенная вода до объема - 5,00 мл
Бензоат натрия растворяли в части очищенной воды и добавляли раствор сорбита. Добавляли и диспергировали активный ингредиент. В глицерине диспергировали загущающее вещество (диспергируемую целлюлозу). Обе эти дисперсии смешивали и доводили до необходимого объема при помощи очищенной воды. Большее загущение обеспечивали, если это необходимо, увеличением среза суспензии.
Пример 56. Суппозиторий (мг/суппозиторий)
Активный ингредиент (63 мкм) - 250
Тугоплавкий жир. Б.Ф. (Уитепсол X15-Динамит Нобель) - 1700
Итого - 1950
Активный ингредиент использовали в виде порошка, в котором по крайней мере 90% частиц имеют диаметр 63 мкм и меньше.
Одну пятую часть Уитепсола X15 расплавляли в чашке, снабженной рубашкой, через которую пропускали пар, при температуре 45oC максимум. Активный ингредиент просеивали через сито с диаметром отверстий 200 мкм и добавляли в расплавленную основу при перемешивании, используя сильверсон, снабженный срезающей головкой до тех пор, пока не будет получена однородная дисперсия. Поддерживая температуру смеси на уровне 45oC, добавляли оставшийся Уитепсол X15 в суспензию и при помощи перемешивания добивались получения однородной смеси. Суспензию полностью пропускали через сито из нержавеющей стали с диаметром отверстий 200 мкм при непрерывном перемешивании, давая возможность смеси остыть до 40oC. При температуре от 38 до 40oC 2,02 г смеси заполняли подходящие пластмассовые формы. Далее суппозиториям давали возможность охладиться до комнатной температуры.
Пример 57. Пессарии (мг/пессарий)
Активный ингредиент 63 мкм - 250
Безводная декстроза - 380
Картофельный крахмал - 363
Стеарат магния - 7
Итого - 1000
Указанные выше ингредиенты непосредственно перемешивали и пессарии получали при помощи прямой прессовки полученной в результате смеси.
Пример 58 Противовирусная токсичность и испытание на биопригодность. Определение противовирусной активности против вируса Барицелла-Зостер
Ингибиторный эффект соединений на репликацию ВВ3 (штамм Ока) исследовали при помощи процедуры ЭЛИЗА (Берковиц, Ф.Е., и Левин, М.Дж. (1985), Antimicrob. Agents and Chemother, которую модифицировали следующим образом. Инфицирование начинали в присутствии лекарственного препарата, а не перед его добавлением. В конце третьего дня инкубирования лекарственного препарата и вируса с неинфицированными клетками (человеческие диплоидные фибробласти, штамм MR G-5) пластины с 96 углублениями подвергали центрифугированию в течение 5 мин со скоростью 200 g, чтобы осадить отделившиеся клетки перед фиксацией глютаральдегида. В модифицированной ЭЛИЗЕ в качестве второго антитела использовали конъюгированный щелочной фосфатазой античеловеческий 1 gG. Скорость расщепления пара-нитрофенил фосфата рассекающей щелочной фосфатазой определяли при помощи процедуры, описанной в (Тадепалли, С.М., Квинн, Р.П. и Аверетт, Д. Р. 1986, Antimicrob, Agents and Chemother, 29 с. 93-98). Неинфицированные клетки использовали для того, чтобы получить "чистые" скорости реакции, которые вычитали из скоростей, полученных в присутствии вируса. Этот анализ пригоден для обнаружения вирусного потомства в культурах, которые первоначально были инфицированы от 15 до 3600 инфицирующими частицами на углубление.
Исследование ингибирования роста неинфицированных клеток млекопитающих.
Способность предлагаемых соединений ингибировать рост клеток Д98 (человека) и α - клеток (мыши) измеряли при помощи определения количества клеток, которые получают через три дня контакта стандартного количества клеток с различными концентрациями соединения (Ридеут, Дж. Л., Кренитцки, Т.Э., Кошалка, Г. У., Кон, Н.К., Чао, Е.И., Элион, Г.Б., Латтер. В.С. и Уильямс, Р. Б. , (1982) J. Med. Chem., 25, с. 1040-1044). Затем это количество клеток сравнивали с количеством, полученных в эксперименте без соединения. Счет клеток осуществляли либо при помощи спектрофотометрического определения количества живого штамма, составляемого клетками. Сравнимые результаты получали при помощи обеих процедур.
Анализ данных.
Концентрацию соединения, приводящую к 50% от контрольных значений (IC50) рассчитывали либо при помощи прямой интерполяции из графитов log концентрации соединений относительно процента контрольного значения, либо с использованием компьютерной программы, которая осуществляет анализы в соответствии с одним и тем же алгоритмом. В этих расчетах использовали данные в области от 20 до 80% от контрольного (см. табл. 2)
Анализ и данные относительно биопригодности.
Две крысы вида Лонг-Эванс получали дозу соединения при помощи трубки, вставленной внутрь желудка, из примера 3 10 мг/кг или молярные эквиваленты соединений из примеров 16, 24 и 32. Животных помещали в метаболические клетки и собирали мочу в периоды от 0 до 24 ч и от 24 до 48 ч после введения дозы. Мочу анализировали при помощи обращенно-фазовой высокоэффективной жидкостной хроматографии. Результаты выражены в % дозы, выделенной из мочи в течение 48 ч, как для соединения из примере 3.
Пример - % дозы
3 - 4,9/2,5
16 - 11,7
24 - 7,9
32 - 15,9к
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ ЗАМЕЩЕННЫХ ПУРИНОВЫХ АРАБИНОЗИДОВ ИЛИ ЕГО ФАРМАЦЕВТИЧЕСКИ ПРИЕМЛЕМЫХ ПРОИЗВОДНЫХ | 1988 |
|
RU2039752C1 |
| МОНО-, ДИ- ИЛИ ТРИСЛОЖНЫЕ ЭФИРЫ 2-АМИНО-6-(С - С-АЛКОКСИ-9-(βD-АРАБИНОФУРАНОЗИЛ)-9Н-ПУРИНА, СПОСОБ ИХ ПОЛУЧЕНИЯ, ПРИМЕНЕНИЕ И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 1991 |
|
RU2114860C1 |
| ЭНАНТИОМЕРНЫЕ СОЕДИНЕНИЯ И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ИХ ОСНОВЕ | 1992 |
|
RU2091386C1 |
| СПОСОБ ПОЛУЧЕНИЯ ЭНАНТИОМЕРНЫХ СОЕДИНЕНИЙ ИЛИ ИХ ПРОИЗВОДНЫХ | 1990 |
|
RU2068849C1 |
| СПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОДНЫХ 2'-ДЕЗОКСИ-2'-ФТОРРИБОНУКЛЕОЗИДОВ ИЛИ ИХ ФАРМАЦЕВТИЧЕСКИ ПРИЕМЛЕМЫХ СОЛЕЙ | 1990 |
|
RU2043361C1 |
| Способ получения 2,4-диамино-5-(замещенных) пиримидинов | 1983 |
|
SU1306473A3 |
| СПОСОБ ПОЛУЧЕНИЯ ПИРИДИНОВЫХ НУКЛЕОЗИДОВ | 1989 |
|
RU2036199C1 |
| Способ получения пиримидиновых нуклеозидов | 1987 |
|
SU1731064A3 |
| СПОСОБ ИНГИБИРОВАНИЯ ВИРУСНЫХ ИНФЕКЦИЙ ГЕПАТИТА В | 1992 |
|
RU2116789C1 |
| СИНЕРГЕТИЧЕСКАЯ ФАРМАЦЕВТИЧЕСКАЯ КОМБИНАЦИЯ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ И СПОСОБ ЛЕЧЕНИЯ ИЛИ ПРОФИЛАКТИКИ ВИЧ-ИНФЕКЦИЙ | 1992 |
|
RU2110993C1 |
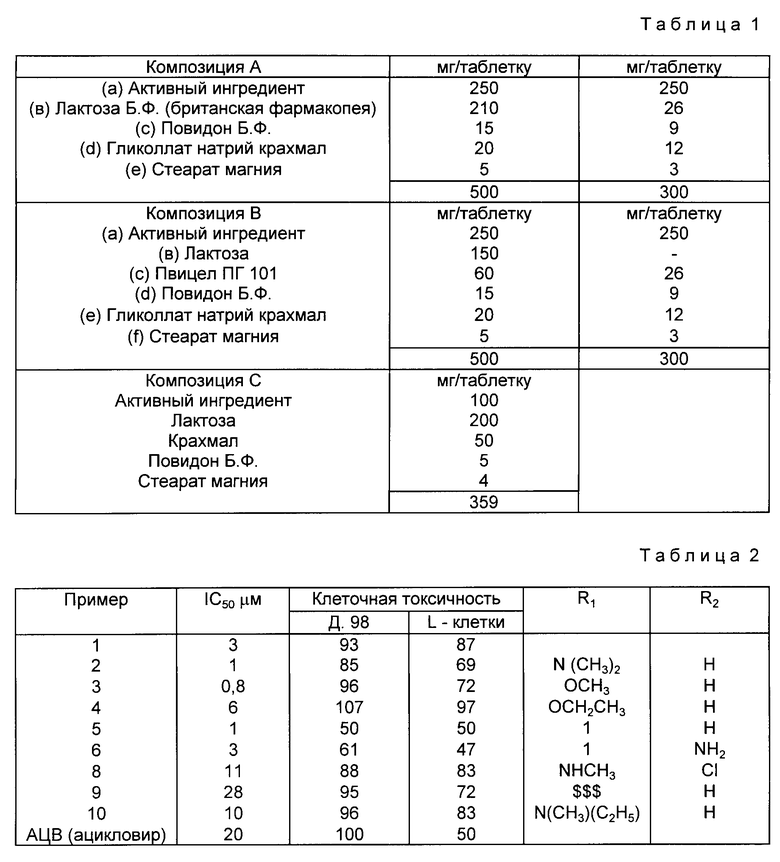
Изобретение относится к 9-β-D-арабинофуранозил-2-амино-6-метокси-9Н-пурину и его производным и 9-β-D-арабинофуранозил-2-амино-6-метокси-9Н-пурину и его производным и фармацевтической композиции, включающей указанные производные пурина, которая проявляется активность против вирусной инфекции у человека, вызванной вирусом варицелла зостер (VZV). 3 с. и 6 з.п.ф-лы, 1 табл.
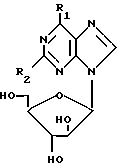
где R1 представляет собой метокси группу,
R2 - водород или аминогруппа,
или его фармацевтически приемлемых солей, простых или сложных эфиров, или солей этих эфиров.
Авторы
Даты
1998-06-10—Публикация
1993-02-09—Подача