Изобретение относится к биотехнологии и может быть использовано при работе с клеточными культурами и в вирусологии.
Известен способ получения протеина путем осаждения белков сульфатом аммония [1].
Недостатком данного способа является необходимость использования сернокислого аммония, который может содержать токсические для клеток примеси, а также сложность получения, очистки и анализа препарата, длительность технологического процесса.
Наиболее близким к заявленному способу является способ получения ростового протеина [2, прототип] . Ростовой протеин получают из сыворотки крови следующим образом: сыворотку крови крупного рогатого скота обрабатывают 30 - 40%-ным водным раствором полиэтиленгликоля с молекулярной массой 3000 - 6000 дальтон, обработку осуществляют двукратно, при этом при первой обработке раствор полиэтиленгликоля (ПЭГ) добавляют к сыворотке до конечной концентрации 8-10%, а при второй - до 14-16%, экспозицию смеси проводят в течение 10-20 мин, при этом после первой обработки и центрифугирования pH супернатанта доводят до 5,3-5,6 уксусной кислотой, а перед очисткой осадок растворяют в забуференном растворе хлористого натрия с pH 8,0 - 9,0.
Получение ростового протеина с использованием ПЭГ имеет то преимущество, что для фракционирования и осаждения белков используется полиэтиленгликоль, который находит сегодня самое широкое применение в медицине, биологии, ветеринарии, так как он не токсичен, не пиpогенен, не вызывает денатурации белков [3, 4], способствует пролиферативной активности клеточных культур и повышает продуктивность клеточных культур при накоплении вирусной биомассы [5] .
Недостатком известного способа получения ростового протеина является использование водного раствора полиэтиленгликоля (ПЭГ). Добавление водного раствора ПЭГ приводит к значительному разбавлению сыворотки крови, что оказывает существенное влияние на изоэлектрическое состояние белков. Кроме того, водные растворы ПЭГ с молекулярным весом свыше 3000 обладают очень высокой вязкостью, что приводит к значительному искажению электрофоретической подвижности белков сыворотки крови в присутствии полимера. Осаждаемый в этих условиях белок намного труднее отделяется из среды с высокой вязкостью. В технологии заложена очень трудоемкая стадия центрифугирования, требующая дорогостоящего оборудования, а главное в процессе данной технологической операции возможна вторичная контаминация препарата бактериофагами, вирусами, микоплазмами.
При разработке наиболее рационального способа выделения ростовых протеинов из сыворотки крови различных животных учитывают следующие моменты:
1. Влияние молекулярного веса полиэтиленгликоля на растворимость белков сыворотки крови.
Показано, что по мере повышения молекулярного веса полимера увеличивается количество осажденного белка. ПЭГ с молекулярным весом 100 не вызывает значительного осаждения белка. В пределах молекулярных весов от 400 до 6000 наблюдается прямая зависимость между количеством осажденного белка и степенью полимеризации ПЭГ, однако дальнейшее повышение молекулярной массы ПЭГ (15000, 20000) не вызывает значительного возрастания в количестве осажденного белка.
2. Влияние концентрации полиэтиленгликоля на растворимость белков сыворотки крови.
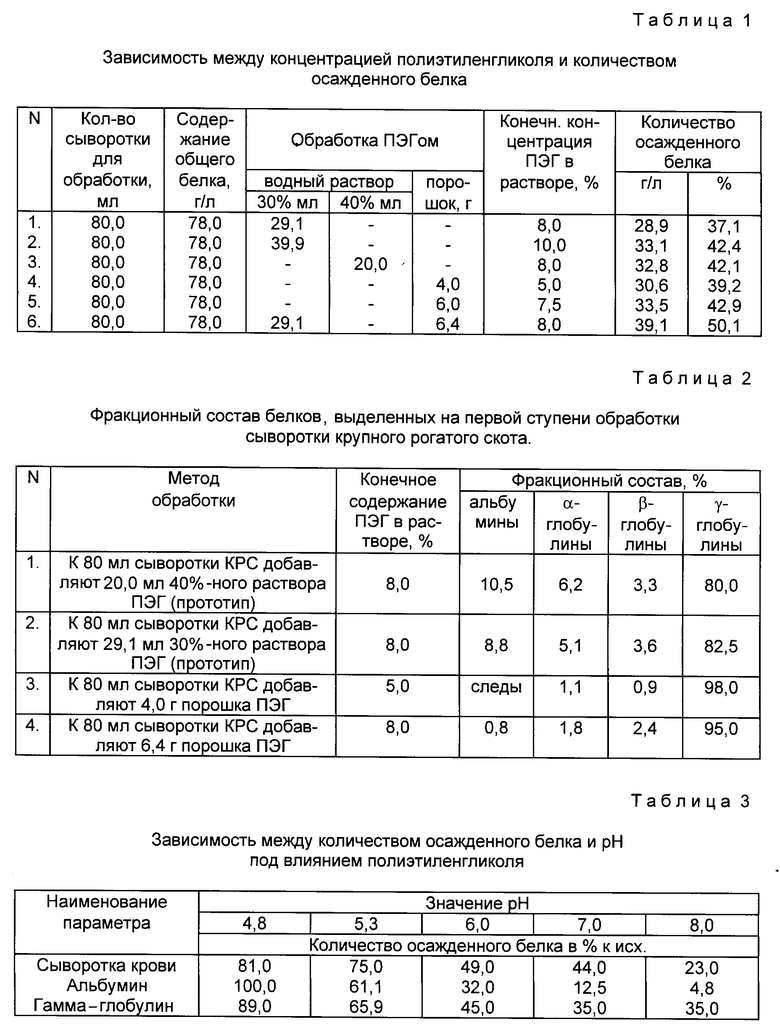
Показано, что по мере повышения концентрации полимера в сыворотке крови увеличивается количество осаждаемого белка (табл. 1).
Статистически достоверное осаждение белков из сыворотки крови наблюдается при конечной концентрации ПЭГ в сыворотке 3%. При конечной концентрации полимера 20% происходит почти полное осаждение всех белков. При концентрации ПЭГ от 3 до 6% осаждаются белки с электрофоретической подвижностью гамма-глобулинов. По мере повышения концентрации полимера происходит преципитация белков в порядке, обратном их молекулярному весу (табл. 2).
3. Влияние pH на растворимость белков сыворотки в присутствии полиэтиленгликоля.
Показано, что в присутствии полиэтиленгликоля при снижении pH возрастает количество осажденного белка, а при повышении pH растворимость белка заметно увеличивается.
Задачей изобретения является разработка способа получения ростовых протеинов из сывороток крови различных видов животных, свободных от гамма-глобулиновой фракции белков, обладающих ростстимулирующей активностью для культур клеток и вирусов.
Сущность предлагаемого способа получения ростовых протеинов заключается в том, что в сыворотке создаются условия, при которых определенная белковая фракция, в силу своих индивидуальных свойств, переводится в состояние, отличающееся от исходного. Имеется в виду растворимость, влияя на которую, происходит направленное воздействие на агрегатное состояние групп однородных белковых молекул. Перевод искомой фракции в нерастворимое состояние и сохранение требуемого белкового компонента или группы компонентов в растворе лежит в основе предлагаемого способа. Из крови, полученной от различных видов животных (крупнорогатый скот, свиньи, овцы, лошади, олени), получают сыворотку крови путем удаления клеточных элементов и фибрина. Для этих целей используют метод отстаивания или центрифугирования. Затем в сыворотку добавляют порошок ПЭГ, который получают путем измельчения на шаровой мельнице. Процесс добавления полиэтиленгликоля в сыворотку крови проводят при постоянном перемешивании в течение 10-15 мин. Смесь оставляют для осаждения гамма-глобулинов при температуре 4-8oC на 10-12 ч до образования плотного осадка. Затем надосадочную жидкость осторожно декантируют, доводят pH до 4,8 - 5,0 0,1 н. раствором соляной кислоты (HCl) и обрабатывают порошком ПЭГ при постоянном перемешивании, доводя конечную концентрацию ПЭГ до 18-20%. Смесь тщательно перемешивают в течение 10-15 мин. Затем обработанную сыворотку подвергают 2- и 3-кратному циклу замораживания-оттаивания до полного осветления надосадочной жидкости и образования плотного осадка. Супернатант удаляют, осадок растворяют в физиологическом растворе до концентрации белка 70 - 80 г/л, проводят стерилизующую фильтрацию препарата на мембранных фильтрах с размером пор 0,2 мкм и направляют на лиофильную сушку. Препарат расфасовывают по 1 г в пенфлаконы, закрывают резиновыми пробками, завальцовывают алюминиевыми колпачками и проводят стерилизацию гамма-облучением.
Новыми признаками способа получения ростовых протеинов по сравнению с прототипом являются:
- в качестве осаждающего агента используется порошок полиэтиленгликоля с молекулярной массой 4000 - 6000 дальтон;
- при осаждении гамма-глобулиновой фракции добавляют порошок ПЭГ до конечной концентрации в сыворотке 5-7,5%;
- перед выделением ростовых протеинов pH супернатанта доводится до 4,8 - 5,0. Для доведения pH используется 0,1 н. раствор соляной кислоты;
- выделение ростовых протеинов проводится при добавлении ПЭГ до конечной концентрации 18 - 20%;
- для осаждения ростовых протеинов используется 2- и 3-кратный цикл замораживания-оттаивания;
- ростовые протеины растворяются в дистиллированной воде;
- готовый препарат может использоваться как в жидкой форме, так и в сухой, что позволяет использовать его как добавку для повышения ростстимулирующей активности сывороток крови для культур клеток и вирусов, так и в качестве основы при конструировании бессывороточных или малосывороточных питательных сред.
- простота воспроизведения способа и короткий технологический цикл.
Совокупность всех перечисленных признаков экспериментально разработана авторами, неизвестна из опубликованных источников информации, что позволяет сделать вывод о существенных отличиях предлагаемого метода от известных и в соответствии критериям "новизна" и "изобретательский уровень". Показано, что пpименение поpошка ПЭГ пpиводит к значительному осаждению белка, даже пpи более низких концентpациях ПЭГ в pаствоpе по сpавнению с обpаботкой водными pаствоpами ПЭГ.
Навеску альбумина или гамма-глобулина растворяют в воде и pH раствора доводят до разных значений - 4,8; 5,3; 6,0; 7,0; 8,0. К полученным растворам добавляют полиэтиленгликоль в равном объеме до получения конечной концентрации 20%.
В исходных белковых растворах, а также в надосадочной жидкости, остающейся после отделения осадков, определяют количество общего белка. Количество осажденного белка определяют в % к исходному белку принятым способом. В табл. 3 представлены результаты определения количества осажденного белка полиэтиленгликолем к конечной концентрации 20% при различных pH.
Представленные результаты свидетельствуют о том, что при прочих равных условиях максимальное осаждение белка происходит при pH 4,8 - 5,1.
Разработанный способ получения ростовых протеинов достаточно прост, не требует дорогостоящего оборудования и реактивов. Позволяет значительно повысить выход препарата до 59-60%, в прототипе - 44-52%, получить более чистый препарат (содержание гамма-глобулиновой фракции в следовых количествах, в прототипе 0,5%). Использование ростовых протеинов в качестве основы питательных сред при культивировании клеточных линий и вирусов позволяет значительно повысить ростстимулитрующую активность питательной среды и снизить опасность контаминации клеточных линий вирусами, микоплазмами, бактериофагами, а также избежать присутствия в питательной среде антител, которые могут оказать отрицательное влияние на процесс культивирования.
Пример 1. Получение ростовых протеинов. К 80 мл сыворотки крупного рогатого скота при постоянном перемешивании медленно добавляют 4 г порошка полиэтиленгликоля с молекулярной массой 6000 (предварительно измельченного на шаровой мельнице). Полученную смесь после перемешивания в течение 10 мин оставляют при температуре 4 - 6oC на 10 ч для образования плотного осадка. Надосадочную жидкость осторожно декантируют, доводят pH супернатанта 0,1 н. раствором соляной кислоты до 4,8 и медленно при постоянном перемешивании добавляют порошок ПЭГ в количестве 15,8 г до конечного содержания ПЭГ в супернатанте 20%, тщательно перемешивают и проводят двухкратный цикл замораживания-оттаивания. Супернатант удаляют, осадок растворяют в 50 мл деионизованной воды, проводят стерилизующую фильтрацию и лиофильно сушат.
Получают 4,82 г ростового протеина, что составляет 61,8% от общего белка в исходной сыворотке крови и 95,0% от белка в сыворотке после удаления гамма-глобулинов. Фракционный состав полученных ростовых протеинов: альбумины - 62%, альфа-глобулины - 21%, бета-глобулины - 21%, гамма-глобулины - следы.
Пример 2. Получение ростовых протеинов. К 80 мл сыворотки крупного рогатого скота при постоянном перемешивании медленно добавляют 6 г порошка полиэтиленгликоля с молекулярной массой 4000 (предварительно измельченного на шаровой мельнице). Полученную смесь после перемешивания в течение 10 мин оставляют при температуре 4-6oC на 5 ч для образования плотного осадка. Надосадочную жидкость осторожно декантируют, доводят pH супернатанта 0,1 н. раствором соляной кислоты до 5,0 и медленно при постоянном перемешивании добавляют порошок ПЭГ до конечного содержания ПЭГ в супернатанте 18%, тщательно перемешивают и проводят трехкратный цикл замораживания-оттаивания. Супернатант удаляют, осадок растворяют в 100 мл деионизованной воды, проводят стерилизующую фильтрацию и лиофильно сушат.
Получают 4,62 г ростового протеина, что составляет 59,2% от общего белка в исходной сыворотке крови и 97,8% от белка в сыворотке после удаления гамма-глобулинов. Фракционный состав полученных ростовых протеинов: альбумины - 64% , альфа-глобулины - 17%, бета-глобулины - 19%, гамма-глобулины - следы.
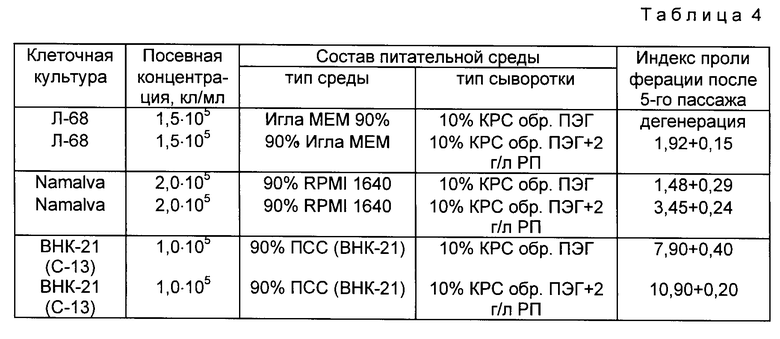
Пример 3. Сравнительная характеристика ростстимулирующей активности сывороток, обработанных ПЭГ и с добавками ростовых протеинов (РП) представлена в табл. 4.
Список литературы
1. Michl I., Rezacova D. Cultivation of Mammalian Cell in a Medium with growth-promoting protein from calf zerum. - Acta virology, 1966, N 10, p. 254-259.
2. А.С. СССР N 1250573, 1986.
3. Русанов В.М., Скобелев Л.И. Фракционирование белков плазмы в производстве препаратов крови. - М.: Медицина, 1983, с. 75-97.
4. Шинкаренко А.А. Особенности взаимодействия полиэтиленгликоля с белками плазмы крови и возможности использования этого полимера для фракционирования. - Автореф. дис. д.б.н. - Киев, 1972, 31 с.
5. Кухарева О.Ю. Влияние полиэтиленгликоля на накопление и выделение вирусов в культурах клеток. - Автореф. дис. к.б.н. - Ленинград, 1989, 19 с.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ РАСТВОРА ГАММА-ГЛОБУЛИНА, ПРЕДНАЗНАЧЕННОГО ДЛЯ ВНУТРИВЕННОГО ВВЕДЕНИЯ, И ПРОДУКТ, ПОЛУЧАЕМЫЙ ЭТИМ СПОСОБОМ | 1998 |
|
RU2198668C2 |
| Способ очистки гамма-глобулина для внутривенного введения | 1987 |
|
SU1829938A3 |
| Способ получения антигена вируса Зика, обладающего иммуногенными и антигенными свойствами | 2019 |
|
RU2717993C1 |
| СПОСОБ ОПРЕДЕЛЕНИЯ ЦИРКУЛИРУЮЩИХ ИММУННЫХ КОМПЛЕКСОВ | 2005 |
|
RU2343484C2 |
| СПОСОБ ПОЛУЧЕНИЯ КОНЦЕНТРАТА ФАКТОРА VIII ИЗ ПЛАЗМЫ КРОВИ ЧЕЛОВЕКА | 2010 |
|
RU2445974C2 |
| СПОСОБ ПОЛУЧЕНИЯ С1-ИНАКТИВАТОРА ЧЕЛОВЕКА | 1992 |
|
RU2068693C1 |
| Способ культивирования штамма-продуцента вируса иммунодефицита человека I типа | 1988 |
|
SU1597388A1 |
| СПОСОБ ВЫДЕЛЕНИЯ ЭКЗОСОМ ИЗ ПЛАЗМЫ КРОВИ | 2020 |
|
RU2741776C1 |
| Способ получения препаратов, обладающих адъювантными свойствами, при комплексной переработке киллерных дрожжей Saccharomyces cerevisiae | 2023 |
|
RU2836349C1 |
| СРЕДЫ ДЛЯ КУЛЬТУР КЛЕТОК МЛЕКОПИТАЮЩИХ, КОТОРЫЕ СОДЕРЖАТ НАДОСАДОЧНУЮ ЖИДКОСТЬ СТАДИЙ ФРАКЦИОНИРОВАНИЯ ПО КОНУ, И ИХ ПРИМЕНЕНИЕ | 2010 |
|
RU2461629C2 |
Способ может быть использован в биотехнологии для выращивания клеточных культур и вирусов. Ростовые протеины получают из сыворотки крови животных путем двукратной обработки ПЭГ до конечной концентрации 5,0-7,5% и после подкисления раствором соляной кислоты концентрацию ПЭГ доводят до 18-20%. Препарат подвергают трехкратному замораживанию и оттаиванию, сушат или оставляют в жидком виде. Способ позволяет получить безвредный, высокоактивный препарат. 2 з.п.ф-лы, 4 табл.
Авторы
Даты
1998-06-10—Публикация
1996-02-16—Подача