Изобретение относится к медицине, а именно к клинической иммунологии, и может быть использовано для определения содержания циркулирующих иммунных комплексов (ЦИК) в сыворотке крови человека.
Содержание ЦИК повышается в сыворотке крови при различных системных нарушениях, таких как ревматологические и аутоиммунные заболевания (1-4), при аллергических заболеваниях (5), вирусных, бактериальных и паразитарных инфекциях (1,6-8) и новообразованиях (2, 9). Тесты для определения ЦИК (10), используемые в клинической практике, основаны на
1) преципитации ЦИК полиэтиленгликолем (ПЭГ) (11, 12);
2) взаимодействии ЦИК с комплементом (Clq-тест) (13);
3) определении ЦИК, связанных с С3b (Raji-клеточный тест, конглютининовая проба) (14);
4) связывании ЦИК с аутоантителами, такими как моноклональный ревматоидный фактор (mRF-тест)(15).
В сравнительных исследованиях ВОЗ (10) было показано, что только некоторые тесты обладают достаточной чувствительностью и воспроизводимостью. Поэтому ВОЗ рекомендует использовать не менее двух тестов, которые основаны на различных иммунологических свойствах ЦИК. Комбинированное применение Clq- и mRF-тестов позволяет определять как комплементфиксирующие, так и не связывающие комплементиммунные комплексы различных размеров.
Коммерческие иммуноферментные тесты используют факторы комплемента или моноклональные антитела к ним (Clq, maClq, C3d, maC3d) и являются малодоступными в рутинных исследованиях.
Наиболее распространенным методом определения ЦИК является метод преципитации 3,5%-ным раствором ПЭГ 6000 (11). Принцип основан на способности ПЭГ 6000 осаждать из сыворотки крови агрегированные иммуноглобулины и иммунные комплексы. Изменение плотности раствора регистрируется спектрофотометрически при длине волны 450 нм. Различные концентрации ПЭГ (2,5; 3,5; 7 и 10%) вызывают преципитацию различных по молекулярной массе и размерам иммунных комплексов. Низкие концентрации ПЭГ осаждают комплексы крупных размеров, высокие концентрации вызывают преципитацию более низкомолекулярных соединений. 3,5% ПЭГ флокулирует наиболее распространенные "промежуточные" комплексы средних размеров (12).
Существенным недостатком этого метода является противоречивость результатов, получаемых, в частности, при тяжелых аутоиммунных заболеваниях (16).
С этой точки зрения понятен интерес к способам определения циркулирующих иммунных комплексов, которые отражали бы не только физические, но и биологические свойства ЦИК.
Наиболее близким техническим решением является определение иммунных комплексов в тесте потребления комплемента преципитатом, полученным с использованием ПЭГ (17). Суть метода заключается в приготовлении преципитата из сыворотки крови человека с использованием ПЭГ 6000 с концентрацией 3,5% и последующим проведением реакции потребления комплемента морской свинки этим преципитатом. Степень потребления комплемента определяется после добавления эритроцитов барана, сенсибилизированных антителами кролика. Количество иммунных комплексов в ПЭГ преципитате определяется по калибровочному графику. Однако использование ПЭГ с концентрацией 3,5% не позволяет полностью осаждать "средне" и "низкомолекулярные" иммунные комплексы, а использование термоагрегированного препарата гамма-глобулина в качестве стандарта завышает содержание иммунных комплексов в сыворотке крови, вследствие чего этот способ является недостаточно точным.
Таким образом, на настоящий момент не существует способа количественного определения циркулирующих иммунных комплексов, включающего исследование "средне" и "низкомолекулярных" ЦИК в сыворотке крови с высокой точностью и специфичностью.
Задачей настоящего изобретения является преодоление недостатков известных на сегодняшний день способов определения содержания циркулирующих иммунных комплексов.
Поставленная задача решается путем приготовления 7% ПЭГ-преципитата из сыворотки крови человека путем инкубации в течение 20 мин при комнатной температуре, что позволяет сократить время подготовительной стадии в 4,5 раза, а также приводит к осаждению "низкомолекулярных" ЦИК. Приготовленный ПЭГ-преципитат используется в последующем в реакции связывания комплемента с 0,3% сывороткой морской свинки и проводится расчет содержания циркулирующих иммунных комплексов по калибровочному графику, полученному с использованием в качестве стандарта растворимого иммунного комплекса, выделенного из сыворотки крови человека (см. чертеж). Использование 0,3% комплемента морской свинки вместо 2,4% в прототипе повышает чувствительность способа на два порядка (CI50 0,325 мкг/мл вместо 100 мкг/мл в прототипе), а использование в качестве стандарта растворимых циркулирующих иммунных комплексов, выделенных из сыворотки крови человека, позволяет максимально приблизить условия реакции к физиологическим условиям организма.
Разработанный способ включает забор крови, приготовление сыворотки, получение ПЭГ-преципитата, проведение теста связывания комплемента этим преципитатом и расчет содержания циркулирующих иммунных комплексов по калибровочному графику.
Технический результат, получаемый при реализации изобретения, заключается, с одной стороны, в углубленном исследовании физиологии циркулирующих иммунных комплексов и патогенеза многих заболеваний, сопровождающихся накоплением ЦИК в органах и тканях, приводящих к системной и органной патологии. С другой стороны, реализация изобретения позволит контролировать эффективность проводимого лечения и выявлять доклинические состояния вторичных иммунодефицитов, аутоиммунных и опухолевых процессов.
Пример. Способ определения циркулирующих иммунных комплексов в тесте связывания комплемента включает забор крови, приготовление сыворотки и получение ПЭГ преципитата, проведение теста связывания комплемента этим преципитатом и расчет содержания циркулирующих иммунных комплексов по калибровочному графику.
Влияние преципитата, полученного с использованием ПЭГ 6000, на классический путь активации комплемента морской свинки in vitro изучали с помощью гемолитических тестов с использованием эритроцитов барана (1,5×108 кл/мл), сенсибилизированных кроличьими антителами (ЕА), в вероналовом солевом буфере, содержащем 0,5 мМ MgCl2 и 0,15 мМ CaCl2 (VBS2+). ПЭГ-преципитат предварительно инкубировали с комплементом морской свинки, затем добавляли ЕА для определения остаточной активности комплемента.
Этап 1. Определение оптимальной концентрации ПЭГ 6000 для полного осаждения иммунных комплексов из сыворотки крови человека, связывающих комплемент морской свинки.
1.1. Приготовление преципитата сыворотки крови при различных концентрациях ПЭГ 6000. К 100 мкл сыворотки крови человека добавляли по 100 мкл раствора ПЭГ 6000 с концентрацией от 4 до 20% (конечная концентрация ПЭГ 6000 составляла от 2 до 10% в смеси), тщательно перемешивали и инкубировали 20 мин при комнатной температуре. Полученную суспензию центрифугировали в течение 10 мин при 3000 об/мин. Супернатант декантировали и осадок 2 раза отмывали раствором ПЭГ 6000 с соответствующей концентрацией, при которой преципитат был получен. Осадок растворяли в исходном объеме 0,01 М трис-HCl-буфера, содержащего 0,15 М NaCl и 0,01% NaN3, pH 7,4.
1.2. Определение связывания комплемента морской свинки преципитатами, полученными при возрастающих концентрациях ПЭГ 6000. К 10 мкл растворов преципитатов, разбавленных в соотношении 1:99 буфером VBS2+, полученных при различных концентрациях ПЭГ 6000, добавляли 20 мкл раствора, разбавленного 1:19 комплемента морской свинки. Общий объем доводили до 0,3 мл буфером VBS2+ и инкубировали 20 мин при 37°С. После предварительной инкубации добавляли 200 мкл ЕА и инкубировали 30 мин при 37°С. После инкубации в каждую пробу добавляли по 2,5 мл холодного раствора 0,15 М NaCl, центрифугировали и определяли величину A412 супернатанта. Контрольная проба не содержала ПЭГ-преципитата. Пониженный гемолиз в опытных пробах по сравнению с контролем свидетельствовал о наличии связывания комплемента. Степень лизиса эритроцитов (У) определяли по формуле
У(%)=[(X-R)/(H-R)×100],
где Н, R и Х-величины оптической плотности A412 в гемолитических системах контрольной пробы, в контроле спонтанного лизиса ЕА и в опытной пробе соответственно. Степень связывания комплемента (ССК) определяли по формуле
ССК(%)=100-У
Данные о ССК преципитатами сывороток, приготовленных при разных концентрациях ПЭГ 6000, приведены в таблице 1.
Из таблицы 1 следует, что преципитат, приготовленный при концентрации ПЭГ 6000 ниже 3%, обладает низкой способностью (менее 15%) связывать комплемент морской свинки. При концентрации от 3 до 6% ПЭГ в системе наблюдается дозозависимый эффект увеличения степени связывания комплемента, а свыше 6% наблюдается плато.
Таким образом, при концентрации 7% ПЭГ 6000 и выше наблюдается наиболее полное осаждение комплементсвязывающих циркулирующих иммунных комплексов из сыворотки крови человека.
Этап 2. Приготовление растворимого иммунного комплекса из сыворотки крови человека.
2.1. Приготовление преципитата сыворотки крови при концентрации 7% ПЭГ 6000 в системе. К 1 мл сыворотки крови человека добавляли 1 мл 14% ПЭГ 6000 в 0,01 М трис-HCl-буфере, содержащем 0,15 М NaCl, 0,01% NaN3, pH 7,4. Инкубировали 20 мин при 25°С. Преципитат осаждали центрифугированием при 3000 об/мин в течение 10 мин, декантировали и осадок дважды промывали 7% раствором ПЭГ 6000. Осадок растворяли в 1 мл 0,01 М трис-HCl-буфере, содержащем 0,15 М NaCl и 0,01% NaN3, pH 7,4.
2.2. Гель-фильтрация ПЭГ-преципитата. 0,5 мл раствора ПЭГ-преципитата, приготовленного, как описано выше, наносили на колонку с Sephacryl S-300 (1,6×100 см), уравновешенную 0,01 М трис-HCl-буфером, содержащим 0,15 М NaCl и 0,01% NaN3, pH 7,4. Элюцию белка осуществляли тем же буферным раствором со скоростью 20 мл/ч. Раствор белка собирали фракциями по 2 мл.
2.3. Определение комплементсвязывающей активности иммунных комплексов во фракциях с Sephacryl S-300 проводили следующим образом: к 10 мкл каждой фракции добавляли 0,3% раствор комплемента морской свинки, общий объем доводили до 0,3 мл буфером VBS2+ и инкубировали 20 мин при 37°С. После предварительной инкубации добавляли 200 мкл ЕА и инкубировали 30 мин при 37°С. Степень лизиса рассчитывали, как описано выше. Определение содержания белка осуществляли спектрофотометрически при длине волны 280 нм и методом Бредфорда. Фракцию, содержащую минимальное количество белка и обладающую максимальной комплементсвязывающей активностью, использовали в качестве стандарта растворимых циркулирующих иммунных комплексов (рЦИК).
Этап 3. Построение калибровочного графика с использованием стандарта рЦИК в тесте связывания комплемента. 5-50 мкл разбавленного в 10 раз раствора стандарта, содержащего 9,4 мкг/мл рЦИК, инкубировали в течение 20 мин при 37°С с 20 мкл разбавленного 1:19 раствора комплемента морской свинки в конечном объеме 300 мкл. После предварительной инкубации в каждую пробу добавляли по 200 мкл ЕА и продолжали инкубацию в течение 30 мин при 37°С. Степень гемолиза определяли, как описано выше. Сниженный гемолиз в опытных пробах по сравнению с контролем свидетельствовал о степени связывании комплемента (ССК) в зависимости от концентрации рЦИК. Данные степени связывания комплемента рЦИК представлены в таблице 2.
Степень связывания комплемента (ССК) имеет линейный характер до 0,564 мкг/мл рЦИК, а с 0,752 мкг/мл и выше наблюдается плато при остаточной активности комплемента на уровне 5%. CI50 для рЦИК в данном тесте составил 0,325 мкг/мл. Приведены средние значения трех измерений.
Таким образом, для более точного определения рЦИК необходимо, чтобы в тесте связывания комплемента преципитатом сыворотки, приготовленным с использованием ПЭГ 6000, ССК не должен превышать 95%. В случае, если ССК преципитатом сыворотки превышает 95% и более необходимо развести в два раза буфером и повторить тест.
Этап 4. Построение калибровочного графика с использованием термоагрегированного препарата гамма-глобулина в качестве стандарта в тесте связывания комплемента. Термоагрегированный гамма-глобулин (ТАГТ) готовили следующим образом: препарат иммуноглобулина человека с концентрацией белка 100 мг/мл агрегировали нагреванием при 63°С в течение 20 мин, быстро охлаждали и удаляли нерастворимые агрегаты центрифугированием со скоростью 3000 об/мин в течение 20 мин при 4°С. Концентрацию белка определяли спектрофотометрически при длине волны 280 нм и методом Лоури. Постановку теста связывания комплемента проводили следующим образом: 1-8 мкг/мл ТАГГ предварительно инкубировали с 1 мкл комплемента морской свинки в конечном объеме 300 мкл, доведенном буфером VBS2+, в течение 20 мин при 37°С. Затем добавляли 200 мкл ЕА и продолжали инкубацию в течение 30 мин при 37°С. ССК определяли, как описано выше. Данные ССК ТАГГ представлены в таблице 3.
Степень связывания комплемента имеет линейный характер до 3 мкг/мл ТАГГ, а с 4 мкг/мл и выше наблюдается плато при остаточной активности комплемента на уровне 30%. CI50 для ТАГГ в данном тесте составил 2,75 мкг/мл. Приведены средние значения трех измерений.
Таким образом, использование ТАГГ в качестве стандарта в тесте связывания комплемента является менее чувствительным (в 8,5 раза) по сравнению с ТСК, где используется раствор рЦИК, приготовленный из сыворотки крови человека преципитацией иммунных комплексов в 7% ПЭГ 6000 и последующей гель-фильтрацией.
Этап 5. Определение содержания ЦИК в сыворотке доноров и больных с дисплазией соединительной ткани (ДСТ).
5.1. Приготовление ПЭГ преципитата из сыворотки крови человека. К 20 мкл сыворотки крови добавляли 20 мкл 14% ПЭГ 6000, тщательно перемешивали и инкубировали 20 мин при комнатной температуре. Преципитат осаждали центрифугированием в течение 10 мин при 3000 об/мин, декантировали осадок, 2 раза промывали 7% ПЭГ 6000 центрифугированием. Преципитат растворяли в 20 мкл 0,01 М трис-HCl-буфера, содержащего 0,15 М NaCl и 0,01% NaN3, pH 7,4.
5.2. Определение связывания комплемента морской свинки ПЭГ преципитатами сывороток больных с дисплазией соединительной ткани и доноров. Тест связывания комплемента ПЭГ преципитатами проводили, как описано в пункте 1.2. Данные степени связывания комплемента рЦИК представлены в таблице 4.
Степень связывания комплемента в группе доноров колебалась от 5 до 26%, и среднее значение составило 18±8%, а в группе больных с ДСТ ССК колебалась от 33 до 95%, среднее значение - 67±18%.
5.3. Расчет содержания рЦИК в ПЭГ-преципитатах. Содержание рЦИК в ПЭГ-преципитатах определены по калибровочному графику и представлены в таблице 5.
Как видно из таблицы 5, в группе доноров средний уровень рЦИК составил 0,62±0,24 мг/мл, верхняя граница нормы в группе доноров - 0,85 мг/мл. Средний уровень рЦИК при ДСТ равнялся 2,32±0,93 мг/мл, колебания составили от 1,10 до 5,00 мг/мл.
Таким образом, способ позволяет повысить точность количественного определения циркулирующих иммунных комплексов в сыворотке крови как доноров, так и больных с ДСТ. Доступность реагентов и простота теста определения рЦИК в лабораторной практике позволит проводить углубленное исследование патогенеза хронических заболеваний, сопровождающихся накоплением ЦИК в органах и тканях, приводящих к системной и органной патологии. С другой стороны, реализация изобретения позволит контролировать эффективность проводимого лечения и выявлять доклинические состояния вторичных иммунодефицитов, аутоиммунных и опухолевых процессов.
Степень связывания комплемента преципитатами, приготовленными при разных концентрациях ПЭГ 6000 в системе
Степень связывания комплемента в зависимости от концентрации рЦИК
Степень связывания комплемента в зависимости от концентрации ТАГГ
Степень связывания комплемента ПЭГ преципитатами доноров и больных с дисплазией соединительной ткани
Литература
1. Nydegger UE, Lambert PH, Gerberg N, Miescher PA. Circulating immune complexes in the serum in systemic lupus erythematosus and in carries of hepatitis В antigen. Quantitation by binding to radiolabeled Clq // J Clin. Invest. - 1974. - V.54. - P.297-309.
2. Nydegger UE, Davis J.S. IV. Soluble immune complexes in human disease // CRC Grit Rev Clin Lab Sci. - 1980. - V.15. - P.123-70.
3. Report of IUIS/WHO working group. Use and abuse of laboratory tests in clinical immunology: critical considerations of eight widely used diagnostic procedures // Clin Exp Immunol. - 1981. - V.46. - P.662-74.
4. Bernstain KA, K.ahl LE, Balow JE, Lefkowith JB. Serologic markers of lupus nephritis in patiens: use of tissue-based ELISA and evidence for immunopathogenic heterogeneity // Cli Exp Immunol. - 1994. - V.98. - P.60-65.
5. Theofilipouslos AN, Dixon FJ. The biology and detections of immune complexes // Adv Immunol. - 1979. - V.28. - P.89-220.
6. Ritzmann SE, Daniels JC. Immune complexes: Characteristics, clinical correlations and interpretative approaches in the clinical laboratory // Clin Chem. - 1982. - V.28. - P.1259-71.
7. Sagnelli E, Felaco FM, Triolo G et al. Circulating complement fixing immune complexes in chronic hepatitis. Use of anti-С3 enzyme immunoassay to define antibody class and nature of antigen // J Clin Lab Immunol. - 1983. - V.12. - P.11-15.
8. Cook L, Agnello V. Detection of immune complexes. In: Rose NR, De Macario EC, Fahey JL, Friedman H, Penn GM, eds. Manual of clinical laboratory immunology. Washington DC: ASM, 1992. - P.110-13.
9. Segal-Eiras A, Croce MV. Immune complexes in malignent tumours. A reviw. Allergol et Immunopath. - 1984. - V.12. - P.225-232.
10. Lambert PH, Dixon FJ, Zubler RH, Agnello V, Cambiaso C, Casali P. et al.
A WHO collaborative study for the evaluation of eighteen methods for detecting immune complexes in serum // J Clin Lab Immunol. - 1978. - V. - P.1-15.
11. Лабораторные методы исследования в клинике: Справочник / Меньшиков В.В., Делеторская Л.Н., Золотницкая Р.П. и др.: Под ред. В.В. Меньшикова. - М.: Медицина, 1987. - 368 с.
12. Фримель Г. Иммунологические методы, М.: Медицина, 1987. - С.120-128.
13. Glikmann G, Svehag S.E. Detection and quantitation of circulating immune complexes by the Clq-protein A binding assay (Clq-PABA) // Methods Enzymol. - 1981. - V.74. - P.571-587.
14. Theofilopoulos A.N., Aduado M.T. Assays for the detection of complement-fixing immune complexes: Raji cells, conglutinin, and anti-С3 assays. In: Rose N.R., Friedman H., Fahey J.L., Eds. Manual of clinical laboratory immunology. Washington D.C: ASM, 1992. - P.104-109.
15. Vanham G., Bloemmen F.I, Ceuppens J.L., Stevens E.A.M. Influens of complex size and antigen-antibody ratio on immune complex detection with monoclomal rheumatoid factor and Clq // J. Clin. Lab. Immunol. - 1984. - V.15. - P.63-68.
16. Klein М, Simonovitch K. The significance and limitation of current methods for detecting imune complexes // J Reumatol. - 1981. - V.8. - 188-92.
17. Brandslund I., Siersted H.C., Jensenius J.C., and Svenag S-E. Detections and quantitation of immune complexes with a rapid polyethylen glycol precipitation complement consumption method (PEG-CC) // Methods in Enzymology. - 1981. - V.74. Pt C. - P.551-571.
| название | год | авторы | номер документа |
|---|---|---|---|
| ЭКСПРЕСС-СПОСОБ ОПРЕДЕЛЕНИЯ ХОЛЕСТЕРИНА В ИММУННЫХ КОМПЛЕКСАХ | 2012 |
|
RU2530627C2 |
| СПОСОБ ЭКСПРЕСС-ОПРЕДЕЛЕНИЯ ХОЛЕСТЕРИНА В ИММУННЫХ КОМПЛЕКСАХ | 2013 |
|
RU2538685C1 |
| СПОСОБ ВЫДЕЛЕНИЯ И ИССЛЕДОВАНИЯ АТЕРОГЕННОСТИ ИММУННЫХ КОМПЛЕКСОВ, СОДЕРЖАЩИХ МНОЖЕСТВЕННО МОДИФИЦИРОВАННЫЕ ЛИПОПРОТЕИНЫ | 2016 |
|
RU2632118C1 |
| СПОСОБ ОПРЕДЕЛЕНИЯ АТЕРОГЕННОСТИ ИММУННЫХ КОМПЛЕКСОВ | 2013 |
|
RU2549467C1 |
| ЭКСПРЕСС-СПОСОБ ОПРЕДЕЛЕНИЯ АТЕРОГЕННОСТИ ИММУННЫХ КОМПЛЕКСОВ СЫВОРОТКИ КРОВИ ЧЕЛОВЕКА | 2013 |
|
RU2549466C1 |
| СПОСОБ И ТЕСТ-СИСТЕМА ОПРЕДЕЛЕНИЯ ЦИРКУЛИРУЮЩИХ ИММУННЫХ КОМПЛЕКСОВ | 2010 |
|
RU2452962C2 |
| СПОСОБ ОПРЕДЕЛЕНИЯ ЦИРКУЛИРУЮЩИХ ИММУННЫХ КОМПЛЕКСОВ | 2009 |
|
RU2415430C1 |
| СРЕДА И СПОСОБ ОПРЕДЕЛЕНИЯ МНОЖЕСТВЕННО МОДИФИЦИРОВАННЫХ ЛИПОПРОТЕИНОВ СЫВОРОТКИ КРОВИ ЧЕЛОВЕКА | 2010 |
|
RU2444014C1 |
| СПОСОБ ОЧИСТКИ КРОВИ ОТ ДНК-СОДЕРЖАЩИХ ИММУННЫХ КОМПЛЕКСОВ С ПОМОЩЬЮ КОМБИНИРОВАННОГО СОРБЕНТА | 2010 |
|
RU2441674C1 |
| СПОСОБ ОПРЕДЕЛЕНИЯ НАРУШЕНИЯ ИММУННОГО СТАТУСА | 2002 |
|
RU2247381C2 |
Изобретение относится к области медицины, а именно к клинической иммунологии. В способе преципитат иммунных комплексов из сыворотки крови человека готовят в 7% растворе ПЭГ 6000 инкубацией сыворотки в течение 20 мин при комнатной температуре. Тест связывания комплемента проводят с 0,3% комплементом морской свинки и используют в качестве стандарта растворимые иммунные комплексы, приготовленные из сыворотки крови человека. Способ позволяет повысить точность количественного определения циркулирующих иммунных комплексов в сыворотке крови и проводить исследования патогенеза заболеваний, сопровождающихся накоплением иммунных комплексов в органах и тканях, приводящих к системной и органной патологии. 5 табл., 1 ил.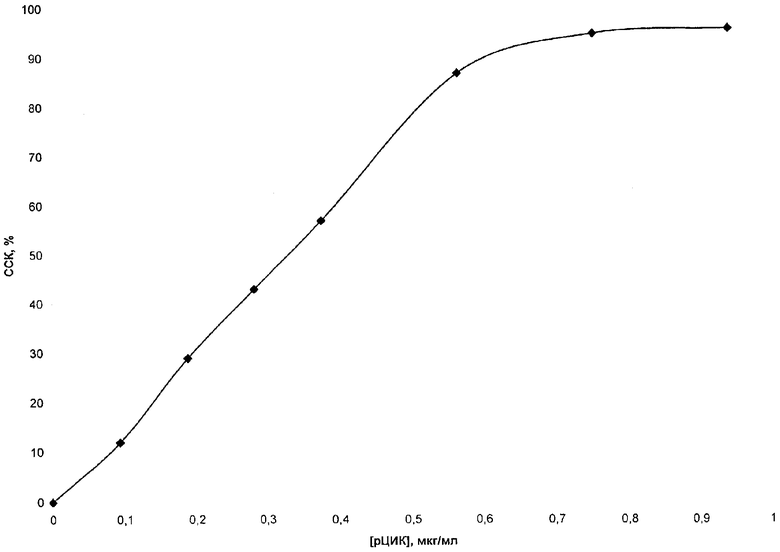
Способ количественного определения циркулирующих иммунных комплексов, включающий приготовление преципитата из сыворотки крови человека в растворе ПЭГ 6000, его центрифугирование, растворение и проведение теста путем инкубации ПЭГ-преципитата с комплементом морской свинки, последующим добавлением эритроцитов барана, сенсибилизированных антителами кролика, повторной инкубацией и определением степени связывания комплемента по сравнению с контролем системы, не содержащей ПЭГ-преципитата, после чего проводят определение концентрации циркулирующих иммунных комплексов, с использованием в качестве стандарта термоагрегированных иммуноглобулинов, отличающийся тем, что преципитат готовят в 7%-ном растворе ПЭГ 6000 инкубацией сыворотки в течение 20 мин при комнатной температуре, тест связывания комплемента осуществляют путем инкубации ПЭГ-преципитата с 0,3% комплементом морской свинки, а в качестве стандарта используют растворимые иммунные комплексы, приготовленные из сыворотки крови человека, а количественное определение циркулирующих иммунных комплексов проводят по калибровочному графику.
| BRANDSLUND I et al | |||
| Detection and quantitation of immune complexes with a rapid polyethylene glycol precipitation complement comsumption method (PEG-CC), Methods Enzymol., 1981, v.74, Pt C | |||
| Рабочее колесо паровой турбины | 1922 |
|
SU551A1 |
| HARKISS GD et al | |||
| Detection of immune complex by a new assay, the polyethylene glycol precipitation-complement comsumption test (PEG-CC), Clin Exp | |||
Авторы
Даты
2009-01-10—Публикация
2005-09-28—Подача