Изобретение относится к области гидрометаллургии щелочных металлов, в частности к получению хлорида лития.
Известно промышленное получение хлорида лития взаимодействием гидроокиси или карбоната лития с соляной кислотой.
Однако при получении металлического лития электролизом расплава солей выделяется газообразный хлор, который необходимо утилизировать.
Известно, что при взаимодействии хлора с раствором гидроокиси лития возможны реакции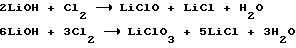
причем на холоде образуется преимущественно гипохлорит лития, а при нагревании - хлорат лития.
Аналогично протекают реакции взаимодействия суспензии карбоната лития с хлором.
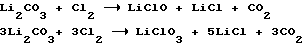
Известны способы очистки хлоридных растворов от гипохлорита и хлората взаимодействием их с восстановителями, авт.св. N 617366,C 01 В 11/06,1977 г. , 865800, МКИ C 01 D 3/14, 1979 г.
Однако использование восстановителей загрязняет раствор хлорида лития и экономически нецелесообразно.
Известен способ очистки хлоридных растворов от хлората путем подкисления соляной кислотой нагретого до 60 -100oC хлоридно-хлоратного рассола с последующим разложением образующейся двуокиси хлора ультрафиолетовым излучением (патент США N 4169773, кл. 204-298, 1978 г.).
Недостатком данного способа очистки раствора от хлората применительно к производству хлорида лития методом абсорбции газообразного хлора гидроокисью лития является дополнительный расход соляной кислоты для создания кислой среды и газообразный хлор, получаемый в результате разложения двуокиси хлора: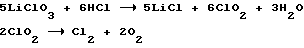
который необходимо утилизировать, что приводит к перепроизводству хлорида лития по отношению к затраченному на производство лития металлического. К тому же двуокись хлора при определенных условиях разлагается со взрывом (Г.Реми, Курс неорганической химии, Т. 1, с. 862, 1963 г.).
Наиболее близким техническим решением разрушения гипохлорита при получении хлорида лития способом абсорбции газообразного хлора (хлорвоздушной смеси) является использование в качестве катализатора окиси меди, окиси железа, гидроокиси никеля и гидроокиси кобальта, а для разрушения хлората-двуокиси марганца. Очистка полученного раствора хлорида лития от остаточного гипохлорита и хлората лития, а также от алюминия, содержащегося в исходном сырье, и металлов катализатора заключается в разрушении остаточного гипохлорита и хлората нагреванием до 80 - 100oC в кислой среде, и осаждении гидрооксидов металлов катализатора и алюминия при pH 10,0 - 11,0, так как при более низком значении pH в растворе остаются металлы катализатора, а при более высоком pH в раствор переходит алюминий в виде гидроалюмината лития (Справочник химика. Т. IV, с. 56 -57).
Однако при осаждении гидрооксидов алюминия и металлов катализатора из раствора хлорида лития образуются гидратные осадки, имеющие сложную структуру состава:
(Li,Me)[Al(OH,Cl)] и Li[Me(OH,Cl)]
где Me - металлы катализатора. (Сборник докладов VI Всесоюзной конференции по химии технологии щелочных элементов. Ашхабад 1983 г. "О сложных структурах гидроалюмината лития и его анионсодержащих производных" Н.П.Томилов, Е.Г.Девяткина, А.С.Бергер), что исключает повторное использование катализатора без дополнительной очистки от алюминия. К тому же при контакте с воздухом во время хранения (до переработки) гидроалюминат лития поглощает углекислоту (Сборник докладов II Всесоюзного совещания по редким щелочным элементам 13-16 октября 1964 г., Новосибирск "Свойства гидроалюмината лития" Н.П.Коцупало, И.В.Гусева и другие), и в гидратных осадках происходят модификационные превращения двойных и многокомпонентных гидрооксидов с образованием продуктов, устойчивых в растворе соляной кислоты. Экспериментально установлено, что данные гидратные осадки после недельного и более длительного хранения полностью растворяются соляной кислотой только при достижении кислотности раствора 2,95 -3,05 нормали. Но растворение гидратных осадкой при кислотности 2,95 -3,05 нормали с последующим осаждением гидрооксида алюминия при pH 4,0 - 4,2, с целью извлечения металлов катализатора не дает желаемого результата, так как при осаждении гидрооксида алюминия из раствора хлорида лития и металлов катализатора образуются осадки, имеющие сложную структуру состава (Li,Me)[Al(OH,Cl)]
Результаты экспериментов приведены в таблице.
Из приведенных данных таблицы видно, что при осаждении гидрооксида алюминия из раствора хлорида лития, где лития 26 г/л, содержание никеля в растворе падает в несколько раз за счет осаждения гидроалюмината никеля. Поэтому извлечение никеля из гидратных осадков в случае использования гидрооксида никеля в качестве компонента катализатора не превышает 25% при соотношении Al: Ni = 2,25:1, а увеличение содержания алюминия в исходном сырье и соответственно в гидратных осадках делает извлечение никеля невозможным. Использование в качестве компонентов катализатора других гидрооксидов тяжелых металлов переменной валентности показало, что при осаждении гидрооксида алюминия также имеет место соосаждение в виде гидроалюминатов, и извлечение металлов катализатора в аналогичных условиях не превышает 20 - 30%. Поэтому гидратные осадки, содержащие гидрооксиды алюминия и металлов катализатора, где содержание лития составляет 26 - 30 г/л, идут в отходы, т.к. литий химически связан в виде двойных и многокомпонентных гидрооксидов.
Известно, что при нагревании до 200oC 91,5% гидроалюмината лития разлагается на гидрооксид алюминия в форме метагидроокиси - AlO(OH) и гидроокись лития (Сборник докладов III Всесоюзного совещания по редким щелочным элементам, г. Пермь 1968 г. "Гидролиз гидроалюмината лития" О.Г.Евтеева, Н.П.Коцупало).
Однако данный способ извлечения лития из гидроалюмината требует специального оборудования, к тому же температурное разрешение многокомпонентных гидрооксидов не изучено.
Целью изобретения является сокращение потерь лития и катализатора, а также уменьшение отходов производства.
Поставленная цель достигается тем, что раствор, полученный взаимодействием гидроокиси лития с хлором в присутствии катализатора, нагревают до 50 - 100 oC при pH > 11, так как при pH>11 алюминий находится в растворе (Справочник химика. Т. IV, с. 56-57), а при температуре раствора выше 50oC, как установлено экспериментально, резко возрастает скорость каталитической реакции перехода гипохлорита лития в хлорид с выделением кислорода, а не с выделением хлора и двуокиси хлора, как при нагревании в кислой среде, при этом гидрооксиды металлов катализатора коагулируются, что повышает фильтруемость раствора. Затем раствор фильтруют, осадок, содержащий коагулированные гидрооксиды металлов катализатора, где содержание алюминия в сухом веществе осадка составляет не более 0,5% вес., что исключает накопление алюминия в технологической системе, направляют на стадию взаимодействия раствора гидроокиси лития с хлором, а фильтрат, где содержание гипохлорита и хлората лития зависит от температуры и длительности нагрева, переводят в кислую среду с pH < 4, и при температуре 70 - 100oC осаждают гидрооксид алюминия в интервале pH 5,5 - 8,5, так как при гидролизе из кислой среды и температуре выше 70oC, как установлено экспериментально, в осадок выпадает гидрооксид алюминия в форме AlO(OH), который не содержит химически связанный литий, как в случае осаждения гидроалюмината лития - Li[Al(OH)4]. Указанный интервал pH осаждения позволяет из фильтрата получать товарный хлорид лития с содержанием Al < 6,4•10-4 вес. %, а при pH < 5,5 и pH > 8,5 содержание алюминия в товарном хлориде возрастает. Осадок AlO(OH) после промывки конденсатом, где содержание лития зависит от качества промывки, является товарным продуктом.
Изобретение также можно использовать для очистки растворов хлоридов щелочных металлов от гипохлорита и хлората и для извлечения лития из гидроалюмината, например, полученного по способу (Сборник докладов VI Всесоюзной конференции по химии и технологии щелочных элементов. Ашхабад 1983 г. "Извлечение лития из малоконцентрированных литий содержащих отходов" Н.К. Ефимов, А.И.Горбунов и другие) путем его разрушения соляной кислотой и осаждения алюминия в виде гидрооксида в форме метагидроокиси.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ВЫДЕЛЕНИЯ ЦЕРИЯ | 1995 |
|
RU2085493C1 |
| СПОСОБ ОЧИСТКИ ВОДЫ ОТ СОЕДИНЕНИЙ МЫШЬЯКА | 2019 |
|
RU2725315C1 |
| СПОСОБ ИЗВЛЕЧЕНИЯ КОБАЛЬТА ИЗ КОБАЛЬТСОДЕРЖАЩЕГО МАТЕРИАЛА | 1998 |
|
RU2127326C1 |
| СПОСОБ КОМПЛЕКСНОЙ ПЕРЕРАБОТКИ ПОПУТНЫХ ВОД НЕФТЯНЫХ МЕСТОРОЖДЕНИЙ | 2000 |
|
RU2189362C2 |
| СПОСОБ ПОЛУЧЕНИЯ КОНЦЕНТРАТОВ ГИПОХЛОРИТОВ ЩЕЛОЧНЫХ МЕТАЛЛОВ | 1992 |
|
RU2026808C1 |
| СПОСОБ ПОЛУЧЕНИЯ ХЛОРИДА КАЛЬЦИЯ | 2003 |
|
RU2255899C1 |
| СПОСОБ ПОЛУЧЕНИЯ ХЛОРИДА ЛИТИЯ | 2005 |
|
RU2300497C1 |
| Способ комплексной переработки попутных вод нефтяных месторождений | 2020 |
|
RU2724779C1 |
| Способ переработки отработанных плавов титановых хлоратов | 1987 |
|
SU1452144A1 |
| Способ обработки кислых шахтных вод от металлов | 2024 |
|
RU2837416C1 |

Изобретение относится к области гидрометаллургии щелочных металлов, в частности, к способам получения хлорида лития. Способ заключается в том, что гидроксид лития или суспензию карбоната лития подвергают взаимодействию с хлором и подученный при этом раствор нагревают до 50-100oС при рН>11 в присутствии катализатора, состоящего из гидроксидов металлов, после чего отделяют осадок, содержащий катализатор, и возвращают его на повторное использование, а раствор подвергают очистке от примесей алюминия осаждением его в виде гидроксида, который отделяют от раствора, и последний направляют на производство товарного хлорида лития. Согласно изобретению сокращаются потери лития и катализатора. 1 табл.
Способ получения хлорида лития, включающий взаимодействие раствора гидроксида лития или суспензии карбоната лития с хлором, отличающийся тем, что раствор, полученный в результате взаимодействия исходных реагентов, нагревают до 50 - 100oC при pH > 11 в присутствии катализатора, состоящего из гидроксидов металлов, после чего осадок, содержащий катализатор, отделяют и возвращают его на повторное использование, а раствор подвергают очистке от примесей алюминия осаждением его в виде гидроксида, который отделяют от раствора, и последний направляют на производство товарного хлорида лития.
| SU, авторское свидетельство, 617366, кл | |||
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| Плюще В.Е | |||
| и др | |||
| Химия и технология редких и рассеянных элементов | |||
| Ч | |||
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| Краткая химическая энциклопедия | |||
| Т | |||
| Походная разборная печь для варки пищи и печения хлеба | 1920 |
|
SU11A1 |
| - Советская энциклопедия, 1963, с | |||
| Складная кровать с брезентовой палубой | 1921 |
|
SU987A1 |
Авторы
Даты
1998-06-27—Публикация
1996-01-11—Подача