Изобретение относится к области растворения металлического золота выщелачивающим раствором, в особенности гидрометаллургического извлечения золота из руды. В частности, это касается области выщелачивания золота, где для выщелачивания применяют лиганд и окислитель, в качестве активатора растворения используют гетероциклическое ароматическое соединение, содержащее в кольце азот или серу.
Технические предпосылки
Многие процессы требуют растворения золота, например извлечение металлического золота из руды, содержащей небольшие количества металла, выделение золота из позолоченных предметов и получение растворимых соединений золота для применения в производстве катализаторов. Однако золото как металл известно своей устойчивостью к растворению и химическому взаимодействию. Например, золото будет растворяться в водном растворе только в том случае, если раствор содержит подходящий лиганд или связывающий агент для золота плюс окислитель. Ни один из компонентов по отдельности не эффективен. Такое сочетание лиганда и окислителя называется выщелачивающей системой.
В прошедшем столетии для золота было предложено и использовано много выщелачивающих систем, главным образом, для золотодобывающего производства. Наиболее широко используемая система представляет собой сочетание цианида натрия в качестве лиганда с воздухом (кислородом) в качестве окислителя, в основном, из-за экономии и простоты процесса. Другими важными системами лиганд/окислитель являются тиомочевина и тиоцианат с ионами трехвалентного железа, тиосульфат натрия и воздух, сульфат меди (II) и аммиак, хлорид натрия и гипохлорит натрия, бромид натрия и бром, а также множество других систем. Химия этих и других альтернативных выщелачивающих систем описывается в обзорной статье J.B. Hiskey and V.P.Atluri, Mineral Processing and Extractive Metallurgy Review, 4,95-134 (1988). Выбор определенной выщелачивающей системы зависит от различных факторов, в том числе, от стоимости компонентов, безопасности, охраны окружающей среды и коррозии оборудования. Для горнодобывающих процессов основным фактором выбора определенной выщелачивающей системы часто является легкость отделения примесей, связанных с золотом в руде.
Известно, что некоторые двухвалентные катионы металлов, такие как свинец, ртуть, таллий и висмут, ускоряют растворение золота в растворах цианидов. Механизм действия неизвестен, несмотря на то, что предполагают деполяризацию поверхности золота и предотвращение пассивирования поверхности золота. Использование этих металлов нежелательно. Если они выделяются вместе с золотом, в дальнейшем может потребоваться дорогостоящая очистка. Если какая-либо часть этих сильнотоксичных ионов металла попадет в отходы от переработки руды, они создадут серьезную и длительную опасность загрязнения окружающей среды.
Усовершенствование любой из обычно используемых систем выщелачивания будет иметь большое значение, особенно если оно получит широкое применение в разнообразных системах. Это усовершенствование могло бы дать более высокий выход растворенного золота при стандартных условиях растворения, сокращение времени цикла на этом этапе, снижение жесткости рабочего режима, использование меньших количеств компонентов щелока или привести также к другим способам снижения стоимости, повышения безопасности или повышения выхода золота. В настоящее время не открыт ни способ улучшения работы обычно применяемых систем выщелачивания без использования ядовитых соединений металлов, ни способ, который широко применим.
Патент США 3597290 открывает метод химического растворения металлов и, в частности, описывает травление меди подкисленным пероксидом водорода. В методе используется раствор, содержащий сильную органическую кислоту или неорганическую кислоту (кроме галогенводородных кислот) плюс пероксид водорода и насыщенный низший алифатический спирт. Эта система может содержать, по выбору, каталитические количества соли металла с более низким окислительным потенциалом, чем у растворяемого металла, для повышения растворения последнего, катализаторы, в том числе, соли таких металлов, как серебро, ртуть, палладий, золото и платина. По выбору, система может также включать соединения азота, имеющие по крайней мере один участок связывания с медью, такие как мочевина, пиридин, амины и кислые амиды. В отличие от настоящего изобретения патент '290 не дает способ усиления растворения золота или других металлов, а скорее предлагает использование каталитических количеств солей определенных благородных металлов для усиления растворения других металлов с более высоким окислительным потенциалом, таких как медь. Упомянутые азотсодержащие соединения являются скорее необязательными, чем необходимыми, и полезны как связывающиеся с медью агенты для подавления подрезания меди в селективном процессе травления.
Польский патент PL 130.801 открывает процесс извлечения серебра и меди из сульфидных руд, включающий применение смеси, включающей пиридин и его гидрохлорид для растворения минералов, содержащих эти ионы металлов, отделение инертного материала фильтрованием, добавление воды, экстракцию хлороформом для удаления хлорида серебра и пиридина и восстановление меди из водной фазы путем электролиза. Процесс похож на многие примеры, описанные в литературе, где содержащие азот гетероциклические соединения используются для перевода комплексов металлов в органический растворитель. Патент '801 обеспечивает повышения эффективности работы системы выщелачивания золота, содержащей лиганд и окислитель, путем добавления каталитических количеств ароматического гетероциклического соединения, содержащего в кольце азот или серы. Он скорее предполагает применение больших количеств пиридина и гидрохлорида пиридина для растворения содержащих сульфиды серебра и меди руд и осуществление отделения ионов меди от ионов серебра путем экстракции серебра и пиридина в раствор хлороформа.
Патент США 5169503 открывает процесс экстракции металлов из руды, использующий выщелачивающую систему, состоящую из хлорида, гипохлорита и, необязательно, циануровой кислоты, азотсодержащего гетероциклического соединения. Циануровая кислота используется для продления срока действия раствора гипохлорита в кислых условиях, даже если установлено, что фактически скорость реакции между металлами, которые должны быть растворены, и хлорсодержащими соединениями снижается.
Многочисленные примеры в литературе описывают применение азотсодержащих гетероциклических ароматических соединений в сочетании с растворимыми соединениями золота для различных целей. Патент США 4654145, патент Японии 01111824; Z.Zhang and W. Gam, Huaxue Shiji, 137-139 (1982) и M.Igbal and M. Ejaz, Radiochim. Acta, 22, 37-39 (1975). Например, распространенное применение для извлечения золота из водных растворов их солей путем экстракции растворителем. Эти азотсодержащие ароматическое гетероциклические соединения также применяются в получении смол для отделения растворимых видов металлов из растворов и часто используется для улучшения нанесения гальванического покрытия из золота, позволяя применять высокую плотность тока без потерь выхода по току. В качестве ближайшего аналога рекомендуется использовать известный из патента ЕР, 0358004, C 22 B 11/08, опубл. 14.03.90 способ растворения золота и выщелачивающей системе лиганд/окислитель, включающий добавление в систему каталитического количества каталитического соединения. Во всех этих примерах гетероциклические ароматические соединения взаимодействуют с растворимыми ионами металлов и не принимают участия в растворении металла, в действительности, в случае нанесения гальванического покрытия процесс как раз является обратным, удаляющим металл из его раствора.
Таким образом, необходим способ повышения эффективности работы выщелачивающей системы для растворения золота, который повысил бы скорость растворения, сделал возможным более высокий выход металла, использовал меньше реактивов или допускал применение менее жестких условий. В частности, необходим каталитический метод усовершенствования таких выщелачивающих систем, которые широко применимы для большого количества систем и которые не требуют использования солей ядовитых металлов.
Это изобретение обеспечивает усовершенствование в процессе выщелачивания металлического золота в системах, использующих лиганд и окислитель. Усовершенствование включает добавление каталитических количеств произвольно замещенных гетероциклических ароматических соединений, содержащих в кольце серы или азот, при условии, что гетероатомы серы и/или азота и гетероциклическое кольцо в таких гетероциклических соединениях доступны для образования координационной связи с поверхностью нерастворенного металлического золота.
В традиционных системах для выщелачивания золота используется окислитель для первичного превращения металлического золота в ион золота и лиганд, который образует координационную связь с образовавшимся ионом золота.
В усовершенствованной системе изобретения добавляется содержащий азот и/или серу ароматический гетероцикл, который способствует растворению золота с большей скоростью или при более мягких условиях, чем без него. Получающийся комплекс золота состоит из окисленного иона металла, соединенного координационной связью с добавленным лигандом и, возможно, молекул растворителя; ароматическое гетероциклическое соединение не является частью координационной сферы и в процессе не расходуется.
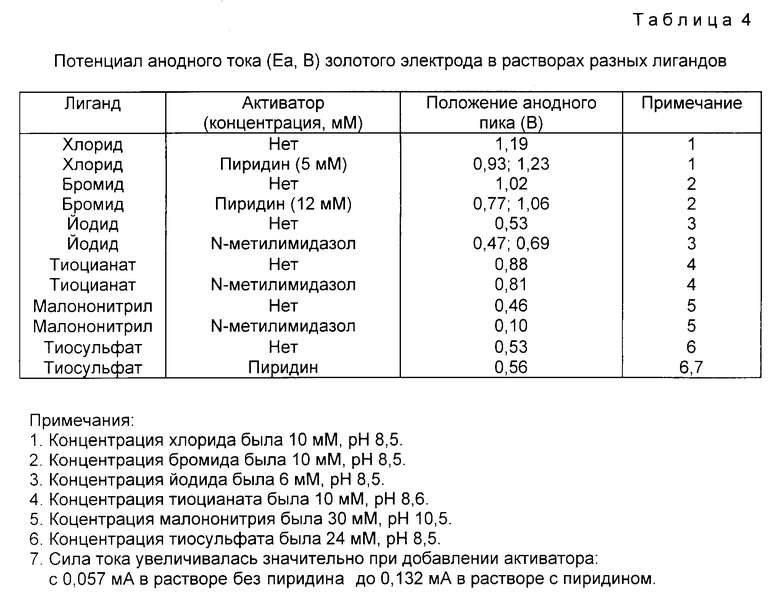
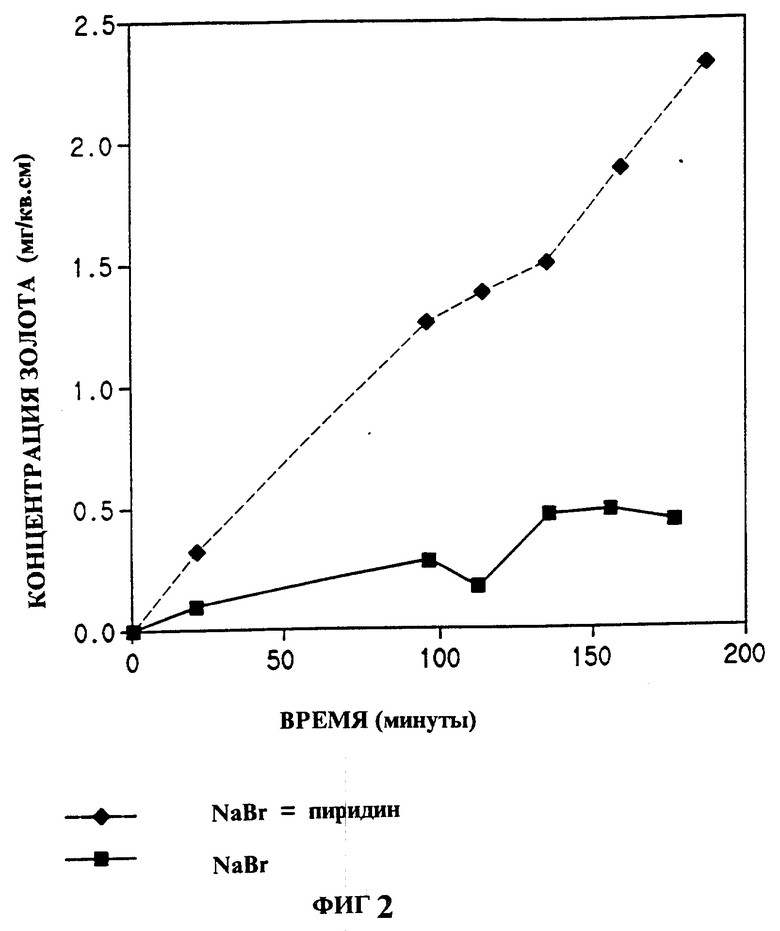
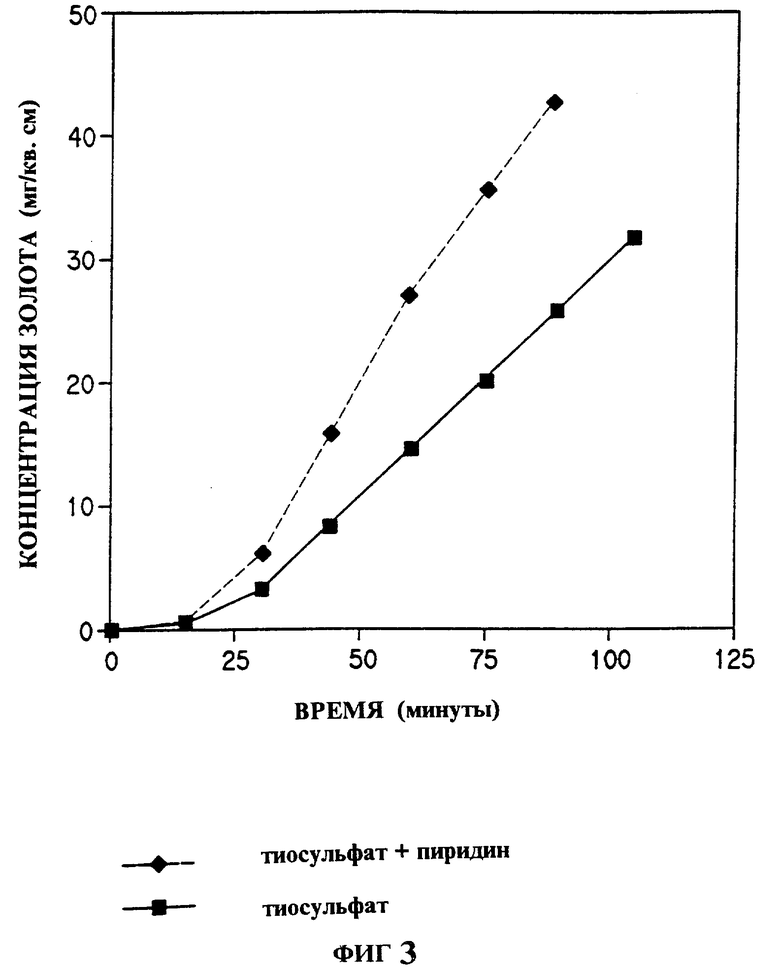
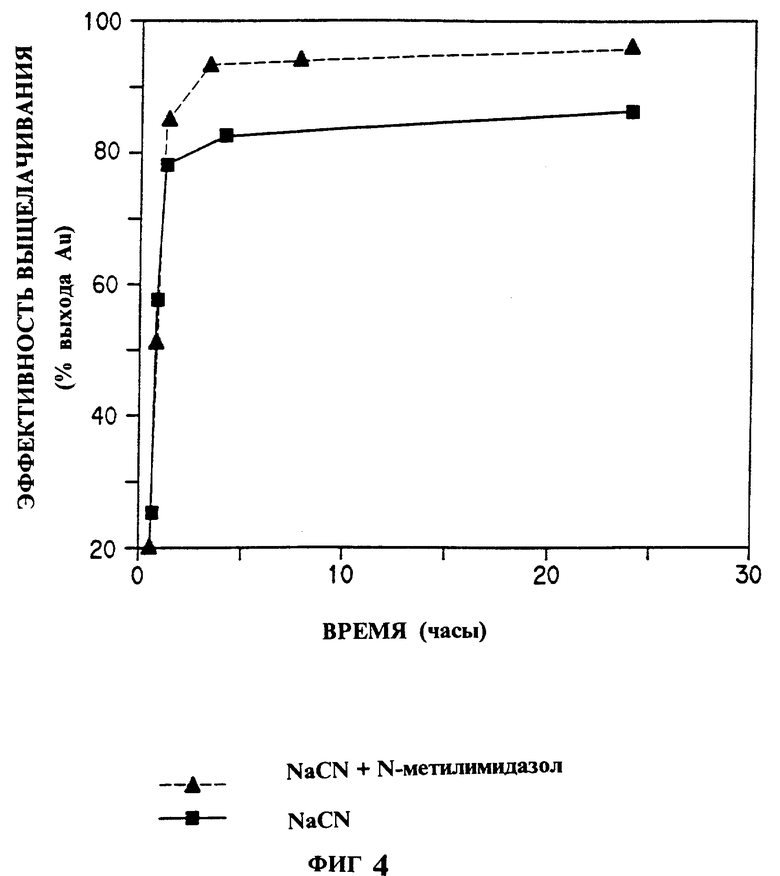
На фиг. 1 показано влияние различных гетероциклических соединений изобретения на растворение золота в системе хлорид натрия - гипохлорит натрия; на фиг. 2 - влияние пиридина на растворение золота в системе бромид натрия - гипобромит натрия; на фиг. 3 - растворение золота в системе аммиачная медь-тиосульфат-воздух в присутствии или отсутствии пиридина; на фиг. 4 - эффективность выщелачивания золота из золотосодержащей руды раствором цианид натрия - воздух в присутствии или отсутствии 5 ppm N-метилимидазола.
Все выщелачивающие системы для металла, обычно используемые в настоящее время, требуют добавления лиганда для связывания иона металла и окислителя для окисления металла. Для таких металлов как золото требуются сильные окислители, такие как хлор или бром, и много лигандов, таких как хлорид- или бромид ионы. Такие выщелачивающие растворы сильно коррозионно-агрессивны и должны применяться в дорогостоящем оборудовании, которое инертно по отношению к этим веществам. Также такие сильные окисляющие растворы часто неселективны в окислительных реакциях, что приводит к нежелательному загрязнению требуемого металлического продукта.
Добавление соединений-активаторов, таких как описывают Заявители изобретения, позволяет использовать менее коррозионно-агрессивные растворы для выщелачивания металла без значительных потерь в скорости растворения металла. Такой активатор также позволяет использовать меньшее количество реактивов для растворения металлов. Требуется не только меньше лиганда для растворения металла с приемлемой скоростью, но и меньшее количество реагента для выхода и/или разложения в конце цикла выщелачивания. В горной промышленности, использующей, например, цианид натрия, применение меньших количеств цианида также означает применение меньших количеств реагента для разложения цианида в конце цикла выщелачивания. Кроме того, более низкая концентрация цианидов в водоеме для отходов в водоеме с обогащенным раствором и других водных растворах, означает уменьшение риска загрязнения окружающей среды. Таким образом, настоящее изобретение дает значительные преимущества для горной промышленности.
В заявленном изобретении рассматривается процесс повышения растворения или выщелачивания металлического золота путем добавления каталитических количеств определенных гетероциклических ароматических соединений, содержащих азот и/или серу в ароматическом кольце, в выщелачивающую систему лиганд/окислитель.
В соответствии с целями настоящего открытия заявленного изобретения подразумевается, что следующие термины имеют значения, приводимые ниже.
Слово "выщелачивать" обозначает "экстрагировать или растворять компонент, входящий в состав твердой смеси". Выщелачивающий раствор или система представляют собой раствор или систему, содержащую компоненты, необходимые для извлечения желаемого компонента. В частности, как используется Заявителями для описания растворения золота, выщелачивающая система содержит как окисляющий агент, который окисляет металлическое золото до катиона золота, и лиганд для образования координационной связи с катионом золота.
Используя словосочетание "каталитические количества" или "каталитическое соединение" в отношении определенных гетероциклических соединений. Заявители имеют в виду традиционное значение слова "каталитический", т.е. гетероциклические соединения в процессе выщелачивания не изменяются. В частности 9-й Новый Академический Словарь Уэбстера (Webster's Ninth New Collegiate Dictionary) определяет термин "катализ" как "изменение и, главным образом, увеличение скорости химической реакции, вызываемое веществом, не изменяющимся химически до конца реакции". Обычно катализатор используется в меньшем, чем стехиометрическое, количестве.
Используя выражение "выщелачивающая система, использующая лиганд и окислитель". Заявители включают цианид и воздух или растворенный кислород, хлорид и гипохлорид; бромид и бром; йодид и йод; тиоцианат и ионы трехвалентного железа; тиомочевину и ионы трехвалентного железа; тиосульфат аммония, медь, аммиак и воздух или растворенный кислород; малононитрил и воздух или растворенный кислород; и цианид, хлорид, бромид, йодид, тиоцианат, тиосульфат, малононитрил и тиомочевину на золотом электроде в анодном растворении золота.
При описании "азот и серосодержащих ароматических гетероциклических соединений" изобретения. Заявители включают те соединения, у которых по крайней мере один гетероатом азота и/или серы в кольце доступен для образования координационной связи с поверхностью твердого металла в течение процесса растворения. В частности, включены ароматические гетероциклы, содержащие азот и/или серу в кольце, у которых
1) атом азота в кольце не протонирован;
2) по крайней мере один атом серы или азота в кольце не имеет заместителей;
3) стерическое препятствие не мешает гетероатому или ароматической структуре, содержащей его, образовывать координационную связь с поверхностью твердого нерастворенного металла. Стерическое препятствие может быть связано, например, с наличием на кольце больших заместителей, которые предотвращают приближение либо гетероатома, либо гетероциклического кольца к поверхности металла.
Гетероциклические соединения изобретения
Гетероциклические соединения изобретения эффективны в широком спектре выщелачивающих систем, типичных для золотодобывающих процессов, особенно в системах цианид натрия - воздух; хлорид натрия - гипохлорит; бромид натрия - бром; медь - тиосульфат аммония; тиоцианат-ион трехвалентного железа; тиомочевина и ион трехвалентного железа; иодид и малононитрил. Однако, как описано ниже, не каждая предлагаемая добавка может быть одинаково эффективна в каждой выщелачивающей системе из-за вероятности побочных химических реакций или свойств определенных выщелачивающих растворов (pH, потенциала раствора, лиганда, золота и т.д.). Также Заявители предполагают, что гетероциклические ароматические соединения данного изобретения будут действовать не только как активаторы в различных выщелачивающих системах, обычно применяемых в золотодобывающих процессах, но также будут применимы в других процессах, требующих растворения золота.
Гетероциклические ароматические соединения данного изобретения имеют несколько общих свойств. Все они содержат один или более атомов азота и/или серы в гетероциклическом ароматическом кольце, где гетероатом азота или серы доступен для образования координационной связи с поверхностью металла. Гетероатом должен иметь свободную электронную пару для координационной связи. Азотсодержащие соединения не должны иметь стерических препятствий, и pH выщелачивающего раствора должен быть достаточно щелочным, чтобы гетероатом азота не подвергался протонированию. Примеры соответствующих азотнесущих гетероциклических ароматических соединений включают пиридин, имидазол,N-метилимидазол, 2,2'-дипиридил, 2,3-, 2,4-, 3,5- и 2,6-лутидин, коллидин, пиразин, замещенные триазины, пиримидины и конденсированные циклические производные, такие как хинолин, изохинолин, бензимидазол и замещенные бензимидазолы, такие как 2-аминобезимидазол. Примерами неэффективных или менее эффективных соединений, у которых атом азота имеет стерическое препятствие, являются 2,6-дифенилпиридин, 2,6-t-бутилпиридин и пиридин-N-оксид.
Аналогично, координирующий гетероатом не должен быть протонирован; в случае азотсодержащего гетероциклического соединения, значение pH выщелачивающей системы должно быть больше pKa содержащего протонированный атом азота соединения. Серосодержащие соединения согласно данному изобретению также не должны иметь стерических препятствий. Примерами подходящих серосодержащих соединений являются тиофен, 3-тиофенкарбоновая кислота и 3-тиофенацетонитрил. Неэффективные или менее эффективные производные тиофена включают тетрабромтиофен и 3, 6, 9, 14 - тетратиабицикло[9.2.1]тетрадека - 11, 13 - диен. Неактивность соединений необязательно предполагает отсутствие связывания с поверхностью металла.
Под гетероциклическими ароматическими соединениями Заявители подразумевают соединения, попадающие под традиционное определение "ароматические" широко используемое в органической химии (J.Marh, Advanced Organic Chemistry, 4th Ed. Wiley & Sons, 1992). К ним относятся органические циклические соединения, содержащие по крайней мере один гетероатом (или атом, не являющийся углеродом), у которых кольцо замкнуто или представляет собой конденсированную, полностью конъюгированную систему с 4n+2 (n=0,1,2,3...) пи-электронами в конъюгированной системе. Например, пиридин, 6-членный цикл с атомом азота, является таким гетероциклическим ароматическим соединением, у которого азот и каждый атом углерода в кольце отдают по одному электрону в пи-систему общих 6 пи-электронов. Тиофен, 5-членный гетероцикл с атомом серы, также является ароматическим, с атомом серы, отдающим два электрона, и каждым из атомов углерода, отдающим по одному электрону в общую систему из 6 пи-электронов. Ароматический характер также предполагает другие важные особенности молекул, используемых в этом изобретении. Циклы, описанные выше, имеют плоскую или планарную структуру с гетероциклическим атомом в виде части планарной структуры молекулы. Однако необязательно, чтобы молекула активного соединения была полностью планарной. Заместители могут значительно влиять на активность гетероциклических соединений, изменяя ароматичность кольца. Как 2-гидроксипиридин, так и 4-гидроксипиридин неэффективны как катализаторы цианирования золота, тогда как 3-гидроксипиридин является эффективным катализатором. Инертность является результатом того, что 2- и 4-гидроксипроизводные присутствуют в форме кетотаутомеров, что, таким образом, ослабляет ароматический характер и способствует протонированию азота пиридина. Этот таутомер не имеет значение для 3-гидроксипиридина, который остается полностью ароматическим с непротонированным атомом азота. Подобные примеры можно привести для других азотсодержащих ароматических циклических систем.
Разнообразные заместители на ароматическом гетероциклическом кольце могут быть толерантными или даже повышать активность исходных гетероциклических ароматических соединений. К исходным соединения относятся, например, пиридин, пиразин, пиримидин, имидазол, оксазол, пиразол, тиазол, тиадиазол, тиатриазол, тиазин, тиофен и триазол, а также конденсированные гетероциклические производные, такие как хинолин, изохинолин, бензимидазол, бензотиофен. Заместители включают алкильные группы (такие как, метил, этил, пропил и бутил), алкокси группы (такие как метокси и этокси), арильные группы (такие как фенил и толлил), гетероциклические ароматические группы (такие как пиридил, пиразолил, имидазолил и тиофенил), амино и замещенные аминогруппы (такие как у 4-диметиламинопиридина), карбокси, ацетил и галогенид (фторид, хлорид, бромид, йодид). Сочетание заместителей также эффективно; например, амино и гидроксильный заместители на алкильной цепи в качестве заместителя пиридина (например 2-(2-гидроксиэтил)пиридин) дают активные соединения. Азотсодержащие гетероциклические ароматические соединения с заместителями, которые повышают pKa атома азота в кольце, являются более эффективными активаторами, позволяющими выщелачивающей системе работать в подходящем интервале pH.
Соединения могут проверяться на действие их как активаторов электрохимически. Для сравнения растворов интересующих лигандов, содержащих и несодержащих предполагаемый активатор, используют циклические вольтамограммы. В этом методе изменяют напряжение между двумя электродами (рабочим электродом из золота и индикаторным электродом, таким как платина), измеряя силу тока между электродами. Если на электроде при определенном напряжении идет реакция окисления или восстановления, между электродами идет ток. При растворении золотого электрода происходит повышение силы тока при заданном напряжении. Этот электрический ток называется волной окисления или анодным пиком, потенциал, при котором это происходит является потенциалом окисления. Без активатора или с неэффективным соединением волна окисления наблюдается только при окислительном потенциале, определяемом находящимся в растворе лигандом. В присутствии активатора в пассивном участке вольтамограммы неактивированного варианта наблюдается дополнительная волна. Эта новая волна смещена в сторону катода (при более низком потенциале) от пика в неактивном варианте.
Например, в растворе хлорида процесс, дающий анодный пик, следующий:
Au + 4Cl- ---> [AuCl4]- +3 электрона,
Этот процесс соответствует анодному растворению золота. В присутствии даже низких концентраций активатора наблюдается дополнительный пик, ближе к катоду по сравнению с первым пиком, но получается то же соединение золота. То есть, соединение-активатор активирует растворение золотого электрода.
Важно, что новая волна окисления возникает в результате сочетания лиганда (такого как ион хлора) с активатором (таким как пиридин) синергическим образом, что фактически сдвигает волну окисления золота к более низкому потенциалу. Аналогичные эффекты по отношению к потенциалам окисления золота можно наблюдать с различными сочетаниями активатора (таких как пиридин, имидазол, N-метилимидазол или 3-тиолфенкарбоновая кислота) и лиганда (таких как хлорид, бромид, йодид, тиоцианат, малононитрил или цианид). В некоторых случаях, как например, с тиосульфатом в качестве лиганда новый пик не наблюдается, скорее ток, связанный с окислением золота значительно возрастает при добавлении низких концентраций активатора, такого как пиридин. Повышение электрического тока указывает на усиление анодного растворения золота в растворе тиосульфата.
Этот новый или усиленный пик не наблюдается в растворах активатора с анионом, который не образует координационной связи с золотом (таким как перхлорат или нитрат); таким образом, новый пик не является единственно результатом взаимодействия активатора с поверхностью золота.
Циклические вольтамограммы золотого электрода в растворах активатора сильно различаются. Действительно, для большинства азотсодержащих гетероциклических соединений при некислых условиях нет данных о растворении золотого электрода.
Предшествующий опыт не содержит данных об этой возможности активаторов сдвигать волну окисления к более низкому потенциалу. Действительно, при использовании пиридина в растворах, содержащих такие анионы, как перхлорат, который не образует стабильного комплекса с золотом, найдено, что пиридин повышает потенциал волны окисления и, следовательно, защищает поверхность золота от анодных реакций (P. Zelenay, L.M. Rice-Jackson and A. Wieckowski, Langmuir, 6, 974-979 (1990)).
Так как нет полного перечня возможных азот и серосодержащих ароматических гетероциклов, соответствующих данному изобретению, то в следующем списке представлены наиболее предпочтительные соединения: 2-(аминометил)пиридин, 2-аминопиридин, 3-аминопиридин, 4-аминопиридин, 2,2'-дипиридил, 2-пропилпиридин, 2,2'-пиридил, пиридин, 3-аминопиразол, 3,5-диметилпиразол, 4,4'-дипиридил, 2,2'-дипиридиламин, ди-2-пиридилкетон, 4-t-бутилпиридин, 2-хлорпиридин, 2,4,6-коллидин, 4-диметиламинопиридин, 2-этилпиридин, 2-фторпиридин, 2-(2-гидроксиэтил)пиридин, 3-гидроксипиридин, 2,3-лутидин, 2,4-лутидин, 2,6-лутидин, 3,5-лутидин, 2-метоксипиридин, никотинамид, никотиновая кислота, 2-фенилпиридин, 3-фенилпиридин, 4-фенилпиридин, 2-пиколин, 3-пиколин, 4-пиколин, 2-тиофенкарбоновая кислота, 3-тиофенкарбоновая кислота, 4-метилпиразол, 3-метилпиразол, 1-фенилпиразол, пиразол, 1-(3-аминопропил)имидазол, 2,2'-бис(4,5-диметилимидазол), 4,5-дицианоимидазол, 1,2-диметилимидазол, 2-этилимидазол, гистамин, этиловый эфир гистидина, имидазол, N-метилимидазол, 2-метилимидазод, 4-метилимидазол, N-фенилимидазол, 2-ацетилтиофен, 3-бромтиофен, 2,5-диметилтиофен, 2-метилтиофен, 3-метилтиофен, тиофен, 3-тиофенуксусная кислота, хинолин, 2-аминобензимидазол,
2-тиофенметанол, 2-аминотиазол, 3-амино-5,6-диметил-1,2,4-триазин, 2-амино-1,3,4-тиадиазол, 2,4,5-триметилоксазол, триметилпиразин, бензимидазол, бензотиазол, бензотриазол, изохинолин, 1,10-фенантролин, 2-аминоимидазол, аминопиразин, 2-аминопиримидин, 2-амино-4,6-диметилпиримидин, 2,6-диаминопиридин, L-гистидин, DL-гистидин, пиразин, тетраметилпиразин, триметилпиразин.
Системы лиганд/окислитель
Выщелачивающие системы изобретения - это системы, в основном, известные в данной области, которые эффективны в растворении золота, использующие систему лиганд/окислитель, и, в частности, включающие цианид ион и воздух или растворенный кислород; хлорид ион с гипохлоритом натрия (может применяться стабилизатор, такой как сульфаминовая кислота); бромид ион с бромом, в присутствии стабилизатора, такого как сульфаминовая кислота; йодид и йод; тиоцианат и ионы трехвалентного железа; тиомочевина и ионы трехвалентного железа; тиосульфат анион и ионом меди в качестве катализатора в присутствии аммиака и воздуха или растворенного кислорода; малононитрил и воздух или растворенный кислород и цианид, хлорид, бромид, йодид, тиоцианат, тиосульфат, молононитрил или тиомочевина и золотой электрод с потенциалом, соответствующим каждому из этих ионов. Каждый из активаторов, перечисленных выше, может не подходить всем выщелачивающим растворам из-за побочных реакций, pH или плохого связывания с поверхностью золота при условиях реакции в определенной системе.
Выбор концентрации лиганда, концентрации окислителя, концентрации активатора и pH зависит от системы, которая будет использована для экстракции. Соответствующие комбинации экстрагирующий агент-активатор могут быть проверены электрохимически, как описано далее.
Цианид с воздухом или растворенным кислородом является преимущественной выщелачивающей системой, наиболее широко применяемой для извлечения золота (например, добыча золота и извлечение золота в гальванике). E.B.Saubestre in "Modern Electroplating", E.A. Lowenheim, Ed., John Wiley and Sons, Inc., New York, 1953, p. 748-770. Такие системы обычно работают при щелочных значениях pH из-за образования HCN, что снижает pH ниже 10 (pKa HCN 9,1). Выбор концентрации цианида и активатора зависит от конкретного применения, При измерении скорости растворения золота в виде золотого порошка, фольги, брусков или дисков воздухом лучшие результаты дают низкие концентрации цианида (2-10 мМ цианида). Однако электрохимические исследования показывают, что активация растворения золота может наблюдаться в широком интервале концентраций цианида. При применение в золотодобывающей отрасли выбор концентрации цианида зависит от многих факторов. Предпочтительна низкая концентрация активаторов (1-10 ppm) при стандартных концентрациях цианида. Для активаторов подходят щелочные значения pH, обычные для реакций цианирования. В некоторых случаях, цианирование проводят при более низких pH (<9). Активатор при этих условиях необходимо выбирать так чтобы гетероатом в гетероциклическом кольце не протонировался. Для цианидных систем подходит широкий круг активаторов.
Предпочтительными соединениями являются имидазол, N-метилимидазол, 1,2-диметилимидазол, пиридин, альфа-, бета-, гамма-пиколин, 2-, 3-, 4-аминопиридин, 4-диметиламинопиридин, тиофен, 3-тиофенкарбоновая кислота, 3-тиофенуксусная кислота, пиразин, 2,4,6-триметилтриазин, тиазол, L-гистидин, 2-аминопиримидин, никотинамид, 2-амино-4,6-диметилпиримидин. Наиболее предпочтительны имидазол, N-метилимидазол, L-гистидин и 2-аминопиримидин.
Система хлорид-гипохлорит может применяться как альтернатива цианиду. Смотри например, J.B. Hiske and V.P. Atluri, Mineral Processing and Extracive Metallurgy Review, 4.95-134(1998) и патент США 5.169.503, включенные здесь в виде ссылок. Эта система обычно работает при более чем 3% NaCl и pH 5-8. Применение активаторов делает возможным работу системы при менее коррозионно-агрессивных условиях с меньшей концентрацией хлорида. Предпочтительная хлоридная выщелачивающая система с активаторами состоит из 2-5% NaCl (или другого источника хлорида), 0,1% гипохлорита натрия с pH 8-8,5. В обоих случаях требуется стабилизатор гипохлорита. Стабилизаторами являются соединения, у которых хлор по-прежнему активен, но находится в более стабильной форме. Стабилизатор должен быть выбран такой, чтобы он не участвовал в реакции растворения золота. Подходящим стабилизатором для выщелачивающего раствора хлорид натрия - гипохлорит натрия является сульфаминовая кислота. В этом случае сульфаминовая кислота взаимодействует с гипохлорит анионом с образованием N-хлоросульфаминовых кислот, у которых хлор по-прежнему активен. Смотри, например, "Kirk-Othmer Encyclopedia of Chemical Technology", v. 21, John Wiley and Sons, New York, 1983, p.949-956.
Активатор должен выбираться таким образом, чтобы гетероатом гетероциклического ароматического соединения был доступен для образования координационной связи с поверхностью золота и не происходило взаимодействия с другими компонентами выщелачивающего раствора. Предпочтительными активаторами являются пиридин, альфа-, бета-, гамма-пиколин, ди-2-пиридилкетон, 2,2-дипиридил, 3,5-лутидин, 2,6-лутидин, 2,3-лутидин и N-метилимидазол.
Система бромид-бром может использоваться как альтернатива цианиду. Смотри, например, J.B.Hiskey and V.P. Atluri, Mineral Processing and Extractive Metallurgy Review, 4,95-134 (1988); J.Marsden and I.House,"The Chemistry of Gold Extraction", Ellis Horwood, New York, 1992, pp.304-305; и A. Dadger, Journal of Minerals, Metals and Materials Society, 41, 37-41(1989), которые включены в виде ссылок. Аргументы для выбора активатора такие же, что и для системы хлорид - гипохлорит. Предпочтительная система с бромидом, содержащая активатор, состоит из 1% NaBr (или другого источника бромид-иона), 0,3% брома в присутствии сульфаминовой кислоты, pH 9,0. Предпочтительными активаторами являются пиридин, альфа-, бета-, гамма-пиколин, ди-2-пиридилкетон, 2,2'-дипиридил, 3.5-лутидин, 2,6-лутидин, 2,3-лутидин, 2,3-лутидин и N-метилимидазол.
Система тиосульфат-медь-аммиак-воздух или растворенный кислород может применяться как альтернатива цианиду. Смотри, например, J.B. Hiskey and V.P. Atluri, Mineral Processing and Extractive Metallurgy Review, 4,95-134(1988); J. Marsden and I.House, "The Chemistry of Gold Extraction", Ellis Horwood, New York, 1992, pp. 303-304; C.Changlin, H.Jiexue and G.Qian, "Leaching Gold by Low Concentration Nhisulfate Solution", Randol Gold Forum, Vancoucer' 92, March 25027, 1992, pp. 293-298, J.Tao, C.Jin and X.Shi in "Hydrometallurgy", J. B. Hiske and G.W.Warren, Eds., Society for Mining, Metallurgy and Exploration, Jnc. , Littleton, CO, 1993, pp. 119-126; и M.J. Nicol, C.A. Fleming and R.L. Paul in "The Extractive Metallurgy of Gold in South Africa", Volume 2, G.G. Stanley, Ed., South African Institution of Mining Metallurgy, Johannesburg, 1987, 831-905, которые включены здесь в виде ссылок. В тиосульфатной системе может использоваться следующий диапазон концентраций реагентов: тиосульфат-ион - 0,1 - 0,25 М; ион меди (II) - 0,01-0,15 М; ион аммония (в виде тиосульфата, гидроксида и сульфата) - 0,5 - 4,8 М. Предпочтительными условиями являются 0,1 М тиосульфат натрия, 0,01 М сульфат меди и 0,5 М гидроксид аммония. Предпочтительными активаторами являются пиридин, альфа-, бета-, гамма-пиколин, ди-2-пиридилкетон, 2,2'-дипиридил, 3,5-лутидин, 2,6-лутидин, 2,3-лутидин, имидазол, N-метилимидазол, тиофен, 3-тиофенкарбоновая кислота, 3-тиофенуксусная кислота, пиразин, 2,4,6-триметилтриазин и тиазол.
Другие выщелачиватели могут использоваться аналогично, то есть, к системе при обычных условиях, применяемых в данной выщелачивающей системе, добавляется соответствующий активатор. Систему йодид-йод применяют в качестве выщелачивания золота. Для использования подходит широкий диапазон концентраций в широком интервале pH. Однако приемлемую скорость растворения золота дает 0,03 М йодид натрия в присутствии 0,005 М йода при pH 5. (P.H.Qiand, J. B. Hiske "Hydrometallurgy", 27, 47-66 (1991) и F.W. Devries and J.B.Hiskey, "Environmental Impact of Lixiviants: An Overview That Includes Noncyanide Chemistry", Randol Gold Forum, Vancouver'92, March 25-27, 1992, p.89-92). Псевдогалогенид тиоцианат также используют в качестве выщелачивателя золота. J. Marsden and I.House, "The Chemistry of Gold Extraction", Ellis Horwood, New York, 1992, p.303-304; и O.Barbosa and A.J.Monhemius in "Precious Metals'89", M. C. Jha and S.D.Hill, Eds., The Minerals, Metals amd Materials Society, p. 307-339 (1988)). Реакционная среда с этим лигандом обычно содержит 10-15 г/л тиоцианата натрия и 1-10 г/л иона трехвалентного железа в качестве окислителя в интервале pH 2-3. Малононитрил - другой псевдогалогенид, который используется в качестве выщелачивателя золота в присутствии воздуха или кислорода. (H.J.Heinen, J.A.Eisele and B.J.Scheiner, "Malononitrile Extraction of Gold From Ores", Bureau of Mines Report of Investigation, 7464, 1970 и
K. R.Sandgren and J.E. Murphy in "Hydrometallurgy", J.B. Hiskey and G.W. Warren, Eds., Society For Mining, Metallurgy and Exploration, Inc., Littleton, CO, 1993, p. 301-310). В реакции с этим лигандом обычно используют 0,01-1,0% малононитрил в широком интервале pH (7,5-12). Тиомочевина - еще одно соединение, которое применяется как выщелачиватель золота с ионами трехвалентного железа или пероксидом водорода в качестве окислителя (J. Marsden and I.House,"The Chemistry of Gold Extraction", Ellis Horwood, New York, 1992, p.299-302; M.J.Nicol, C.A.Fleming and R.L. Paul in "The Extractive Metallurgy of Gold in South Africa", V. 2, G.G.Stanley, Ed., South African Institution of Mining Metallurgy, Johannesburg, 1987, p.845-846; J.B.Hiskey and V. P.Atluri. Mineral Processing and Extractive Metallurgy Review, 4,95-134 (1988). В реакции с этим лигандом используется обычно тиомочевина (1-5 г/л) и ион трехвалентного железа (0,5-5 г/л) при pH 1-3.
Ароматические гетероциклические соединения изобретения и реагенты, используемые в описанных выщелачивающих системах лиганд/окислитель, хорошо известны в этой области и продаются. Изобретение проиллюстрировано следующими неограничивающими его примерами.
Пример 2. Активация растворения золота в растворе хлорид натрия - гипохлорит при pH 8,5
В этом примере добавление соединений активаторов позволяет использовать гипохлорит в качестве окислителя в условиях, при которых в других случаях растворение золота незначительно или совсем отсутствует. Реакции проводили в буферном растворе pH 8,5, приготовленном следующим образом. Борат натрия (0,955 г) и сульфаминовую кислоту (0,05 г) смешивали с приблизительно 40 мл воды HPLC чистоты (чистой для жидкостной хроматографии высокого разрешения). Смесь перемешивали до полного растворения. Добавляли хлорид натрия (1,25 г). pH раствора доводили до 8,5 1н HCl. Стандартизованный гипохлорид натрия добавляли до 0,1% по весу раствора и pH снова доводили до 8,5. Затем раствор переносили в 50 мл мерную колбу. К раствору добавляли активатор. Доводили объем раствора водой HPLC чистоты. Аликвоту 2 мл отбирали в момент времени 0. Оставшийся раствор переливали в сосуд с предварительно измеренным кусочком золотой фольги (1 см x 5 см x 0,1 мм) и периодически отбирали аликвоты для анализа содержания золота.
Образцы анализировали, превращая растворенный комплекс золота в [AuBr4] -, экстрагируя бромид в хлороформ с оксидом триоктилфосфина и измеряя поглощение этого раствора для определения концентрации золота (F.F.Beamish ahd J. C. Van Loon, "Recent Advances in the Analytical Chemistry Of The Noble Metals", Pergamon Press, New York, 1972, p.322-323 и W.N.Nolbrook and E. Rein, Analytical Chemistry, 36, 2451-2453 (1964). Скорости растворения золота рассчитывали, стоя график количества растворенного золота (микрограмм золота на кв. см. фольги) относительно времени в часах. Количество часов фиксировалось в точке, где концентрация золота достигала максимума. Ниже в табл. 1 перечислены используемые активаторы и полученные результаты:
Показано, что при этом высоком значении pH гипохлорит натрия сам по себе является очень слабым окислителем для того, чтобы вызывать какое-либо значительное растворение золота. Однако в присутствии активатора этот слабый окислитель становится очень эффективным.
На фиг. 1 представлены графически типичные измерения концентрации растворенного золота в зависимости от времени для нескольких реакций.
Пример 2. Активация растворения золота в растворе бромид натрия-бром пиридином
В этом примере активатор катализирует растворение золота в растворе, содержащем бромид натрия и окислитель, полученный путем добавления брома к основному раствору; при этом образуется гипобромид (R.C.Troy and D.W. Margerum, Inorganic Chemistry, 30, 3538-3543 (1991). Бромид натрия (1,00 г), борат натрия (1,910 г) и сульфаминовую кислоту (0,10 г) смешивали с 90 мл воды HPLC чистоты. pH раствора доводили NaOH до 9,0. Смесь перемешивали во льду 0,25 ч. Добавляли 100 мкл брома. Смесь перемешивали при температуре льда 0,5 ч и затем согревали до комнатной температуры. pH раствора доводили NaOH до 9,0, раствор переносили в 100 мл мерную колбу и доводили до полного объема. Затем раствор делили на 2 части: 50 мл перемешивали с образцом золотой фольги тех же размеров, что и в примере 1, другие 50 мл смешивали со 100 мкл пиридина и перемешивали с другим образцом золотой фольги.
Через определенные промежутки времени отбирали аликвоты и анализировали их, как в примере 1. Результаты представлены графически на фиг. 2. Образец с пиридином ясно показывает более высокую скорость растворения золота, чем образец без пиридина.
Пример 3. Активация растворения золота в растворе цианида натрия азотсодержащим гетероциклом
В этом примере добавление активатора позволяет увеличить скорости растворения золота в системе цианид натрия - воздух. Реакцию проводили в растворе NaCN при pH 10,5, приготовленном следующим образом. NaCN (0,033 г) добавляли к 100 мл воды и 10 мл 0,10 М калий-фосфатного буфера при pH 11. Окончательное значение pH раствора доводили до 10,5, добавляя K2HPO4. Концентрацию цианида определяли с тем, чтобы она составила 5,98 мМ, титрованием нитратом серебра. Образец золота (площадь 0,495 кв. см) получали вакуумным осаждением слоя золота 2000 А на пластиковую подложку. Раствор цианида натрия (2,50 мл) добавляли к образцу золота, и UV контроль устанавливали на 0 прибора против исходного раствора. Раствор перемешивали при 25oC и измеряли поглощение (при 240 нм) образовавшегося [AU (CN2]- каждые 5 с в течение 200 с. Константу скорости нулевого порядка получали, проводя лучшую прямую через полученные точки. Через 200 с добавляли 20 мкл 0,013 М раствора N-метилимидазола, предварительно приготовленного добавлением 0,10 7 г N-метилимидазола к 100 мл воды. За образованием [Au (CH)2]- наблюдали еще 400 с и константу скорости нулевого порядка определяли как описано ранее. Относительную скорость растворения золота в присутствии активатора получали делением константы скорости нулевого порядка с активатором на константу скорости без активатора. Результаты, включающие повторное испытание, представлены в табл. 2.
Пример 4. Активация растворения золота в растворе цианида натрия серосодержащим гетероциклом
В этом примере добавление активатора делает возможным повышение скорости растворения золота в растворе цианида. Реакции проводили в забуференных растворах NaCN при pH 10,5 приготовленных следующим образом. NaCN (0,027 г) добавляли к 100 мл воды и 10,0 мл 0,10 М фосфатного буфера при pH 11. pH раствора доводили до 10,5, добавляя K2HPO4. Концентрацию цианида определяли (она должна составлять 4,74 мМ) титрованием нитрата серебра. Образец золота (площадь поверхности 0,495 кв.см.) готовили как в примере 3. Раствор цианида натрия (2,00 мл) добавляли к образцу золота и проводили UV контроль этого раствора. Раствор перемешивали и держали при 25oC в течение реакции растворения. Поглощение образцов при 240 нм, связанное с образованием [Au(CN)2]- в процессе реакции, измеряли каждые 5 с в течение 100 с и получали константу скорости нулевого порядка, проводя лучшую прямую линию через полученные точки. 9,67 мМ раствор 3-тиофенкарбоновой кислоты готовили, добавляя 0,031 г к 25 мл раствора, содержащего 60 ч. (по объему) воды и 40 ч. метанола. Затем к образцу золота в забуференном растворе цианида, как описано выше, добавили 64 мкл раствора 3-тиокарбоновой кислоты. За образованием [Au(CN)2]- следили еще 100 с и определяли константу скорости нулевого порядка как описано ранее. Относительную скорость растворения золота в присутствии активатора получали делением константы скорости нулевого порядка в присутствии активатора на константу скорости без активатора. Результаты, включающие повторные испытания, представлены в табл. 3.
Пример 5. Активация растворения золота в растворе тиосульфата натрия пиридином.
В этом примере добавление активатора катализирует растворение золотой фольги в щелочном растворе тиосульфата с ионом меди, добавленным как катализатор окисления. Раствор тиосульфата готовили, растворяя тиосульфат натрия (1,242 г Na2S2O3 • 5 H2O) и сульфат меди (0,079 г) в примерно 40 мл воды HPLC чистоты. Затем добавляли гидроксид аммония (5 мл концентрированного NH4OH). Объем раствора доводили в мерной колбе до 50 мл, получая 0,1 М тиосульфат натрия, 0,01 М сульфат меди и 0,5 М гидроксид аммония. В момент времени 0 определяли концентрацию золота, отбирая 0,5 мл раствора, добавляя 1,0 мл царской водки в 10 мл мерной колбе и доводя объем до метки. Концентрацию золота определяли атомно-адсорбционной спектроскопией в графитовой печи. Оставшийся раствор переносили в сосуд с завинчивающейся крышкой. Добавляли кусочек золотой фольги (1 см x 5 см x 0,1 мм), сосуд закрывали. Аликвоты (0,5 мл) отбирали каждые 15 мин для анализа золота как описано выше. На фиг. 3 показана концентрация золота в этом исследовании. Описанную выше процедуру повторяли в присутствии активатора пиридина. После переноса раствора аммиачная медь-тиосульфат в сосуд с завинчивающейся крышкой добавляли 1 мкл пиридина, а затем кусочек фольги. Анализ концентрации золота проводили как описано выше. Сравнение двух временных кривых на фиг. 3 показывает, что в примере с пиридином скорость растворения намного выше, чем без активатора.
Пример 6. Активация растворения золота из окисленной золотой руды в растворе цианида натрия с азотсодержащим гетероциклом.
Этот опыт проводили с золотой рудой, которую раздробили и измельчили до такого состояния, что 80% проходило через сито 200 mesh. Руду смешивали с водой до образования взвеси 40-50% концентрации твердых частиц. Добавляли цианид натрия до получения раствора конечной концентрации 0,4 г NaCN/литр. Концентрацию золота определяли атомно-адсорбционной спектроскопией. На фиг. 4 показаны временные кривые перемешиваемых с рудой выщелачивающего раствора, описанного выше, и описанного выше раствора с 5 мг/л добавленного N-метилимидазола. На фиг. 4 видно, что N-метилимидазол катализирует растворение золота в растворах цианида. Катализируемая реакция достигает максимума эффективности выщелачивания золота значительно быстрее, чем некатализируемая реакция.
Пример 7. Влияние азотсодержащих активаторов на золотые электроды в присутствии различных лигандов.
В этом примере демонстрируется влияние активаторов пиридина и N-метилимидазола на циклическую вольтамограмму золотого электрода в растворе лиганда. Все потенциалы даны относительно электрода сравнения серебро-хлорид серебра. Лиганды - хлорид, бромид, йодид, тиоцианат, тиосульфат и малононитрил. Золотые электроды для каждого раствора лиганда готовили гальваническим нанесением слоя золота на стекловидный углеродный электрод из раствора хлорида золота в воде HPCL чистоты, вначале проводя окисление электрода при 1,00 В до силы тока 0,01 мА или менее и затем наносили золото из неперемешиваемого раствора [Au Cl4]- в атмосфере азота при 0,00 И 5-10 мин. Условия получения вольтамограммы показаны ниже в табл. 4. Если специально не указано, то электролитом во всех случаях служит 0,05 М KF. Циклическую вольтамограмму вначале записывали для каждого лиганда с растворе без активатора. Затем добавляли активатор до желаемой концентрации и записывали циклическую вольтамограмму в том же интервале потенциалов.
Наблюдали два типа ответа, каждый соответствует активации реакции растворения золота. С галогенидами и псевдогалогенидами (хлорид, бромид, йодид, тиоцианат, малононитрил и цианид) новая волна окисления (анодный пик) появляется при более низком потенциале. В некоторых случаях, таких как цианат, новая волна перекрывается с волной растворения в растворе лиганда без активатора.
С тиосульфат-анионом новая волна не наблюдалась, более того, при добавлении активатора (пиридина) к раствору электролита наблюдалось значительное увеличение тока при окислительном потенциале Au(0)/Au(1). Этот пример определенно показывал, что пиридин катализирует растворение золота в растворе тиосульфата.
В заключение, двумя ответами, показанными в этой таблице, являются появление новых волн с более низким потенциалом, катодным относительно пары Au(0)/Au(1), в растворе лиганда и/или значительное увеличение тока при этом потенциале. Тип ответа зависит от типа лиганда, используемого в исследовании. Каждый из ответов указывает на увеличение скорости растворения золота и, следовательно, на активацию выщелачивающей системы.
Пример 8. Влияние гетероциклических ароматических соединений на золотые электроды в растворе цианида
В этом примере изучали влияние различных гетероциклических ароматических соединений на циклическую вольтаметрию золотого электрода в растворе 0,1 M KCN/0,1 M KOH. Золотым электродом служил продаваемый электрод, который перед использованием шлифовали 6 мк алмазной пастой, промывали деионизованной водой и ацетоном, вымачивали в 30% пероксиде водорода и промывали деионизованной водой. Перед помещением электрода в раствор KCN этот раствор тщательно деаэрировали азотом. Циклические вольтамограммы получали на вольтамографе BAS CV27 (Bioanalytical Systems, Inc., 2701 Kent Avenue, West Lafayette, IN 47906), используя электрод из платиновой проволоки и Ag/AgCl электрод сравнения. Золотой электрод испытывали, подавая напряжение (-800 мВ относительно Ag/AgCl электрода) в течение 2 мин, перемешивая раствор магнитной мешалкой. Затем получали вольтамограмму для неперемешиваемого раствора защищенного азотом. Испытание электрода повторяли. В этот момент добавляли ароматическое гетероциклическое соединение. Раствор перемешивали обычно 2 мин. без наложения напряжения, для более слабых активаторов требовался более длительный период инкубации. Затем записывали циклическую вольтамограмму раствора.
В табл. 5 представлены волны KCN/KOH растворов с различными органическими соединениями. Для активаторов характерна волна в участке от -180 до -350 мВ (пик 2), который отсутствует в KCN/KOH растворе без активатора. В некоторых случаях дополнительная волна наблюдается при более низких потенциалах (са. -600 мВ). Неактивированные KCN/KOH растворы показывают волну в участке + 200 мВ.
Пример 9. Влияние серосодержащего гетероциклического активатора на золотой электрод в растворе тиомочевины.
В этом примере показывается влияние активатора 3-тиофенкарбоновой кислоты на циклическую вольтамограмму золотого электрода в кислом растворе тиомочевины. Использовали электрохимическое оборудование, описанное в примере 8. Для приготовления растворов и мытья химической посуды и электродов использовали воды из Barnstead Nanopure System (Barnstead Thermolyne Corporation, 2555 Kerper Boulevard, Dubuque, IA 52001, USA). В качестве рабочего электрода использовали золотой вольтамометрический электрод, серебряный электрод и электрод из платиновой проволоки. Их использовали в качестве электродов сравнения и счетного электрода; все указанные потенциалы даны относительно серебряного электрода. Все электроды получали от (Bioanalytical Systems, Inc., 2701 Kent Avenue, West Lafayette, IN 47907, USA).
Раствор 0,10 М сульфата натрия готовили, растворяя 0,710 г безводного сульфата натрия в примерно 40 мл воды в химическом стакане на 50 мл. pH раствора доводили концентрированной серной кислотой до 2,5. Раствор переносили в мерную колбу на 50 мл и доводили объем до метки. Этот раствор использовали как поддерживающий электролит при получении циклической вольтамограммы. Циклическую вольтамограмму получали в интервале потенциала от +0,400В до - 0,400 В; скорость развертки в этом примере составляла 50 мВ/с. Первоначальный потенциал составлял - 0,20 В; наложенный потенциал развертывали в направлении анода до 0,40 В; в этой точке развертку поворачивали в обратном направлении до -0,400 В. Никаких волн не наблюдалось.
К 10 мл поддерживающего раствора электролита в электрохимической ячейке добавляли 0,076 г тиомочевины до получения 0,10 М раствора. Циклическую вольтамограмму получали в описанном выше интервале. Окислительную волну наблюдали примерно при +0,335 В; при обратном направлении развертки волну восстановления наблюдали при 0,00 В. Эти волны соответствуют окислению золота с образованием комплекса золото-тиомочевина и восстановлению комплекса золото-тиомочевина с образованием металлического золота соответственно.
0,2 М раствор 3-тиофенкарбоновой кислоты готовили, растворяя 0,380 г в 25 мл абсолютного этанола.
К раствору тиомочевины в электрохимической ячейке добавляли 2 мкл описанного выше раствора 3-тиофенкарбоновой кислоты в этаноле. Раствор перемешивали примерно 30 мин. Циклическую вольтамограмму получали как описано выше. Ток, как для волны окисления, так и для волны восстановления, возрастал, указывая на усиленное растворение золота и восстановление комплекса золото-тиомочевина соответственно. Дополнительные аликвоты раствора 3-тиофенкарбоновой кислоты в этаноле добавляли до получения общего объема добавок 4, 6 и 8 млк; концентрации раствора, таким образом, находились в интервале 0,04 - 0,16 мМ. После каждого добавления раствор перемешивали 15-30 мин. Циклическую вольтамограмму затем получали в указанном выше интервале потенциала. Ток волн окисления и восстановления возрастал с увеличением концентрации активатора с 0,04 до 0,16 мМ, указывая на усиление растворения золота в растворе активатора.
Пример 10. Сравнительные примеры неактивных азот- и серосодержащих гетероциклических ароматических соединений
В этом примере показаны некоторые азот- и серосодержащие гетероциклические ароматические соединения, которые не активируют реакции растворения золота при применении описанных выше методов. В табл. 6 перечислены неактивные соединения, а также методы, использованные для проверки активности, и полученные результаты. Циклическую вольтаметрию примера 7 использовали для демонстрации появления новой окислительной волны, катодически смещенной от волны, наблюдаемой в растворе одного лиганда. В качестве лиганда использовали KCl(все растворы готовили как описано выше). Никакой новой волны не наблюдали, что указывало на неактивность соединения. В примере 8 использовали раствор 0,1 М KCN/0,1 M KOH для демонстрации активации растворения золота в растворе цианида. Активные соединения дают новую волну (Пик 2), катодически смещенную от пика, наблюдаемого в растворе лиганда. Отсутствие новой волны показывает на отсутствие активации реакции растворения золота.



Способ может быть использован в процессах требующих растворения металлического золота, в особенности при гидрометаллургическом извлечении золота из руды. Процесс растворения металлического золота осуществляется в выщелачивающей системе, содержащей лиганд и окислитель, где растворимость золота повышается за счет добавления ароматических соединений, содержащих в кольце серу или азот. Выщелачивание золота осуществляется при использовании менее коррозионно-агрессивных растворов без значительных потерь в скорости растворения металла. 19 з.п.ф-лы, 6 табл, 4 ил.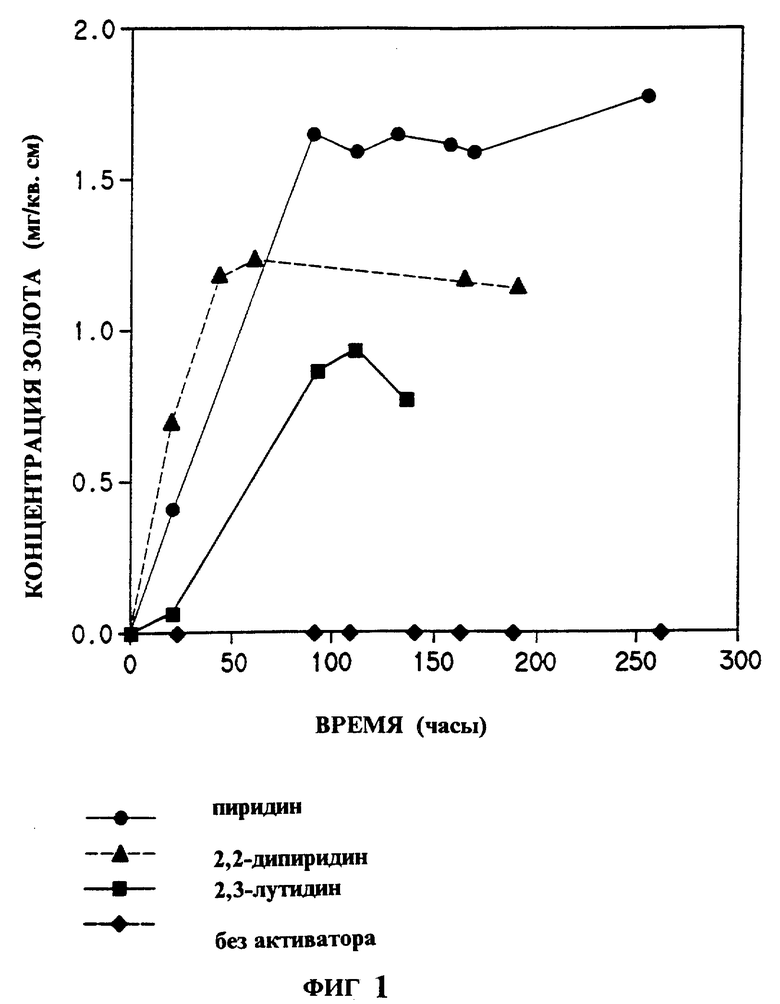
Приоритет по пунктам:
21.10.93 по пп.1 - 6, 8 - 19;
28.07.94 по пп.7 и 20.
| US, 5169503, C 25 C 1/00, 1992 | |||
| US, 4654145, B 01 D 11/04, 1987 | |||
| EP, 0358 004, C 22 B 11/08, 1990. |
Авторы
Даты
1998-07-10—Публикация
1994-10-06—Подача