Изобретение относится к области медицины и предназначено для лечения тяжелых состояний у человека, вызванных инфекцией.
Сепсис является наиболее общей причиной смерти после сердечно-сосудистых заболеваний и занимает 13-е место среди прочих причин смерти. Уровень смертности от септического шока превышает 40% и не проявляет тенденции к снижению на протяжении последних трех десятилетий. В последнее десятилетие риск развития сепсиса существенно возрос у иммунокомпрометированных, хронически- и(или) тяжелобольных и у пожилых людей, особенно среди госпитализированных пациентов.
Обычно сепсисом принято называть неспецифическое заболевание нециклического типа, характеризующееся нарушениями реактивности организма на фоне постоянного или периодического поступления в кровь микробов или их токсинов из очага инфекции.
Согласно новейшим международным соглашениям, термином "сепсис" обозначают синдром системного воспалительного процесса, причиной которого является инфекция. Критерием синдрома системного воспалительного процесса является наличие у больного более одного из следующих условий:
повышенная или пониженная температура тела: выше 38 или ниже 36oC;
повышенная частота сердечных сокращений (тахикардия): свыше 90 уд/мин;
учащенное дыхание (тахипноэ): свыше 20 дыханий в мин;
измененная лейкоцитарная формула: более 12000 или менее 4000 лейкоцитов в 1 мм3 или свыше 10% незрелых форм нейтрофилов (с перетяжками).
Термином "тяжелый сепсис" обозначается сепсис, ассоциированный с органной дисфункцией, гипоперфузией или гипотензией.
Для клинической картины заболевания характерны гектическая лихорадка, потеря веса вплоть до развития кахексии, выраженная анемия, приводящая к характерной бледности кожных покровов, и интоксикация, проявляющаяся в той или иной степени энцефалопатии. В поздних стадиях сепсиса наблюдаются снижение уровня систолического артериального давления и коматозное состояние.
Сепсис возникает обычно у пациента, заранее имеющего предрасположенность к такому заболеванию, которая обуславливается либо особенностями организма, например медленным срабатыванием иммунной системы, либо особенностью заболевания, перенесенного пациентом, например гриппа, ослабившего иммунную систему.
Когда человек подвергается инфицированию, развивается ответ на эту инфекцию, который иммунная система должна локализовать. У пациента с предрасположенностью к сепсису такой локализации не происходит, и развивается системный ответ организма, который переходит в неадекватный (разбалансированный) ответ, приводящий к депрессии иммунной системы и сепсису.
Для лечения сепсиса применяются антибиотики, средства, улучшающие микроциркуляцию, инфузионная терапия, а также симптоматическая терапия (для улучшения функционирования сердечно- сосудистой, нервной и других систем организма).
Действие антибиотиков направлено на уничтожение микроорганизмов в ране и в кровотоке, а улучшающие микроциркуляцию средства обеспечивают усиление кровотока в пораженных органах, с тем чтобы повысить доставку антибиотиков и компонентов плазмы, обезвреживающих токсины. Симптоматическая терапия направлена на улучшение функций жизненно важных органов, а инфузионная терапия - на промывание организма с целью разбавления и удаления токсинов.
Для лечения сепсиса применялись и иммунопрепараты, такие как иммуностимуляторы, например Т-активин, леакадин, тимолин и тимоген. Такие препараты предназначены для активации фагоцитарного звена иммунной системы (лейкоцитов, макрофагов, лимфоцитов); однако желаемая стимуляция при этом не достигается, так как эти препараты не достаточно сильны. Иммунная система при сепсисе нарушена настолько сильно, что такие иммуностимуляторы практически на нее не действуют. Их способность стимулировать иммунную систему в условиях септической иммуносупрессии практически не проявляется.
При иммунологических исследованиях септических больных обнаруживается сильное угнетение иммунной системы. В иммунограмме выявляются отчетливые признаки дисбаланса реакций иммунитета, снижение показателей фагоцитоза (замедление спонтанной миграции лейкоцитов) и количества Т-лимфоцитов почти в 2 раза по сравнению с нормой. Известно использование ч-ИЛ-2 при сепсисе (см. М. В. Гринев - в кн.: Актуальные проблемы и перспективы развития современной реаниматологии. Материалы Международного симпозиума, посвященного 85-летию акад. Росс. АМН В.А.Неговского, 16-18 марта 1994 года, стр.103-104).
Задачей данного изобретения является создание средства и способа воздействия на компоненты иммунной системы, которая находится в состоянии практически полного угнетения, вызванного синдромом системной воспалительной реакции, с тем чтобы восстановить активность и количество лейкоцитов, а также остальных компонентов иммунной системы, на которые воздействуют активные лимфоциты, и тем самым осуществить лечение иммуносупрессии при сепсисе.
Эта задача решается тем, что в качестве средства для лечения иммуносупрессии при сепсисе предложен человеческий интерлейкин-2 (ч-ИЛ-2), а также тем, что предложен способ ее лечения путем парентерального введения пациенту ч-ИЛ-2.
Из опытов in vitro известно, что ч-ИЛ-2 является лимфокином, который в основном продуцируется Т-лимфоцитами; его считают веществом, которое играет центральную регуляторную роль в иммунном ответе. В опытах in vitro установлены некоторые его свойства, которые приводят, например, к тому, что ч-ИЛ-2 стимулирует пролиферацию Т-клеток, обуславливает их цитотоксичность, усиливает продукцию фактора роста В-клеток, усиливает индукцию рецепторов ч-ИЛ-2 и продукцию гамма-интерферона.
Известно применение ч-ИЛ-2 для усиления антиинфекционной компетентности хозяина. В этом случае ч-ИЛ-2 вводится пациенту, иммунная система которого в основном функционирует нормально, для усиления работы этой системы в процессе борьбы с инфекцией. Все компоненты такой иммунной системы, на которые воздействует при этом ч-ИЛ-2 (в частности лимфоциты), находятся в большом количестве, характерном для здоровой иммунной системы, и активность их не угнетена. В этом случае ч-ИЛ-2 воздействует непосредственно на рецепторы активных лимфоцитов, что ведет к усилению их активности и пролиферации, а терапевтический эффект достигается тем, что активность иммунной системы еще больше стимулируется.
Известно также применение ч-ИЛ-2 для воздействия на иммунную систему через конкурентное подавление выработки фактора некроза опухолей (ФНО), обнаруживаемого у пациентов, страдающих кахексией, ассоциированной с раком, инфекционными болезнями и другими катаболическими нарушениями. При этом у таких пациентов отмечено значительное повышение уровня ФНО, ведущее к истощению организма, а уровень продукции ИЛ-2 недостаточен для того, чтобы конкурентно подавить выработку этого фактора. Терапевтический эффект здесь обусловлен, в основном, снижением в результате введения ч-ИЛ-2 концентрации в крови ФНО, ответственного за механизм поддержания интоксикации, сопровождающей, в частности, инфекции.
Известно также применение ч-ИЛ-2 для восполнения его природного недостатка в организме при врожденном или приобретенном иммунодефиците у детей, при котором дефектны пре- или интратимические клетки (такой иммунодефицит относят к разряду "первичного иммунодефицита"). При таком иммунодефиците организм ребенка, подвергшегося инфекции, не способен против нее бороться, так как по какой-то причине отсутствует один из главных компонентов регуляции иммунной системы - ч-ИЛ-2. Введение экзогенного ч-ИЛ-2 восполняет его недостаток в организме, позволяя осуществлять стимуляцию здоровых лимфоцитов и другие функции, присущие ч-ИЛ-2 при работе нормальной иммунной системы. Однако при прекращении введения экзогенного ч-ИЛ-2 содержание ч-ИЛ-2 в организме возвращается на начальный патологически низкий уровень.
Были проведены различные эксперименты на животных (мышах и крысах), у которых был либо искусственно вызван сепсис, либо они были искусственно подвергнуты травмам, после которых высока вероятность возникновения сепсиса.
Изучены обожженные мыши, у которых высока восприимчивость к бактериальному сепсису. У таких животных ухудшена способность митогенстимулированной продукции ИЛ-2 клетками селезенки. Добавление in vitro экзогенного рекомбинантного ч-ИЛ-2 (100 ед/мл) восстанавливает митогенный ответ Т-клеток селезенки. Было изучено действие рекомбинантного ч-ИЛ-2, введенного in vivo в разных дозах (от 16 000 ед/день до 256 000 ед/день). Низкие дозы приводили к улучшению ответа in vitro селезеночных Т-клеток, доза в 60 000 ед/день сама оказалась иммуносупрессивной.
Известны результаты опытов, проводимых на мышах, которым вводили летальную дозу клеток бактерии Esherichia coli. Таким мышам после введения дозы бактерий, вызывающей септицемию со смертельным исходом, через определенное время вводили рекомбинантный ч-ИЛ-2. В группе мышей, получивших рч-ИЛ-2, отмечен значительно более высокий уровень выживания за время наблюдения по сравнению с контрольной группой, не получавшей рекомбинантный ч-ИЛ-2. Такой опыт вызывает состояние лишь сходное с сепсисом. Как и всякая модель, он не учитывает, однако, очень важных факторов, возникающих при сепсисе человека. При таком опыте происходит быстрое искусственное заражение, и. количество лейкоцитов у мышей, а также их активность не снижены, как это бывает при иммуносупрессии, вызванной сепсисом, у человека. То есть фактически отсутствует угнетение иммунной системы, и ее лечение не осуществляется. Эффект же обусловлен связыванием рекомбинантного ч-ИЛ-2 с рецепторами лимфоцитов, находящихся в активном состоянии и достаточном количестве. Эффект при этом достигается лишь при введении рекомбинантного ч-ИЛ-2 не позднее чем через 1 ч. после введения дозы бактерий, ведущей к развитию состояния, сходного с сепсисом, что невозможно в случае сепсиса у человека, который развивается постепенно.
Известно, что ч-ИЛ-2 в относительно здоровом организме стимулирует пролиферацию Т-лимфоцитов (не находящихся в состоянии иммуносупрессии), аналогичную функцию выполняют также и другие вещества, например препараты тимуса.
Однако в условиях сепсиса число и функция лимфоцитов резко снижены, что является главной причиной, по которой препараты тимуса не обнаруживают эффекта стимуляции иммунной системы при сепсисе. Практически все лимфоциты при иммуносупрессии являются "покоящимися" лимфоцитами. У таких "покоящихся" лимфоцитов нет рецепторов к ч-ИЛ-2, и опыты, проведенные in vitro, показали, что ч-ИЛ-2 (так же как и другие иммуномодуляторы) на "покоящиеся" лимфоциты не действует.
В результате экспериментов, проведенных авторами настоящего изобретения, неожиданно было установлено, что вопреки сложившемуся мнению специалистов в условиях человеческого организма рекомбинантный ч-ИЛ-2 оказывает стимулирующее воздействие на такие "покоящиеся" лимфоциты. По-видимому, это обусловлено тем, что рекомбинантный ч-ИЛ-2 действует на некоторые другие клетки человеческого организма, такие как моноциты, эндотелиальные клетки или клетки стромоселезенки, вырабатывающие факторы стимуляции, которые приводят к возникновению рецепторов у "покоящихся" лимфоцитов, что позволяет ч-ИЛ-2 связаться с этими рецепторами, вызывая активацию и пролиферацию Т-клеток. При этом увеличивается количество лимфоцитов, усиливается их активность и запускается комплекс иммунных реакций, приводящий к выводу практически полностью угнетенной иммунной системы на нормальный уровень функционирования и возобновлению работы всех ее компонентов.
В качестве ч-ИЛ-2 можно использовать любую субстанцию, обладающую активностью ч-ИЛ-2, в частности различные лекарственные формы рекомбинантных ч-ИЛ-2. Коммерчески наиболее доступными являются сейчас препараты рч-ИЛ-2, получаемые на основе рекомбинантных штаммов микроорганизмов (бактерий или дрожжей).
Очевидно, что для медицинских целей целесообразно использовать рекомбинантный ч-ИЛ-2, продуцируемый непатогенными микроорганизмами, клетки которых не содержат эндотоксины типа липополисахаридов. Таковыми являются, например, пекарские дрожжи- сахаромицеты. В частности представляет интерес дрожжевой рекомбинантный ч-ИЛ-2, получаемый из рекомбинантного штамма дрожжей Saccaharomyces cerevisiae, депонированного во Всероссийской коллекции промышленных микроорганизмов под номером ВКМГ-791.
Целесообразно вводить ч-ИЛ-2 в количестве 100 000 - 3 000 000 МЕ/сут на 1 м2 поверхности тела пациента.
Введение дозы ниже 100 000 МЕ не усиливает пролиферацию Т- лимфоцитов до клинически значимой, доза более 3 000 000 уже может вызвать побочные эффекты в виде угрожающего снижения уровня артериального давления, тяжелых аллергических реакций, аллергического шока, диареи, вызванные действием препарата рекомбинантного р-ИЛ-2, который неизбежно содержит балластные белки.
Целесообразно измерять количество Т-лимфоцитов до и после введения ч-ИЛ-2 и при уменьшении их количества относительно предыдущего измерения прекращать введение.
При этом увеличение числа лимфоцитов крови перед очередным введением препарата по сравнению с предыдущим исследованием свидетельствует об эффективном воздействии на иммунную систему и служит основанием к очередному введению ч-ИЛ-2. Отсутствие увеличения числа лимфоцитов крови отражает истощение резервов иммунной системы и является основанием для прекращения введения ч-ИЛ-2.
Критериями выбора пациентов для лечения иммуносупрессии, вызванной сепсисом, являются следующие:
наличие установленных очагов и источников инфекции;
повышенная - более 38,5oC или пониженная - менее 36,0oC температура тела;
тахикардия - более 90 ударов в мин;
одышка - более 20 дыханий в мин;
наличие по крайней мере одного из следующих признаков: нарушенного ментального статуса, гипоксемии, олигурии, повышения лактата в крови;
возраст больных от 16 до 65 лет.
ч-ИЛ-2 не применялся для лечения иммуносупрессии при сепсисе в следующих случаях:
цирроз печени с портальной гипертензией;
дыхательная недостаточность, связанная с обструктивным синдромом (в частности при туберкулезе легких);
онкологические заболевания;
аллергические реакции в анамнезе;
применение иммуномодулирующих препаратов;
несоблюдение условий, перечисленных в предыдущем разделе.
Производилась оценка тяжести состояния больного. Обследование больного включало в себя регистрацию основных симптомов и оценку состояний внутренних органов, гемодинамики, температуры тела, диареи и т.д.
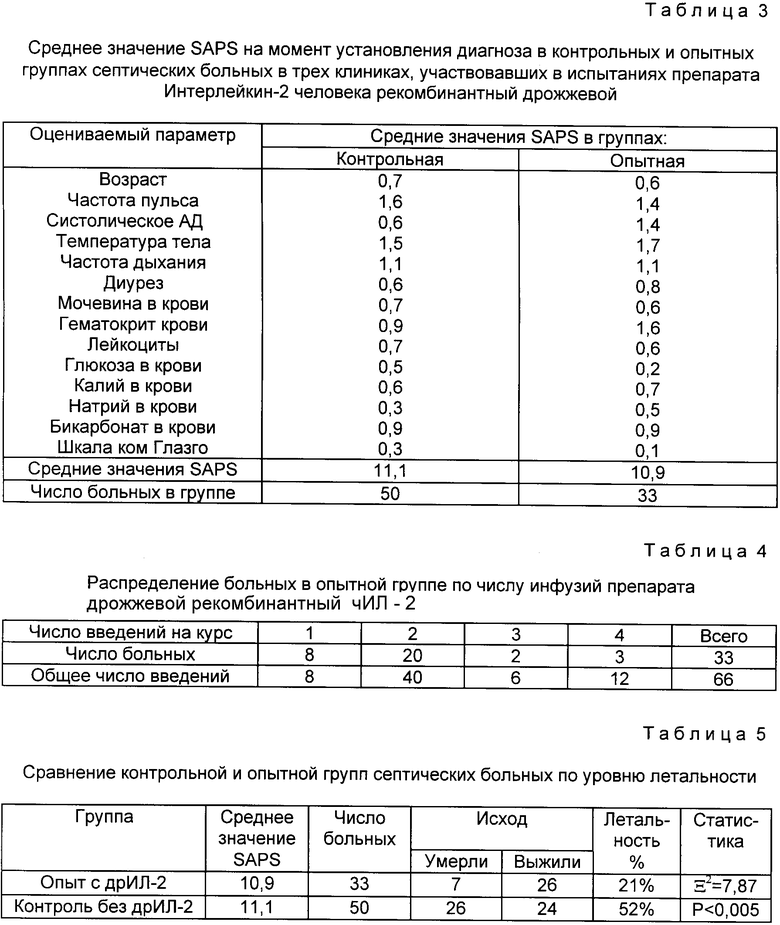
Интегральная оценка тяжести состояния больного производилась с использованием широко применяемой в клинических исследованиях шкалы SAPS (Simplified Acute Physiology Score). Эта шкала учитывает 13 основных клинических и лабораторных признаков, которые отражают функциональное состояние основных систем и органов. Вычисленные значения SAPS позволяют, с одной стороны, проследить изменение состояния каждого больного до и после каждого введения ч-ИЛ-2, и, с другой стороны, сравнить по тяжести состояния контрольную и опытную группы пациентов.
Непосредственно перед применением пациенту препарата содержимое ампулы с препаратом дрожжевого рекомбинантного ч-ИЛ-2 с активностью 1- 2 млн.ед растворяют в 400 мл стерильного физраствора.
Введение осуществляют парентерально путем капельной внутривенной инфузии через центральную или периферическую вену продолжительностью 5-6 ч. При введении ч-ИЛ-2 в организм через 5-6 мин из кровотока уже исчезает до 70% активного вещества. Для достижения клинического эффекта от введения ч-ИЛ-2 предпочтительно некоторое время поддерживать его концентрацию в кровотоке на постоянном уровне. Поэтому дозу вводят не одномоментно, а в течение 5-6 ч. Более длительное введение неудобно с практической точки зрения.
Препарат вводят один раз в сутки. Для достижения стойкого клинического эффекта можно повторять введения, но не более 4 раз, так как для любого конкретного пациента 4-х кратное введение должно уже обеспечить иммуностимуляцию и дальнейшие дозы будут вести лишь к истощению иммунной системы (лимфоцитов).
Между введениями препарата предпочтительно делать перерывы в 2-3 дня, так как в течение этого времени реализуется действие предыдущей дозы ч-ИЛ-2, то есть иммунная система находится в состоянии, стимулированном предыдущей дозой.
Действие препарата оценивается клинически по уменьшению частоты пульса, стабилизации артериального давления, снижению температуры тела и одышки.
Биохимический анализ показывает снижение лейкоцитарного индекса интоксикации, возрастание числа лимфоцитов в периферической крови, а также уменьшение концентрации кератина в крови на следующий день после введения.
Иммунологический анализ показывает на 3-й день после введения нормализацию скорости спонтанной миграции, стимулирование бактерицидной активности лейкоцитов в крови (по данным люминометрического анализа).
Интегральный показатель тяжести состояния пациентов по шкале SAPS в среднем снижался на 4 балла после первого введения, на 1,6 - после второго, на 0,9 - после третьего.
Испытанию была подвергнута группа пациентов, включающая в себя 33 человека, сравнение проводили с контрольной группой (50 человек). Ниже приведены таблицы 1-5 с результатами испытания.
Пример 1. Больной, 41 год, был сбит трамваем, диагностированы множественные травмы обеих нижних конечностей. Была проведена ампутация по типу "первичной хирургической обработки".
Начиная со вторых суток уже диагностирована минимальная дистанция до профиля "метаболического дисбаланса" и отмечены положительные признаки ССВР (синдрома системной воспалительной реакции). Температура повысилась до 38,8oC, тахикардия составила 120 уд/мин, тахипноэ - 24 дд/мин, лейкоцитоз - 27•109 к/л. Продолжались инфузионная и антибактериальная терапия, начата антикоагуляционная терапия. Признаки ССВР сохранялись, несмотря на коррекции в проводимой терапии. Подъемы температуры достигли 40,1oC, лейкоцитоз 34•109 к/л, палочкоядерный сдвиг 30%. Поставлен диагноз сепсис.
На 6-е сутки после травмы были сняты швы с культи правого бедра, где был диагностирован неклостридиальный анаэробный целлюломиозит (при микробиологическом исследовании в ране обнаружен Bacteriodes fragilis). Проведена операция "вторичная хирургическая обработка". Операция была закончена проведением тщательной инфильтрации окружающих тканей противовоспалительной смесью.
Больному начат весь комплекс терапии, направленный на ликвидацию синдрома системной воспалительной реакции. Произведена смена антибактериальной терапии - назначен клафоран по 2 г 4 раза в сутки, гентамицин по 80 мг 3 раза в сутки, метраджил по 100 мл 3 раза в сутки. Количество контрикала увеличено до 90 тыс. ед в сутки. Назначена антикоагулянтная терапия в режиме умеренной гипокоагуляции - по 1 тыс.ед в час, на фоне трентала по 5 мл 3 раза в сутки, реполиглюкина - 400 мл, нативной плазмы - 2 дозы. Температура снизилась до 39,2oC, однако сохранялась тахикардия - 110 уд/мин, тахипноэ - 23 дд/мин, развилась лейкопения - 3,9•109 к/л, отношение лактат/пируват возросло до 48.
В связи с тем, что происходило прогрессирование признаков генерализации воспалительного синдрома, характеризующееся угнетением лекопоэза, резким снижением относительного и абсолютного количества лимфоцитов, то есть видны признаки нарастающего вторичного иммунодефицита, было принято решение о проведении иммуномодулирующей терапии с использованием дрожжевого рекомбинантного ч-ИЛ-2, полученного из штамма дрожжей ВКПМ-У791 (известен под названием "Ронколейкин"TM), в дозе 1 млн. ед на 1 м2 поверхности тела больного, внутривенно, капельно, по 200 000 ед/час. Пациент получил две дозы дрожжевого рекомбинантного ч-ИЛ-2 на 8 и 10-е сутки после травмы. Обе инфузии перенес без каких-либо побочных явлений.
Уже на следующие сутки после первого введения температура снизилась до 38,1oC, уменьшилась тахикардия до 95 уд/мин, количество лейкоцитов увеличилось до 7•109 к/л при сохраняющемся палочкоядерном сдвиге 12% (после 30%), тахипноэ осталось в пределах 22-23 дд/мин. В ходе перевязки было отмечено отсутствие дополнительных участков некроза.
После проведенного на 10-е сутки после травмы повторного введения дрожжевого рекомбинантного ч-ИЛ-2 состояние пострадавшего полностью стабилизировалось, максимальная температура на 11-е сутки не превышала 37,5oC, количество палочкоядерных нейтрофилов уменьшилось до 6%, количество лимфоцитов увеличилось до 18%, а в абсолютных величинах - 1,98•109 к/л, количество сегментоядерных нейтрофилов возросло до 73%.
Пример 2. Больная, 42 года, диагноз: метроэндометрит, пельвеоперитонит, сепсис, септический эндокардит. Состояние тяжелое. Выраженная интоксикация: пульс 108 уд/мин, температура тела 38,7oC, частота дыханий 36 в мин.
Оценка тяжести состояния по шкале SAPS 9 баллов.
Произведено однократное внутривенное капельное введение дрожжевого рекомбинантного ч-ИЛ-2 в дозе 3 000 000 ЕД на м2 поверхности тела больной в течение 5 ч. На следующие сутки состояние больной значительно улучшилось. Пульс 76 уд/мин, температура тела 37,1oC, частота дыхания 18 в мин.
Оценка тяжести состояния по шкале SAPS 3 балла.
На третьи сутки состояние относительно удовлетворительное. Температура тела 36,7oC, пульс 72 уд/мин, частота дыхания 16 в мин.
Оценка тяжести состояния по шкале SAPS 1 балл. Сепсис прекращен.
Пример 3. Больной, 25 лет. Диагноз: ангиогенный сепсис, эндомиокардит, двухсторонний плеврит, интерстициальный нефрит, асцит. Состояние тяжелое. Выраженные отеки. Пульс 100 уд/мин, одышка 24 дыханий в мин, температура тела 38,3oC. Количество лимфоцитов крови 0,7•109 к/л.
Оценка тяжести состояния по шкале SAPS 6 баллов.
С интервалом в 4 дня дважды проведена внутривенная капельная инфузия дрожжевого рекомбинантного ч-ИЛ-2 по 300 000 ЕД на м2 поверхности тела больного. На следующие сутки после первого введения отмечена нормализация температуры тела (36,9oC), снижение одышки до 20 дыханий в мин, тахикардии до 92 уд/мин. Отечность конечностей существенно не изменилась. На 5-й день отеки уменьшились, число лимфоцитов крови возросло до 1,1•109 к/л. После 2-го введения дрожжевого рекомбинантного ч-ИЛ-2 отмечена стабилизация достигнутого улучшения, температура тела нормализовалась. На 3-й день после 2-го введения препарата состояние больного средней тяжести. Отеков нет. Пульс 88 уд/мин, частота дыханий 20 в мин, температура тела 36,4oC.
Оценка тяжести состояния по шкале SAPS 1 балл.
Количество лимфоцитов крови снизилось до 0,9•109 к/л. Инфузии ч-ИЛ-2 прекращены. На 9-й день после начала лечения с помощью дрожжевого рекомбинантного ч-ИЛ-2 больной был переведен из реанимации на общее кардиологическое отделение.
Пример 4. Больной, 45 лет. Диагноз: ожоги кожи 2-3 степени 15% поверхности тела, ушивание стрессовых язв желудка, нагноение раны, сепсис. Состояние тяжелое. Температура тела 40,0oC. Пульс 108 уд/мин., частота дыханий 22 в мин. Шкала SAPS 9 баллов. Количество лимфоцитов крови 0,5•109 к/л.
Выполнено 2 внутривенных инфузии дрожжевого рекомбинантного ч-ИЛ-2, каждая по 500 000 Ед на м2 поверхности тела больного аналогично описанному выше примеру. Интервал между введениями составил 5 дней.
На 5-й день после первой инфузии состояние больного несколько улучшилось. Температура тела 39,4oC, пульс 108 уд/мин, частота дыханий 20 в мин, шкала SAPS 7 баллов. Количество лимфоцитов возросло до 0,9•109 к/л.
Выполнена 2-я инфузия ч-ИЛ-2. На 3-й день после второй инфузии состояние еще улучшилось. Температура тела 38,3oC, пульс 96 уд/мин, частота дыханий 18 в мин. Шкала SAPS 4 балла. Количество лимфоцитов крови уменьшилось до 0,76•109 к/л. Иммуностимуляция интерлейкином-2 прекращена.
Пример 5. Больная, 57 лет. Диагноз: политравма, отморожение нижних конечностей, шок-1, пневмония, ДВС-синдром, сепсис. Состояние тяжелое. Пульс 100 уд./мин. Температура тела 39,7oC. Одышка - 32 дыхания/мин. Шкала SAPS 10 баллов. Число лимфоцитов крови 1,75•109 к/л.
Проведена инфузия дрожжевого рекомбинантного ч-ИЛ-2 в дозе 100 000 ЕД на м2 поверхности тела больного по методике, приведенной выше. Состояние больной несколько улучшилось. Температура тела снизилась. На 3-й день температура тела - 38,1oC, пульс - 74 уд/мин, частота дыхания 22/мин, шкала SAPS 8 баллов, число лимфоцитов крови возросло до 2,05•109 к/л.
Выполнена 2-я инфузия дрожжевого рекомбинантного ч-ИЛ-2 в такой же дозировке. Состояние больной стабилизировалось. Через 2 дня после 2-й инфузии ч-ИЛ-2: пульс 76 уд/мин, температура тела 37,6oC, частота дыханий 20 в мин, шкала SAPS 5 баллов, число лимфоцитов крови 2,15•109 к/л.
Проведена третья инфузия дрожжевого рекомбинантного ч-ИЛ-2 в дозе 100 000 ЕД на м2 поверхности тела больной. На 3-й день после инфузии состояние больной без существенных изменений. Число лимфоцитов крови снизилось до 1,9•109 к/л. Иммуностимуляция ч-ИЛ-2 прекращена.
Изобретение может быть использовано в медицине для лечения иммуносупрессии при сепсисе, являющимся одним из наиболее опасных осложнений, возникающих в послеоперационном и постшоковом периоде.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ЛЕЧЕНИЯ ЗАТЯЖНЫХ, РЕЦИДИВИРУЮЩИХ ФОРМ ПСЕВДОТУБЕРКУЛЕЗА И ЕГО СПЕЦИФИЧЕСКИХ ОСЛОЖНЕНИЙ У ДЕТЕЙ | 2000 |
|
RU2189249C2 |
| СПОСОБ ЛЕЧЕНИЯ РАССЕЯННОГО СКЛЕРОЗА | 2001 |
|
RU2199339C2 |
| ФАРМАЦЕВТИЧЕСКИЙ ПРЕПАРАТ НА ОСНОВЕ ИНТЕРЛЕЙКИНА-2 (ВАРИАНТЫ) | 1998 |
|
RU2140283C1 |
| СПОСОБ ЛЕЧЕНИЯ ВТОРИЧНОЙ ИММУННОЙ НЕДОСТАТОЧНОСТИ ПРИ СЕПСИСЕ И СЕПТИЧЕСКОМ ШОКЕ В УРОЛОГИИ | 2014 |
|
RU2586243C1 |
| ИММУНОСТИМУЛЯТОР И ПРЕПАРАТ НА ЕГО ОСНОВЕ | 1995 |
|
RU2120298C1 |
| СПОСОБ РАННЕЙ ДИАГНОСТИКИ ЗЛОКАЧЕСТВЕННЫХ ОПУХОЛЕЙ ОРГАНОВ И ТКАНЕЙ (ЕГО ВАРИАНТЫ) - СПОСОБ ДААБУЛЯ И ВЕЩЕСТВО ДЛЯ ЕГО ОСУЩЕСТВЛЕНИЯ | 1997 |
|
RU2130775C1 |
| СПОСОБ ПОСЛЕОПЕРАЦИОННОЙ ИНТЕНСИВНОЙ ТЕРАПИИ БОЛЬНЫХ С РАСПРОСТРАНЕННЫМ ПЕРИТОНИТОМ | 2003 |
|
RU2228193C1 |
| ИММУНОМОДУЛИРУЮЩИЙ ПРЕПАРАТ "БЕТАЛЕЙКИН" | 1998 |
|
RU2128706C1 |
| СПОСОБ ПРОФИЛАКТИКИ ГНОЙНО-СЕПТИЧЕСКИХ ОСЛОЖНЕНИЙ ТЯЖЕЛОЙ СОЧЕТАННОЙ ТРАВМЫ | 2006 |
|
RU2326687C1 |
| СПОСОБ ЛЕЧЕНИЯ УВЕАЛЬНОЙ МЕЛАНОМЫ | 2000 |
|
RU2175242C1 |

Изобретение относится к медицине, в частности к лечению тяжелых состояний у человека, вызванных инфекцией. В качестве средства для коррекции иммуносупрессии в способе лечения сепсиса у человека предлагается использовать человеческий интерлейкин-2, полученного из дрожжей вида Saccharomyces cerevisiae, депонированного во Всероссийской коллекции промышленных организмов под номером ВКПМ-У791, который вводят в дозе от 100 000 до 3 000 000 МЕ/сут на 1 м2 поверхности тела пациента. В отличие от других интерлейкинов, используемых при сепсисе у человека, он оказывает стимулирующее воздействие на "покоящиеся" лимфоциты, индуцирует продукцию ИЛ-8 и фактора некроза опухоли. 5 табл.
Способ лечения иммуносупрессии при сепсисе у человека путем парентерального введения пациенту рекомбинантного человеческого интерлейкина-2, полученного из дрожжей, отличающийся тем, что в качестве последнего используют интерлейкин-2, полученный из штамма дрожжей вида Saccharomyces cerevisiae, депонированного во Всероссийской коллекции промышленных микроорганизмов под номером ВКПМ-V791, который вводят в дозе от 100000 до 3000000 МЕ/сут на 1 м2 поверхности тела пациента.
| Гринев М.В | |||
| В кн | |||
| Актуальные проблемы и перспективы развития современной реаниматологии | |||
| Материалы международного симпозиума, посвященного 85-летию акад | |||
| РАМН В.А.Неговского, 16 - 18 марта 1994 г | |||
| М., с.103 - 104. |
Авторы
Даты
1998-07-20—Публикация
1995-03-28—Подача