Настоящее изобретение относится к производным акридина, способам их получения, к содержащим их фармацевтическим композициям и к их использованию в медицине. В особенности оно относится к соединениям и композициям, которые способны повышать чувствительность мультилекарственно-резистентных (резистентных к многим лекарствам) раковых клеток к химиотерапевтическим агентам.
У многих пациентов эффективность химиотерапии при лечении рака низкая или понижается после того, как начальное лечение обусловливает развитие резистентности к противораковым лекарствам, известной как мультилекарственная резистентность. Мультилекарственная резистентность представляет собой процесс, посредством которого злокачественные клетки становятся резистентными к структурно различным химиотерапевтическим агентам последующего лечения с помощью единственного противоопухолевого лекарства. Эта приобретенная резистентность к лекарству может быть главным клиническим препятствием при лечении рака. Некоторым опухолям свойственна мультилекарственная резистентность и, следовательно, нет реакции на химиотерапию.
Оказалось, что этот тип резистентности может быть аннулирован за счет некоторых блокирующих источник кальция средств, таких как Никардипин и Верапамил: за счет антиаритмических агентов, таких как Амиодарон и Хинидин так же, как благодаря природным продуктам, таким как Цефарантин. Однако эти соединения проявляют свою, повышающую чувствительность мультилекарственно-резистентной клетки активность только при очень высоких дозах, которые значительно выше присущего им токсического уровня, и это строго в пределах их клинического использования в области химиотерапии рака.
Найдена новая группа соединений, с помощью которых можно повышать чувствительность мультилекарственно-резистентных раковых клеток к химиотерапевтическим агентам при уровнях доз, при которых эти новые соединения оказываются нетоксичными.
Таким образом, настоящее изобретение относится к соединению формулы I
где
R обозначает атом водорода или галогена или C1-C4-алкильную, C1-C4-алкоксильную, C1-C4-алкилтио-, амино- или нитрогруппу;
p - 1 или, когда R0 обозначает C1-C4-алкоксил, также может обозначать 2 или 3;
R1 обозначает атом водорода или галогена или C1-C4-алкильную, C1-C4-алкоксильную или C1-C4-алкилтиогруппу;
R2 обозначает атом водорода или C1-C4-алкильную группу;
A обозначает атом кислорода или серы, связь или группу (CH2)lNH9 (где l обозначает 0 или 1 и R9 обозначает атом водорода или метильную группу);
B обозначает C1-C4-алкиленовую цепь, необязательно замещенную гидроксильной группой, за исключением того, что гидроксильная группа и часть A не могут быть связаны с одним и тем же атомом углерода, когда A обозначает атом кислорода или серы или группу (CH2)lNR9, или когда A обозначает связь, то B также может обозначать C2-C4-алкениленовую цепь;
R3 обозначает атом водорода или C1-C4-алкильную группу;
m - 1 или 2;
R4 обозначает атом водорода или галогена, или C1-C4-алкильную, C1-C4-алкоксильную или C1-C4-алкилтиогруппу;
R5 обозначает атом водорода или C1-C4-алкоксильную группу;
R6 обозначает атом водорода или C1-C4-алкильную или C1-C4-алкоксильную группу;
R7 обозначает атом водорода или R3 и R7 вместе образуют группу -(CH2)n-, где n = 1 или 2;
R8 обозначает атом водорода или C1-C4-алкоксильную группу; причем группа a
связана с бензольным кольцом в 3-м или 4-положении по отношению к карбоксамидному заместителю, при условии, что, когда группа связана с бензольным кольцом в положении 3, тогда R6 должен быть связан с бензольным кольцом в положении 6;
и их солям и сольватам, включая их физиологически совместимые соли и сольваты.
В качестве используемой здесь алкильная группа как таковая или как часть алкоксильной или алкилтиогруппы, может быть алкильной группой с линейной или с разветвленной цепью, например метильная, этильная или проп-2-ильная группа.
Галоидным заместителем может быть атом фтора, хлора, брома или иода.
Группа (группы) R0, когда она другая, чем атом водорода, может находиться в положении 5, 6, 7 или 8 молекулы акридона, а группа R1, когда она другая, чем атом водорода, может находиться в положении 1, 2 или 3 молекулы акридона.
Примеры цепи -A-B-CH2- включают: -(CH2)2-; -(CH2)3-; -(CH2)4-; -(CH2)5-; 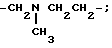 -CH=CHCH2-; -CH2CH=CHCH2-; -CH(OH)CH2-; -O(CH2)2-; -O(CH2)3-; -OCH2CH(OH)CH2-; -NH(CH2)2-; -S(CH2)2- и -S(CH2)3-.
-CH=CHCH2-; -CH2CH=CHCH2-; -CH(OH)CH2-; -O(CH2)2-; -O(CH2)3-; -OCH2CH(OH)CH2-; -NH(CH2)2-; -S(CH2)2- и -S(CH2)3-.
Предпочтительным классом соединений формулы I является тот, в котором R0 обозначает атом водорода или фтора, или C1-C4-алкоксильную (например, метокси) группу, C1-C4-алкильную (например, метильную) группу или C1-C4-алкилтио- (например, метилтио-) группу, и R1 обозначает атом водорода. Когда R0 обозначает другой заместитель чем атом водорода, то R0 - группа предпочтительно находится в положении 5 акридоновой молекулы.
Другим предпочтительным классом соединений формулы I является тот, в котором R2 обозначает атом водорода.
Когда R3 обозначает атом водорода или C1-C4-алкильную группу, предпочтительно R3 обозначает C1-C4-алкильную (например, метильную) группу.
Еще другим предпочтительным классом соединений формулы (I) является тот, в котором R4 обозначает атом водорода или C1-C4-алкоксильную группу (например, метоксигруппу); R5 обозначает атом водорода или C1-C4-алкоксильную (например, метокси-)группу и R8 обозначает атом водорода или C1-C4-алкоксильную (например, метокси) группу, при условии, что по крайней мере один из R4, R5 и R8 обозначает C1-C4-алкоксильную (например, метокси) группу. Особенно предпочтительным классом соединений формулы (I) является тот, в котором R4 и R5, каждый, обозначает C1-C4-алкоксильную (например, метокси) группу и R8 обозначает атом водорода.
Следующим предпочтительным классом соединений формулы I является тот, в котором R6 обозначает атом водорода или метильную, этильную, метокси- или этоксигруппу.
Предпочтительной группой соединений формулы (I) является такая, в которой m обозначает 1 и R3 и R7 вместе образуют группу -(CH2)2- и их физиологически совместимые соли и сольваты.
Особой группой соединений формулы I является таковая формула Ia
где
R0 обозначает атом водорода или галогена, или C1 - C4-алкильную, C1 - C4-алкоксильную, C1 - C4-алкилтио- или нитрогруппу;
R1 обозначает атом водорода или галогена, или C1 - C4-алкильную, C1 - C4-алкоксильную или C1 - C4-алкилтиогруппу;
R2 обозначает атом водорода или C1 - C4-алкильную группу;
A обозначает атом водорода или серы или связь;
B обозначает незамещенную C1 - C4-алкиленовую цепь;
R4 и R5 каждый независимо друг от друга обозначают C1 - C4-алкоксильную группу;
и их физиологически совместимые соли и сольваты.
Особенно предпочтительной группой соединений формулы I является таковая формулы Ia, в которой R0 обозначает атом водорода или фтора, или C1 - C4-алкоксильную (например, метокси-), или C1 - C4-алкильную (например, метильную) группу;
R1 и R2, каждый, обозначают атом водорода и R4 и R5, каждый, обозначают C1 - C4-алкоксильную (например, метокси) группу. Особенно предпочтительны также соединения, в которых R0-группа находится в положении 5 акридоновой молекулы.
Само собой разумеется, что настоящее изобретение включает все комбинации вышеуказанных особых и предпочтительных групп.
Особенно предпочтительным соединением согласно изобретению является 9,10-дигидро-5-метокси-9-оксо-N-[4-[2-[1,2,3,4-тетрагидро- 6,7-диметокси-2-изохинолинил] этил] фенил]-4-акридинкарбоксамид и его физиологические совместимые соли и сольваты.
Другими предпочтительными соединениями согласно изобретению являются:
9,10-дигидро-5-метокси-9-оксо-N-[4-[[3-[1,2,3,4-тетрагидро- 6,7-диметокси-2-изохинолинил]пропил]тио]фенил]-4-акридинкарбоксамид;
5-фтор-9,10-дигидро-9-оксо-N-[4-[[3-[1,2,3,4-тетрагидро- 6,7-диметокси-2-изохинолинил]пропил]тио]фенил]-4-акридинкарбоксамид;
9,10-дигидро-5-метокси-9-оксо-N-[4-[3-[1,2,3,4-тетрагидро- 6,7-диметокси-2-изохинолинил]пропокси]фенил]-4-акридинкарбоксамид;
9,10-дигидро-5-метил-9-оксо-N-[4-[[3-[1,2,3,4-тетрагидро- 6,7-диметокси-2-изохинолинил]пропил]тио]фенил]-4-акридинкарбоксамид;
9,10-дигидро-5-метокси-N-[2-метокси-4-[3-[1,2,3,4-тетрагидро- 6,7-диметокси-2-изохинолинил]пропил]фенил]-9-оксо-4-акридинкарбоксамид;
9,10-дигидро-N-[2-метокси-4-[3-[1,2,3,4-тетрагидро-6,7- диметокси-2-изохинолинил]пропил]фенил]-5-метил-9-оксо-4- акридинкарбоксамид;
и их физиологически совместимые соли и сольваты.
Другими предпочтительными соединениями согласно изобретению являются:
N-[4-[4-[[[3,4-диметоксифенил] метил] метиламино] бутил]фенил]- 9,10-дигидро-9-оксо-4-акридинкарбоксамид;
N-[4-[2-[[[3,4-диметоксифенил] метил] метиламино] этил] фенил]- 9,10-дигидро-9-оксо-4-акридинкарбоксамид;
N-[4-[4-[[[3,4-диметоксифенил] метил] метиламино] бутил]фенил]- 5-фтор-9,10-дигидро-9-оксо-4-акридинкарбоксамид;
N-[4-[2-[[[3,4-диметоксифенил] метил] метиламино] этил] фенил]- 9,10-дигидро-5-метокси-9-оксо-4-акридинкарбоксамид;
и их физиологически совместимые соли и сольваты.
Еще другими предпочтительными соединениями согласно изобретению являются:
N-[4-[3-[[[3,4-диметоксифенил] метил] метиламино]пропил]фенил]- 5-фтор-9,10-дигидро-9-оксо-4-акридинкарбоксамид;
N-[4-[2-[[[3,4-диметоксифенил] метил] метиламино] этил] фенил]- 5-фтор-9,10-дигидро-9-оксо-4-акридинкарбоксамид;
N-[4-[[3-[[[3,4-диметоксифенил] метил] метиламино] пропил] тио] фенил] - 9,10-дигидро-5-метокси-9-оксо-4-акридинкарбоксамид;
и их физиологически совместимые соли и сольваты.
Следующими предпочтительными соединениями согласно изобретению являются:
N-[4-[[3-[[[3,4-диметоксифенил] метил] метиламино] пропил] тио] фенил] - 9,10-дигидро-9-оксо-4-акридинкарбоксамид;
N-[4-[4-[[[3,4-диметоксифенил] метил] метиламино] бутил]фенил]- 9,10-дигидро-5-метокси-9-оксо-4-акридинкарбоксамид;
N-[4-[3-[[2-[3,4-диметоксифенил] этил]метиламино]пропил]фенил]- 9,10-дигидро-9-оксо-4-акридинкарбоксамид;
N-[4-[2-[[2-[3,4-диметоксифенил] этил]метиламино]этокси]фенил]- 9,10-дигидро-5-метокси-9-оксо-4-акридинкарбоксамид;
N-[4-[3-[[[3,4-диметоксифенил]метил]метиламино]пропокси]фенил]- 9,10-дигидро-9-оксо-4-акридинкарбоксамид;
N-[4-[3-[[[3,4-диметоксифенил] метил] метиламино] пропокси] фенил] - 5-фтор-9,10-дигидро-9-оксо-4-акридинкарбоксамид;
N-[4-[2-[[2-[3,4-диметоксифенил] этил] метиламино] этил]фенил]- 9,10-дигидро-9-оксо-4-акридинкарбоксамид;
N-[4-[5-[[[3,4-диметоксифенил] метил] метиламино]пентил]фенил]- 5-фтор-9,10-дигидро-9-оксо-4-акридинкарбоксамид;
N-[4-[3-[[[3,4-диметоксифенил] метил] метиламино]пропокси]фенил]- 9,10-дигидро-9-оксо-4-акридинкарбоксамид;
N-[4-[2-[[[3,4-диметоксифенил] метил]метиламино]этиламино]фенил]- 9,10-дигидро-5-метокси-9-оксо-4-акридинкарбоксамид;
N-[4-[[3-[[[3,4-диметоксифенил] метил] метиламино] пропил] тио] фенил] - 9,10-дигидро-5-фтор-9-оксо-4-акридинкарбоксамид;
N-[4-[2-[[[3,4-диметоксифенил] метил] метиламино] этил] фенил]- 9,10-дигидро-5-метилтио-9-оксо-4-акридинкарбоксамид;
N-[4-[2-[[[3,4-диметоксифенил] метил] метиламино] этил] фенил]- 9,10-дигидро-5-метил-9-оксо-4-акридинкарбоксамид;
N-[4-[3-[[[3,4-диметоксифенил] метил] метиламино] пропокси]фенил]-9,10-дигидро -5-метил-9-оксо-4-акридинкарбоксамид;
и их физиологически совместимые соли и сольваты.
Еще другими предпочтительными соединениями согласно изобретению являются:
N-[4-[2-[[2-[3,4-диметоксифенил] этил] метиламино] этил]фенил]-9,10- дигидро-9-оксо-4-акридинкарбоксамид;
N-[4-[4-[[2-[3,4-диметоксифенил] этил] метиламино]бутил]фенил]-9,10- дигидро-9-оксо-4-акридинкарбоксамид;
N-[4-[2-[[2-[4-метоксифенил] этил]метиламино]этил]фенил]-9,10- дигидро-9-оксо-4-акридинкарбоксамид:
N-[4-[2-[[2-[3,4-диметоксифенил] этил]метиламино]этокси]фенил]-9,10- дигидро-2-(метилтио)9-оксо-4-акридинкарбоксамид:
N-[4-[3-[[2-[3,4-диметоксифенил] этил] метиламино] пропокси]фенил]-9,10- дигидро-9-оксо-4-акридинкарбоксамид;
N-[4-[2-[[2-[4-метоксифенил] этил] метиламино]этокси]фенил]-9,10- дигидро-9-оксо-4-акридинкарбоксамид;
N-[4-[2-[[[3,4-диметоксифенил] метил] метиламино]этокси]фенил]-9,10- дигидро-9-оксо-4-акридинкарбоксамид;
N-[4-[3-[[[3,4-диметоксифенил]метил]метиламино]пропокси]фенил]-9,10- дигидро-5-метокси-9-оксо-4-акридинкарбоксамид;
N-[4-[[2-[[[3,4-диметоксифенил] метил] метиламино] этил]тио]фенил]-9,10- дигидро-9-оксо-4-акридинкарбоксамид:
и их физиологически совместимые соли и сольваты.
Пригодные физиологически совместимые соли соединений формулы I включают соли присоединения кислот, образованные с органическими или неорганическими кислотами, например гидрохлориды, гидробромиды, сульфаты, алкил- или арилсульфонаты (например, метансульфонаты или п-толуолсульфонаты), фосфаты, ацетаты, цитраты, сукцинаты, лактаты, тартраты, фумараты и малеаты. Сольватами могут быть, например, гидраты.
Другие соли, которые не являются физиологически совместимыми, могут быть пригодны для получения соединений формулы I и они составляют другую часть изобретения.
Способность соединений формулы I повышать чувствительность мультилекарственно-резистентных клеток была продемонстрирована ин витро на мультилекарственно-резистентной линии клеток яичника китайского хомяка (описано Bech-Hansen и др. , J.Cell.Physiol., 1976, 88, 23-32) и на мультилекарственно-резистентной линии клеток карциномы грудной железы человека (описано Batist и др. J.Biol.Chem., 1986, 261, 1544-1549), используя испытание, аналогическое таковому, описанному Carmichael и др., Cahcer Research 1987, 47, 936.
Способность соединений формулы I повышать чувствительность мультилекарственно-резистентных клеток также была продемонстрирована ин виво на линии клеток опухоли P388P (описано Johnson и др., Cancer Treat. Rep., 1978, 62, 1535-1547). Используемая методология аналогична таковой, описанной Boesch и др., Cancer Research, 1991, 51, 4226-4233. Однако, при нашем исследовании соединения вводились орально, внутривенно или интраперитонеально в виде разовой дозы.
Настоящее изобретение, следовательно, относится к соединению формулы I или его физиологически совместимой соли или сольвату для применения в терапии, более конкретно для использования при лечении млекопитающих, включая человека, страдающих от рака, для
(а) - улучшения или увеличения эффективности противоопухолевого лекарства, или
(б) - увеличения или восстановления чувствительности опухоли к противоопухолевому лекарству, или
(в) - аннулирования или снижения резистентности приобретенной, индуцированной или иного рода опухоли к противоопухолевому лекарству.
Также, настоящее изобретение относится к способу лечения млекопитающего, включая человека, страдающего от рака, причем этот способ включает введение вышеупомянутому млекопитающему эффективного количества соединения формулы I или его физиологически совместимой соли или сольвата, для
(а) - улучшения или увеличения эффективности противоопухолевого лекарства, или
(б) увеличения или восстановления чувствительности опухоли к противоопухолевому лекарству, или
(в) - аннулирования или снижения резистентности приобретенной, индуцированной или иного рода опухоли к противоопухолевому лекарству.
В одном аспекте настоящее изобретение относится к использованию соединения формулы I или его физиологически совместимой соли или сольвата для приготовления лекарства для лечения млекопитающего, включая человека, страдающего от рака, для
(а) улучшения или восстановления чувствительности опухоли к противоопухолевому лекарству, или
(б) увеличения или восстановления чувствительности опухоли к противоопухолевому лекарству, или
(в) - аннулирования или снижения резистентности приобретенной, индуцированной или иного рода опухоли к противоопухолевому лекарству.
Нужно принимать во внимание, что соединения согласно настоящему изобретению вводятся вместе с противоопухолевым лекарством. Таким образом, в другом аспекте, настоящее изобретение относится к продукту, содержащему соединение формулы I или его физиологически совместимую соль или сольват и противоопухолевое лекарство, в виде комбинированного препарата или одновременного, отдельного или последовательного использования при лечении рака, особенно для:
(а) улучшения или увеличения эффективности вышеуказанного противоопухолевого лекарства, или
(б) увеличения или восстановления чувствительности опухоли к противоопухолевому лекарству, или
(в) - аннулирования или снижения резистентности приобретенной, индуцированной или иного рода опухоли к противоопухолевому лекарству.
Примерами пригодных противоопухолевых лекарств, используемых вместе с соединениями настоящего изобретения, являются Vinca - алкалоиды (например, винкристин, винбластин и винорелбин), антрациклины (например, даунорубицин, доксорубицин и акларубицин), таксол и его производные (например, таксотер), подофиллотоксины (например, этопозид и VP 16), митоксантрон, актиномицин, колхицин, грамицидин Д, амсакрин или любое лекарство, обладающее перекрестной разистентностью с вышеуказанными лекарствами, характеризующимися так называемым MDR - фенотипом (фенотипом реакции элиминации макрофагов).
Нужно принимать во внимание, что, если введение двух лекарств неодновременное, то отсрочка для введения второго из активных ингредиентов не должна быть такой, чтобы потерялся целебный эффект комбинации.
Таким образом, в другом аспекте, настоящее изобретение относится к соединению формулы I или его физиологически совместимой соли или сольвату и противораковому лекарству в присутствии всякого другого в организме человека или животного для использования при лечении рака, особенно для
(а) - улучшения или увеличения эффективности вышеуказанного противоопухолевого лекарства, или
(б) - увеличения или восстановления чувствительности опухоли к противоопухолевому лекарству, или
(в) - аннулирования или снижения резистентности приобретенной, индуцированной или иного рода опухоли к противоопухолевому лекарству.
Некоторым опухолям часто присуща мультилекарственная резистентность, особенно карциномам толстой кишки, карциномам почечных клеток, гепатомам и адренокортикальным карциномам.
Другие типы опухолей, за исключением первоначально чувствительных, часто могут становиться мультилекарственно-резистентными, особенно лейкемии, лимфатомы, миеломы, педиатрические опухоли (например, нейробластомы), саркомы и рак груди, яичников и легких.
Следовательно, соединения изобретения особенно пригодны при лечении млекопитающих, включая людей, получающих химиотерапию против одного из вышеуказанных типов рака.
При использовании соединения формулы I или его физиологически совместимой соли или сольвата и противоопухолевого лекарства может оказаться предпочтительным применением активных ингредиентов в форме отдельных фармацевтических формулировок, хотя может быть использована одна комбинированная формулировка, как будет продемонстрировано дальше. Однако в последней формулировке оба активных ингредиента должны быть стабильными и взаимно совместимыми в отдельной применяемой формулировке.
Фармацевтические формулировки пригодных противоопухолевых лекарств и соответствующие дозировки и дозировочные нормы как правило соответствуют таковым, если бы осуществляли введение одного противоопухолевого лекарства для лечения опухоли.
Пригодные фармацевтические формулировки и соответствующие дозировки и дозировочные нормы соединений формулы I и их физиологически совместимых солей и сольватов описываются ниже.
Таким образом, далее, изобретение относится к фармацевтической композиции, которая включает соединение формулы I или его физиологически совместимую соль или сольват вместе с одной или более физиологически совместимыми основами или эксципиентами.
С другой стороны, настоящее изобретение относится к фармацевтической композиции, которая включает эффективное количество соединения формулы I или его физиологически совместимой соли или сольвата, применяемой при лечении млекопитающих, страдающих от рака, для
(а) - улучшения или увеличения эффективности противоопухолевого лекарства, или
(б) - увеличения или восстановления чувствительности опухоли к противоопухолевому лекарству, или
(в) - аннулирования или снижения резистентности приобретенной индуцированной или иного рода опухоли к противоопухолевому лекарству.
Соединения согласно изобретению могут быть сформулированы для орального, буккального, парентерального или ректального введения, из которых предпочтительны оральное и парентеральное введения.
Для орального введения фармацевтические композиции можно приготовлять, например, в виде таблеток или капсул, которые обычно получают с фармацевтически совместимыми эксципиентами, такими как связующие агенты (например, предварительно желатинизированный кукурузный крахмал, поливинилпирролидон или оксипропилметилцеллюлоза); наполнители (например, лактоза, микрокристаллическая целлюлоза или гидрофосфат кальция); смазки (например, стеарат магния, тальк или диоксид кремния); диспергаторы (например, лаурилсульфат натрия или крахмалгликолят натрия). Таблетки могут быть покрыты покрытием само по себе известными способами. Жидкие композиции для орального введения могут быть приготовлены, например, в виде растворов, сиропов или суспензий, или они могут находиться в виде сухого продукта, который перед использованием разбавляют водой или другими пригодным растворителем. Такие жидкие композиции могут быть получены обычным способом с фармацевтически совместимыми (приемлемыми) добавками, такими как суспендирующие агенты (например, сироп сорбитола, производные целлюлозы или гидрированные, годные в пищу жиры); эмульгаторы (например, лецитин или асаса (акация)); неводные растворители (например, миндальное масло, сложные эфиры масел, этиловый спирт или фракционированные растительные масла); и консерванты (например, метил- или пропил-п-оксибензоаты или сорбиновая кислота). Композиции также могут содержать соответствующие буферные соли, ароматизирующие вещества, красители и подслащивающие агенты.
Препараты для орального введения могут быть пригодным образом сформулированы с получением контролируемого высвобождения активного соединения.
Для буккального введения композиции могут быть приготовлены в виде таблеток или лепешек, сформулированных обычным образом.
Соединения изобретения могут быть сформулированы для парентерального введения путем инъекции большой дозы или непрерывного вливания. Формулировки для инъекции могут быть в форме единичной дозы, например в ампулах, или в многодозовых емкостях, с добавленным консервантом. Композиции могут быть в таких формах, как суспензии, растворы или эмульсии в масле, воде или спиртовых растворителях, и могут содержать агенты для формулирования, такие как суспендирующие агенты, стабилизаторы и/или диспергаторы. Альтернативно, активный ингредиент может быть в порошкообразной форме, перед использованием разбавляемый пригодным растворителем, например стерильной, не содержащей пирогенных веществ водой.
Соединения изобретения также могут быть сформулированы в виде ректальных (кишечных) композиций, таких, как свечи, или удерживаемых клизм, например, содержащие обычные для свечей основы, такие, как масло, какао или другие глицериды.
Предлагаемая суточная доза соединений изобретения для введения человеку (весом примерно 70 кг) составляет около 10-1000 мг, более предпочтительно около 25-500 мг. Нужно принимать во внимание, что может быть необходимым осуществлять определенные изменения дозы, в зависимости от возраста и состояния пациента и от пути введения. Например, суточная доза около 1 мг/кг может быть соответствующей для введения человеку путем вливания. Суточная доза может вводиться в виде разовой единицы или в виде двух или более частей разовой единицы, вводимых через соответствующие временные интервалы.
Соединения общей формулы I и их физиологически совместимые соли и сольваты могут быть получены нижеуказанными обычными способами. В последующем описании, группы R0- R8, m, p, A и B имеют указанные для соединений формулы I значения, если не указано ничего другого.
Таким образом, согласно первому общему способу A, соединение формулы I может быть получено путем взаимодействия соединения формулы II
с соединением формулы (III):
Реакция может быть осуществлена при использовании реагента сочетания, обычно применяемого в пептидном синтезе, такого как дициклогексилкарбодиимид (необязательно в присутствии 1-оксибензтриазола), дифенилфосфонилазид или N, N'-карбодиимидазол. Реакцию обычно осуществляют в инертном растворителе, таком как простой эфир(например, тетрагидрофуран), галогенуглеводород (например, дихлорметан), амид (например, диметилформамид) или кетон (например ацетон) и при температуре, например, от -10 до +100oC, более предпочтительно примерно при комнатной температуре.
Согласно другому общему способу Б, соединение формулы I может быть получено путем взаимодействия соединения формулы IV
где
Q обозначает галоген (например, бром),
с соединением формулы V
или его солью. Реакцию можно осуществлять в присутствии акцептора кислоты, такого как карбонат щелочного металла (например, карбонат калия), в присутствии или в отсутствие растворителя, и при повышенной температуре (например, 50-120oC). Пригодными растворителями являются кетоны (например, ацетон, метилэтилкетон или метилизопропилкетон) и спирты (например, этанол или изопропанол).
Соединения формулы III, в которой A обозначает атом кислорода или связь, могут быть получены путем восстановления соединения формулы VI
в которой A обозначает атом кислорода или связь,
с помощью пригодного восстановителя, такого как литийалюминийгидрид, в инертном растворителе, таком как простой эфир (например, тетрагидрофуран), при повышенной температуре.
Соединения формулы VI могут быть получены путем восстановления соединения формулы VII
путем каталитического гидрирования, например, используя водород в присутствии катализатора на основе благородного металла (например, палладия). Катализу можно способствовать путем применения, например, угля. Гидрирование можно осуществлять в растворителе, таком как спирт (например, этанол), и предпочтительно при температуре порядка 20-100oC (например, при 20-50oC) и при атмосферном давлении. Альтернативно, восстановление можно осуществлять при использовании железа и концентрированной соляной кислоты при повышенной температуре (например, при температуре кипения с обратным холодильником). Этот альтернативный процесс восстановления оставляет незатронутой любую двойную связь, имеющуюся в соединении формулы VII.
Соединения формулы VII могут быть получены путем взаимодействия соединения формулы VIII.

или его активированного производного, с вышеуказанным соединением формулы V, или его солью, необязательно в присутствии основания, такого как органическое основание (например, триэтиламин или N,N-диизопропилэтиламин), или неорганического основания, такого как карбонат щелочного металла (например, карбонат калия) или гидрокарбонат щелочного металла (например, гидрокарбонат натрия).
Если свободную кислоту VIII вводят во взаимодействие с амином V, то можно использовать реагенты сочетания и условия, описанные в способе A для реакции соединения формулы II с соединением формулы III.
Если используют активированное производное соединение формулы VIII, то им может быть, например, галоидангидрид кислоты (например, хлорангидрид кислоты), получаемый путем взаимодействия свободной кислоты VIII с галогенирующим агентом (например, тионилхлоридом). Это активированное производное соединения формулы VIII можно вводить во взаимодействие с соединением формулы V в растворителе, таком как ацетон, в присутствии основания, такого как гидрокарбонат натрия.
Соединения формулы VIII, где A обозначает связь, можно получать путем нитрирования соединения формулы IX.

с помощью азотной кислоты.
Соединения формулы VIII, где A обозначает связь, а B обозначает группу -CH=CH-, обычно можно получать путем гидролиза соединения формулы X
где
R10 обозначает C1-C4-алкильную группу. Гидролиз можно осуществлять при использовании обычных способов, например путем использования гидроксида натрия в водном этаноле.
Соединения формулы X можно получить путем взаимодействия соединения формулы XI
где
R11 обозначает атом водорода или C1-C4-алкильную, C1-C4-алкоксильную или гидроксильную группу,
с соединением формулы XII
(C6H5)3R = CHCO2R10, ХII
где
R10 имеет вышеуказанное значение,
в инертном растворителе, таком как углеводород (например, толуол), и при повышенной температуре. Для получения соединения формулы X, где R6 обозначает C1-C4-алкоксильную группу, из соединения формулы XI, где R11 обозначает гидроксильную группу, вышеуказанную реакцию осуществляют путем алкилирования гидроксильной группы, используя, например, алкилгалогенид.
Соединения формулы VIII, где A обозначает атом кислорода, могут быть получены путем гидролиза соединения формулы XIII
где
R10 имеет вышеуказанное значение.
Гидролиз можно осуществлять при использовании обычных способов, например путем применения гидроксида натрия в водном этаноле.
Соединения формулы XIII, можно получать путем взаимодействия соединения формулы XIV
L - B - CO2R10,
где
L обозначает атом галогена (например, брома),
с производным нитрофенола в присутствии карбоната щелочного металла (например, карбоната калия), в растворителе, таком как ацетон.
Соединения формулы III, где A обозначает атом кислорода или серы, или связь, можно получать путем восстановления соединения формулы XV
где
A обозначает атом кислорода или серы или связь,
используя условия, описанные выше для восстановления соединения формулы VII.
Соединения формулы XV можно получать путем нагревания соединения формулы XVI
где
Q обозначает атом галогена (например, брома),
A представляет собой атом кислорода или серы, или связь,
с соединением формулы V, указанным выше, в условиях, описанных выше в способе Б.
Соединения формулы XVI, где A обозначает атом кислорода или серы, могут быть получены путем взаимодействия соединения формулы XVII
где
A обозначает атом кислорода или серы,
с дигалогеналканом Q - B - CH2 - Q, в присутствии пригодного основания, такого как карбонат щелочного металла (например, карбонат калия).
Соединения формулы XVI, где A обозначает связь, можно получать путем взаимодействия соединения формулы XVIII
с галогенирующим агентом, таким как трибромид фосфора.
Соединения формулы XVIII можно получать путем восстановления соединения формулы XIX
с помощью пригодного восстановителя, такого, как диборан.
Соединения формулы XIX можно получать, подвергая соединение формулы XX
где
Q обозначает атом галогена (например, хлор),
одному или более последовательным синтезам Arndt-Eistert, т.е. реакции с диазометаном с последующей обработкой, например, оксидом серебра и водой).
Нужно принимать во внимание также, что соединения формулы XIX, в которой B обозначает незамещенную C2-C4-алкиленовую цепь, также могут быть получены, подвергая соединение формулы XXI
реакции Виттига с пригодным фосфорилидом (например, как (C6H5)3P = CH(CH2)OH) с последующим восстановлением двойной связи с помощью пригодного восстановителя, такого как диборан, и окислением первичного спирта до карбоновой кислоты с помощью пригодного окислителя, такого как оксид хрома-(VI).
Соединения формулы III, где A обозначает группу (CH2)lNR9, можно получать путем восстановления соединения формулы XXII
в которой B' обозначает связь или C1-C3-алкиленовую цепь, необязательно замещенную гидроксильной группой),
с помощью пригодного восстановителя, такого как литийалюминийгидрид, в инертном растворителе таком, как простой эфир (например, тетрагидрофуран), при повышенной температуре.
Соединения формулы XXII можно получать путем восстановления формулы XXIII
путем каталитического гидрирования, например, как описано выше для получения соединения формулы VI.
Соединения формулы XXIV можно получать путем взаимодействия соединения формулы XXIV
где
Q обозначает атом галогена (например, хлора),
с соединением формулы V, указанным выше, в условиях, описанных выше в способе Б.
Соединения формулы IV можно получать путем взаимодействия соединения формулы II, указанного выше, с соединением формулы XXV
где
Q обозначает атом галогена (например, брома),
в условиях, описанных выше в способе А для реакции соединения формулы (II) с соединением формулы III.
Соединения формулы V, где R3 обозначает C1-C4-алкильную группу, могут быть получены путем взаимодействия соединения формулы XXVI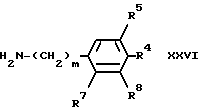
с бензальдегидом в присутствии C1-C4-алкилгалогенида. Последующий гидролиз результирующей четвертичной соли путем обработки разбавленным раствором гидроксида натрия дает соединение формулы V, где R3 обозначает C1-C4-алкильную группу.
Само собой разумеется, что вышеуказанные общие способы могут быть использованы для получения соединения формулы I, в которой Б содержит гидроксильный заместитель. Однако может быть предпочтительным восстановление промежуточного соединения, в котором В содержит оксогруппу, для получения желательного промежуточного соединения, в котором В содержит гидроксильный заместитель, на соответствующей стадии общего способа.
Промежуточные соединения формул III, IV, VI, VII, VIII, X, XIII, XV, XVI, XVIII, XIX, XXII и XXIII являются новыми соединениями и представляют собой дальнейший предмет настоящего изобретения.
Соединения формулы II само по себе известны или могут быть получены обычными способами, такими как способы, описанные G.W. Rewcastle и W.A. Denny в Synth. Commun, 1985, 217-222.
Соединения формул V, IX, XI, XII, XIV, XVII, XX, XXI, XXIV и XXVI сами по себе известны или могут быть получены обычными способами.
Соединения формулы XXV само по себе известны или могут быть получены обычными способами. Так, например, соединения формулы XXV, где A обозначает атом кислорода, можно получать путем реакции производного 4-ацетамидофенола с дигалогеналканом Q-BCH2-Q с последующим кислотным гидролизом, используя, например, разбавленную соляную кислоту.
Там, где желательно выделять соединение изобретения в виде соли, например, физиологически совместимой соли, это может быть осуществлено путем взаимодействия соединения формулы I в форме свободного основания с соответствующей кислотой, предпочтительно с эквивалентным количеством, в пригодном растворителе, таком как спирт (например, этанол или метанол), водный спирт, (например, водный этанол), галогенуглеводород (например, дихлорметан), сложный эфир (например, этилацетат) или простой эфир (например, тетрагидрофуран), или смесь двух или более таких растворителей.
Физически совместимые соли также могут быть получены из других солей, включая другие физиологически совместимые соли, соединения формулы I при применении обычных способов.
Нужно также принимать во внимание, что в вышеуказанных многостадийных процессах, различные способы, описанные для введения требуемых в целевом продукте желательных групп, можно осуществлять в различных последовательностях из описанных последовательностей. Последовательность реакций в многостадийных процессах должна выбираться в таком порядке, чтобы используемые реакционные условия не затрагивали групп в молекуле, которые желательны в целевом продукте.
Изобретение далее иллюстрируется следующими промежуточными продуктами и примерами, которые никоим образом не ограничивают объема охраны изобретения. Все температуры даны в градусах Цельсия (oC). 1H-ЯМР-Спектры получают в разбавленных растворах в CDCl3, если не указано ничего другого. Растворители, которые указаны, высушиваются над сульфатом натрия. Используемый для колоночной хроматографии силикагель марки Merck 60, 230-400 меш. Используются следующие сокращения: ТГФ = тетрагидрофуран: ДМФ = диметилфомамид.
Промежуточное соединение I.
(а) 1,2,3,4-Тетрагидро-6,7-диметокси-2-(3-(4-нитрофенокси) пропил)изохинолин
Смесь 1-(3-бромпропокси)-4-нитробензола (10 г), 1,2,3,4-тетрагидро-6,7-диметоксиизохинолин-гидрохлорида (8,8 г) и карбоната калия (10,6 г) в ДМФ (100 мл) нагревают при 100oC в течение 16 часов. Смесь затем отфильтровывают и фильтрат выпаривают. Остаток обрабатывают водой и экстрагируют дихлорметаном. Органический слой промывают водой, сушат и выпаривают с получением масла, которое кристаллизуется из эфира, давая титульное соединение (11,3 г), т.пл. 100oC.
Следующие соединения получают подобным получению промежуточного соединения 1а образом:
(б) 1,2,3,4-Тетрагидро-6,7-диметокси-2-(3)(4-нитрофенил(тио)- пропил)изохинолин
Титульное соединение (5,3 г) получают в виде масла (которое потом кристаллизуется) из 1-((3-бромпропил)тио)-4-нитробензола (7,0 г) и 1,2,3,4-тетрагидро-6,7-диметоксиизохинолин-гидрохлорида (5,8 г).
ЯМР включает: δ = 4,05 (6H, с., 2хOCH3).
(в) 1,2,3,4-Тетрагидро-6,7-диметокси-2-(2-(4-нитрофенил(этил)- изохинолин
Титульное соединение (16 г) получают в виде твердого вещества из 1-(2-бромэтил)-4-нитробензола (10 г) и 1,2,3,4-тетрагидро-6,7-диметоксиизохинолина (10,9 г). Т. пл. 118oC, ЯМР-спектр включает δ = 3,9 (6H, с., 2xOCH3).
(г) 1,2,3,4-Тетрагидро-6,7-диметокси-2-(4-(4-нитрофенил) бутил)-изохинолин
Целевое соединение (12,6 г) получают в виде масла из 1-(4-бромбутил)-4-нитробензола (12,5 г) и 1,2,3,4-тетрагидро-6,7-диметоксиизохинолин-гидрохлорида (11,1 г). Продукт очищают колоночной хроматографией, элюируя смесью дихлорметана с метанолом (99:1).
ЯМР-спектр включает δ 3,85 (6H, с., 2xOCH3)
Промежуточное соединение 2
(а) 4-(3-(1,2,3,4-Тетрагидро-5,6-диметокси-2-изохинолинил) пропокси)-аминобензол
Раствор промежуточного соединения 1(а) (16 г) в этаноле (200 мл) гидрируют при комнатной температуре и при атмосферном давлении в присутствии 10%-ного палладия-на-угле (1,6 г). После полного поглощения водорода, катализатор отфильтровывают и раствор концентрируют с получением титульного соединения (14,7 г) в виде масла, которое кристаллизуется из гексана. Т. пл. 100oC.
(б) 4-((3-(1,2,3,4-Тетрагидро-6,7-диметокси-2-изохинолинил/- пропил)-тио)-аминобензол
Промежуточное соединение 1(б) (5,3 г) растворяют в смеси метанола с концентрированной соляной кислотой (5 мл) при комнатной температуре и при перемешивании. Порошок железа (3,8 г) затем добавляют порциями и смесь кипятят с обратным холодильником в течение 1,5 часов. Смесь затем охлаждают, выливают на лед, подщелачивают гидроксидом натрия и экстрагируют этилацетатом. Органический слой промывают водой, сушат и выпаривают, получая титульное соединение (4,35 г) в виде масла. ИК-спектр: частота NH2 : 3350 см-1.
(в) 4-(2-(1,2,3,4-Тетрагидро-6,7-диметокси-2-изохинолинил)- этил)-аминобензол
Промежуточное соединение 1(в) (14 г) восстанавливают согласно способу для промежуточного соединения 2(б), получая титульное соединение (12 г) в виде твердого вещества. Т. пл. 120oC.
(г) 4-(4-(1,2,3,4-Тетрагидро-6,7-диметокси-2-изохинолинил)- бутил)-аминобензол
Промежуточное соединение 1(г) (8,5 г) восстанавливают согласно способу для промежуточного соединения (2а). Продукт очищают путем колоночной хроматографии, элюируя смесью дихлорметана с метанолом (99:1), и получают титульное соединение (4,3 г) в виде масла, которое затвердевает. ИК-спектр: частота NH2 : 3350 см-1.
Промежуточное соединение 3
(а) 1,2,3,4-Тетрагидро-6,7-диметокси-2-((4-нитрофенокси) ацетил)-изохинолин
Смесь (4-нитрофенокси)-уксусной кислоты (50 г) и тионилхлорида (150 мл) кипятят с обратным холодильником в течение 3 часов. Раствор концентрируют и затем выпаривают вместе с бензолом, получая 4-нитрофеноксиацетилхлорид в виде твердого вещества. Раствор этого твердого вещества (9,4 г) в ацетоне (100 мл) добавляют по каплям к перемешиваемой смеси 1,2,3,4-тетрагидро-6,7-диметоксиизохинолин-гидрохлорида (10 г) и гидрокарбоната натрия (9 г) в ацетоне (100 мл) при 0oC. Перемешивание продолжают при комнатной температуре в течение 16 часов, смесь затем отфильтровывают и фильтрат концентрируют. Остаток обрабатывают водой и экстрагируют дихлорметаном. Органический слой промывают водой, сушат и концентрируют, получая титульное соединение (6,6 г) в виде масла. ИК-спектр: частота CO: 1650 см-1.
Способом, подобным способу получения промежуточного соединения 3(а), получают следующее соединение:
(б) 1,2,3,4-Тетрагидро-6,7-диметокси-2-[3-(4-нитрофенил)-1- оксопропил] -изохинолин
Целевое соединение (12,3 г) получают в виде твердого вещества, с т. пл. 134oC из 4-нитробензолпропановой кислоты (9,75 г) и 1,2,3-тетрагидро-6,7-диметоксиизохинолина (11,6 г).
Промежуточное соединение 4.
(а) 2-((4-Аминофенокси)ацетил)-1,2,3,4-тетрагидро-6,7- диметоксиизохинолин
Промежуточное соединение 3(а) (6,6 г) растворяют в смеси метанола (100 мл) с концентрированной соляной кислотой (50 мл) при комнатной температуре и при перемешивании. Порошок железа (5 г) затем добавляют порциями и смесь кипятят с обратным холодильником в течение 3 часов. Смесь затем охлаждают, выливают на лед, подщелачивают гидроксидом натрия и экстрагируют этилацетатом. Органически слой промывают водой, сушат и выпаривают, получая титульное соединение (4 г) в виде масла. ИК-спектр: частота NH2: 3360 см-1.
(б) 2-(3-(4-Аминофенил)-1-оксопропил)-1,2,3,4-тетрагидро-6,7- диметокси-изохинолин
Раствор промежуточного соединения 3(б) (12 г) в смеси этанола с диоксаном (18 мл, 5:1) гидрируют при комнатной температуре и при атмосферном давлении в присутствии 10%-ного палладия-на-угле (1,2 г). После полного поглощения водорода катализатор отфильтровывают и раствор концентрируют, получая титульное соединение (11 г) в виде твердого вещества. ИК-спектр: частота NH2: 3360 см-1, частота CO: 1650 см-1.
Промежуточное соединение 5
(а) 4-(2-(1,2,3,4-Тетрагидро-6,7-диметокси-2-изохинолинил)-этокси)-аминобензол
Раствор промежуточного соединения 4(а) (4 г) в ТГФ (50 мл) прикапывают к перемешиваемой суспензии литийалюминийгидрида (1,8 г) в ТГФ (20 мл) при комнатной температуре, и смесь кипятят с обратным холодильником в течение 3 часов. К охлажденной смеси осторожно добавляют воду, затем отфильтровывают, промывают с помощью ТГФ, выпаривают и экстрагируют дихлорметаном. Органический слой сушат и выпаривают, получая титульное соединение (1,5 г) в виде масла. ИК-спектр: частота NH2: 3350 см-1.
Подобным получению промежуточного соединения 5(а) образом получают следующие соединения:
(б) 4-(3-(1,2,3,4-Тетрагидро-6,7-диметокси-2-изохинолинил)пропил-аминобензол
Целевое соединение (8,6 г) получают в виде твердого вещества с т.пл. 138oC путем восстановления промежуточного соединения 4(б) (11 г).
Промежуточное соединение 6
(а) 1-(3-Бромпропокси)-3-метокси-4-нитробензол
Смесь промежуточного соединения 18 (2,4 г), 1,3-дибромпропана (7,5 мл) и карбоната калия (2,2 г) в ДМФ (30 мл) перемешивают при комнатной температуре в течение 24 часов. Смесь отфильтровывают и фильтрат выпаривают досуха. Остаток обрабатывают водой и экстрагируют дихлорметаном. Органический экстракт затем промывают с помощью 5%-ного раствора гидроксида натрия и рассолом, сушат и концентрируют в вакууме, получая титульное соединение (3,5 г) в виде масла
ЯМР-спектр: δ = 2,3 (2H, м, CH2); 3,6 (2H,т., CH2Br); 3,8 (3H, с., OCH3); 4,1 (2H, т., CH2O).
Следующие соединения получают подобным получению промежуточного соединения 6(а) образом:
(б) 1-(3-Бромпропокси)-3-метил-4-нитробензол
Титульное соединение (33 г) получают в виде масла из 3-метил-4-нитро-фенола (25 г) и 1,3-дибромпропана (83 мл). ЯМР-спектр: δ = 2,3 (2H, м, CH2); 2,5 (3H, c., CH3); 3,6 (2H, т., CH2Br); 4,1 (2H, т., OCH2).
(в) 1-(3-Бромпропокси)-3-этил-4-нитробензол
Титульное соединение получают из 3-этил-4-нитрофенола и 1,3-дибромпропана. ЯМР-спектр: δ = 1,23 (т., 3H, CH3-CH2-); 2,2 (м., 2H, CH2-CH2-CH2); 2,8 (к.,2H, CH2-CH3); 3,5 (т., 2H, CH2Br); 4,1 (т.,2H, O-CH2-); 6,6 (м., 2H, Ar); 7,8 (д., 2H, Ar)
Промежуточное соединение 7.
(a) 1,2,3,4-Тетрагидро-6,7-диметокси-2-(3-(3-метокси-4-нитрофенокси)- пропил)-изохинолин
Смесь промежуточного соединения 6(a) (0,7 г), 1,2,3,4-тетрагидро-6,7-диметоксиизохинолина (0,4 г) и карбоната калия (0,36 г) в ДМФ (25 мл) нагревают при 60oC в течение 16 часов. Смесь отфильтровывают и фильтрат выпаривают. Остаток обрабатывают водой и экстрагируют дихлорметаном. Органический слой сушат, концентрируют и полученный остаток очищают путем колоночный хроматографии, элюируя смесью дихлорметана с метанолом (99:1), получают титульное соединение (0,64 г) в виде масла. ЯМР-спектр: δ = 3,8 (9H, 2c., 3xOCH2).
Подобным получению промежуточного соединения 7(a) образом получают следующее соединение:
(б) 1,2,3,4-Тетрагидро-6,7-диметокси-2-(3-(3-метил-4-нитрофенокси)-пропил) -изохинолин
Титульное соединение (5,3 г) получают в виде масла из промежуточного соединения 6(б) (5,7 г) и 1,2,3,4-тетрагидро-6,7-диметоксиизохинолина (4,0 г). ЯМР-спектр: δ = 2,5 (3H, с., СH3); 3,8 (6H, c., 2xOCH3).
Промежуточное соединение 8
(а) 2-Метокси-4-(3-(1,2,3,4-тетрагидро-6,7-диметокси-2-изохинолин) -пропокси)-аминобензол)
Раствор промежуточного соединения 7(а) (0,64 г) в этаноле (25 мл) гидрируют при комнатной температуре и при атмосферном давлении в присутствии 10%-ного палладия-на-угле (60 мг). После окончания поглощения водорода, катализатор отфильтровывают и раствор концентрируют в вакууме, получая титульное соединение (0,4 г) в виде твердого вещества, ЯМР-спектр: δ = 3,8 (9H, c., 3xOCH3); 3,0 (2H, ш.с., NH2).
Подобным получению промежуточного соединения 8(а) образом получают следующее соединение:
(б) 2-Метил-4-(3-(1,2,3,4-тетрагидро-6,7-диметокси-2-изохинолинил)-пропокси)- аминобензол
Титульное соединение (4,8 г) получают в виде масла (которое затем кристаллизуется) из промежуточного соединения 7(б) (5,3 г). ЯМР-спектр: δ = 2,1 (3H, с., CH3), 3,8 (6H, с., 2xOCH3).
Промежуточное соединение 9.
(а) 3-Метил-4-нитробензолуксусная кислота
3-Метил-4-нитробензоилхлорид (10 г) в эфире (100 мл) прикапывают к раствору диазометана (получен из 30 г N-метил-N-нитрозо п-толуол-сульфонамида) при 0oC. Реакционную смесь перемешивают при комнатной температуре в течение 3 часов и затем концентрируют в вакууме: получают диазокетон в виде твердого вещества. Этот диазокетон в диоксане (100 мл), затем прикапывают к раствору оксида серебра в воде (получен из нитрата серебра (20 г)) и разбавлен гидроксидом натрия (100 мл)). Смесь перемешивают в течение 3,5 часов при 75-80oC и отфильтровывают. Фильтрат разбавляют водой, подкисляют раствором азотной кислоты и продукт экстрагируют горячим диизопропиловым эфиром, обрабатывают рассолом и концентрируют в вакууме, получая титульное соединение (6 г) в виде твердого вещества, т.пл. 95oC.
Таким же путем получают следующее соединение:
(б) 3-Метокси-4-нитробензолуксусная кислота, т.пл.130-131oC.
Из 3-метокси-4-нитробензоилхлорида.
Промежуточное соединение 10. Этил-3-(3-окси-4-нитрофенил)-2-пропеноат
К раствору 3-окси-4-нитробензальдегида (5 г) в толуоле (50 мл) добавляют карбоэтоксиметилентрифенилфосфоран (8,9 г), и смесь кипятят с обратным холодильником в течение 2 часов. Смесь затем концентрируют и остаток очищают путем колоночной хроматографии, элюируя смесью циклогексана с этилацетатом (6: 4), при получении титульного соединения (6,2г) в виде твердого вещества. Т.пл.95oC.
Промежуточное соединение 11. Этил-3-(3-метокси-4-нитрофенил)-2-пропеноат
К раствору промежуточного соединения 10 (5,88 г) в ДМФ (50 мл) добавляют карбонат калия (4,4 г) и метилиодид (4 мл). Смесь перемешивают при комнатной температуре в течение 2 часов и затем концентрируют в вакууме. Остаток обрабатывают водой и экстрагируют дихлорметаном. Органический экстракт сушат и концентрируют, получая титульное соединение (6,2 г) в виде твердого вещества. Т. пл. 130oC.
Промежуточное соединение 12. 3-(3-Метокси-4-нитрофенил)-2-пропеновая кислота
К суспензии промежуточного соединения 11( 6,2 г) в этаноле (50 мл) добавляют 1н. раствор гидроксида натрия (50 мл). Смесь кипятят с обратным холодильником в течение 1 часа и затем выливают на расколотый лед. Добавляют 1 н. раствор соляной кислоты (60 мл) и осадок отфильтровывают, получая титульное соединение (4 г) в виде твердого вещества. ЯМР-спектр (DMCO-d6): δ = 8,95 (3H. с., OCH3).
Промежуточное соединение 13. 3-(3-Этокси-4-нитрофенил)-2-пропеновая кислота
Используя реакции, подобные таковым, описанным для промежуточных соединений 11 и 12, получают титульное соединение (3.1 г) в вине твердого вещества, т. пл. 272oC, из промежуточного соединения 10 (4,0 г), этилиодида (4 мл) и карбоната калия (2,6 г), с последующим омылением сложноэфирной функции.
Промежуточное соединение 14
(a) 1,2,3,4-Тетрагидро-6,7-диметокси-2-(3-метокси-4-нитрофенил) -1-оксо-2-пропенил)-изохинолин
Смесь промежуточного соединения 12 (4,9 г) и 1-оксибензотриазола (2,95 г) в ДМФ (100 мл) перемешивают при комнатной температуре в течение 10 минут. Добавляют 1,2,3,4-Тетрагидро-6,7-диметоксиизохинолин (5 г), затем дициклогексилкарбодиимид (4,52 г) и смесь перемешивают при комнатной температуре в течение 16 часов и после этого отфильтровывают.
Фильтрат концентрируют в вакууме, обрабатывают разбавленной соляной кислотой, затем разбавленным раствором гидроксида натрия и экстрагируют дихлорметаном. Органический экстракт сушат, концентрируют в вакууме и остаток очищают путем колоночной хроматографии, элюируя сначала смесью этилацетата с циклогексаном (4:6), затем этилацетатом, получая при этом титульное соединение, которое кристаллизуется из смеси этилацетата с эфиром и получается в виде кристаллов (6,5 г). ЯМР-спектр: δ = 3,85 (6H, с., 2xOCH3); 3,95 (3H, с. , OCH3).
Следующие соединения получают аналогичным получению промежуточного соединения 14(a) образом:
(б) 2-(3-(3-Этокси-4-нитрофенил)-1-оксо-2-пропенил)1,2,3,4- тетрагидро-6,7-диметоксиизохинолин
Титульное соединение (5,3 г) получают в виде твердого вещества, т. пл. 152oC, из промежуточного соединения 13 (3,0 г) и 1,2, 3,4-тетрагидро-6,7-диметоксиизохинолина (2,5 г).
(в) 1,2,3,4-Тетрагидро-6,7-диметокси-2-((3-метил-4-нитрофенил)- ацетил)-изохинолин
Целевое соединение (2,8 г) получают в виде масла из промежуточного соединения 9 (а) (1,8 г) и 1,2,3,4-тетрагидро-6,7-диметоксиизохинолина (1,9 г).
ИК-спектр: частота CO: 1650 см-1.
Промежуточное соединение 15
(а) 2-(3-(4-Амино-3-метоксифенил)-1-оксопропил)-1,2,3,4-тетрагидро-6,7- диметоксиизохинолин
Раствор промежуточного соединения 14(а) (6,5 г) в смеси метанола с этилацетатом (1: 1) (100 мл) гидрируют при комнатной температуре и атмосферном давлении в присутствии 10%-ного палладия-на-угле (0,3 г). После окончания поглощения водорода, катализатор отфильтровывают и раствор концентрируют в вакууме, получая титульное соединение (6 г) в виде масла. ЯМР-спекктр: δ = 3,8 (9H, с., 3xOCH3).
Следующие соединения получают аналогичным получению промежуточного соединения 15 (а) образом:
(б) 2-(3-(4-Амино-3-этоксифенил)-1-оксопропил)-1,2,3,4-тетрагидро-6,7- диметоксиизохинолин.
Целевое соединение (4,5 г) получают в виде масла от промежуточного соединения 14 (б) (5,3 г). ИК-спектр: частота CO: 1640 см-1, частота NH2: 3450 см-1.
(в) 2-((4-Амино-3-метилфенил)-ацетил)-1,2,3,4-тетрагидро-6,7- диметоксиизохинолин
Титульное соединение (2,4 г) получают в виде масла из промежуточного соединения 14(в) (2,8 г), ИК-спектр: частота CO: 1650 см-1, частота NH2: 3340 - 3440 см-1.
Промежуточное соединение 16
(а) 2-Метокси-4-(3-(1,2,3,4-тетрагидро-6,7-диметокси-2-изохинолинил] -пропил]-аминобензол
Раствор промежуточного соединения 15(а) в ТГФ (30 мл) прикапывают к перемешиваемой суспензии литийалюминий гидрида (1,84 г) в ТГФ (50 мл) при комнатной температуре и смесь кипятят с обратным холодильником в течение 2 часов. Осторожно добавляют воду к охлажденной смеси, которую затем фильтруют. Фильтрат концентрируют в вакууме, обрабатывают водой и экстрагируют дихлорметаном. Органический слой сушат и концентрируют в вакууме, получая титульное соединения (4,2 г) в виде масла. ИК-спектр: частота NH2 3340 - 3440 см-1.
Аналогичным получению промежуточного соединения 16(а) образом получают следующие соединения:
(б) 2-Этокси-4-(3-(1,2,3,4-тетрагидро-6,7-диметокси-2-изохинолинил) -пропил)-аминобензол
Титульное соединение (2,5 г) получают в виде масла из промежуточного соединения 15(б) (4,5 г). ИК-спектр, частота NH2: 3340 - 3440 см-1.
(в) 2-Метил-4-(2-(1,2,3,4-тетрагидро-6,7-диметокси-2-изохинолинил/этил) -аминобензол
Титульное соединение (1,7 г) получают в виде твердого вещества, т. пл. 105oC, из промежуточного соединения 15 (в) (2,4 г).
Промежуточное соединение 17. 3-Хлор-4-нитрофенол
Концентрированную азотную кислоту (10 мл) в уксусной кислоте (30 мл) прикапывают к охлажденному раствору 3-хлорфенола (10 г) в уксусной кислоте (10 мл). Спустя 1 час при -5oC, смесь выливают на лед, экстрагируют эфиром, сушат над сульфатом натрия и выпаривают. Остаток затем очищают путем колоночной хроматографии, элюируя смесью гексана с этилацетатом (85-15), с получением титульного соединения (9 г). Т. пл. 120oC.
Промежуточное соединение 18. 3-Метокси-4-нитрофенол
Раствор промежуточного соединения 17 (4,4 г) в метаноле (15 мл) добавляют к раствору натрия (5,8 г) в метаноле (60 мл) и смесь перемешивают в автоклаве в течение 16 часов при 100oC. Смесь охлаждают и выливают на лед и подкисляют концентрированной соляной кислотой. Метанол затем выпаривают в вакууме, вызывая кристаллизацию титульного соединения (3,5 г). Т. пл. 142oC.
Промежуточное соединение 19. 1-(2-Хлорэтокси)-3-метил-4-нитробензол
Смесь 3-метил-4-нитрофенола (10 г) 1-бром-2-хлорэтана (16 мл) и гидроксида натрия (2,9 г) в воде (50 мл) перемешивают при температуре кипения с обратным холодильником в течение 16 часов. Смесь разбавляют водой и продукт экстрагируют метиленхлоридом. Органический экстракт высушивают над сульфатом натрия и концентрируют в вакууме, получая титульное соединение в виде масла (10,81 г). ЯМР-спектр: δ = 2,5 (с., 3H, -CH3); 3,9 (т, 2H, CH2-O) и 4,3 (т, 2H, -CH2-Cl).
Промежуточное соединение 20
(а) 3,4-Диметокси-N-метилбензолэтанамин
3,4-Диметоксибензолэтанамин (100 г) смешивают с бензальдегидом (59 г), и выпаривают на роторном испарителе, получая масло. Затем добавляют метилиодид (69 мл) и смесь нагревают в течение 48 часов при 40oC и затем в течение 3 часов кипятят с 80%-м этанолом (500 мл). После того, как половина этанола испарится, раствор обрабатывают эфиром ( 1 литр), получая твердое вещество, которое отфильтровывают, промывают эфиром, обрабатывают разбавленным раствором гидроксида натрия и экстрагируют эфиром, получая титульное соединение (80 г) в виде масла, которое перегоняют при пониженном давлении. Т. кип. 92 - 95oC при 0,1 мм рт. ст.
(б) 3,4-Диметокси-N-метилбензолметанамин
3,4-Диметоксибензолметанамин (100 г) смешивают с бензальдегидом (64 г) и выпаривают на роторном испарителе с получением масла. Затем добавляют метилиодид и смесь нагревают в течение 48 часов при 40oC и затем кипятят с 80%-ным этанолом (800 мл) в течение 3 часов. После того как половина этанола испарится, раствор обрабатывают эфиром (1 литр), получая твердое вещество, которое отфильтровывают, промывают эфиром, обрабатывают разбавленным раствором гидроксида натрия и экстрагируют эфиром, получая титульное соединение (69 г) в виде масла, которое перегоняют при пониженном давлении. Т. кип. 91oC при 0,03 мм рт. ст.
Следующие амины получают подобным получению промежуточных соединений 20(а) и 20(б) образом:
(в) 4-фтор-N-метилбензолметанамин в виде масла. ИК-спектр: включает пик при 3300 см-1 (NH). Их 4-фторбензолметанамина и метилиодида.
(г) 4-Метокси-N-метилбензолметанамин в виде масла. ИК-спектр включает пик при 3310 см-1 (NH). Из 4-метоксибензолметанамина и метилиодида.
(д) 4-Метокси-N-метилбензолэтанамин в виде масла. ИК-спектр включает пик при 3310 см-1 (NH). Из 4-метоксибензолметанамина и метилиодида.
(е) 4-(Метилтио)-N-метилбензолэтанамин в виде масла. ИК-спектр включает пик при 3310 см-1 (NH). Из 4-(метилтио)бензолметанамина и метилиодида.
(ж) 4-Метил-N-метилбензолэтанамин в виде масла. ИК-спектр включает пик при 3310 см-1 (NH). Из 4-метилбензолметанамина и метилиодида.
Промежуточное соединение 21
(а) 3,4-Диметокси-N-метил-N-(3-(3-метил-4-нитрофенокси)пропил)- бензолметанамин
Смесь промежуточного соединения 6(б) (6 г), промежуточного соединения 20(б) (4 г) и карбоната калия (3,3 г) в ДМФ (80 мл) нагревают при 60oC в течение 36 часов. Смесь отфильтровывают и фильтрат выпаривают. Остаток вносят в воду и экстрагируют дихлорметаном. Органический слой промывают водой, сушат над сульфатом натрия, отфильтровывают и выпаривают. Затем остающееся масло хроматографируют, элюируя смесью дихлорметана с метанолом (99:1), получая титульное соединение в виде масла (4,6 г).
ЯМР-спектр: δ = 2,2 (с., 3H,-CH3); 2,4 (с., 3H, N-CH3); и 3,8 (с., 6H, 2-OCH3).
Таким же путем получают следующие соединения:
(б) 3,4-Диметокси-N-(3-(3-метокси-4-нитрофенокси)-пропил)-N- метил-бензолметанамин
В виде масла. Из промежуточного соединения 6(а) и промежуточного соединения 20(б). ЯМР-спектр: δ = 2,2 (с., 3H, N-CH3); 3,85-3,9 (2 с., 3H-6H, 3 O-CH3).
(в) 3,4-Диметокси-N-(3-(3-этил)-4-нитрофенокси)пропил)-N- метил-бензолметанамин в виде масла. Из промежуточного соединения 6(в) и промежуточного соединения 20(б). ЯМР-спектр: δ = 2,2 (с., 3H, N-CH3); 3,85-3,9 (2 с., 6H, 20-CH3).
(г) 3,4-Диметокси-N-метил-N-(2-(3-метил-4-нитрофенокси)-этил/- бензолметанамин в виде масла. Из промежуточного соединения 19 и 20(б). ЯМР-спектр: δ = 2,3 (с., 3H, N-CH3); 2,5 (2 с., 3H, N-CH3); 3,8 (с., 6H, 2-OCH3).
Промежуточное соединение 22
(а) N-(3-(4-Амино-3-метилфенокси)пропил)-3,4-диметокси-N- метилбензол-метанамин
Раствор промежуточного соединения 21(а) (4,6 г) в этаноле (100 мл) гидрируют при комнатной температуре в присутствии 10%-ного палладия-на-угле (450 мг). По окончании поглощения водорода катализатор отфильтровывают и раствор концентрируют с получением титульного соединения (3,7 г) в виде масла. ЯМР-спектр: δ = 2,0 (с., 3H, CH3); 2,1 (2 с., 3H, N-CH3); 3,7 (с., 6H, 2 OCH3).
Таким же путем получают следующие соединения:
(б) N-(3-(4-Амино-3-метоксифенокси)пропил)-3,4-диметокси-N- метил-бензолметанамин в виде масла. Из промежуточного соединения (21 б). ЯМР: δ = 2,2 (с., 3H, N-CH3); 3,85-3,9 (с., 3H, OCH3); 3,9 (с., 6H, 2 OCH3).
(в) N-(3-(4-Амино-3-этилфенокси)пропил)-3,4-диметокси-N- метилбензолметанамин в виде масла. Из промежуточного соединения 21 (в).
ЯМР-спектр: δ = 2,1 (с., 3H, N-CH3); 3,7 (с., 6H, 2 OCH3).
(г) N-(2-(4-Амино-3-этилфенокси)этил)-3,4-диметокси-N- метилбензолметанамин в виде масла. Из промежуточного соединения 21 (г).
ЯМР-спектр: δ = 2,0 (с., 3H, N-CH3); 2,2 (с., 3H, N-CH3); 3,8 (с., 6H, 2OCH3).
Промежуточное соединение 23. Диэтил-(3-метил-4-нитробензил)- малонат
К раствору этилена натрия (получен из 1,35 г натрия в этаноле (30 мл)) добавляют диэтилмалонат (9,2 мл) и затем прикапывают 3-метил-4-нитробензилбромид (13,4 г). Смесь перемешивают 30 минут при комнатной температуре, затем 30 минут кипятят с обратным холодильником и после этого концентрируют. Остаток обрабатывают водой и гексаном, осадок отфильтровывают и фильтрат экстрагируют диэтиловым эфиром. Органический экстракт сушат над сульфатом натрия и концентрируют, получая титульное соединение в виде масла (4 г). ЯМР-спектр: δ = 1,15 (т., 6H, 2xCH3-CH2); 2,5 (с., 3H, CH3-Ar); 3,16 (с., 2H, CH2-Ar); 4,0 (к., 4H, 2xCH2CH3); 7,0 (м., 2H, Ar); 7,7 (д., 1H, Ar).
Промежуточное соединение 24. 3-(3-Метил-4-нитрофенил)- пропионовая кислота
Промежуточное соединение 23 (4 г) прикапывают к раствору гидроксида калия (3,1 г) в воде и смесь перемешивают при температуре кипения с обратным холодильником в течение 2 часов, разбавляют водой, промывают диэтиловым эфиром и затем подкисляют разбавленным раствором соляной кислоты. После экстракции диэтиловым эфиром и концентрирования концентрат нагревают при 130oC в течение 3 часов, причем получают титульное соединение в виде твердого вещества желтого цвета (2,3 г).
ЯМР-спектр (CDCl3): δ = 2,5 (с., 3H, CH3); 2,9 (м., 4H, 2 CH2).
Промежуточное соединение 25
(а) N-(3,4-Диметоксифенил/-метил)-N-метил-3-метил-4- нитробензолэтанамид.
Смесь промежуточного соединения 9(а) (2 г) и 1-оксибензотриазода (1,6 г) в ДМФ (35 мл) перемешивают при комнатной температуре в течение 5 минут. Добавляют промежуточное соединение 20(б) (1,9 г) в ДМФ (20 мл), затем дициклогексилкарбодиимид (2,1 г) и смесь перемешивают при комнатной температуре в течение 16 часов и затем отфильтровывают. Фильтрат концентрируют в вакууме, обрабатывают разбавленным раствором гидроксида натрия и экстрагируют дихлорметаном. Объединенные, высушенные органические экстракты выпаривают и остаток очищают путем колоночной хроматографии, элюируя смесью дихлорметана с метанолом (97:3), причем получают титульное соединение (1,7 г) в виде масла. ИК-спектр включает сигнал при 1640 см-1 (CO).
Таким же путем получают следующие соединения:
(б) N-[[3,4-Диметоксифенил]метил]-N-метил-3-метокси-4- нитробензолэтанамид
Из промежуточного соединения 9(б) и промежуточного соединения 20(б) ИК-спектр включает сигнал при 1645 см-1 (CO).
(в) N-[[3,4-Диметоксифенил]-метил]-N-метил-3-метил-4- нитробензолпропанамид в виде масла. Из промежуточного соединения 24 и 20(б). ЯМР-спектр (CDCl3): δ = 2,5 (с., 3H, -CH3); 2,9 (с., 3H, N-CH3); 3,8 (с., 6H, 2 OCH3).
Промежуточное соединение 26.
(а) 4-Амино-3-метил-N-[[3,4-диметоксифенил]метил]-N-метил- бензолэтанамид
Раствор промежуточного соединения 25(а) (1,7 г) в этаноле (60 мл) гидрируют при комнатной температуре в присутствии 10%-ного палладия-на-угле (0,25 г). По окончании поглощения водорода, катализатор отфильтровывают и раствор концентрируют, получая титульное соединение (1,4 г) в виде масла. ИК-спектр включает сигналы при 3450-3350 см-1 (NH2) и 1630 см-1 (CO).
Таким же путем получают следующие соединения:
(б) 4-Амино-3-метокси-N-[[3,4-диметоксифенил] метил]-N- метилбензолэтанамид. Из промежуточного соединения 25(б). ИК-спектр включает сигналы при 3450-3350 см-1 (NH2) и 1625 см-1 (CO).
(в) 4-Амино-3-метил-N-[[3,4-диметоксифенил] метил]-N- метилбензолпропанамид. Из промежуточного соединения 25(в). ЯМР-спектр: δ = 2,1 (3H, с, CH3): 2,75 (3H, с., N-CH3): 3,8 (6H, с., 2 OCH3).
Промежуточное соединение 27.
(а) 4-Амино-3-метил-N-[[3,4-диметоксифенил]метил]-N- метилбензолэтанамин
Раствор промежуточного соединения 26(а) (1,4 г) в ТГФ (50 мл) прикапывают к перемешиваемой суспензии литийалюминийгидрида (0,7 г) в ТГФ (30 мл) при комнатной температуре и смесь кипятят с обратным холодильником в течение 3 часов. К охлажденной смеси осторожно добавляют воду, затем смесь отфильтровывают через целитовую прокладку, промывают ТГФ, выпаривают и экстрагируют эфиром. Эфирные экстракты сушат и выпаривают с получением титульного соединения (1 г) в виде масла. ИК-спектр включает сигнал при 3450-3350 см-1 (NH2).
Таким же путем получают следующие соединения:
(б) 4-Амино-3-метокси-N-[[3,4-диметоксифенил]метил]-N- метилбензолэтанамин. Из промежуточного соединения 26(б). ИК-спектр включает сигнал при 3455-3345 см-1 (NH2).
(в) 4-Амино-3-метил-N-[[3,4-диметоксифенил] метил]-N- метилбензолпропанамин в виде масла. Из промежуточного соединения 26(в). ЯМР-спектр: δ = 2,0 (3H, с., -CH3): 2,1 (3H, с., N-CH3); 3,8 (6H, с., 2 OCH3).
Промежуточное соединение 28.
N-[[3,4-Диметоксифенил] метил] -N-метил-3-метокси-4- нитробензол-2-пропенамид
Смесь промежуточного соединения 12 (3 г) и 1-оксибензотриазола (1,95 г) в ДМФ (100 мл) перемешивают при комнатной температуре в течение 10 минут. Добавляют промежуточное соединение 20(б) (2,5 г) затем дициклогексилкарбодиимид (2,95 г) и смесь перемешивают при комнатной температуре в течение 16 часов, а затем отфильтровывают. Фильтрат концентрируют в вакууме, обрабатывают разбавленным раствором соляной кислоты, затем разбавленным раствором гидроксида натрия и экстрагируют метиленхлоридом. Органический экстракт сушат над сульфатом натрия и концентрируют. Остаток очищают путем колоночной хроматографии, элюируя этилацетатом, с получением титульного соединения (4,4 г) ЯМР-спектр: δ = 2,9 (3H, с., N-CH3): 3,85 (3H, с., OCH3): 3,9 (6H, с., 2 OCH3).
Промежуточное соединение 29. 4-Амино-3-метокси-N-(3,4-диметоксифенил)-метил)-N-метил- бензолпропанамид.
Раствор промежуточного соединения 28 (8,4 г) в смеси метанола с этилацетатом (1 : 1, 100 мл) гидрируют при комнатной температуре в присутствии 10%-ного палладия-на-угле (0,3 г). По окончании поглощения водорода, катализатор отфильтровывают и раствор концентрируют с получением титульного соединения (7,3 г в виде масла. ИК-спектр включает сигналы при 3450-3350 см-1 (NH2) и 1635 см-1 (CO).
Промежуточное соединение 30. 4-Амино-3-метокси-N-[[3,4-диметоксифенил] метил]-N-метилбензолпропанамин.
Раствор промежуточного соединения 29 (7,32 г) в тетрагидрофуране (100 мл) прикапывают к перемешиваемой суспензии литийалюминийгидрида (2,3 г) в тетрагидрофуране (100 мл) при комнатной температуре и смесь кипятят с обратным холодильником в течение 1 часа. Осторожно добавляют воду (20 мл) к охлажденной смеси, которую фильтруют через целитную прокладку, промывают диэтиловым спиртом, концентрируют и экстрагируют метиленхлоридом. Органический экстракт сушат над сульфатом натрия, выпаривают и продукт очищают путем колоночной хроматографии на силикагеле, элюируя смесью дихлорметана с метанолом (95: 5) с получением титульного соединения в виде масла (2,5 г), ИК-спектр включает сигнал при 3440-3340 см-1 (NH2).
Промежуточное соединение 31.
(а) N-[[3,4-диметоксифенил]метил]-N-метил-4-нитробензолбутанамид
Смесь 4-нитробензолбутановой кислоты (31 г) с тионилхлоридом (200 мл) кипятят с обратным холодильником в течение 1 часа. Раствор затем концентрируют и выпаривают вместе с бензолом с получением масла. Это масло растворяют в ацетоне (100 мл) и прикапывают к перемешиваемой смеси промежуточного соединения 20(б) (28, 6 г) с гидрокарбонатом натрия (35 г) в ацетоне (150 мл) при комнатной температуре. Перемешивание продолжают в течение 4 часов, смесь затем отфильтровывают и фильтрат концентрируют. Остаток выливают в воду и затем экстрагируют дихлорметаном. Органическую фазу выпаривают с получением титульного соединения (41,5 г) в виде масла. Перекристаллизация из этанола дает титульное соединение в виде твердого вещества. Т. пл. 90oC.
(б) N-[[3,4-Диметоксифенил]метил]-N-метил-4-нитробензолэтанамид.
Смесь 4-нитробензолуксусной кислоты (22 г) с тионилхлоридом (200 мл) кипятят с обратным холодильником в течение 3 часов. Раствор концентрируют и затем выпаривают совместно с бензолом, получая масло. Это масло растворяют в этаноле (100 мл) и прикапывают к перемешиваемой смеси промежуточного соединения 20(б) (22 г) и гидрокарбоната натрия (15,3 г) в ацетоне (100 мл) при комнатной температуре. Перемешивание продолжают в течение 6 часов, смесь затем отфильтровывают и фильтрат концентрируют. Остаток выливают в воду и экстрагируют этилацетатом. Органическую фазу промывают сначала разбавленным раствором гидроксида натрия, затем водой, сушат и концентрируют с получением титульного соединения (22,3 г) в виде масла. ИК-спектр включает пик при 1650 см-1 (CO).
Аналогичным получению промежуточного соединения 31(а) и промежуточного соединения 31(б) образом получают следующие амиды:
(в) N-(2-(3,4-Диметоксифенил)этил)-N-метил-4-нитробензобутанамид в виде масла. ИК-спектр включает пик при 1640 см-1 (CO). Из 4-нитробензолбутановой кислоты и промежуточного соединения 20(а).
(г) N-(2-(3,4-Диметоксифенил)этил)-N-метил-4- нитробензолпропанамид в виде масла. ИК-спектр включает пик при 1640 см-1 (CO). Из 4-нитробензолпропановой кислоты и промежуточного соединения 20(а).
(д) N-[2-[3,4-Диметоксифенил]этил]-N-метил-4- нитробензолэтанамид в виде масла. ИК-спектр включает пик при 1650 см-1 (CO). Из 4-нитробензолуксусной кислоты и промежуточного соединения (20а).
(е) N-[[3,4-Диметоксифенил]метил]-N-метил-4-нитробензолпропанамид в виде масла. ИК-спектр включает пик при 1640 см-1 (CO). Из 4-нитробензолпропановой кислоты и промежуточного соединения 20(б).
(ж) N-[[4-Метоксифенил] метил] -N-4-нитробензолпропанамид в виде масла. ИК-спектр включает пик при 1640 см-1 (CO). Из 4-нитробензолпропановой кислоты и промежуточного соединения 20(г).
(з) N-(2-(4-Метоксифенил)этил)-N-метил-4-нитробензолбутанамид в виде масла: ИК-спектр включает пик при 1650 см-1 (CO). Из 4-нитробензолбутановой кислоты и промежуточного соединения 20(д).
(и) N-[[4-Фторфенил]метил]-N-метил-4-нитробензолбутанамид в виде масла: ИК-спектр включает пик при 1640 см-1 (CO). Из 4-нитробензолбутановой кислоты и промежуточного соединения 20(в).
(к) N-[[4-[Метилтио] фенил]метил]-N-метил-4-нитробензолбутанамид в виде масла. ИК-спектр включает пик при 1640 см-1 (CO). Из 4-нитробензолбутановой кислоты и промежуточного соединения 20(е).
(л) N-[2-[4-Метоксифенил]этил]-N-метил-нитробензолэтанамид в виде масла. ИК-спектр включает пик при 1650 см-1 (CO).
Из 4-нитробензолуксусной кислоты и промежуточного соединения 29(д).
(м) N-[[3,4-Диметоксифенил] метил] -N-метил-4- нитробензолпентанамид в виде масла; ИК-спектр включает пик при 1650 см-1 (CO). Из 4-нитробензолпентановой кислоты и промежуточного соединения 20(б).
Промежуточное соединение 32
(а) 4-Амино-N-[[3,4-диметоксифенил]метил]-N-метилбензолбутанамид
Промежуточное соединение 31(a) (40 г) растворяют в смеси метанола (200 мл) и концентрированной соляной кислотой (160 мл) при комнатной температуре и при перемешивании. Медленно добавляют затем порошок железа (21 г) и реакционную смесь кипятят с обратным холодильником в течение 1 часа. Смесь затем выпаривают и подщелачивают с помощью раствора гидроксида натрия. Добавляют этилацетат (1 л) и смесь фильтруют. Органическую фазу промывают водой, сушат и выпаривают с получением титульного соединения (30 г) в виде масла, ИК-спектр включают пик при 1630 см-1 (CO) и пик при 3350 - 3430 см-1 (NH2).
(б) 4-Амино-N-[[3,4-диметоксифенил]метил]-N-метилбензолэтанамид
Промежуточное соединение 31(б) (22 г) растворяют в смеси метанола (300 мл) и концентрированной соляной кислоты (150 мл) при комнатной температуре и при перемешивании. Медленно добавляют затем порошок железа (18 г) и реакционную смесь кипятят с обратным холодильником в течение 3 часов. Смесь затем выпаривают, подщелачивают с помощью раствора гидроксида натрия и экстрагируют этилацетатом. Органическую фазу промывают водой, сушат и выпаривают с получением титульного соединения (14 г) в виде масла. ИК-спектр включает пики при 1620 см-1 (CO) и 3350 - 3450 см-1 (NH2).
Подобным получению промежуточных соединений 32(а) и 32(б) образом получают следующие соединения:
(в) 4-Амино-N-(2-(3,4-диметоксифенил)этил)-N- метилбензолбутанамид в виде масла. ИК-спектр включает пики при 1630 см-1 (CO) и 3330 - 3420 см-1 (NH2). Из промежуточного соединения 31(в).
(г) 4-Амино-N-(2-(3,4-диметоксифенил)этил)-N- метилбензолпропанамид в виде масла. ИК-спектр включает пики при 1630 см-1 (CO) и 3340 - 3420 см-1 (NH2). Из промежуточного соединения 31(г).
(д) 4-Амино-N-[2-[3,4-диметокси] этил] -N-метилбензолэтанамид в виде масла, ИК-спектр включает пики при 1640 см-1 (CO) и 3330 - 3420 см-1 (NH2). Из промежуточного соединения 31(д).
(е) 4-Амино-N-[[3,4-диметоксифенил] метил] -N- метилбензолпропанамид в виде масла; ИК-спектр включает пики при 1640 см-1 (CO) и 3350 - 3440 см-1 (NH2). Из промежуточного соединения 31(е).
(ж) 4-Амино-N-[[4-диметоксифенил] метил]-N-метилбензолпропанамид в виде масла, ИК-спектр включает пики при 1650 см-1 и 3330 - 3420 см-1 (NH2). Из промежуточного соединения 31(ж).
(з) 4-Амино-N-(2-(4-диметоксифенил)этил)-N- метилбензолбутанамид в виде масла, ИК-спектр включает пики при 1640 см-1 (CO) и 3340 - 3430 см-1 (NH2). Из промежуточного соединения 31(з).
(и) 4-Амино-N-[[4-фторфенил]метил]-N-метилбензолбутанамид в виде масла. ИК-спектр включает пики при 1640 см-1 (CO) и 3340 - 3430 см-1 (NH2). Из промежуточного соединения 31(и).
(к) 4-Амино-N-[[4-[метилтио] фенил]метил]-N-метилбензолбутанамид в виде масла. ИК-спектр включает пики при 1640 см-1 (CO) и 3340 - 3430 см-1 (NH2). Из промежуточного соединения 31(к).
(л) 4-Амино-N-(2-(4-метоксифенил)этил)-N- метилбензолэтанамид в виде масла. ИК-спектр включает пики при 1635 см-1 (CO) и 3340 - 3440 см-1 (NH2). Из промежуточного соединения 31(л).
(м) 4-Амино-N-[[3,4-диметоксифенил] метил] -N- метилбензолпентанамид в виде масла. ИК-спектр включает пики при 1630 см-1 (CO) и 3340 - 3420 см-1 (NH2). Из промежуточного соединения 31(м).
Промежуточное соединение 33
(а) 4-Амино-N-[[3,4-диметоксифенил]метил]-N-метилбензолбутанамин
Раствор промежуточного соединения 32(а) (30 г) в ТГФ (150 мл) прикапывают к перемешиваемой суспензии литийалюминийгидрида (10 г) в ТГФ (150 мл) при комнатной температуре и смесь кипятят с обратным холодильником в течение 3 часов. К охлажденной смеси осторожно добавляют воду, затем смесь фильтруют, промывают с помощью ТГФ, выпаривают, и экстрагируют эфиром. Объединенные эфирные экстракты сушат и выпаривают с получением титульного соединения (21 г) в виде масла. ИК-спектр включает пик при 3370 - 3440 см-1 (NH2).
(б) 4-Амино-N-[[3,4-диметоксифенил]метил]-N-метилбензолэтанамин
Раствор промежуточного соединения 32(б) (14 г) в ТГФ (100 мл) прикапывают к перемешиваемой суспензии литийалюминийгидрида (8 г) в ТГФ (100 мл) при комнатной температуре и смесь кипятят с обратным холодильником в течение 3 часов. К охлажденной смеси осторожно добавляют воду, затем смесь фильтруют, промывают ТГФ, выпаривают и экстрагируют эфиром. Объединенные эфирные экстракты сушат и выпаривают с получением титульного соединения (9,5 г) в виде масла.
ИК-спектр включает пик при 3360 - 3430 см-1 (NH2).
Аналогичным получению промежуточных соединений 33(а) и 33(б) образом получают следующие соединения:
(а) 4-Амино-N-(2-(3,4-диметоксифенил)этил)-N- метилбензолбутанамин в виде масла ИК-спектр включает пик при 3360 - 3430 см-1 (NH2).
Из промежуточного соединения 32 (в).
(г) 4-Амино-N-(2-(3,4-диметоксифенил)этил)-N- метилбензолпропанамин в виде масла. ИК-спектр включает пик при 3360 - 3460 см-1 (NH2).
Из промежуточного соединения 32 (г).
(д) 4-Амино-N-(2-(3,4-диметоксифенил)этил)-N- метилбензолэтанамин в виде масла. ИК-спектр включает пик при 3360 - 3430 см-1 (NH2).
Из промежуточного соединения 32(в).
(е) 4-Амино-N-((3,4-диметоксифенил)метил)-N- метилбензолпропанамин в виде масла. ИК-спектр включает пик при 3360 - 3440 см-1 (NH2).
Из промежуточного соединения 32 (е).
(ж) 4-Амино-N-((4-метоксифенил)метил)-N- метилбензолпропанамин в виде масла. ИК-спектр включает пик при 3360 - 3430 см-1 (NH2).
Из промежуточного соединения 32 (ж).
(з) 4-Амино-N-(2-(4-метоксифенил)этил)-N- метилбензолбутанамин в виде масла. ИК-спектр включает пик при 3330 - 3460 см-1 (NH2).
Из промежуточного соединения 32(з).
(и) 4-Амино-N-((4-фторфенил)метил)-N-метилбензолбутанамин в виде масла. ИК-спектр включает пик при 3350 - 3430 см-1 (NH2).
Из промежуточного соединения 32(и).
(к) 4-Амино-N-((4-метилтио)фенил)-метил-N-метилбензолбутанамин в виде масла. ИК-спектр включает пик при 3350 - 3430 см-1 (NH2).
Из промежуточного соединения 32(к).
(л) 4-Амино-N-(2-(4-метоксифенил)этил)-N-метилбензолэтанамин в виде масла. ИК-спектр включает пик при 3360 - 3440 см-1 (NH2).
Из промежуточного соединения 32(л).
(м) 4-Амино-N-((3,4-диметоксифенил)метил)-N- метилбензолпентанамин в виде масла. ИК-спектр включает пик при 3360 - 3440 см-1 (NH2).
Из промежуточного соединения 32(м).
Промежуточное соединение 34
(а) N-(2-(3,4-Диметоксифенил)этил)-N-метил-2- (4-нитрофенокси)ацетамид
Смесь (4-нитрофенокси)-уксусной кислоты (31 г) и тионилхлорида кипятят с обратным холодильником в течение 2 часов. Раствор концентрируют и выпаривают вместе с бензолом с получением твердого вещества. Твердое вещество растворяют в ацетона (250 см) и прикапывают к перемешиваемой смеси промежуточного соединения 20(а) (50 г) и гидрокарбоната натрия (22 г) в ацетоне (250 мл) при комнатной температуре. Перемешивание продолжают в течение 4 часов, смесь затем фильтруют и фильтрат концентрируют. Остаток обрабатывают водой и экстрагируют этилацетатом. Органическую фазу промывают сначала разбавленным раствором гидроксида натрия, затем водой, сушат и концентрируют. Перекристаллизация из этанола дает титульное соединение (82 г). Т. пл. 121oC.
Аналогичным получению промежуточного соединения 34(а) образом получают следующие соединения:
(б) N-((3,4-Диметоксифенил)метил)-N-метил-2- (4-нитрофенокси)ацетамид т. пл. 130oC. Из (4-нитрофенокси-уксусной кислоты и промежуточного соединения 20(б).
(в) N-метил-2-(4-нитрофенокси)-N-(фенилметил-ацетамид). Т.пл. 98oC. Из (4-нитрофенокси)уксусной кислоты и N-метилбензолметанамина.
(г) N-((3,4-Диметоксифенил)метил)-N-метил-2-(4-нитрофенилтио)- ацетамид в виде масла. ЯМР-спектр: δ = 3,0 (3H, с., N-CH3), 3,8 (6H, с., OCH3). Из (4-нитрофенилтио)-уксусной кислоты и промежуточного соединения 20(б).
(д) N-(2-(4-Метоксифенил)этил)-N-метил-2-(4-нитрофенокси)- ацетамид, т. пл. 107oC. Из (4-нитрофенокси)уксусной кислоты и промежуточного соединения 20(д).
(е) N-((4-Метоксифенил)метил)-N-метил-2-(4-нитрофенокси)- ацетамид, т. пл. 120oC. Из (4-нитрофенокси)уксусной кислоты и промежуточного соединения 20 (г).
(ж) N-Метил-N-((4-метилфенил)метил)-2-(4-нитрофенокси)-ацетамид. Т. пл. 126oC. Из (4-нитрофенокси)уксусной кислоты и промежуточного соединения 20(ж)
(з) N-Метил-N-[[4-метилтио]фенил]метил]-2-(4-нитрофенокси)-ацетамид. Т. пл. 122oC. Из (4-нитрофенокси)уксусной кислоты и промежуточного соединения 20(е).
(и) N-Этил-2-(4-нитрофенокси)-N-(фенилметил)-ацетамид в виде масла. ИК-спектр включает пик при 1655 см-1 (CO). Из (4-нитрофенокси)-уксусной кислоты и N-этилбензолметанамина.
Промежуточное соединение 35.
(а) 2-(4-Аминофенокси)-N-(2-(3,4-диметоксифенил)этил)-N-метилацетамид
Раствор промежуточного соединения 34(а) (37,5 г) в этаноле (350 мл) гидрируют при комнатной температуре в присутствии 10%-ного палладия-на- угле (3,5 г). По окончании поглощения водорода, катализатор отфильтровывают и раствор концентрируют с получением титульного соединения (34 г) в виде масла. ИК-спектр включает пики при 1650 см-1 (CO) и 3340-3400 см-1 (NH2).
Аналогичным получению промежуточного соединения 35(а) образом получают следующие соединения:
(б) 2-(4-Аминофенокси)-N-((3,4-диметоксифенил)метил)-N-метилацетамид в виде масла. ИК-спектр включает пики при 1650 см-1 (CO) и 3340-3400 см-1 (NH2). Из промежуточного соединения 34(б).
(в) 2-(4-Аминофенокси)-N-метил-N-(фенилметил)ацетамид. В виде масла ИК-спектр включает пики при 1660 см-1 (CO) и 3300-3420 см-1 (NH2).
Из промежуточного соединения 34 (в).
(г) 2-(4-Аминофенилтио)-N-((3,4-диметоксифенил)метил)-N-метил-ацетамид в виде масла. ИК-спектр включает пики при 1645 см-1 (CO) и 3350 см-1 (NH2). Из промежуточного соединения 34 (г).
(д) 2-(4-Аминофенокси)-N-(2-(4-метоксифенил)этил)-N-метил-ацетамид в виде масла. ИК-спектр включает пики при 1630 см-1 (CO) и 3350-3420 см-1 (NH2). Из промежуточного соединения 34 (д).
(е) 2-(4-Аминофенокси)-N-((4-метоксифенил)метил)-N-метилацетамид в виде масла. ИК-спектр включает пики при 1650 см-1 (CO) и 3340-3430 см-1 (NH2). Из промежуточного соединения 34 (е).
(ж) 2-(4-Аминофенокси)-N-метил-N-((4-метилфенил)метил)-ацетамид в виде масла. ИК-спектр включает пики при 1650 см-1 (CO) и 3350-3420 см-1 (NH2). Из промежуточного соединения 34 (ж).
(з) 2-(4-Аминофенокси)-N-метил-N-((4-(метилтио)фенил)метил)-ацетамид в виде масла. ИК-спектр включает пики при 1660 см-1 (CO) и 3340-3420 см-1 (NH2). Из промежуточного соединения 34 (з).
(и) 2-(4-Аминофенокси)-N-этил-N-(фенилметил)-ацетамид в виде масла. ИК-спектр включает пики при 1650 см-1 (CO) и 3350-3430 см-1 (NH2). Из промежуточного соединения 34 (и).
Промежуточное соединение 36
(а) N-(2-(4-(Аминофенокси)этил)-3,4-диметокси-N-метилбензолэтанамин
Раствор промежуточного соединения 35 (а) (20 г) в ТГФ (200 мл) прикапывают к перемешиваемой суспензии литийалюминий гидрида в ТГФ (100 мл) при комнатной температуре и смесь кипятят с обратным холодильником в течение 3 часов. К охлажденной смеси осторожно добавляют воду, затем смесь фильтруют, промывают с помощью ТГФ, выпаривают и экстрагируют эфиром. Объединенные эфирные экстракты сушат и выпаривают с получением титульного соединения (11 г) в виде масла, ИК-спектр включает пик 3350-3430 см-1 (NH2).
Подобным получению промежуточного соединения 36 (а) образом получают следующие соединения:
(б) N-(2-(4-Аминофенокси)этил)-3,4-диметокси-N-метилбензол-метанамин в виде масла. ИК-спектр включает пик при 3360-3420 см-1 (NH2).
Из промежуточного соединения 35 (б)
(в) N-(2-(4-Аминофенокси)этил)-N-метилбензолметанамин в виде масла. ИК-спектр включает пик при 3330-3420 см-1 (NH2).
Из промежуточного соединения 35 (в).
(г) N-(2-(4-Аминофенилтио)этил)-3,4-диметокси-N-метилбензолметанамин в виде масла. ЯМР-спектр: δ = 2,30 (3H, с, N-CH3); 3,85 (6H, с., OCH3).
Из промежуточного соединения 35 (г).
(д) N-(2-(4-Аминофенокси)этил)-4-метокси-N-метилбензолметанамин в виде масла. ИК-спектр включает пик при 3340-3430 см-1 (NH2).
Из промежуточного соединения 35 (д).
(е) N-(2-(4-Аминофенокси)этил)-4-метокси-N-метилбензолметанамин в виде масла. ИК-спектр включает пик при 3350- 3430 см-1 (NH2). Из промежуточного соединения 35 (е).
(ж) N-(2-(4-Аминофенокси)этил-)-4-метил-N-метилбензолметанамин в виде масла. ИК-спектр включает пик при 3350-3430 см-1 (NH2). Из промежуточного соединения 35 (ж).
(з) N-[2-(4-Аминофенокси)этил] -N-метил-4-(метилтио)бензолметанамин в виде масла. ИК-спектр включает пик при 3350-3420 см-1 (NH2). Из промежуточного соединения 35 (з).
(и) N-[2-(4-Аминофенокси)этил] -N-этилбензолметанам в виде масла. ИК-спектр включает пик при 3360-3430 см-1 (NH2). Из промежуточного соединения 35 (и).
Промежуточное соединение 37
(а) 3,4-Диметокси-N-метил-N-(3-(4-нитрофенокси)пропил)-бензолэтанамин.
Смесь 1-(3-бромпропокси)-4-нитробензола (18,7 г) с промежуточным соединением 20(а) (14,1 г) нагревают в течение 30 минут при 140oC и затем разбавляют водой. Смесь экстрагируют дихлорметаном и органическую фазу промывают водой, сушат и концентрируют. Остаток очищают путем колоночной хроматографии, элюируя смесью дихлорметана в метанолом (95:5) с получением титульного соединения (18 г) в виде масла, ЯМР-спектр включает сигнал при δ = 2,38 (3H, с, N - CH3).
Подобным образом, как при получении промежуточного соединения 37 (а), получают следующие соединения:
(б) 4-Метокси-N-метил-N-(3-(4-нитрофенокси)пропил)-бензолэтанамин в виде масла. ЯМР-спектр включает сигнал при δ = 2,40 (3H, с., N - CH3). Из 1-(3-бромпропокси)-4-нитробензола и промежуточного соединения 20 (д).
(в) 3,4-Диметокси-N-метил-N-(3-(4-нитрофенокси)пропил)-бензолметанамин в виде масла. ЯМР-спектр включает сигнал при δ = 2,40 (3H, с., N-CH3). Из 1-(3-бромпропокси)-4-нитробензола и промежуточного соединения 20(б).
(г) 3,4-Диметокси-N-метил-N-(3-(4-нитрофенил)тио)-пропил)- бензолметанамин в виде масла. ЯМР-спектр включает сигнал при δ = 2,40 (3H, с., N-CH3). Из 1-((3-бромпропил)тио)-4-нитробензола и промежуточного соединения 20(б).
Промежуточное соединение 38
(а) N-[3-(4-Аминофенокси]-3,4-диметокси-N-метилбензолэтанамин
Раствор промежуточного соединения 37(а) (18 г) в этаноле (200 мл) гидрируют при комнатной температуре в присутствии 10%-ного палладия-на-угле (1 г). По окончании поглощения водорода, катализатор отфильтровывают и раствор концентрируют с получением титульного соединения (15 г) в виде масла. ИК-спектр включает пик при 3300-3370 см-1 (NH2).
Подобным получению промежуточного соединения 38(а) образом получают следующие соединения:
(б) N-[3-(4-Аминофенокси]пропил]-4-метокси-N-метилбензолэтанамин в виде масла. ИК-спектр включает пик при 3350-3430 см-1 (NH2). Из промежуточного соединения 37 (б).
(в) N-[3-(4-Аминофенокси]пропил]-3,4-диметокси-N-метилбензолметанамин в виде масла. ИК-спектр включает пик при 3360-3430 см-1 (NH2). Из промежуточного соединения 37(в).
(г) N-/3-(4-Аминофенил)тио)пропил)-3,4-диметокси-N-метилбензолметанамин в виде масла. ИК-спектр включает пик при 3370-3450 см-1 (NH2). Из промежуточного соединения 37(г).
Промежуточное соединение 39. 9,10-Дигидро-2-(метилтио)-9-оксо-4-акридинкарбоновая кислота
(I) 2-((2-Карбоксифенил)амино)-5-(метилтио)бензойная кислота
Смесь 2-хлор-5-(метилтио)бензойной кислоты (10 г), антраниловой кислоты (7 г), карбоната калия (14 г) и меди (1 г) в 2-(2-метоксиэтокси)этаноле (100 мл) нагревают при 180oC в течение 24 часов. Затем добавляют воду (400 мл), и катализатор отфильтровывают. Фильтр подкисляют с помощью разбавленной соляной кислоты. Полученный осадок отфильтровывают, промывают водой, сушат и кристаллизуют из метанола с получением титульного соединения (4,5 г) в виде кристаллов. ИК-спектр включает пики при 3300 см-1 (NH) и 1700 см-1 (CO2H).
(II) 9,10-Дигидро-2-(метилтио)-9-оксо-4-акридинкарбоновая кислота
Продукт вышеуказанной части (1) (2 г) в оксихлориде фосфора (6 мл) кипятят с обратным холодильником в течение 1 часа. Раствор затем охлаждают (до 0oC), и медленно добавляют воду (15 мл). Смесь затем нагревают при 100oC в течение 10 минут и после этого выливают на расколотый лед. Образующийся осадок отфильтровывают, промывают водой и кристаллизуют из метанола с получением титульного соединения (1,6 г). ИК-спектр включает пик при 1690 см-1 (CO2H) и пик при 1620 см-1(CO).
Промежуточное соединение 40.
N-[4-(3-Бромпропокси)фенил]-9,10-дигидро-9-оксо-4-акридинкарбоксамид
(I) N-[4-(3-Бромпропокси/фенил]ацетамид
Смесь N-(4-оксифенил)ацетамида (10 г) и карбоната калия (11 г) в ДМФ (200 мл) перемешивают в течение 20 минут при комнатной температуре. Затем добавляют 1,3-дибромпропан (35 мл) и перемешивание продолжают в течение 4 часов. Смесь отфильтровывают и фильтрат концентрируют в вакууме. Остаток обрабатывают водой и экстрагируют дихлорметаном. Органическую фазу промывают сначала разбавленным раствором гидроксида натрия, затем водой, сушат и концентрируют с получением твердого вещества, которое затем порошкуют с гексаном при получении титульного соединения (14 г).T.пл. 120oC.
(II) 4-(3-Бромпропокси)-аминобензол
Смесь продукта вышеуказанной части I (13 г) и 6 н.соляной кислоты (200 мл) кипятят с обратным холодильником в течение 2 часов. После охлаждения смесь подщелачивают раствором гидроксида натрия и экстрагируют дихлорметаном. Органическую фазу выпаривают с получением титульного соединения (7 г) в виде масла. ИК-спектр включает пик при 3360-3450 см-1 (NH).
(III) N-[4-(3-Бромпропокси)фенил] -9,10-дигидро-9-оксо-4- акридинкарбоксамид
Смесь 9,10-дигидро-9-оксо-4-акридинкарбоновой кислоты (1,5 г) и 1-оксобензотриазола (1,1 г) в ДМФ (50 мл) перемешивают при комнатной температуре в течение 10 минут. Продукт вышеуказанной части (II) (1,5 г) затем добавляют, после чего добавляют дициклогексилкарбодиимид (1,3 г), и смесь перемешивают при комнатной температуре в течение 16 часов и после этого отфильтровывают. Фильтрат концентрируют в вакууме, обрабатывают водой и экстрагируют дихлорметаном. Объединенные, высушенные органические экстракты концентрируют с получением с получением титульного соединения (0,5 г), которое перекристаллизуют из ацетонитрила T.пл. 126oC.
Промежуточное соединение 41. N-[(3,4-Диметоксифенил)метил]-N- метил-4-нитрофениламинокарбонил-метанамин
Смесь промежуточного соединения 20(б) (2,8 г), промежуточного соединения 56 (3 г) и карбоната калия (2,3 г) в ДМФ (50 мл) нагревают при 60oC в течение 24 часов. Затем смесь выпаривают, экстрагируют дихлорметаном, промывают водой, сушат и концентрируют с получением твердого вещества, которое перекристаллизуют из диэтилового эфира с получением титульного соединения (3,7 г) Т.пл. 120oC.
Промежуточное соединение 42. N-[(3,4-Диметоксифенил)-метил]-N- метил-4-аминофенил-аминокарбонил-метанамин
Раствор промежуточного соединения 41 (3,6 г) в этаноле (100 мл) гидрируют при комнатной температуре в присутствии 10%-ного палладия-на-угле (500 мг). По окончании поглощения водорода катализатор отфильтровывают и фильтрат концентрируют с получением титульного соединения (3,5 г), ЯМР-спектр включает сигналы при δ = 2,5/3H,с., N-CH3); 3,8 (6H, с., OCH3).
Промежуточное соединение 43. N-[2-(4-Аминофениламино)этил]-3,4-диметокси-N-метилбензолметанамин
Раствор промежуточного соединения 42 (3,5 г) в ТГФ (50 мл) прикапывают к перемешиваемой суспензии литийалюминийгидрида в ТГФ (30 мл) при комнатной температуре и смесь кипятят с обратным холодильником в течение 48 часов. К охлажденной смеси осторожно добавляют воду, затем смесь фильтруют через цилитовую прокладку. Фильтрат выпаривают досуха и подвергают колоночной хроматографии (дихлорметан-метанол), остающийся остаток дает титульное соединение (1,4 г). ЯМР-спектр включает сигналы при δ = 2,15 (3H, c., N-CH3; 2,5 и 3 (4H, 2 т., -CH2-CH2); 3,7 (6H., c., OCH3).
Промежуточное соединение 44. 9,10-Дигидро-5,7-диметокси -9-оксо-4-акридинкарбоновая кислота
Смесь 2-иодизофталевой кислоты (5,8 г), 2,4-диметоксианилина (4,3 г) и хлорида меди -(I) (1 г) в 2,3-бутандиоле (20 мл) в толуоле (10 мл) нагревают при 120oC. После того, как толуол больше не отгоняется, добавляют П-этилморфолин (10 мл) и смесь перемешивают при 120oC в течение 1 часа. После охлаждения и разбавления с помощью 2 н. раствора карбоната калия отфильтровывают через целит. Фильтра подкисляют с помощью 2 н. соляной кислоты и зеленоватый осадок отделяют путем фильтрации. Продукт (4 г) в полифосфорной кислоте (50 г) нагревают при 120oC в течение 1,5 часов с получением титульного соединения, которое получают в виде твердого вещества (1,5 г) путем осаждения водой и очищают путем растворения в 1 н. растворе гидроксида натрия и повторного осаждения уксусной кислотой (pH 4).
Анализ: C16H13NO5 0,5 H2O
найдено, %: C 62,1; H 4,6; N 4,3
рассчитано, %: С 62,3; H 4,6; N 4,5
Подобным получению промежуточного соединения 44 образом получают следующую кислоту.
Промежуточное соединение 45. 9,10-Дигидро-6,7,8-триметокси-9-оксо-4-акридинкарбоновая кислота (1,5 г). ИК-спектр включает пик при 1620 см-1(CO). Из 3,4,5-триметоксианилина (3,8 г) и 2-иодизофталевой кислоты (5 г).
Промежуточное соединение 46. 3-(2-Бромэтил)-нитробензол
Трибромид фосфора (0,94 мл) прикапывают к раствору 3-нитроэтоксифенилового спирта (5 г) в безводном диэтиловом эфире (30 мл) при 0oC. Смесь перемешивают при комнатной температуре в течение 2 часов и затем обрабатывают раствором карбоната калия и после этого водой. Органический слой сушат и концентрируют в вакууме с получением титульного соединения в виде масла (4,51 г). ЯМР-спектр: δ = 3,25 (м., 2H, CH2-C6H5) и 3,55 (м., 2H, CH2-B)
Промежуточное соединение 47.
(a) N-[(3,4-Диметоксифенил)метил]-N-метил-3-нитробензолэтанамин
Смесь промежуточного соединения 46 (2,2 г), промежуточного соединения 20 (б) (1,71 г) и карбоната калия (1,58 г) в ДМФ (50 мл) нагревают при 60oC в течение 36 часов. Смесь отфильтровывают и фильтрат концентрируют в вакууме. Остаток обрабатывают водой и экстрагируют метиленхлоридом. Органический экстракт сушат, концентрируют и очищают путем колоночной хроматографии на силикагеле, элюируя смесь метиленхлорида с метанолом (99:1) при получении титульного соединения в виде масла (1 г). ЯМР-спектр: δ = 2,2(с., 3H, N-CH3); 3,7 (c., 6H, 2xOCH3).
Таким же путем получают следующее соединение:
(б) N-[(3,4-Диметоксифенил)метил]-N- метил-3-(3-нитрофенокси)-пропанамин
Из 3-(3-бромпрокси)нитробензола и промежуточного соединения 20 (б). ЯМР: δ = 2,2(с. 3H, N-CH3): 3,35 (c., 2H, N-CH2-C6H5); 3,8 (c., 6H, 2xOCH3).
Промежуточное соединение 48.
(a) 3-Амино-N-[(3,4-диметоксифенил)метил]-N-метилбензолэтанамин
Раствор промежуточного соединения 47(а) в 1 г (в этаноле (50 мл) гидрируют при комнатной температуре в присутствии 10%-ного палладия-на-угле (0,15 г). По окончании поглощения водорода, катализатор отфильтровывают и раствор концентрируют с получением титульного соединения (0,8 г) в виде масла. ЯМР-спектр: δ = 2,25 (с. , 3H, N-CH3); 3,4 (c., 2H, NH2) и 3,8 (с., 6H, 2xOCH3).
Таким же путем получают следующее соединение:
(б) N-(3-(3-Аминофенокси)пропил)-3,4-диметокси-N-метилбензометанамин
Из промежуточного соединения 47(б), ЯМР-спектр: δ = 2,2 (с., 3H, N-CH3), 2,7 (с., 2H, NH2), 3,4 (с., 2H, N-CH2-C6H5), 3,7 (с., 6H, 2xOCH3).
Промежуточное соединение 49. N-[(3,4-Диметоксифенил)метил]-N-метил- 3-(3-нитрофенил)-2-пропенамид
Смесью 3-нитрокоричной кислоты (10 г) и 1-оксибензотриазола (8,26 г) в ДМФ (100 мл) перемешивают при комнатной температуре в течение 10 минут, добавляют промежуточное соединение 20(б) (9,2 г), затем дициклогексилкарбодиимид (10,63 г). Смесь перемешивают при комнатной температуре в течение 16 часов и затем фильтруют. Фильтрат концентрируют в вакууме, обрабатывают разбавленным раствором соляной кислоты, затем разбавленным раствором гидроксида натрия и экстрагируют метиленхлоридом. Органический экстракт сушат и концентрируют с получением титульного соединения (15,63 г). ЯМР-спектр: δ = 3,1 (с., 3H, N-CH3); 3,75 (с., 6H, 2xOCH3).
Промежуточное соединение 50. 3-Амино-N-[(3,4-диметоксифенил)метил]- N-метилбензолпропанамин
Раствор промежуточного соединения 49 (10 г) в этаноле (100 мл) гидрируют при комнатной температуре в присутствии 10%-ного палладия-на-угле (1 г). По окончании поглощения водорода катализатор отфильтровывают и фильтрат концентрируют в вакууме. Остаток очищают путем колоночной хроматографии на силикагеле, элюируя смесью метиленхлорида с метанолом (98:2) с получением титульного соединения в виде масла (5,56 г). ЯМР-спектр: δ = 2,7 (с., 2H, N-CH3); 3,65 (с., 6H, 2хOCH3).
Промежуточное соединение 51. 3-Амино-N-[(3,4-диметоксифенил)метил]- N-метилбензолпропанамин
Раствор промежуточного соединения 50 (5 г) в ТГФ (100 мл) прикапывают к перемешиваемой суспензии литийалюминийгидрида (2,31 г) в ТГФ (80 мл) при комнатной температуре и смесь кипятят с обратным холодильником в течение 2 часов. К охлажденной смеси осторожно добавляют воду (20 мл), затем смесь фильтруют. Фильтрат концентрируют, обрабатывают водой и экстрагируют и продукт очищают путем колоночной хроматографии на силикагеле, элюируя смесью метиленхлорида с метанолом (97:3) с получением титульного соединения в виде масла (2,46 г). ЯМР-спектр: δ = 2,1 (с., 3H, N-CH3); 3,35 (с., 2H, N-CH2-C2H5), 3,7 (с., 6H, 2хOCH3).
Промежуточное соединение 52. 4-(3-Метокси-4-нитрофенил)-3-бутен-1-ол.
Реакция Виттига в ТГФ (100 мл) между 3-метокси-4-нитробензальдегидом (1) (2 г) и 3-оксипропиотрифенилфосфонийбромидом (2) (5,3 г) в присутствии раствора н-бутиллития (1,6 М) в гексане (16,5 мл) дает титульное соединение (2,6 г) в виде масла. ЯМР-спектр: δ = 3,4 (2H, т., CH2OH), 3,6 (3H, с., OCH3). (1): C.A. 113(19): 171567W; (2): A.R.Hands and A.F.H.Mercer F.Chem. Soc. (c) (1968) 2448.
Промежуточное соединение 53. 4-(4-Бром-1-бутенил)-2-метокси-1-нитробензол
Трибромид фосфора (0,33 мл) прикапывают к раствору промежуточного соединения 52 (2,6 г) в безводном диэтиловом эфире (10 мл) при 0oC. Смесь перемешивают при комнатной температуре в течение 1 часа, затем промывают раствором карбоната калия (1 М) и водой. Органический слой сушат и концентрируют в вакууме с получением титульного соединения (3,3 г) в виде желтого масла. ЯМР-спектр: δ = 3,35 (2H, т., CH2-Br), 3,8 (3H, с., O-CH3).
Промежуточное соединение 54. N-(4-(3-Метокси-4-нитрофенил)-3-бутенил- 3,4-диметокси-N-метилбензолметанамин
Смесь промежуточного соединения 53 (3,3 г), промежуточного соединения 20(б) (2,5 г) и карбоната калия (1,9 г) в ДМФ (20 мл) перемешивают при комнатной температуре в течение 48 часов. Смесь отфильтровывают и фильтрат выпаривают. Остаток вносят в воду и экстрагируют дихлорметаном. Органический слой промывают водой, сушат, фильтруют и выпаривают. Маслянистый остаток затем очищают путем колоночной хроматографии на силикагеле, элюируя смесью дихлорметана с метанолом (95:5) с получением титульного соединения (3,4 г) в виде масла, ЯМР-спектр включает сигналы при δ = 2,1 (3H, с., N-CH3); 3,7 (6H, с., 2хOCH3); 3,8 (3H, с., OCH3).
Промежуточное соединение 55. 4-Амино-N-[(3,4-диметоксифенил)метил]-3-метокси-N-метилбензолбутанамин
Раствор промежуточного соединения 54 (1,2 г) в смеси этанола (50 мл) с этилацетатом (20 мл) гидрируют при комнатной температуре в присутствии 10%-ного палладия-на-угле (0,1 г). По окончании поглощения водорода катализатор отфильтровывают и раствор концентрируют с получением титульного соединения (1 г) в виде масла, ЯМР-спектр включает сигналы: δ = 2,1 (3H, с., N-CH3); 3,65 (3H, с., O-CH3); 3,7 (6H, с., 2хOCH3).
Промежуточное соединение 56. 2-Хлор-N-(4-нитрофенил)-ацетамин
Хлорацетилхлорид (11 мл) прикапывают к перемешиваемой смеси карбоната калия (18,8 г) и 4-нитроанилина (15 г) в ДМФ (100 мл) поддерживаемой при 0oC). Смесь затем оставляют стоять в течение ночи при комнатной температуре и выливают на расколотый лед. Получают вещество желтого цвета и кристаллизуют его из толуола, содержащего изопропанол (10%), получая титульное соединение (10 г).
Т. пл. 180oC, ЯМР-спектр: δ/ = 4,1 (2H, с., COCH2Cl); 7,4-8,1 (4H, м., ароматические); 10,3 (1H, ш.с., NH).
Промежуточное соединение 57. 3,4-Дигидро-6,7-диметокси- N-(4-нитрофенил)-2-(1H)-изохинолинацетамид
Смесь промежуточного соединения 56 (10,3 г), карбоната калия (8 г) и 1,2,3,4-тетрагидро-6,7-диметоксиизохинолина (9,3 г) в ДМФ (100 мл) нагревают в течение ночи при 60oC. После охлаждения реакционную смесь выливают на расколотый лед и получают нерастворимое вещество, высушивают его с получением титульного соединения. Т. пл. 173-178oC. ЯМР-спектр: δ = 2,8 (4H, с., 2хCH2); 3,2 (2H, с. , COCH2-N); 3,7 (2H, с., N-CH2-C6H5); 3,7 (6H, м., 2хOCH3); 6,2-8,15 (6H, м., ароматические), 9,3 (1H, ш.с., NHCO).
Промежуточное соединение 58. N-(4-Аминофенил)-3,4-дигидро-6,7- диметокси-2(1H)-изохинолинацетамид
Суспензию промежуточного соединения 57 (15 г) и 10%-ного палладия-на-угле (1 г) в этаноле (200 мл) перемешивают при комнатной температуре при слегка повышенном давлении водорода. Спустя 2 часа катализатор отфильтровывают и промывают смесью дихлорметана с метанолом (9:1). Фильтрат и промывной раствор концентрируют, и кристаллический остаток после промывки этанолом и высушивания представляет собой титульное соединение (10,6 г). Т.пл. 185oC, ЯМР-спектр включает сигналы: δ = 2,8 (4H, с., 2хCH2); 3,15 (2H, с., CO-CH2-N); 3,6 (2H, сс., фенил-CH2 -N); 3,7 (6H, с., 2хOCH3); 6,15-7,3 (6H, м., ароматические), 8,65 (1H, ш.с., CONH).
Промежуточное соединение 59. N-(2-(1,2,3,4-Тетрагидро-6,7-диметокси- 2-изохинолинил)этил)-1,4-диаминобензол
Раствор борана в тетрагидрофуране (1 М; 35,4 мл) добавляют к перемешиваемому раствору промежуточного соединения 58 (2 г) в ТГФ (150 мл). После кипячения с обратным холодильником в течение 4 часов реакционную смесь охлаждают, обрабатывают концентрированной соляной кислотой с получением раствора концентрации около 3 н. в соляной кислоте и снова кипятят с обратным холодильником в течение 15 минут. Добавляют 10 н. раствор гидроксида натрия и смесь экстрагируют дихлорметаном. Органический слой промывают водой, сушат и концентрируют с получением остатка, который, после очистки на силикагеле путем колоночной хроматографии при элюировании смесью толуола с изопропиламином (95: 5), дает титульное соединение в виде масла (1,2 г). ЯМР-спектр включает сигналы при δ = 2,6 (4H, ш.с., фенил-CH2-CH2-N); 3,45 (4H, с., CH2-NH-фенил- и фенил-CH2-N); 3,6 (6H, с., 2хOCH3), 6,3 (6H, с., ароматические).
Промежуточное соединение 60. 4-[2-[2,3-Дигидро-5,6-диметокси-1H-изоиндол-2-ил]этил]бензоламин
4,5-Бисхлорметилвератрол (2,35 г, S.H.Wood. M.A.Peny and C.C.Tung F.A.C. S. (1950), 72, 2989-2991) при комнатной температуре добавляют к перемешиваемой суспензии 50%-ного водного раствора гидроксида натрия (5 мл), толуола (25 мл), 4-аминофенилэтиламина (1,5 г) и Aliguat (0,2 г). Гетерогенную смесь перемешивают при комнатной температуре в течение 16 часов, выливают в воду и экстрагируют метиленхлоридом. Органический слой сушат и растворитель выпаривают в вакууме. Остаток очищают путем колоночной хроматографии на силикагеле, элюируя смесью метиленхлорида с метанолом (95:5), получая титульное соединение в виде твердого вещества (0,6 г). Т. пл. 150oC, ЯМР-спектр включает сигналы при δ = 2,7 (4H, м., фенил-CH2-CH2-N); 4,6 (2H, ш.с., NH2); 3,7 (6H, с., 2хOCH3); 3,8 (4H, с., 2х N-CH2-фенил), 6,2-7,0 (6H, м., ароматические).
Промежуточное соединение 61. 1-(4-Нитрофенил)-2-(1,2,3,4- тетрагидро-6,7-диметокси-2-изохинолин)-этанон-гидробромид.
Раствор 6,7-диметокси-1,2,3,4-тетрагидрохинолина (15,63 г) и 2-бром-4'-нитроацетофенона (16,47 г) в смеси этанола (150 мл) с метиленхлоридом (150 мл) нагревают при 60oC в течение 24 часов. После охлаждения до комнатной температуры появляются кристаллы желтого цвета. Их отфильтровывают и высушивают в вакууме, получая титульное соединение (9,4 г). Т. пл. 216oC. ЯМР-спектр (DMCO-d6) включает сигналы при δ = 3,6 (6H, с., 2х OCH3), 4,2 (2H, с., N-CH2-фенил), 4,95 (2H, с., CO-CH2-N), 6,6 (2H, ароматические изохинолина); 8 ( 4H, м., ароматические).
Промежуточное соединение 62. 3,4-Дигидро-6,7-диметокси- α-(4-нитрофенил)-2-(1H)-изохинолинэтанол.
К суспензии промежуточного продукта 61 (9,4 г) в метаноле (600 мл) добавляют порциями раствор боргидрида натрия (2,44 г) и смесь перемешивают при комнатной температуре в течение 16 часов. Реакционную смесь разбавляют водой (200 мл), отфильтровывают и выпаривают в вакууме. Остаток экстрагируют метиленхлоридом и промывают водой. Органический слой сушат и выпаривают в вакууме с получением титульного соединения (1,15 г), после кристаллизации из этанола. Т. пл. 130oC. ЯМР-спектр включает сигналы при δ = 2,4-3,1 (6H, м., 3хCH2), 3,7 (6H, с. , 2хOCH3), 4,2 (1H, ш.с., OH); 4,8 (1H, м., H-C-OH); 6,1-8,1 (6H, м., ароматические).
Промежуточное соединение 63. α-(4-Аминофенил)-3,4-дигидро-6,7-диметокси-2-(1H)-изохинолинэтанол.
Раствор промежуточного соединения 62 (2,4 г) в этаноле (200 мл) гидрируют при комнатной температуре в присутствии 10%-ного палладия-на-угле (0,3 г). По окончании поглощения водорода катализатор отфильтровывают и раствор концентрируют, получая титульное соединение (1,9 г) в виде твердого вещества белого цвета. Т. пл. 168oC.
ЯМР-спектр включает сигналы при δ = 2,4-2,9 (6H, м., 3х CH2); 3,5 (2H, ш. с., NH2); 3,7 (6H, с., 2х OCH3);, 4,55 (1H, т., H-COH); 6,25-7,1 (6H, м., ароматические).
Промежуточное соединение 64. 2-Бром-N-Метил-N-[(4-нитрофенил) метил]ацетамид.
К раствору бромацетилбромида (30 г) в метиленхлориде (20 мл) при 0oC добавляют раствор N-метил-4-нитробензол-метанамина (8,3 г, G.I.Wilson, F. Chem. Soc. 1926, 2461) в метиленхлориде (10 мл) и триэтиламине (12 мл). Реакционную смесь перемешивают в течение 5 минут при 0oC, затем добавляют в воду (20 мл). Метиленхлоридный слой сушат и выпаривают в вакууме. Остаток очищают путем колоночной хроматографии, элюируя смесью метиленхлорида с метанолом (97: 3), при получении титульного соединения (15 г) в виде масла. ЯМР-спектр включает сигналы при δ = 3,1 (3H, с., N-CH3), 3,9 (2H, с., CH2Br), 4,55 (2H, с., фенил-CH2-N-); 7,0-8,3 (4H, м., ароматические).
Промежуточное соединение 65. 3,4-Дигидро-6,7-диметокси-N-метил-N-[[4-нитрофенил]метил]-2(1H)- изохинолинацетамид.
Смесь промежуточного соединения 64 (1,8 г), 6,7-диметокси- 1,2,3,4-тетрагидроизохинолина (1,4 г) и карбоната калия (1,6 г) в ДМФ (150 мл) перемешивают в течение ночи. После удаления нерастворимого вещества путем отфильтровывания, растворитель выпаривают в вакууме и остаток распределяют между дихлорметаном и водой. Органическую фазу сушат, затем концентрируют при пониженном давлении и продукт, после очистки путем колоночной хроматографии при элюировании смесью метиленхлорида с метанолом (96:4), представляет собой титульное соединение (1,65 г). ЯМР-спектр включает сигналы при δ = 2,8 (4H, м. , 2хCH2); 3,0 (3H, с., N-CH3), 3,33 (2H, с., CO-CH2-N); 3,6 (2H, с., N-CH2-фенил), 3,7 (6H, с. , 2хOCH3), 4,55 (2H, с., фенил-CH2-NHCO), 6,2-8,1 (6H, м., ароматические).
Промежуточное соединение 66. N-[[4-Аминофенил]метил]-3,4- дигидро-6,7-диметокси-N-метил 2(1H)-изохинолинацетамид.
Раствор промежуточного соединения 65 (1,65 г) в этилацетате (100 мл) гидрируют при комнатной температуре и при атмосферном давлении в присутствии 10%-ного палладия-на-угле (0,34 г). По окончании поглощения водорода катализатор отфильтровывают и раствор концентрируют с получением титульного соединения (1,43 г) в виде твердого вещества белого цвета. Т. пл. 175-215oC. ЯМР-спектр включает сигналы при δ = 2,8 (7H, м., NCH3 и 2xCH2); 3,2 (2H, с., CO-CH2-N); 3,5 (2H, с., N-CH2-фенил); 3,7 (6H, с., 2xCH3).
Промежуточное соединение 67. N-[[2-Аминофенил]метил]-3,4- дигидро-6,7-диметокси-N-метил-2(1H)-изохинолинэтанамин
Раствор промежуточного соединения 66 (1,49 г) в ТГФ (150 мл) прикапывают к перемешиваемой суспензии литийалюминийгидрида (0,47 г) в ТГФ (100 мл) при комнатной температуре в течение 4 часов. К охлажденной смеси осторожно добавляют воду (5 мл), затем смесь фильтруют и фильтрат концентрируют и остаток экстрагируют метиленхлоридом. Органический слой сушат и выпаривают. Результирующий продукт очищают путем колоночной хроматографии на силикагеле, элюируя смесью метиленхлорида с изопропиламином (92:8). Получают титульное соединение в виде масла (0,7 г). ЯМР-спектр включает сигналы при δ = 2,15 (3H, с. , N-CH3); 2,55 (7H, м., 4xCH2); 3,55 (2H, с., NH2); 3,65 (6H, с., 2xCH3); 6,3-7,1 (6H, м., ароматические)
Промежуточное соединение 68. 2-[[3,4-Диметоксифенил)метил]метиламино]-N-метил-N-[(4-нитрофенил)- метил]-ацетамид
Смесь промежуточного соединения 64 (4,3 г), промежуточного соединения 20(б) (3,26 г) и карбоната калия (4,14 г) в ДМФ (100 мл) перемешивают в течение ночи. Смесь отфильтровывают и фильтрат концентрируют в вакууме с получением остатка, который экстрагируют метиленхлоридом. После промывки водой и высушивания органический слой выпаривают до получения сиропа, который очищают путем колоночной хроматографии на силикагеле, элюируя смесь этилацетата с циклогексаном (1: 1). Получают титульное соединение в виде масла (5,7 г). ЯМР-спектр включает сигналы при δ = 2,3 (3H, с., N-CH3); 3,7 (6H, с., 2xOCH3); 4,5 (2H, с., фенил-CH2-NHCO).
Промежуточное соединение 69. N-[(4-Аминофенил)метил]-2-[(3,4- диметоксифенил)метил]-метиламино)-N-метилацетамид
Раствор промежуточного соединения 68 (5,7 г) в смеси этилацетата с метанолом - 1:2 (100 мл) гидрируют при комнатной температуре и при атмосферном давлении в присутствии 10%-ного палладия-на-угле (0,8 г). По окончании поглощения водорода катализатор отфильтровывают и фильтрат концентрируют, получая титульное соединение (5,2 г) в виде масла. ЯМР-спектр включает сигналы при δ = 3,8 (6H, с., 2хOCH3); 4,5 (2H, с., фенил-CH2-NCO).
Промежуточное соединение 70. N-[(4-Аминофенил)метил] -N'-[(3,4- диметоксифенил)метил]-N,N'-диметил-1,2-диаминоэтан
Раствор промежуточного соединения 69 (5,2 г) в ТГФ (150 мл) прикапывают к перемешиваемой суспензии литийалюминийгидрида (1 г) в ТГФ (50 мл) при комнатной температуре. Спустя 4 часа, к охлажденной смеси осторожно добавляют воду (10 мл), затем смесь фильтруют. Фильтрат концентрируют досуха и остаток разбавляют метиленхлоридом и экстрагируют 1М соляной кислотой. Водный слой подщелачивают с помощью водного раствора гидроксида натрия (1М) и экстрагируют метиленхлоридом. Органический слой сушат и затем концентрируют в вакууме. Остаток очищают путем колоночной хроматографии на силикагеле, элюируя с помощью смеси циклогексана с метиленхлоридом и изопропиламином (5:4: 1). Получают титульное соединение в виде масла (2 г). ЯМР-спектр включает сигналы при δ = 2,1 (6H, с., 2xNCH3); 2,4 (4H, с., 2xNCH2); 3,2 (4H, м., 2xN-CH2-фенил); 3,6 (6H, с., 2xOCH3); 3,85 (2H, с., NH2); 6,1-7,5 (7H, м., ароматические).
Промежуточное соединение 71. 3,4-Диметокси-N-метил-N-[4- (4-нитрофенил)-2-бутенил]-бензолметанамин
Смесь промежуточного соединения 20(б) (9 г), карбоната калия (8 г) и 1-хлор-4(4-нитрофенил)-2-бутена (10,6 г, Morgan и др. , 7. Med. Chem. 8(1986), 1398-1405) в 4-метил-2-пентанона (300 мл) кипятят с обратным холодильником в течение 18 часов. После охлаждения смесь отфильтровывают и выпаривают в вакууме. Остаток очищают путем колоночной хроматографии, элюируя смесью метиленхлорида с метанолом (97,5:2,5). Получают титульное соединение (2 г) в виде масла. ЯМР-спектр включает сигналы при δ = 2,2 (3H, с., N-CH3); 3,9 (6H, с., 2xOCH3); 5,7 (2H, м., двойная связь), 6,9 (3H, м., ароматические, фенил(OCH3)2), 7,4 и 8,15 (4H, 2 д, ароматические, фенил-NO2).
Промежуточное соединение 72. N-[4-[4-Аминофенил]-2-бутенил]-3,4- диметокси-N-метилбензолметанамин.
Промежуточное соединение 71 (1,7 г) растворяют при комнатной температуре и при перемешивании в смеси метанола (50 мл) и концентрированной соляной кислоты (2 мл). Затем медленно добавляют порошок железа (1,5 г) и реакционную смесь кипятят с обратным холодильником в течение 1 часа. Смесь затем выпаривают, подщелачивают гидроксидом натрия и экстрагируют диэтиловым эфиром. Органический слой сушат и выпаривают в вакууме, получая титульное соединение (0,21 г) в виде масла. ЯМР-спектр включает сигналы при δ = 2,15 (3H, с., N-CH3), 3,8 (6H, с., 2xOCH3), 5,55 (2H, м., двойная связь), 6,3-7,2 (7H, м., ароматические).
Промежуточное соединение 73. 3,4-Диметокси-N-метил-N-[3-[4- нитрофенил] -2-пропенил]-бензолметанамин
Смесь промежуточного соединения 20(б) (3,6 г), 1-хлор-3-/4-нитрофенил/-2-пропена (4,8 г, Cignalla и др., J. Med. Chem., 8 (1965), 326-329) и карбоната калия (3,5 г) в 4-метил-2-пентаноне (60 мл) кипятят с обратным холодильником в течение 3 часов. После охлаждения смесь фильтруют и фильтрат выпаривают в вакууме. Остаток очищают путем колоночной хроматографии, элюируя смесью метиленхлорида с метанолом (95:5). Получают титульное соединение (4,9 г) в виде масла. ЯМР-спектр: δ = 2,25 (3H, с., NCH3); 3,2 (2H, д, N-CH2-CH= CH), 3,5 (2H, с, NCH2-фенил), 3,85 (6H, с, 2xOCH3), 6,55 (2H, м, двойная связь), 6,8 (3H, д, ароматические фенил-(OCH3)2), 7,4 и 8,1 (4H, 2д, ароматические, фенил - NO2).
Промежуточное соединение 74. 4-[3-[[(3,4-Диметоксифенил)метил] метиламино]-1-пропенил]-аминобензол
Промежуточное соединение 73 (4,8 г) растворяют в смеси метанола (100 мл) и концентрированной соляной кислоты (10 мл) при комнатной температуре и при перемешивании. Затем медленно добавляют порошок железа (5 г) и реакционную смесь кипятят с обратным холодильником в течение 0,5 часа. После охлаждения смесь выпаривают, разбавляют водой (20 мл), подщелачивают раствором гидроксида натрия, концентрируют и экстрагируют диэтиловым эфиром. Органический слой сушат и выпаривают. Получают титульное соединение (3,9 г) в виде масла. ЯМР-спектр: δ = 2,2 (3H, с., NCH3), 3,15 (2H, д., N-CH2-CH=CH), 3,5 (2H, с., NCH2-фенил), 3,6 (2H, с., NH2), 3,8 (6H, с., 2xOCH3), 5,7-7,6 (9H, м, ароматические и двойная связь).
Промежуточное соединение 75. 1,2,3,4-Тетрагидро-6-метокси-2- (2-(4-нитрофенил)этил)-изохинолин
Смесь 1-(2-бромэтил)-4-нитробензола (6,4 г), 1,2,3,4-тетрагидро-6-метоксиизохинолина (4,6 г, Daniel J. Sall и Gary L. Grunewald, J. Med. Chem. 1987, 30, 2208-2216) и карбоната калия (9,7 г) в ДМФ (150 мл) перемешивают при 50oC в течение 15 часов. Смесь выпаривают досуха и остаток экстрагируют дихлорметаном. Органический слой промывают водой, сушат, фильтруют и выпаривают. Остаток затем очищают путем колоночной хроматографии, элюируя смесью дихлорметана с метанолом (98:2). Получают титульное соединение (2 г) в виде масла, которое отверждается при стоянии. ЯМР-спектр: δ = 3,6 (2H, м, N-CH2-арил), 3,7 (3H, с., OCH3).
Промежуточное соединение 76. 4-(2-1,2,3,4-Тетрагидро-6-метокси- 2-изохинолинил)этил)-аминобензол
Раствор промежуточного соединения 75 (2 г) в этаноле (100 мл) гидрируют при комнатной температуре в присутствии 10%-ного палладия-на-угле (0,2 г). По окончании поглощения водорода катализатор отфильтровывают и фильтрат концентрируют в вакууме, получая титульное соединение (1,8 г) в виде оранжевого цвета масла, которое при стоянии твердеет.
ЯМР-спектр: δ = 3,4 (2H, с., NH2), 3,55 (2H, с., N-CH2-Ar), 3,65 (3H, с. , OCH3).
Промежуточное соединение 77. 1,2,3,4-Тетрагидро-6,7-диметокси- 2-[3-[3-нитрофенил]-1-оксо-2-пропенил]изохинолин
Смесь 3-нитрокоричной кислоты (10 г) и 1-оксибензотриазола (8,2 г) в ДМФ (100 мл) перемешивают при комнатной температуре в течение 10 минут. Затем добавляют 1,2,3,4-тетрагидро-6,7-диметоксиизохинолин (10 г), после чего добавляют бициклогексилкарбондиимил (10,6 г) и смесь перемешивают при 50oC в течение 48 часов и после этого отфильтровывают, фильтрат концентрируют в вакууме, обрабатывают разбавленным раствором гидроксида натрия и экстрагируют дихлорметаном. Высушенный органический экстракт выпаривают и очищают путем колоночной хроматографии, элюируя смесью дихлорметана с метанолом (97: 3). Получают титульное соединение (7,8 г). ЯМР-спектр: δ = 3,85 (6H, с., OCH3).
Промежуточное соединение 78. 2-(3-(3-Аминофенил)-оксопропил)- 1,2,3,4-тетрагидро-6,7-диметоксиизохинолин
Раствор промежуточного соединения 77 (7,8 г) в этаноле (100 мл) гидрируют при комнатной температуре в присутствии 100%-ного палладия-на-угле (1 г). По окончании поглощения водорода катализатор отфильтровывают и фильтрат концентрируют в вакууме, получая титульное соединение (6,8 г). ИК-спектр: частота CO: 1640 см-1; частота NH2 : 3450 см-1.
Промежуточное соединение 79. 3-(3-(1,2,3,4-Тетрагидро-6,7- диметокси-2-изохинолинил)пропил)-аминобензол
Раствор промежуточного соединения 78 (6,8 г) в ТГФ (100 мл) прикапывают к перемешиваемой суспензии литийалюминийгидрида (3 г) в ТГФ (100 мл) при комнатной температуре и смесь кипятят с обратным холодильником в течение 3 часов. Затем, к охлажденной смеси осторожно добавляют воду, смесь фильтруют, выпаривают и экстрагируют эфиром. Экстракт сушат и выпаривают вплоть до получения титульного соединения (5,4 г) в виде масла, которое при стоянии затвердевает.
ИК-спектр: частота NH2 : 3360-3450 см-1.
Промежуточное соединение 80. 1-[[(3,4-Диметоксифенил)метил] метиламино] -3-(4-нитрофенокси)-2- пропанол
Смесь 1,2-эпокси-3-(4-нитрофенокси)пропана (6 г, Sigma) и промежуточного соединения 20(б) (5 г) в изопропаноле (100 мл) кипятят с обратным холодильником в течение 18 часов и выпаривают. Маслянистый остаток кристаллизуют из эфира, получая титульное соединение (8,3 г) в виде твердого вещества белого цвета.
ЯМР-спектр: δ = 2,3 (3H, с, N-CH3), 3,9 (6H, с, OCH3).
Промежуточное соединение 81. 1-[4-Аминофенокси[-3-(3,4- диметоксифенил)метил]метиламино]-2-пропанол
Раствор промежуточного соединения 80 (8 г) в этаноле (100 мл) гидрируют при комнатной температуре в присутствии 10%-ного палладия-на-угле (0,8 г). По окончании поглощения водорода катализатор отфильтровывают и фильтрат концентрируют в вакууме. Маслянистый продукт затем очищают путем колоночной хроматографии, элюируя смесью дихлорметана с метанолом (95:5), причем получают титульное соединение (5,8 г) в виде масла, ЯМР-спектр: δ = 2,25 (3H, с. , N-CH3), 3,8 (6H, с., OCH3).
Промежуточное соединение 82. 3,4,5-Триметокси-N-метил-N-(3-(4- нитрофенокси)пропил)бензолметанамин
Смесь 1-(3-хлорпропокси)-4-нитробензола (4,6 г), 3,4,5-триметокси-N-метилбензолметанамина (4,1 г, Sigma) и карбоната калия (2,9 г) в ДМФ (60 мл) нагревают при 70oC в течение 24 часов. Смесь затем фильтруют и фильтрат выпаривают. Остаток обрабатывают водой и экстрагируют дихлорметаном. Органический слой промывают водой, сушат выпаривают и очищают путем колоночной хроматографии, элюируя смесь дихлорметана с метанолом (99:1). Получают титульное соединение (5,8 г) в виде желтого масла. ЯМР-спектр: δ = 2,15 (3H, с., N-CH3), 3,3 (2H, с., CH2-Ar), 3,7 (9H, с., OCH3).
Промежуточное соединение 83. N-[3-[4-Аминофенокси]пропил]-3,4,5- триметокси-N-метилбензолметанамин
Раствор промежуточного соединения 82 (5,8 г) в этаноле (100 мл) гидрируют при комнатной температуре в присутствии 10%-ного палладия-на-угле (0,5 г). По окончании поглощения водорода катализатор отфильтровывают и раствор концентрируют, получая титульное соединение (5,1 г) в виде масла. ЯМР-спектр: δ = 2,25 (3H, с., N-CH3); 3,5 (2H, с., CH2-Ar), 3,8 (9H, с., OCH3).
Промежуточное соединение 84. 1,2,3,4,-Тетрагидро-6,7-диметокси- 2-[(4-метокси-3-нитрофенил)-ацетил]изохинолин
Смесь 4-метокси-3-нитрофенилуксусной кислоты (1,2 г) и 1-оксибензотриазола (0,95 г) в ДМФ (30 мл) перемешивают при комнатной температуре в течение 10 минут. Затем добавляют 1,2,3,4-тетрагидро-6,7-диметоксиизохинолин (1,1 г) в ДМФ (20 мл), после чего дициклогексилкарбодиимид (1,2 г) и смесь перемешивают при комнатной температуре в течение 6 часов, затем отфильтровывают, фильтрат концентрируют в вакууме, обрабатывают разбавленным раствором гидроксида натрия и экстрагируют этилацетатом. Органический экстракт сушат и выпаривают, получая титульное соединение (1,6 г) в виде масла, которое кристаллизуется из этанола в виде твердого вещества белого цвета. Т. пл. 175oC. ИК-спектр: 1650 см-1 (CO).
Промежуточное соединение 85. 2-((3-Амино-4-метоксифенил)ацетил)- 1,2,3,4-тетрагидро-6,7-диметоксиизохинолин
Раствор промежуточного соединения 84 (1,6 г) в этаноле (50 мл) гидрируют при комнатной температуре в присутствии 10%-ного палладия-на-угле (0,3 г). По окончании поглощения водорода катализатор отфильтровывают и раствор концентрируют, получая титульное соединение (1,4 г) в виде масла. ИК-спектр: частота CO: 1650 см-1, частота NH2 : 3340-3440 см-1.
Промежуточное соединение 86. 5-(2-(1,2,3,4-Тетрагидро-6,7- диметокси-2-изохинолинил)этил)-2-метоксиаминобензол
Раствор промежуточного соединения 85 (1,4 г) в ТГФ (30 мл) прикапывают к перемешиваемой суспензии литийалюминийгидрида (0,9 г) в ТГФ (50 мл) при комнатной температуре и смесь кипятят с обратным холодильником в течение 3 часов. Затем к охлажденной смеси осторожно добавляют воду, смесь затем фильтруют, выпаривают и экстрагируют эфиром. Экстракт сушат и выпаривают, получая титульное соединение (1,2 г) в виде масла, которое при стоянии затвердевает. ИК-спектр: 3340-3440 см-1 (NH2).
Промежуточное соединение 87. 1,2,3,4-Тетрагидро-2-[3-(4- нитрофенил)пропил]изохинолин
Смесь 1-(3-бромпропокси)-4-нитробензола (10 г), 1,2,3,4- тетрагидроизохинолина (5,1 г) и карбоната калия (10,6 г) в ДМФ (100 мл) перемешивают при 70oC в течение 24 часов. Смесь затем отфильтровывают и фильтрат выпаривают. Остаток обрабатывают водой и экстрагируют дихлорметаном. Органический слой промывают водой, сушат, выпаривают и очищают путем колоночной хроматографии, элюируя смесью дихлорметана с метанолом (96:4). Получают титульное соединение (8,8 г) в виде желтого масла. ЯМР-спектр: δ = 3,6 (2H, с., N-CH2Ar); 4,1 (2H, т., O-CH2).
Промежуточное соединение 88. 4-[3-[1,2,3,4-Тетрагидро-2- изохинолинил] пропокси]-аминобензол
Промежуточное соединение 87 (8,8 г) растворяют в смеси метанола (80 мл) с концентрированной соляной кислотой (50 мл) при комнатной температуре и при перемешивании. Затем порциями добавляют порошок железа (7,9 г) и смесь кипятят с обратным холодильником в течение 2 часов. Смесь затем охлаждают, выливают на лед, подщелачивают гидроксидом натрия и экстрагируют этилацетатом. Органический слой промывают водой, сушат и выпаривают, получая титульное соединение (4,5 г) в виде красного масла. ЯМР-спектр: δ = 3,7 (2H, с., N-CH2-Ar), 3,9 (2H, т., O-CH2).
Промежуточное соединение 89. 1,2,3,4-Тетрагидро-7-метокси-2- [2-[4-нитрофенил]этил]изохинолин
Смесь 1-(2-бромэтил)-4-нитробензола (3,7 г), 1,2,3,4-тетрагидро-7-метоксиизохинолина (2,7 г, Daniel J. Sall и Gary L. Grunewald J. Med. Chem. 1987, 30, 2208-2216) и карбоната калия (6,7 г) в изопропаноле (150 мл) перемешивают при температуре кипения с обратным холодильником в течение 48 часов. Смесь выпаривают досуха и остаток экстрагируют дихлорметаном. Органический слой промывают водой, фильтруют и выпаривают. Остаток затем очищают путем колоночной хроматографии, элюируя смесью дихлорметана с метанолом (99: 1), получают титульное соединение (1,6 г) в виде оранжевого твердого вещества (1,6 г). Т. пл. 92-94oC, ЯМР-спектр: δ = 3,6 (2H, м, N - CH2Ar), 3,7 (3H, с, OCH3).
Промежуточное соединение 90. 4-[2-[1,2,3,4-Тетрагидро-7-метокси]-2-изохинолинил]-аминобензол
Раствор промежуточного соединения 89 (1,6 г) в этаноле (100 мл) гидрируют при комнатной температуре в присутствии 10%-ного палладия-на-угле (0,16 г). По окончании поглощения водорода катализатор отфильтровывают и фильтрат концентрируют в вакууме, получая титульное соединение (1,4 г) в виде белого твердого вещества. Т.пл. 82-84o, ЯМР-спектр: δ = 3,4 (2H, с, NH2), 3,45 (2H, с, N - CH2-арил), 3,55 (3H, с, OCH3).
Промежуточное соединение 91. 1,2,3,4-Тетрагидро-6,7-диметокси-2-[2-[3-нитрофенил]этил]-изохинолин
Смесь 1-(2-бромэтил)-3-нитробензола (2,3 г), 1,2,3,4-тетрагидро-6,7-диметоксиизохинолин-гидрохлорида (2,3 г) и карбоната калия (3 г) в ДМФ (50 мл) нагревают при 50oC в течение 12 часов. Смесь затем отфильтровывают и фильтрат выпаривают. Остаток затем обрабатывают водой, экстрагируют дихлорметаном, сушат, выпаривают и очищают путем колоночной хроматографии, элюируя смесью дихлорметана с метанолом (99:1). Получают титульное соединение (1,4 г) в виде желтого масла.
ЯМР-спектр: δ = 3,6 (2H, с, N - CH2Ar); 3,75 (6H, с, OCH3).
Промежуточное соединение 92. 3-(2-(1,2,3,4-Тетрагидро-6,7-диметокси-2-изохинолинил)этил)-аминобензол
Раствор промежуточного соединения 91 (1,4 г) в этаноле (50 мл) гидрируют при комнатной температуре в присутствии 10%-ного палладия-на-угле (0,14 г). По окончании поглощения водорода катализатор отфильтровывают и фильтрат концентрируют в вакууме, получая титульное соединение (1,15 г) в виде желтого масла, которое затвердевает. ЯМР-спектр: δ = 3,6 (2H, с, N - CH2Ar), 3,75 (6H, с, OCH3), 4,5 (2H, с, NH2).
Промежуточное соединение 93. N-[[3,4-Диметоксифенил]метил]-4-метокси-N-метил-3-нитробензолэтанамид
Смесь 4-метокси-3-нитробензолуксусной кислоты (1,2 г. С.А. 87. 8468h) и 1-оксибензотриазола (0,95 г) в ДМФ (30 мл) перемешивают в течение 10 минут. Затем добавляют промежуточное соединение 20(б) (1,1 г) в ДМФ (20 мл), после чего дициклогексилкарбодиимид (1,2 г) и смесь перемешивают при комнатной температуре в течение 6 часов и затем фильтруют. Фильтрат концентрируют в вакууме, обрабатывают разбавленным раствором гидроксида натрия и экстрагируют этилацетатом. Высушенный органический экстракт выпаривают, получая масло, которое очищают путем колоночной хроматографии, элюируя смесью дихлорметана с метанолом(95: 5). Таким образом получают титульное соединение (1,5 г) в виде масла. ИК-спектр: 1640 см-1(CO).
Промежуточное соединение 94. 3-Амино-N-[[3,4-диметоксифенил]метил]-4-метокси-N-метил-бензолацетамид
Раствор промежуточного соединения 93 (1,45 г) в этаноле (40 мл) гидрируют при комнатной температуре в присутствии 10%-ного палладия-на-угле (0,25 г). По окончании поглощения водорода катализатор отфильтровывают и раствор концентрируют, получая титульное соединение (1,2 г) в виде масла. ИК-спектр: 1630 см-1 (CO), 3350-3450 см-1 (NH2).
Промежуточное соединение 95. 3-Амино-N-[[3,4-диметоксифенил]метил]-4-метокси-N-метил-бензолэтамин
Раствор промежуточного соединения 94 (1,2 г) в ТГФ (30 мл) прикапывают к перемешиваемой суспензии литийалюминийгидрида (0,9 г) в ТГФ (50 мл) при комнатной температуре и смесь кипятят с обратным холодильником в течение 3 часов. К охлажденной смеси осторожно добавляют воду, смесь затем фильтруют, промывают с помощью ТГФ, выпаривают и экстрагируют эфиром. Экстракт сушат и выпаривают, получая титульное соединение (1 г) в виде масла. ИК-спектр: 3350-3450 см-1 (NH2).
Промежуточное соединение 96. 1,2,3,4-Тетрагидро-5,6-диметокси-2-[2-[4-нитрофенил]этил]-изохинолин
Смесь 1-(2-бромэтил)-4-нитробензола (0,3 г), 1,2,3,4-тетрагидро-5,6-диметоксиизохинолина (0,25 г; R.D.Haworth, J. Chem. Soc. 2281 (1987); Robin D. Clark, J. Med. Chem. 596-600, 33 (1990)) и карбоната калия (0,5 г) в ДМФ (25 мл) нагревают при 60oC в течение 3 часов.
Смесь затем отфильтровывают и фильтрат выпаривают. Остаток обрабатывают водой, экстрагируют дихлорметаном, сушат, выпаривают и очищают путем колоночной хроматографии, элюируя смесью дихлорметана с метанолом (99:1), получают титульное соединение (0,3 г) в виде оранжевого твердого вещества. Т.пл. 97oC, ЯМР-спектр: δ = 3,6 (2H, с, N - CH2-Ar); 3,75 (6H, с., OCH3).
Промежуточное соединение 97. 4-(2-(1,2,3,4-Тетрагидро-5,6-диметокси-2-изохинолинил)этил)-аминобензол
Раствор промежуточного соединения 96 (0,3 г) в этаноле (20 мл) гидрируют при комнатной температуре в присутствии 10%-ного палладия-на-угле (30 мг). По окончании поглощения водорода катализатор отфильтровывают и фильтрат концентрируют в вакууме, получая титульное соединение (0,22 г) в виде желтого масла. ЯМР-спектр: δ = 3,55 (2H, с, N - CH2Ar), 3,65-3,85 (8H, OCH3 и NH2).
Промежуточное соединение 98. 1,2,3,4-Тетрагидро-6,7,8-триметокси-2-(2-(4-нитрофенил)этил)-изохинолин
Смесь 1-(2-бромэтил)-4-нитробензола (0,34 г), 1,2,3,4-тетрагидро -6,7,8-триметоксиизохинолина (0,33 г) (J. Chem. Soc. D. (20), 1296-1297 (1970)) и карбоната калия (0,5 г) в ДМФ (20 мл) нагревают при 50oC в течение 12 часов. Смесь затем фильтруют и фильтрат выпаривают. Остаток обрабатывают водой, экстрагируют дихлорметаном, сушат, выпаривают и очищают путем колоночной хроматографии, элюируя смесью дихлорметана с метанолом (99:1), получают титульное соединение (0,34 г) в виде твердого вещества красного цвета. Т. пл. 110oC. ЯМР-спектр: δ = 3,55 (2H, с, N - CH2Ar); 3,70 (6H, с, OCH3), 3,75 (3H, с, OCH3).
Промежуточное соединение 99. 4-[2-[1,2,3,4-Тетрагидро-6,7,8-триметокси-2-изохинолинил]этил]аминобензол
Раствор промежуточного соединения 98 (0,34 г) в этаноле (10 мл) гидрируют при комнатной температуре в присутствии 10%-ного палладия-на-угле (50 мг). По окончании поглощения водорода катализатор отфильтровывают и фильтрат концентрируют в вакууме, получая титульное соединение (0,3 г) в виде твердого вещества белого цвета. Т.пл. 92oC, ЯМР-спектр: δ = 3,55 (2H, с. N - CH2Ar), 3,7-3,75 (11H, OCH3, и NH2).
Промежуточное соединение 100. 1,2,3,4-Тетрагидро-6,7-диметокси-2-[2-[4-нитрофенил]этил]-изохинолин
Смесь 1-(2-бромэтил)-4-нитробензола (9,64 г), 1,2,3,4-тетрагидро-6,7-диметоксиизохинолин-гидрохлорида (10,59 г) и карбоната калия (17,38 г) в изопропаноле (150 мл) кипятят с обратным холодильником в течение 48 часов. Смесь затем фильтруют и фильтрат выпаривают досуха. Полученный остаток обрабатывают водой и экстрагируют дихлорметаном. Органический слой промывают водой, сушат и выпаривают, получая масло, которое кристаллизуется из смеси 2-пропанола и диэтилового эфира, давая титульное соединение (10,27 г) Т.пл. 118-119oC.
Анализ: C19H22N2O4
найдено, %: C 66,48; H 6,48; N 8,14
рассчитано, %: C 66,65; H 6,48; N 8,18
Промежуточное соединение 101. 4-[2-[1,2,3,4-Тетрагидро-6,7-диметокси-2-изохинолинил]этил]аминобензол
Метод а:
Раствор промежуточного соединения 100 (20 г) в этаноле (300 мл) гидрируют при комнатной температуре и при атмосферном давлении в присутствии 10%-ного палладия-на-угле (2 г). По окончании поглощения водорода катализатор отфильтровывают и раствор концентрируют, получая титульное соединение (17,2 г) в виде масла, которое отверждается при растирании в гексане.
Метод б:
Порошок железа (12,44 г) порциями и при комнатной температуре к перемешиваемому раствору промежуточного соединения 100 (14 г) в смеси метанола (150 мл) с концентрированной соляной кислотой (150 мл). Затем в течение 45 минут кипятят с обратным холодильником, смесь охлаждают, выливают на лед, подщелачивают раствором гидроксида натрия и экстрагируют этилацетатом. Органический слой промывают водой, сушат и выпаривают, получая титульное соединение. Т. пл. 128oC (этанол).
Анализ: C19H24N2O2
найдено, %: C 72,77; H 7,80; N 9,17
рассчитано, %: C 73,05; H 7,74; N 8,97
Пример 1. 9,10-Дигидро-5-метокси-9-оксо-N-[4-[2-[1,2,3,4- тетрагидро-6,7-диметокси-2-изохинолинил]этил]фенил]-4- акридинкарбоксамид
Смесь 9,10-дигидро-5-метокси-9-оксо-4-акрилинкарбоновой кислоты (1,3 г) и 1-оксибензотриазола (0,43 г) в ДМФ (30 мл) перемешивают при комнатной температуре в течение 10 минут. Затем добавляют промежуточный продукт (2в) - (1г) в ДМФ (20 мл), после этого - дициклогексилкарбодиимид (0,66 г) и смесь перемешивают при комнатной температуре в течение 16 часов, после чего отфильтровывают. Фильтрат концентрируют в вакууме, обрабатывают разбавленным раствором гидроксида натрия и экстрагируют дихлорметаном. Органический слой промывают водой, сушат и выпаривают, получая остаток, который очищают путем колоночной хроматографии, элюируя смесью дихлорметана с метанолом (97:3), получают твердое вещество, которое перекристаллизуют из изопропанола и отфильтровывают, получая титульное соединение (0,4 г), Т. пл. 215 - 225oC.
Анализ: C34H33N3O5
найдено, %: C 72,3; H 5,9; N 7,4
рассчитано, %: C 72,5; H 5,9; N 7,4
Пример 2. 9,10-Дигидро-5-метокси-9-оксо-N-[4-[[3-[1,2,3,4- тетрагидро-6,7-диметокси-2-изохинолинил]пропил]тио]фенил]-4- акридинкарбоксамид.
Смесь 9,10-дигидро-5-метокси-9-оксо-4-акридинкарбоновой кислоты (0,7 г) и 1-оксибензотриазола (0,35 г) в ДМФ (20 мл) перемешивают при комнатной температуре в течение 10 минут. Затем добавляют промежуточное соединение 2(б) (0,9 г) в ДМФ (20 мл), после чего - дициклогексилкарбодиимид (0,5 г) и смесь перемешивают при комнатной температуре в течение 16 часов, после чего отфильтровывают. Фильтрат концентрируют в вакууме, обрабатывают разбавленным раствором гидроксида натрия и экстрагируют дихлорметаном. Объединенные, высушенные органические экстракты выпаривают, получая масло, которое очищают путем колоночной хроматографии, элюируя смесью дихлорметана с метанолом (97: 3). Полученное твердое вещество перекристаллизуют из ацетонитрила, отфильтровывают и получают титульное соединение (0,26 г). Т. пл. 199oC.
Анализ: C35H35N3O5S (0,5 H2O)
найдено, %: C 67,7; H 5,9; N 6,6; S 5,2
рассчитано, %: C 67,9; H 5,9; N 6,8; S 5,2
Пример 3. 9,10-Дигидро-5-метокси-9-оксо-N-[4-[3-[1,2,3,4- тетрагидро-6,7-диметокси-2-изохинолинил]пропокси]фенил]-4- акридинкарбоксамид
Смесь 9,10-дигидро-5-метокси-9-оксо-4-акридинкарбоновой кислоты (1,5 г) и 1-оксибензотриазола (0,5 г) в ДМФ (30 мл) перемешивают при комнатной температуре в течение 10 минут. Затем добавляют промежуточное соединение 2(a) (1,27 г) в ДМФ (20 мл), после чего - дициклогексилкарбодиимид (0,76 г) и смесь перемешивают при комнатной температуре в течение 16 часов, после чего отфильтровывают. Фильтрат концентрируют в вакууме, обрабатывают разбавленным раствором гидроксида натрия и экстрагируют дихлорметаном. Объединенные, высушенные органические экстракты выпаривают, получая остаток, который очищают путем колоночной хроматографии, элюируя смесью дихлорметана с метанолом (97: 3). Твердое вещество перекристаллизируют из изопропанола и отфильтровывают, получая титульное соединение (0,89 г). Т. пл. 190oC.
Анализ C35H35N3O6
найдено, %: C 68,6; H 5,9; N 6,8
рассчитано, %: C 68,6; H 6,1; N 6,9
Пример 4. 5-Фтор-9,10-дигидро-9-оксо-N-[4-[[3-(1,2,3,4- тетрагидро-6,7-диметокси-2-изохинолинил)пропил]тио]фенил]-4- акридинкарбоксамид
Смесь 5-фтор-9,10-дигидро-9-оксо-4-акридинкарбоновой кислоты (1 г) и 1-оксибензотриазола (0,5 г) в ДМФ (30 мл) перемешивают при комнатной температуре в течение 10 минут. Затем добавляют промежуточное соединение 2(б) (1,4 г) в ДМФ (20 мл), после чего - дициклогексилкарбодиимид (0,8 г) и смесь перемешивают при комнатной температуре в течение 16 часов, затем отфильтровывают. Фильтрат концентрируют в вакууме, обрабатывают разбавленным раствором гидроксида натрия и экстрагируют дихлорметаном. Объединенные, высушенные органические экстракты выпаривают, получая остаток, который очищают путем колоночной хроматографии, элюируя смесью дихлорметана с метанолом (97: 3). Твердое вещество перекристаллизуют из изопропанола и отфильтровывают, получая титульное соединение (0,28 г). Т. пл. 162oC.
Анализ C34H32FN3O4S
найдено, %Ж C 66,1; H 5,4; F 3,0; N 6,8; S 5,3
рассчитано, %: C 66,3; H 5,6; F 3,1; N 6,8; S 5,2
Подобным осуществлению примера 1 образом получают следующие соединения:
Пример 5. 9,10-Дигидро-5-метил-9-оксо-N-[4-[[3-[1,2,3,4- тетрагидро-6,7-диметокси-2-изохинолинил]пропил]тио]фенил]-4- акрилинкарбоксамид
Сочетание 9,10-дигидро-5-метил-9-оксо-4-акридинкарбоновую кислоту (1 г) с промежуточным соединением 2 (б) (1,4 г) после кристаллизации из изопропанола, дает титульное соединение (0,45 г). Т. пл. 155oC.
Анализ для C35H35N3O4S (H2O)
найдено, %: C 68,8; H 5,9; N 6,8; S 5,0
рассчитано, %: C 68,7; H 6,1; N 6,8; S 5,2
Пример 6. 9,10-Дигидро-9-оксо-N-[4-[3-[1,2,3,4-тетрагидро-6,7- диметокси-2-изохинолинил]пропокси]фенил]-4-акрилинкарбоксамид
Сочетание 9,10-дигидро-9-оксо-4-акридинкарбоновой кислоты (0,8 г) с промежуточным соединением 2(a) (1,1 г) после кристаллизации из изопропанола дает титульное соединение (0,27 г). Т. пл. 220oC.
Анализ для C34H33N3O5 (0,5 H2O)
найдено, %: C 71,4; H 5,9; N 7,3
рассчитано, %: C 71,3; H 6,0; N 7,3
Пример 7. 9,10-Дигидро-9-оксо-N-[4-[2-[1,2,3,4-тетрагидро- 6,7-диметокси-2-изохинолинил]этокси]фенил]-4-акрилинкарбоксамид
Сочетание 9,10-дигидро-9-оксо-4-акридинкарбоновой кислоты (0,37 г) с промежуточным соединением 5 (а) (0,51 г) после перекристаллизации из изопроданола дает титульное соединение (0,27 г) Т. пл. 154oC,
Анализ для C33H31N3O5 (0,5 H2O)
найдено, %: C 70,4; H 5,7; N 7,5
рассчитано, %: C 70,9; H 5,8; N 7,5
Пример 8. 9,10-Дигидро-9-оксо-N-[4-[[3-[1,2,3,4-тетрагидро-6,7- диметокси-2-изохинолинил]пропил]тио]фенил]-4-акридинкарбоксамид
Сочетание 9,10-дигидро-9-оксо-4-акридинкарбоновой кислоты (0,8 г) с промежуточным соединением 2 (б) (1 г) после кристаллизации из изопропанола дает титульное соединение (0,04 г), Т. пл. 182oC
Анализ для C34H33N3O4S (1,5 H2O)
найдено, %: C 67,3; H 5,6; N 6,9; S 5,25
рассчитано, %:C 67,3; H 5,9; N 6,9; S 5,3
Пример 9. 9,10-Дигидро-5-метил-9-оксо-N-[4-[4-[1,2,3,4- тетрагидро-6,7-диметокси-2-изохинолинил]бутил]фенил]-4- акридинкарбоксамид.
Сочетание 9,10-дигидро-5-метил-9-оксо-4-акридинкарбоновой кислоты (1 г) с промежуточным соединением 2 (г) (1,34 г) после кристаллизации из смеси этанола с ацетоном дает титульное соединение (0,86 г). Т. пл. 140oC.
Анализ для C36H37N3O4 (H2O)
найдено, %: C 73,1; H 6,3; N 6,8
рассчитано, %: C 72,8; H 6,5; N 7,1
Пример 10. 9,10-Дигидро-5-метокси-9-оксо-N-[4-[3-[1,2,3,4- тетрагидро-6,7-диметокси-2-изохинолинил]пропил]фенил]-4- акридинкарбоксамид
Сочетание 9,10-дигидро-5-метокси-9-оксо-4-акридинкарбоновой кислоты (0,65 г) с промежуточным соединением 5(б) (0,53 г) после кристаллизации из изопропанола дает титульное соединение (0,3 г). Т. пл. 135oC.
Анализ для C35H35N3O5 (H2O)
найдено, %: C 70,9; H 6,0; N 6,7
рассчитано, %: C 70,6; H 6,3; N 7,05
Пример 11. 9,10-Дигидро-5-метил-9-оксо-N-[4-[3-(1,2,3,4- тетрагидро-6,7-диметокси-2-изохинолинил)пропил]фенил]-4- акридинкарбоксамид
Сочетание 9,10-дигидро-5-метил-9-оксо-4-акридинкарбоновой кислоты (0,61 г) с промежуточным соединением 5(б) (0,53 г) после кристаллизации из изопропанола дает титульное соединение (0,45 г). Т. пл. 120oC.
Анализ для C35H35N3O4 (0,5 H2O)
найдено, %: C 73,2; H 6,15; N 7,3
рассчитано, %: 73,7; 6,35; 7,4
Пример 12. 5-Фтор-9,10-дигидро-9-оксо-N-[4-[2-(1,2,3,4- тетрагидро-6,7-диметокси-2-изохинолинил)тио]фенил]-4-акридинкарбоксамид
Сочетание 5-фтор-9,10-дигидро-9-оксо-4-акридинкарбоновой кислоты (1 г) с промежуточным соединением 2(в) (0,8 г) после кристаллизации из смеси ацетонитрила с изопропанолом дает титульное соединение (0,2 г). Т. пл. 212oC.
Анализ для C33H30FN3O4 (H2O)
найдено, %: C 69,4; H 5,2; N 7,8
рассчитано, % 69,6; 5,6; 7,4
Пример 13. 5-Фтор-9,10-дигидро-9-оксо-N-[4-[3-(1,2,3,4- тетрагидро-6,7-диметокси-2-изохинолинил)пропил]фенил]-4- акридинкарбоксамид
Сочетание 5-фтор-9,10-дигидро-9-оксо-4-акридинкарбоновой кислоты (1 г) с промежуточным соединением 5 (б) (0,85 г) после кристаллизации из изопропанола дает титульное соединение (0,4 г).
Т. пл. 166oC.
Анализ для C34H32FN3O4 (H2O)
найдено, %: C 70,3; H 5,4; N 7,2
рассчитано, %: 69,9; 5,8; 7,2
Пример 14. 9,10-Дигидро-5-метил-9-оксо-N-[4-[2-[1,2,3,4- тетрагидро-6,7-диметокси-2-изохинолинил]этил]фенил]-4- акридинкарбоксамид
Сочетание 9,10-дигидро-5-метил-9-оксо-4-акридинкарбоновой кислоты (0,63 г) с промежуточным соединением 2(в) (0,62 г) после кристаллизации из этанола дает титульное соединение (0,2 г).
Т. пл. 175oC.
Анализ для C34H33N3O4 (H2O)
найдено, %: C 71,8; H 6,2; N 7,2
рассчитано, %: 72,2; 6,2; 7,4
Пример 15. 9,10-Дигидро-N-[2-метокси-4-[3-(1,2,3,4-тетрагидро- 6,7-диметокси- 2-изохинолинил)пропил]фенил]-5-метил-9-оксо-4- акридинкарбоксамид.
Смесь 9,10-дигидро-5-метил-9-оксо-4-акридинкарбоновой кислоты (1 г) и 1-оксибензотриазола (0,53 г) в ДМФ (30 мл) перемешивают при комнатной температуре в течение 10 минут. Затем добавляют промежуточное соединение 16 (а) (1,28 г) в ДМФ (20 мл), после чего - дициклогексилкарбодиимид (0,74 г) и смесь перемешивают при комнатной температуре в течение 16 часов, затем отфильтровывают. Фильтрат концентрируют в вакууме, обрабатывают разбавленным раствором гидроксида натрия и экстрагируют дихлорметаном. Органический слой промывают водой, сушат и концентрируют, получая остаток, который очищают путем колоночной хроматографии, элюируя смесью дихлорметана с метанолом (95: 5). Получают твердое вещество, которое перекристаллизуют из эфира. Таким образом получают титульное соединение (0,54 г). Т. пл. 174oC
Анализ для C36H37N3O5
найдено, %: C 72,9; H 6,3; N 7,4
рассчитано, %: 73,1; 6,3; 7,1
Пример 16. 9,10-Дигидро-5-метокси-N-[2-метокси-4-[3-(1,2,3,4- тетрагидро-6,7-диметокси-2-изохинолинил)пропил] фенил] -9-оксо-4- акридинкарбоксамид
Раствор промежуточного соединения 16(а) (1,28 г) дициклогексилкарбодиимида (0,74 г) в ДМФ (20 мл) добавляют, при перемешивании, к раствору 9,10-дигидро-5-метокси-9-оксо-4- акридинкарбоновой кислоты (1 г) и 1-оксибензотриазола (0,5 г) в ДМФ (20 мл). Результирующую смесь перемешивают в течение ночи при комнатной температуре, отфильтровывают и концентрируют в вакууме. Остаток обрабатывания дихлорметаном и затем промывают последовательно разбавленным раствором гидроксида натрия и водой. Органический слой затем сушат и выпаривают, получая остаток, который очищают путем колоночной хроматографии, элюируя смесью дихлорметана с метанолом (9:1). Получают твердое вещество, которое кристаллизуется из эфира, давая титульное соединение (0,43 г).
Т. пл. 188oC
Анализ для C36H37N3O6
найдено, %: C 70,9; H 6,4; N 7,0
рассчитано, %: 71,15; 6,1; 6,9
Аналогичным примеру 15 и примеру 16 образом получают следующие соединения.
Пример 17. 5-Фтор-9,10-дигидро-N-[2-метокси-4-[3-(1,2,3,4-тетрагидро- 6,7-диметокси-2-изохинолинил)пропокси]фенил]-9-окси-4-акридинкарбоксамид.
Сочетая 5-фтор-9,10-дигидро-9-оксо-4-акридинкарбоновую кислоту (0,31 г) с промежуточным соединением 8(a) (0,4 г), получают после кристаллизации из изопропанола титульное соединение (0,2 г). Т. пл. 152oC
Анализ для C35H34FN3O6 (1,5 H2O)
найдено,%: C 65,7; H 5,6; F 3,0; N 6,9
рассчитано,%: 65,8; 5,8; 2,9; 6,6
Пример 18. 9,10-Дигидро-5-метокси-N-[2-метил-4-[3-(1,2,3,4- тетрагидро-6,7-диметокси-2-изохинолинил)пропокси]фенил]-9-оксо-4- акридинкарбоксамид
Сочетание 9,10-дигидро-5-метокси-9-оксо-4-акридинкарбоновой кислоты (1,5 г) с промежуточным соединением 8(б) (1,3 г) после кристаллизации из смеси изопропанола с этанолом дает титульное соединение (0,53 г), т.пл. 160oC.
Анализ для C36H37N3O6 0,5 H2O)
найдено,%: C 69,6; H 5,8; N 6,5
рассчитано,%: 70,1; 6,2; 6,8
Пример 19. 9,10-Дигидро-5-метил-N-[2-метил-4-[2-(1,2,3,4-тетрагидро-6,7- диметокси-2-изохинолинил)пропокси]фенил]-9-оксо-4-акридинкарбоксамид
Сочетание 9,10-дигидро-5-метил-9-оксо-4-акридинкарбоновой кислоты (1 г) с промежуточным соединением 8(б) (1,4 г) после кристаллизации из ацетона дает титульное соединение (0,73 г), т.пл. 160oC.
Анализ для C36H37N3O5 (H2O)
найдено,%: C 71,0; H 6,1; N 6,5
рассчитано,%: 70,9; 6,4; 6,9
Пример 20. 9,10-Дигидро-5-метокси-N-[2-метил-4-[2-(1,2,3,4-тетрагидро-6,7- диметокси-2-изохинолинил)этил]фенил]-9-оксо-4-акридинкарбоксамид
Сочетание 9,10-дигидро-5-метокси-9-оксо-4-акридинкарбоновой кислоты (1,7 г) с промежуточным соединение 16(в) 91,7 г) после кристаллизации из этанола дает титульное соединение (0,21 г). Т. пл. 200-201oC.
Анализ для C35H35N3O5 (0,5 H2O):
найдено,%: C 71,9; H 5,9; N 6,9
рассчитано,%: 71,65; 6,2; 7,2
Пример 21. 5-Фтор-9,10-дигидро-N-[2-метил-4-[2-(1,2,3,4-тетрагидро-6,7- диметокси-2-изохинолинил)этил)фенил]-9-оксо-4-акридинкарбоксамид
Сочетание 5-фтор-9,10-дигидро-9-оксо-4-акридинкарбоновой кислоты (1 г) с промежуточным соединением 16 (в) (1,25 г) после кристаллизации из этанола дает титульное соединение (0,32 г). Т. пл. 210oC.
Анализ для C34H32FN3O4 (0,5 H2O)
найдено,%: C 71,2; H 5,9; F 3,4; N 7,4
рассчитано,%: 71,1; 5,8; 3,3; 7,3
Пример 22. 9,10-Дигидро-N-[2-метокси-4-[3-(1,2,3,4-тетрагидро-6,7- диметокси-2-изохинолинил)пропокси]фенил]-5-метил-9-оксо-4-акридинкарбоксамид.
Сочетание 9,10-дигидро-5-метил-9-оксо-4-акридинкарбоновой кислоты (0,7 г) с промежуточным соединением 8(а) (1 г) после кристаллизации из ацетонитрила дает титульное соединение (0,83 г) Т.пл. 183-184oC.
Анализ для C36H37N3O6 (0,5 H2O)
найдено,%: C 70,2; H 6,1; N 6,8
рассчитано,%: 70,1; 6,2; 6,8
Пример 23. N-(2-Этокси-4-[3-[1,2,3,-4-тетрагидро-6,7-диметокси-2- изохинолинилпропил]фенил]-9,10-дигидро-5-метокси-9-оксо-4- акридинкарбоксамид
Сочетание 9,10-дигидро-5-метокси-9-оксо-4-акридинкарбоновой кислоты (0,65 г) с промежуточным соединением 16(б) (0,6 г) после кристаллизации из смеси изопропанола с ацетонитрилом (9:1) дает титульное соединение (0,22 г. ). Т.пл. 198oC.
Анализ для C37H39N3O6
найдено,%: C 71,1; H 6,4; N 6,9
рассчитано,%: 71,8; 6,3; 6,8
Пример 24. N-[2-Метокси-4-[3-[[3,4-диметоксифенил]метил]метиламино] пропокси]-фенил]-5-фтор-9,10-дигидро-9-оксо-4-акридинкарбоксамид
Смесь 5-фтор-9,10-дигидро-9-оксо-4-акридинкарбоновой кислоты (1 г) и 1-оксибензотриазола (0,5 г) в ДМФ (30 мл) перемешивают при комнатной температуре в течение 10 минут. Промежуточное соединение 22(b) (1,2 г) в ДМФ добавляют к смеси с последующим добавлением дициклогексилкарбодиимида (0,8 г) и смесь перемешивают при комнатной температуре в течение 16 ч и затем фильтруют. Фильтрат концентрируют в вакууме, обрабатывают разбавленным раствором гидроксида натрия и экстрагируют дихлорметаном. Объединенные, высушенные органические экстракты выпаривают и остаток очищают путем колоночной хроматографии, элюируя смесью дихлорметана с метанолом (97:3). Твердое вещество перекристаллизуют из изопропанола и получают титульное соединение (0,68 г). Т. пл. 108oC.
Анализ для C34H34FN3O6 (H2O)
найдено,%: C 66,4; H 5,5; F 3,0; N 7,0
рассчитано,%: 66,11; 5,8; 3,1; 6,8
Пример 25. N-[2-Метил-4-[3-[[(3,4-диметоксифенил)метил]метиламино]пропокси] фенил]-5-фтор-9,10-дигидро-9-оксо-4-акридинкарбоксамид
Смесь 5-фтор-9,10-дигидро-9-оксо-4-акридинкарбоновой кислоты (1 г) и 1-оксибензотриазола (0,47 г) в ДМФ (30 мл) перемешивают при комнатной температуре в течение 10 минут. Затем добавляют промежуточное соединение 22(а) (1,2 г) в ДМФ (15 мл), после чего - дициклогексилкарбодиимид (0,7 г) и смесь перемешивают при комнатной температуре в течение 16 часов, после чего отфильтровывают. Фильтрат концентрируют в вакууме, обрабатывают разбавленным раствором гидроксида натрия и экстрагируют дихлорметаном. Объединенные, высушенные органические экстракты выпаривают и остаток очищают путем колоночной хроматографии, элюируя смесью дихлорметана с метанолом (98:2). Затем твердое вещество перекристаллизуют из изопропанола, получая титульное соединение (0,86 г). Т.пл. 130oC.
Анализ для C34H34FN3O5
найдено,%: C 69,93; H 5,89; F 3,2; N 7,3
рассчитано,%: 69,97; 5,87; 3,2; 7,2
Пример 26. N-[2-Метокси-[3[[(3,4-диметоксифенил)метил)метиламино] пропокси]-фенил]-9,10-дигидро-5-метокси-9-оксо-4-акридинкарбоксамид:
Смесь 9,10-дигидро-5-метокси-9-оксо-4-акридинкарбоновой кислоты (1 г) и 1-оксибензотриазола (0,62 г) в ДМФ (30 мл) перемещают при комнатной температуре в течение 10 мин. Затем добавляют промежуточное соединение 22(б) (1 г) в ДМФ (20 мл), после чего - дициклогексилкарбодиимид (0,62 г), и смесь перемешивают при комнатной температуре в течение 16 часов, после чего отфильтровывают. Фильтрат концентрируют в вакууме, обрабатывают разбавленным раствором гидроксида натрия и экстрагируют метилен хлоридом. Объединенные, высушенные органические экстракты выпаривают и остаток очищают путем колоночной хроматографии на силикагеле, элюируя смесью дихлорметана с метанолом (97: 3). После кристаллизации из изопропанола, титульное соединение получают в виде твердого вещества (0,4 г). Т. пл. 146oC.
Анализ для C35H37N3O7
найдено,%: C 68,4; H 5,9; N 6,7
рассчитано,%: 68,7; 6,1; 6,9
Тем же путем получают следующие соединения.
Пример 27. N-[2-Метил-4-[3-[[[3,4-диметоксифенил]-метил]метиламино пропокси]фенил-9,10-дигидро-5-метил-9-оксо-4-акридинкарбоксамид
Реакция сочетания (сочетание) 9,10-дигидро-5-метил-9-оксо- 4-акридинкарбоновой кислоты (1 г) с промежуточным соединением 22(а) (1,23 г) после кристаллизации из изопропанола дает титульное соединение (1,2 г) в виде твердого вещества. Т. пл. 146oC.
Анализ для C35H37N3O5
найдено,%: C 72,5; H 6,5; N 7,1
рассчитано,%: 72,5; 6,4; 7,2
Пример 28. N-[2-Метил-4-[3-[[[3,4-диметоксифенил]метил]метиламино пропокси]фенил-9,10-дигидро-9-оксо-4-акридинкарбоксамид
Реакция сочетания 9,10-дигидро-9-оксо-4-акридинкарбоновой кислоты (0,9 г) с промежуточным соединением 22 (а) (1,2 г) после кристаллизации из изопропанола дает титульное соединение в виде твердого вещества (1,3 г). Т. пл. 145-150oC, ЯМР-спектр: δ = 2,2 и 2,3 (2.с. 2x3H, N-CH3 и CH3-Ar), 3,4 (с, 2H, CH2Ar), 3,7 (с, 6H, OCH3), 6,6-8,5-(м, 13H, ароматические).
Пример 29. N-[2-Метил-4-[2-[[[3,4-диметоксифенил]метил] метиламино]этокси]фенил]-9,10-дигидро-5-метокси-9-оксо-4- акридинкарбоксамид
Реакция сочетания 9,10-дигидро-5-метокси-9-оксо-4-акридинкарбоновой кислоты (1,2 г - с промежуточным соединением 22 (г) (1,12 г) после кристаллизации из этанола дает титульное соединение в виде твердого вещества (0,6 г). Т. пл. 178-179oC.
Анализ для C34H35N3O6
найдено,%: C 70,1; H 6,1; N 7,1
рассчитано,%: C 70,2 H 6,1 N 7,2
Пример 30. N-[2-Этил-4-[3-[[[3,4-диметоксифенил]метил] метиламино]пропокси]фенил]-5-фтор-9,10-дигидро-9-оксо-4- акридинкарбоксамид
Реакция сочетания 5 фтор-9,10-дигидро-9-оксо-4-акридинкарбоновой кислоты (1 г) с промежуточным соединением 22 (в) (1,2 г) после кристаллизации из изопропанола дает титульное соединение в виде твердого вещества (0,95 г). Т. пл. 146oC.
Анализ для C35H36FN3O5
найдено,%: C 70,3; H 6,1; F 3,2; N 7,0
рассчитано,%: 70,3; 6,1; 3,1; 7,0
Пример 31. N-[2-Метокси-4-[3-[[[3,4-диметоксифенил] метил] метиламино] пропокси]-фенил]-9,10-дигидро-5-метил-9-оксо-4- акридинкарбоксамид
Реакция сочетания 9,10-дигидро-5-метил-9-оксо-4-акридинкарбоновой кислоты (0,8 г) с промежуточным соединением 22 (б) (1,14 г) после кристаллизации из изопропанола дает титульное соединение в виде твердого вещества (0,4 г). Т. пл. 156-157oC.
Анализ для C35H37N3O6
найдено,%: C 70,6; H 6,3; N 7,15
рассчитано,%: 70,6; 6,3; 7,05
Пример 32. N-[2-Метил-4-[2-[[[3,4-диметоксифенил]метил] метиламино]этил] фенил]-5-фтор-9,10-дигидро-9-оксо-4- акридинкарбоксамид
Реакция сочетания 5-фтор-9,10-дигидро-9-оксо-4-акридинкарбоновой кислоты (0,82 г) с промежуточным соединением 27 (а) (1,07 г) после кристаллизации из этанола дает титульное соединение в виде твердого вещества желтого цвета (0,21 г). Т. пл. 125oC.
Анализ для C33H32FN3O4 (1,5 H2O)
найдено,%: C 68,3; H 5,8; F 3,3; N 7,2
рассчитано,%: 68,3; 6,1; 3,3; 7,2
Пример 33. N-[2-Метил-4-[2[[[3,4-диметоксифенил]метил] метиламино]этил] фенил]-9,10-дигидро-5-метил-9-оксо-4- акридинкарбоксамид
Реакция сочетания 9,10-дигидро-5-метил-9-оксо-4-акридинкарбоновой кислоты (0,8 г) с промежуточным соединением 27 (а) (1 г) после кристаллизации из этанола дает титульное соединение в виде твердого вещества желтого цвета (0,45 г). Т. пл. 160-161oC.
Анализ для C34H35N3O4 (0,5 H2O)
найдено,%: C 73,4; H 6,3; N 7,5
Рассчитано,%; 73,1; 6,5; 7,5
Пример 34. N-[2-Метокси-4-[2-[[[3,4-диметоксифенил] метил] метиламино] этил]фенил]-5-фтор-9,10-дигидро-9-оксо-4- акридинкарбоксамид
Реакция сочетания 5-фтор-9,10-дигидро-9-оксо-4-акридинкарбоновой кислоты (1 г) с промежуточным соединением 27 (б) (1,3 г) после кристаллизации из этанола дает титульное соединение в виде твердого вещества (0,55 г). Т.пл. 161-162oC.
Анализ для C33H32FN3O5
найдено,%: C 69,3; H 5,8; N 7,5
рассчитано,%: 69,6; 5,6; 7,4
Пример 35. N-[2-Метил-4-[3-[[[3,4-диметоксифенил]метил] метиламино]пропил]фенил]-9,10-дигидро-5-метокси-9-оксо-4- акридинкарбоксамид.
Реакция сочетания 9,10-дигидро-5-метокси-9-оксо-4-акридинкарбоновой кислоты (0,69 г) с промежуточным соединением 27 (в) (0,65 г) после кристаллизации из изопропанола дает титульное соединение в виде твердого вещества (0,185 г). Т.пл. 154oC.
Анализ для C35H37N3O5
найдено,%: C 72,65; H 6,4; N 7,0
рассчитано,%: 72,50; 6,4; 7,25
Пример 36. N-[2-Метил-4-[3-[[[3,4-диметоксифенил]метил]метиламино]пропил]- фенил]-5-фтор-9,10-дигидро-9-оксо-4-акридинкарбоксамид
Реакция сочетания 5-фтор-9,10-дигидро-9-оксо-4-акридинкарбоновой кислоты (0,5 г) с промежуточным соединением 27 (в) (0,59 г) после кристаллизации из изопропанола дает титульное соединение в виде твердого вещества (0,26 г). Т. пл. 132oC.
Анализ для C34H34FN3O4
найдено,%: C 71,9; H 6,0; F 3,3; N 7,3
рассчитано,%: 71,9; 6,0; 3,3; 7,45
Пример 37. N-[2-Метокси-4-[3-[[[3,4-диметоксифенил]метил]метиламино]пропил]- фенил]-9,10-дигидро-5-метокси-9-оксо-4-акридинкарбоксамид
Реакция сочетания 9,10-дигидро-5-метокси-9-оксо-4-акридинкарбоновой кислоты (0,43 г) и промежуточного соединения 30 (0,5 г) после кристаллизации из изопропанола дает титульное соединение в виде твердого вещества (0,16 г). Т. пл. 105oC.
Анализ для C35H37N3O6
найдено,%: C 70,6; H 6,3; N 6,9
рассчитано,%: 70,6; 6,3; 7,0
Пример 38. N-[2-Метокси-4-[3-[[[3,4-диметоксифенил]метил]метиламино]пропил] фенил]-5-фтор-9,10-дигидро-9-оксо-4-акридинкарбоксамид
Реакция сочетания 5-фтор-9,10-дигидро-9-оксо-4-акридинкарбоновой кислоты (0,4 г) с промежуточным соединением 30 (0,5 г) после кристаллизации из смеси этанола с циклогексаном дает титульное соединение в виде твердого вещества (0,26 г). Т. пл. 170-190oC.
Анализ для C34H34FN3O5 • H2O
найдено,%: C 67,7; H 5,7; N 6,6
рассчитано,%: 67,9; 6,0; 7,0
Пример 39. N-[4-[4-[[[3,4-диметоксифенил]метил]метиламино] бутил]фенил] -5-фтор-9,10-дигидро-9-оксо-4-акридинкарбоксамид
Смесь 5-фтор-9,10-дигидро-9-оксо-4-акридинкарбоновой кислоты (0,42 г) и 1-оксибензотриазола (0,27 г) в ДМФ (30 мл) перемешивают при комнатной температуре в течение 10 минут. Затем добавляют промежуточное соединение 33 (а) (0,55 г) в ДМФ (30 мл), а после этого дициклогексиликарбодиимид (0,34 г), и смесь перемешивают при комнатной температуре в течение 16 часов, затем фильтруют. Фильтрат концентрируют в вакууме, обрабатывают разбавленным раствором гидроксида натрия и экстрагируют дихлорметаном. Объединенные, высушенные органические экстракты выпаривают до тех пор, пока не останется масло, которое очищают путем колоночной хроматографии, элюируя смесью дихлорметана с метанолом (95:5), причем получают масло, которое кристаллизуют из этанола и отфильтровывают, получая титульное соединение (0,32 г). Т. пл. 131oC.
Анализ для C34H34FN3O4
найдено,%: C 71,4; H 5,9; N 7,3
рассчитано,%: 71,9; 6,0; 7,4
Пример 40. N-[4-[2-[[[3,4-Диметоксифенил]метил]метиламино] этил]фенил] -9,10-дигидро-5-метокси-9-оксо-4-акридинкарбоксамид
Смесь 9,10-дигидро-5-метокси-9-оксо-4-акридинкарбоновой кислоты (0,8 г) и 1-оксибензотриазола (0,41 г) в ДМФ (50 мл) перемешивают при комнатной температуре в течение 10 минут. Затем добавляют промежуточное соединение 33(б) (0,9 г) в ДМФ (30 мл), после чего - дициклогексилкарбодиимид (0,62 г), и смесь перемешивают при комнатной температуре в течение 16 часов, после чего фильтруют. Фильтрат концентрируют в вакууме, обрабатывают разбавленным раствором гидроксида натрия и экстрагируют дихлорметаном. Объединенные, высушенные органические экстракты выпаривают до тех пор, пока не останется масло, которое очищают путем колоночной хроматографии, элюируя смесью дихлорметана с метанолом (95:5), получая твердое вещество. Его кристаллизуют из изопропанола и отфильтровывают, получая титульное соединение (0,31 г). Т.пл. 172oC.
Анализ для C33H33N3O5
найдено, %: C 71,3; H 6,0; N 7,35
рассчитано, %: 71,8; 6,0; 7,6
Пример 41. N-[4-[4-[[[3,4-Диметоксифенил]метил]метиламино]бутил] фенил] -9,10-дигидро-9-оксо-4-акридинкарбоксамид
Смесь 9,10-дигидро-9-оксо-4-акридинкарбоновой кислоты (4 г) и 1-оксибензотриазола (2,83 г) в ДМФ (50 мл) перемешивают при комнатной температуре в течение 10 минут. Затем добавляют промежуточное соединение 33 (а) (5,5 г) в ДМФ (100 мл), после чего - дициклогексилкарбодиимид (3,45 г), и смесь перемешивают при комнатной температуре в течение 16 часов, после чего отфильтровывают. Фильтрат концентрируют в вакууме, обрабатывают разбавленным раствором гидроксида натрия и экстрагируют дихлорметаном. Объединенные, высушенные органические экстракты выпаривают до тех пор, пока не останется масло, которое очищают путем колоночной хроматографии, элюируя смесью дихлорметана с метанолом (95:5), получая твердое вещество. Его кристаллизуют из метанола и затем отфильтровывают, получая титульное соединение (3,2 г). Т. пл. 140oC. Анализ для C34H35N3O4
найдено, %: C 74,3; H 6,5; N 7,7
рассчитано, % 74,3; 6,4; 7,6
Пример 42. N-[4-[2-[[[3,4-Диметоксифенил]метил]метиламино]этил] фенил] -9,10-дигидро-9-оксо-4-акридинкарбоксамид
Смесь 9,10-дигидро-9-оксо-4-акридинкарбоновой кислоты (0,8 г) с 1-оксибензотриазолом (0,56 г) в ДМФ (50 мл) перемешивают при комнатной температуре в течение 10 минут. Затем добавляют промежуточное соединение 33(б) (1 г) в ДМФ (10 мл), затем - дициклогексилкарбодиимид (0,7 г). Смесь перемешивают при комнатной температуре в течение 16 часов и затем отфильтровывают. Фильтрат концентрируют в вакууме, обрабатывают разбавленным раствором гидроксида натрия и экстрагируют дихлорметаном. Объединенные, высушенные органические экстракты выпаривают до тех пор, пока не останется масло, которое очищают путем колоночной хроматографии, элюируя смесью дихлорметана с метанолом (9: 1), получая твердое вещество. Это твердое вещество кристаллизуют из ацетонитрила и отфильтровывают, получая титульное соединение (0,35 г). Т.пл. 172oC.
Анализ для C32H31N3P4
найдено, %: C 73,6; H 6,0; N 8,0
рассчитано, %: 73,7; 6,0; 8,1
Подобным примерам 39 - 42 образом получают следующие соединения.
Пример 43. N-[4-[[3-[[[3,4-Диметоксифенил]метил]метиламино] пропил]тио] фенил]-9,10-дигидро-9-оксо-4-акридинкарбоксамид
Реакция сочетания 9,10-дигидро-9-оксо-4-акридинкарбоновой кислоты (0,8 г) с промежуточным соединением 38 (г) (1,16 г) после кристаллизации из этанола дает титульное соединение (0,28 г). Т.пл. 140oC.
Анализ для C33H33N3O4
найдено, %: C 69,7; H 5,7; N 7,5
рассчитано, %: 69,8; 5,9; 7,4
Пример 44. N-[4-[2-[[Фенилметил] метиламино]этокси]фенил]-9,10- дигидро-9-оксо-4-акридинкарбоксамид
Реакция сочетания 9,10-дигидро-9-оксо-4-акридинкарбоновой кислоты (1 г) с промежуточным соединением 36(в) (1 г) после кристаллизации из этанола дает титульное соединение (0,8 г). Т.пл. 173oC.
Анализ для C30H27N3O3
найдено, %: C 75,5; H 5,6; N 8,8
рассчитано, %: 75,45; 5,7; 8,8
Пример 45. N-[4-[3-[[2-]3,4-Диметоксифенил]этил]метиламино] пропокси]фенил]-9,10-дигидро-9-оксо-4-акридинкарбоксамид
Реакция сочетания 9,10-дигидро-9-оксо-4-акридинкарбоновой кислоты (1 г) с промежуточным соединением 38(а) (1,44 г) после кристаллизации из этанола дает титульное соединение (0,82 г). Т. пл. 140oC.
Анализ для C34H35N3O5
найдено, %: C 71,7; H 6,3; N 7,4
рассчитано, %: 72,2; 6,2; 7,4
Пример 46. N-[4-[3-[[[3,4-Диметоксифенил]метил]метиламино] пропокси]фенил]-9,10-дигидро-5-метокси-9-оксо-4-акридинкарбоксамид
Реакция сочетания 9,10-дигидро-5-метокси-9-оксо-4- акридинкарбоновой кислоты (2 г) с промежуточным соединением 38 (в) (2,4 г) после кристаллизации из изопропанола дает титульное соединение (1,2 г), т.пл. 180oC.
Анализ для C34H35N3O6
найдено, %: C 70,1; H 6,1; N 7,2
рассчитано, %: 70,2; 6,1; 7,2
Пример 47. N-[4-[2-[[2-[4-Метоксифенил]этил]метиламино]этокси]- фенил] -9,10-дигидро-9-оксо-4-акридинкарбоксамид
Реакция сочетания 9,10-дигидро-9-оксо-4-акридинкарбоновой кислоты (0,8 г) с промежуточным соединением 36(д) (0,9 г) после кристаллизации из этанола дает титульное соединение (0,7 г), т.пл. 165oC.
Анализ для C32H31N3O4
найдено, %: C 73,6; H 6,0; N 8,0
рассчитано, %: 73,7; 6,0; 8,1
Пример 48. N-[4-[3-[[2-[4-Метоксифенил]этил]метиламино]пропокси] фенил] -9,10-дигидро-9-оксо-4-акридинкарбоксамид
Реакция сочетания 9,10-дигидро-9-оксо-4-акридинкарбоновой кислоты (0,8 г) с промежуточным соединением 38(б) (0,94 г) после кристаллизации из этанола, дает титульное соединение (0,9 г). Т.пл. 160oC.
Анализ для C33H33N3O4
найдено, %: C 73,9; H 6,2; N 7,8
рассчитано, %: 74,0; 6,2; 7,8
Пример 49. N-[4-[2-[[4-[Метоксифенил]метил]метиламино]этокси] фенил]-9,10-дигидро-9-оксо-4-акридинкарбоксамид
Реакция сочетания 9,10-дигидро-9-оксо-4-акридинкарбоновой кислоты (0,6 г) с промежуточным соединением 36(е) (0,72 г) после кристаллизации из метанола дает титульное соединение (0,18 г). Т.пл. 146oC.
Анализ для C31H29N3O4
найдено, %: C 73,5; H 5,8; N 8,1
рассчитано, %: 73,35; 5,8; 8,3
Пример 50. N-[4-[2-[[[4-Метилфенил]метил]метиламино]этокси]фенил]-9,10- дигидро-9-оксо-4-акридинкарбоксамид
Реакция сочетания 9,10-дигидро-9-оксо-4-акридинкарбоновой кислоты (0,7 г) с промежуточным соединением 36 (ж) (0,78 г) после кристаллизации из изопропанола дает титульное соединение (0,23 г). Т.пл. 168oC.
Анализ для C31H29N3O3
найдено, %: C 75,3; H 6,0; N 8,1
рассчитано, %: 75,7; 5,95; 8,55
Пример 51. N-[4-[2-[[[3,4-Диметоксифенил]метил]метиламино]этокси]фенил] 9,10-дигидро-9-оксо-4-акридинкарбоксамид
Реакция сочетания 9,10-дигидро-9-оксо-4-акридинкарбоновой кислоты (1 г) с промежуточным соединением 36 (б) (1,25 г) после кристаллизации из этанола дает титульное соединение (1,39 г). Т.пл. 140oC
Анализ для C32H31N3O5
найдено, %: C 71,7; H 6,2; N 7,7
рассчитано, %: 71,5; 5,8; 7,8
Пример 52. N-[4-[2-[[[4-Метилтио] фенил]метил]метиламино]этокси]фенил- 9,10-дигидро-9-оксо-4-акридинкарбоксамид
Реакция сочетания 9,10-дигидро-9-оксо-4-акридинкарбоновой кислоты (0,8 г) с промежуточным соединением 36 (з) (1г) после кристаллизации из этанола дает титульное соединение (0,75 г).
Т.пл. 150oC.
Анализ для C31H29N3O3S
найдено,%: C 71,1; H 5,6; N 7,9; S 5,8
Рассчитано, %: 71,1; 5,6; 8,0; 6,1
Пример 53. N-[4-[2-[[[3,4-Диметоксифенил]метил]метиламино]этокси]фенил]- 9,10-дигидро-2-(метилтио)-9-оксо-4-акринилкарбоксамид
Реакция сочетания промежуточного соединения 39 (0,7 г) с промежуточным соединением 36 (б) (0,81 г) после кристаллизации из этанола дает титульное соединение (0,45 г) Т.пл. 170oC.
Анализ для C33H33N3O5S
найдено, %: C 68,1; H 5,65; N 7,0; S 5,4
рассчитано, %: 67,9; 5,7; 7,2; 5,5
Пример 54. N-[4-[2-[[[3,4-Диметоксифенил]метил]метиламино]этокси]фенил]- 9,10-дигидро-70(метилтио)-9-оксо-4-акридинкарбоксамид
Реакция сочетания 9,10-дигидро-7-(метилтио)-9-оксо-4-акридинкарбоновой кислоты (0,7 г) с промежуточным соединением 36 (б) (0,81 г) после кристаллизации из ацетонитрила дает титульное соединение (0,14 г). Т.пл. 160oC.
Анализ для C33H33N3O5S
найдено, %: C 67,8; H 5,8; N 7,1; S 5,4
рассчитано, %: 67,9; 5,7; 7,2; 5,5
Пример 55. N-[4-[2-[[2-[3,4-Диметоксифенил]этил]метиламино]этокси]фенил] - 9,10-дигидро-2-(метилтио)-9-оксо-4-акридинкарбоксамид
Реакция сочетания промежуточного соединения 39 (0,8 г) с промежуточным соединением 36 (а) (0,93 г) после кристаллизации из этанола даст титульное соединение (0,46 г). Т.пл. 150oC
Анализ для C34H35N3O5S
найдено, %: C 68,0; H 5,8; N 7,0; S 5,1
рассчитано, %: 68,3; 5,9; 7,0; 5,4
Пример 56. N-[4-[2-[[2-[3,4-Диметоксифенил]этил]метиламино]этокси]фенил] - 9,10-дигидро-10-метил-9-оксо-4-акридинкарбоксамид
реакция сочетания 9,10-дигидро-10-метил-9-оксо-4-акридинкарбоновой кислоты (0,72 г) с промежуточным соединением 36 (а) (0,9 г) после кристаллизации из изопропанола дает титульное соединение (0,8 г). Т.пл. 139oC.
Анализ для C34H35N3O5
найдено, %: C 72,25; H 6,2; N 7,4
рассчитано,: % 72,20; 6,2; 7,4
Пример 57. N-[4-[2-[[[3,4-Диметоксифенил]метил]метиламино]этокси]фенил]- 9,10-дигидро-5-метокси-9-оксо-4-акридинкарбоксамид
Реакция сочетания 9,10-дигидро-5-метокси-9-оксо-акридинкарбоновой кислоты (0,8 г) с промежуточным соединением 36 (б) (0,94 г) после кристаллизации из этанола дает титульное соединение (0,25 г). Т.пл. 184oC.
Анализ для C33H33N3O6
найдено, %: C 69,9; H 6,0; N 7,4
рассчитано, %: 69,8; 5,9; 7,4
Пример 58. N-[4-[2-[[2-[3,4-Диметоксифенил]этил]метиламино]этокси]фенил- 9,10-дигидро-5-метокси-9-оксо-4-акридинкарбоксамид
Реакция сочетания 9,10-дигидро-5-метокси-9-оксо-4-акридинкарбоновой кислоты (0,8 г) с промежуточным соединением 36 (а) (0,98 г) после кристаллизации из этанола дает титульное соединение (0,25 г). Т. пл. 190oC.
Анализ для C34H35N3O6
найдено, %: C 70,0; H 6,1; N 7,3
рассчитано, %: 70,2; 6,1; 7,2
Пример 59. N-[4-[3-[[[3,4-Диметоксифенил]метил]метиламино]пропокси]фенил]- 9,10-дигидро-9-оксо-4-акридинкарбоксамид
Реакция сочетания 9,10-дигидро-9-оксо-4-акридинкарбоновой кислоты (1 г) с промежуточным соединением 38 (в) (1,4 г) после кристаллизации из этанола дает титульное соединение (0,8 г). Т.пл. 130oC.
ИК-спектр : 1650 см-1 (CONH), 1620 см-1 (CO) и 3350 см-1 (NH).
Пример 60. N-[4-[3-[[[3,4-Диметоксифенил]метил]метиламино]пропокси]фенил]- 5-фтор-9,10-дигидро-9-оксо-4-акридинкарбоксамид
Реакция сочетания 5-фтор-9,10-дигидро-9-оксо-4-акридинкарбоновой кислоты (0,8 г) с промежуточным соединением 33 (в) (1 г) после кристаллизации из этанола дает титульное соединение (0,52 г). Т. пл. 150oC.
Анализ для C33H32FN3O5
найдено, %: C 69,6; H 5,7; F 3,25; N 7,3
рассчитано, %: 69,6; 5,7; 3,3; 7,4
Пример 61. N-[4-[2-[[2-[3,4-Диметоксифенил]этил]метиламино]этил]фенил]- 9,10-дигидро-9-оксо-4-акридинкарбоксамид
Реакция сочетания 9,10-дигидро-9-оксо-4-акридинкарбоновой кислоты (0,76 г) с промежуточным соединением 33 (д) (1 г) после кристаллизации из ацетонитрила получают титульное соединение (0,7 г). Т.пл. 180oC.
Анализ для C33H33N3O4
найдено, %: C 73,5; H 6,1; N 7,9
рассчитано, %: 74,0; 6,2; 7,8
Пример 62. N-[4-[4-[[[4-Метилтио] фенил]метил]метиламино]бутил]фенил]- 9,10-дигидро-9-оксо-4-акридинкарбоксамид
Реакция сочетания 9,10-дигидро-9-оксо-4-акридинкарбоновой кислоты (0,8 г) с промежуточным соединением 33 (к) (1 г) после кристаллизации из ацетонитрила дает титульное соединение (0,64 г). Т.пл. 135oC.
Анализ для C33H33N3O2S
найдено, %: C 73,7; H 6,2; N 7,9; S 5,7
рассчитано, %: 74,0; 6,2; 7,8; 6,0
Пример 63. N-[4-[4-[[[4-фторфенил] метил]метиламино]бутил]фенил]-9,10- дигидро-9-оксо-4-акридинкарбоксамид
Реакция сочетания 9,10-дигидро-9-оксо-4-акридинкарбоновой кислоты (0,7 г) с промежуточным соединением 33 (и) (0,86 г) после кристаллизации из ацетонитрила дает титульное соединение (0,43 г). Т. пл. 151oC.
Анализ для C32H30FN3O2
найдено, %: C 75,9; H 6,0; F 3,7; N 8,25
рассчитано, %: 75,7; 5,9; 3,7; 8,3
Пример 64. N-[4-[3-[[[4-Метоксифенил] метил]метиламино]пропил]фенил]-9,10- дигидро-9-оксо-4-акридинкарбоксамид
Реакция сочетания 9,10-дигидро-9-оксо-4-акридинкарбоновой кислоты (0,72 г) с промежуточным соединением 33 (ж) (0,85 г) после кристаллизации из изопропанола дает титульное соединение (0,64 г). Т.пл. 155o.
Анализ для C32H31N3O3
найдено, %: C 76,2; H 6,1; N 7,9
рассчитано, %: 76,0; 6,2; 8,3
Пример 65. N-[4-[4-[[2-[4-Метоксифенил]этил]метиламино]бутил] фенил]-9,10-дигидро-9-оксо-4-акридинкарбоксамид
Реакция сочетания 9,10-дигидро-9-оксо-4-акридинкарбоновой кислоты (0,8 г) с промежуточным соединением 33 (з) после кристаллизации из ацетонитрила дает титульное соединение (0,53 г). Т. пл. 143oC.
Анализ для C34H35N3O3
найдено, %: C 76,4; H 6,6; N 7,8
рассчитано, %: 76,5; 6,6; 7,9
Пример 66. N-[4-[3-[[2-[3,4-Диметоксифенил]этил]метиламино] пропил]фенил]-9,10-дигидро-9-оксо-4-акридинкарбоксамид
Реакция сочетания 9,10-дигидро-9-оксо-4-акридинкарбоновой кислоты (0,8 г) с промежуточным соединением 33 (г) (1 г) после порошкования с эфиром дает титульное соединение (0,88 г).
Т.пл. 114oC.
Анализ для C34H35N3O4
найдено,%: C 74,2; H 6,35; N 7,55
рассчитано,%: 74,3; 6,4; 7,6
Пример 67. N-[4-[4-[[2-[3,4-Диметоксифенил]этил]метиламино] бутил]фенил] -9,10-дигидро-9-оксо-4-акридинкарбоксамид
Реакция сочетания 9,10-дигидро-9-оксо-4-акридинкарбоновой кислоты (0,72 г) с промежуточным соединением 33 (в) (1 г) после кристаллизации из ацетонитрила дает титульное соединение (0,12 г). Т.пл. 120oC.
Анализ для C35H37N3O4
найдено, %: C 74,2; H 6,5; N 7,6
рассчитано, %: 74,6; 6,6; 7,45
Пример 68. N-[4-[2-[[2-[4-Метоксифенил] этил]метиламино] этил]фенил]-9,10-дигидро-9-оксо-4-акридинкарбоксамид
Реакция сочетания 9,10-дигидро-9-оксо-4-акридинкарбоновой кислоты (0,8 г) с промежуточным соединением 33 (л) (0,95 г) после кристаллизации из ацетонитрила дает титульное соединение (0,4 г). Т.пл. 179oC.
Анализ для C32H31N3O3
найдено, %: C 76,0; H 6,1; N 8,1
рассчитано, %: 76,0; 6,2; 8,3
Пример 69. N-[4-[3-[[[3,4-Диметоксифенил]метил]метиламино] пропил]фенил] -9,10-дигидро-9-оксо-4-акридинкарбоксамид
Реакция сочетания 9,10-дигидро-9-оксо-4-акридинкарбоновой кислоты (0,8 г) с промежуточным соединением 33 (е) (1 г) после кристаллизации из ацетонитрила дает титульное соединение (1 г). Т. пл. 112oC.
Анализ для C33H33N3O4
найдено, %: C 74,1; H 6,2; N 7,7
рассчитано, %: 74,0; 6,2; 7,8
Пример 70. N-[4-[5-[[[3,4-Диметоксифенил]метил]метиламино] пентил]фенил] -9,10-дигидро-9-оксо-4-акридинкарбоксамид
Реакция сочетания 9,10-дигидро-9-оксо-4-акридинкарбоновой кислоты (0,8 г) с промежуточным соединением 33 (м) (1,15 г) после порошкования с эфиром дает титульное соединение (0,41 г). Т. пл. 110oC.
Анализ для C35H37N3O4
найдено, %: C 74,3; H 6,6; N 7,4
рассчитано, %: 74,6; 6,6; 7,45
Пример 71. N-[4-[4-[[2-[3,4-Диметоксифенил]этил]метиламино] бутил]фенил] -9,10-дигидро-7-метокси-9-оксо-4-акридинкарбоксамид
Реакция сочетания 9,10-дигидро-7-метокси-9-оксо-4-акридинкарбоновой кислоты (1 г) с промежуточным соединением 33 (в) (1,3 г) после кристаллизации из этанола дает титульное соединение (0,85 г).
Т.пл. 155oC.
Анализ для C36H39N3O5
найдено, %: C 72,7; H 6,9; N 7,05
рассчитано, %: 72,8; 6,6; 7,1
Пример 72. N-[4-[4-[[[3,4-Диметоксифенил]метил]метиламино]бутил]фенил] -9,10- дигидро-5-метокси-9-оксо-4-акридинкарбоксамид
Реакция сочетания 9,10-дигидро-5-метокси-9-оксо-4-акридинкарбоновой кислоты (0,8 г) с промежуточным соединением 33 (а) (0,98 г) после кристаллизации из изопропанола дает титульное соединение (0,12 г). Т. пл. 157oC
Анализ для C35H37N3O5
найдено, %: C 71,9; H 6,4; N 7,2
рассчитано, %: 72,5; 6,4; 7,25
Пример 73. N-[4-[3-[[[3,4-Диметоксифенил]метил]метиламино]пропил] фенил] -5-фтор-9,10-дигидро-9-оксо-4-акридинкарбоксамид
Реакция сочетания 5-фтор-9,10-дигидро-9-оксо-4-акридинкарбоновой кислоты (0,72 г) с промежуточным соединением 33 (е) (0,9 г) после кристаллизации из этанола дает титульное соединение (0,89 г). Т. пл. 158oC.
Анализ для C33H32FN3O4
найдено, %: C 71,9; H 6,1; F 3,25; N 7,7
рассчитано, %: 71,65; 5,8; 3,4; 7,6
Пример 74. N-[4-[2-[[[3,4-Диметоксифенил]метил]метиламино]этил] фенил] -5-фтор-9,10-дигидро-9-оксо-4-акридинкарбоксамид
Реакция сочетания 5-фтор-9,10-дигидро-9-оксо-4-акридинкарбоновой кислоты (1 г) с промежуточным соединением 33 (б) (1,2 г) после кристаллизации из этанола дает титульное соединение (0,78 г). Т. пл. 175oC.
Анализ для C32H30FN3O4
найдено,%: C 69,9; H 5,5; F 3,1; N 7,45
рассчитано,%: 70,1; 5,7; 3,5; 7,65
Пример 75. N-[4-[4-[[[3,4-Диметоксифенил]метил]метиламино]бутил]фенил] -9,10- дигидро-5-нитро-9-оксо-4-акридинкарбоксамид
Реакция сочетания 9,10-дигидро-5-нитро-9-оксо-4-акридинкарбоновой кислоты (0,6 г) с промежуточным соединением 33 (а) (0,7 г) после кристаллизации из ацетонитрила дает титульное соединение (0,35 г). Т. пл. 174oC.
Анализ для C34H34N4O6
найдено, %: C 68,6; H 5,7; N 9,5
рассчитано, %: 68,7; 5,8; 9,4
Пример 76. N-[4-[2-[[[3,4-Диметоксифенил]метил]метиламино]этил] фенил] -9,10-дигидрокси-5-нитро-9-оксо-4-акридинкарбоксамид
Реакция сочетания 9,10-дигидро-5-нитро-9-оксо-4-акридинкарбоновой кислоты (0,6 г) с промежуточным соединением 33 (б) (0,63 г) после кристаллизации из изопропанола дает титульное соединение (0,45 г). Т. пл. 197oC.
Анализ для C32H30N4O6
найдено,%: C 67,4; H 5,3; N 9,7
рассчитано,%: 67,8; 5,3; 9,9
Пример 77. N-[4-[5-[[[3,4-Диметоксифенил]метил]метиламино] пентил]фенил] -5-фтор-9,10-дигидро-9-оксо-4-акридинкарбоксамид
Реакция сочетания 5-фтор-9,10-дигидро-9-оксо-4-акридинкарбоновой кислоты (0,8 г) с промежуточным соединением 33 (м) (1 г) после кристаллизации из ацетонитрила дает титульное соединение (0,29 г). Т. пл. 130oC. Анализ для C35H36FN3O4
найдено,%: C 71,9; H 6,2; F 3,2; N 7,1
Рассчитано,%: 72,3; 6,2; 3,3; 7,2
Пример 78. N-[4-[4-[[2-[4-Метоксифенил]-этил]метиламино] бутил]фенил]-9,10-дигидро-5-метокси-9-оксо-4-акридинкарбоксамид
Реакция сочетания 9,10-дигидро-5-метокси-9-оксо-4-акридинкарбоновой кислоты (0,8 г) с промежуточным соединением 33 (з) (0,93 г) после порошкования с эфиром дает титульное соединение (0,3 г). Т. пл. 182oC.
Анализ для C35H37N3O4
найдено,%: C 74,2; H 6,6; N 7,8
рассчитано,%: 74,6; 6,6; 7,5
Пример 79. N-[4[2-[[2-[3,4-Диметоксифенил]этил]метиламино] этил]фенил] -9,10-дигидро-5-метокси-9-оксо-4-акридинкарбоксамид
Реакция сочетания 9,10-дигидро-5-метокси-9-оксо-4-акридинкарбоновой кислоты (0,8 г) с промежуточным соединением 33 (д) (0,94 г), после кристаллизации из изопропанола, дает титульное соединение (0,17 г). Т. пл. 179oC.
Анализ для C34H35N3O5
найдено,%: C 72,3; H 6,0; N 7,8
рассчитано,%: 72,2; 6,2; 7,4
Пример 80. N-[4-[4-[[2-[3,4-диметоксифенил]этил]метиламино] бутил]пентил]-9,10-дигидро-5-метокси-9-оксо-4-акридинкарбоксамид.
Реакция сочетания 9,10-дигидро-5-метокси-9-оксо-4-акридинкарбоновой кислоты (0,8 г) с промежуточным соединением 33 (в) (1 г) после кристаллизации из изопропанола дает титульное соединение (0,12 г). Т. пл. 170oC, ИК-спектр: 1645 см-2 (CONH), 1620 см-1 (CO) и 3300 см-1 (NH).
Пример 81. N-[4-[3-[[[3,4-Диметоксифенил]метил]метиламино]пропил]фенил] -9,10- дигидро-5-нитро-9-оксо-4-акридинкарбоксамид
Реакция сочетания 9,10-дигидро-5-нитро-9-оксо-4-акридинкарбоновой кислоты (0,8 г) с промежуточным соединением 33 (е) (0,88 г) после кристаллизации из изопропанола дает титульное соединение (0,29 г) Т.пл. 192oC. Анализ для C33H32N4O6
найдено, %: C 67,8; H 5,6; N 9,4
рассчитано, %: 68,3; 5,6; 9,65
Пример 82. N-[4-[3-[[[3,4-Диметоксифенил]метил]метиламино]пропил]фенил] -9,10- дигидро-5-метокси-9-оксо-4-акридинкарбоксамид
Реакция сочетания 9,10-дигидро-5-метокси-9-оксо-4-акридинкарбоновой кислоты (0,8 г) с промежуточным соединением 33 (е) (0,93 г) после кристаллизации из этанола дает титульное соединение (0,27 г). Т. пл. 180oC.
Анализ для C34H35N3O5
найдено, %: C 72,0; H 6,1; N 7,6
рассчитано, %: 72,2; 6,2; 7,4
Пример 83. N-[4-[2-[[Фенилметил]этиламино]этокси]фенил]-9,10- дигидро-9-оксо-4-акридинкарбоксамид
Реакция сочетания 9,10-дигидро-9-оксо-4-акридинкарбоновой кислоты (0,8 г) с промежуточным соединением 36 (и) (0,9 г) после кристаллизации из этанола дает титульное соединение (0,34 г). Т. пл. 157oC.
Анализ для C31H29N3O3
найдено, %: C 75,3; H 5,9; N 8,4
рассчитано, %: 75,7; 5,9; 8,5
Пример 84. N-[4-[4-[[[3,4-Диметоксифенил]метил]метиламино] бутил]фенил] -9,10-дигидро-10-метил-9-оксо-4-акридинкарбоксамид
Реакция сочетания 9,10-дигидро-10-метил-9-оксо-4-акридинкарбоновой кислоты (0,8 г) с промежуточным соединением 33 (а) (1,04 г) после кристаллизации за изопропанола дает титульное соединение (0,65 г). Т. пл.: 142oC, ИК-спектр: 1675 см-1 (CONH), 1610 (CO) и 3250 см-1 (NH).
Пример 85. N-[4-[2-[[[3,4-Диметоксифенил]метил]метиламино]этил] фенил] -9,10-дигидро-10-метил-9-оксо-4-акридинкарбоксамид
Реакция сочетания 9,10-дигидро-10-метил-9-оксо-4-акридинкарбоновой кислоты (0,87 г) с промежуточным соединением 33 (б) (1 г) после кристаллизации из изопропанола дает титульное соединение (0,42 г). Т. пл. 182oC.
Анализ для C33H33N3O4
найдено, %: C 73,5; H 6,1; N 7,8
рассчитано, %: 74,0; 6,2; 7,8
Пример 86. N-[4-[4-[[[3,4-Диметоксифенил]метил]метиламино]бутил] фенил] -9,10-дигидро-7-метокси-9-оксо-4-акридинкарбоксамид
Реакция сочетания 9,10-дигидро-7-метокси-9-оксо-4-акридинкарбоновой кислоты (0,8 г) с промежуточным соединением 33 (а) (0,97 г) после кристаллизации из изопропанола дает титульное соединение (0,17 г). Т. пл.: 172oC.
Анализ для C35H37N3O5
найдено,%: C 71,5; H 6,4; N 6,9
рассчитано,%: 71,4; 6,5; 7,1
Пример 87. N-[4-[[2[[[3,4-Диметоксифенил] метил] метиламино] этил]тио] фенил/-9,10-дигидро-9-оксо-4-акридинкарбоксамид
Реакция сочетания 9,10-дигидро-9-оксо-4-акридинкарбоновой кислоты (0,7 г) с промежуточным соединением 36 (г) (1 г) после кристаллизации из изопропанола дает титульное соединение (0,26 г). Т. пл. 113oC.
Анализ для C32H531N3O4S
найдено, %: C 69,3; H 5,5; N 7,4; S 5,8
рассчитано, %: 69,4; 5,6; 7,6; 5,8
Пример 88. N-[4-[[3-[[[3,4-Диметоксифенил]метил]метиламино] пропил]тио] -фенил]-9,10-дигидро-5-метил-9-оксо-4-акридинкарбоксамид
Реакция сочетания 9,10-дигидро-5-метил-9-оксо-акридинкарбоновой кислоты (0,8 г) с промежуточным соединением 58(г) (1,09 г) после кристаллизации из этанола дает титульное соединение (50 мг). Т. пл. 158oC
Анализ для C34H35N3O4S 0,5 H2O
найдено, %: C 69,4; H 5,9; N 6,9; S 5,6
рассчитано, %: 69,1; 6,1; 7,1; 5,4
Пример 89. N-[4-[[3-[[[3,4-Диметоксифенил]метил]метиламино] пропил]тио] фенил]-9,10-дигидро-5-метокси-9-оксо-4-акридинкарбоксамид
Реакция сочетания 9,10-дигидро-5-метокси-9-оксо- акридинкарбоновой кислоты (1 г) с промежуточным соединением 38(г) (1,28 г) после кристаллизации из ацетонитрида дает титульное соединение (0,37 г). Т.пл. 184-186oC.
Анализ для C34H35N3O5S
найдено, %: C 68,1; H 5,9; N 6,8; S 5,2
рассчитано, %: 68,3; 5,9; 7,0; 5,4
Пример 90. N-[4-[[3-[[[3,4-Диметоксифенил]метил]метиламино] пропил]тио] фенил]9,10-дигидро-5-фтор-9-оксо-4-акридинкарбоксамид
Реакция сочетания 9,10-дигидро-5-фтор-9-оксо-акридинкарбоновой кислоты (0,9 г) с промежуточным соединением 38 (г) (1,1 г) после кристаллизации из изопропанола дает титульное соединение (0,5 г). Т. пл. 120-130oC
Анализ для C33H22FN3O4S • 0,5 H2O
найдено, %: C 66,6; H 5,6; F 3,1; N 6,9; S 5,3
рассчитано, %: 66,6; 5,6; 3,2; 7,1; 5,4
Пример 91. N-[4-[2-[[[3,4-Диметоксифенил] -метил] метиламино] этил]фенил-9,10-дигидро-5-метилтио-9-оксо-4-акридинкарбоксамид
Сочетание 9,10-дигидро-5-метилтио-9-оксо-4-акридинкарбоновой кислоты (0,7 г) с промежуточным соединением 33(б) (0,74 г) после кристаллизации из этанола дает титульное соединение (0,3 г). Т. пл. 190oC.
Анализ для C33H33N3O4S • 0,5 H2O
найдено, %: C 68,5; H 6,1; N 7,2
рассчитано, %: 68,7; 5,9; 7,3
Пример 92. N-[4-[2-[[[3,4-Диметоксифенил]метил]метиламино] этил]фенил]- 9,10-дигидро-5-метил-9-оксо-4-акридинкарбоксамид
Сочетание 9,10-дигидро-5-метил-9-оксо-4-акридинкарбоновой кислоты (1,27 г) с промежуточным соединением 33(б) (1,5 г) после кристаллизации из смеси изопронола с диизопропиловым эфиром дает титульное соединение (0,3 г). Т. пл. 119oC.
Анализ для C33H33N3O4
найдено, %: C 73,5; H 6,2; N 7,6
рассчитано, %: 74,0; 6,2; 7,8
Пример 93. N-[4-[3-[[[3,4-Диметоксифенил]метил]метиламино] пропокси]фенил]-9,10-дигидро-5-метил-9-оксо-4-акридинкарбоксамид
Сочетание (реакция сочетания) 9,10-дигидро-5-метил-9-оксо-4-акридинкарбоновой кислоты (1 г) с промежуточным соединением 38(в) (1,3 г) после кристаллизации из изопропанола дает титульное соединение (0,9 г). Т. пл. 160oC.
Анализ для C34H35N3O5
найдено, %: C 72,3; H 6,3; N 7,5
рассчитано, %: 72,2; 6,3; 7,5
Пример 94. N-[4-[2-[[[3,4-Диметоксифенил]-метил]метиламино] этиламино] фенил]-9,10-дигидро-5-метокси-9-оксо-4-акридинкарбоксамид
Сочетание 9,10-дигидро-5-метокси-9-оксо-4-акридинкарбоновой кислоты (1,4 г) с промежуточным соединением 43 (1,4 г), после кристаллизации из изопропанола имеет титульное соединение (0,2 г). Т. пл. 196oC
Анализ для C33H34N4O5
найдено, %: C 69,8; H 6,3; N 10,0
рассчитано, %: 69,9; 6,1; 9,9
Пример 95. N-[4-[2-[[[3,4-Диметоксифенил]метил]метиламино] этил]фенил] -9,10-дигидро-5,8-диметокси-9-оксо-4-акридинкарбоксамид
Сочетание 9,10-дигидро-5,8-диметокси-9-оксо-4-акридинкарбоновой кислоты (0,8 г) с промежуточным соединением 33(б) (0,67 г) после кристаллизации из этанола дает титульное соединение (0,15 г). Т. пл. 196oC.
Анализ для C34H35N3O6 • 0,5 H2O
найдено, %: C 68,99; H 5,76; N 7,18
рассчитано, %: 69,13; 6,14; 7,11
Пример 96. N-[4-[2-[[[3,4-Диметоксифенил]-метил]метиламино] этил]фенил] -9,10-дигидро-5,7-диметокси-9-оксо-4-акридинкарбоксамид
Реакция сочетания (сочетание) промежуточного соединения 44 (1,4 г) с промежуточным соединением 33(б) (1,2 г) после кристаллизации из этанола дает титульное соединение (0,25 г). Т.пл. выше 260oC.
Анализ для C34H35N3O6
найдено, %: C 70,09; H 6,35; N 7,01
рассчитано, %: 70,20; 6,06; 7,22
Пример 97. N-[4-[2-[[[3,4-Диметоксифенил]метил]метиламино]этил] фенил] -9,10-дигидро-6,7,8-триметокси-9-оксо-4-акридинкарбоксамид
Сочетание (реакция сочетания) промежуточного соединения 45 (0,6 г) с промежуточным соединением 33(б) (0,6 г) после кристаллизации из изопропанола дает титульное соединение (0,4 г). Т.пл. 158oC.
Анализ для C35H37N3O7
найдено, %: C 68,69; H 6,32; N 6,40
рассчитано, %: 68,72; 6,10; 6,87
Пример 98. N-[4-[3-[[[3,4-Диметоксифенил]метил]амино]пропокси] фенил]-9,10-дигидро-9-оксо-4-акридинкарбоксамид
Смесь промежуточного соединения 40 (0,5 г) и 3,4-диметоксибензолметанамина (0,5 г) нагревают при 140oC в течение 1 часа. Затем добавляют воду и смесь экстрагируют дихлорметаном. Высушенную органическую фазу концентрируют с получением твердого вещества, которое очищают путем колоночной хроматографии, элюируя смесью дихлорметана с метанолом (9:1). Результирующее твердое вещество кристаллизуют из бензола, получают титульное соединение (50 мг). Т. пл. 138-139oC.
Анализ для C32H31N3O5 • 0,5 H2O
найдено, %: C 70,1; H 5,9; N 7,5
рассчитано, %: 70,3; 5,9; 7,7
Пример 99. Оксалат N-[4-[4-[[[3,4-диметоксифенил]метил]метиламино]бутил] фенил]-9,10-дигидро- 9-оксо-4-акридинкарбоксамида
Раствор вещества примера 41 (0,55 г) и дигидратированной щавелевой кислоты (0,126 г) в этаноле (10 мл) кипятят в течение 2 минут. После охлаждения и царапания палочкой по стенкам стакана происходит кристаллизация. Кристаллы отфильтровывают и высушивают, причем получают титульное соединение (0,55 г).
Т. пл. 155-160oC.
Анализ для C36H37N3O8 (0,5 H2O)
найдено, %: C 66,3; H 5,9; N 6,3
рассчитано, %: 66,6; 5,9; 6,4
Пример 100. Малеат N-[4-[4-[[[3,4-пиметоксифенил]метил]метиламино]бутил] -фенил]-9,10-дигидро- 9-оксо-4-акридинкарбоксамида
Раствор соединения примера 41 (0,55 г) и малеиновой кислоты (0,130 г) в этаноле (50 мл) кипятят в течение 2 минут. После охлаждения и царапания палочкой по стенке стакана, происходит кристаллизация. Кристаллы отфильтровывают и высушивают, получая титульное соединение (0,5 г). Т. пл. 205oC.
Анализ для C38H39N3O8
найдено, %: C 68,2; H 5,9; N 6,2
рассчитано, %: 68,5; 5,9; 6,3
Пример 101. Гидрохлорид N-[4-[4-[[[3,4-диметоксифенил]метил]метиламино] бутил]-фенил]-9,10-дигидро-9- оксо-4-акридинкарбоксамида
Горячий раствор соединения примера 41 (0,55 г) в этаноле (50 мл) обрабатывают незначительным избытком эфирного раствора соляной кислоты. Раствор затем концентрируют с получением пены, которую порошкуют с изопропанолом, получая титульное соединение (0,4 г) в виде кристаллов. Т. пл. 165oC.
Анализ для C34H36ClN3O4 H2O
найдено, %: C 67,6; H 6,3; N 7,0
рассчитано, %: 67,5; 6,4; 7,0
Пример 102. L(+)Лактат N-[4-[4-[[[3,4-диметоксифенил]метил]метиламино] -бутил]фенил]-9,10-дигидро- 9-оксо-4-акридинкарбоксамида.
Раствор соединения примера 41 (0,55 г) и L(+)-молочной кислоты (0,95 г) в изопропаноле (30 мл) кипятят в течение 2 минут. После охлаждения и царапания палочкой по стенке стакана, происходит кристаллизация. Кристаллы отфильтровывают и высушивают, получая титульное соединение (0,45 г). Т.пл. 120oC.
Анализ для C37H41N3O7
найдено, %: C 69,5; H 6,5; N 6,6
рассчитано, %: 69,4; 6,6 N; 6,5
Пример 103. Оксалат N-[3-[3-[[[3,4-диметоксифенил] метил] метиламино] пропил]-фенил]-5-фтор- 9,10-дигидро-9-оксо-4-акридинкарбоксамида
Смесь 5-фтор-9,10-дигидро-9-оксо-4-акридинкарбоновой кислоты (1 г) и 1-оксобензотриазола (0,63 г) в ДМФ (30 мл) перемешивают при комнатной температуре в течение 10 минут. Затем добавляют промежуточное соединение 51 (1,23 г) в ДМФ (3,9 мл), после чего - дициклогексилкарбодиимид (0,8 г), и смесь перемешивают при комнатной температуре в течение 16 часов и отфильтровывают. Фильтрат концентрируют в вакууме, обрабатывают разбавленным раствором гидроксида натрия и экстрагируют метиленхлоридом. Объединенные, высушенные, органические экстракты выпаривают до тех пор, пока не останется масло, которое, после очистки с помощью колоночной хроматографии на силикагеле при элюировании смесью метиленхлорида с метанолом (99:1), приводит к титульному соединению (1,1 г). т.пл. 126oC.
Анализ для C33H32FN3O4 • C2H2O4 (H2O)
найдено, %: C 63,9; H 5,4; F 2,8; N 6,2
рассчитано, %: 63,5; 5,5; 2,9; 6,3
Подобным примеру 103 образом получают следующие соединения.
Пример 104. N-[3-[3-[[[3,4-Диметоксифенил]метил]метиламино]пропокси]фенил]-9,10-дигидро- 5-метокси-9-оксо-4-акридинкарбоксамид
Сочетание 9,10-дигидро-5-метокси-9-оксо-4-акридинкарбоновой кислоты (1,5 г) с промежуточным соединением 48(б) (1,22 г) после кристаллизации из изопропанола дает титульное соединение (0,47 г) в виде твердого вещества. Т. пл. 124oC.
Анализ для C34H35N3O6
найдено, %: C 70,1; H 6,1; N 7,05
рассчитано, %: 7,92; 6,1; 7,2
Пример 105. Оксалат N-[3-[3-[[[3,4-Диметоксифенил]метил]метиламино]пропил]-фенил]-9,10-дигидро- 5-метокси-9-оксо-4-акридинкарбоксамид
Сочетание 9,10-дигидро-5-метокси-9-оксо-4-акридинкарбоновой кислоты (1,26 г) с промежуточным соединением 51 (1,23 г) дает титульное соединение (1,13 г), Т.п. 112-114oC.
Анализ для C34H35N3O5 C2H2O4 (0,5 H2O)
найдено, %: C 65,2; H 6,2; N 6,2
рассчитано, %: 65,0; 5,8; 6,3
Пример 106. Фумарат N-[3-[2-[[[3,4-диметоксифенил]метил]метиламино]этил] фенил]-5-фтор- 9,10-дигидро-9-оксо-4-акридинкарбоксамида
Реакция сочетания 5 фтор-9,10-дигидро-9-оксо-4-акридинкарбоновой кислоты (0,34 г) с промежуточным соединением 48(а) (0,4 г) дает титульное соединение (0,3 г). Т.пл. 155oC.
Пример 107. Фумарат N-[3-[2-[[[3,4-диметоксифенил]метил]метиламино]этил] фенил]-9,10-дигидро-5- метокси-9-оксо-4-акридинкарбоксамида.
Сочетание 9,10-дигидро-5-метокси-9-оксо-4-акридинкарбоновой кислоты (0,36 г) с промежуточным соединением 48 (а) (0,4 г) дает титульное соединение (0,13 г) Т.пл. 140oC.
В примерах 106 и 107 соответствующие свободные основания получают по методике, аналогичной примеру 103, а затем превращают в соли фумаратов методом, аналогичным примеру 100.
Пример 108. N-[4-[4[[[3,4-Диметоксифенил]метил]метиламино]бутил]-2-метоксифенил]-9,10-дигидро-5-метокси-9-оксо-4-акридинкарбоксамид
Сочетание 9,10-дигидро-5-метокси-9-оксо-4-акридинкарбоновой кислоты (0,38 г) с промежуточным соединением 55 (0,5 г) дает после кристаллизации из изопропанола титульное соединение (0,36 г) в виде твердого вещества. Т.пл. 114 - 115oC
Анализ для C36H39N3O6
найдено, %: C 70,98; H 6,19; N 6,79
рассчитано, %: 70,92; 6,45; 6,89
Пример 109. 9,10-Дигидро-5-метокси-9-оксо-N-[4-[[2-[1,2,3,4-тетрагидро-6,7- диметокси-2-изхинолинил]этил]амино]фенил]-4-акридинкарбоксамид
Сочетание 9,10-дигидро-5-метокси-9-оксо-4-акридинкарбоновой кислоты (0,99 г) с промежуточным соединением 59 (1,2 г) после кристаллизации из ацетонитрила дает титульное соединение (1,3 г).
Т.пл. 228 - 234oC.
Анализ для C34H34N4O5 0,5 H2O
найдено, %: C 69,37; H 5,87; N 9,37
рассчитано, %: 69,48; 6,00; 9,50
Пример 110. N-[4-[2-[2,3-Дигидро-5,6-диметокси-1H-изоиндол-2-ил]-этил] фенил] 9,10-дигидро-5-метокси-9-оксо-4-акридинкарбоксамид
Сочетание 9,10-дигидро-5-метокси-9-оксо-4-акридинкарбоновой кислоты (0,54 г) с промежуточным соединением 60 (0,6 г) после кристаллизации из этанола дает титульное соединение (0,3 г).
Т.пл. 215 - 225oC.
ЯМР-спктр: δ = 2,85 (4H, c, N-(CH2)2-фенил); 3,7 (6H, c, 2xOCH3), 3,8 (3H, c, OCH3), 3,9 (4H, c, 1 x N-CH2-фенил).
Пример 111. 9,10-Дигидро-5,8-диметокси-N-[2-метокси-4-[3-[1,2,3,4-тетрагидро- 6,7-диметокси-2-изохинолинил] пропил] фенил] -9-оксо-4-акридинкарбоксамид
Сочетание 9,10-дигидро-5,8-диметокси-9-оксо-4-акридинкарбоновой кислоты (0,7 г) с промежуточным соединением 16(а) (0,83 г) после кристаллизации на этаноле дает титульное соединение (0,1 г).
Т.пл. 140oC
Анализ для C37H39N3O7• H2O
найдено, %: C 67,44; H 5,94; N 6,80
рассчитано, %: 67,77; 6,30; 6,40
Пример 112. 9,10-дигидро-5-метокси-N-[4-[2-[1,2,3,4-тетрагидро-6,7-диметокси- 2-изохинолинил]-1-оксиэтил]фенил]9-оксо-4-акридиникарбоксамид
Сочетание 9,10-дигидро-5-метокси-9-оксо-4-акридинкарбоновой кислоты (0,49 г) с промежуточным соединением 63 (0,5 г) после кристаллизации из ацетонитрила дает титульное соединение (0,8 г)
Т.пл. 160 - 165oC
Анализ для C34H33N3O6 H2O
найдено, %: C 68,51; H 5,74; N 7,25
рассчитано, %: 68,33; 5,90; 7,09
Пример 113. 9,10-Дигидро-5-метокси-9-оксо-N-[4-[[[2-[1,2,3,4-тетрагидро-6,7- диметокси-2-изохинолинил]этил]метиламино]метил]фенил]-4- акринилкарбоксамид
Сочетание 9,10-дигидро-5-метокси-9-оксо-4-акридинкарбоновой кислоты (0,53 г) с промежуточным соединением 67 (0,7 г) путем осаждения смесью метиленхлорида с диэтиловым эфиром дает титульное соединение (0,5 г). Т.пл. 202oC.
Анализ для C36H38N4O5•1,25H2O
найдено, %: C 68,68; H 6,27; N 8,52
рассчитано, %: 68,71; 6,48; 8,90
Пример 114. N-[4-[[[2-[[[3,4-Диметоксифенил]метил]метиламино]-этил]-метиламино]- метил]фенил]-9,10-дигидро-5-метокси-9-оксо-4-акридинкарбоксамид
Сочетание 9,10-дигидро-5-метокси-9-оксо-4-акридинкарбоновой кислоты (1,1 г) с промежуточным соединением 70 (1,43 г) после кристаллизации из метанола дает титульное соединение (0,75 г) в виде твердого вещества желтого цвета. Т.пл. 170oC.
Анализ для C35H38N4O5 • 0,5H2O
найдено, %: C 69,69; H 6,30; N 9,10
рассчитано, %: 69,63; 6,51; 9,28
Пример 115. 5-фтор-9,10-дигидро-N-[2-метокси-4-[3-[1,2,3,4-тетрагидро-6,7-диметокси- 2-изохинолинил]пропил]фенил]-9-оксо-4-акридинкарбоксамид
Сочетание 5-фтор-9,10-дигидро-9-оксо-4-акридинкарбоновой кислоты (0,5 г) с промежуточным соединением 16(а) (0,63 г) после кристаллизации из этанола дает титульное соединение (0,3 г).
Т.пл. 128oC
ЯМР-спектр: δ = 3,6 (3H, c., OCH3), 3,8 (6H, c, 2 x OCH3), 9,15 (1H, c, NHCO), 11,35 (1H, c, NH-акридон).
Пример 116. N-[4-[[3-[[[3,4-Диметоксифенил]метил]метиламино]пропилтио] -фенил]- 9,10-дигидро-5-]метилтио]-9-оксо-4-акридинкарбоксамид
Сочетание 9,10-дигидро-5-метилтио-9-оксо-4-акридинкарбоновой кислоты (0,3 г) с промежуточным соединением 38 (г) (0,36 г) дает после кристаллизации из метанола титульное соединение (0,13 г). Т.пл. 142oC
ЯМР-спектр: δ = 2,2 (3H, c, SCH3), 2,45 (3H, c, N-CH3, 3,7 (6H, c, 2xOCH3)
Пример 117. N-[4-[3-[[[3,4-Диметоксифенил] метил]метиламино]пропил]-2- метоксифенил]-9,10-дигидро-5-метил-9-оксо-4-акридинкарбоксамид
Сочетание 9,10-дигидро-5-метил-9-оксо-4-акридинкарбоновой кислоты (0,75 г) с промежуточным соединением 30 ( 1 г) после кристаллизации из метанола дает титульное соединение (0,1 г) Т.пл. 111oC.
ЯМР-спектр: δ = 2,18 (3H, c, NCH3), 2,55 (3H, c, CH3 акридина), 3,42 (2H, c, N-CH2-фенил), 3,9 (9H, 3c, 3хOCH3)
Пример 118. N-[2-Этокси-4-[3-[1,2,3,4-тетрагидро-6,7-диметокси-2-изохинолинил]- пропил]-фенил]-5-фтор-9,10-дигидро-9-оксо-4-акридинкарбоксамид
Сочетание 5-фтор-9,10-дигидро-9-оксо-4-акридинкарбоновой кислоты (1 г) с промежуточным соединением 16 (б) (0,86 г) после кристаллизации из ацетонитрила дает титульное соединение (0,4 г). Т.пл. 200oC
ЯМР-спектр: δ = 1,4 (2H, т, CH3-CH2); 3,7 (6H, c, 2xOCH3).
Пример 119. N-[4-[4-[[[3,4-Диметоксифенил]метил]метиламино]-2-бутенил] фенил]- 9,10-дигидро-9-оксо-4-акридинкарбоксамид
Сочетание 9,10-дигидро-9-оксо-4-акридинкарбоновой кислоты (154 мг) с промежуточным соединением 72 (210 мг) после кристаллизации из этанола дает титульное соединение (80 мг). Т.пл. 140oC
Анализ для C34H33N3O4
найдено, %: C 74,17; H 6,08; N 7,61
рассчитано, %: 74,55; 6,07; 7,67
Пример 120. N-[4-[3-[[[3,4-Диметоксифенил]метил]метиламино]-1-пропенил] фенил]- 9,10-дигидро-5-метокси-9-оксо-4-акридинкарбоксамид
Сочетание 9,10-дигидро-5-метокси-9-оксо-4-акридинкарбоновой кислоты (0,95 г) с промежуточным соединением 74 (1,1 г) после кристаллизации из этанола дает титульное соединение (0,7 г). Т.пл. 200oC.
Анализ для C34H33N3O5
найдено, %: C 72,46; H 6,04; N 7,61
рассчитано, %: 72,45; 5,90; 7,45
Пример 121. 5-Метокси-9-оксо-N-[4-[2-[1,2,3,4-тетрагидро-6-метокси-2- изохинолинил]этил]фенил]-9,10-дигидро-4-акридинкарбоксамид
Сочетание 9,10-дигидро-5-метокси-9-оксо-4-акридинкарбоновой кислоты (0,5 г) с промежуточным соединением 76 (0,48 г) после кристаллизации из смеси пиридина с водой дает титульное соединение (0,4 г). Т.пл. 260oC.
Анализ для C33H31N3O4
найдено, %: C 74,29; H 6,06; N 8,02
рассчитано, %: 74,28; 5,86; 7,87
Пример 122. 5-Фтор-9,10-Дигидро-9-оксо-N-[3-[3-[1,2,3,4-тетрагидро-6,7- диметокси-2-изохинолинил]пропил]фенил]-4-акридинкарбоксамид
Сочетание 5-фтор-9,10-дигидро-9-оксо-4-акридинкарбоновой кислоты (1 г) с промежуточным соединением 79 (1,3 г) после кристаллизации из изопропанола дает титульное соединение (0,25 г). Т.пл 128oC.
Анализ для C34H32FN3O4 (1,5 H2O)
найдено, %: C 68,84; H 5,67; F 3,01; N 6,88
рассчитано, %: 68,90; 5,95; 3,20; 7,09
Пример 123. 9,10-Дигидро-5-метокси-9-оксо-N-[3-[3-[1,2,3,4-тетрагидро-6,7- диметокси-2-изохинолинил]пропил]фенил]-4-акридинкарбоксамид
Сочетание 9,10-дигидро-5-метокси-9-оксо-4-акридинкарбоновой кислоты (1,2 г) с промежуточным соединением 79 (1,2 г) после кристаллизации из изопропанола дает титульное соединение (0,5 г).
Т.пл 138-140oC
Анализ для C35H3N3O5 (H2O)
найдено, %: C 70,55; H 6,25; N 7,06
рассчитано, %: 70,56; 6,26; 7,05
Пример 124. N-[4-[3-[[[3,4-Диметоксифенил]метил]метиламино]-2-оксипропокси]-фенил]- 9,10-дигидро-5-метокси-9-оксо-4-акридинкарбоксамид
Сочетание 9,10-дигидро-5-метокси-9-оксо-4-акридинкарбоновой кислоты (1 г) с промежуточным соединением 81 (1,3 г) после кристаллизации из изопропанола дает титульное соединение (0,7 г) Т.пл. 175oC
Анализ для C34H35N3O7
найдено, %: C 68,38; H 5,82; N 6,86
рассчитано, %: 68,33; 5,90; 7,03
Пример 125. 9,10-Дигидро-5-метокси-9-оксо-N-[4-[3-[[[3,4,5-триметоксифенил] метил]-метиламино]пропокси]фенил]-4-акридинкарбоксамид
Сочетание 9,10-дигидро-5-метокси-9-оксо-4-акридинкарбоновой кислоты (1,5 г) с промежуточным соединением 83 (1,3 г) после кристаллизации из изопропанола дает титульное соединение (1,3 г). Т.пл. 186oC.
анализ для C35H37N3O7
найдено, %: C 68,82; H 6,08; N 6,83
рассчитано, %: 68,72; 6,10; 6,87
Пример 126. Фумарат 5-фтор-9,10-дигидро-N-[2-метокси-5-[2-[1,2,3,4-тетрагидро-6,7- диметокси-2-изохинолинил] этил] фенил]-9-оксо-4-акридинкарбоксамид
Сочетание 5-фтор-9,10-дигидро-9-оксо-4-акридинкарбоновой кислоты (1 г) с промежуточным соединением 86 (1,2 г) дает титульное соединение (0,5 г)
Т.пл. 166-168oC
Анализ для C38H36FN3O9(H2O)
найдено, %: C 63,78; H 53,15; N 6,10
рассчитано, %: 63,76; 5,35; 5,87
Пример 127. 9,10-Дигидро-9-оксо-N-[4-[3-[1,2,3,4-тетрагидро-2-изохинолинил] пропокси]фенил]-4-акридинкарбоксамид
Сочетание 9,10-дигидро-9-оксо-4-акридинкарбоновой кислоты (0,8 г) с промежуточным соединением 88 (0,9 г) после кристаллизации из этанола дает титульное соединение (0,3 г). Т.пл. 182oC.
Анализ для C32H29N3O3 (0,5H2O)
найдено, %: C 74,88; H 5,81; N 8,16
рассчитано, %: 74,98; 5,90; 8,20
Пример 128 9,10-Дигидро-5-метокси-9-оксо-N-[4-[2-[1,2,3,4-тетрагидро-7- метокси-2-изохинолинил]этил]фенил]-4-акридинкарбоксамид
Сочетание 9,10-дигидро-5-метокиси-9-оксо-4-акридинкарбоновой кислоты (0,7 г) с промежуточным соединением 90 (0,7 г) после кристаллизации из изопропанола дает титульное соединение (0,65 г). Т.пл. 213-216oC
Анализ для C33H31N3O4 (0,5H2O)
найдено, %: C 73,27; H 5,94; N 7,82
рассчитано,%: 73,04; 5,94; 7,74
Пример 129. 9,10-Дигидро-5-метокси-9-оксо-N-[3-[2-[1,2,3,4-тетрагидро-6,7- диметокси-2-изохинолинил]этил]фенил]-4-акридинкарбоксамид
Сочетание 9,10-дигидро-5-метокси-9-оксо-4-акридинкарбоновой кислоты (0,5 г) с промежуточным соединением 92 (0,57 г) после кристаллизации из изопропанола дает титульное соединение (0,15 г). Т. пл. 152oC
Анализ для C34H33N3O5 (0,5 H2O)
найдено, %: C 71,33; H 5,77; N 7,16
рассчитано, %: 71,30; 5,98; 7,33
Пример 130. 5-Фтор-9,10-дигидро-9-оксо-N-[3-[2-[1,2,3,4-тетрагидро-6,7- диметокси-2-изохинолинил]этил]фенил]-4-акридинкарбоксамид
Сочетание 5-фтор-9,10-дигидро-9-оксо-4-акридинкарбоновой кислоты (0,5 г) с промежуточным соединением 92 (0,57 г) после кристаллизации из изопропанола дает титульное соединение (0,35 г) Т.пл. 178oC.
Анализ для C33H30FN3O4 (0,5 H2O)
найдено, %: C 70,80; H 5,36; F 3,34; N 7,34
рассчитано, %: 70,70; 5,57; 3,38; 7,49
Пример 131. Фумарат N-[5-2-[[[3,4-диметоксифенил]метил]метиламино]этил] -2- метоксифенил]-5-фтор-9,10-дигидро-9-оксо-4-акридинкарбоксамид
Сочетание 5-фтор-9,10-дигидро-9-оксо-4-акридинкарбоновой кислоты (0,8 г) с промежуточным соединением 95 (1 г) дает титульное соединение (0,5 г). Т. пл. 140-142oC.
Анализ для C37H36FN3O9 (1,5 H2O)
найдено, %: C 62,4; H 5,1; N 5,8
рассчитано, %: 62,35; 5,5; 5,9
Пример 132. 9,10-Дигидро-5-метокси-9-оксо-N-[4-[2-[1,2,3,4-тетрагидро-5,6- диметокси-2-изохинолинил]этил]фенил]-4-акридинкарбоксамид
Сочетание 9,10-дигидро-5-метокси-9-оксо-4-акридинкарбоновой кислоты (0,19 г) с промежуточным соединением 97 (0,22 г) после кристаллизации из смеси пиридина с водой дает титульное соединение (0,32 г). Т.пл. 235-237oC. ЯМР-спектр: δ = 2,6-3,0 (8H, м, N-(CH2)2-Ar), 3,6 (2H, с, N-CH2-арил), 3,75 (6H, шс, OCH3), 4(3H, с, OCH3) 6,5-8,5 (12H, м, ароматические).
Анализ для C34H33N3O5
найдено, %: C 72,38; H 5,80; N 7,41
рассчитано, %: 72,45; 5,90; 7,45
Пример 133. 9,10-Дигидро-5-метокси-9-оксо-N-[4-[2-[1,2,3,4-тетрагидро-6,7,8- триметокси-2-изохинолинил]этил]фенил]-4-акридинкарбоксамид
Сочетание 9,10-дигидро-5-метокси-9-оксо-4-акридинкарбоновой кислоты (0,26 г) с промежуточным соединением 99 (0,3 г) после кристаллизации из изопропанола дает титульное соединение (0,3 г). Т. пл. 222-226oC.
ЯМР-спектр: δ = 2,4-2,9 (8H, м, 2xN-(CH2)2-арил): 3,45 (2H, с, N-CH2-арил), 3,7 (9H, ш.с., OCH3), 3,9 (3H, с, OCH3), 6,2-8,4 (11H, м, ароматические).
Анализ для C 35H35N3O6 (0,5 H2O)
найдено, %: C 69,46; H 6,14; N 6,84
рассчитано, %: 69,75; 6,02; 6,97
Пример 134. 5-Амино-N-[4-[4-[[[3,4-диметоксифенил]метил]метиламино]бутил] фенил]-9,10-дигидро-9-оксо-4-акридинкарбоксамид
Суспензию соединения примера 75 (0,15 г) в этаноле (40 мл) гидрируют при комнатной температуре в присутствии 10%-ного палладия-на-угле (70 мг). По окончании поглощения водорода, смесь разбавляют метиленхлоридом (50 мл). Катализатор отфильтровывают и раствор концентрируют в вакууме, получая титульное соединение (85 мг) в виде твердого вещества желтого цвета. Т.пл. 250oC.
Анализ для C34H36N4O4
найдено, %: C 72,38; H 6,69; N 9,06
рассчитано, %: 71,31; 6,42; 9,92
Пример 135. 9,10-Дигидро-5-метокси-9-оксо-N-[4-[2-[1,2,3,4-тетрагидро-6,7- диметокси-2-изохинолинил]этил]фенил]-4-акридинкарбоксамид
К перемешиваемой смеси 9,10-дигидро-5-метокси-9-оксо-4-акридинкарбоновой кислоты (28,9 г) и гидрата 1-оксибензотриазола (15,66 г) в ДМФ (300 мл), поддерживаемой при 0oC, прикапывают додецилкарбодиимид (22,76 г) в ДМФ (50 мл), затем промежуточное соединение 101 (33,5 г) в ДМФ (150 мл). По истечении 4 часов при 0oC и двух дней при комнатной температуре, смесь отфильтровывают, фильтрат концентрируют в вакууме и остаток обрабатывают с помощью 1н раствора гидроксида натрия и экстрагируют дихлорметаном. Органический слой затем промывают водой, сушат и выпаривают с получением твердого остатка. Его растворяют в 500 мл кипящего пиридина и раствор осветляют путем фильтрования. Прозрачный раствор разбавляют с помощью 10 мл воды и при охлаждении выкристаллизовывается продукт. Получают титульное соединение (52,82 г). Т. пл. 215-225oC.
ЯМР-спектр: δ = 2,60-2,95 (м, 8H, CH2); 3,58 (с, 2H, N-CH2-фенил); 3,72 (с, 6H, OCH3), 4,05 (с, 3H, OCH3 акридона), 6,78 (2 с, 2H, Ar изохинолина), 7,20-7,88 (м. 8H, Ar), 8,48 (т, 2H, H1 и H8 акридона), 10,60 (с, 1H, CONH), 12,32 (с, 1H, NH акридона).
Анализ для C34H33N3O5
найдено, % C: 72,07; H 5,96; N 7,35
рассчитано, %: 72,45; 5,90; 7,45
Пример 136. Малеат 9,10-дигидро-5-метокси-9-оксо-N-[4-[2-[1,2,3,4-тетрагидро-6,7-диметокси -2-изохинолинил]этил]фенил]-4-акридинкарбоксамид
Соединение примера 135 (100 мг) растворяют в 50 мл смеси дихлорметана и метанола (1: 1) и добавляют малеиновую кислоту (22 мг). Смесь кипятят до получения прозрачного раствора и раствор выпаривания в вакууме. Остаток обрабатывают горячим метанолом и охлаждают с получением титульного соединения в виде желтых игл (90 мг). Т.пл. 171-187oC.
Таким же путем получают следующие соли соединения примера 135: фумарат - т. пл. 170-203oC; сукцинат - т.пл. 135-143oC, L (+)-тартрат - Т.пл. 165-180oC.
Пример 137. Гидрохлорид 9,10-дигидро-5-метокси-9-оксо-N-[4-[2-[1,2,3,4-тетрагидро-6,7-диметил-2- изохинолинил]этил]фенил]-4-акридинкарбоксамид
Соединение 135 (100 г) растворяют в смеси метанола с дихлорметаном (4:1) и добавляют избыток метанольного раствора хлороводорода. Сольват извлекают после добавления диэтилового эфира и отфильтровывания. Получают титульное соединение (примерно 100 мг). Т.пл. 225oC (размягчается при постепенном исчезновении растворителя).
Пример 138. Циктотоксичность in vitro ингибиторов MDR (реакции элиминации макрофагов) в клетках яичников китайских хомяков
Мультилекарственно-резистентная линия клеток яичника (CHO) китайского хомяка, CHRC5, была получена доктором V.Ling (Госпиталь принцессы Маргариты. Торонто, Канада) и сохранилась в виде зависимых от сил сцепления монослойных культур ва-минимально необходимой среде, дополненной тимидином, аденозином, 10%-ой эмбриональной бычьей сывороткой, 2 ммоль L - глутамина (Flow) 100 ед/мл пенициллина и 100 мг/мл стрептомицина, во влажной атмосфере с 95% воздуха и 5% диоксида углерода. Клетки переносят в склянки для культур дважды в неделю после диссоциации с помощью ЭДТК.
Производят посев CHRC5 - клеток при плотности 104 клеток на лунку в пластины микротитратора. Спустя 24 часа среду удаляют и заменяют 0,1 мл свежей среды, содержащей последовательные двухкратные разбавления MDR - ингибиторов. Каждый ингибитор испытывают два раза при двухкратном разбавлении от 1250 до 20 нмоль. Последнюю лунку каждой колонки используют для подтверждения отсутствия токсичности при высшей дозе ингибитора в отсутствие доксорубицина. Другие контрольные условия испытывают на каждой пластине микротитратора: одни клетки (1 лунка), один доксорубицин (7 лунок), амиодарон (ряд двухкратных разбавлений, начиная с 5 мМ на каждое по 2 лунки). Добавляют 0,1 мл в концентрации 10 мг/мл раствора доксорубицина. После инкубации в течение 72 часов испытывают жизнедеятельность клетки путем восстановления 3-(4,5-диметилтиазол-2-ил)-2,5- дифенилтатразолийбромида (МТТ: Sigma) до темносинего формазанового продукта. В частности, в каждую лунку добавляют 20 мл раствора МТТ с концентрацией 5 мг/мл, приготовленного в буферированном фосфатом солевом растворе. После инкубации в течение 4 часов при 37oC среду отсасывают и заменяют 0,1 мл диметилсульфоксида. После интенсивного встряхивания количество образовавшегося формазана (формазанового продукта) исследуют на его оптическую плотность при 550 нм. Абсорбция непосредственно соответствует числу выживших клеток в лунках.
Расчеты цитотоксичности осуществляют по среднему из двух лунок для каждого условия. Концентрацию каждого М.Р. - ингибитора, дающую снижение на 50% оптической плотности по отношению к клеткам, обработанным одним доксорубицином, определяют с получением значения ЭК50.
Результаты.
В вышеуказанном тесте соединения вышеприведенных примеров имеют EC50 в области 0,018 - 0,72 ммоль. Так, например, соединение примера 1 имеет EC50 = 0,02 ммоль, что, по крайней мере, в 100 раз более эффективно, чем MDR - ингибиторы, приведенные в прототипе и включающие амиодарон (EC50 = 3 ммоль) и верапамил (3 ммоль). Введение мыши соединения примера 1 орально не дает заметных токсичных эффектов при разовых дозах вплоть до 300 мг/кг.
Ниже приводятся примеры фармацевтических композиций согласно изобретению. Термин "активный ингредиент", используемый ниже, означает соединение изобретения и может, например, представлять собой соединение примера 1.
Пример А - Таблетка для приема орально - на таблетку (мг)
активный ингредиент - 50,0
микрокристаллическая целлюлоза - 110,0
лактоза - 67,5
крахмалистый гликолят натрия - 20,0
стеарат магния - 2,5 - в целом: 250,0
Лекарство просевают через 250 мм - сито и затем 5 порошков тщательно смешивают в смесителе и сдавливают по 3/8 дюйма (0,95 см) стандартным вогнутым пуансоном в машине для изготовления таблеток.
Пример Б - Капсула для орального приема - на капсулу (мг)
активный ингредиент - 50,0
микрокристаллическая целлюлоза - 66,5
лактоза P/ - 66,5
крахмалистый гликолят натрия - 15,0
стеарат магния - 2,0 - в целом: 200,0
Лекарство просевают через 250 мм - сито и затем пять порошков тщательно смешивают в смесителе и этой смесью заполняют оболочки твердой желатиновой капсулы N 2 на машине для наполнения капсул.
Пример В - Инъекционная композиция для внутривенного введения (10 мг в 10 мл) - % (по весу)
активный ингредиент - 0,1
химиотерапевтический противораковый агент по необходимости вода для инъекции - 100,0
разбавленная соляная кислота до - pH 3,0
Активный ингредиент (соответствующие химиотерапевтический противораковый агент) растворяют путем смешения в воде для инъекции, к которой медленно добавляют кислоту по pH 3,0. Раствор продувают азотом и фильтруют стерильно через стерильный фильтр с размером пор 0,22 микрона. В асептических условиях этот стерильный раствор вносят в стерильные ампулы и ампулы запаивают.
Пример Г - Сироп для орального приема - % вес/объем
активный ингредиент - 2,0
химиотерапевтический противораковый агент по необходимости разбавленная соляная кислота до - pH 3
раствор сорбитола - 60 по объему
ароматизирующие вещества - по необходимости
дистиллированная вода - до 100
Активный ингредиент (соответственно, химиотерапевтический противораковый агент) растворяют в некотором количестве воды при перемешивании, куда постепенно добавляют соляную кислоту до pH 3,0. Добавляют раствора сорбитола, ароматизирующие вещества и остальную воду и pH-значение доводят до 3,0. Сироп осветляют путем фильтрования через пригодный фильтр.
| название | год | авторы | номер документа |
|---|---|---|---|
| СОЕДИНЕНИЯ, СПОСОБ ИХ ПОЛУЧЕНИЯ И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ИХ ОСНОВЕ | 2004 |
|
RU2317985C1 |
| Способ получения производных бензазепина или их кислотно-аддитивных солей с неорганическими кислотами | 1982 |
|
SU1160935A3 |
| Способ получения производных циклического амина или их кислотно-аддитивных солей | 1988 |
|
SU1561823A3 |
| ЗАМЕЩЕННЫЕ 4-(1,2,3,4-ТЕТРАГИДРО-1-НАФТАЛИНИЛ)-1Н-ИМИДАЗОЛЫ И 4-(2,3-ДИГИДРО-1Н-ИНДЕН-1-ИЛ)-1Н-ИМИДАЗОЛЫ, СПОСОБЫ ИХ ПОЛУЧЕНИЯ И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ИХ ОСНОВЕ | 1995 |
|
RU2156239C2 |
| Способ получения фенилэтиламинов или их солей | 1978 |
|
SU700061A3 |
| Способ получения производных изохинолина или их солей | 1974 |
|
SU528035A3 |
| ПРОИЗВОДНЫЕ ТЕТРАГИДРОПИРИДИНА И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ИХ ОСНОВЕ | 2001 |
|
RU2276140C2 |
| НИТРАТНЫЕ СОЛИ ГИПОТЕНЗИВНЫХ ЛЕКАРСТВЕННЫХ СРЕДСТВ | 1999 |
|
RU2235097C2 |
| ПРОИЗВОДНЫЕ ПИРИДО(2,1-А)ИЗОХИНОЛИНА В КАЧЕСТВЕ ИНГИБИТОРОВ DPP-IV | 2002 |
|
RU2297417C2 |
| ПРОИЗВОДНЫЕ АНТРАНИЛОВОЙ КИСЛОТЫ, СПОСОБЫ ИХ ПОЛУЧЕНИЯ И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ИХ ОСНОВЕ | 1997 |
|
RU2195454C2 |
Изобретение может быть использовано в медицине для повышения чувствительности мультилекарственно-резистентных раковых клеток к химиотерапевтическим агентам. Заявлены производные акридина формулы I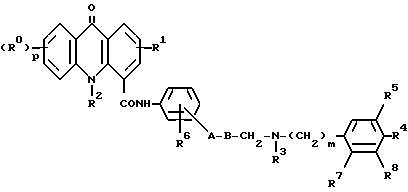
где R0 - водород, галоген, C1 - C4-алкил, C1 - C4-алкокси, C1 - C4-алкилтио, амино-, нитрогруппа; p - 1 или, когда R0 - C1 - C4-алкокси, p - 2 или 3; R1 - водород, C1 - C4-алкил, C1 - C4-алкокси, C1 - C4-алкилтио; R2 - водород, C1 - C4-алкил; A - кислород, сера, связь, группа -(CH2)lNR9, где l - 0 или 1 и R9 - водород или метил; B - C1 - C4-алкилен, необязательно замещенный гидроксильной группой, за исключением того, что гидроксильная группа и часть A не могут быть связаны с одним и тем же атомом углерода, когда А - атом кислорода или серы, или группа - (CH2)lNR9, или когда A означает связь, то B означает C2 - C4-алкениленовую цепь; R3-водород, C1 - C4-алкил; m = 1 или 2; R4 - водород или галоген, C1 - C4-алкил, C1 - C4-алкокси, C1 - C4-алкилтио; R5 - водород, C1 - C4-алкокси; R6 - водород, C1 - C4-алкил, C1 - C4-алкокси; R7-водород, или R3 и R7 вместе образуют группу -(CH2)n-, где n = 1 или 2; R8 - водород, C1 - C4-алкокси, причем группа формулы a (а)
(а)
связана с бензольным кольцом в 3 или 4 положении по отношению к карбоксамидному заместителю, при условии, что когда группа присоединена к бензольному кольцу в положении 3, тогда R6 должна быть в положении 6 бензольного кольца, или его физиологически совместимые соли. Заявлены производные акридина формулы Iа
где R0 - водород, галоген, C1 - C4-алкил, C1 - C4-алкокси; R1 - водород, C1 - C4-алкокси; R2 - водород; A - кислород, сера, связь; B - незамещенная C1 - C4-алкиленовая цепь; R4 и R5-одинаковые и означают C1 - C4-алкокси, или их физиологически совместимые соли. Производные акридина общей формулы I получают взаимодействием соединения II
где значения R0, R1, p приведены выше, с соединением III
где значения A, B, R3 - R8 приведены выше, в присутствии агента реакции сочетания. Далее могут быть получены физиологически совместимые соли соединения I. Производные акридина общей формулы I могут быть получены взаимодействием соединения формулы IV
где значения R0, R1, R2, R6, A, B, p приведены выше, Q - атом галогена, с соединением формулы V
или его солью, где значения R3 - R5, R7, R8 приведены выше, в присутствии акцептора кислоты. Могут быть получены физиологически совместимые соли соединения I. Способ разрушения клеток раковой опухоли осуществляют воздействием на опухоль соединением формулы I или Iа или их солями. Фармацевтическая композиция содержит указанные соединения. Она может быть в форме для орального, буккального, парентерального или ректального введения. 6 с. и 6 з.п.ф-лы.

где R0 - водород, галоген, С1 - С4-алкил, С1 - С4-алкокси, С1 - С4-алкилтио, амино-, нитрогруппа;
p = 1 или, когда R0 = С1 - С4-алкокси, p = 2 или 3;
R1 - водород, С1 - С4-алкил, С1 - С4-алкокси, С1 - С4-алкилтио;
R2 - водород, С1 - С4-алкил;
A - кислород, сера, связь, группа -(CH2)lNR9, где l = 0 или 1 и R9 - водород или метил;
B - С1 - С4-алкилен, необязательно замещенный гидроксильной группой, за исключением того, что гидроксильная группа и часть A не могут быть связаны с одним и тем же атомом углерода, когда A означает атом кислорода или серы, или группа -(CH2)lNR9, или когда A означает связь, то B означает С2 - С4-алкениленовую цепь;
R3 - водород, С1 - С4-алкил;
m = 1 или 2;
R4 - водород или галоген, С1 - С4-алкил, С1 - С4-алкокси, С1 - С4-алкилтио;
R5 - водород, С1 - С4-алкокси;
R6 - водород, С1 - С4-алкил или С1 - С4-алкокси;
R7 - водород или R3 и R7 вместе образуют группу -(CH2)n-, где n = 1 или 2;
R8 - водород, С1 - С4-алкокси, причем группа формулы а
связана с бензольным кольцом в 3 или 4 положении по отношению к карбоксамидному заместителю, при условии, что когда группа присоединена к бензольному кольцу в положении 3, тогда R6 должна быть в положении 6 бензольного кольца,
или его физиологически совместимые соли.
7. Производные акридина формулы Ia
где R0 - водород, галоген, С1 - С4-алкил, С1 - С4-алкокси;
R1 - водород, С1 - С4-алкил, С1 - С4-алкокси;
R2 - водород;
A - кислород, сера, связь;
B - незамещенная С1 - С4-алкиленовая цепь;
R4 и R5 - одинаковые, С1 - С4-алкокси,
или его физиологически совместимые соли.
9,10-дигидро-5-метокси-9-оксо-N-[4-[[3-[1,2,3,4-тетрагидро-6,7-диметокси-2-изохинолинил]пропил]тио]фенил]-4-акридинкарбоксамид;
5-фтор-9,10-дигидро-9-оксо-N-[4-[[3-[1,2,3,4-тетрагидро-6,7-диметокси-2-изохинолинил]пропил]тио]фенил]-4-акридинкарбоксамид;
9,10-дигидро-5-метокси-9-оксо-N-[4-[3-[1,2,3,4-тетрагидро-6,7-диметокси-2-изохинолинил]пропокси]фенил]-4-акридинкарбоксамид;
9,10-дигидро-5-метил-9-оксо-N-[4-[[3-[1,2,3,4-тетрагидро-6,7-диметокси-2-изохинолинил]пропил]тио]фенил]-4-акридинкарбоксамид;
9,10-дигидро-5-метокси-N-[2-метокси-4-[3-[1,2,3,4-тетрагидро-6,7-диметокси-2-изохинолинил]пропил]фенил]-9-оксо-4-акридинкарбоксамид;
9,10-дигидро-N-[2-метокси-4-[3-[1,2,3,4-тетрагидро-6,7-диметокси-2-изохинолинил]пропил]фенил]-5-метил-9-оксо-4-акридинкарбоксамид
и его физиологически совместимые соли.
N-[4-[4-[[[3,4-диметоксифенил] метил] метиламино] бутил] фенил]-9,10-дигидро-9-оксо-4-акридинкарбоксамид;
N-[4-[2-[[[3,4-диметоксифенил] метил] метиламино]этил]фенил]-9,10-дигидро-9-оксо-4-акридинкарбоксамид;
N-[4-[4-[[[3,4-диметоксифенил] метил] метиламино] бутил] фенил]-5-фтор-9,10-дигидро-9-оксо-4-акридинкарбоксамид;
N-[4-[2-[[[3,4-диметоксифенил] метил] метиламино]этил]фенил]-9,10-дигидро-5-метокси-9-оксо-4-акридинкарбоксамид;
N-[4-[3-[[[3,4-диметоксифенил]метил]метиламино]пропил]фенил]-5-фтор-9- , 10-дигидро-9-оксо-4-акридинкарбоксамид;
N-[4-[2-[[[3,4-диметоксифенил] метил] метиламино]этил]фенил]-5-фтор-9- , 10-дигидро-9-оксо-4-акридинкарбоксамид;
N-[4-[[3-[[[3,4-диметоксифенил] метил] метиламино]пропил]фенил]-9,10-дигидро-5-метокси-9-оксо-4-акридинкарбоксамид;
N-[4-[[3-[[[3,4-диметоксифенил] метил] метиламино] пропил] тио] фенил]-9,10-ди- гидро-9-оксо-4-акридинкарбоксамид;
N-[4-[4-[[[3,4-диметоксифенил] метил] метиламино] бутил] фенил]-9,10-ди- гидро-5-метокси-9-оксо-4-акридинкарбоксамид;
N-[4-[3-[[2-[3,4-диметоксифенил] этил] метиламино]пропил]фенил]-9,10-дигидро-9-оксо-4-акридинкарбоксамид;
N-[4-[2-[[2-[3,4-диметоксифенил] этил] метиламино]этокси]фенил]-9,10-дигидро-5-метокси-9-оксо-4-акридинкарбоксамид;
N-[4-[3-[[[3,4-диметоксифенил] метил]метиламино]пропокси]фенил]-9,10-ди- гидро-9-оксо-4-акридинкарбоксамид;
N-[4-[3-[[[3,4-диметоксифенил] метил]метиламино]пропокси]фенил]-5-фтор-9,10-дигидро-9-оксо-4-акридинкарбоксамид;
N-[4-[2-[[2-[3,4-диметоксифенил] этил]метиламино]этил]фенил]-9,10-дигидро-9-оксо-4-акридинкарбоксамид;
N-[4-[5-[[[3,4-диметоксифенил]метил]метиламино]пентил]фенил]-5-фтор-9- , 10-дигидро-9-оксо-4-акридинкарбоксамид;
N-[4-[3-[[[3,4-диметоксифенил]метил]метиламино]пропил]фенил]-9,10-дигидро-9-оксо-4-акридинкарбоксамид;
N-[4-[2-[[[3,4-диметоксифенил]метил]метиламино]этиламино]фенил]-9,10-дигидро-5-метокси-9-оксо-4-акридинкарбоксамид;
N-[4-[[3-[[[3,4-диметоксифенил] метил] метиламино] пропил] тио] фенил]-9,10-дигидро-5-фтор-9-оксо-4-акридинкарбоксамид;
N-[4-[2-[[[3,4-диметоксифенил] метил] метиламино]этил]фенил]-9,10-дигидро-5-метилтио-9]оксо-4-акридинкарбоксамид;
N-[4-[2-[[[3,4-диметоксифенил] метил] метиламино]этил]фенил]-9,10-дигидро-5-метил-9-оксо-4-акридинкарбоксамид;
N-[4-[3-[[[3,4-диметоксифенил] метил]метиламино]пропокси]фенил]-9,10-дигидро-5-метил-9-оксо-4-акридинкарбоксамид;
N-[4-[2-[[2-[3,4-диметоксифенил] этил]метиламино]этил]фенил]-9,10-дигидро-9-оксо-4-акридинкарбоксамид;
N-[4-[4-[[2-[3,4-диметоксифенил]этил]метиламино]бутил]фенил]-9,10-дигидро-9-оксо-4-акридинкарбоксамид;
N-[4-[2-[[2-[4-метоксифенил] этил] метиламино]этил]фенил]-9,10-дигидро-9-оксо-4-акридинкарбоксамид;
N-[4-[2-[[2-[3,4-диметоксифенил] этил] метиламино]этокси]фенил]-9,10-дигидро-2-(метилтио)-9-оксо-4-акридинкарбоксамид;
N-[4-[3-[[2-[3,4-диметоксифенил]этил]метиламино]пропокси]фенил]-9,10-дигидро-9-оксо-4-акридинкарбоксамид;
N-[4-[2-[[2-[4-метоксифенил] -этил] метиламино]этокси]фенил]-9,10-дигидро-9-оксо-4-акридинкарбоксамид;
N-[4-[2-[[[3,4-диметоксифенил]метил]метиламино]этокси]фенил]-9,10-дигидро-9-оксо-4-акридинкарбоксамид;
N-[4-[3-[[[3,4-диметоксифенил] метил] метиламино] пропокси]фенил]-9,10-дигидро-5-метокси-9-оксо-4-акридинкарбоксамид;
N-[4-[[2-[[[3,4-диметоксифенил] этил] метиламино] этил]тио]фенил]-9,10-дигидро-9-оксо-4-акридинкарбоксамид,
и его физиологически совместимые соли.
где значения R0, R1, p приведены в п.1,
подвергают взаимодействию с соединением формулы III
где значения A, B, R3 - R8 приведены в п.1,
в присутствии агента реакции сочетания, с последующим, в случае необходимости, получением физиологически совместимой соли соединения I.
где значения R0, R1, R2, R6, A, B, p приведены в п.1;
Q - атом галогена,
подвергают взаимодействию с соединением формулы V:
или его солью,
где значения R3 - R5, R7, R8, m приведены в п.1,
в присутствии акцептора кислоты, с последующим, в случае необходимости, получением физиологически совместимой соли соединения I.
| Машковский М.Д | |||
| Лекарственные средства, 1986, ч.2, с.457 - 458 | |||
| Насадка к шнековый шприц машинам для формования изделий, в частности, пирометрических конусов, из керамических масс | 1951 |
|
SU98098A1 |
Авторы
Даты
1998-09-27—Публикация
1992-01-07—Подача