Изобретение относится к стерильным свободным от частиц препаратам кристаллического S-2-(3-аминопропиламина) этил дигидрофосфоротиоата (аминофостина), которые обладают улучшенной стабильностью.
Соединение S-2-(3-аминопропиламино)этил дигидрофосфоротиоата (которое известно так же, как амифостин, этиофос, этиол, NSC 296961 и WR-2721 и которое далее именуется как "амифостин") и другие аминоалкил дигидрофосфоротиоаты раскрыты в патенте США N 3892824, выданном Piper и др. Этот патент раскрывает также известный способ получения кристаллической формы лекарственного вещества амифостина и включен сюда как ссылка.
Эта кристаллическая форма, как указано, проявила себя относительно стабильной при комнатной температуре в течение нескольких лет, а также при 50oC в течение нескольких месяцев. Эти соединения первоначально разрабатывались как антирадиационные агенты (защищающие от радиации), в частности, в применении против рентгеновского или ядерного излучения, которое может иметь место в ходе военных действий.
Помимо его полезности в качестве противорадиационного агента при военных действиях, амифостин продемонстрировал свое применение и как радио- и химиозащитный агент в условиях не военных действий, т.е. как защитный агент при нежелательных побочных действиях, которые имеют место в применении лучевой терапии при лечении рака и использовании химиотерапевтических агентов, например, алкилирующих агентов, таких, как циклофосфамид, цисплатин, карбоплатин, доксорубицин и их производные и митомицин и его производные.
Также были сообщения о том, что амифостин использовался экспериментально в защите больных, инфицированных ВИЧ (СПИД), от вредных побочных действий лечения AZT (3'-азидо-3'-деокситимидином). Амифостин и его производные осуществляют свое защитное действие, не влияя значительно на положительные свойства назначаемых терапевтических агентов. Частично это можно отнести за счет селективного поглощения нормальной тканью защитного тиола.
Здесь термин "лекарственное средство амифостин" означает амифостин или его состояние до сушки вакуумом, которое доступно как таковое в виде тригидрата. Имеющиеся в наличии стерильные высушенные вакуумом лекарственные препараты амифостина будут именоваться "аморфным амифостином", а форма настоящего изобретения будет называться "кристаллическим амифостином", чтобы различать эти две формы. Если не указано иначе, количества, указанные здесь, рассчитаны на безводной основе.
Хотя амифостин обладает многими преимуществами, попытки получить удобный стабильный стериальный дозированный препарат претерпели много трудностей.
Современный способ изготовления и упаковки амифостина включает этапы заполнения в заранее простерилизованные ампулы стерильного водного раствора, содержащего амифостин, до определенного объема, охлаждение ампул и их содержимого, и удаление растворителя лиофилизацией для получения определенного количества высушенного амифостина в каждой ампуле. (Cм. L. Lachman, и др. Теория и практика промышленной фармакологии, с. 62-63, 1986).
Это избавляет от значительных практических проблем, связанных с упаковкой объемного твердого амифостина, с использованием так называемого способа "Сухого заполнения" или "порошкового заполнения". Эти проблемы включают в себя трудности в ручной манипуляции с порошками, необходимость их измельчения до приемлемого размера частиц и текучести, трудность поддерживать асептические условия и дозировать точное количество твердого амифостина в каждую ампулу.
Однако эта аморфная форма, которую получают лиофилизацией, не стабильна в температурных условиях. Такой лиофилизированный препарат следует хранить при температурах около -20oC, а длительные перевозки осуществлять при температурах от -70 до -20oC, с тем, чтобы избежать разложения готового продукта. Необходимость поддержания низкой температуры при перевозке и хранении является недостатком получаемых в настоящее время высушенных вакуумом форм амифостина. Для перевозок и хранения продукта требуется специальная упаковка, и это приводит к значительным расходам.
Кроме того, больницы, не снабженные специальными морозильными камерами для хранения лекарств, не смогут держать амифостин для своих больных (например, рынки стран третьего мира будут находиться в затруднительном положении в отношении поставок амифостима). Однако поскольку других препаратов нет, клинические испытания проводились с использованием этого препарата.
Следовательно, существует потребность получить форму дозировки, которая будет обладать достаточной стабильностью, чтобы обеспечить длительный срок хранения при комнатной температуре или небольшом охлаждении, что является обычным для многих лекарственных продуктов.
Настоящее изобретение описывает новые процедуры, с помощью которых получают твердые композиции, содержащие высушенный вакуумом амифостин, с фармацевтически приемлемыми наполнителями, такими, как маннит, или без наполнителей, и эти композиции обладают лучшей стабильностью в сравнении с имеющимися сейчас композициями.
Изобретение относится к способу получения кристаллических композиций, включающему стадии (а) получения препарата, содержащего аминоалкил дигидрофосфоротиоат формулы RHN(CH2)nNH(CH2)mSRO3H2 или его гидраты или соли щелочного металла, в которых R - H или C1-С7 алкил, и n и m могут быть независимо целым числом от 2 до 6, спирт и раствор водного растворителя, в котором соответствующие количества аминоалкил дигидрофосфоротиоата, спирта и воды таковы, что при температурах от комнатной до 10oC можно получить свободный от частиц раствор, который дает кристаллический осадок аминоалкил лигидрофосфоротиоата при охлаждении ниже 0oC; (б) охлаждения препарата до температуры ниже 0oC на время, позволяющее выпадение в осадок кристаллического аминоалкил дигидрофосфоротиоата; и (в) вакуумной сушки полученной смеси для получения твердого кристаллического препарата с повышенной температурной стабильностью. В качестве следующей стадии в настоящем изобретении над препаратом можно пропустить стерильный инертный газ, такой, как аргон, азот и гелий.
Лучше, если температура, при которой препарат охлаждается для инициации осаждения кристаллического аминоалкил дигидрофосфоротиоата, находится около точки эвтектики температуры препарата. В оптимальном случае препарат может также содержать наполнители, такие, как маннит.
Аминоалкил дигидрофосфоротиоаты, приемлемые для использования в настоящем изобретении, включают, но неограничены до: S-2-(3- аминопропиламино)этил дигидрофосфоротиоата (амифостина), S-2-(3- метиламинопропил-амино)этил дигидрофосфоротиоата (WR-3689), S-2-(3- эти-ламинопропиламино)этил дигидрофосфоротиоата, S-2-(3- аминопропиламино)-2-метилпропил дигидрофосфоротиоата, S-2-(2- аминоэтиламино)-2-этил дигидрофосфоротиоата, S-2-(4-аминобутиламино)- 2-этил дигидрофосфоротиоата, S-2-(5-аминопентиламино)-2-этил дигидрофосфоротиоата, S-2-(6-аминогексиламино)-2-этил дигидрофосфоротиоата, S-2-(2-метиламиноэтиламино)-2-этил дигидрофосфоротиоата, S-2-(3-метиламинопропиламино)-2-этил дигидрофосфоротиоата и S-3-(3-метиламинопропиламино)-3-пропил дигидрофоссроротиоата (WR-151327).
В предпочтительном варианте аминоалкил дигидрофосфоротиоатом является амифостин, WR-3689, WR- 151327, наиболее предпочтителен амифостин. Спирты, пригодные для проведения осаждения кристаллического аминоалкил дигидрофосфоротиоата для использования в настоящем способе, включают, но не ограничены до C1-C5 алкиловых спиртов, таких, как метанол, этанол, пропанол, изопропанол, н-бутанол, втор-бутанол, трет-бутанол, н-пентанол, 2-пентанол и других, предпочтителен этанол.
В конкретном способе изобретения температура смеси из стадии (б) поднимается до температуры отжига, которая находится в диапазоне 1-20 С выше точки эвтектики температуры препарата с последующим снижением температуры смеси от температуры отжига до эвтектической температуры или ниже до проведения стадии вакуумной сушки (в).
В отдельных случаях точка эвтектики может опускаться до пределов от -80 до 0oC, а температура отжига может падать до -30 - +10oC.
Таким образом, цель настоящего изобретения - предложить способ, в котором препарат содержит от около 50 до 400 мг аминоалкил дигидрофосфоротиоата на 1 мл препарата, около 1-35% (об/об.) спирта и около 65-99% (об/об. ) воды. Лучше, если препарат содержит около 125-250 мг аминоалкил дигидрофосфоротиоата на 1 мл препарата, около 5-20% (об/об.) спирта и около 80-95% (об/об. ) воды. Еще лучше такая композиция: около 100 мг аминоалкил дигидрофосфоротиоата на 1 мл препарата, около 10% спирта и около 90% воды.
Температуры на разных стадиях охлаждения и вакуумной сушки могут широко варьироваться в зависимости от конкретных соотношений аминоалкил дигидрофосфоротиоата к спирту и воде. Однако, как правило, температуры стадий (б) и (в) попадают в диапазон от -40 до около - 5oC, предпочтительно около -20oC.
В конкретном варианте данного изобретения способ включает стадию стерилизации. Стерилизацию можно проводить любым из множества известных специалистам способов, таким, как нагревание смеси в автоклаве, обработка гамма излучением, асептическая рекристаллизация или стерильная фильтрация раствора, например, через фильтр с размером пор в 0,2 μm.
Также надо сказать, что кристаллический аминоалкил дигидрофосфоротиоат может быть безводным или содержать кристаллизационные растворители. В частности, кристаллический амифостин может быть безводным, сольватом или гидратом, таким, как моногидрат или тригидрат. Обычно гидраты могут содержать от 1 до около 5, предпочтительно 1- 3 моль кристаллизационной воды.
В альтернативной процедуре приготовления препарата аминоалкил дигидрофосфоротиоат, такой, как амифостин и любые нужные наполнители растворяются в воде для инъекции, USP (Фармакопея США), и полученные растворы затем стерильно фильтруются. После этого добавляется нужное количество стерильного спирта, такого, как стерильный этанол, USP, чтобы получить препарат, который затем подвергается стадиям охлаждения или отжига.
Препарат, полученный в соответствии с раскрытым способом, может включать в себя фармацевтически приемлемый наполнитель. Подходящие наполнители включают, но не ограничиваются до хлорида натрия, пропиленгликоля, сахарозы, декстрозы, сорбита, инозита, маннита, глицина, аргинина или других аминокислот, но предпочтителен маннит и особенно маннит NF.
Таким образом, конкретной задачей настоящего изобретения является способ приготовления фармацевтической композиции, содержащей кристаллический амифостин, включающий стадии (а) получения препарата, содержащего от около 50 до 300 мг амифостина на 1 мл препарата, около 3-30% (об/об.) этанола, около 70-97% (об/об.) воды и, возможно, около 5-300 мг фармацевтически приемлемого наполнителя на 1 мл препарата, так что при температурах в диапазоне от комнатной до около 10oC получается свободный от частиц раствор, который при охлаждении ниже 0oС дает кристаллический осадок амифостина; (б) охлаждения препарата до температуры в диапазоне около -40 - -5oC на период времени, достаточный для осаждения кристаллического амифостина; и (в) вакуумного высушивания полученной смеси с получением препарата твердого кристаллического амифостина с улучшенной температурной стабильностью.
В общем, стадии после (а) и до (в) проводятся в течение 0,5-72 часов по времени, предпочтительно от 2 до 24 часов. Манипуляции стадии (в) занимают 1-72 часа, лучше от 10 до 20 часов. Кроме того, вакуумное высушивание на стадии (в) проводится с вакуумом от около 10 до 1000 мТорр, лучше 150 мТорр.
Другая цель изобретения - препарат стерильной фармацевтической композиции, обладающий повышенной температурной стабильностью, в котором активный ингредиент, т.е. кристаллический аминоалкил дигидрофосфоротиоат, такой, как амифостин, остается стабильным при 4 С по меньшей мере в течение 2 лет.
Предпочтительно, кристаллический аминоалкил дигидрофосфоротиоат, такой, как амифостин, остается стабильным при температуре окружающей среды по меньшей мере в течение 2 лет. Итак, предлагается стерильная композиция, обладающая повышенной температурной стабильностью, которая содержит кристаллический амифостин, который можно дополнить фармацевтически приемлемым носителем в инъекционный свободный от частиц лекарственный продукт.
Желательно, чтобы стерильная композиция представляла собой стерильный препарат одноразовой дозировки с повышенной температурной стабильностью и содержала от около 10 до около 10000 кг кристаллического амифостина и, возможно, от около 10 до 10000 мг фармацевтически приемлемого наполнителя, который можно дополнить (сформулировать) фармацевтически приемлемым носителем в инъекционное свободное от частиц лекарственное средство.
В более предпочтительном варианте стерильный препарат одноразовой дозировки содержит около 100 - 1000 мг кристаллического амифостина и около 100 - 1000 мг наполнителя. Еще лучше, если такой препарат содержит около 500 мг кристаллического амифостина и около 500 мг маннита. Носитель выбирается из множества фармацевтически приемлемых носителей и может включать воду для инъекции, USP, обычный физраствор, USP, 5% декстрозу в воде, USP, или водные буферы.
Еще одна цель изобретения предполагает метод лечения субъекта, нуждающегося в радио- или химиозащите, который включает назначение субъекту эффективного количества фармацевтической композиции, содержащей кристаллический аминоалкил дигидрофосфоротиоат, имеющий общую химическую формулу, описанную выше, такой, как амифостин, который дополнен фармацевтически приемлемым носителем. Сформулированную фармацевтическую композицию можно назначать парентерально.
При необходимости фармацевтическую композицию можно назначать внутривенно, внутримышечно, подкожно, внутрь полости и внутрь оболочки.
Эти и другие цели изобретения станут очевидны специалисту данной области из общего и подробного описания заявки.
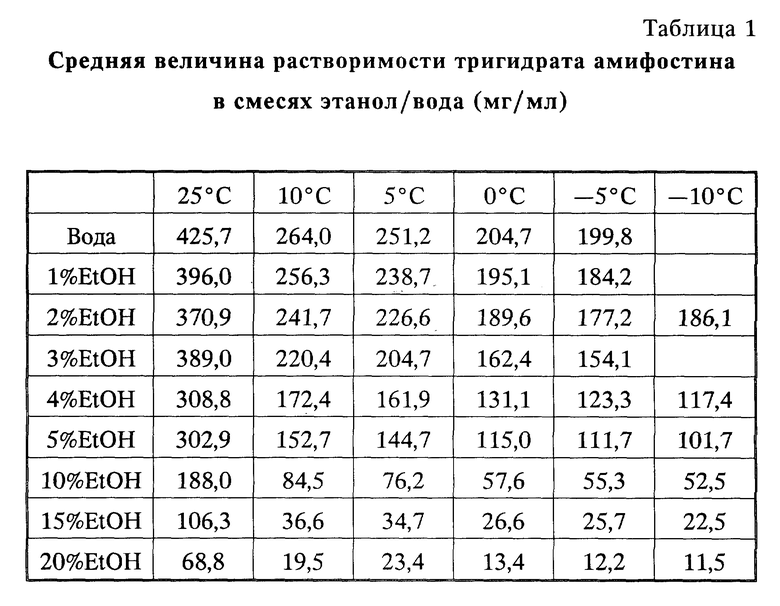
На фиг. 1 показан график растворимости лекарственного вещества амифостина (WR-2721) в водно-этанольных растворах от температуры (-oC);
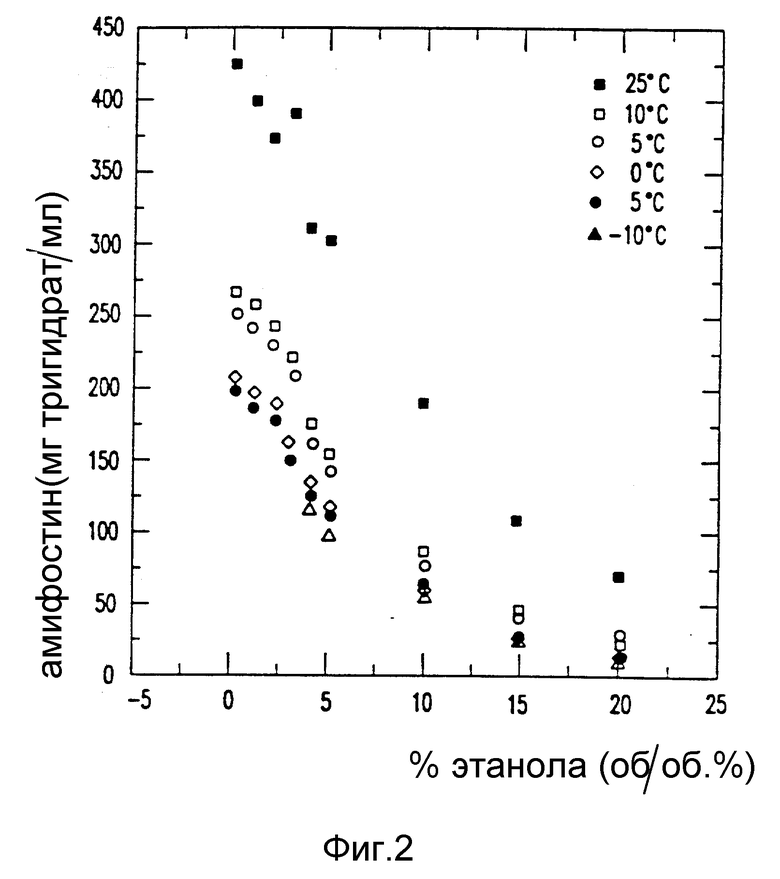
на фиг. 2 - график зависимости растворимости лекарственного вещества амифостина от концентрации этанола;
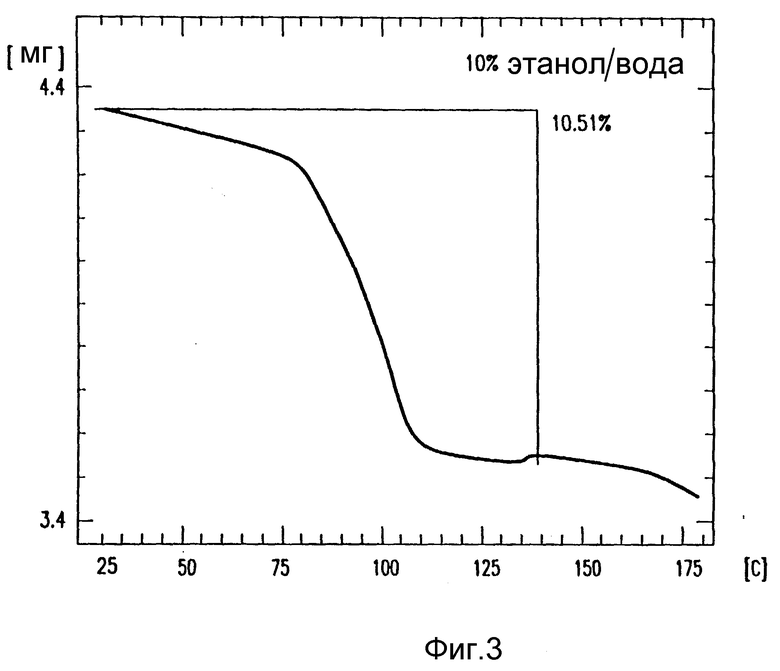
на фиг. 3 - термогравиметрический анализ (TGA) лекарственного продукта кристаллического амифостина, полученного из 10% этанола в воде;
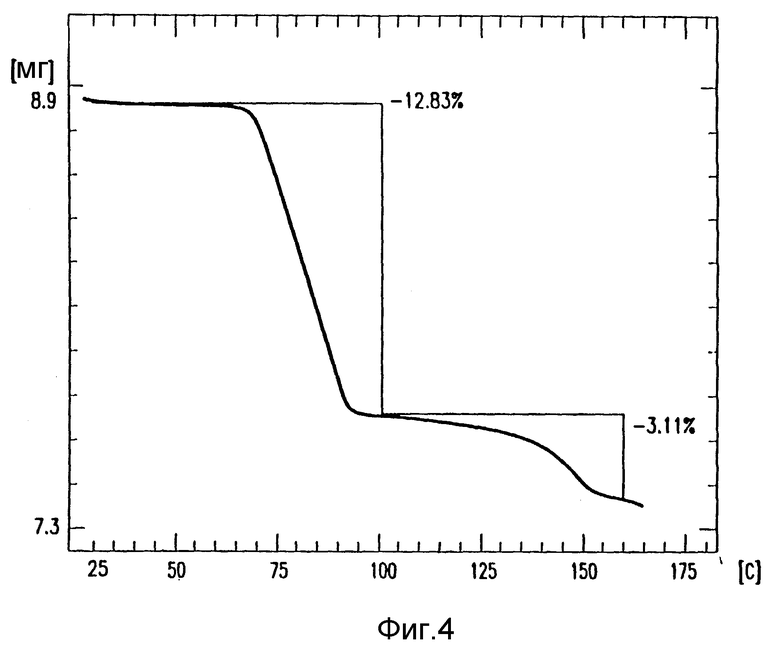
на фиг. 4 - TGA препарата амифостина;
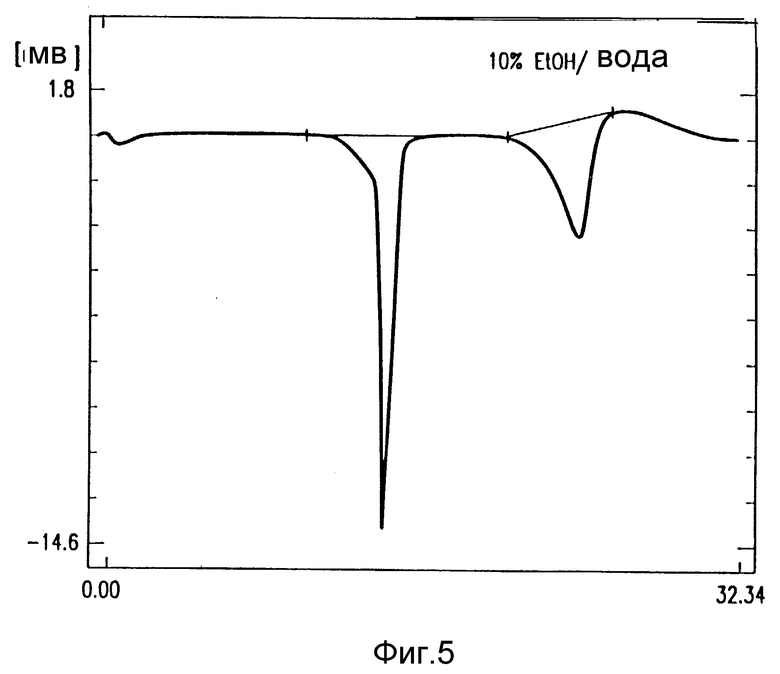
на фиг. 5 - дифференциальная сканирующая калориметрия (DSC) кристаллического лекарственного продукта амифостина, полученного из 10% этанола в воде;
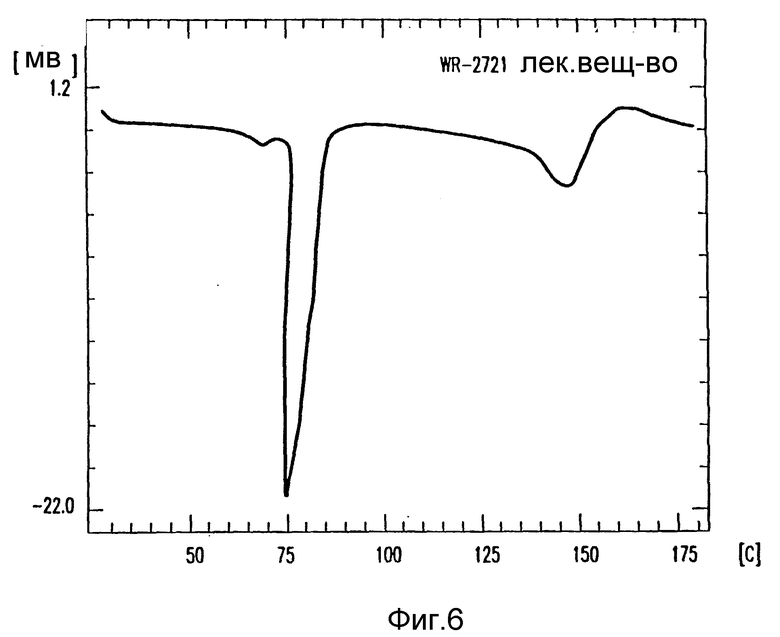
на фиг. 6 - DSC лекарства амифостина;
на фиг. 7 - FTIR лекарственного продукта кристаллического амифостина, полученного в 10% этаноле в воде;
на фиг. 8 - FTIR лекарства амифостина;
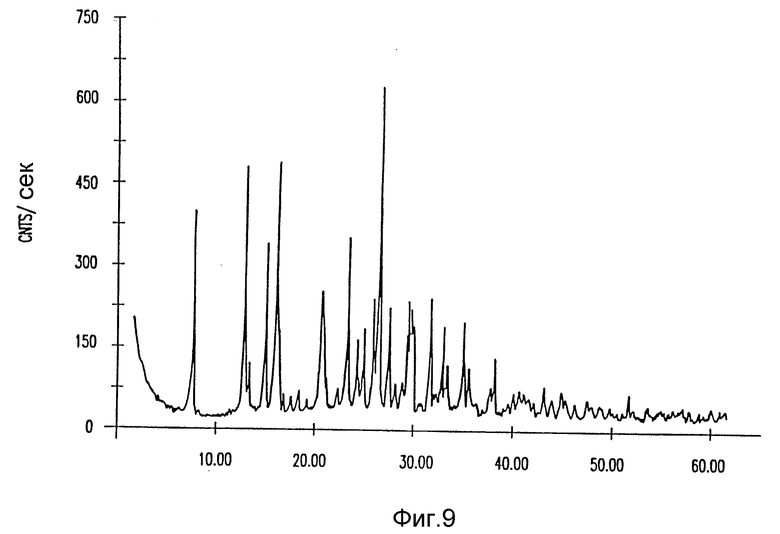
на фиг. 9 - рентгеновская дифракция лекарственного продукта кристаллического амифостина, полученного из 10% этанола в воде;
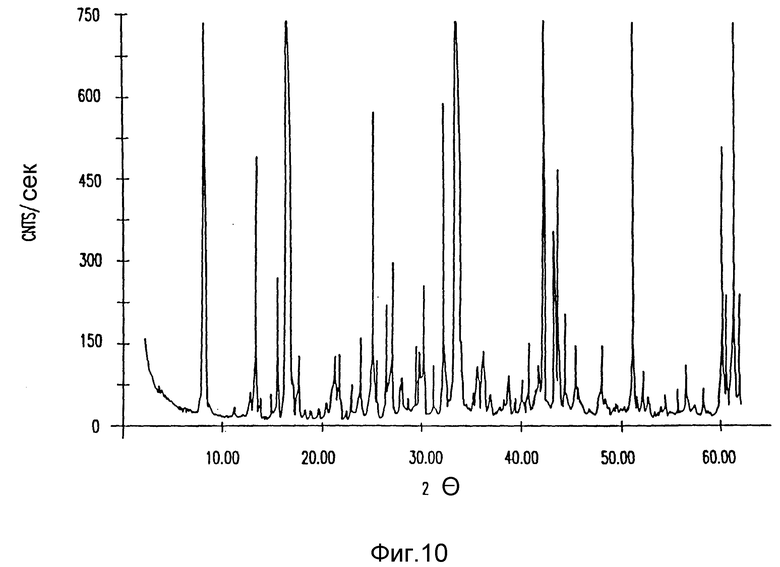
на фиг. 10 - рентгеновская дифракция лекарственного вещества амифостина;
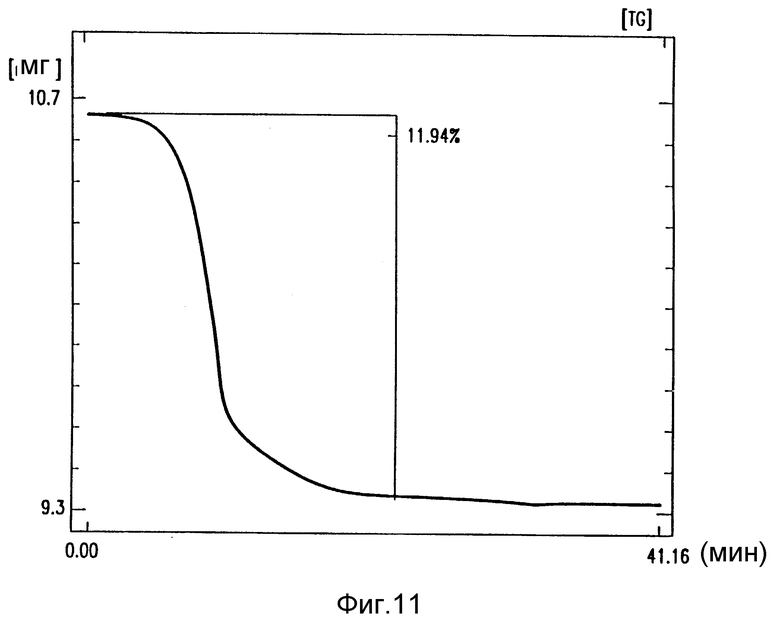
на фиг. 11 - TGA лекарственного продукта кристаллического амифостина и маннита, полученного из 10% этанола в воде;
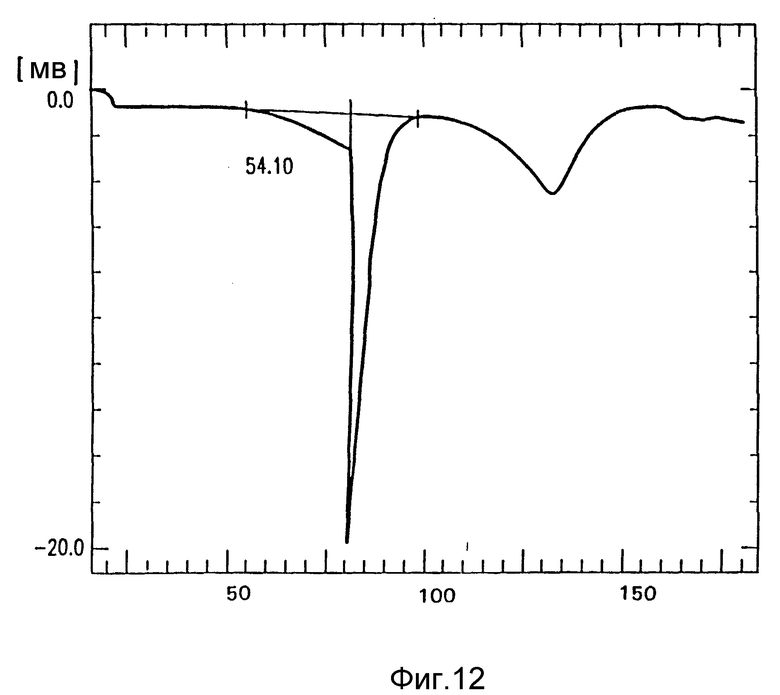
на фиг. 12 - DSC лекарственного продукта кристаллического амифостина и маннита, полученного из 10% этанола в воде
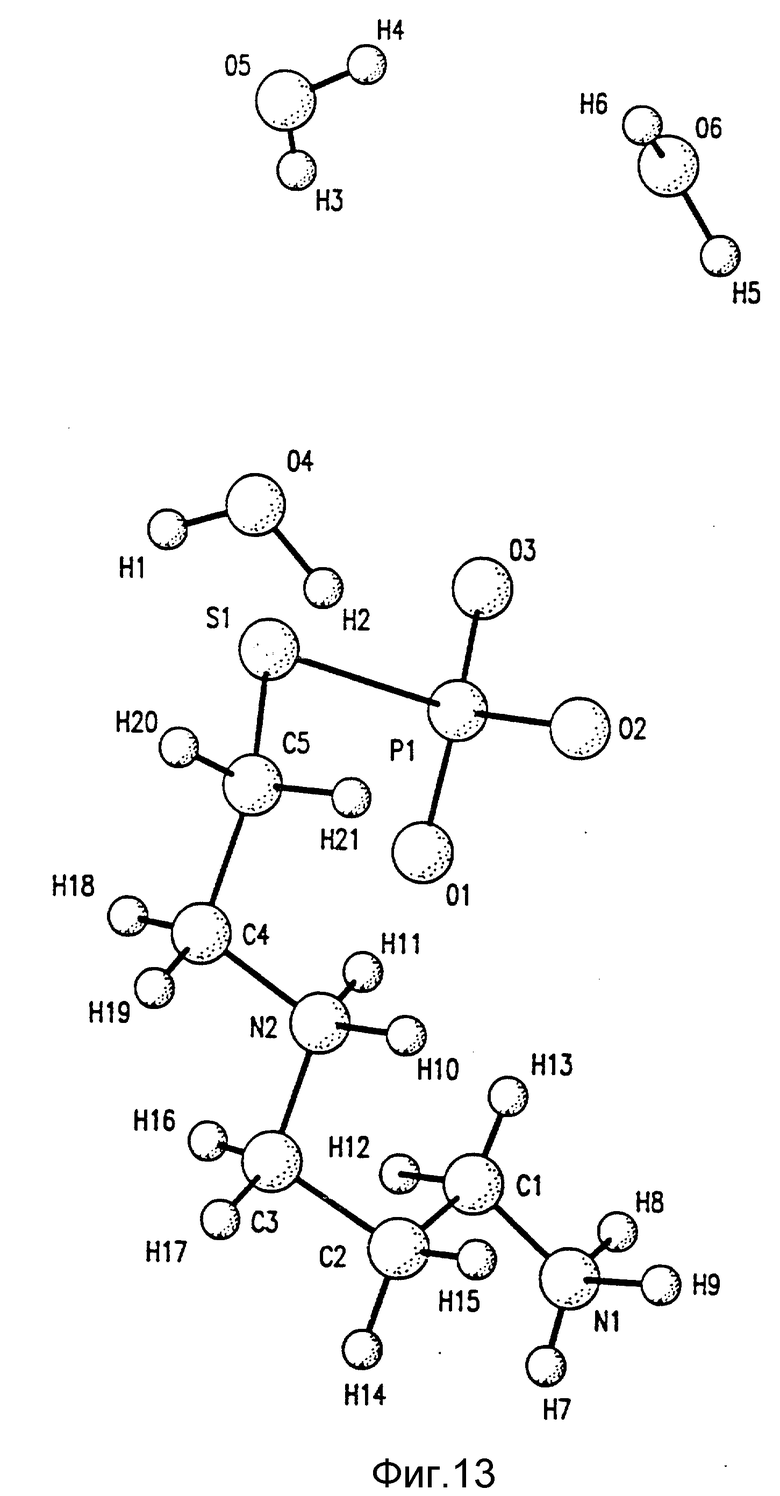
на фиг. 13 изображена молекулярная и кристаллическая структура высушенного вакуумом амифостина.
До настоящего изобретения имеющийся в наличии фармацевтический препарат амифостина (этиол) был термически нестабильным. Из-за его нестабильности препарат этиол требовал низких температур при хранении и перевозке, чтобы воспрепятствовать разложению продукта.
Настоящее изобретение предлагает первый стабильный высушенный вакуумом фармацевтический препарат амифостина, который легок в обращении и может храниться при температурах от 4oC до комнатной температуры в течение длительных периодов времени без значительного разложения продукта, с получением нужного раствора. Препарат позволяет перевозить и хранить амифостин в больницах в любом регионе мира, где нет возможности хранить его в морозильных камерах, предназначенных для лекарств.
Неожиданно было выявлено, что стериальный и стабильный продукт кристаллического амифостина без наполнителей и с наполнителями, такими, как маннит, можно приготовить вакуумным высушиванием водно-этанольного раствора, содержащего лекарственное вещество амифостина, с содержанием этанола от 1 до 35%.
Важный аспект настоящего изобретения включает предварительные исследования до приготовления, которые определяют (1) растворимость лекарственного вещества амифостина (мг/мл) при различных концентрациях воды/этанола, (2) растворимость лекарственного вещества амифостина в воде/этаноле при разных температурах, (3) соответствующую температуру сушки замораживанием, необходимую для осаждения амифостина до вакуумной сушки и (4) нужную концентрацию этанола в препарате, чтобы получить сверхнасыщенный раствор, который при охлаждении до нужной внутренней температуры в сушилке замораживанием дает осаждение амифостина в кристаллической форме. Из вышеупомянутых исследований до приготовления (см. примеры infra) было определено, что предпочтительная концентрация амифостина на безводной основе составляет около 100 мг/мл в 10%- водном этаноле. Также температура морозилки около -20oC является температурой, при которой амифостин выпадает в осадок.
Чтобы получить брикетик эстетичного вида процент этанола в смеси этанол/вода составляет от 1 до около 35% об./об. этанола (например, соотношение этанол:вода 1:99; 35:65); и внутренняя температура сушки вымораживанием может колебаться от -40oC до около -10oC, а лучшее -20oC. Результаты предварительных исследований, представленных в этом изобретении, являют собой важную основу для регулирования взаимозависимых переменных концентрации аминофостина, концентрации этанола и температуры для получения многообразных комбинаций размеров ампулы/объема заполнения.
Как правило, внутренняя температура сушки с вымораживанием предварительно снижается до температуры от -30 до -25oC, предпочтительно до -20oC. Затем ампулы помещаются внутрь, и температура регулируется от -30oC до около -15oC, лучше ее установить на -20oC и при этой температуре ампулы выдерживаются около 20 ч.
В зависимости от концентрации этанола и амифостина или амифостина и наполнителя в растворах и в зависимости от концентрации этанола будет соответственно меняться температура, необходимая для выпадения осадка. После выпадения в осадок кристаллического амифостина препарат замораживается.
Когда препарат подвергся замораживанию, начинается цикл первичной сушки, чтобы удалить основную часть воды и этанола. Обычно давление в камере снижается до 150 мТорр. Цикл первичной сушки завершается, когда температура препарата -20±2oC уже более двух часов. Во время процесса вторичной сушки препарат выдерживается при температуре -20 - +10oC, лучше при температуре выше температуры цикла первичной сушки, в течение 40-50 ч для облегчения процесса вторичной сушки, т.е. удаления остаточной воды и этанола.
Когда парциальные давления воды и этанола достигают стабильного состояния, сушка считается завершенной. Такой способ получения дает высушенный в вакууме продукт, который представляет собой кристаллический амифостин, демонстрирующий улучшенную стабильность в сравнении с известным препаратом, который содержит аморфный амифостин. Эти ампулы можно хранить и перевозить при температурах от 4oC до комнатной температуры, не опасаясь разложения продукта.
Кроме того, можно добавить наполнители, чтобы увеличить количество твердых веществ, присутствующих в препарате. Наполнителями, использующимися для этой цели, часто в комбинации, являются фосфаты натрия или калия, хлорид натрия, лимонная кислота, винная кислота, желатин и карбогидраты, такие, как декстроза, сахароза, сорбит, инозит, маннит и декстран. Кроме упомянутых здесь, специалистам известны многие другие наполнители.
Твердые композиции кристаллического амифостина с вакуумной сушкой по изобретению можно изготовить в ампулах с одноразовой дозировкой асептическим заполнением подходящих ампул стериальным высушенным вакуумом раствором до определенного содержания амифостина; получением твердой композиции вакуумной сушкой; и затем герметичным укупориванием ампулы, рассчитанной на одноразовое применение.
Твердая композиция в этих заполненных ампулах быстро растворяется и восстанавливается соответствующими стерильными разбавителями прямо в ампуле с получением соответствующего стерильного раствора с нужной концентрацией амифостина для применения.
Здесь термин "подходящая ампула или контейнер" обозначают контейнер, способный сохранять стерильную среду, такой, как ампула, способный хранить высушенный вакуумом продукт с помощью герметичной пробки. Кроме того, понятие подходящих контейнеров включает в себя соответствующий размер контейнера с учетом введения раствора, предназначенного для пересоставления высушенной в вакууме композиции; а также соответствующий материал, из которого он изготовлен, обычно стекло типа 1.
Под пробками, которые используются здесь (например, стерильные резиновые пробки или их эквиваленты), следует понимать такие уплотняющие средства, которые обеспечивают герметичность, но в то же время позволяют ввести через них разбавитель, например, стерильную воду для инъекции, USP, чтобы восстановить раствор амифостина.
Эти и другие аспекты приемлемости контейнеров для фармацевтических продуктов хорошо известны специалистам фармацевтической области.
Физические свойства, такие, как внешний вид, были улучшены в твердых композициях быстрого разведения, что обеспечило выполнение одной задачи изобретения, но параллельно с этим неожиданно выяснилось, что эти твердые композиции быстрого разведения обладали также повышенной термостабильностью по сравнению с известными до сих пор препаратами.
В практике ожидание повышения химической стабильности при вакуумной сушке обычно относят к большей стабильности твердого продукта в сравнении со стабильностью формы раствора фармацевтической композиции. Однако композиции данного изобретения демонстрируют лучшую химическую стабильность, в сравнении с твердыми дозированными формами (см. примеры).
Фармацевтические композиции настоящего изобретения пригодны для парентерального назначения, например, внутривенного, внутримышечного, а также внутриполостных, внутриоболочковых и подкожных инъекций.
Следующие примеры иллюстрируют настоящее изобретение, но их никоим образом не следует рассматривать как ограничивающие его.
Пример 1. Процедура исследования параметров до приготовления препарата.
Этот пример описывает процедуру, используемую для исследования и оценки параметров, т.е. концентрации амифостина, концентрации этанола и температуры для получения стерильной высушенной вакуумом формы кристаллического амифостина с фармацевтически приемлемыми наполнителями или без них с последующей вакуумной сушкой из смеси вода/этанол.
A. Получение образцов растворов.
В отдельные тестовые пробирки с винтовыми пробками добавляют следующее:
(а) 5000 μл воды
(б) 475 μл воды и 250 μл этанола
(в) 4500 μл воды и 500 μл этанола
(г) 4250 μл воды и 750 μл этанола
(д) 4000 μл воды и 1000 μл этанола
Добавляют амифостин в каждую тестовую пробирку до тех пор, пока твердое вещество перестанет растворяться. Обрабатывают ультразвуком 30 с. Если весь амифостин растворился, добавляют лекарственное вещество еще до тех пор, пока частицы перестанут растворяться в растворителе. Энергично встряхивают пробирки в течение 30 мин при 25oC.
Б. Получение стандартных растворов.
Готовят 10 мл следующих растворов лекарственного вещества в воде:
(а) 0,05 мг/мл
(б) 0,1 мг/мл
(в) 0,3 мг/мл
(г) 0,5 мг/мл
На УФ-спектрофотометре сканируют каждый раствор в сравнении с чистой водой в качестве контроля в диапазоне 190-290 нм. Регистрируют положения при 200 или 210 нм. Проводят анализ линейной регрессии стандартных данных при 200 или 210 нм и получают кривую и величину отсечения.
В. Анализ растворов образцов.
Берут приблизительно 0,5 мл из каждого раствора и центрифугируют до осадка в виде таблетки. Фильтруют каждый образец на 0,45 μл фильтре для удаления лишних частиц (при необходимости). Разбавляют каждый образец водой до рабочей концентрации 0,3-0,4 мг/мл. На УФ-спектрофотометре сканируют каждый образец в диапазоне 190-290 нм. Получают считывание для каждого образца при 200 или 210 нм.
Из стандартной кривой величины поглощения и разбавлений рассчитывают концентрацию амифостина в каждом растворе. Охлаждают растворы до следующей самой низкой температуры и повторяют процедуру после выдерживания раствора при температуре в течение 1 ч. В табл. 1 представлены результаты опытов на растворимость амифостина в смесях этанол/вода при разных температурах. Эта связь графически показана на фиг. 1 и 2.
Этот пример демонстрирует то, что растворимость лекарственного вещества амифостина находится в сильной зависимости как от содержания сорастворителя этанола, Так и от температуры.
Обычно степень сверхнасыщения, являющаяся результатом падения температуры данного раствора амифостина, снижается с увеличением содержания сорастворителя этанола (см. табл. 1 и фиг. 1 и 2). Эта зависимость используется в следующих примерах 2 и 3 при получении кристаллического амифостина.
Пример 2. Способ получения кристаллического амифостина без маннита.
К 130 мл воды при 25oC с перемешиванием добавляют 21,25 г лекарственного вещества тригидрата амифостина, которые эквивалентны 17,0 г безводного амифостина. После полного растворения амифостина к раствору с перемешиванием добавляют 17 мл абсолютного этанола, USP. Затем добавляют нужное количество воды до 170 мл.
Полученный раствор стерильно фильтруют через фильтр 0,22 μм. В каждую из 33-х 10- миллилитровых ампул или пузырьков дозируют 5 мл фильтрованного раствора, что составляет 500 мг амифостина на безводной основе на ампулу при соотношении этанол/вода 10:90. Ампулы закупоривают съемными пробками и образцы подвергают следующему циклу вакуумной сушки: они помещают на полки сушки-морозильника, которые предварительно охлаждались до около -20oC в течение 17 ч при давлении окружающей среды, после чего камеру откачивали и температуру полок поддерживали при -20oC 28 ч.
По истечении этого времени камеру вновь заполняли азотом и ампулы быстро закрывали вручную. Такая процедура давала ампулу с одноразовой дозировкой в 500 мг термостабильного, высушенного замораживанием кристаллического амифостина в виде эстетичного брикетика.
Пример 3. Способ получения кристаллического амифостина.
К 150 мл воды при 25oC добавляют с перемешиванием приблизительно 20 г маннита. К этому раствору с перемешиванием добавляют приблизительно 25 г лекарственного вещества амифостина (тригидрат), которые эквивалентны 20 г безводного амифостина. После полного растворения к раствору с перемешиванием добавляют 20 об. мл безводного этанола, USP. Добавляют нужное количество воды до 200 мл.
Полученный раствор подвергают стерильному фильтрованию через 0,2 μм фильтр, и 5 мл раствора переносят в каждую из 40-ка 10-миллилитровых ампул. Ампулы закрывают съемными пробками, и образцы помещают на полку сушки-морозильника при температуре окружающей среды. Внутренняя температура снижается на 2oC/мин, до -25oC, и температуру выдерживают 90 мин, чтобы инициировать кристаллизацию амифостина.
После этого времени температуру внутри поднимают выше точки эвтектики температуры со скоростью 2oC/мин, до -5oC и выдерживают в течение 10 ч для отжига продукта. Далее внутреннюю температуру снижают до -25oC до тех пор, пока температура продукта будет не менее -18oC, при которой продукт выдерживают не более 60 мин.
После этого включают конденсатор сушки-морозильника и вакуум в камере снижается до 150 мТорр. Температура поднимается до -20oC, и образцы высушиваются вакуумом в течение 14 ч. К этому моменту температура ампул сравнивается с температурой полок камеры, указывая на конец цикла первичной сушки. Ампулы оставляют при 150 мТорр на полке с температурой -20oC еще 13,4 ч для удаления негидратной воды.
Камеру вновь заполняют азотом, и ампулы закрываются механически. В результате этой процедуры получают ампулу с однократной дозировкой приятного на вид термостабильного полученного с вакуумной сушкой брикетика, содержащего приблизительно 500 мг амифостина (на безводной основе) и 500 мг маннита.
Пример 4. Испытания высушенного в вакууме кристаллического амифостина на стабильность.
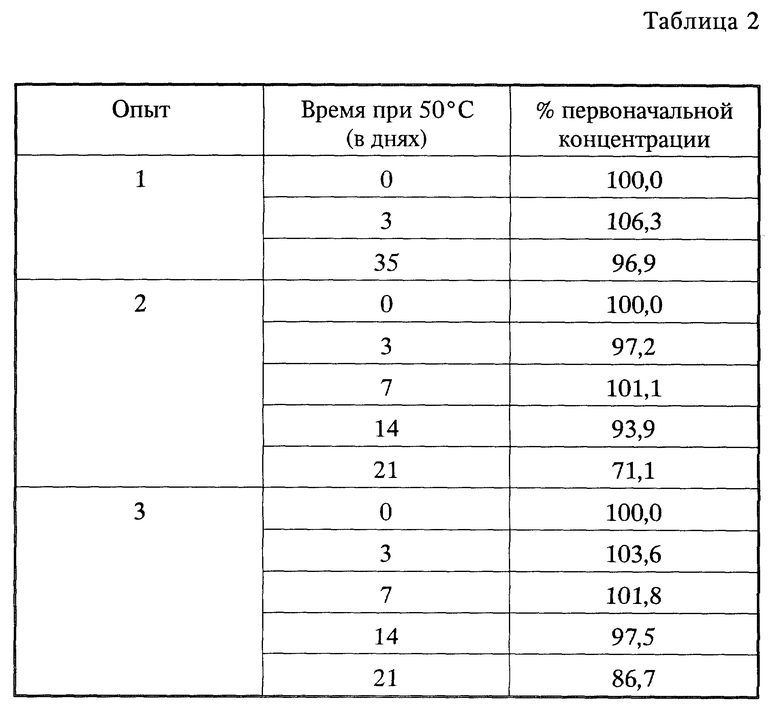
Несколько закупоренных заполненных азотом ампул с кристаллическим амифостином, полученным из 10:90 этанол/вода, как описано в примере 2, подвергались выдержке при 50oC в течение до 35 дней, чтобы определить термоустойчивость кристаллического амифостина. Результаты представлены в табл. 2, где все данные даются как процент (%) от первоначальной концентрации, которая определена как 100%.
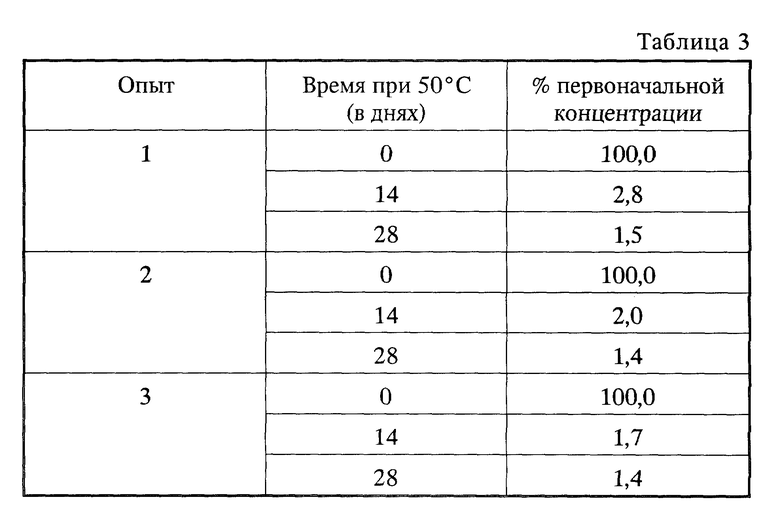
В целях сравнения известный препарат аморфного амифостина также подвергался тестированию на стабильность при 50oC в течение 28 дней. Результаты представлены в табл. 3. Все данные даются как процент (%) от первоначальной концентрации, которая определена как 100%.
Из данных табл.3 видно, что даже между твердыми препаратами наблюдается значительная разница в термостабильности, и кристаллические композиции раскрытого здесь способа существенно отличаются большей термоустойчивостью.
Пример 5. Предпочтительный способ получения кристаллического амифостина.
Процедура составления смеси амифостин:/маннит (100 мг безводного каждого/мл).
Следующая процедура рассчитана на получение 3,5 л раствора.
1. 350 г маннита (USP) растворяли с перемешиванием (магнитной тефлоновой мешалкой) в 2300 мл наночистой воды при комнатной температуре в реакторе давления (автоклаве) из нержавеющей стали.
2. К этому раствору добавляли 438,3 г тригидрата амифостина. Растворение сопровождалось энергичным перемешиванием.
3. После полного растворения амифостина к раствору медленно добавляли с энергичным помешиванием 525 мл дегидратированного этанола (USP). Амифостин выпадает в осадок сразу в месте добавления с последующим быстрым повторным растворением разбавлением этанола при перемешивании.
4. После завершения добавления этанола раствор разбавляли до 3500 мл наночистой водой.
5. Раствор фильтровался при положительном давлении в 10 фунт/дм2 (0,7 кг/см2) в азоте через фильтр Millipore-40.
6. 5 мл полученного раствора переносилось в каждую из 660-ти 10-миллилитровых ампул (Wheaton Е-2910- В47В). Ампулы частично закрывались серыми бутиловыми резиновыми пробками (Tompkins PT 23В0857 F2) и высушивались вакуумом.
Цикл вакуумной сушки для амифостина маннита (100 мг безводного/мл).
1. Ампулы помещали на полку при 25oC, чтобы осаждение амифостина было однородным.
2. Температура полок в камере снижалась на 2oC в 1 мин до -35oC. При достижении этой температуры она поддерживалась постоянной в течение 240 мин, чтобы раствор замерз во всех ампулах. На этой стадии образцы проходили через точку эвтектики температуры (приблизительно -16oC).
3. В конце этого 240-минутного периода выдержки температура внутри камеры поднималась на 2oC в 1 мин до 0oC в продолжение 25 мин. При достижении температуры она поддерживалась постоянной 600 мин.
4. В конце этого периода выдержки температура вновь опускалась до -35oC на 2oC в 1 мин. При достижении этой температуры она поддерживалась постоянной 180 мин.
5. После этого времени включался конденсатор. Когда температура конденсатора достигала менее -40oC, из камеры откачивался газ. При достижении давления в камере менее 150 мТорр температура внутри поднималась до -20oC на 2oC в 1 мин и давление в камере поддерживалось на 150 мТорр клапаном в камере.
6. Продукт находился в камере при 150 мТорр от 12 до 25 ч после того, как температура контролируемого продукта достигала температуры полок. Камера вновь заполнялась азотом, и ампулы закрывались пробкой.
Примечание. 1 Торр равен 1 мм рт. ст. при 0oC.
Укупоренные, заполненные азотом 10-миллилитровые ампулы, содержащие высушенный в вакууме кристаллический амифостин, полученный, как описано в примере 5, подвергались испытанию на термоустойчивость при 40oC в течение 4-х недель. Из кристаллического амифостина, высушенного при -20oC в течение 12 ч, в конце испытательного срока сохранилось 93%. Из кристаллического амифостина, высушенного при -20oC в течение 24 ч, после испытательного срока осталось 84%.
Пример 6. Наиболее предпочтительный способ получения кристаллического амофостина.
Было выявлено, что самый стабильный кристаллический амифостин был получен вакуумной сушкой раствора амифостин/маннит, этанол/вода, содержащего 15% этанола (об./об.). Процедура смешивания та же, что описана в примере 5, за исключением добавления к раствору меньшего количества дегидратированного этанола.
К конкретному способу проведения цикла вакуумной сушки для получения самого стабильного кристаллического амифостина авторы пришли после проведения нескольких исследований по оценке действий в изменении конечной температуры сушки, времени конечной сушки и скорости первоначального охлаждения до -35oC ампул с раствором.
Было выявлено, что в общем стабильность кристаллического амифостина наибольшая, когда температура конечной сушки была -20oC, и время конечной сушки составило между 12 и 24 ч. Кроме того, стабильность кристаллического амифостина была выше, когда первоначальное охлаждение до -35oC ампул с раствором проводилось в течение 160 мин, а не 45 мин.
Исходя из описанных выше исследований, можно рассчитать наиболее предпочтительный способ проведения цикла вакуумной сушки. Это следующий способ:
Цикл вакуумной сушки для амифостина/маннита (100 мг безводного/мл)
1. Ампулы помещаются на полку при температуре около 25oC, чтобы осаждение амифостина проходило однородно.
2. Температура полки внутри камеры снижается с 25 до ОoC в течение 20 мин, с 0 до -20oC в течение 60 мин и затем с -20 до -35oC в течение 80 мин. После этого температура поддерживается постоянной 240 мин, чтобы раствор замерз во всех ампулах. На этой стадии образцы пропускаются через эвтектическую (приблизительно -16oC) температуру.
3. В конце периода выдержки в 240 мин температура полок внутри камеры поднимается до 0oC на протяжении 25 мин. Период поддерживания температуры при 0oC продолжается 600 мин.
4. В конце периода выдержки в 600 мин температура полок вновь снижается от 0 до -15oC в течение 15 мин, а затем от 15 до -35oC в течение 120 мин. Как только достигается температура - 35oC, она сохраняется постоянной в течение 180 мин.
5. После этого времени включается конденсатор. Когда температура конденсатора становится менее -40oC, газ из камеры откачивается. При давлении в камере менее 150 мТорр, температура полки поднимается от -35 до -20oC на 2oC в 1 мин в течение 54 ч, а давление в камере поддерживается на 150 мТорр с помощью клапана.
6. После того как температура контролируемого продукта достигла температуры полки, продукт в ампулах оставляют в камере при 150 мТорр на 12-24 часа. Камера вновь заполняется азотом и ампулы закупориваются.
Примечание: 1 Торр равен 1 мм рт.ст. при 0oC.
Если не ограничиваться теорией, можно считать, что в вышеуказанной стадии 2 происходит образование затравочных кристаллов амифостина в замороженном растворе, а на стадии 3 происходит рост кристаллов амифостина вокруг затравочных кристаллов и завершается кристаллизация амифостина из частично замерзшего раствора.
Кристаллический амифостин был получен с использованием вышеуказанного цикла вакуумной сушки с 12,5% раствором этанола, причем в одном случае стадия конечной сушки продолжалась 12 ч, а в другом - 24 ч. Тестирование на стабильность этих двух продуктов при 40oC в течение 8 недель не показало разложения амифостина в случае сушки за 12 ч и показало 2% разложения при сушке за 24 ч.
Пример 7. Предпочтительный способ проведения тестирования кристаллического амифостина на стабильность.
Закупоренные, заполненные азотом ампулы емкостью в 10 мл, содержащие высушенный вакуумом кристаллический амифостин, полученный, как описано в примере 6, выдерживались при 40oC сроком до 8 недель.
Было выявлено, что предшествующий тест на стабильность при 50oC вызвал разложение кристаллического амифостина в закупоренных ампулах, которое трудно сопоставить со стабильностью кристаллического амифостина в обычных условиях хранения (т.е. при температуре охлаждения около 4oC). Однако результаты теста на стабильность при 40oC и ниже можно соотнести со стабильностью кристаллического амифостина в обычных условиях хранения.
Примерно стабильность в течение одного месяца при 30oC можно сравнить с 18 месяцами при 4oC; стабильность в течение 8-12 недель при 40oC сопоставима с 18 месяцами при 25oC; и стабильность в течение 2-3 недель при 40oC сопоставима с 18 месяцами при 4oC. Cм. L.Lachman и др. Теория и практика промышленной фармакологии, стр. 766-767 в общем обсуждении прогноза стабильности.
В конце периода испытания кристаллический амифостин в ампулах тестировался на содержание воды, тиола и амифостина. Содержание воды определялось титрованием по Карлу Фишеру. Так как амифостин может подвергнуться гидролизу при испытании и образовать 2-[(3-аминопропил)амино]этан тиол и фосфорную кислоту, определение количества этого тиола дают указание о стабильности амифостина. Анализ содержания тиола и амифостина проводился с использованием следующей процедуры.
1. Получение стандартов и образцов
Вес и объемы могут регулироваться при условии, что конечные концентрации остаются те же самые. Хранить растворы можно после охлаждения и/или в охлажденном автозаборном устройстве сразу после приготовления.
1.1 Подготовка стандартных растворов амифостина (3 мг/мл, метанол/вода 50/50)
Точно отвешивают приблизительно 30,0 мг амифостина в 10-миллилитровую мерную колбу. Растворяют в 5 мл воды и разбавляют до объема метанолом.
Хранят 24 ч при t полки 4oC.
1.2. Подготовка 2-[(3-амино пропил/амино]этантиола, дигидрохлорида
Стандартного раствора (0,012 мг/мл
Свободного основания, метанол/вода 50/50)
Точно отвешивают приблизительно 1,85 мг 2-[(3-амино пропил)амино] этантиола, дигидрохлорида, стандарта в 100-миллилитровую мерную колбу. Добавляют 50 мл воды, затем разбавляют до объема метанолом.
Хранят 24 ч при t полки 4oC.
1.3. Подготовка амифостина (лекарственного вещества)
A. Подготовка образца (3 мг/мл, метанол/вода 50/50).
Точно отвешивают приблизительно 30,0 мг амифостина в 10-миллилитровую мерную колбу. Растворяют в 5 мл воды и разбавляют до объема метанолом.
Хранят 24 ч при t полки 4oC.
B. Родственные вещества (15 мг/мл, вода)
Точно отвешивают приблизительно 150,0 мг амифостина в 10-миллилитровую мерную колбу. Растворяют и разбавляют до объема водой.
Хранят 24 ч при t полки 4oC.
1.4. Подготовка амифостина для инъекций (лекарственный продукт) 4,8 мг/мл, метанол (вода 50/50).
Растворяют содержимое 1 ампулы с лекарственным продуктом в 9 мл воды. Количественно переносят образец в 25-миллилитровую мерную колбу и разбавляют до объема водой. Переносят 6 мл этого раствора в 50-миллилитровую мерную колбу, добавляют 19 мл воды и разбавляют до объема метанолом.
Хранят 24 ч при t полки 4oC.
2. Требования к системе
Амифостин (используют стандартный раствор 1.1) % RSD от 6 noвторов впрыскивания амифостина - ≤2
Фактор образования размытых пиков - ≤ 2
Теоретические тарелки - > 1000
2-[(3-аминопропил/амино]этантиол, дихлорид ("WR- 1065") (Используют стандартный раствор 1.2) %RSD от 6 впрыскиваний - ≤ 4
Фактор образования размытых пиков - ≤ 2
Теоретические тарелки - > 7000
3. Оборудование и материалы (указанные ниже или их эквиваленты)
Приборы
Система ВЖХВР с УФ-детектором
Материалы
Амифостин Стандарт
Концентрированная фосфорная кислота (Н3Р04): для ЖХВР
Метанол (МеОН): для ЖХВР
Очищенная вода: 16 мег-Ом или выше
1-октансульфокислота, натриевая соль (OSA): для ЖХВР
Условия хроматографирования ЖХВР
Характеристики колонны:
Насадка : TosoHaas TSK-ODS-80 ТМ с колпачками (USP LI)
Размеры: 4,6 х 250 мм
Размер частиц: 5 μм
Подвижная фаза: метанол/водная фосфорная кислота, pH 3,0 3,5 мМ OSA (50/50)
1. Растворяют 0,38 г OSA в 500 мл водной фосфорной кислоты pH 3,0
2. Разбавляют до 1000 мл метанолом
3. Фильтруют и дегазируют подвижную фазу.
Обнаружение: 220 нм (поглощения) Скорость потока: 1,0 мл/мин
Объем впрыскивания: 10 мл
Температура колонны: окружающей среды
Температура образца: 4oC
Обратить внимание: отрегулировать, чтобы получить приблизительно 80% полномасштабного пика амифостина.
4. Процедура
Впрыскивают образец и стандартные растворы, зарегистрируют время удержания пика амифостина (приблизительно 4 мин). Время удержания пика стандартного амифостина и пика препарата образца должно совпадать на 10% для подтверждения идентификации амифостина в образце.
Расчеты
Образец амифостина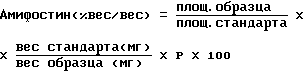
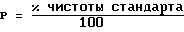
Образец амифостина для впрыскиваний
Амифостин (безводный) % соответствия заявленному


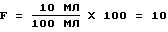

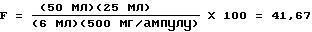
Родственные вещества (RS) (в-ва из реакции)
Исключают пики на хроматограмме образца родственного вещества, которые имеются на контрольной хроматограмме, или пики от фронтальных возмущений растворителя.
Для каждого обнаруженного дополнительного родственного вещества регистрируют процент площади относительного пика: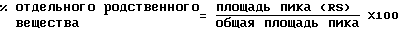
Отмечают процент WR-1065 и любое дополнительное родственное вещество с площадью большее 0,1%. Указывают суммарное количество всех родственных веществ.
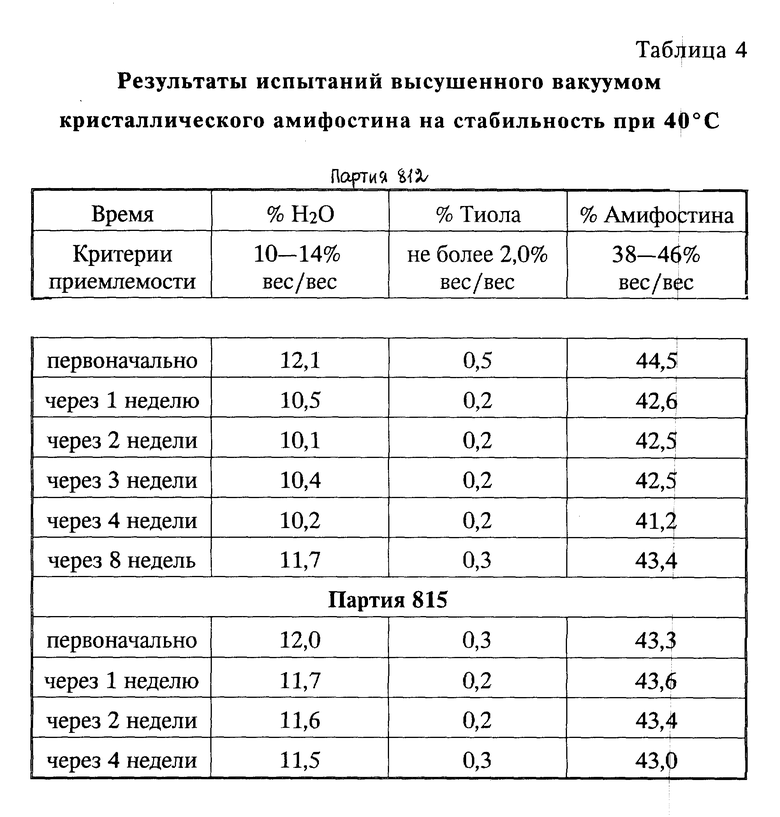
Пример 8. Результаты по стабильности кристаллического высушенного вакуумном амифостина испытанием при 40oC.
Результаты, полученные при испытании кристаллического амифостина, полученного способом, описанным в примере 6, и тестировании, как описано в примере 7, суммированы в табл. 4.
Данные результаты ясно указывают на повышенную стабильность кристаллического амифостина, полученного способом, описанным в примере 6. Повышенная стабильность очевидна из низкого вес. % образования тиола, что является показателем очень небольшого разложения амифостина гидролизом и образования 2-[(3-аминопропил)амино] этан тиола.
Кроме того, со временем происходит небольшая потеря в содержании воды или содержании амифостина. Эти показатели резко отличаются от плохой стабильности высушенного вакуумом препарата аморфного амифостина, который демонстрирует значительное разложение в течение 14 дней при 50oC (см. табл. 3 примера 4).
Пример 9. Кристаллическая структура высушенного вакуумом амифостина.
Была определена молекулярная и кристаллическая структура высушенного вакуумом кристаллического амифостина. Исследование кристаллов, определение элементарной ячейки и сбор данных проводились с использованием излучения меди при комнатной температуре.
Структура определялась прямыми методами и уточнялась полно-матричным методом наименьших квадратов и разностным методом Фурье. Все неводородные атомы определялись анизотропно. Атомы водорода, присоединенные к атомам азота и кислорода воды, определялись по разностным картам Фурье и уточнялись изотропно. Позиции остальных атомов водорода рассчитывались исходя из идеальной геометрии. Эти атомы водорода не подвергались уточнению из-за незначительного влияния на соотношение параметров.
Соединение кристаллизуется в группе P212121 хирального пространства. Данные, представленные в этом примере, взяты от энантиомерной структуры с низкими R величинами (R = 0,036 и Rw = 0,042). Другая энантиомерная структура имеет R величину 0,042 и Rw величину 0,051. Графическое изображение молекулярной и кристаллической структуры тригидрата амифостина вакуумной сушки показано на фиг. 13.
Экспертиментальная процедура
Сбор данных
Бесцветный плоский игольчатый кристалл C5H21N2O6PS с приблизительными размерами 0,350 х 0,050 х 0,030 мм закреплялся на стекловолокне. Все измерения делались на дифрактометре Rigaku AFC5R с графитным монохроматическим Cu Kα излучением и 12 кВ генератором с вращающимся анодом.
Постоянные ячейки и матрица ориентации для сбора данных, полученных из уточнения до наименьших квадратов с использованием установочных углов 20 тщательно центрированных отражений в диапазоне 40,45< 2θ <52,03o, соответствовали ромбической ячейке с размерами: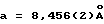
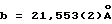

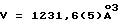
Для Z = 4 и FM = 268,26. расчетная плотность составила 1,447 г/см3. Учитывая систематическое отсутствие:
hOO:h ≠ 2 n
ОКО:k ≠ 2 n
001:l ≠ 2 n
и успешное определение и уточнение структуры, пространственной группой будет
P212121(#19).
Данные собирались при температуре 23±1oC с использованием техники сканирования ω-2θ до максимальной величины 2θ в 120,0o. Омеговые сканирования нескольких интенсивных отражений, проведенные до сбора данных, имели среднюю ширину на полувысоте в 0,21o с углом захвата 6,0o. Сканирования (0,89 + 0,14 tan θ)° делались со скоростью 8,0 o/мин (в омеге).
Слабые отражения (1 < 15,0σ (I)) сканировались повторно (максимум 4 повторных сканированиями импульсы накапливались для получения хорошей статистики подсчетов. Стационарные фоновые импульсы регистрировались на каждой стороне отражения. Соотношение пикового времени отсчета к фоновому времени отсчета составило 2: 1. Диаметр коллиматора пучка падения был 0,5 мм, и расстояние от кристалла до детектора - 400,0 мм.
Обработка данных
Всего было собрано 1120 отражений. Интенсивность трех представительных отражений, которые измерялись после каждых 150 отражений, оставались постоянными в ходе сбора данных, указывая на кристаллическую и электронную стабильность (коррекция на затухание не применялась).
Коэффициент линейной абсорбции для Cu Kα составил 37,1 см-1.
Применялась эмпирическая коррекция абсорбции на основе азимутальных сканирований нескольких отражений, которая дала коэффициенты перехода с диапазоном от 0,89 до 1,00. Данные корректировались на эффекты поляризации и Лоренца.
Подробности эксперимента
A. Данные о кристалле
Эмпирическая формула - C5H21N2O6PS
Вес формулы - 268,26
Цвет кристалла, форма - Бесцветный, - плоский, - игольчатый
Размеры кристалла (мм) - 0,350 х 0,050 х 0,030
Кристаллическая система - Ромбическая
Число отражений, используемых для определения элементарной ячейки (в диапаз. - 20) - 20 (40,5-52,0o)
Ширина пика на полувысоте при омега-сканировании - 0,21
Параметры решетки: - a = 8,456 (2) 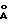 - в = 21,553 (2)
- в = 21,553 (2) 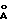 - с = 6,758 (2)
- с = 6,758 (2) 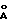 - V = 1231,6 (5)
- V = 1231,6 (5) 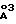
Пространственная группа - P212121 (#19)
Z величина - 4
D (расчет) - 1,447 г/см3
FOOO - 576
μ(CuKα) - 37,10 см-1
B. Измерения интенсивности
Дифрактометр - Rigaku AFC5R
Излучение - CuKα - 
Температура - 23oC
Аттенюаторы - Zr (показат. L фольги: 3,8; 13,4; 47,8)
Угол захвата - 6,0o
Отверстие детектора - 6,0 мм по горизонтали; 6,О мм по вертикали
Расстояние детектора от кристалла - 40 см
Тип сканирования - ω-2θ
Скорость сканирования - 8,0 o/мин (в омеге) (4 повторных скан.)
Ширина сканирования - (0,89 + 0,14 tan θ)°
2θмакс. - 120,0o
Число измеряемых отражений - Всего: 1120
Коррекции - Поляризационное поглощение Лоренца (коэфф. перехода: 0,89-1,00)
C. Определение структуры и уточнение
Определение структуры - Прямые методы
Уточнение - Наименьшие квадраты полной матрицы
Минимальная функция - 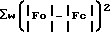
Вес наименьших квадратов - 4Fo2(σ2(Fo2)
р-фактор - 0,03
Аномальная дисперсия - Все неводородные атомы
Число наблюдений (I > 3,00 σ(I)) - 856
Число переменных - 180
Соотношение отражение/параметр - 4,76
Остаточные велич.: R; Rw - 0,03 σ; 0,042
Индикатор согласия - 1,37
Макс. сдвиг/погреш. в конечном цикле - 0,00
Макс. пик в конечной разност.
карте - 0,30 e 
Макс. пик в конечной разност.
карте - -0,22 e 
Позиционные параметры и B (ур.) для C(5)H(21)N(2)O(6)P(1)S(1) приведены в конце текста описания.
Специалисту данной области должно быть очевидно, что в объем настоящего изобретения включаются и другие варианты, не раскрытые здесь. Следовательно, данное раскрытие изобретения не следует рассматривать как ограничивающее изобретение, объем которого обусловлен прилагаемой формулой изобретения.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБЫ ПОЛУЧЕНИЯ КРИСТАЛЛИЧЕСКОГО ЦЕОЛИТА | 1993 |
|
RU2137713C1 |
| СОЛИ И КРИСТАЛЛИЧЕСКИЕ ФОРМЫ | 2014 |
|
RU2654855C2 |
| КРИСТАЛЛИЧЕСКИЙ БЕЗВОДНЫЙ МИКОФЕНОЛЯТ МОФЕТИЛА, ВНУТРИВЕННАЯ КОМПОЗИЦИЯ НА ЕГО ОСНОВЕ, СОСТАВ, ПРИГОДНЫЙ ДЛЯ ПОЛУЧЕНИЯ ВОДНОЙ ВНУТРИВЕННОЙ КОМПОЗИЦИИ | 1994 |
|
RU2132849C1 |
| КРИСТАЛЛИЧЕСКОЕ ВЕЩЕСТВО И СОДЕРЖАЩИЙ ЕГО ФАРМАЦЕВТИЧЕСКИЙ ПРЕПАРАТ | 2013 |
|
RU2622644C2 |
| КРИСТАЛЛИЧЕСКАЯ ФОРМА ЦВИТТЕРИОНА ТРОВАФЛОКСАЦИНА И СПОСОБ ЕЕ ПОЛУЧЕНИЯ | 1996 |
|
RU2144921C1 |
| СПОСОБЫ ПОЛУЧЕНИЯ НЕЦЕОЛИТНЫХ МОЛЕКУЛЯРНЫХ СИТ | 1995 |
|
RU2150428C1 |
| АМИФОСТИН В ВИДЕ ПОРОШКА ДЛЯ ИНЪЕКЦИЙ И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 2001 |
|
RU2264808C2 |
| НАНОЭМУЛЬСИЯ | 2007 |
|
RU2491917C2 |
| ВЫСОКОДИСПЕРСНАЯ КОМБИНИРОВАННАЯ ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ БЕКЛОМЕТАЗОНА И САЛЬБУТАМОЛА С БЕТА-ГЛИЦИНОМ И СПОСОБ ЕЕ ПОЛУЧЕНИЯ | 2013 |
|
RU2539374C1 |
| КРИСТАЛЛИЧЕСКИЕ ФОРМЫ СОЕДИНЕНИЯ 3-КАРБОКСИПРОПИЛ-АМИНОТЕТРАЛИНА | 2009 |
|
RU2512390C2 |




Изобретение относится к медицине, а именно к стерильной дозированной стабильной композиции кристаллического амифостина и фармацевтически приемлемого носителя, а также к способам получения кристаллического амифостина S-2-(3-аминопропиламино)этил дигидрофосфотиоата. Сущность изобретения: композиция свободна от нерастворенных частиц, содержит активное вещество и носитель. Активное вещество получают смешиванием S-2-(З-аминопропиламино) этилдигидрофосфоротиоата, спирта и воды для получения раствора без нерастворенных частиц при температуре от комнатной до 10°С. Раствор охлаждают ниже 0°С для осаждения продукта. Получают более стабильный продукт. 3 с.и 28 з.п.ф-лы, 4 табл., 13 ил.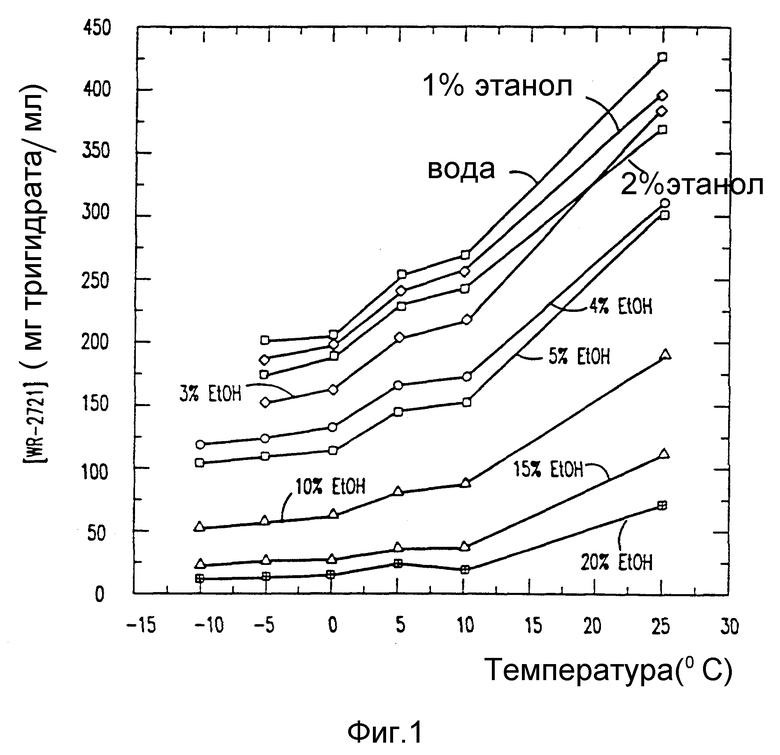
 b = 21,55
b = 21,55 и c = 6,76
и c = 6,76
25. Стерильная дозированная композиция, свободная от нерастворенных частиц, по п. 23, отличающаяся тем, что она содержит кристаллический S-2-(3-аминопропиламино)этил дигидрофосфоротиоат, который образует менее 2% 2-[(3-аминопропил)амино] этантиола при нагревании до 40oC в течение одной недели в запаянных, заполненных азотом ампулах.
Разбивка приотитетов по пунктам формулы:
31.07.92 - пп.1 - 5, 8 - 23, 27, 28,
29.07.93 - пп.6, 7, 24, 25, 26, 29, 30, 31.
| Переносная печь для варки пищи и отопления в окопах, походных помещениях и т.п. | 1921 |
|
SU3A1 |
| Лачмэн Л | |||
| и др | |||
| Теория и практика промышленной фармакологии, 1986, с.62, 63. | |||
Авторы
Даты
1999-02-10—Публикация
1993-07-30—Подача