ПРЕДПОСЫЛКИ ДЛЯ СОЗДАНИЯ ИЗОБРЕТЕНИЯ
Область техники, к которой относится изобретение
Данное изобретение относится к амифостину в виде стерильного порошка для инъекций и способу его получения; главным образом изобретение относится к амифостину в форме нелиофилизированного порошка для инъекций c повышенной устойчивостью и к способу его получения.
Уровень техники
Амифостин (S-2-(3-аминопропиламино)этилдигидрофосфоротиоат) представляет собой агент, оказывающий защитное действие на клетки, с широким спектром действия. Его применяли в качестве противорадиационных средств в военной области, а в настоящее время обычно используют как защитное средство в лучевой терапии и химиотерапии. Амифостин обладает замечательной способностью снижать отрицательные действия противораковых фармацевтических препаратов, например, циклофосфамида, диаминдихлорплатины, адриамицина и анти-ВИЧ-препаратов, например, 3-азидо-3-деокситимидина, и не влияет на эффективность противораковых фармацевтических средств и анти-ВИЧ-препаратов.
В настоящее время US Bioscience Inc производит только коммерческий продукт амифостин под торговым названием ETHYOL. Этот продукт представляет собой только лиофилизированный порошок для инъекций. Сообщается, что некристаллическая форма, полученная лиофильной сушкой при пониженном давлении, является термически неустойчивой. Таким образом, этот лиофилизированный препарат должен храниться при температуре примерно -20°С и перевозиться при температурах от около -70 до -20°С, чтобы предотвратить разложение полученного продукта. Это не только неудобно, но, кроме того, требует специальной упаковки и повышает стоимость транспортировки.
В китайской патентной заявке CN-93117436.8 раскрывается способ получения амифостина. Заявитель US Bioscience Inc сообщает, что "появляется много серьезных практических проблем, связанных с методами "сухого наполнения" или "наполнения порошка" в случае нелиофилизированного порошка амифостина для инъекций в ходе упаковки сыпучего твердого амифостина. Такие проблемы включают сложности в работе с порошком вручную, необходимость измельчать порошок до приемлемого размера частиц и приемлемой подвижности; трудно поддерживать стерильные и беспылевые условия, а также трудно обеспечить точную дозировку твердого амифостина в каждый флакон". Другими словами, на основании предшествующего уровня техники полагают, что амифостин в виде нелиофилизированного порошка для инъекций, состоящий из кристаллов единственного компонента, не может быть получен и использован в практике.
КРАТКОЕ ОПИСАНИЕ ДАННОГО ИЗОБРЕТЕНИЯ
Одна из целей данного изобретения состоит в обеспечении устойчивого стерильного нелиофилизированного порошка амифостина для инъекций, состоящего из кристаллов одного компонента амифостина.
Второй целью данного изобретения является обеспечение способа получения устойчивого стерильного нелиофилизированного порошка амифостина для инъекций, состоящего из кристаллов одного компонента амифостина.
Третья цель данного изобретения состоит в обеспечении промышленного способа получения устойчивого стерильного нелиофилизированного порошка амифостина для инъекций, полученый кристалл имеет умеренную длину и приемлемую подвижность без измельчения и может быть прецизионно расфасован во флаконы.
Эти и другие цели данного изобретения будут описаны и пояснены нижеследующими примерами.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
В данном изобретении вышеуказанный порошок амифостина для инъекций является нелиофилизированным порошком для инъекций, состоящим из кристаллов единственного компонента амифостина с длиной кристалла от 300 до 700 мкм.
Кроме того, кристалл амифостина в порошке амифостина для инъекций по данному изобретению содержит 1-3 молекулы кристаллизационной воды, предпочтительно 3 молекулы кристаллизационной воды. Вода для инъекций включает физиологический раствор, дистиллированную воду и глюкозу и т.п.
Способ получения порошка амифостина для инъекций по данному изобретению включает растворение исходного амифостина в воде для инъекций при массовом соотношении 1:2-10. После смешивания основной раствор используют для доведения рН раствора до 6,6-7,4, а затем добавляют 75-98% этанол, при соотношении масс амифостина и этанола 1:1-5, считая на исходный амифостин. После замораживания появляется кристаллический осадок амифостина с длиной гранул 300-700 мкм.
Предпочтительно способ получения порошка амифостина для инъекций по данному изобретению включает растворение исходного амифостина в воде для инъекций при соотношении масс амифостина и воды 1:3-8. После смешивания доводят рН раствора до 7,0-7,2 с помощью основного раствора, а затем добавляют 75% этанол при соотношении масс амифостина и этанола 1:1,5-3, считая на исходный амифостин. После замораживания выпадает кристаллический осадок амифостина с длиной гранул от 300 до 700 мкм.
Основным раствором, используемым в способе получения порошка амифостина для инъекций по данному изобретению, может быть водный раствор гидроксида натрия, гидроксида калия, бикарбоната натрия и карбоната натрия. Один из этих основных растворов можно использовать по отдельности или необязательно можно использовать комбинацию двух или трех из этих растворов. Температура вышеуказанного замораживания для кристаллизации составляет от -16 до -23°С, время замораживания составляет 5-10 ч, оптимальное время замораживания составляет 6-8 ч. После замораживания и кристаллизации осуществляют фильтрование при пониженном давлении и сушку в вакууме. После анализа на содержание воды кристаллы просеивают сквозь сито 20-50 меш, предпочтительно через сито 30 меш, а затем продукт расфасовывают во флаконы.
Когда амифостин используют, его количество определяют, считая на безводную форму. Внутривенную инъекцию амифостина делают за 30 мин до введения химиотерапевтического средства или препарата для лучевой терапии, и доза амифостина составляет 800 мг/м2 для химиотерапии или 200 мг/м2 для лучевой терапии, считая на площадь поверхности тела. В каждом конкретном случае следует выполнять рекомендации врача.
Преимущества данного изобретения состоят в повышенной устойчивости препарата и возможности хранить препарат при комнатной температуре в течении двух лет без охлаждения.
В способе получения порошка амифостина для инъекций по данному изобретению не применяют эксципиент и вместо лиофильной сушки используют сушку в вакууме, таким образом устраняется нестабильность препарата, возможная из-за повторяющегося процесса замораживания и размораживания (т.е. нагревания и охлаждения). Кристаллы соответствующего размера могут быть получены путем регулирования рН, температуры и времени кристаллизации в процессе получения. И длина гранулы кристалла амифостина составляет 300-700 мкм. Кристаллы такого размера можно просеивать через сито 30 меш и расфасовывать непосредственно во флаконы. Таким образом, решаются проблемы, связанные с трудностями работы с порошком вручную, и нет необходимости размельчать порошок для получения частиц приемлемого размера и приемлемой подвижности; кроме того, решается задача поддержания стерильных и беспылевых условий, а также и проблема соблюдения точной дозировки твердого амифостина для каждого флакона.
Структура кристалла амифостина после вакуумной сушки
Кристалл амифостина выглядит как бесцветный прозрачный кусок. Размер исследуемого кристалла 0,8×0,6-0,8 мм. Кристалл относится к ромбической системе, и его пространственная группа P212121. Параметры элементарной ячейки: a=21,486 (2), b=8,433 (3), c=6,742 (2) Å, Z (молекулярные числа элементарной ячейки) =4 и V (объем ячейки) =1221,6(6) Å3. Соответствующая молекулярная формула C5H15N2O3PS·3H2O. Рассчитанная плотность кристалла составляет DX=1,462 г/см3.
Данные по интенсивности дифракции получают на четырехкруговом диффрактометре Nomus CAD-4 c графитовым монохроматором, Mo-Kα-излучение, θ/2θ-сканирование и 2θmax=50,0°. Сумма полученных независимых отражений 1211, и в ней число наблюдаемых отражений (|F1>3,0σF|) 1129.
Для определения кристаллической структуры применяют прямой метод (SHELXS-86). Расположение 13 атомов может быть определено непосредственно из Е-диаграммы, а затем используют дифференциальный метод Фурье, чтобы установить расположение всех 15 неводородных атомов и определить, какой вид атомов имеется, например, углерод, азот, кислород, фосфор и сера. Значения координат атомов и их изотропные термические колебательные параметры уточняют методом наименьших квадратов. Расположение всех атомов водорода определяют с помощью метода геометрических расчетов и альтернативно, дифференциально-комбинированного метода Фурье. И наконец, структурные параметры уточняют полноматричным методом наименьших квадратов. Фактор достоверности R=0,041, RW=0,044, (Δ/σ)max=0,87, (Δρ)min=-0,290e/A3, ((Δρ)min=0,520e/A3.
Молекулярная структура показана ниже.
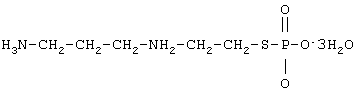
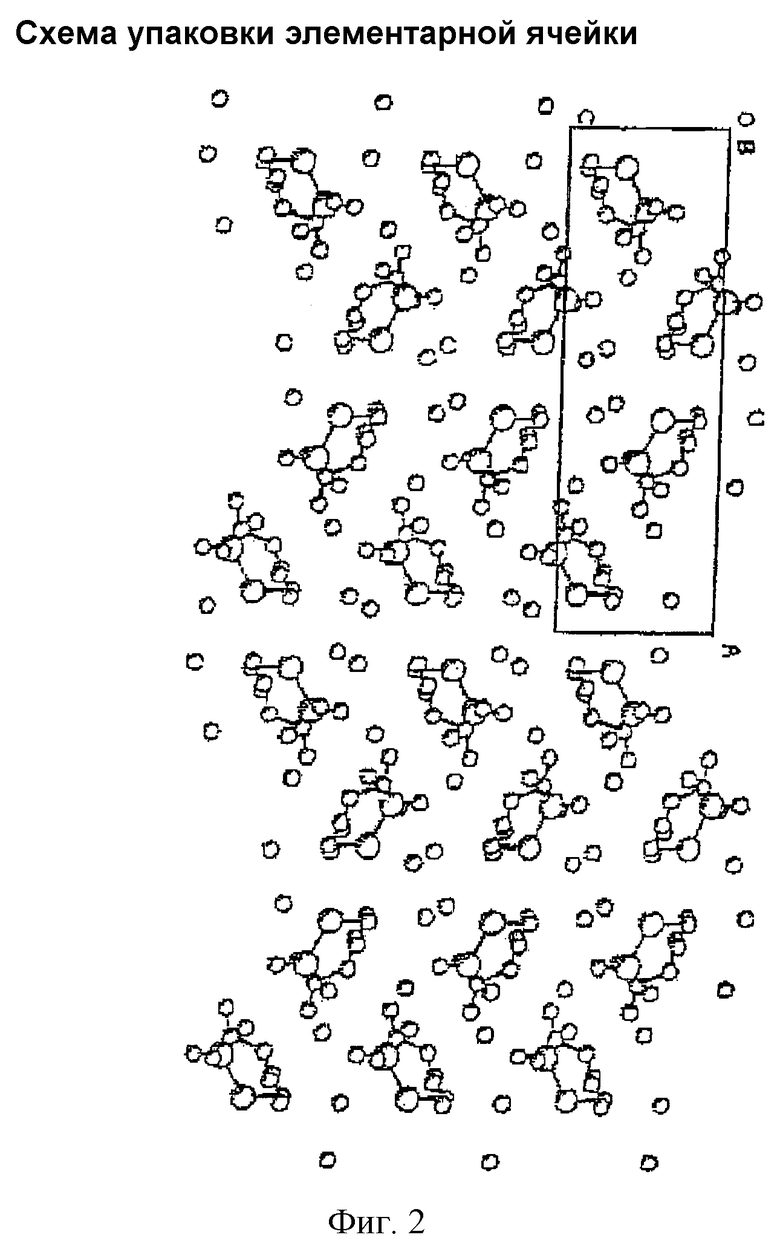
На фиг.1 изображена проекция пространственной структуры, а на фиг.2 показан чертеж упаковки элементарной ячейки.
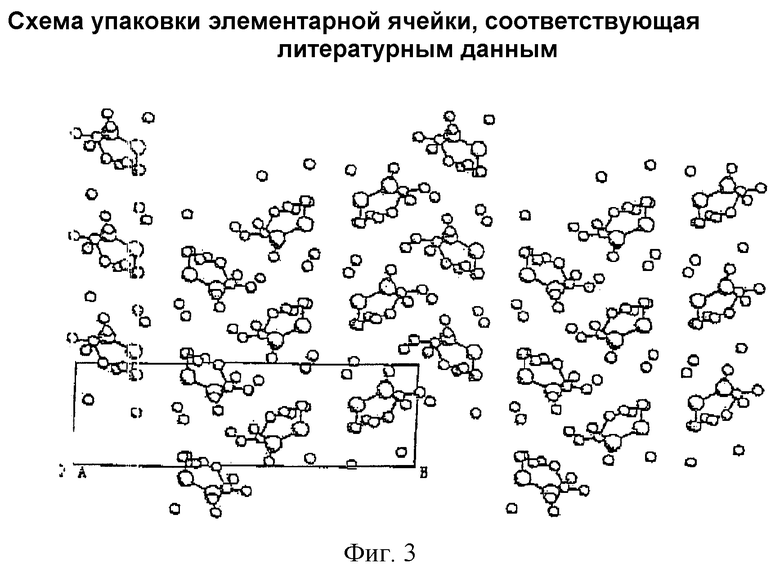
Эти результаты показывают, что молекулярная структура амифостина является такой же, как структура, ранее описанная, и молекулярная пространственная структура изображена на фиг.1. В кристалле содержится три молекулы воды, а из-за существования молекул воды между молекулами в кристаллическом состоянии образуются водородные связи. 04...06: 2,851 Å, 05...N2: 2,744 Å, 04...01 (1-x, 0,5-y, 0,5-z): 2,83 Å, 04...06 (1-x, 0.5-y, 1,5-z): 2,882 Å, 05...01 (x, y, 1-z): 2,700 Å, 05...02 (0,5-x, -y, 0,5-z): 2,862 Å, 06...03 (x, y, 1-z). Можно видеть на фиг.2, что молекулы воды придают устойчивость кристаллической решетке и, таким образом, заставляют молекулы в кристаллическом состоянии выстраиваться устойчивым образом. На фиг.3 показано изображение упаковки элементарной ячейки, соответствующее ранее опубликованным данным. Сравнение фигур 2 и 3 показывает, что кристаллическая структура амифостина идентична структуре, описанной в литературе, т.е. обе эти структуры являются идентичным кристаллом C5H15N2O3PS 3H2O.
Продукты по данному изобретению сохраняются при комнатной температуре и остаются активными в течение 1, 3, 5, 12, 18 и 24 месяцев соответственно. Каждый пункт в запланированном исследовании дал удовлетворительный результат. Таким образом, срок действия продуктов составляет по меньшей мере два года.
Все материалы и вспомогательные средства (адъюванты) для осуществления данного изобретения можно приобрести. При необходимости самостоятельно получить исходный амифостин в качестве ссылок могут быть использованы некоторые хорошо известные документы. Эти документы включены в данное описание в качестве ссылок. Предпочтительный способ получения исходного амифостина описан в статье Zengslou Tong, et al. (ACTA Pharmaceutica Sinica, 1981, 16(4), 302).
Краткое описание чертежей:
Фигура 1. Проекция пространственной структуры.
Фигура 2. Схема упаковки элементарной ячейки.
Фигура 3. Схема упаковки элементарной ячейки, соответствующая литературным данным.
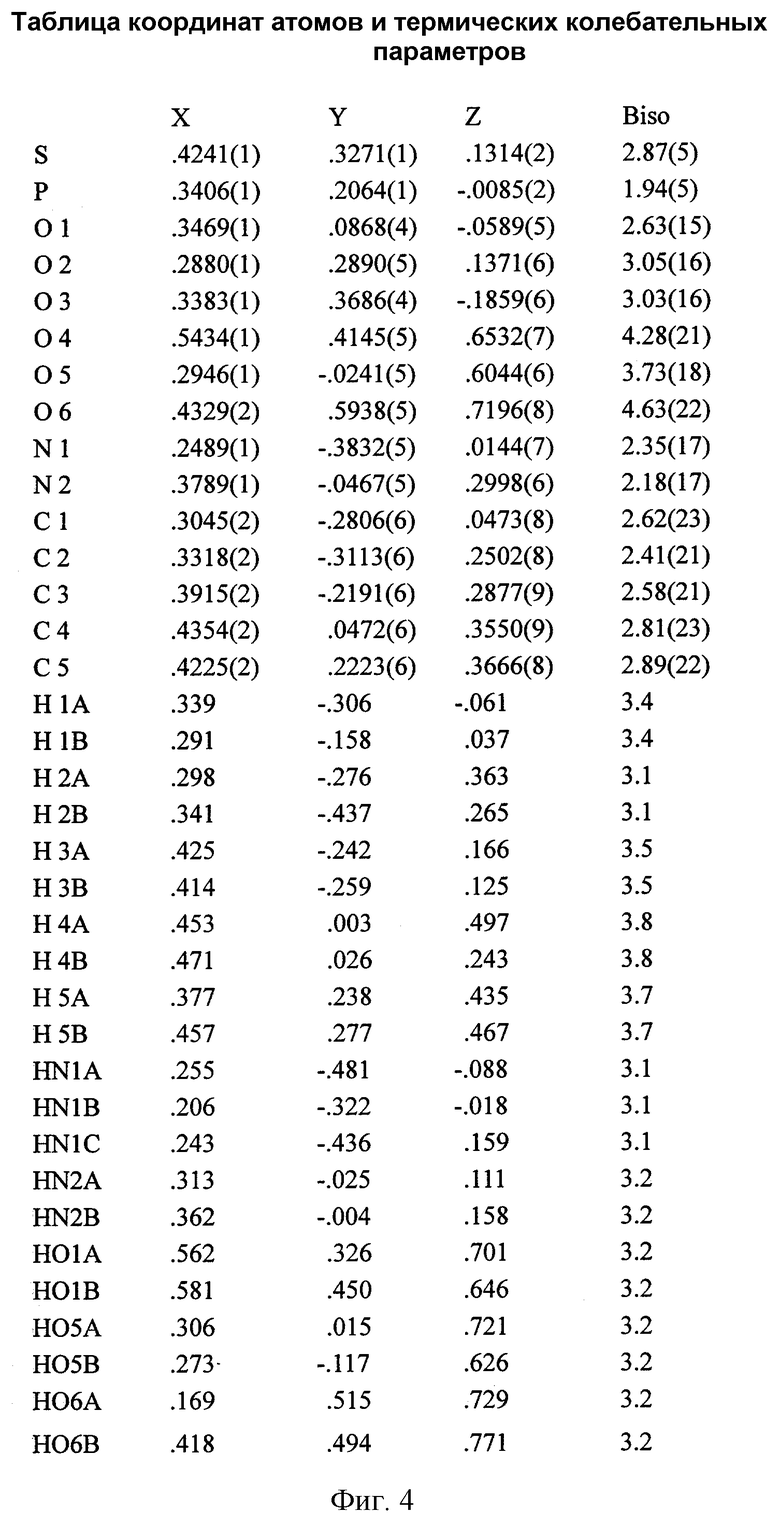
Фигура 4. Таблица координат атомов и термических колебательных параметров.
Фигура 5. Таблица значений длин связей и валентных углов.
Данное изобретение дополнительно иллюстрируется несколькими вариантами его осуществления. Но эти варианты осуществления изобретения используются только для иллюстрации и никоим образом не ограничивают объем данного изобретения.
Если специально не указано, все части или измерения выражены в единицах массы в расчете на общую массу.
Пример 1
Эффективность продуктов по данному изобретению сравнивали с эффективностью амифостина отечественного производства и эффективностью импортного амифостина для инъекций (лиофилизированный порошок для инъекций). Полученные результаты доказывают, что продукты по данному изобретению имеют эффективность, в целом эквивалентную эффективности продукта, импортируемого в настоящее время, как показано в таблице 1.
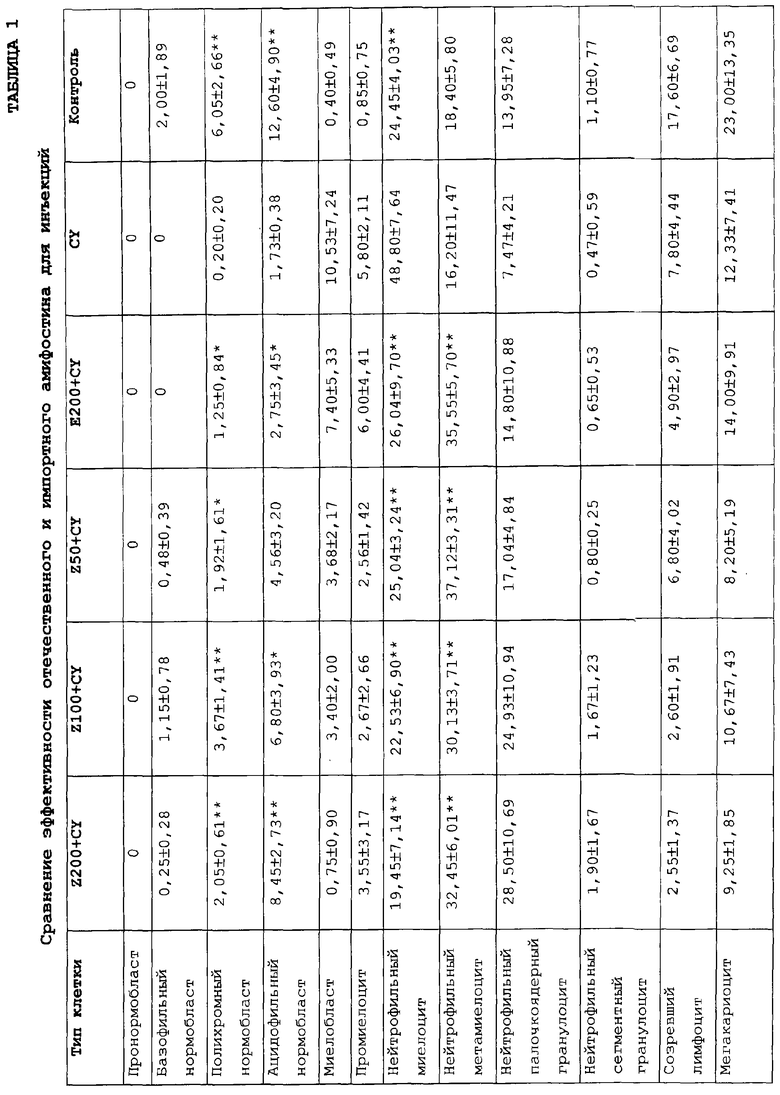
Примечания: (1) Z обозначает амифостин для инъекций; CY обозначает химиотерапевтический препарат циклофосфамид; Е обозначает импортный амифостин для инъекций (Ethyol); и по сравнению с группой CY *P<0,05; **P<0,01.
(2) Группа Z200+CY представляет действие 200 мг/кг амифостина, производимого Zhenzhong, Nanjing.
(3) Группа Z100+CY представляет действие 100 мг/кг амифостина, производимого Zhenzhong, Nanjing.
(4) Группа Z50+CY представляет действие 50 мг/кг амифостина, производимого Zhenzhong, Nanjing.
(5) Группа E200+CY представляет действие 200 мг/кг импортного амифостина.
(6) Группа CY демонстрирует эффект без использования аминофостина.
(7) Контрольная группа показывает нормальные величины.
Пример 2
Продукты по данному изобретению (которые далее будут упоминаться как "нелиофилизированный порошок амифостина для инъекций от Zhenzhong, Nanjing" сравнивают с обычным лиофилизированным порошком и амифостином, полученным по формуле изобретения патента США для проверки их устойчивости. Полученные результаты показывают, что продукты по данному изобретению по устойчивости превосходят другие препараты амифостина.
В таблице 2 представлены результаты испытаний на устойчивость продуктов по данному изобретению в течение 0-90 дней, при температуре 40°С и относительной влажности 75%.
Пример 3
В таблице 3 представлены результаты тестов на долговременную устойчивость продуктов амифостина при комнатной температуре.
Пример 4: Предпочтительный способ испытаний на устойчивость амифостина, высушенного в вакууме
(1) Метод определения анализируемого вещества - амифостина: Тонкослойная хроматография (ТСХ)
 Условия ТСХ:
Условия ТСХ:
Неподвижная фаза: силикагель H или силикагель GF254 (Qingdao Ocean Chemical Plant).
Проявляющее вещество (элюент): смесь хлороформ-метанол-концентрированная хлорная вода (1:2:2) (все вещества представляют собой аналитически чистые продукты, то же самое относится и к веществам, описанным ниже).
Окрашивающий проявляющий агент: пары иода.
Объем пробы: 5 мкл
 Получение образца для испытаний и контрольного образца
Получение образца для испытаний и контрольного образца
Берут навеску амифостина и растворяют в смеси воды и метанола (7:3) для получения раствора, содержащего 10 мг/мл амифостина, для использования в качестве испытуемого образца. И соответствующее количество раствора было точно измерено и разбавлено смесью воды и метанола (7:3) для получения раствора, содержащего 0,15 мг/мл амифостина для использования в качестве контрольного образца.
 Методика работы
Методика работы
На одну и ту же пластинку для тонкослойной хроматографии наносят пробы испытываемого образца и контрольного образца. После перемещения пробы элюентом на пластине в хроматографическом сосуде пластину сушат на воздухе. И проявление в цвете производят в емкости с насыщенными парами иода. Если в пятне испытуемого образца есть пятно примеси, оттенок пятна примеси сравнивают с оттенком пятна контрольного образца.
 Результат
Результат
Если оттенок пятна примеси в пятне испытуемого образца светлее, чем цвет пятна контрольного образца, тогда можно определить, что содержание примеси в испытуемом образце менее 1,5%. А если пятно примеси в пятне испытуемого образца темнее, чем цвет пятна контрольного образца, тогда можно определить, что содержание примеси в испытуемом образце выше 1,5%.
 Результаты испытаний
Результаты испытаний
Пять партий амифостина, полученного в соответствии с примером 1, анализируют на содержание амифостина и полученные результаты сравнивают с данными по чистоте, полученными ВЭЖХ.
Вышеописанные результаты показывают, что предельное содержание примеси в образцах всех пяти партий, определенное в соответствии с этим примером методом ТСХ, вполне согласуется с результатами, полученными с помощью ВЭЖХ. Таким образом, подтверждается достоверность определения предельного содержания примесей этим методом.
(2) Способ определения содержания амифостина с помощью ВЭЖХ
 Условия хроматографии:
Условия хроматографии:
Хроматографическая колонна: kronacil C-18 5 мкм 4,6×250 мм (Tena Science Instrument Ltd., Tianjing).
Подвижная фаза: 0,1% водный раствор октилсульфоната натрия - метанол (50:50) (фосфорной кислотой доводят рН до 3)
Длина волны детектирования: 210 нм
Скорость потока: 1,0 мл/мин
Объем пробы: 20 мкл
Температура: комнатная температура
Относительное стандартное отклонение (RSD) при пятикратном отборе проб <2,0%
Теоретическое число тарелок: >1000
Коэффициент "размывания" пика: <2
 Получение исследуемого образца и контрольного образца
Получение исследуемого образца и контрольного образца
Получение контрольного образца: точную навеску вещества-стандарта (около 50,0 мг) помещают в мерную колбу на 25 мл; в колбу добавляют 12,5 мл воды для растворения навески и медленно по каплям прибавляют метанол до метки для разбавления.
Получение исследуемого образца: точную навеску образца амифостина (около 50 мг) помещают в мерную колбу на 25 мл; в колбу добавляют 12,5 мл воды для растворения навески и медленно по каплям прибавляют метанол до метки для разбавления.
 Методика
Методика
Вводят по 20 мкл исследуемого образца и контрольного образца соответственно. Регистрируют площади пиков основных компонентов контрольного образца и исследуемого образца и рассчитывают содержание этих компонентов по методу внешнего стандарта.
 Расчеты: определение полученного амифостина
Расчеты: определение полученного амифостина
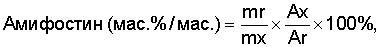
где mr - масса безводного вещества-стандарта,
Ar - площадь пика контрольного образца,
mx - масса безводного исследуемого образца,
Ax - площадь пика исследуемого образца.
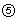 Определение амифостина для инъекций
Определение амифостина для инъекций
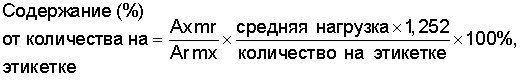
где Ax - площадь пика исследуемого образца,
mx - масса исследуемого образца,
Ar - площадь пика контрольного образца,
mx - масса исследуемого образца (считая на безводное вещество),
1,252 - коэффициент превращения С5H15N2O3PS, превращенного в С5H15N2O3PS 3H2O.
Пример 5
Исходный амифостин получают по методу, описанному Zengshou Tong, et al. (Acta Pharmaceutica Sinica, 1981, 16(4), 302). В стерильных условиях 50 г исходного амифостина растворяют в 250 мл воды при перемешивании при комнатной температуре 18-22°С. Несколько капель насыщенного раствора бикарбоната натрия добавляют по каплям для полного растворения. Определяют значение рН (между 7,0 и 7,2) и медленно прибавляют 125 мл 98% этанола. После смешивания раствор хранят в холодильнике (-16°С-(-23°С)) в течение 6-8 ч для получения осадка белого кристаллического порошка. Длина гранулы кристалла составляет 300-700 мкм. После фильтрования при пониженном давлении проводят сушку в вакууме и определяют содержание воды. Затем продукт просеивают через сито (30 меш) и расфасовывают во флаконы.
Пример 6
В стерильных условиях 100 г исходного амифостина, полученного, как в примере 1, растворяют в 500 мл воды при комнатной температуре 18-22°С. Добавляют несколько капель насыщенного раствора бикарбоната натрия. Доводят значение рН до 6,8-7,0 и прибавляют 250 мл безводного этанола. После смешивания раствор хранят в холодильнике (-16°С-(-23°С)) в течение 6-8 ч для получения осадка белого кристаллического порошка. Длина гранулы кристалла составляла 300-700 мкм. После фильтрования при пониженном давлении проводят сушку в вакуум-эксикаторе с пятиокисью фосфора и определяют содержание воды. Затем продукт просеивают через сито (30 меш) и расфасовывают во флаконы.
Пример 7
В стерильных условиях 50 г исходного амифостина, содержащего одну молекулу кристаллизационной воды, полученного, как в примере 1, растворяют в 250 мл воды при комнатной температуре 18-22°С. Прибавляют по каплям 1 М раствор карбоната натрия и перемешивают до полного растворения. Доводят величину рН до 7,1-7,3 и медленно прибавляют 125 мл этанола. Раствор осторожно перемешивают и потом хранят в холодильнике (-16°С-(-23°С)) в течение 6-8 ч для получения осадка белого кристаллического порошка. Длина гранулы кристалла составляет 300-700 мкм. После фильтрования при пониженном давлении проводят сушку в вакууме и определяют содержание воды. Затем продукт просеивают через сито (30 меш) и расфасовывают во флаконы.
Пример 8
В стерильных условиях 100 г исходного амифостина, содержащего две молекулы кристаллизационной воды, растворяют в 500 мл воды при комнатной температуре, указанной выше. Прибавляют по каплям 0,5 М раствор гидроксида натрия. Доводят величину рН до 6,7-6,9 и медленно прибавляют 250 мл этанола. Раствор осторожно перемешивают и потом хранят в холодильнике (при температуре, указанной выше) в течение 6-8 ч для получения осадка белого кристаллического порошка. Длина гранулы кристалла составляет 300-700 мкм. После фильтрования при пониженном давлении проводят сушку в вакууме и определяют содержание воды. Затем продукт просеивают через сито (30 меш) и расфасовывают во флаконы.
Пример 9
Исходный амифостин получают по методу, описанному Zengshou Tong, et al. (Acta Pharmaceutica Sinica, 1981, 16(4), 302). В стерильных условиях 80 г полученного исходного амифостина растворяют в 180 мл воды для инъекций при перемешивании при комнатной температуре 18-22°С. Добавляют несколько капель насыщенного раствора гидроксида калия для полного растворения. Определяют значение рН (между 6,6 и 6,7) и медленно прибавляют 80 мл 98% этанола. После смешивания раствор хранят в холодильнике (-16°С-(-23°С) в течение 5-6 ч для получения осадка белого кристаллического порошка. Длина кристаллической гранулы составляет 300-700 мкм. После фильтрования при пониженном давлении проводят сушку в вакууме и определяют содержание воды. Затем продукт просеивают через сито (30 меш) и расфасовывают во флаконы.
Пример 10
Исходный амифостин получают по методу, описанному Zengshou Tong, et al. (Acta Pharmaceutica Sinica, 1981, 16(4), 302). В стерильных условиях 100 г полученного исходного амифостина растворяют в 500 мл дистиллированной воды для инъекций при перемешивании при комнатной температуре 18-22°С. Прибавляют по каплям смесь насыщенных растворов гидроксида натрия и бикарбоната натрия для полного растворения. Определяют значение рН (между 6,8 и 6,9) и медленно прибавляют 200 мл 98% этанола. После смешивания раствор хранят в холодильнике (-16°С-(-23°С)) в течение 7-8 ч для получения осадка белого кристаллического порошка. Длина гранулы кристалла составляет 300-700 мкм. После фильтрования при пониженном давлении проводят сушку в вакууме и определяют содержание воды. Затем продукт просеивают через сито (20 меш) и расфасовывают во флаконы.
Пример 11
В стерильных условиях 120 г исходного амифостина растворяют в 1000 мл дистиллированной воды для инъекций при перемешивании при комнатной температуре 18-22°С. Прибавляют по каплям насыщенный раствор бикарбоната натрия для полного растворения. Определяют значение рН (между 6,9 и 7,0) и медленно прибавляют 360 мл 75% этанола. После смешивания раствор хранят в холодильнике (-16°С-(-23°С)) в течение 8-9 ч для получения осадка белого кристаллического порошка. Длина гранулы кристалла составляет 300-700 мкм. После фильтрования при пониженном давлении проводят сушку в вакууме и определяют содержание воды. Затем продукт просеивают через сито (20 меш) и расфасовывают во флаконы.
Пример 12
В стерильных условиях 60 г исходного амифостина растворяют в 600 мл дистиллированной воды для инъекций при перемешивании при комнатной температуре 18-22°С. Прибавляют по каплям насыщенный раствор карбоната натрия для полного растворения. Определяют значение рН (между 7,1 и 7,2) и медленно прибавляют 180 мл 95% этанола. После смешивания раствор хранят в холодильнике (-16°С-(-23°С)) в течение 9-10 ч для получения осадка белого кристаллического порошка. Длина гранулы кристалла составляет 300-700 мкм. После фильтрования при пониженном давлении проводят сушку в вакууме и определяют содержание воды. Затем продукт просеивают через сито (20 меш) и расфасовывают во флаконы.
Пример 13
В стерильных условиях 50 г коммерческого амифостина растворяют в 150 мл дистиллированной воды для инъекций при перемешивании при комнатной температуре 18-22°С. Прибавляют по каплям насыщенный раствор карбоната натрия для полного растворения. Определяют значение рН (между 7,3 и 7,4) и медленно прибавляют 120 мл 75% этанола. После смешивания раствор хранят в холодильнике (-16°С-(-23°С) в течение 6-8 ч для получения осадка белого кристаллического порошка. Длина гранулы кристалла 300-700 мкм. После фильтрования при пониженном давлении проводят сушку в вакууме и определяют содержание воды. Затем продукт просеивают через сито (30 меш) и расфасовывают во флаконы.

Изобретение относится к области фармацевтики и касается порошка амифостина для инъекций и способа его получения. Изобретение заключается в том, что порошок состоит из кристаллов одного компонента амифостина. Длина гранулы кристалла 300-700 мкм с содержанием 1-3 молекулы кристаллической воды. В способе получения порошка амифостина для инъекций применяют процесс сушки в вакууме. Изобретение обеспечивает устойчивость полученного продукта, полученные кристаллы имеют умеренную длину и приемлемую подвижность без измельчения. 3 н. и 3 з.п. ф-лы, 4 табл., 5 ил.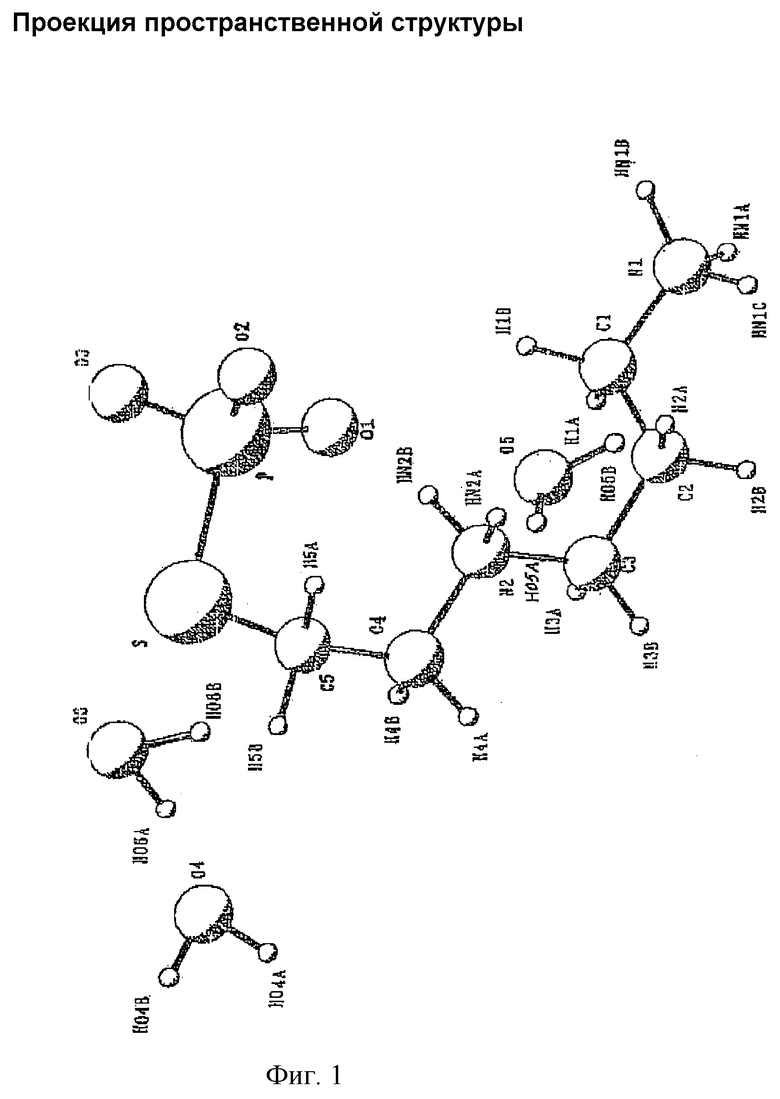
| CN 1092980 А, 05.10.1994 | |||
| КОМПОЗИЦИЯ КРИСТАЛЛИЧЕСКОГО АМИФОСТИНА, СПОСОБ ПОЛУЧЕНИЯ КРИСТАЛЛИЧЕСКОГО АМИФОСТИНА (ВАРИАНТЫ) | 1993 |
|
RU2125880C1 |
| US 5167947 А, 01.12.1992. | |||
Авторы
Даты
2005-11-27—Публикация
2001-02-28—Подача