Многочисленные клинические исследования показали, что экстракты из листьев и цветов и/или плодов Crataegus species могут быть с успехом применены для лечения пациентов с пониженной сердечной деятельностью. Накопленный в течение многих лет терапевтический опыт также демонстрирует терапевтическую эффективность таких экстрактов в случае нестабильных функционально-вегетативных стенокардий, также как и в случае средних по тяжести форм брадикардиальной аритмии. Эти открытия привели к тому, что Комиссия E министерства здравоохранения Германии опубликовала монографию (см. Официальную Федеральную Газету от 03.01.1984) со следующими показаниями к применению:
Пониженная сердечная функция, соответствующая стадиям I и II в соответствии с NYHA: ощущение давления и сужения в области сердца; сенильное (старческое) сердце, еще не требующее дигитализной терапии (терапии наперстянкой); и средние по тяжести формы брадикардиальной аритмии.
До настоящего времени известный терапевтический эффект, также как и фармакодинамический спектр действия этих экстрактов Crataegus в основном объясняли присутствием флавоноидов и олигомерных процианидинов в экстрактах Crataegus. Поэтому фармацевтические препараты были стандартизованы по этим компонентам. Один из известных экстрактов Crataegus (WS 1442) содержит ориентировочно от 18,5 до 19,5% олигомерных процианидинов.
Настоящее изобретение основано на неожиданных открытиях, полученных при испытаниях на животных с использованием крыс с экспериментально вызванной ишемией. В соответствии с этими открытиями полученный экстракцией со смесью воды и растворимого в воде органического растворителя, такого как этанол, экстракт из листьев с цветами соответствующих видов Crataegus, таких как Crataegus monogyna JAQUIN emend. LINDMAN, Crataegus laevigata (POIRET) DE CANDOLLE syn. Crataegus oxyacantha L.p.p. et duct., Crataegus azarolus L, Crataegus nigra WALDSTEIN и KITAIBEL и Crataegus pentagyna WALDSTEIN, KITAIBEL и WILLDENOW:
а) имеет кардиозащитное действие в случае ишемической болезни сердца и угрожающих жизни сердечно-сосудистых патологических изменений, вызванных реперфузией;
б) причем известные до настоящего времени активные вещества экстракта Crataegus не обнаруживали эти эффекты.
Эти эффекты экстракта Crataegus позволяют найти терапевтическое применение экстрактам Crataegus в предупреждении и лечении ишемии сердца с нарушениями сердечного кровообращения, вызванными реперфузией патологических изменений сердца и предупреждении внезапной смерти, вызванной остановкой сердца, также как и других угрожающих жизни вызванных реперфузией патологических условий.
Расширенные испытания с тремя новыми фракциями экстракта Crataegus показывают, что особенно активный компонент экстракта Crataegus имеет молекулярный вес более 3000 единиц Дальтона. Структура этого компонента пока еще неизвестна.
Тестируемые вещества.
Фракция (а). Полный экстракт из листьев с цветами Crataegus monogyna, laevigata, azarolus, nigra и pentagyna, полученный экстракцией с этанолом 45% (по весу) при 60oC, при содержании олигомерных процианидинов 18,5 - 19,5%;
Фракция (б). Фракция соединений с молекулярным весом более 3000 единиц Дальтона, полученная при помощи ультрафильтрации фракции (а) с использованием мембранного фильтра с порогом отрезания 3000 единиц Дальтона;
Фракция (в) получена при помощи распределения жидкость-жидкость (экстракция в противотоке) фракции (а) в бутаноле/воде;
Фракция (г) получена из фракции (а), из которой удалены флавоноиды и проантоцианидины при помощи абсорбции с использованием поглотителя, который связывает эти компоненты, в частности такого как гидроксипропиловый полидекстран, полиамиды, оксид алюминия и активированный древесный уголь.
Методика испытаний.
Использовался метод, описанный H. Seley [Сели и др., Ангиология 11 (1960), 398-407] , в применении к крысам-самцам Sprague-Dawley с весом тела от 250 до 350 г., анестезированным пентобарбиталом. Ишемия сердца провоцировалась перевязкой коронарной артерии и реперфузией, вызванной повторным открытием лигатуры после 7 минут ишемии. Кровяное давление и частота сердечных сокращений животных измерялись ранее и в ходе ишемии, также как и после реперфузии; также определялись длительность и тип аритмии сердца во время фазы реперфузии. При таких условиях проведения испытаний ориентировочно 50% контрольных животных умирало в течение периода реперфузии 15 минут. Причинами такой смертности были приступ гипотензии и желудочковые фибрилляции, вызванные реперфузией и происходящие немедленно после нее. Эта фармакологическая модель была применена для определения эффективности фармацевтических веществ, которые могут предотвратить внезапную смерть, вызванную остановкой сердца, или оказать благоприятное действие на поражения сердечнососудистой системы, вызванные реперфузией.
Результаты испытаний.
В этой модели был исследован полный экстракт Crataegus, то есть фракция (а), а также фракции (б), (в) и (г). В первой серии испытаний полный экстракт вводился перорально при помощи фарингоскопа при дозировке 100 мг/кг/день в течение периода 6 дней. На 7-й день животные получали пероральную дозу 50 мг/кг и подвергались исследованиям часом позже.
Результаты испытаний для животных, получивших лечение полным экстрактом, и для контрольной группы животных, которые получали только растворитель, сведены в табл. 1 и проиллюстрированы на чертеже.
На чертеже показано среднее кровяное давление (в мм рт. столба со стандартной погрешностью) выживших животных контрольной группы (n=8) и группы, получившей экстракт Crataegus (n =16). Эти результаты испытаний показывают, что введение полного экстракта Crataegus защищает животных от аритмии, вызванной кратковременной ишемией и реперфузией, а также от угрожающего жизни приступа гипотензии и возможной смерти.
В дальнейшей серии испытаний была исследована фракция (а) при различных дозах и в соответствии с различными планами лечения. Результаты испытаний сведены в табл. 2.
Результаты испытаний показывают, что максимальный эффект применения фракции (а) против ишемической болезни сердца и вызванных реперфузией поражений может быть получен только после продолжительного приема фракции (а), и что простой кратковременный, однако надежный защитный эффект можно ожидать после приема 2х100 мг/кг фракции (а) (1 днем ранее + за 1 час до ишемии).
При проведении дополнительных испытаний, в которых фракция (а) вводилась внутривенно различными дозами за 15 минут до начала тестирования, не были получены определенные (благоприятные) эффекты фракции (а).
Затем производилось испытание аналогичным образом других фракций с использованием адекватных доз с учетом соответствующих выходов, связанных с полным экстрактом.
Сравнение воздействий фракций табл. 3 ясно показывает, что лучшее воздействие оказывают такие фракции экстракта, которые содержат вещества с более высоким молекулярным весом, причем наличие флавоноидов или олигомерных процианидинов, которые до настоящего времени считались эффективными компонентами экстрактов Crataegus, не является обязательным.
Преимущественные фармацевтические составы в соответствии с настоящим изобретением, предназначенные для профилактики и терапии вызванных реперфузией сердечно-сосудистых поражений, для предотвращения внезапной смерти в результате остановки сердца, так же как и других угрожающих жизни вызванных реперфузией патологических условий, должны содержать достаточное количество не флавоноидных полимерных соединений фракций Crataegus с высоким содержанием этих активных веществ.
В соответствии с настоящим изобретением составы должны изготавливаться следующим образом:
а) экстракция превращенного в порошок растительного материала смесями воды, ацетона, алканолов C1-C4 или смесями воды и указанных растворимых в воде органических растворителей, преимущественно этанола 45% (по весу) (фракция (а));
б) отделение низкомолекулярных соединений от фракции (а) ультрафильтрацией через соответствующий мембранный фильтр с порогом отсечки 3000 Д (фракция (б));
в) получение распределения жидкость-жидкость фракции (а) в бутаноле/воде (фракция (в);
г) гелевая фильтрация фракции (а) с полидекстранами или другими гелями, подходящими для разделения с использованием эффекта молекулярного сита, для отделения флавоноидов и проантоцианодинов и других низкомолекулярных соединений (фракция (г)).
Для профилактики и терапии вызванных реперфузией сердечно- сосудистых поражений и для предотвращения внезапной смерти в результате остановки сердца, фракции (а), (б), (в) и (г), а преимущественно фракция (а), могут быть использованы во всех фармацевтических формах для введения перорально, а именно, в таких формах, как таблетки с покрытием, таблетки, капсулы, растворы. Для приготовления таких фармацевтических препаратов фракции должны быть составлены обычным образом с использованием носителей, таких как лактоза, крахмал, микрокристаллическая целлюлоза, стеарат магния, тальк или вода, спирты, полиэтиленгликоли, глицериновый эфир. В виде добавок могут использоваться консерванты, смазки, смачивающие вещества, эмульгаторы, красители, корректоры запаха и ароматизаторы.
Дневные принимаемые (вводимые) дозы составляют от 50 до 500 мг полного экстракта Crataegus (фракция (а); в случае приема фармацевтических препаратов с обогащенными активным веществом фракциями (б), (в) и (г) доза может быть соответственно уменьшена.
Примеры показывают преимущественное осуществление методик и приготовления фракций.
Пример 1
100 кг сухих листьев и цветов разновидностей Crataegus (коммерческая смесь около 77% Crataegus monogyna, около 2% С. laevigata, около 4% С. azarolus, около 16% С. nigra и около 1% С. pentagyna) дробились в мельнице и подвергались вихревой экстракции на генераторе DispaxR с 1000 кг 45 весовых процентов водного раствора этанола в течение 1 часа при 60oC. Экстракт отделялся непрерывным центрифугированием. Растительный материал подвергался аналогичному экстрагированию еще раз с 1000 кг 45 весовых процентов раствора этанола в воде в течение 1 часа при 60oC. Растворы комбинированных (объединенных) экстрактов концентрировались при давлении около 400 мбар при 80oC; концентрированный экстракт сушился в вакуумной стеллажной сушилке при 60oC, под давлением 5-10 мбар.
Выход полного экстракта (фракция (а):
20% в пересчете на сухие листья и цветы Crataegus. Экстракт содержит ориентировочно 18,75 % олигомерных процианидинов.
Пример 2
200 г сухих листьев с цветами разновидностей Crataegus (смесь ориентировочно 63% Crataegus monogyna, ориентировочно 3% С. laevigata, ориентировочно 9% С. azarolus, ориентировочно 25% С. nigra/pentagyna) дробились в мельнице и подвергались экстрагированию с 2 литрами 40 весовых процентов ацетона в течение 1 часа при перемешивании, с использованием системы с обратным холодильником. После отделения раствора экстракта остаток подвергался дополнительному экстрагированию 2 литрами 40 весовых процентов водного раствора ацетона в течение 30 минут при перемешивании и с использованием системы с обратным холодильником. Растворы объединенных экстрактов концентрировались до сухости при температуре ванны 60oC под давлением 520-20 мбар.
Выход: 65,6 г. сухой фракции экстракта (а), что соответствует 32,8% в пересчете на сухие листья с цветами Crataegus.
Пример 3
20 г экстракта из листьев с цветами разновидностей Crataegus, приготовленного с помощью 40 весовых процентов ацетона в воде в соответствии с примером 2, добавлялись к 400 мл воды при 70oC при перемешивании. После добавки 10 г активированного угля смесь перемешивалась в течение 1 часа. Активированный уголь и нерастворенные компоненты экстракта фильтровались через фильтрующий слой. Фильтрат концентрировался до сухости при температуре ванны 60oC под давлением 80-20 мбар.
Выход: 8,8 г. вещества (а), что соответствует 44 % в пересчете на экстракт Crataegus.
Пример 4
85 кг сухих листьев и цветов разновидностей Crataegus (смесь ориентировочно 76% Crataegus monogyna, ориентировочно 5% С. laevigata, ориентировочно 19% С. nigra) дробились в мельнице и нагревалась до 60oC с 600 кг метанола в экстракторе с циркуляцией: после этого производилось отделение раствора экстракта. После этого раствор экстракта концентрировался при температуре 60oC и под давлением 200- 260 мбар и сушился в вакуумной стеллажной сушилке при 60oC, под давлением 20 мбар.
Выход: 12,75 кг. сухой фракции (а) экстракта, что соответствует 15 % в пересчете на сухие листья с цветами Crataegus.
Пример 5
200 г сухих листьев с цветами разновидностей Crataegus (смесь ориентировочно 63% Crataegus monogyna, ориентировочно 3% С. laevigata, ориентировочно 9% С. azarolus, ориентировочно 25% С. nigra/pentagyna) дробились в мельнице и смешивались с 2 литрами кипящей деминерализованной (умягченной) воды, а затем экстрагировались в течение 15 минут в дозирующем устройстве с ножами.
Раствор экстракта фильтровался через фильтрующий слой на основе целлюлозы. Растительный остаток подвергался еще раз вихревому экстрагированию с 2 литрами кипящей деминерализованной воды в течение 15 минут. Раствор экстракта от второго экстрагирования также фильтровался через фильтрующий слой на основе целлюлозы.
Растворы экстракта комбинировались (объединялись) и концентрировались до сухости в роторном испарителе при температуре ванны 60oC и под давлением 50 мбар.
Выход: 52 г фракции экстракта (а), что соответствует 26% в пересчете на сухие листья с цветами Crataegus.
Пример 6.
20 г экстракта из сухих листьев с цветами Crataegus в соответствии с примером 1, добавлялись к 50 мл 45 объемных процентов этанола при перемешивании и загружались в колонну, содержащую 200 г сшитого поливинилпирролидона, образующего суспензию в 45 объемных процентах этанола. Устанавливалась скорость потока (расход) 40 мл в течение 8 минут. При помощи фракционного коллектора производился сбор фракций 40 мл. Первые фракции, содержащие активное вещество, сливались и концентрировались до сухости в роторном испарителе при температуре ванны 60oC и под давлением 120-50 мбар.
Выход: 8,9 г концентрата активного компонента (свободного от флавоноидных соединений и процианидинов), что соответствует 44,5% в пересчете на экстракт.
Пример 7.
6,65 г экстракта из листьев с цветами Crataegus, полученного с помощью 40 весовых процентов ацетона в воде в соответствии с примером 2, были диспергированы в 20 мл деминерализованной воды при нагревании до 50oC и при обработке ультразвуком. Полученный таким образом раствор пропускался через слой геля, образованный гидрофильным сшитым декстраном (средство Sephadex G-25®) в воде ( высота 57 см, диаметр 2,8 см). Первые 240 мл элюата колонны, содержащие (активное) вещество, комбинировались и концентрировались до сухости в роторном испарителе при температуре ванны 60oC и под давлением 50 мбар.
Выход: 0,13 осадка (свободного от флавоноидных соединений и процианидинов), что соответствует 1,95% в пересчете на экстракт.
Пример 8.
80 г полного экстракта, приготовленного в соответствии с примером 1, смешивались в течение 15 минут при 40oC с 1, 2 литрами 50 объемных процентов этанола. Нерастворенные компоненты экстракта центрифугировались, надосадочная жидкость фильтровалась через фильтр из спеченного стекла D3. Раствор подвергался ультрафильтрации под давлением 2, 5 бар при пропускании через спирально-намотанный регенерированный, на основе целлюлозы, ультрафильтрационный картридж (Amicon®, картридж для ультрафильтрации типа S1Y3 со спиральной намоткой), имеющий границу отрезания 3000 Д.
Оставшийся раствор концентрировался до 400 мл и затем четырехкратно промывался 700 мл 50 объемных процентов этанола. Полученные указанным образом 200 мл оставшейся жидкости удалялись и картридж (патрон) фильтра промывался 1 литром 70 объемных процентов этанола. Сохраненный раствор и промывочная жидкость концентрировались до ориентировочно 200 мл в роторном испарителе при 60oC под давлением 40 мбар, за счет чего этанол перегонялся. Концентрат подвергался глубокому замораживанию в ванне этанол/сухой лед при температуре - 40oC и был лиофилизован под давлением 0,22 мбар.
Выход: 15,35 г фракции (б), что соответствует 19, 19% в пересчете на полный экстракт.
Пример 9.
а) 100 г полного экстракта, приготовленного в соответствии с примером 1, растворялись в 1 литре деминерализованной воды при нагреве до 50oC. После охлаждения до комнатной температуры водный раствор подвергался пятикратному экстрагированию с 400 мл насыщенного водой n- бутанола в каждом случае. Водная фаза сохранялась и затем обрабатывалась в соответствии с п. б).
Фазы бутанола объединялись. После этого полученный раствор бутанола однократно промывался 500 мл деминерализованной воды. Водный раствор хранился и дополнительно обрабатывался по п. б).
Раствор бутанола концентрировался в вакууме при 60oC/30 мбар, за счет чего n-бутанол перегонялся при добавке воды. Остаток высушивался в вакууме 60oC/ 17 мбар. Окончательный вес фракции n -бутанола составляет 29,5 г.
б) Водная фаза, полученная при операции а), так же как и водный раствор, полученный повторной промывкой раствора бутанола, концентрируется под вакуумом при 60oC/55 мбар восстанавливается испарением при 17 мбар. За счет окончательной сушки при 60oC/20 мбар в вакуумной стеллажной сушилке получаем 71,4 г фракции (в) в виде осадка из водной фазы, что соответствует 71,4% в пересчете на полный экстракт.
При помощи тонкого слоя хроматографически в системе растворителя, описанной в примере 10, возможно обнаружить хлорофилл, флавоноидные компоненты и часть олигомерных процианидинов во фракции n-бутанола.
Водная фракция (фракция (в)) содержит процианидины и еще неизвестное активное вещество.
Пример 10.
50 г полного экстракта из листьев с цветами перемешивались в 200 мл деминерализованной воды при 50oC. После этого содержащая нерастворенные компоненты суспензия пропускалась через слой геля, образованный 1 кг Sephadex-LH 20® (гидроксипропиловым сшитым полидекстраном), образующим суспензию в воде, в стеклянной колонне диаметром 7,4 см с высотой наполнения 100 см. Колонна промывалась 5 литрами деминерализованной воды. Элюаты исследовались хроматографически на отсутствие типичных флавоновых гликозидов типа Apigenin (Vitexin -2"-O-rhamnoside и пр.) и флавоновых гликозидов Quercetin (Hyperoside = Quercetin-3-Q-галактоза, Rutin = Quercetin -3-rutinoside и пр.) при помощи тонкого слоя на силикагелевых пластинах в растворителе этилацетат/муравьиная кислота/уксусная кислота/вода 100+11+11+27 объемных частей.
Фракции после 1 литра преэлюата и до 5 литров элюата объединялись и концентрировались до сухости в роторном испарителе при 60oC/20 мбар.
Выход: 25,36 г фракции (г), что соответствует 50,72 % в пересчете на полный экстракт.
Пример 11.
Таблетки с 50 мл полного экстракта Crataegus, фракция (а),г:
Фракция (а) - 50
Коллоидальная кремниевая кислота (Aerosil®) - 50
Лактоза - 100
Микрокристаллическая целлюлоза - 25
Зерновой крахмал - 24
Стеарат магния - 1
Первые пять ингредиентов перемешивались, гранулировались и прессовались после добавки стеарата магния в таблетировочной пресс-машине для получения таблеток 250 мг.
Пример 12.
Капсулы с 50 мг экстракта из Crataegus, фракция (б),г:
Фракция (б) - 30
Лактоза - 120
Коллоидальная кремниевая кислота - 50
Ингредиенты равномерно перемешивались и обрабатывались обычным образом для получения капсул с весом наполнения 200 мг.
Пример 13. Таблетки с покрытием, мг:
Фракция (г) - 40,00
Микрокристаллическая целлюлоза - 100,00
Лактоза - 60,00
Коллоидальная кремниевая кислота - 50,00
Тальк (в сердцевине таблетки) - 4,50
Стеарат магния - 0,50
Гидроксипропилметилцеллюлоза - 12,00
Тальк (для оболочки таблетки) - 0,50
Суммарный вес таблетки с покрытием около 267,50 мг.
Пример 14. Раствор, г:
Фракция (в) - 40
Ароматизирующая эссенция - 40
Сахаринат натрия - 5
Этанол - 460
Очищенная вода - 475а
Изобретение относится к медицине, а именно к препаратам из Crataegus и фармацевтической композиции на их основе сердечно-сосудистого действия. Препарат получен экстракцией листьев с цветами Crataegus с 45 вес. % этанола при 60oС и последующей ультрафильтрацией экстракта через мембранный фильтр с порогом отрезания 3000 Д. Препарат получен также экстракцией с последующим отделением низкомолекулярных компонентов распределением жидкость-жидкость в бутаноле -воде. Препарат получен также экстракцией с последующей гелевой фильтрацией. Препарат получен также экстракцией с последующей абсорбцией флавоноидов и процианидинов на поглотителе. Фармацевтический состав содержит один из препаратов. Препараты и состав являются более эффективными против сердечно-сосудистых заболеваний. 5 с. и 1 з.п.ф-лы, 3 табл., 1 ил.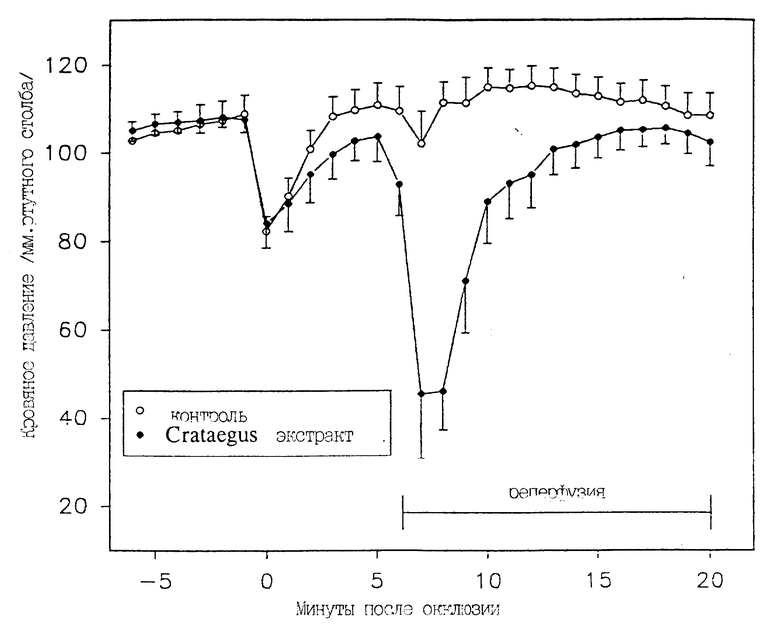
| Рафинировочная смесь | 1982 |
|
SU1062294A1 |
| СПОСОБ ПОЛУЧЕНИЯ СРЕДСТВА, ОБЛАДАЮЩЕГО АНТИАРИТМИЧЕСКИМ ДЕЙСТВИЕМ | 1992 |
|
RU2039568C1 |
| Машковский М.Д | |||
| Лекарственные средства | |||
| - М.: Медицина, ч | |||
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| Счетная бухгалтерская линейка | 1922 |
|
SU386A1 |
Авторы
Даты
1999-02-20—Публикация
1994-07-28—Подача