Область техники
Абсцизовая кислота является одним из гормонов растений, таких как ауксин, гиббереллин, цитокинин, этилен и др. Поскольку абсцизовая кислота была найдена в 1963 году, стали известными ее физиологические действия, включающие образование отделительного слоя, индукцию покоя, подавление прорастания (образования почек), подавление цветения, подавление выхода в стрелку (развития цветоножки), подавление транспирации, активацию старения, и сопротивление стрессу (например, усиление холодостойкости). Хотя полагают, что абсцизовая кислота обычно проявляет подавляющее рост действие, как описывалось выше, недавно было обнаружено, что, аналогично другим растительным гормонам, абсцизовая кислота обнаруживает, как промотирующий или активирующий, так и подавляющий эффект в зависимости от ее концентрации и, например, при низкой концентрации она активирует рост растений, повышая урожай, (Nacabori et al., Bulletin of the Aomori Agricultural Experiment Station in 1991 (1992)). Далее известно применение для промотирования утолщения (уплотнения) и созревания плодов (японские патентные LOP публикации NN 264005/1992, 264006/1992 и 264007/1992), предотвращения цветков или незрелых плодов от опадания (японская патентная LOP публикация N 139911/1993), активация роста сельскохозяйственной продукции (японская патентная LOP публикация N 178705/1993) или активации цветения (японская патентная публикация N 186303/1993).
Однако абсцизовая кислота является дорогой, и среди оптических изомеров абсцизовой кислоты один природный тип демонстрирует более высокие эффекты, и, таким образом, абсцизовая кислота практически не используется. Недавно был разработан способ получения абсцизовой кислоты природного типа с помощью культивирования микроорганизма рода Botrytis, но едва ли можно говорить, что данный метод является удовлетворительным (японские патентные LOP NN 296696/1988, 296697/1988 и 60590/1990). Было сделано несколько сообщений о ее органическом синтезе, но все еще остаются проблемы, связанные с большим числом стадий, стоимостью, стереоселективностью (Helv. Chim. Acta, 71, 931 (1988); J. Org. Chem., 54, 681 (1989); и (японская патентная LOP публикация N 184966/1991).
Из тех соединений, которые относятся к регуляторам роста растений согласно настоящему изобретению, свободная карбоновая кислота и метиловосложноэфирное производное описываются в указанных выше литературных источниках как промежуточные продукты для химического синтеза, но в них ничего не говорится о том, что такие промежуточные продукты оказывают физиологические действия, подобные абсцизовой кислоте.
С одной стороны, брассиностероиды представляют группу вездесущих соединений, присутствующих в растениях, и оказывают специфическое физиологическое действие на рост, такое как промотирование или активация роста, промотирование оплодотворения и плодоношения, усиление холодостойкости, промотирование уплотнения или утолщения плодов и др., и промотирование прорастания или укоренения семян или черенков.
Однако, не было известно, что смесь абсцизовой кислоты или вещества, подобного абсцизовой кислоте и брассиностероида оказывает синергистическое действие на регулирование роста растений.
Раскрытие изобретения
Объектом настоящего изобретения является предоставление нового и высокоактивного вещества, проявляющего физиологические действия, подобные абсцизовой кислоте, и высокоактивного регулятора роста растений.
В результате своих неустанных исследований настоящие изобретатели нашли, что специфические эпоксициклогексановые производные проявляют превосходные физиологические действия, подобные абсцизовой кислоте, и что смесь указанных соединений и брассиностероида действует синергистически на растения, оказывая сильное регуляторное действие на их рост, завершив тем самым настоящее изобретение.
Иными словами, первое изобретение согласно настоящей заявке относится к регулятору роста растений, включающему в качестве активного ингредиента производное эпоксициклогексана, представленное общей формулой 1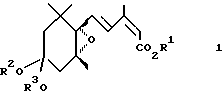
в которой R1 представляет атом водорода, C1-C6 алкильную группу или C3-C6 циклоалкильную группу, и R2 и R3 представляет независимо C1-C6 алкильные группы или объединены, образуя C2-C3 полиметиленовую группу, которая может быть замещена C1-C6 алкильной группой, и, в частности, к ускорителю роста растений, ускорителю роста всходов, ингибитору транспирации и увядания, усилителю холодостойкости, и ускорителю роста, утолщения или созревания плодов, корней или корнеплодов, стеблей или луковиц.
Второе изобретение согласно настоящей заявке относится к регулятору роста растений, включающему в качестве активных ингредиентов производное эпоксициклогексана, представленное общей формулой (1), и брассиностероид, и, в частности, к ускорителю роста всходов, усилителю холодостойкости и ускорителю роста, утолщения или созревания плодов, корней или корнеплодов, стеблей или луковиц.
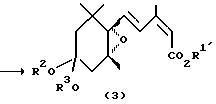
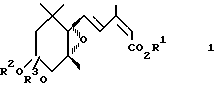
Третье изобретение согласно настоящей заявке относится к производному эпоксициклогексана, представленному общей формулой (3):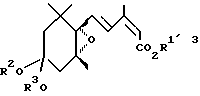
в которой R1′ представляет C2-C6 алкильную группу или C3-C6 циклоалкильную группу, и R2 и R3 представляют независимо C1-C6 алкильные группы или объединены, образуя C2-C3 полиметиленовую группу, которая может быть замещена C1-C6 алкильной группой.
В общей формуле (1) C1-C6 алкильная группа, представленная символом R1, включает метильную группу, этильную группу, пропильную группу, изопропильную группу, бутильную, изобутильную, вторбутильную, трет-бутильную, пентильную, изопентильную, гексильную, втор-гексильную группы и др. Среди них предпочтительными по физиологическому действию являются C2-C4 алкильные группы, особенно пропильная и изопропильная группы.
В общей формуле (3) C2-C6 алкильная группа, представленная символом R1, включает этильную группу, пропильную группу, изопропильную группу, бутильную, изобутильную, втор-бутильную, трет-бутильную, пентильную, изопентильную, гексильную, втор-гексильную группы и др. Среди них особенно предпочтительными в связи с более сильным физиологическим действием являются пропильная и изопропильная группы.
В общих формулах (1) и (3) C3-C6 циклоалкильные группы, представленные символами R1 и R1′, включают циклоалкильную группу, циклобутильную группу и циклогексильную группу.
В общих формулах (1) и (3) C1-C6 алкильными группами, представленными символами R2 и R3, является предпочтительно C1-C4 алкильные группы с прямой цепью, и они включают метильную, этильную, пропильную и бутильную группы. C2-C3 полиметиленовая группа, которая может быть замещена C1-C6 алкильной группой, включает этиленовую группу, пропиленовую группу и др. Среди них этиленовая группа является предпочтительной ввиду сильной активности и легкости синтеза. Группа заместитель, необязательно присутствующая в указанной полиметиленовой группе, включает описанную выше C1-C6 алкильную группу.
Брассиностероиды, используемые в настоящем втором изобретении, включают брассинолид и его аналоги ("Shokubutsu No Kagaku Chosetsu" (Chemicai Regulation of Plant), 22[1], 10 - 17 (1987); "Yukagaku" (Oil Chemistry), 39[4], 227 - 235 (1990)). Аналоги включают соединения, разработанные некоторыми из настоящих изобретателей, которые представлены общей формулой (2):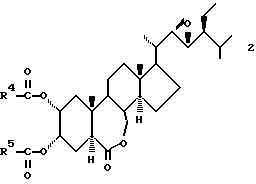
в которой R4 и R5 представляют C1-C6 низшие алкильные группы ("Shokubutsu No Kagaku Chosetsu" 29[1], 23 - 30 (1994); японская патентная LOP публикация N 125396/1989).
C1-C6 алкильными группами, представленными символами R4 и R5 в общей формуле (2), являются предпочтительно C1-C4 алкильные группы с прямой цепью, и они включают метильную, этильную, пропильную и бутильную группы. В связи с высокой активностью, в частности, предпочтительными являются этильная группа и пропильная группа.
Эпоксициклогексановые производные, представленные общей формулой (1) и (3), получаются в общем следующим образом: 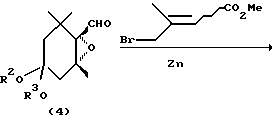
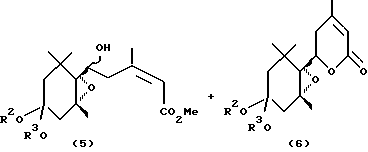
 где R1′ R2 и R3 имеют значения, определенные выше.
где R1′ R2 и R3 имеют значения, определенные выше.
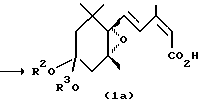
Эпоксициклогексанкарбальдегид (4), являющийся исходным материалом, может быть синтезирован по методу, описанному в литературе (Helv. Chim. Acta, 71, 931 (1988)). Превращение соединения (4) в карбоновую кислоту формулы (1а) может проводиться по методу, описанному в японской патентной LOP публикации N 184966/1991. Настоящие соединения, представленные формулой (3), могут получаться с помощью сложной этерификации карбоновой кислоты формулы (1а), например, по реакции с соответствующим спиртом в присутствии агента конденсации, такого как карбодиимид. В японской патентной LOP публикации N 184966/1991 описывается, что соединение (1b) формулы (1), в которой R1 представляет метильную группу, может синтезироваться путем подвержения действию диазометаном на карбоновую кислоту (1а). Однако, данный известный метод ограничивается синтезом метилового эфира и не может применяться для синтеза других сложных эфиров.
Соединения формулы (2), используемые во втором изобретении, получаются обычно следующим образом: 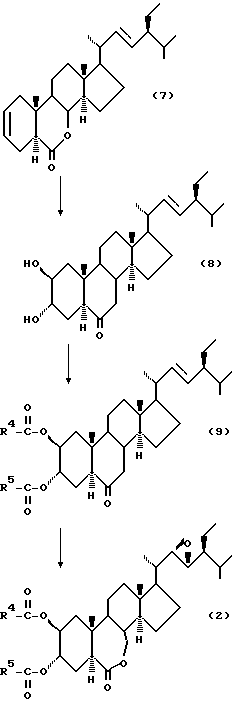 где R4 и R5 имеют значения, определенные выше.
где R4 и R5 имеют значения, определенные выше.
Когда (22Е, 24S)-24-этил-5альфа-холеста-2,22-диен-6-он (7) (R. Mori, Agric. Biol. Chem., 44 (5), 1211 (1980)) подвергаются каталитическому гидроксилированию каталитическим количеством тетраоксида осмия в инертном газе, таком как азот, аргон и др., в присутствии трет-бутилгидроперекиси или N-метилморфолин-N-оксида, его дигидроксилирование в 2альфа- и 3альфа-положениях протекает селективно при регулировании количеств реагентов, и 2альфа, 3альфа-дигидрокси производное может получаться с высоким выходом. Данное дигидрокси производное (8) растворяется в пиридине, содержащем 4-диметиламинопиридин, и подвергается реакции с соответствующим карбоновым ангидридом (например, пропионовым ангидридом, масляным ангидридом и др.), давая соединение (9). Затем соединение (9) растворяется в хлорированном органическом растворителе стабильном к окислению и окисляется органической перекисью, например, надбензойной кислотой, м-монохлорнадбензойной кислотой, м-монобромнадбензойной кислотой, моноперфталевой кислотой, трифторнадуксусной кислотой или их натриевыми или калиевыми солями, давая соединения формулы (2).
В качестве регулятора роста растений согласно первому изобретению указанное производное эпоксициклогексана может смешиваться с обычными носителями, разбавителями и др. для применения к растениям или семенами растений в виде, например, жидкости, порошка, эмульсии, смачиваемого порошка, гранул и др. Для использования в него могут также включаться общепринятые регуляторы роста растений, гербициды, фунгициды и бактерициды, инсектициды и акарициды и др. Дополнительно могут добавляться такие вспомогательные агенты, как спредеры и стикеры (т.е. соответственно агенты, способствующие распределению и прилипанию), эмульгатор, смачивающий агент, диспергирующий агент, фиксирующий агент дезинтегрирующий агент и др. Данные носители, разбавители, вспомогательные агенты и др. предпочтительно выбираются так, чтобы оптимизировать регулирующее действие на рост растений.
Количество регулятора роста растений согласно первому изобретению варьирует в зависимости от способа применения и желаемого действия. Для применения путем опрыскивания, например, его концентрация составляет предпочтительно 1000 - 1 ч./млн., более предпочтительно 100 - 5 ч./млн. Для применения с помощью погружения или макания семян и др. его концентрация составляет предпочтительно 1- 0.001 ч./млн., более предпочтительно 0.1 - 0.01 ч/млн.
В качестве регулятора роста растений согласно второму изобретению указанное производное эпоксициклогексана и брассиностероид могут смешиваться с обычными носителями, разбавителями и др. для применения к растениям или семенам растений в воде, например, жидкости, порошка, эмульсии, смачиваемого порошка, гранул и др. Для использования в него могут также включаться общепринятые другие регуляторы роста растений или гербициды, фунгициды и бактерициды, инсектициды и акарициды и др. Дополнительно могут добавляться вспомогательные агенты, такие как спредеры и стикеры (т.е. соответственно агенты, способствующие распределению и прилипанию), эмульгатор, смачивающий агент, диспергирующий агент, фиксирующий агент и дизентегрирующий агент. Данные носители, разбавители, вспомогательные агенты и др. предпочтительно выбираются так, чтобы оптимизировать регулирующее действие на рост растений.
Количество и соотношение смешения производного эпоксициклогексана и брассиностероида в регуляторе роста растений согласно второму изобретению варьируют в зависимости от способа применения и желаемого действия. Для применения с помощью опрыскивания, например, предпочтительно смешивать производное эпоксициклогексана в пределах 100 - 0.1 ч./млн. с брассиностероидом в количественном интервале 0.1 - 0.001 ч./млн.
Растения, по отношению к которым применяются регуляторы роста растений согласно настоящему первому и второму изобретениям, включают, но не ограничиваются ими, овощные культуры, такие как шпинат, китайская капуста, огурцы, баклажаны, перилла многолетняя, капуста, гирляндная хризантема, лук-порей и лук, овощные корнеплоды, такие как японская белая редька, ямс, свекла и картофель, зерновые, такие как рис, пшеница и кукуруза, бобовые, такие как соевые бобы, фасоль адзуки и арахис, промышленные культуры, такие как сахарный тростник и конопля, фруктовые, такие как виноград, хурма, мандарины, яблони, томаты, дыня, груша, земляника, персики, бананы, ананасы и кофе, декоративные растения, такие как каучуковое дерево, феникс кустарник и бензоин летний, и цветочные культуры, такие как хризантемы, гвоздики, розы, колокольчики, лилии и тюльпаны.
Наилучший способ воплощения изобретения
Далее в данном описании настоящее изобретение описывается подробно со ссылкой на примеры и примеры испытаний, которые однако не предназначены для ограничения настоящего изобретения.
Пример1. Синтез соединения (3b) 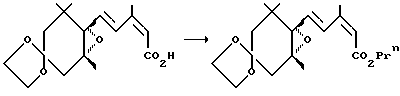
К 308 мг (1.00 ммоль) 4,4-этилендиокси-1-[4-(гидроксикарбонил)-3-метил-1,3-бутадиен-1-ил] -1,2-оксо-2,6,6-триметилциклогексана (1а) (продукт, полученный таким же образом, как в примере 2 в японской патентной LOP публикации N 184966/1991) и 180 мг (224 мкл, 3.00 ммоля) пропилового спирта в сухом дихлорметане (1.5 мл) добавлялось 98 мг (0.80 ммоля) n-диметиламинопиридина (DMAP), и в смесь при охлаждении на льду барботировался аргоновый газ, и смесь герметизировалась в атмосфере аргона. При перемешивании при охлаждении льдом к смеси добавлялось 227 мг (1.10 ммоля) дициклогексилкарбодиимида в дихлорметане (10 мл) на протяжении периода 5 минут, и смесь перемешивалась в течение 15 минут при охлаждении льдом, а затем в течение 3 часов при комнатной температуре. Дополнительно добавлялось 10 мл диэтилового эфира к реакционному раствору, в котором происходило образование огромного количества белых осадков, и осадки удалялись с помощью фильтрования. Дополнительно добавлялся диэтиловый эфир, и осуществлялась промывка смесью водная 2 М соляная кислота/насыщенный раствор хлористого натрия, затем водным насыщенным раствором бикарбоната натрия, и насыщенным водным раствором хлористого натрия. Затем диэтиловоэфирный слой отделялся и сушился над безводным сульфатом натрия. Растворитель отгонялся, и получающееся сырое масло, 385 мг, очищалось с помощью хроматографии на силикагельной колонке (16 г Wako Gel C-200тм; гексан: этилацетат = 4: 1), давая 296 мг 4,4-этилендиокси-1-[4-(пропоксикарбонил)-3-метил-1,3-бутадиен-1-ил] -1,2-оксо-2,6,6-триметилциклогексана (3b) в виде бесцветного маслянистого вещества (выход: 84%).
1Н-ЯМР (CDCl3)δ (млн. дол) : 0.96 (3H, т., J=7.4), 1.00 (3H, с.), 1.22 (3H, с.), 1.25 (3H, с.), 1.34 (1H, дд., J=2.1, 13.6), 1.68 (2H, дд., J=6.7, 7.4), 1.74 (1H, д. , J=13.6), 2.01 (3H, д., J=1.3), 2.04 (1H, дд., J=2.1, 15.7), 2.28 (1H, д., J=15.7), 3.81-3.97(4H, м.), 4.07 (2H, д., J=6.7), 5.71 (1H, шир.с.), 6.27 (1H, дд., J=0.6, 16.1), 7.62 (1H, дд., J=0.7, 16.1).
LRMS m/z: 350 (M+), 291 (M+-C3H7O), 264 (M+ -C4H6O2).
HRMS m/z: По теории (в виде C20H30O5) 350.2092; Найдено 350.2103. [α]
Пример 2. Синтез соединения (3а) 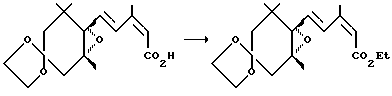
Повторялась та же процедура, что и в примере 1, за исключением того, что использовалось 138 мг (3.00 ммоля) этилового спирта вместо пропилового спирта, давая 264 мг 4,4-этилендиокси-1-[4-(этоксикарбонил)-3-метил-1,3-бутадиен-1-ил]-1,2-оксо-2,6,6-триметилциклогексана (3а) (выход: 78.5%).
1H-ЯМР (CDCl3) δ (млн.дол): 1.00 (3H, с.), 1.22 (3H, с.), 1.25 (3H, с.), 1.38 (3H, т. , J=7.1), 1.34 (1H, дд., J=2.1, 13.7), 1.75 (1H, д., J=13.7), 2.01 (3H, д. , J=1.3), 2.05 (1H, дд., J=2.1, 15.7), 2.28 (1H, д., J=15.7), 3.82-3.96 (4H, м.), 4.17 (2H, кв., J=7.1), 5.70 (1H, шир.с.), 6.27 (1H, дд., J=0.6, 16.0), 7.63 (1H, дд., J=0.8, 16.0).
LRMS m/z: 336 (M+).
HRMS m/z: По теории ( в виде C19H28O5) 336.1935; Найдено 336.1913.
Пример 3. Синтез соединения (3с) 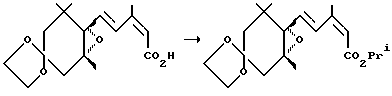
Повторялась та же процедура, что и в примере 1, за исключением того, что использовалось 180 мг (230 мкл) изопропилового спирта вместо пропилового спирта, давая 282 мг 4,4-этилендиокси-1[4-(изопропоксикарбонил)-3-метил-1,3-бутадиен-1-ил]-1,2-оксо-2,6,6-триметилциклогексана (3с) (выход: 81%).
1H-ЯМР (CDCl3) δ (млн.дол.) : 1.00 (3H, с.), 1.22 (3H, с.), 1.25 (3Н, с. ), 1.26 (6Н, д., J=6.3), 1.34 (1Н, дд., J=2.1, 13.7), 1.74 (1Н, д., J=13.7), 2.00 (3Н, д. , J=1.3), 2.04 (1Н, дд, J=2.1, 15.8), 2.28 (1Н, д., J=15.8), 3.81-3.94 (4Н, М. ), 5.06 (1Н, септ., J=6.3), 5.68 (1Н, шир.с.), 6.26 (1Н, дд., J=0.6, 16.1), 7.61 (1Н, дд., J=0.7, 16.1).
LRMS m/z: 350 (M+), 291 (M+-C3Н7O), 264 (M+-C4Н6O2). НRMS m/z: По теории (в виде C20Н30O5) 350.2091; Найдено 350.2087. [α]
Пример 4. Синтез соединения (3d) 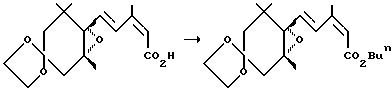
Повторялась та же процедура, что и в примере 1, за исключением того, что использовалось 227 мг (3.00 ммоля) бутилового спирта вместо пропилового спирта, давая 306 мг 4,4-этилендиокси-1-[4-(бутоксикарбонил)-3-метил-1,3-бутадиен-1-ил]-1,2-оксо-2,6,6-триметилциклогексана (3d) (выход: 84%).
1Н-ЯМР (CDCl3) δ (млн.дол.) : 0.94 (3Н, т., J =7.4), 1.00 (3Н, с.), 1.22 (3H, с.), 1.25 (3Н, с.), 1.34 (1Н, дд., J=2.1, 13.7), 1.40 (2H, ткв., J=7.4, 7.4), 1.64 (2Н, тт. , J=6.7, 7.4), 1.74 (1H, д., J=13.7), 2.01 (3H, д. J= 1.2), 2.04 (1H, дд., J=2.1, 15.7), 2.28 (1Н, д., J=15.7), 3.82-3.96 (4Н, м. ), 4.12 (2Н, т. , J=6.7), 5.70 (1H, шир.с.), 6.27 (1Н, дд., J=0.5, 16.0), 7.63 (1H, дд., J=0.7, 16.0). LRMS m/z: 364 (M+).
HRMS m/z: По теории (в виде C21H32O5) 364.2247; Найдено 364.2253.
Пример 5. Синтез соединения (3е) 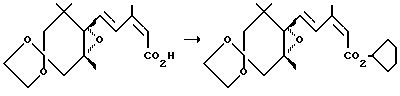
Повторялась та же процедура, что и в примере 1, за исключением того, что использовалось 258 мг (3.00 ммоля) циклопентилового спирта вместо пропилового спирта, давая 312 мг 4,4-этиленди-окси-1-[4-(циклопентилоксикарбонил)-3-метил-1,3-бутадиен-1-ил] -1,2-оксо-2,6,6-триметилциклогексана (3е) (выход: 83%).
1H-ЯМР (CDCl3) δ (млн.дол.) : 0.96 (3Н, с.), 1.21 (3Н, с.), 1.25 (3Н, С. ), 1.34 (1Н, дд., J=2.1, 13.7), 1.55-1.63 (м.), 1.68-1.79 (м.), 1.74 (1Н, д. , J= 13.7), 1.81-1.93 (м. ), 2.00 (3Н, д., J=1.2), 2.04 (1Н, дд., J=2.1, 15.7), 2.27 (1Н, д, J=15.7), 3.82-3.96 (4Н, м.), 5.22 (1Н, м.), 5.67 (1Н, шир.с.), 6.26 (1Н, дд., J=0.6, 16.0), 7.60 (1Н, дд., J=0.6, 16.0).
LRMS m/z: 376 (M+). HRMS m/z: По теории (в виде C22H32O5) 376.2247; Найдено 376.2226.
Пример синтеза 1. Синтез соединения (2а) 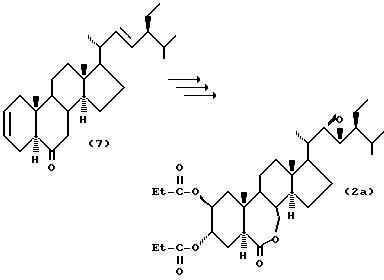
Осуществлялась та же процедура, что описана в японской патентной LOP публикации N 125396/1989, давая (22R, 23R, 24S)-2альфа,3альфа-дипропионилокси-22,23-эпокси-B-гомо-7-окса-5альфа-стигмастан-6-он (2A) в виде игольчатых кристаллов.
Т.пл.: 147-148oC (из метанола)
1H-ЯМР (CDCl3) δ (млн.дол.): 0.72 (3H, с.), 1.10 (3H, с.), 1.18 (3H, с.) 2.73 (1Н, дд.), 3.00 (1Н, дд.), 4.10 (2Н, м.), 4.89 (1Н, м.), 5.38 (1Н, м.). FD-MS m/z: 589 (M++1).
Пример синтеза 2. Синтез соединения (2d) 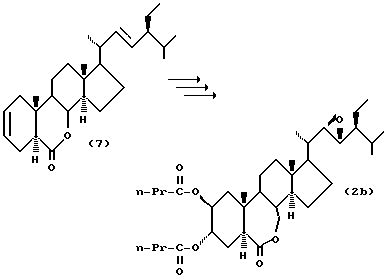
Осуществлялась та же процедура, что описана в японской патентной LOP публикации N 125396/1989, давая (22R, 23R, 24S)-2альфа,3альфа-дибутироилокси-22,23-эпокси-B-гомо-7-окса-5альфа-стигмастан-6-он (2d). Состояние: аморфное вещество.
1H-ЯМР (CDCl3) δ (млн.дол.): 0.67 (3H, с.), 0.99 (3H, с.), 2.70 (1H, дд. ), 3.00 (1Н, дд.), 4.10 (2H, м.), 4.86 (1H, м.), 5.36 (1H, м.). FD-MS m/z: 617 (M++1).
Пример испытаний 1. Оценка подавления транспирации и промотирующего действия на рост.
Семена фасоли Mangbean высаживались в вермикулит и выращивались при 22oC при непрерывном освещении флуоресцентной лампой. В день, когда развивались их примордиальные (зародышевые) листья (длина эпикотиля или надсемядольного колена 2 см), примордиальные листья и эпикотили опрыскивались равномерно раствором для обработки каждого испытываемого соединения. Раствор для обработки приготавливался путем растворения каждого испытываемого соединения в небольшом количестве Etoll тм и разбавления его водой в заданной концентрации.
Семь сеянцев на группу выращивались таким же образом, как описано выше, в сосуде с 100 мл воды, содержащей жидкое удобрение (Hyponexтм).
Через четыре дня после обработки, т.е., когда рост в длину их эпикотиля полностью завершился, определялись транспирация в каждой группе обработки (снижение количества воды в каждом сосуде) и их средний вес и выражались в виде процента на основе показателей в группе без обработки (%). Результаты показаны в таблицах 1 и 2.
Как видно из приведенных результатов, соединения настоящего изобретения показали активность, которая почти эквивалентна или выше, чем активность абсцизовой кислоты природного типа. В частности, соединения (3b) и (3c) показали 10-кратную или более высокую активность, чем активность абсцизовой кислоты природного типа.
Пример испытаний 2. Оценка прорастания семян и промотирующего действия на рост (1)
Неочищенные от шелухи семена риса (разновидность; Nihon Bare) погружались в воду при 15oC на 1 день, а затем погружались в водный раствор каждого испытываемого соединения в заданной концентрации на 24 часа. Пятнадцать семян высаживались в каждый лоток (диаметр: 10 см), заполненный вермикулитом, и выращивались в помещении в искусственных условиях при температуре 20 - 21oC при непрерывном освещении при 15000 люкс.
При этом давалось жидкое удобрение (Hyponexтм).
На стадии 4 листа 10 хорошо выросших сеянцев брались из каждого лотка (2 лотка в каждой группе, всего 20 сеянцев), и определялся средний вес сеянцев, включая корни, и выражался в виде процента в расчете на показатели в группе без обработки. Результаты показаны в таблице 3.
Как видно из приведенных результатов, соединения настоящего изобретения показали активность, которая почти эквивалентна или выше, чем активность абсцизовой кислоты природного типа.
Пример испытаний 3. Оценка прорастания семян и промотирующего действия на рост (2).
Семена моркови (разновидность: Koyo No 2) погружались мгновенно в раствор испытываемого соединения в смеси этанол/вода (50:50) в заданной концентрации. Сразу же после обработки обработанные семена сушились на воздухе, а на следующий день они высаживались и выращивались в виниловой теплице при температуре ночью 13oC или более.
Через шестьдесят дней после посадки определялся средний вес их корней и выражался в виде процента в расчете на вес в группе без обработки. Результаты показаны в таблице 4.
Как видно из приведенных результатов, соединения настоящего изобретения проявили активность, которая почти эквивалентна или выше, чем активность абсцизовой кислоты природного типа.
Пример испытаний 4. Оценка промотирующего действия на созревание плодов
Разновидность винограда Kyoho, выращивается на открытом воздухе (вне помещения) в течение 20 лет, обрабатывалась соединением (3c) настоящего изобретения или абсцизовой кислотой природного типа. При данной обработке каждое испытываемое соединение растворялось в 80% этаноле в заданной концентрации, и 5 мл раствора разбрызгивалось на каждую гроздь во время начала появления окраски. Через семнадцать дней после опрыскивания собирали урожай плодов, и производилась проверка их качества. Результаты показаны в таблице 5.
Как видно из приведенных результатов, активность 50 част./млн. соединения (3c) согласно настоящему изобретению сравнима с активностью 300 част. /млн. абсцизовой кислоты природного типа, что указывает на то, что первое соединение показало активность, примерно в 5 раз превышающую активность последнего.
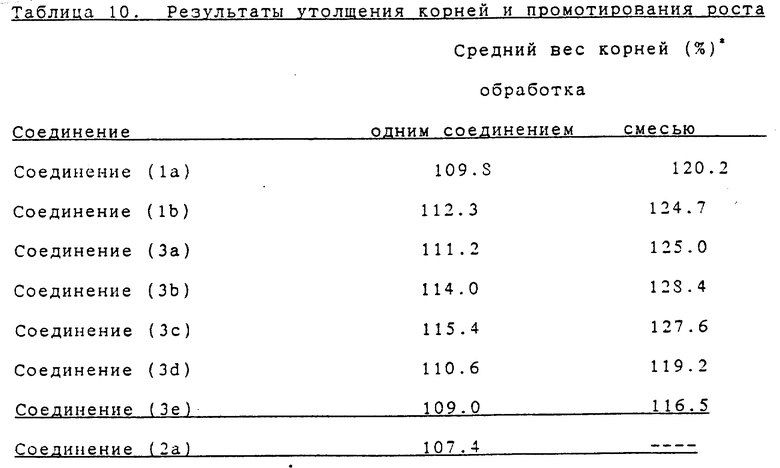
Пример 5 испытаний. Оценка утолщения корней (корнеплодов) и протирующего действия на рост
Редька (ранняя разновидность Akamaru-commet) выращивалась на поле и опрыскивалась испытываемым соединением, когда начиналось утолщение ее корней. Жидкость для опрыскивания (спрей) приготавливалась следующим образом: 95 частей по весу растворителя, состоящего из 60 частей ксилола, 20 частей изофорона и 20 частей поверхностно-активного вещества, смешивались с 5 частями по весу испытываемого соединения, давая эмульсионный препарат. Он разбавлялся водой в заданной концентрации, а затем использовался для опрыскивания в количестве 100 литров 1000 м2.
Через 15 дней опрыскивания определялся средний вес корней растений в каждой группе и выражался в процентах в расчете на вес в группе без обработки. Результаты показаны в таблице 6.
Как видно из приведенных результатов, соединения настоящего изобретения проявили активность, которая почти эквивалентна или выше, чем активность абсцизовой кислоты природного типа.
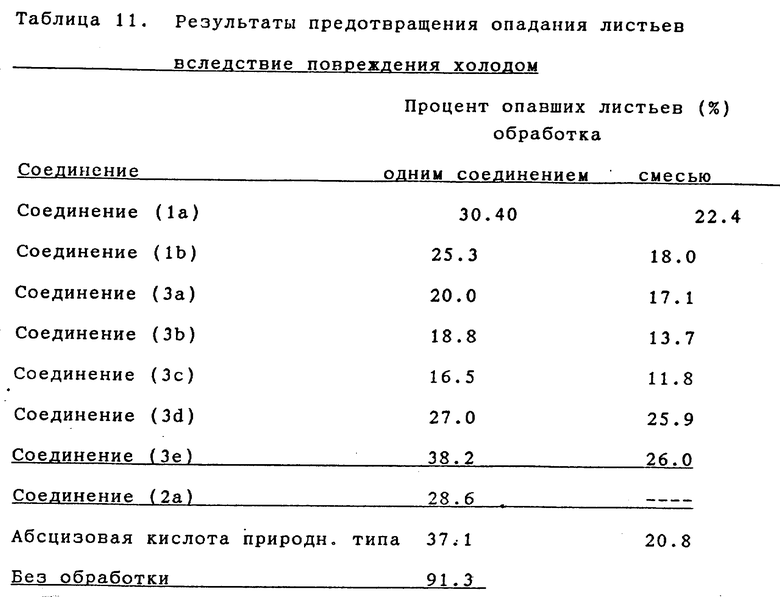
Пример испытаний 6. Оценка действия, повышающего холодостойкость
Растения Benjamin со 150 - 200 листьями, выращиваемые в лотках в теплице, опрыскивались каждым испытываемым соединением. Жидкость для опрыскивания приготавливалась следующим образом: 95 частей по весу растворителя, состоящего из 60 частей ксилола, 20 частей изофорона и 20 частей поверхностно-активного вещества, смешивались с 5 частями по весу испытываемого соединения, давая эмульсионный препарат. Он разбавлялся водой в заданной концентрации. Опрыскивалась вся поверхность листьев, которые равномерно смачивались испытываемым раствором.
В тот же день после опрыскивания (начало ноября) растение помещалось в условия температуры окружающей среды в открытом поле. Спустя 25 дней, определялся процент опавших листьев. Результаты показаны в таблице 7.
Как видно из приведенных результатов, соединения настоящего изобретения проявили активность по предотвращению листьев от опадания вследствие повреждения холодом, которая почти эквивалентна или выше, чем активность абсцизовой кислоты природного типа.
Пример испытаний 7. Оценка прорастания семян и промотирующего действия на рост (сочетание с брассиностероидом) (1) Неочищенные от шелухи семена риса (разновидность: Nihon Bare ) погружались в воду при 15oC на 1 день, а затем погружались в водный раствор каждого испытываемого соединения в заданной концентрации [обработка одним соединением: 0.01 част./млн. соединения; и обработка смесью:0.01 част./млн. соединения (1a, 1b, 3a - 3e), или 0.01 част./млн. абсцизовой кислоты природного типа, плюс 0.01 част./млн. соединения (2a)] на 24 часа. Пятнадцать семян высаживалось в каждый лоток (диаметр: 10 см), заполненный вермикулитом, и выращивались в помещении в искусственных условиях при температуре 20-21oC при непрерывном освещении при 15000 люкс. При этом давалось жидкое удобрение (Hyponexтм).
На стадии 4 листа 10 хорошо выросших сеянцев бралось из каждого лотка (2 лотка в каждой группе, всего 20 сеянцев), и определялся средний вес сеянцев, включая корни, и выражался в виде процента в расчете на показатели в группе без обработки. Результаты показаны в таблице 8.
Как видно из приведенных результатов, обработка смесью показала синергистическое усиливающее действие на прорастание и рост. В частности, сочетание соединения (2a) с соединением (3b) или (3c) показало сильное действие.
Пример испытаний 8. Оценка прорастания семян и промотирующего действия на рост (Сочетание с брассиностероидом) (2)
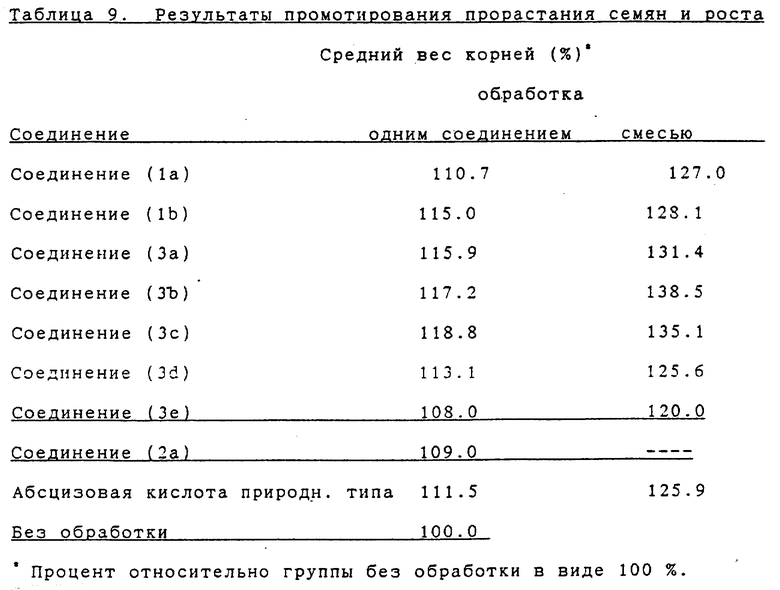
Семена моркови (разновидность: Koyo No 2) погружались мгновенно в раствор испытываемого соединения в смеси этанол/вода (50:50) в заданной концентрации [обработка одним соединением: 0.1 част./млн. соединения (1a, 1b, 3a - 3e) или абсцизовой кислоты природного типа; и обработка смесью: 0.1 част. /млн. соединения (1a, 1b, 3a - 3e), или 0.1 част./млн. абсцизовой кислоты природного типа, плюс 0.01 част./млн. соединения (2a)]]. Сразу же после обработки обработанные семена сушились на воздухе, а на следующий день они высаживались и выращивались в виниловой теплице при температуре ночью 13oC или более.
Через шестьдесят дней после посадки определялся средний вес их корней и выражался в виде процента в расчете на вес в группе без обработки. Результаты показаны в таблице 9.
Как видно из приведенных результатов, обработка смесью показала синергистическое действие на рост.
Пример 9 испытаний. Оценка утолщения корней (корнеплодов) и промотирующего действия на рост (Сочетание с брассиностероидом)
Редька (ранняя разновидность Akamaru-commet) выращивалась на поле и опрыскивалась испытываемым соединением, когда начиналось утолщение ее корней. Жидкость для опрыскивания приготавливалась следующим образом: 95 частей по весу растворителя, состоящего из 60 частей ксилола, 20 частей изофорона и 20 частей поверхностно-активного вещества, смешивались с 5 частями по весу испытываемого соединения, давая эмульсионный препарат. Он разбавлялся водой в заданной концентрации [обработка одним соединением: 5 част./млн. соединения (1a, 1b, 3a - 3e) или абсцизовой кислоты природного типа, или 0.01 част. /млн. соединения (2a); и обработка смесью: 5 част./млн. соединения (1a, 1b, 3a - 3e), или 5 част./млн. абсцизовой кислоты природного типа, плюс 0.01 част./млн. соединения (2a)], а затем использовался для опрыскивания в количестве 100 литров на 1000 м2.
Через 15 дней после опрыскивания определяется средний вес корней в каждой группе и выражается в процентах в расчете на вес в группе без обработки. Результаты показаны в таблице 10.
Как видно из приведенных результатов, обработка смесью показала синергестическое действие на рост.
Пример испытаний 10. Оценка действия, превышающего холодостойкость (Сочетание с брассиностероидом)
Растения Benjamin со 150-200 листьями, выращиваемые в лотках в теплице, опрыскивались испытываемым соединением. Жидкость для опрыскивания приготавливалась следующим образом: 95 частей по весу растворителя, состоящего из 60 частей ксилола, 20 частей изофорона и 20 частей поверхностно-активного вещества, смешивались с 5 частями по весу испытываемого соединения, давая эмульсионный препарат. Он разбавлялся водой в заданной концентрации [обработка одним соединением: 10 част./млн. соединения (1a, 1b, 3a - 3e) или абсцизовой кислоты природного типа, или 0.01 част./млн. соединения (2a); и обработка смесью: 10 част./млн. соединения (1a, 1b, 3a -3e), или 10 част./млн. абсцизовой кислоты природного типа, плюс 0.01 част./млн. соединения (2a)]. Опрыскивалась вся поверхность листьев, которые равномерно смачивались испытываемым раствором.
В тот же день после опрыскивания (начало ноября) растение помещалось в условия температуры окружающей среды в открытое поле. Спустя 25 дней, определяется процент опавших листьев. Результаты показаны в таблице 11.
Как видно из приведенных результатов, обработка смесью показала синергистический эффект по предотвращению опадания листьев.
Промышленная применимость
Эпоксициклогексановые производные настоящего изобретения проявляют сильное действие по регулированию роста растений, которое эквивалентно или выше, чем действие абсцизовой кислоты, такое как действие, промотирующее рост растений, рост при появлении всходов, действие, предотвращающее транспирацию и увядание, действие, выражающееся в усилении холодостойкости (предотвращение повреждения в результате низких температур), и действие, промотирующее рост и утолщение растений, и являются полезными в качестве регуляторов роста растений, таких как ускорители роста растений, ускорители прорастания и появления всходов, ингибиторы транспирации и увядания, усилители холодостойкости, и ускорители роста, утолщения или созревания фруктовых плодов, корней или корнеплодов, стеблей или луковиц. Они также полезны как регуляторы роста растений, такие как регулятор опадания незрелых плодов, ингибитор стрелкования или выбрасывания цветоноса, предохранитель срезанных цветов, ингибитор цветения и др., которые известны для применения абсцизовой кислоты. Кроме того, они применимы для брожения для улучшения качества и снижения стоимости пивоварения. Эпоксициклогексановые производные настоящего изобретения могут легко синтезироваться и, таким образом, поставляться в больших количествах по мере необходимости.
Регулятор роста растений согласно второму настоящему изобретению, который включает эпоксициклогексановое производное и брассиностероид в качестве активных ингибиторов, оказывает синергистическое действие на рост растений, такое как действие, промотирующее прорастание и появление всходов, действие, усиливающее холодостойкость (предотвращающее от низкотемпературных повреждений), и действие, промотирующее утолщение и рост растений, и такие сочетания полезны в качестве регуляторов роста растений, таких как ускорители прорастания и роста всходов, усилители холодостойкости, ускорители роста, утолщения или созревания плодов, корней, стеблей или луковиц, ускорители укоренения черенков и др.
| название | год | авторы | номер документа |
|---|---|---|---|
| БРАССИНОСТЕРОИДНЫЕ ПРОИЗВОДНЫЕ И РЕГУЛИРУЮЩЕЕ РОСТ РАСТЕНИЙ СРЕДСТВО | 1994 |
|
RU2114116C1 |
| СТИМУЛЯТОР РОСТА РАСТЕНИЙ | 1995 |
|
RU2145165C1 |
| ПРОИЗВОДНЫЕ БЕНЗОЛА, СОДЕРЖАЩИЕ ГЕТЕРОЦИКЛ, СПОСОБЫ ИХ ПОЛУЧЕНИЯ И ГЕРБИЦИДНОЕ СРЕДСТВО | 1992 |
|
RU2038351C1 |
| НУКЛЕИНОВОЕ ОСНОВАНИЕ, ИМЕЮЩЕЕ ПЕРФТОРАЛКИЛЬНУЮ ГРУППУ И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 2006 |
|
RU2436777C2 |
| ИЗОКСАЗОЛИНОВЫЕ ПРОИЗВОДНЫЕ И ГЕРБИЦИДЫ, СОДЕРЖАЩИЕ ИХ В КАЧЕСТВЕ АКТИВНЫХ ИНГРЕДИЕНТОВ | 2000 |
|
RU2237664C2 |
| ПРОИЗВОДНЫЕ АМИДОВ АМИНОКИСЛОТ, СПОСОБЫ ИХ ПОЛУЧЕНИЯ, СЕЛЬСКОХОЗЯЙСТВЕННЫЕ ИЛИ САДОВЫЕ ФУНГИЦИДЫ И СПОСОБ УНИЧТОЖЕНИЯ ГРИБОВ | 1995 |
|
RU2129548C1 |
| ПРОИЗВОДНЫЕ ТРИАЗОЛА, СПОСОБЫ ИХ ПОЛУЧЕНИЯ, ИНСЕКТИЦИДНОЕ И АКАРИЦИДНОЕ СРЕДСТВО | 1994 |
|
RU2131421C1 |
| ПРОИЗВОДНЫЕ КАРБАМАТА И ФУНГИЦИД СЕЛЬСКОГО ХОЗЯЙСТВА | 2000 |
|
RU2228328C2 |
| ПРОИЗВОДНЫЕ ПИРИМИДИНИЛОКСИАЛКАНАМИДОВ И ФУНГИЦИДЫ ДЛЯ СЕЛЬСКОГО ХОЗЯЙСТВА ИЛИ САДОВОДСТВА | 1997 |
|
RU2194040C2 |
| КОМПОЗИЦИЯ ДЛЯ ДЕСИКАЦИИ И ДЕФОЛИАЦИИ РАСТЕНИЙ И СПОСОБ ДЕСИКАЦИИ И ДЕФОЛИАЦИИ РАСТЕНИЙ | 1996 |
|
RU2140154C1 |









Изобретение относится к регулятору роста растений, включающему в качестве активного ингредиента производное эпоксициклогексана, представленное общей формулой 1, в которой R1 представляет атом водорода, С1-С6-алкильную группу или C3-С6-циклоалкильную группу и R2 и R3 образуют вместе C2-C3-полиметиленовую группу, а также к регулятору роста растений, включающему производное эпоксициклогексана и брассиностероид в качестве активных ингредиентов. Производные эпоксициклогексана проявляют сильное действие, регулирующее рост растений, которое эквивалентно или выше, чем действие абсцизовой кислоты, и являются полезными в качестве регуляторов роста растений, таких как средства, ускоряющие рост растений, прорастание и рост всходов, ингибирующие транспирацию и увядание, средства, усиливающие холодостойкость, ускоряющие рост, утолщение или созревание плодов, корней и корнеплодов, стеблей или луковиц и др. Синергистический эффект достигается за счет сочетания производного эпоксициклогексана с брассиностероидом. 3 с. и 11 з.п.ф-лы, 11 табл. 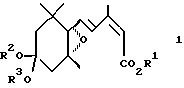
где R1 представляет атом водорода, C1 - C6-алкильную группу или C3 - C6-циклоалкильную группу;
R2 и R3 вместе образуют этиленовую группу,
в количестве, соответствующем концентрации производного эпоксициклогексана при использовании 0,001-1000 ч./млн.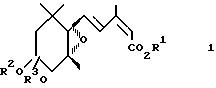
где R1 представляет атом водорода, C1 - C6-алкильную группу или C3 - C6-циклоалкильную группу;
R2 и R3 вместе образуют этиленовую группу,
и брассиностероид общей формулы 2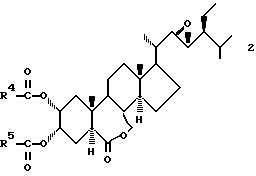
где R4 и R5 представляет независимо C1 - C6-алкильные группы,
в количестве, соответствующем концентрации производного эпоксициклогексана (1) при использовании 0,1-100 ч./млн и концентрации брассиностероида общей формулы (2) 0,001-0,1 ч./млн.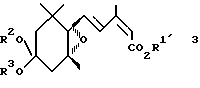
где R1′ представляет C2 - C6-алкильную группу или C3 - C6-циклоалкильную группу;
R2 и R3 объединены, образуя C2 - C3-полиметиленовую группу.
Авторы
Даты
1999-02-20—Публикация
1995-09-13—Подача