Настоящее изобретение относится к получению и использованию нейтрализованного формалином антигена фактора колонизации (CPA) экспрессирующего E. coli организмы для вакцинации людей против кишечной инфекции/диарреи, вызванной энтеротоксигенными E.coli бактериями.
Более конкретно, настоящее изобретение относится к способу получения композиции вакцины против кишечной инфекции, вызываемой у людей энтеротоксигенными бактериями E.coli.
Предпосылки изобретения
Диаррея, вызываемая энтеротоксигенными Escherichia coli (ETEC), представляет важную проблему для здоровья людей, особенно в развивающихся странах, а также для тех, кто едет в эти зоны. В больничных и клинических исследованиях случаев острой диарреи в развивающихся странах ETEC была идентифицирована в 10 - 15% случаев, причем примерно 20% случаев относилось к детям в возрасте младше 5 лет, и несколько выше к более старшим возрастным группам. Аналогично, ETEC была идентифицирована как причина в по крайней мере от одной трети до половины случаев острой диарреи у людей, путешествующих из индустриальных в развивающиеся страны.
Симптомы заболевания, вызываемого ETEC, варьируются от слабой диарреи до обезвоживания организма до заболевания схожего с холерой. В первые 5 лет жизни многие дети в развивающихся странах страдают от 1 - 2 случаев диарреи, вызванной ETEC ежегодно. Хотя при большинстве ETEC инфекциях симптомы бывают относительно слабыми, на счету ETEC более чем один биллион случаев заболевания диарреей и один миллион смертельных случаев ежегодно среди детей в развивающихся странах. Поэтому любые вмешательства, которые помогли бы снизить смертность от ETEC или заболеваемости по этой причине даже частично, имеют огромное значение для здоровья народонаселения.
До сих пор не была доступна никакая вакцина для людей против ETEC диарреи. Однако в широкой области исследований вновь разработанной оральной вакцины против холеры было обнаружено, что B-субъединица компонента этой вакцины, которая перекрестно взаимодействует иммунологически с термолабильным энтеротоксином /LT/ ETEC, обеспечивает существенную защиту не только от холеры, но также и против диарреи, вызванной LT-продуцирующей ETEC. Защита против ETEC инфекции была особенно выражена против заболеваний, связанных с сильной, опасной для жизни дегидратацией, которая снижалась на 86% за счет вакцины в течение первых трех месяцев против иммунизации.
Механизм заболевания и иммунитет
Для того, чтобы вызвать заболевание, ETEC должна быть способна колонизировать тонкий кишечник, и выработать LT и/или термостабильный энтеротоксин /ST, STa/. E.coli LT аналогичен токсину холеры по строению и функциям, и состоит из токсин-активной A-субъединицы, присоединенной к пяти B-субъединицам, которые осуществляют связывание с рецепторами клеточных мембран. Молекула ST представляет собой небольшой полипептид, состоящий всего из 19 аминокислотных остатков, который стимулирует активность гуанилатциклазы в клетках кишечника. В отличие от LT, который является сильным иммуногеном, ST не является иммуногенным, если только экспериментально не связан с более крупным протеином-носителем. Только ST и LT/ST-продуцирующие штаммы являются серьезными причинами диарреи в эндемичных районах, тогда как только LT штаммы часто вызывают диаррею у путешествующих и в развивающиеся страны. Причем доля ETEC штаммов с различными профилями энтеротоксинов меняется от страны к стране.
Во многих ETEC штаммах адгезия к слизистой кишечника осуществляется за счет антигенно различных фимбрий. В штаммах, патогенных для людей, были идентифицированы три основных адгезина; их вызывают антигенами фактора колонизации CFA/I, CFA/II и CFA-IV (ранее именовался PCF8775). CFA/I является простым гомогенным фимбриальным антигеном, тогда как CFA/II содержит coli поверхностные /CS/ антигены CS1, CS2, и CS3, а CFA/IV содержит антигены CS4, CS5 и CS6. Хотя превалирование этих различных факторов колонизации меняется географически, CFA/I, CFA/II или CFA/IV обычно находят в половине - трех четвертях ETEC изоляторов, полученных в случаях с клинически заметной диарреей. Однако, по-видимому, идентифицированы также и дополнительные адгезины.
Наибольшая доля ETEC инфекций в эндемичных зонах наблюдается для маленьких детей. Обнаружили, что степень заболеваний снижается с возрастом, и у взрослых наблюдается больше асимптоматических случаев нежели у детей; это дало возможность предположить, что развивается природный защитный иммунитет. Аналогично, степень устойчивости против ETEC диарреи развивается у путешественников в течение длительного пребывания в странах с повышенным риском заболевания. Экспериментальные исследования на животных и добровольцах также подтвердили, что ETEC инфекция может вызвать существенный иммунитет против повторного заражения гомологическими организмами.
Существует доказательство, что как антибактериальный, так и антитоксичный иммунитет вносит вклад в защиту от ETEC диарреи. Антибактериальный иммунитет против ETEC можно в значительной степени описать как иммунитет против различных факторов колонизации /CFA/, несмотря на то, что антитела против O-антигена могут играть роль также и для защиты против ETEC гомологичных O-групп. У животных анти-CFA антитела защищали против повторного заражения ETEC кэкспрессирующей гомологичные CFA. Аналогично, как у животных, так и у добровольцев оральная или внутрикишечная иммунизация штаммами ETEC, экспрессирующими CFA/I, CFA/II или CFA/IV вызывали защитный иммунитет против последующего повторного заражения E. coli, несущими гомологичный CFA/CS-фактор.
Природный стимулированный антитоксичный ETEC иммунитет направлен только против LT, так как нативный ST не является иммуногенным. Анти-LT иммунная реакция направлена, главным образом, против B-субъединичной части молекулы, которая иммунологически перекрестно - реагирует с B-субъединицей токсина холеры. Это объясняет то, почему, как было упомянуто, оральная иммунизация B-субъединицей холеры может стимулировать защиту против ETEC диарреи /1/; интересно, что защита стимулируется не только против LT, но также против LT/ST штаммов /1/; это открытие также подтверждается фактом, что у животных после иммунизации находят как холерные, так и LT B-субъединицы /неопубликованные данные/.
Известно также, что у людей клиническое ETEC заболевание пробуждает значительную антитоксичную, также антибактериальную иммунную реакцию в кишечнике, что приводит к повышению титра Ig A-антител в кишечной промывной жидкости против LT и гомологичных CFA и O-антигенов. /2/. Как анти-энтеротоксин, так и анти-антитела фактора колонизации могут независимо друг от друга защищать против экспериментального ETEC заражения и, если присутствуют в кишечнике одновременно, эти специфические антитела, как было обнаружено, действуют синергетически по защите против ETEC заболевания /3/.
В противоположность к хорошо известной защитной функции анти-LT иммунитета против ETEC заболевания, важность анти-ST иммунитета для защиты остается неизвестной. Хотя ST в природном состоянии не является иммуногенным, он может стать причиной возникновения ST-нейтрализующих антител, если его использовать вместе с белком-носителем. Это дает возможность предположить, что и стимулированный вакциной анти-ST иммунитет может оказаться достижимой целью. Однако конъюгаты различных ST-носителей, тестированные до настоящего времени, полученные либо химическим слиянием, либо методом рекомбинантных ДНК, все сохраняли значительную, хотя иногда и пониженную токсичную активность. Поэтому недавно были приготовлены несколько синтетических модифицированных ST-пептидов в попытке идентифицировать нетоксичные ST-родственные эпитопы. Синтетические олигонуклеотиды, кодирующие аналогичные пептиды, так же были получены и слиты с геном B-субъединицы холеры, а когда их включили в Vibrio cholerae эти химерические гены кодировали продуцирование высоких концентраций полностью нетоксичного протеина слияния ST - B-субъединиц. Иммунизация подопытных животных такими химически полученными или полученными с помощью генной инженерии нетоксичных конъюгатами пептид-B-субъединица пробуждает реакции антител анти-ST, но теперь уже только со слабой нейтрализующей активностью.
Варианты вакцин
Зная вышеизложенное о ключевых защитных антигенах ETEC бактерий и основные иммунные механизмы, работающие против ETEC инфекций, можно сделать вывод, что эффективная ETEC вакцина должна вводиться орально, и в идеале, возбуждая как антиколонизационную, так и антитоксичную иммунную реакцию в кишечнике. Таким образом, вакцина должна содержать комбинацию антигенов, полученных из бактериальных клеток и токсинов. Различные живые или инактивированные ETEC вакцины недавно были рассмотрены с точки зрения этих предпосылок.
Живые вакцины
Живые бактерии, экспрессирующие основные CFA и продуцирующие B-субъединицу или родственный энтеротоксоид, можно рассматривать, так как такая вакцина за счет мультипликации в кишках может обеспечить существенную антигенную стимуляцию местной кишечной иммунной системы. Однако, так как различные факторы колонизации обычно не экспрессируются на тех же самых штаммах, и нет возможности клонировать гены для различных CFA в один и тот же организм-хозяин, такие вакцины должны по крайней мере на данный момент основываться на смеси нескольких различных штаммов. Однако существует несколько проблем с этим вариантом вакцин. Среди таких вакцин существует риск избыточного роста одного из включенных штаммов вакцин при добавлении других; возврат к токсичности за счет захвата кодирующих токсин плазмид; низкое продуцирование энтеротоксоида в процессе роста in vino и плохая сохранность /выживаемость/ штаммов вакцин при хранении. Поэтому живые оральные ETEC вакцины до сих пор неизвестны.
Неживые вакцины
Наиболее важные из соматических антигенов, которые следует включить в вакцины, это те CFA, которые в значительной степени преобладают по содержанию ETEC штаммов в различных географических районах. Эти антигены включают CFA/I, CFA/II и CFA/IV, и возможно несколько дополнительных CFA, которые еще следует определить. Однако очищенные антигены CFA может быть относительно дорого получать, и, кроме того, после орального введения выделенные CFA, как было показано, оказываются чувствительными к разложению в желудочно-кишечном тракте человека /4, 5/.
Более практичным путем конструирования вакцины может оказаться получение нейтрализованных ETEC бактерий, которые экспрессируют наиболее важные CFA на их поверхности, и объединить эти организмы с соответствующим компонентом токсоида. Важными проблемами получения вакцин, которые следует преодолеть, являются:
a/ обнаружение способа, который позволил бы безопасно нейтрализовать штаммы вакцин, сохранив при этом антигенные и адгезивные /геммагглютинационные/ свойства различных CFA /в идеале эта процедура должна стабилизировать CFA против разложения в кишечнике человека/, и
b/ определение условий, которые обеспечили бы высокий уровень экспрессии CFA на бактерии во время роста в жидкой среде в ферменте для облегчения крупномасштабного производства вакцины.
Хорошо известным, и поэтому выгодным способом инактивации бактерий для использования как целых клеточных вакцин, является применение обработки формалином. Обычно концентрация формалина, которую используют для таких целей, составляет 1М. Мы нашли, что обработка CFA экспрессирующих ETEC обычно используемым для получения вакцин способом, безопасно нейтрализует ETEC организмы, но в то же самое время разрушает большую часть CFA антигена, и поэтому такие способы не совсем пригодны для получения инактивированных ETEC штаммов с сохранением CFA иммуногенности. В соответствии с этим, Левин /6/ описал ограниченные успехи Такета с сотр. в применении обработанных формалином ETEC организмов одного штамма для стимуляции образования IgA антител и защиты добровольцев. Вакцину получали из E.coli штамма E1392-75-2A, 06:H16 биотина A штамма, который экспрессирует CS1 и CS3 фимбри, но не вырабатывает LT или ST. Использованная ранее, как живая оральная вакцина, единичная доза E1392-75-2A обеспечивала существенную защиту добровольцев против экспериментального заражения LT+/ST+ ETEC штаммом серотина 0139:H28, который экспрессирует CS1 и CS3. (Бактерии E1392-75-2A были инактивированы формалином исследователями в US Army vaccine production Facility of the Water Red Army Institute of Research at Forest Gleu, Mauyland). Три дозы вакцины /каждая из которых содержала 5 • 1010 инактивированных бактерий /с NaHCO3 давались Такетом с сотр. с двухнедельными интервалами девяти добровольцам. Существенное повышение содержания CFA антител детектировали в сыворотке двух из девяти вакцинированных, тогда как четыре из девяти показали повышения содержания кишечных SIgA анти-фимбриальных антител. Было предпринято некоторое исследование повторного заражения, в котором четырех вакцинированных и десять контрольных добровольцев повторно заразили патогенным штаммом ETEC E24377A /0139:H28, CS1, CS3, LT+/ST+/. Не было свидетельства какой-либо защиты: диаррея наблюдалась у двух из четырех вакцинированных и у шести из десяти контрольных.
Что касается экспрессии CFA в жидкой среде, об этом нет сообщений. Действительно, до сих пор такая экспрессия не считалась возможной, так как известно, что жидкая среда подавляет экспрессию CFA, и вместо этого стимулирует экспрессию чувствительного к маннозе пилия типа 1 /7/.
Исходные попытки разработать прототип вакцин на основании ETEC, экспрессирующих различные CFA и OS протеины /8/, пришлось основать на росте организмов на твердых агарных пластинах, которые серьезно препятствуют возможности крупномасштабного производства вакцины. В настоящем изобретении мы разработали способ, который позволяет одинаково хорошо экспрессировать CFA на ETEC при выращивании в жидкой среде в культуре со встряхиванием, так и в оптимальных промотирующих CFA рост на агарных пластинах условиях, и мы также показали, высокий уровень экспресии CFA на E.coli в условиях выращивания в ферментере. Мы также описываем способ, с помощью которого эти E.coli, выращиваемые в ферментере с жидкой средой, инактивируют формалином так, что обеспечивают безопасную нейтрализацию тестовых штаммов ETEC вакцин, и, в то же самое время, предохраняют и стабилируют CFA на бактериальной поверхности определенным контролируемым количественно образом.
Пояснения к чертежу. Взрослым шведский добровольцам проводили три иммунизации /I/ прототипом ETEC вакцины на 0, 14, 28 день и образцы кишечной жидкости отбирали непосредственно до 9 дней спустя для второй и третьей иммунизации. ELISA IgA титры против очищенных CFA/I, CFA/II /CS1+CS3/ и CTB/GM1-ELISA/ определяли и делили на полную А концентрацию для каждого образца.
Описание изобретения
Один аспект настоящего изобретения направлен на способ получения композиции вакцины против кишечных инфекций, вызываемых энгеротоксигенными E.coli бактериями у людей. В этом способе по крайней мере один E/coli штамм, выбранный из различных известных штаммов, каждый из которых обладает способностью экспрессировать определенный тип антигенов факторов колонизации, выращивать в соответствующих условиях в жидкой культуральной среде, обеспечивающей высокий уровень экспрессии указанного определенного типа антигенов факторов околонизации на поверхность бактерий E.coli до заранее определенной плотности, с последующим сбором и повторным суспендированием бактериальной культуры в физиологическом растворе, после чего к этой суспензии добавляют формалин при легком перемешивании окончательной концентрации 0,2М формальдегида, с последующим инкубированием при непрерывном перемешивании при 37oC в течение приблизительно 2 часов, с последующим инкубированием при 4oC в течение 24 - 48 часов, в результате чего получают нейтрализованный формалином штамм E. coli с практически сохранившимися патогенными и гемагглютинизационными свойствами указанного определенного типа антигенов фактора колонизации, после чего указанные нейтрализованные формалином бактерии E.coli смешивают с фармацевтически приемлемым эксципиентом и/или разбавителем до достижения соответствующей концентрации.
В одном варианте этого аспекта изобретения указанную жидкую культуральную среду, содержащую 1% /вес/объем/ казаминовых кислот, 0,15% /вес/объем/ дрожжевого экстракта, 0,4 мМ MgSO4, 0,4 мМ MnCl2 и деионизированную воду до pH 7,4, культивируют при интенсивном перемешивании или другим способом в условиях интенсивной аэрации при приблизительно 37oC в течение по крайней мере 4 - 6 часов перед тем, как собрать бактерии за счет центрифугирования или фильтрования или другими способами.
В другом варианте этого аспекта настоящего изобретения указанные штаммы, экспрессирующие определенные типы антигенов факторов колонизации, выбирают из антигенов факторов колонизации кишечника человека CFA/I, CFA/I /CS1, CS2, CS3/ и CFA/IV /CS4, CS5, CS6/.
Еще в одном варианте этого аспекта настоящего изобретения дополнительно добавляют нейтрализующий кислоту буфер, и необязательно дополнительные антигенные компоненты, стимулирующие выработку иммунитета против эндотоксинов кишечника.
Другой аспект настоящего изобретения направлен на способ предотвращения кишечных заболеваний, вызываемых энтеротоксигенными E.coli бактериями у человека, в котором подходящее количество композиции вакцины, содержащей, в качестве иммунизирующего компонента по крайней мере один инактивированный штамм E. coli, выбранный из различных известных штаммов, каждый из которых обладает способностью экспрессировать определенный тип антигенов факторов колонизации, и каждый из которых практически сохраняет антигенные и гемагглютинизационные свойства указанных некоторых типов антигенов факторов колонизации, вводят человеку для предотвращения указанного заболевания.
В предпочтительном варианте этого аспекта изобретения способ введения композиции является оральным.
Описанные процедуры, с помощью которых в ферменте выбранные штаммы бактерий E. coli можно выращивать до высоких плотностей в жидкой среде без потери способности экспрессировать различные CFA, включая CFA/I, CFA/II и CFA/IV, а затем обрабатывать таким способом, чтобы безопасно нейтрализовать организмы, при этом не разрушая CFA. Эти процедуры позволяют так инактивировать организмы E.coli, чтобы были безопасными неживыми оральными вакцинами против кишечных инфекций/диарреи, вызываемыми энтеротоксигенными E.coli бактериями у человека. Процедуры получения таких бактериальных компонентов вакцин и способы, используемые для доказательства их применимости, в качестве иммуногенов слизистой кишечника, включают следующее:
1. Способ достижения высокого уровня экспрессии различных целевых типов CFA/CFA/I, CFA/II и CFA/IV на E.coli организмах в процессе роста в жидкой среде, а не только на ранее описанных пластинах агара или других твердых средах.
2. Успешная адаптация этого способа для экспрессии с высоким уровнем этих CFA на E.coli, выращиваемых в жидкой среде в ферментере.
3. Способ инактивирования выбранных E.coli организмов с помощью формалина с почти полным сохранением иммунологической реактивности со специфическими антителами и гемагглютинационный активности различных CFA.
4. Тест, показывающий, что иммунизация кроликов выращенными в жидкости и обработанными формалином организмами E.coli служит источником равно высоких титров специфических антител против различных CFA, что дает иммунизация соответствующими живыми выращенными на агаре бактериями.
5. Тесты, демонстрирующие, что CFA обработанных формалином организмов вакцины обладают большей стабильностью нежели CFA необработанных живых бактерий, если организмы подвергают инкубированию в кислотном буфере или желудочно-кишечном соке человека.
6. Исследования, документирующие, что выращенные в жидкости, инактивированные формалином CFA организмы E.coli можно давать без заметных побочных эффектов людям-добровольцам в качестве оральной вакцины, и что введение двух-трех доз такой вакцины стимулируют образование IgA антител в кишечной жидкости, также как и появление специфических секретирующих антитела клеток в циркуляции против CFA вакцины.
Примеры
Было тестировано большое количество штаммов, экспрессирующих CFA/I, CFA/II /включая штаммы, экспрессирующие CS1, CS2 или CS3 отдельно, CS1+CS3 или CS2+CS3/ или CFA/IV /штаммы, экспрессирующие CS4+CS6 или CS5+CS6/. Эти штаммы содержат клинические изоляторы, полученные из различных частей мира, а также лабораторно-обработанные штаммы, и включают штаммы, представляющие различные пути получения энтеротоксина /LT+ST, LT или ST отдельно, и токсин-негативные производные/. Так как процедуры, описанные в последующих примерах 1 - 5, до тестированной степени, как было обнаружено, являются ценными для различных штаммов различных типов CFA или субтипов и профилей энтеротоксина, эксперименты, и полученные в этих примерах результаты будут ограничены представительными результатами, которые были получены с несколькими выбранными штаммами.
Пример 1. Экспрессия CFA на организмы E.coli после роста в жидкой среде во встряхиваемой культуре или ферментере.
Ранее используемые процедуры для экспрессии CFA на E.coli всегда базировались на росте организмов на твердых поверхностях, обычно так называемых CFA агарных пластинах /7/, так как было известно, что рост в жидкой среде обычно подавляет экспрессию CFA, и при этом облегчает экспрессию типа 1 пилия на E.coli бактериях. Для облегчения крупномасштабного производства ETEC вакцины мы разработали процедуры, которые позволяли бы достичь высокого уровня экспрессию различных CFA на поверхности E.coli, также в условиях роста в жидкой среде /во встряхиваемой в склянках культуре, или в ферментере/.
После безуспешной проверки нескольких различных обычно используемых бактериологических жидких сред и условий культивирования, мы остановились на следующей процедуре для достижения и документирования требуемых уровней экспрессии CFA на, исходно каждом из модельных штаммов SBL101/CFA/I, SBL102 и SBL103 /оба CFA/II/, после выращивания в жидкой среде. Затем с небольшой модификацией композиции среды для экспрессии CS5, мы также достигли хорошей экспрессии CFA/IV на других штаммах. Из замороженных лотов различных штаммов /хранили в глицерине при -70oC/ платиновую петлю кусочков инокулируют на CFA агарные пластины, которые инкубируют при 37oC в течение ночи. Колонии на пластинах проверяют экспрессию соответствующих CFA в прямом тесте на агглютинацию со специфическими моноклональными антителами против CFA/I, CS1, CS2, CS3, CS4, CS5 и CS6. Эти моноклональные антитела были получены в лаборатории заявителей. Затем бактерии на CFA агарных пластинах собрали с фосфатным буферированным физиологическим раствором /PBS/ и 5 - 10 • 109 организмов из этой суспензии добавили в качестве инокулюма в 400 мл жидкой среды. Состав этой CFA среды: Казаминовые кислоты 1% /вес/объем/, Дрожжевой экстракт 0,15% /вес/объем/, VgSO4 0,4 мМ, MnCl2 0,04 мМ, H2 деионизированная, pH 7,4. Склянки инкубируют со встряхиванием, 150 об/мин примерно 20 часов при 37oC, и к этому времени оптическая плотность для разбавления 1 : 10 этой суспензии становится приблизительно 0,25 - 0,5. Бактерии собирают центрифугированием при +4oC, бактериальные лепешки промывают один раз PBS, и бактерии снова седиментируют центрифугированием и повторно суспендируют в PBS до получения суспензии, которая в разбавлении 1 : 10 имеет оптическую плотность 0,285. Эту суспензию и для сравнения суспензию бактерий, собранных с параллельных культур штаммов на CFA агарных пластинах, доводят до такой же плотности, и тестируют в серийных разбавлениях на экспрессию соответствующих CFA. Для этих анализов используют как непосредственную агглютинацию моноклональными анти-CFA антителами, так и количественное CFA ингибирование ELISA, разработанное в лаборатории заявителей.
Полученные результаты приведены в табл. 2. Они показывают, что суспензии, полученные после выращивания организмов в склянках в жидкой среде, демонстрируют сравнимую экспрессию CFA /будучи доведенными до той же концентрации бактерий/ что и бактерии, выращенные на CFA агарных пластинах.
Плазмиды штаммов SBL102 и SBL103 кодируют различные CFA/II протеины, и кодируют также бактериальную устойчивость против ампицилина и канамицина. Поэтому были получены параллельные культуры этих штаммов в жидкой среде и в агаре дополненные этими антибиотиками. Хотя значение в табл. 2 представляют значения, полученные без антибиотиков, те, которые были получены с антибиотиками оказались практически идентичными /не показаны/. Аналогично, условия роста в жидкой среде, которые использовали для экспериментов, указанных в табл. 2, как показано, одинаково удовлетворительны как для роста на CFA агарных пластинах для экспрессии CFA/I, CFA/II и CFA/IV /каждого из субпротеин CS4, CS5 и CS6/, из ряда других тестированных штаммов; для оптимальной экспрессии CS5 как CFA агар, использованный для этой процедуры, так и жидкая CFA среда, были дополнены 0,15% Bacto Bile солями 1,5 г/л /Дифко/.
В последующих экспериментах эту процедуру для экспрессий с высоким уровнем CFA на ETEC в жидкостных культурах приспособили для выращивания в жидкой среде в ферментере. Приводимая далее процедура была для CFA/I штамма, но она найдена одинаково полезной для других штаммов, продуцирующих CFA/II или CFA/IV, и было обнаружено, что она приводит к аналогичной экспрессии CFA для ряда бактерий, независимо от того, выращивают их на CFA агаре, или в культурах со встряхиванием.
CFA агарные пластины инокулируют штаммом SBL101 /1/ и выращивают при 37oC в течение ночи; в качестве инокулюма используют замороженные бактерии. Эти бактерии собирают с агарных пластин физиологическим раствором, и 5 • 1010 бактерий добавляют в качестве инокулюма в 4 литра CFA среды; в качестве инокулюма можно также использовать лог-фазу шейковой культуры бактерий в CFA среде. Затем бактерии помещают в ферментер Bio-flo III / New Brunswick Scientific Co, Edison, N. J., USA/, выращивают при 37oC при интенсивном перемешивании /800 об/мин/, не устанавливая pH. Уже через 4 - 5 часов после начала ферментного культивирования оптическая плотность культуры составляет 4 - 5, то есть 1 : 10 разбавление суспензии дает 0,4 - 0,5. После продолжения культивирования в ферментере в течение 20 часов не наблюдается повышения оптической плотности. Образцы, собранные из ферментера, с различными интервалами после начала культивирования - и для сравнения суспензии бактерий, приготовленные из шейковой культуры /в склянках/ для того же бактериального инокулюма, тестируют на экспрессию CFA/I после доведения до одинаковой концентрации бактерий, то есть 1010 бактерий на мл. Как видно из табл. 3, экспрессия CFA/I /на число бактерий/ оказывается оптимальной уже после 4 - 5 часов культивирования в ферментере, и сравнимой с CFA/I экспрессией демонстрируемой бактериями, выращенными в шейкерных культурах в склянках в течение 20 часов.
Пример 2. Процедура инактивации формалином бактерий E.coli с сохранением CFA иммунореактивности, а также гемагглютинирующей активности.
С неудовлетворительными результатами были испробованы различные физические и химические способы инактивации, включая обработку формалином в различных условиях, прежде чем была найдена подходящая процедура, описанная в этом примере. Эта процедура, которая включает мягкую обработку формалином при различных температурых в течение нескольких дней, отвечает критериям получения полностью нейтрализованных мнимых E.coli организмов вакцины, без существенных потерь их CFA антигена или качества. Это проверяют, определяя количество различных CFA на бактериях перед и после обработки формалином, используя количественное CFA ингибирование ELISA на основе моноклональных антител против различных CFA/CS компонентов, как указано в примере 1. Этот способ позволяет определить CFA на бактериальной поверхности. Набор требований включает то, что бактериальный препарат после нейтрализации должен сохранить по крайней мере одну треть содержания CFA антигена по сравнению с живыми исходными организмами, а тажке должен сохранить определенную гемагглютинирующую активность, вдобавок к сохранению CFA антигенности.
Нижеследующий пример описывает процедуру и ее использование более подробно. Бактерии, экспрессирующие либо CFA/I, либо CFA/II/CS антигены, выращивают в жидкой среде и суспендируют в PB, используя те же процедуру, которая была описана в примере 1. После этого к суспензии добавляют формалин при легком перемешивании бактериальной суспензии по конечной концентрации 0,2 М формальдегида. Затем эту суспензию инкубируют при непрерывном перемешивании при 37oC в течение примерно 2 часов, после чего ее переносят в холодную комнату, и выдерживают при 4oC в течение еще 24 - 48 часов. После завершения инкубирования с формалином, субобразцы удаляют и тестируют на отсутствие живых организмов путем культивирования как в бульоне, так и на агарных пластинах; агарные пластины и склянки с бульоном исследуют ежедневно в течение 14 дней. Эта процедура соответствует полной нейтрализации всех тестированных организмов E.coli.
После завершения обработкой формалином на холоде, суспензию бактерий анализируют на содержание CFA с помощью изучения гемагглютинационной активности соответствующих образцов /7/, и способности ингибировать связывание соответствующих моноклональных антител в CFA ELISA, как было описано в /9/. Необработанные свежеприготовленные культуры соответствующего штамма, концентрация бактерий в которых доводится до того же значения, что и у обработанных формалином организмов, были включены в каждый из экспериментов для сравнения. Как видно из табл. 4, обработанные формалином препараты сохраняют гемагглютинирующую способность и имеют по крайней мере 50% сохраненной CFA антигенности по оценкам соответствующих тестов по ингибированию CFA ELISA. Результаты, доказывающие, что обработанные формалином бактерии ингибируют связывание соответствующих моноклональных антител со связанными с твердой фазой очищенными CFA на 50% концентраций, соответствующих концентрациям до 50 - 100% для необработанных бактерий, были проверены в ряде последующих экспериментов.
Пример 3. Сравнение стабильности при хранении/инкубировании CFA обработанных формалином и необработанных /живых/ ETEC организмов.
Исследования в других лабораториях показали, что выделенные необработанные CFA фимбрии весьма чувствительны к желудочной кислоте (4, 5). Предварительная нейтрализация желудочной кислоты до нейтральных значений pH, по-видимому, не предотвращает ее вредное воздействие на CFA антигенность фимбриального протеина (4). Против этих известных фактов мы сравнивали антигенность CFA как экспрессированных на необработанных E.coli бактериях, так и на соответствующих обработанных формалином. E.coli после инкубирования в кислотном желудочнокишечном соке и жидкости из тощей кишки, соответственно. Образцы также инкубировали в PBS доведенном до различных значений pH.
В начальных экспериментах различные необработанные и обработанные формалином бактериальные суспензии инкубировали при различных pH, от 3 до 11, в течение 30 минут при 37oC до того как pH изменяли до нейтрального значения. Ни в одном случае инкубирование при этих pH не повлияло на CFA антигенность как необработанных, так и нейтрализованных формалином бактериальных препаратов. В последующих экспериментах инкубирование живых и инактивированных формалином бактерий в буфере при pH 2 в кислотном желудочно-кишечном соке и в жидкости тощей кишки, сравнивали. Желудочнокишечный сок и жидкость из тощей кишки отбирали у взрослых шведов в больнице Sahlgrenska Hospital в Гетеборге. Как видно из табл. 5, обработанные формалином бактерии лишь весьма слабо или вовсе не изменились под действием инкубирования в буфере при pH 2, или в желудочнокишечном соке, и никакого снижения CFA антигенности не наблюдали после инкубирования в жидкости тощей кишки. С другой стороны, антигенность необработанных формалином живых бактерий в большинстве случаев была заметно снижена, как после инкубирования в буфере при pH 2, так и в кислотном желудочнокишечном соке. Эти анализы показывают, что обработка формалином защищает CFA фимбрии от разложения в желудочном соке.
Пример 4. Сравнение иммуногенных свойств CFA на обработанных формалином и необработанных (живых) ETEC
Было проведено сравнение способности обработанных формалином и необработанных (живых) CFA положительных E.coli бактерий вызывать реакции анти-CFA антител. Взрослым новозеландским белым кроликам весом 2 - 3 кг за один цикл иммунизации вводили подкожно соответствующие дозы (5 х 108 - 2 х 109 бактерий), обработанных или необработанных формалином (живых бактерий), исходные инъекции вводили в полном адьюванте Фреунда, вторые инъекции в неполном адьюванте, а послеюущие иммунизации без адьюванта. Обработанные формалином бактерии приготавливали за одну иммунизацию, а затем хранили при +4oC до использования; живые бактерии были свежеприготовлены в день каждой иммунизации. Обработанные формалином бактерии культивировали в CFA среде, а не обработанные живые бактерии в CFA агаре; как обработанные формалином, так и необработанные бактериидважды промывали PBS перед иммунизацией.
Кровь у животных отбирали непосредственно перед иммунизацией, а затем спустя 7 - 10 дней после последней инъекции. Сыворотку приготавливают и замораживают порциями при -30oC до анализов. Специфическую реакцию антител против CFA иммунизированных штаммов определяют, используя различные методы ELISA, ELlSA микротирование пластины покрывают очищенным CFA, например, CFA/I, CFA/II /CS1+CS3/, CS2+CS4 или CS5, растворенными в PBS до конечной концентрации 1 - 5 мкг/мл путем инкубирования пластин с CFA раствором при 37oC в течение ночи. Пятикратные серии разбавленной сыворотки титруют затем в пластинах, как было описано ранее /2, 3/. Титры определяют как обратную величину интраполированных разбавлений, которые дают поглощение на 0,3 над фоном, если энзим с его субстратом реагирует в течение 20 минут.
Ни один из преиммунизационных отборов крови не дал значительных уровней CFA антител, то есть CFA титров, превышающих 50. После завершения иммунизации, с другой стороны, все сыворотки имели титры антител против гомологичных CFA в интервале от 25000 до 300 000 /табл. 6/. Иммунизация обработанными формалином бактериями вызывала весьма схожие титры против гомологичных CFA, что и у соответствующих необработанных организмов /табл. 6/.
Пример 5. Тесты обработанных формалином ETEC на безопасность и способность стимулировать образование специфичных IgA антител в кишечнике человека.
Препараты ETEC вакцины, содержащей нейтрализованные формалином бактерии, экспрессирующие CFA/I, CS2, CS2 и CS3 /то есть штаммы SBL101, SBL102 и SBL103, представленные в табл. 1/ были получены в Национальной Бактериологической лаборатории Швеции для лабораторных клинических исследований. Этот компонент вакцины был выдан вместе с B-субъединицей холеры /CTB/I/. Исследования проводили на взрослых шведских добровольцах для проверки этой объединенной CFA-ETEC-CTB вакцины на безопасность и иммуногенность локально в кишечнике. Оценивали также реакции антител в сыворотке, а также продуцирование специфических антител периферическими лимфоцитами крови.
Каждый из добровольцев получал три оральные иммунизации 1011 нейтрализованными E. coli организмами и 1 мг CTB в каждой с двухнедельными перерывами между иммунизациями. Вакцины давали в 150 мл буферированного бикарбонатного раствора, используя те же самые цитратбикарбонатные таблетки /ACO, Стокгольм, Швеция/, что и для оральной вакцины холеры в полевых испытаниях в Бангладеш /1/. Образцы содержания в кишечнике и сыворотку отбирали непосредственно перед и 9 дней спустя после второй и третьей иммунизации; лимфоциты периферической крови получали в день начала иммунизации и спустя 7 дней после первой, второй и третьей иммунизации.
Реакция IgA антител кишечника против большинства важных защитных антигенов исследовали в кишечной жидкости, как было указано ранее /2/. Кишечную жидкость получали, позволяя добровольцам пить изотонический солевой раствор /обычно 3 - 5 литров/ до начала водяной диарреи. Собираемый жидкий стул фильтровали через марлю, обрабатывали различными инактиваторами энзимов, центрифугировали и концентрировали сушкой вымораживанием. В предыдущих исследованиях мы показали, что кишечная жидкость является богатым источником локально продуцируемых секреторных IgA антител против вводимых в кишечник антигенов: секреторные IgA антитела, синтезируемые локально в кишках, вероятно, имеют наиважнейшее значение для защитного иммунитета против ETEC диарреи. Иммуноциты, стимулированные локально в кишечнике, например, при оральной вакцинации, обычно ингибируют через лимфу в кровь, и затем возвращаются в кишечник, где они созревают в, главным образом, IgA секретирующие клетки плазмы. При сборе лимфоцитоз периферической крови в определенное время рано после оральной вакцинации - оптимально на 7 день /10/ - можно получить эти кишечные секретирующие антитела клетки /ASC/ и проанализировать на предмет продуцирования специфических антител против антигенов, использованных для стимуляции. И наконец, в меньшей степени, антитела сыворотки определенного IgA класса также могут отражать такую кишечную иммунную реакцию.
26 добровольцев получили три дозы вакцины. Ни в одном из случаев не наблюдалось локальной и системной вредной реакции, которую можно было бы связать с указанной иммунизацией. Исследовали кишечную жидкость, полученную у 11 из вакцинированных на антитела против CTB/LT, CFA/I, CFA/II и O-антигена одного из иммунизирующих штаммов /2/. Определяли специфические ELISA IgA титры, деленные на полное содержание IgA в каждом образце. Как показано в табл. 7, заметные реакции IgA антител наблюдались против CFA/I и CFA/I, а также против ICTB у большинства вакцинированных. Частоту реакций в кишечнике сравнивали с ранее наблюдавшимися в Бангладеш выздоровлением от инфекции CFA-позитивной E.coli. Величину реакций антител против CFA/I и CFA/II сравнивали /см. чертеж/ с ранее наблюдавшимися в Бангладеш случаями выздоровления от ETEC заболеваний. У добровольцев наблюдались также заметные кишечные реакции IgA антител на CTB компоненту вакцины /см. чертеж/, и эти реакции были выше, нежели анти-LT реакции, наблюдавшиеся после клинических ETEC заболеваний.
Полученные результаты показывают, что ETEC вакцина способна индуцировать существенные реакции CFA антител локально в кишечнике; такие реакции ранее было трудно вызвать у человека при оральном введении выделенных фимбрий /4, 5/. Иммунизация приводит также к появлению специфических ASC в крови по данным ELIS POT анализа /10/ против CFA/I, CFA/II и LT/CTB у большинства вакцинированных /табл. 7/. Повышенные количества анти-CFA ASC были отмечены после единичной дозы вакцины. Реакции CFA антител продуцирующих клеток были только слегка выше после второй и третьей доз, нежели после начальной иммунизации, тогда как оптимальное число клеток, продуцирующих анти-LT, было обнаружено после второй иммунизации. Анти-CFA антитела, которые при этом вырабатываются, были главным образом IgA классом, но были также обнаружены несколько ASC, продуцирующих IgA; анти-CTB ASC были преимущественно IgA изотипа, но были идентифицированы и некоторые клетки, продуцирующие IgA. Вакцина также служит источником заметных реакций антител сыворотки CFA, а также против CTB/LT у большинства добровольцев (табл. 7).
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОВЫШЕНИЯ ПРЕЗЕНТАЦИИ АНТИГЕНА ETEC CS6 НА КЛЕТОЧНОЙ ПОВЕРХНОСТИ И ПРОДУКТЫ, ПОЛУЧАЕМЫЕ НА ЕГО ОСНОВЕ | 2012 |
|
RU2628698C2 |
| АНТИГЕН HELICOBACTER PYLORI И ВАКЦИННАЯ КОМПОЗИЦИЯ | 1996 |
|
RU2195463C2 |
| ШТАММ МОЛОЧНОКИСЛЫХ БАКТЕРИЙ LACTOBACILLUS ACIDOPHILUS И КОМПОЗИЦИЯ ПРОТИВ ДИАРЕИ | 1993 |
|
RU2126446C1 |
| ШТАММ БАКТЕРИЙ ESCHERICHIA COLI КМ 148 - ПРОДУЦЕНТ ПРОТЕКТИВНЫХ АНТИГЕНОВ, ИСПОЛЬЗУЕМЫЙ ДЛЯ ИММУНОПРОФИЛАКТИКИ КОЛИБАКТЕРИОЗА И ХОЛЕРЫ | 2002 |
|
RU2232189C1 |
| КОМБИНАЦИИ ИЗ ДЕЛЕЦИЙ ГЕНОВ ДЛЯ ЖИВЫХ ОСЛАБЛЕННЫХ ВАКЦИННЫХ ШТАММОВ SHIGELLA | 2008 |
|
RU2467763C2 |
| МУТАНТ ЭНТЕРОТОКСИНА, ЭФФЕКТИВНЫЙ В КАЧЕСТВЕ НЕТОКСИЧНОГО ОРАЛЬНОГО СТИМУЛЯТОРА | 1995 |
|
RU2160606C2 |
| КОМПОЗИЦИЯ, СПОСОБ ЛЕЧЕНИЯ КИШЕЧНОЙ ИНФЕКЦИИ, СПОСОБ НЕСПЕЦИФИЧЕСКОЙ СТИМУЛЯЦИИ ИМVУННОЙ СИСТЕМЫ, СПОСОБ ДОСТАВКИ БИОЛОГИЧЕСКИ АКТИВНОГО МАТЕРИАЛА В ВЕРХНИЕ ОТДЕЛЫ ТОНКОГО КИШЕЧНИКА | 1992 |
|
RU2113220C1 |
| СПОСОБ ПОЛУЧЕНИЯ ЭШЕРИХИОЗНОГО АНАТОКСИНА | 2010 |
|
RU2432174C1 |
| ВАКЦИНЫ С АДЪЮВАНТОМ LTB | 1998 |
|
RU2211050C2 |
| Вакцина против рота-, коронавирусной инфекции и эшерихиоза крупного рогатого скота | 2018 |
|
RU2708891C1 |


Изобретение относится к медицине. Раскрыт способ получения композиции вакцины против кишечных инфекций, вызываемых энтеротоксигенными бактериями Е. coli у людей, Е. coli штаммы, выбранные из различных известных штаммов, каждый из которых обладает способностью экспрессировать определенный тип антигенов фактора колонизации, выращивают в жидкой культуральной среде. В конце нейтрализованный формалином штамм E. coli, обладающий практически сохраненными антигенными и гемогглютинационными свойствами указанного определенного типа антигенов фактора колонизации, смешивают с фармацевтически приемлемым эксципиентом и/или разбавителем. Способ обеспечивает возможность получения эффективной вакцины, способной индуцировать существенную защитную реакцию организма. 7 табл., 1 ил.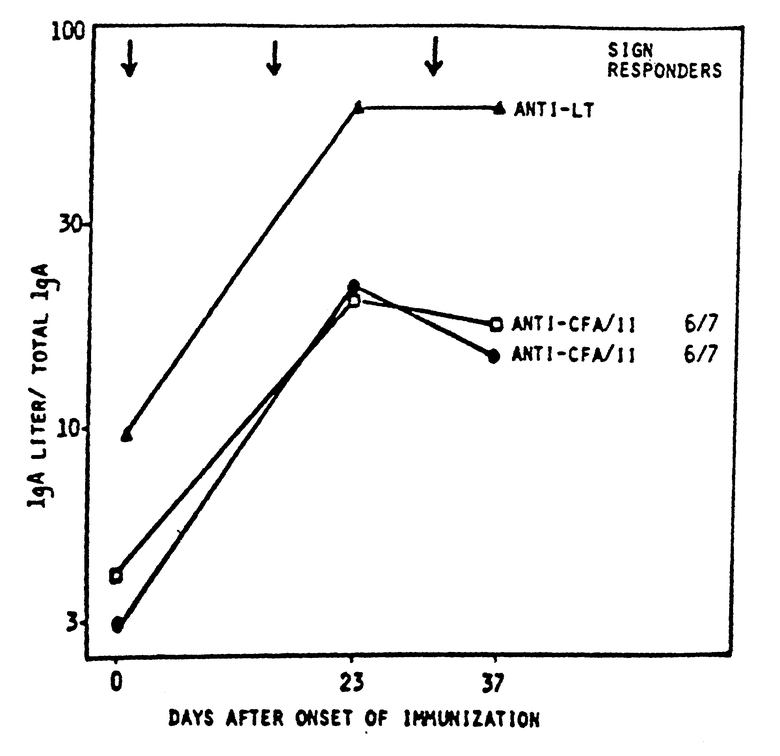
Способ получения вакцинной композиции против кишечной инфекции, вызванной энтеротоксигенными E. Coli у человека, предусматривающий выбор по крайней мере одного штамма E. Coli из различных известных штаммов, каждый из которых имеет способность экспрессировать определенный тип антлигенов фактора колонизации, выращивание его в жидкой культурной среде и осуществление гибели бактерий путем добавления формальдегида, отличающийся тем, что определенный тип антигенов фактора колонизации выбирают из антигенов фактора колонизации кишечника человека CFA/1F, CFA/II(CS1, CS2, CS3) и CFA/IV(CS4, CS5, CS6), причем жидкая культурная среда содержит 1% (вес/объем) казаминовых кислот, 0,15% (вес/объем) дрожжевого экстракта, 0,4 мМ MgSO4, 0,04 мМ MnCL2 и деионизированную воду при pH = 7,4, культивирование осуществляется до предопределенной плотности с сильным встряхиванием или с использованием других средств для интенсивной аэрации при примерно 37oC в течение по крайней мере 4 - 6 ч, затем бактерии собирают цетрифугированием, фильтрацией или с использованием других средств и ресуспендируют в физрастворе, после чего добавляют к суспензии формалин при слабом встряхивании до конечной концентрации формальдегида 0,2 М, затем инкубируют при непрерывном встряхивании при 37oC в течение примерно 2 ч, затем инкубируют при 4oC в течение 24 - 48 ч, получая убитый формалином штамм E. Coli, после чего убитые формалином бактерии E. Coli смешиваются с фармацевтически приемлемым эксципиентом и/или разбавителем до соответствующей концентрации.
| SU 4314993, 09.02.82, A 61 K 39/108 | |||
| US 4298597, 03.11.81, A 61 K 39/108. |
Авторы
Даты
1999-03-10—Публикация
1992-02-25—Подача