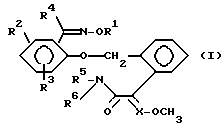
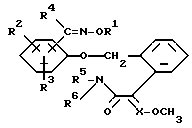
Изобретение относится к новым замещенным простым оксимовым эфирам общей формулы I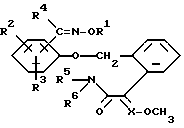
в которой
R1 обозначает C1-C6-алкил, C3-C6-алкенил, C3-C4-алкинил, C1-C6-галогеналкил, C3-C6-галогеналкенил, C1-C4-алкокси-C1-C6-алкил,
C1-C6-алкоксикарбонил-C1-C6-алкил, C3-C6-циклоалкил, C3-C6-циклоалкил-C1-C6-алкил, фенил-C1-C6-алкил, фенилокси-C1-C6-алкил, причем фенил может быть замещен галогеном; циан-C1-C6-алкил, фенил-C3-C6-алкенил, причем фенил может быть замещен галогеном, C1-C2-галогеналкилом; фуран-2-ил-C1-C6-алкил;
R2 и R3 являются одинаковыми или различными и обозначают водород, C1-C4-алкил, C1-C4-алкоксигруппу, галоген, циано или нитрогруппу;
R4 обозначает водород, C1-C6-алкил, C3-C6-циклоалкил, галоген-C1-C7-алкил, фенил;
R5 и R6 являются одинаковыми или различными и обозначают водород или C1-C4-алкил; и
X обозначает - CH или азот.
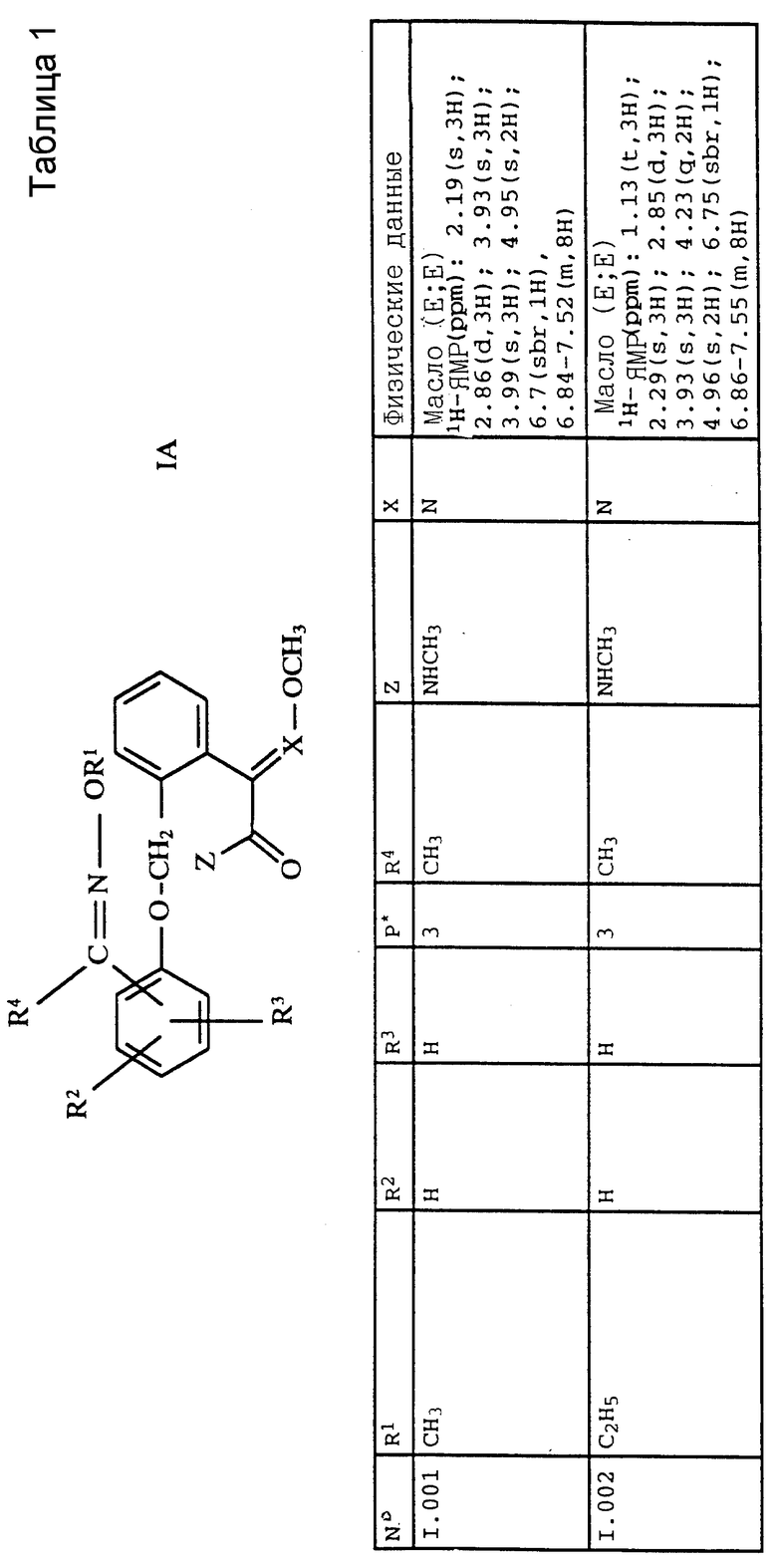
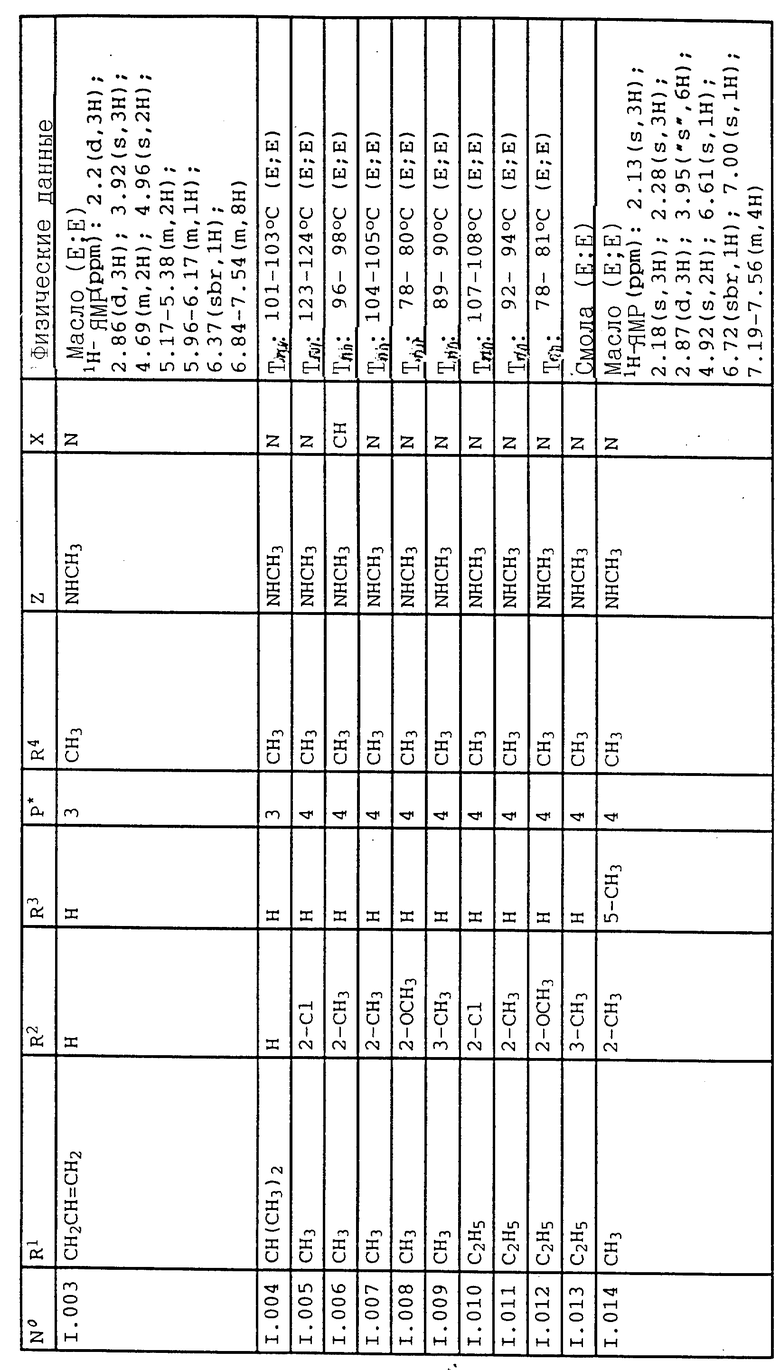
Предпочтительны простые оксимовые эфиры формулы I, выбранные из группы, где R1 обозначает метил, R2 - метил в положении 2, R4 и R6 обозначают метил, R3 и R5 обозначают водород, X обозначает азот, а оксиминоэтиловый радикал находится в положении 4,
или замещенные простые оксимовые эфиры формулы I, где R1 обозначает метил, R2 обозначает метил в положении 2, R4 и R6 обозначают метил, R3 и R5 обозначают водород, X обозначает - CH, а оксиминовый радикал находится в положении 4, или
замещенные простые оксимовые эфиры формулы I, где R1 обозначает метил, R2 обозначает метил в положении 2, R4 означает циклопропил, R6 обозначает метил, R3 и R5 означают водород, X означает азот, а оксиминоэтиловый радикал находится в положении 4, или
замещенные простые оксимовые эфиры формулы I, где R1 обозначает метил, R2 - метил в положении 2, R4 обозначает трифторметил, R6 обозначает метил, R3 и R5 обозначают водород, X обозначает азот, а оксиминоэтиловый радикал находится в положении 4.
Замещенные простые оксимовые эфиры формулы I согласно изобретению проявляют фунгицидную, инсектицидную и арахноицидную активность.
Изобретение также относится к фунгицидному, инсектицидному, арахноицидному средству, включающему активное вещество и инертные добавки, которое содержит в качестве активного вещества соединение формулы (I) в эффективном количестве.
Предлагаемые согласно изобретению соединения формулы I и композиции на их основе обладают улучшенными свойствами и более широким спектром действия для защиты растений по сравнению с известными аналогичными соединениями.
В частности, известно применение простых оксимовых эфиров, таких как, например, сложного метилового эфира О-метилглиоксима 2-(2'-метилфеноксиметил)-фенилглиоксиловой кислоты или сложного метилового эфира О-метилглиоксима 2-[2'-метил-4'-(метоксииминоэт-1''-ил)-феноксиметил] -фенилглиоксиловой кислоты в качестве фунгицидов (EP N 253213; EP N 398692).
Кроме того, в EP N 386561 описаны фунгицидные средства, содержащие соединения формулы IA,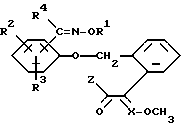
где Z означает метоксигруппу, в качестве фунгицидноактивных веществ.
Радикалы, приведенные в общих формулах I, могут иметь, например, следующее значение:
R1 может представлять собой, например, C1-C6-алкил, преимущественно C1-C4-алкил (например, метил, этил, н- или изопропил, н-, изо-, втор.- или трет. -бутил, н-, изо-, втор. - или неопентил, гексил), C3-C6-алкенил (например, аллил, 2-бутенил, 3-бутенил, 1-метил-2-пропенил, 2-метил-2-пропенил), C3-C4-алкинил (например, пропаргил, 2-бутинил), C1-С6-галогеналкил (например, 2-фторэтил), С3-C6-галогеналкенил (например, 3-хлораллил), C1-C4-алкокси-C1-C6-алкил (например, 2-метоксиэтил, 3- этоксипропил), C3-C6-циклоалкил (например, циклопропил, циклобутил, циклопентил, циклогексил), C3-C6-циклоалкил-C1-C4-алкил (например, циклопропилметил, циклогексилметил), циан-C1-C6-алкил (например, цианметил, 3-цианпропил), C1-C6-алкоксикарбонил-C1-C6-алкил (например, этоксикарбонилметил, трет.-бутоксикарбонилметил, трет. -бутоксикарбонилпропил), фенил-C1-C6-алкил (например, бензил, 2-фенилэтил, 3-фенилпропил, 4-фенилбутил), фенокси-C1-C6-алкил (например, феноксиметил, феноксиэтил, феноксипропил, феноксибутил), причем фенил может быть замещен галогеном, фенил-C3-C6-алкенил (например, 4-фенил-2-бутенил, 4-фенил-3-бутенил), причем фенил может быть замещен одним или несколькими радикалами, например от 1 до 5, в частности, от 1 до 3 радикалами из группы: галоген, C1-C2-галогеналкил (например, трифторметил, трихлорметил); или фуран-2-ил-C1-C6-алкил;
R2 и R3 могут быть одинаковыми или различными и обозначают водород, C1-C4-алкил (например, метил, этил, н- или изопропил, бутил), C1-C4-алкокси (например, метокси, этокси, н- или изопропокси, бутокси), галоген (например, фтор, хлор, бром, йод), циано или нитро;
R4 может быть, например, C1-C6-алкил, (C1-C4-алкил) (например, метил, этил, н- или изопропил, н-, изо-, втор.- или трет.-бутил, н-изо-, втор.-, трет. - или неопентил, гексил), C1-C7-галогеналкил (например, трифторметил, трихлорметил, хлорметил, 2-хлорэтил, 3-хлорпропил, 3-бромпропил, 4-хлорбутил, 4-бромбутил, 5-хлорпентил, 5-бромпентил, 6-хлоргексил, 6-бромгексил), C3-C6-циклоалкил (например, циклопропил, циклобутил, циклопентил или циклогексил), фенил;
R5 и R6 могут быть одинаковыми или различными и обозначают водород или C1-C4-алкил (например, метил, этил, н- или изопропил, бутил). Предпочтительными являются соединения формулы I, где R5 - водород и R6 - метил.
Радикал -C(R4)=N-O-R1 может находиться на фенильном радикале относительно -O-CH2 во втором, или в третьем, или, предпочтительно, в четвертом положении.
Новые соединения общей формулы I могут быть получены относительно двойных связей C=C или C=N в виде изомерных смесей E/Z, которые могут быть разделены на отдельные изомеры обычным способом, например путем кристаллизации или хроматографии. Как отдельные изомерные соединения, так и их смеси охватываются изобретением и являются пригодными в качестве фунгицидов и ядохимикатов. В случае группировки -C(CONR5R6)=X-OCH3 предпочтительными являются те соединения, в которых группы CONR5R6 и OCH3 относительно двойной связи C=X имеют конфигурацию E. В случае группировки -C(R4)=N-OR1 предпочтительными являются те соединения, в которых R4 и OR1 являются устойчивыми по отношению к двойной связи C=N и в связи с этим при небольших заместителях, как, например, метил, двойная связь C=N имеет конфигурацию E.
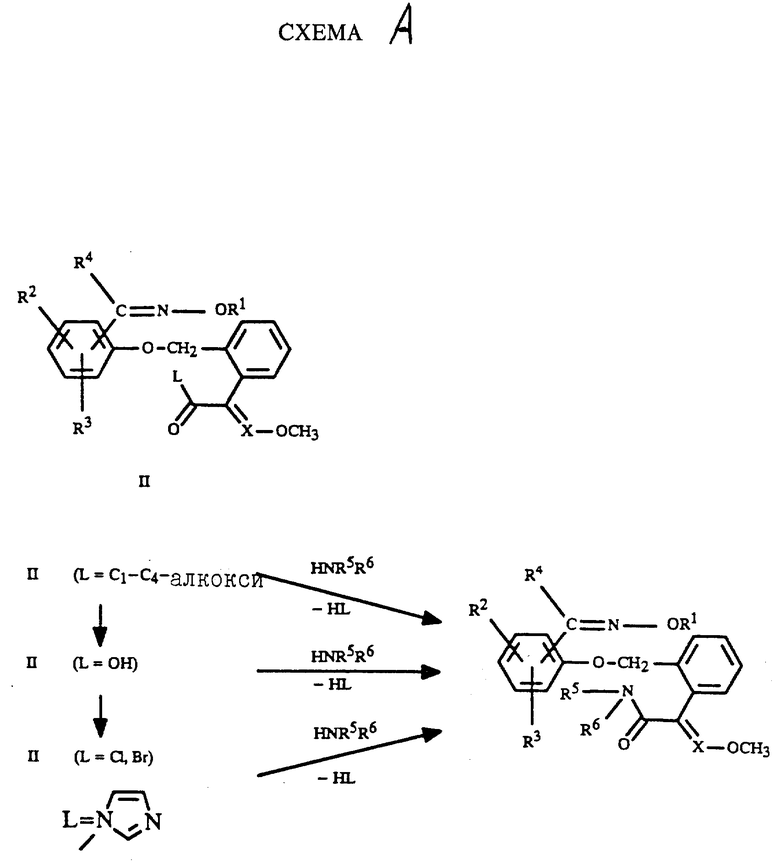
Получение новых соединений формулы I может быть осуществлено, например, следующим образом: замещенный простой оксимовый эфир общей формулы II, где L обозначает C1-C4- алкоксильную группу, гидроксильную группу или галоген, как, например, хлор или бром, обрабатывают первичным или вторичным амином формулы HNR5R6 в соответствии с приведенной схемой A (см. схему в конце текста).
Соединения формулы II, где L обозначает алкоксильную группу C1-C4, известны из EP N 386561 или могут быть получены аналогично описанному там способу. Из них легко могут быть получены соответствующие карбоновые кислоты N (L= OH) обычным способом (см., например, Houben Weyl, Bd E 5, S. 223-254; Org. Reactions 24, (1976), S. 187-224). Затем они могут быть переведены в активированные производные кислот, как, например, имидазолиды кислоты II, где L = имидазол-1-ил или галогениды кислоты II, где L = Cl, Br (Houben Weyl, Bd VIII, S. 463). Полученные соединения формулы II реагируют с первичным или вторичным амином HNR5R6 с получением соответствующего амида формулы I (Houben Weyl, Bd E 5, S. 941-977, S. 983-991; Houben Weyl, Bd VIII S. 654 ff).
R1, R2, R3, R4, R5, R6 и X имеют вышеуказанные значения.
Соединения формулы IA, в которой Z обозначает OR7, известны из Европейской заявки на патент 386561 или могут быть получены по описанным там методам.
Пример получения 1
Метиламид O-метилоксима 2-[2'-метил-4'-(метоксииминоэт-1''-ил)- феноксиметил]-фенилглиоксиловой кислоты
a) 225,3 г (1,5 моль) 4-окси-3-метилацетофенона растворяют в 600 мл сухого метанола. Добавляют 150,3 г (1,8 моль) гидрохлорида метоксиамина и 100 г молекулярного сита. Смесь перемешивают в течение 12 часов при комнатной температуре (20oC). Молекулярное сито отфильтровывают. Фильтрат концентрируют. Остаток забирают дихлорметаном. Органическую фазу промывают водой, высушивают и концентрируют. Полученный твердый продукт промывают пентаном и затем высушивают. Получают 252 г (94%) 4-окси-2-метилацетофенон-O-метилоксима в виде бесцветного кристаллического твердого вещества (температура плавления: 96-98oC).
b) 89,6 г (0,5 моль) 4-окси-3-метилацетофенон-O-метилоксима помещают в атмосфере азота в 300 мл сухого метанола. По каплям добавляют 90 г (0,5 моль) 30%-ного (весовой процент) раствора метанолята натрия. Через 2 часа метанол отгоняют. Остаток растворяют в 700 мл диметилформамида. Добавляют 15 г йодида калия. Затем при комнатной температуре в атмосфере азота по каплям добавляют раствор из 151,6 г (0,53 моль) 2-бромметилового сложного метилового эфира метилглиоксима фенилглиоксиловой кислоты в 300 мл метанола. Примерно через 10 часов перемешивания при комнатной температуре раствор охлаждают примерно до 10oC и по каплям добавляют воду. Полученный осадок отфильтровывают, промывают водой и пентаном и высушивают. Получают 153,7 г (80%) сложного метилового эфира O-метилглиоксима 2-[2'-метил-4'-(метоксииминоэт-1''-ил)- феноксиметил]-фенилглиоксиловой кислоты в виде бесцветного кристаллического твердого вещества (температура плавления: 138-140oC).
c) 4,8 г (0,012 моль) сложного метилового эфира O-метилглиоксима 2-[2'-метил-4'-(метоксииминоэт-1''-ил)-феноксиметил] - фенилглиоксиловой кислоты растворяют в 32 мл тетрагидрофурана и смешивают с 3,6 г (0,047 моль) 40%-ного водного раствора метиламина. Затем реакционную смесь перемешивают в течение 6 часов при 40oC. Затем смесь концентрируют. Остаток забирают простым метил-трет.-бутиловым эфиром. Органическую фазу промывают водой, высушивают и снова концентрируют. Оставшийся сырой продукт очищают хроматографическим путем через колонку с силикагелем (циклогексан/сложный этиловый эфир уксусной кислоты, 1:1). Получают 3,2 г (67%) метиламида O-метилоксима 2-[2'-метил-4'-(метоксииминоэт-1''- ил)-феноксиметил]-фенилглиоксиловой кислоты в виде бесцветных кристаллов (температура плавления: 104-105oC, соединение I.007).
Пример получения 2
Метиламид α-[2-[2′- метил-4'-(метоксииминоэт-1''-ил)-феноксиметил]-фенил] -β- метоксиакриловой кислоты
a) Сложный метиловый эфир α-(2- бромметилфенил) -β- метоксиакриловой кислоты и 4-окси-3-метилацетофенон-O-метилоксима преобразуют аналогично варианту b) (пример 1) в сложный метиловый эфир α-[2-[2′- метил-4'-(метоксииминоэт-1''-ил)-феноксиметил] -фенил] -β- метоксиакриловой кислоты. Соединение получают в виде бесцветного твердого вещества (температура плавления: 118-120oC).
b) 3 г (0,0078 моль) сложного метилового эфира α-[2-[2′-метил-4′- (метоксииминоэт-1''-ил)-феноксиметил] -фенил] -β- метоксиакриловой кислоты растворяют в 15 мл сухого пиридина. Добавляют 5,2 г (0,039 моль) безводного йодида лития и перемешивают в течение 8 часов при 130oC. Реакционную смесь концентрируют. Остаток забирают водой. Водную фазу сначала промывают простым метил-трет.-бутиловым эфиром и затем подкисляют соляной кислотой. Затем водную фазу экстрагируют с помощью простого метил-трет.-бутилового эфира. Фазу простого метил-трет. -бутилового эфира промывают водой, высушивают над сульфатом натрия и концентрируют. Получают 2,1 г α- [2-[2'-метил-4'-(метоксииминоэт-1''-ил)-феноксиметил] -фенил] -β- метоксиакриловой кислоты в виде темной смолы, которая без дальнейшей очистки применяется для последующих реакций.
c) 2,1 г (0,0056 моль) α- [2-[2'-метил-4'-(метоксииминоэт-1''-ил)- феноксиметил]-фенил] -β- метоксиакриловой кислоты и 0,53 г пиридина помещают в 10 мл сухого простого диэтилового эфира. При температуре 0-5oC по каплям добавляют 0,8 г (0,0067 моль) тионилхлорида и перемешивают в течение 10 часов при комнатной температуре. Затем отфильтровывают. Фильтрат концентрируют. Получают 2 г хлорангидрида α- [2-[2'-метил-4'-(метоксииминоэт-1"-ил)-феноксиметил] -фенил] -β- метоксиакриловой кислоты в виде темного масла, которое без дальнейшей очистки применяют для последующих реакций.
d) 1 г (0,0026 моль) хлорангидрида α- [2-[2'-метил-4'- (метоксииминоэт-1"-ил)-феноксиметил] -фенил] -β- метоксиакриловой кислоты помещают в 10 мл дихлорметана. При температуре 0-5oC по каплям добавляют раствор из 1 г (0,032 моль) метиламина в 10 мл дихлорметана. Перемешивают в течение 10 часов при комнатной температуре. Реакционную смесь собирают 20 мл дихлорметана, промывают водой, высушивают и концентрируют. Оставшийся сырой продукт очищают хроматографическим путем через колонку с силикагелем (н-гексан/ацетон, 2: 1). Получают 0,5 г (50%) метиламида α- [2-[2'-метил-4'-(метоксииминоэт-1''-ил)-феноксиметил] -фенил] -β- метоксиакриловой кислоты в виде бесцветных кристаллов (температура плавления: 96-98oC, соединение I. 006).
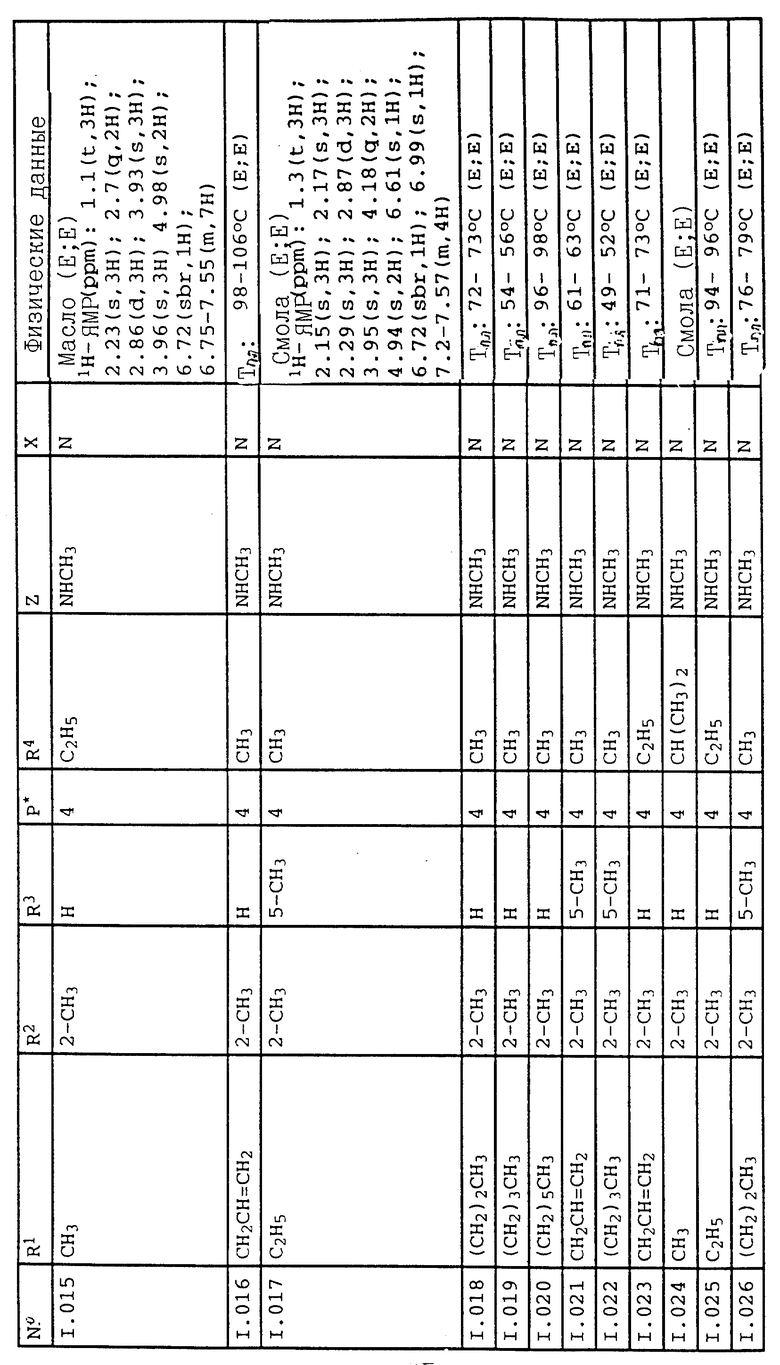
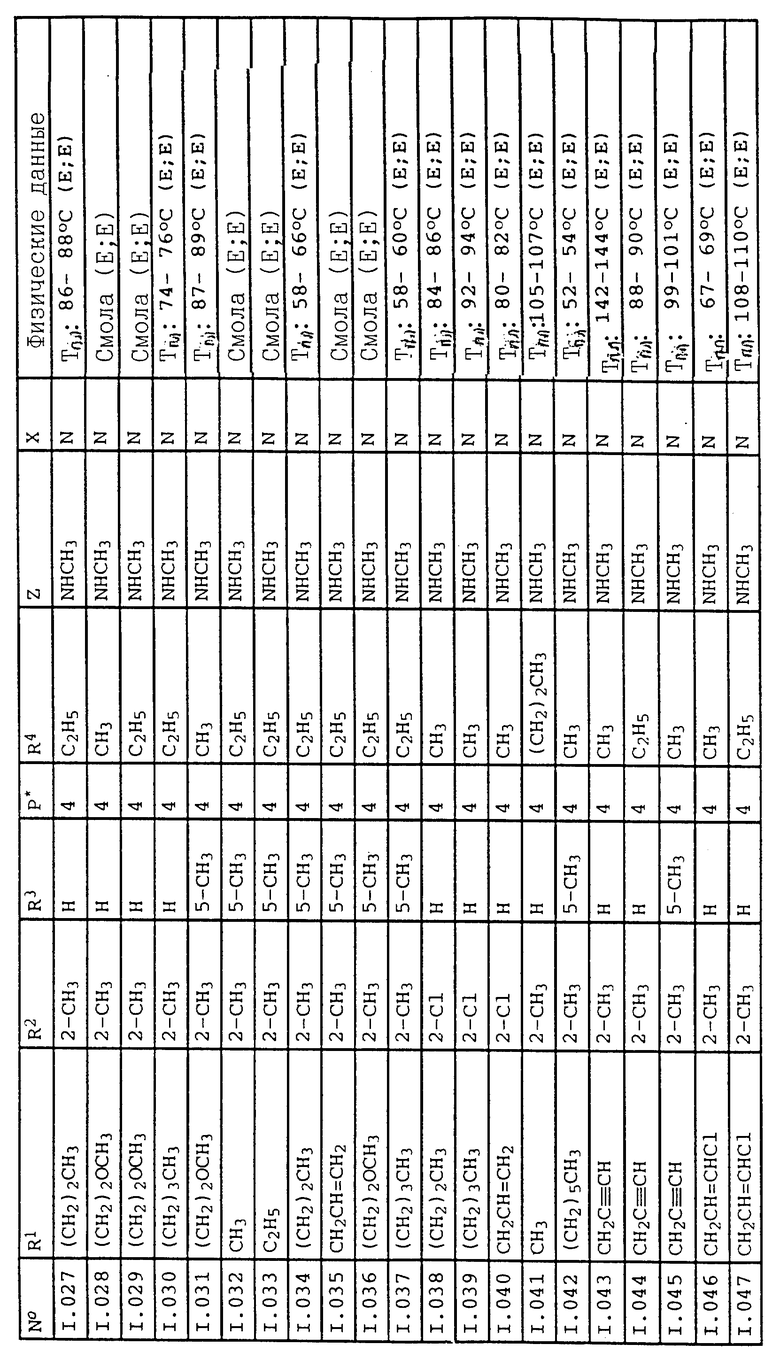
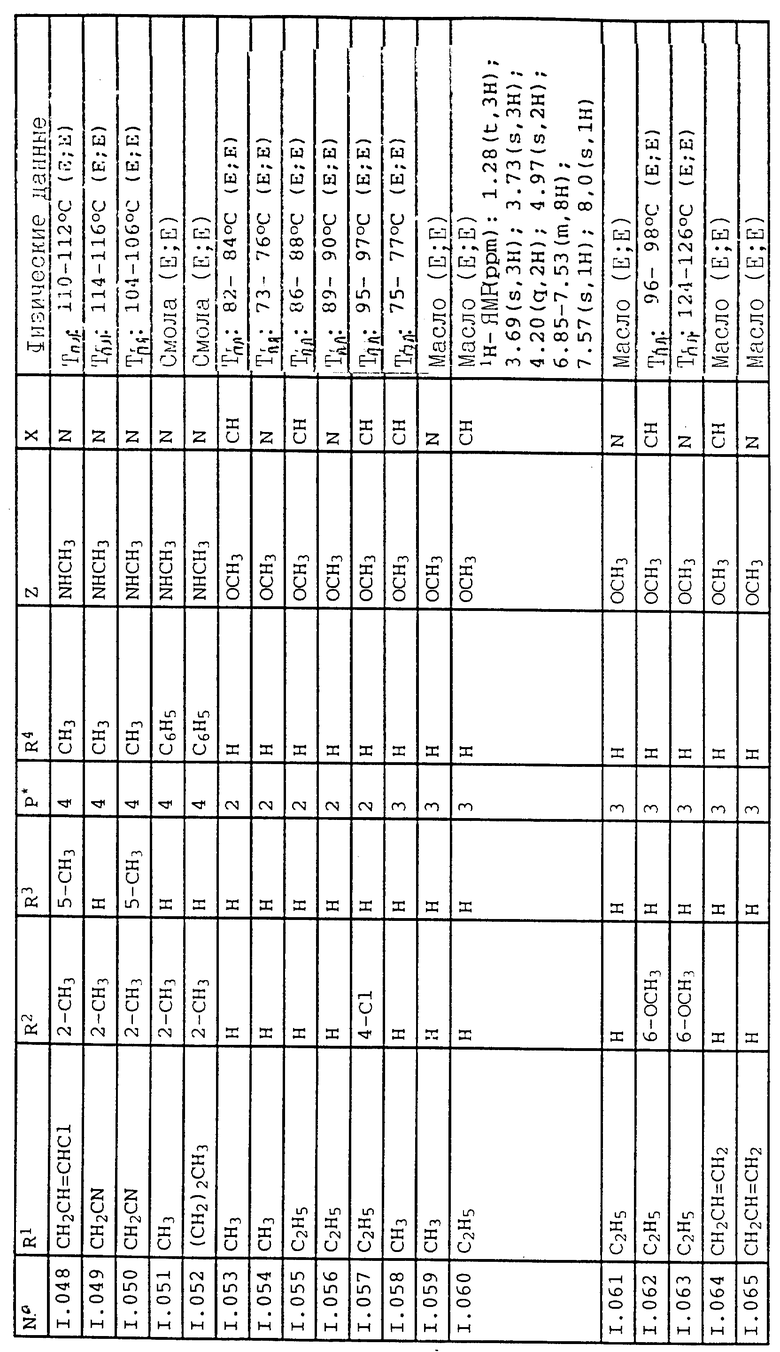
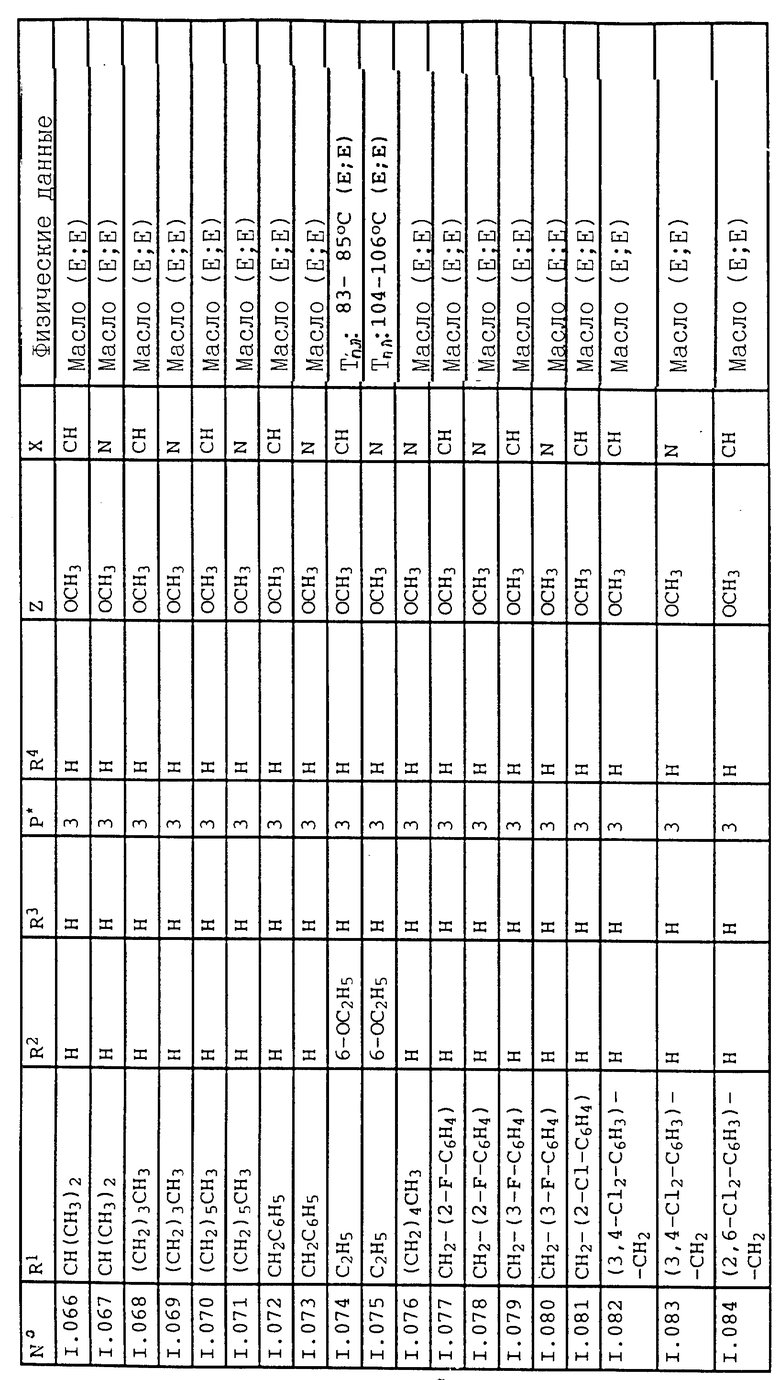
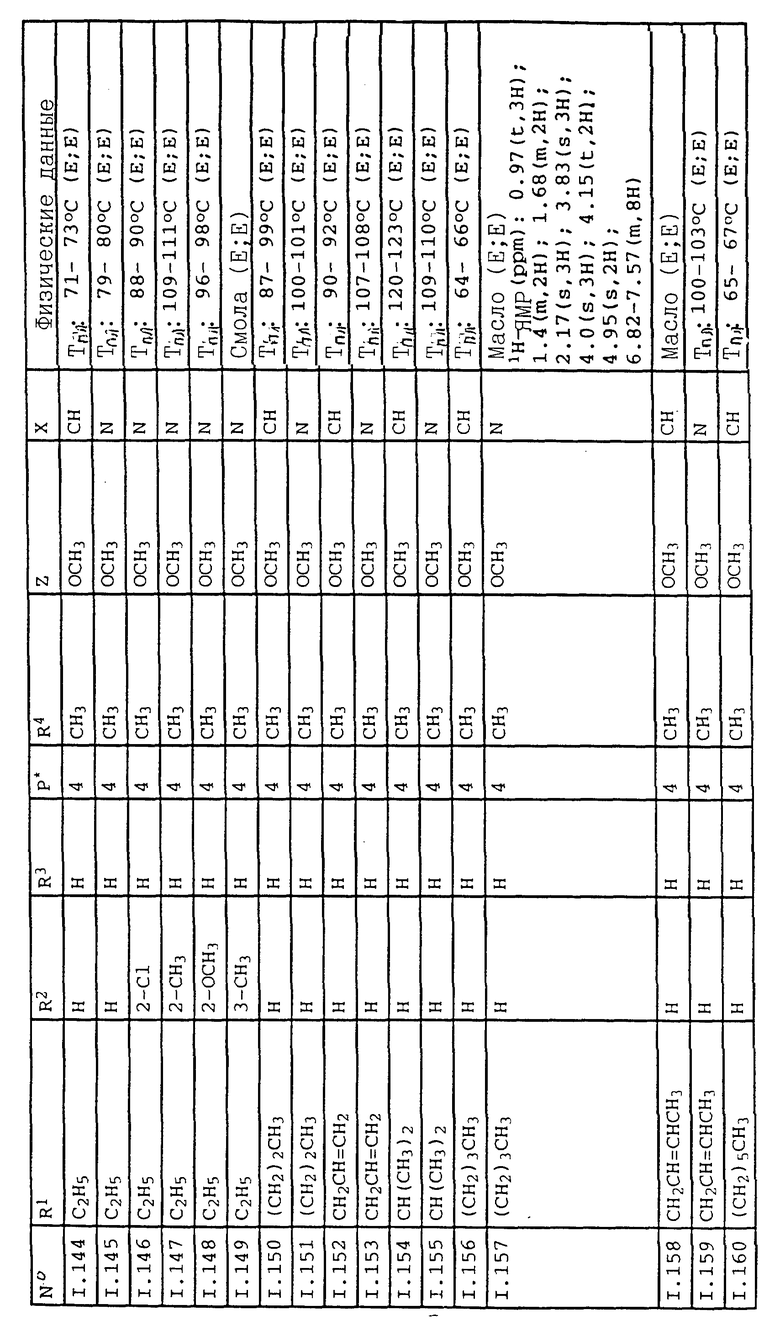
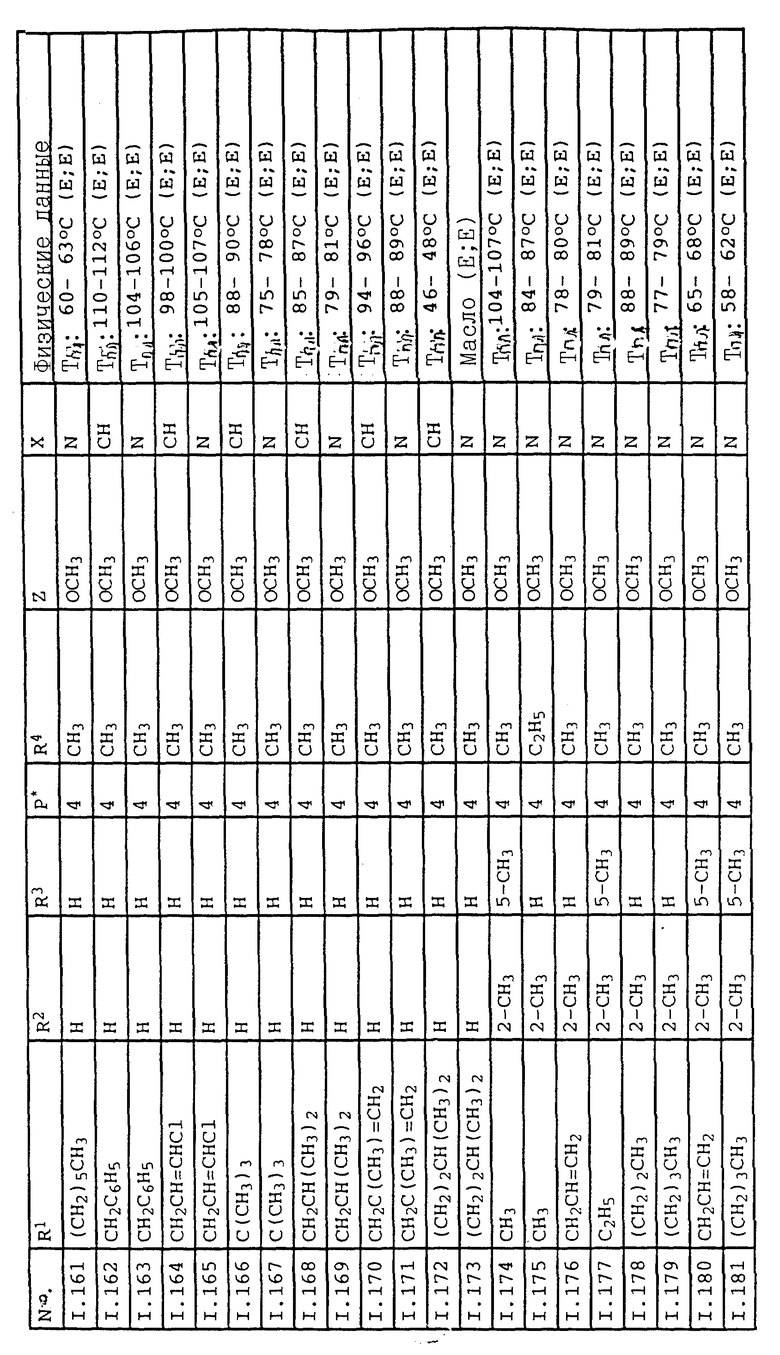
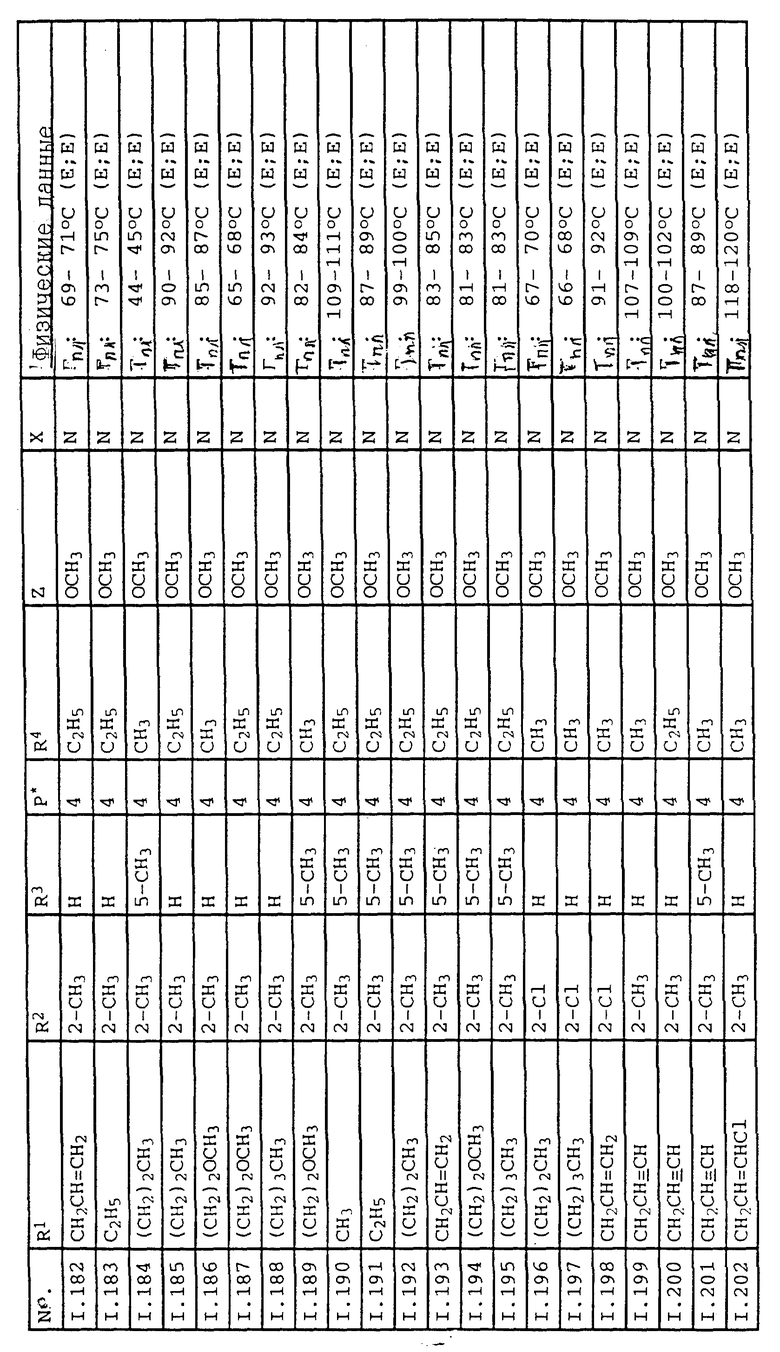
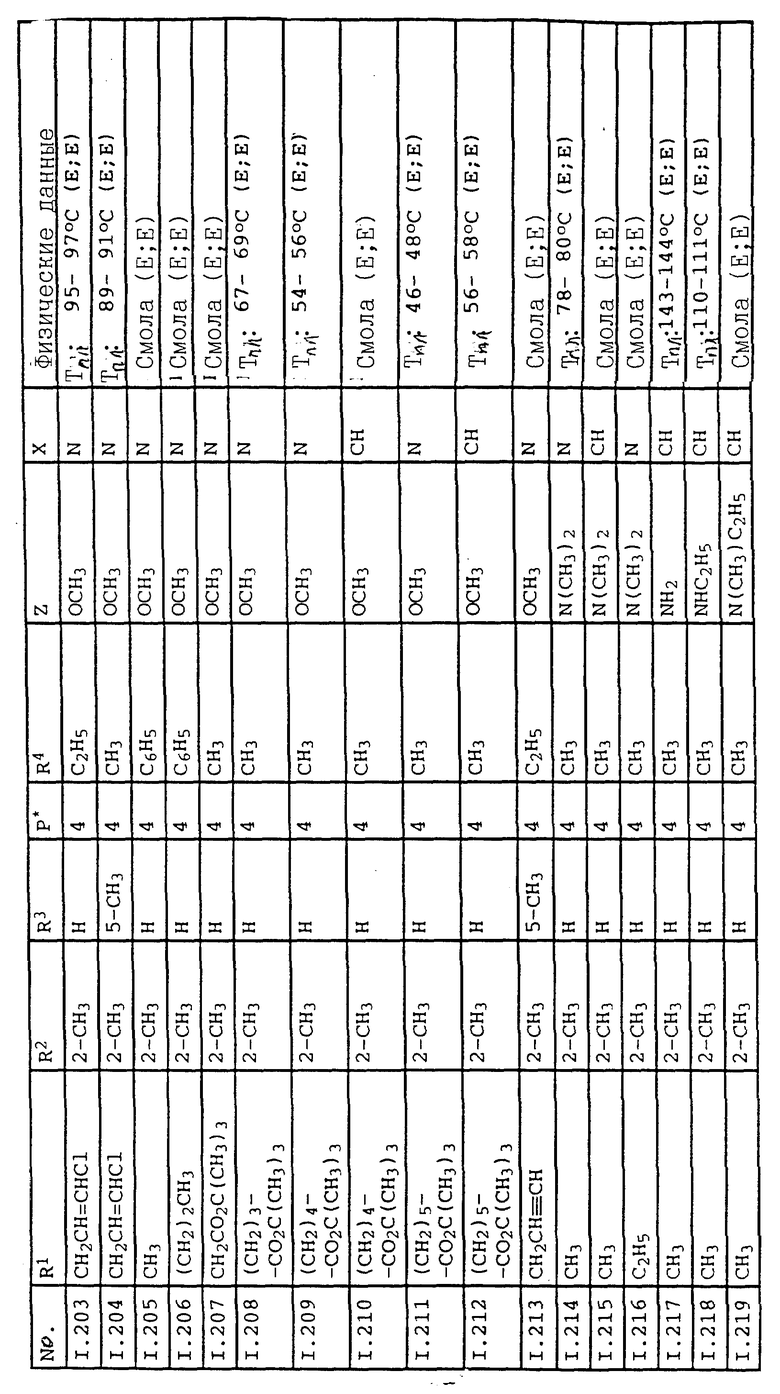
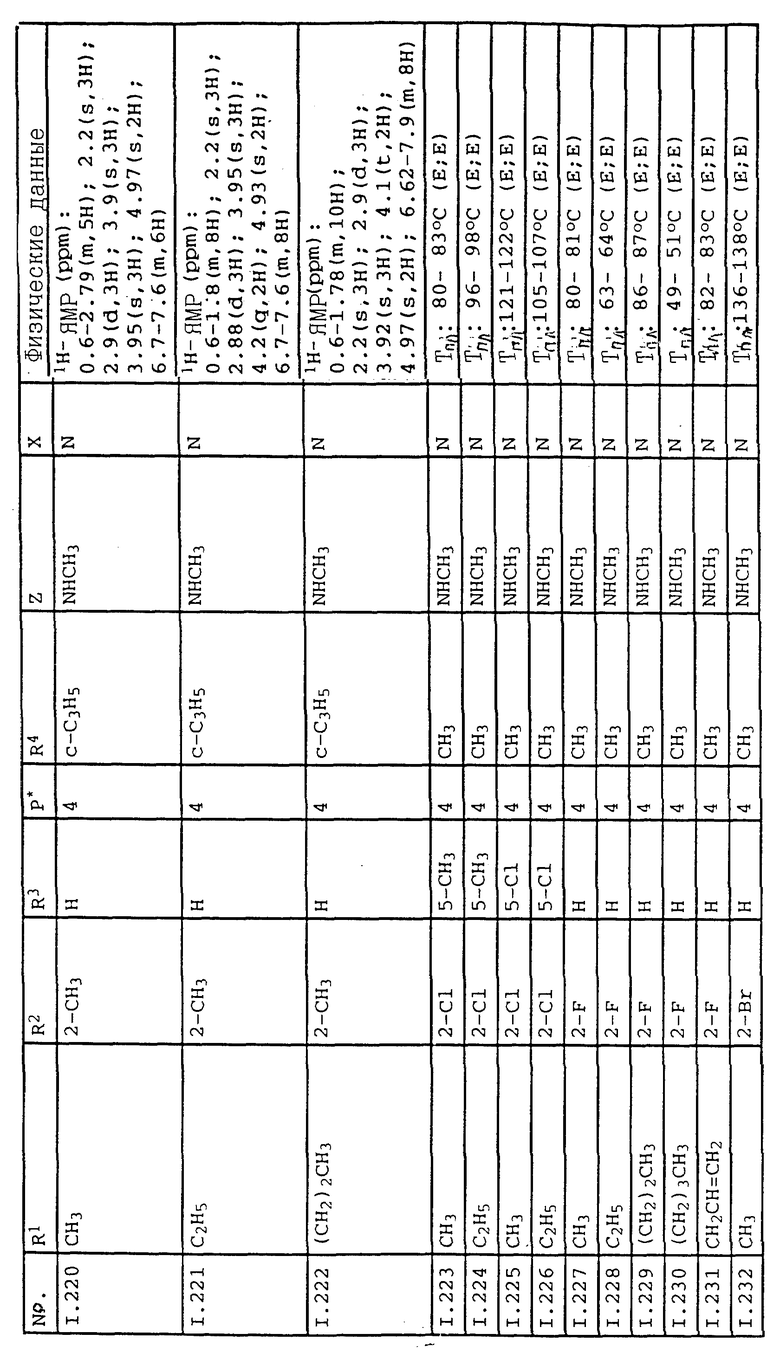
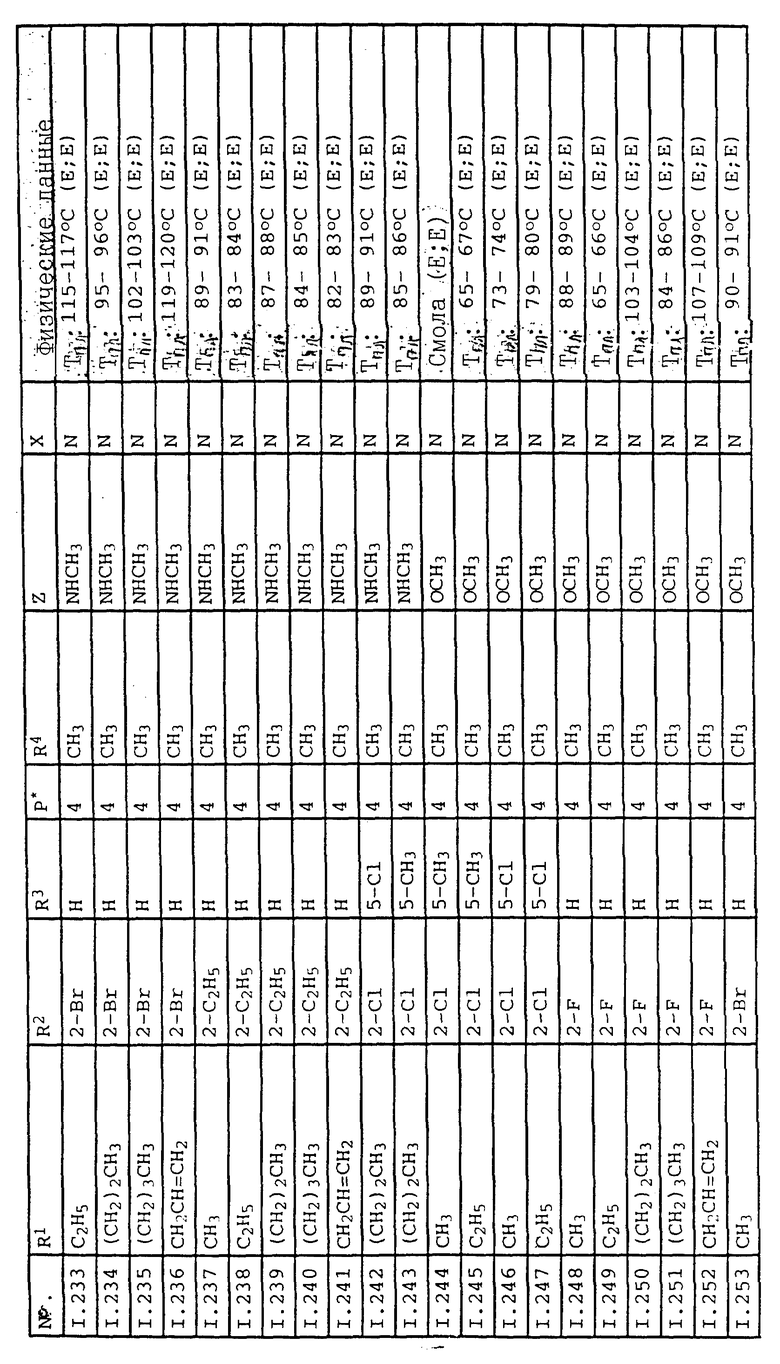
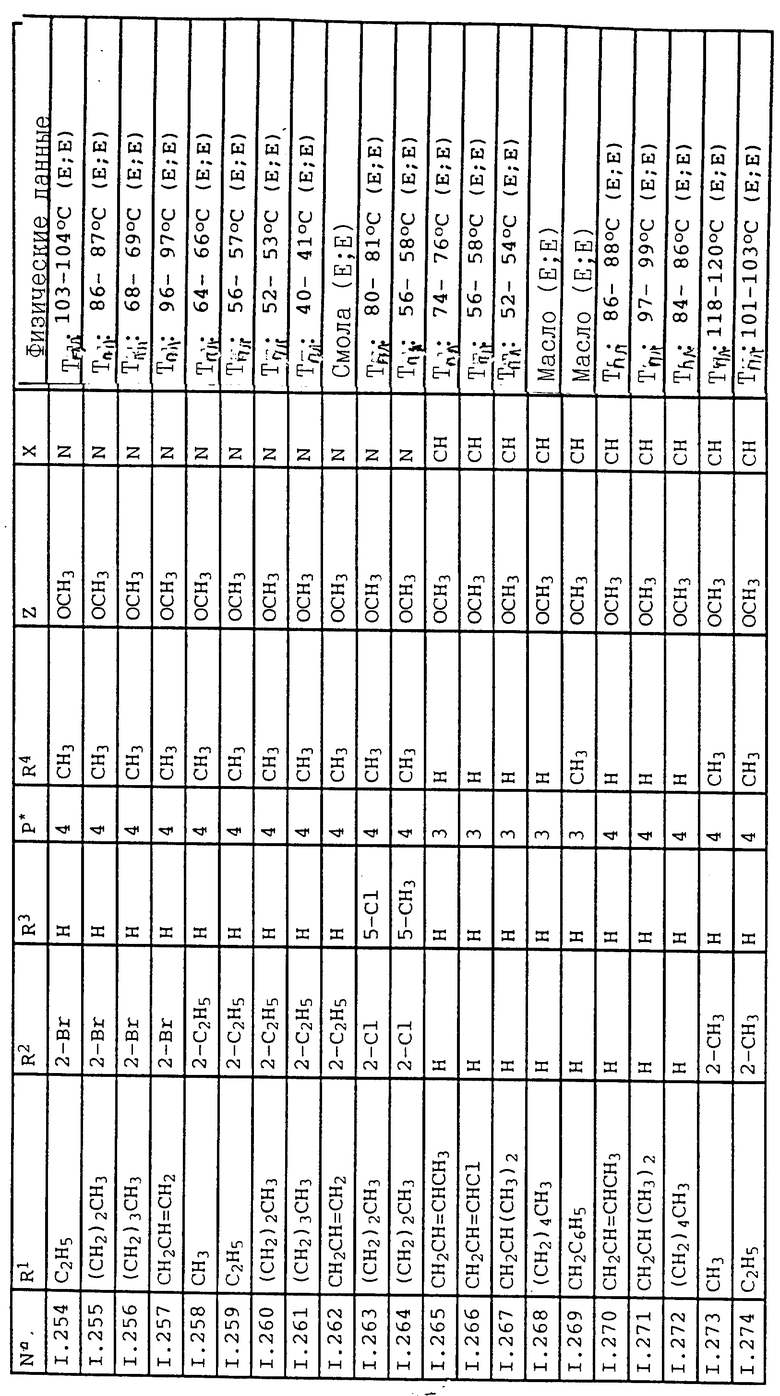
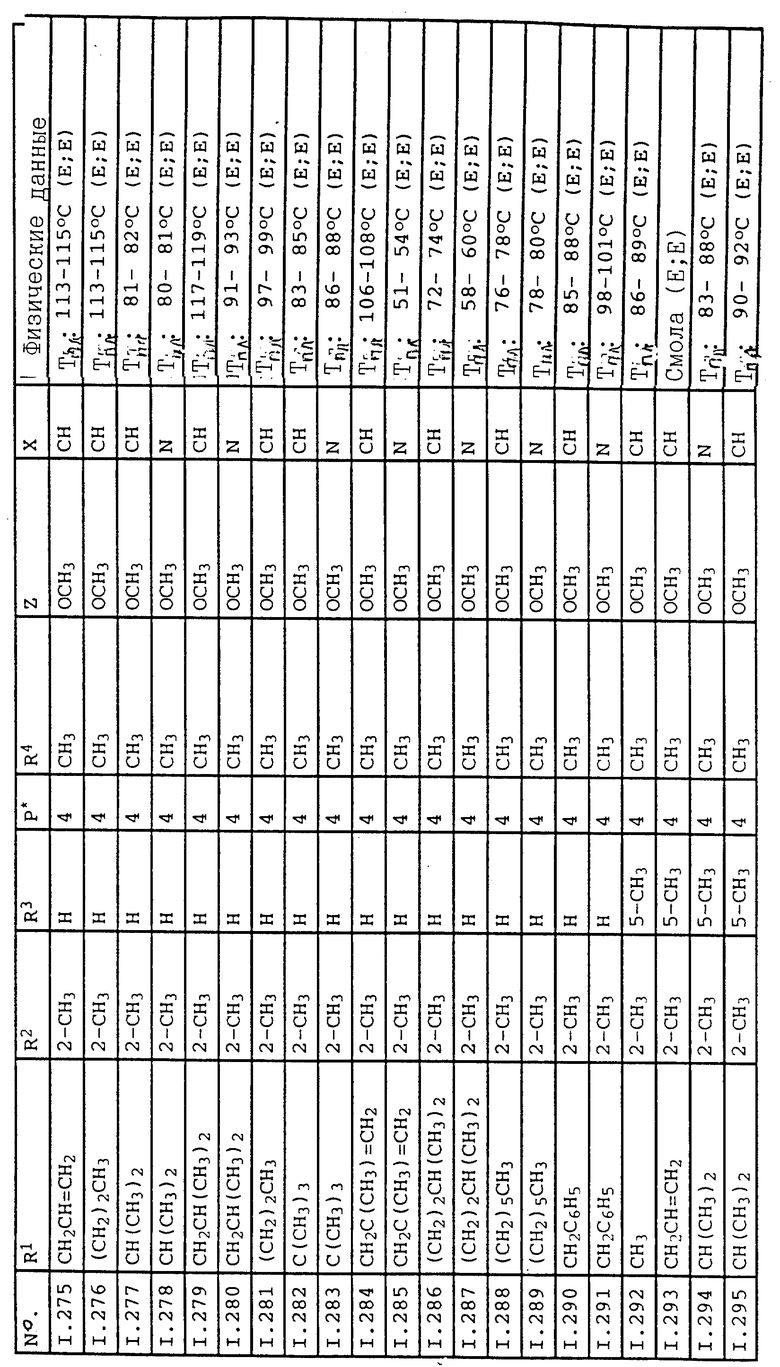
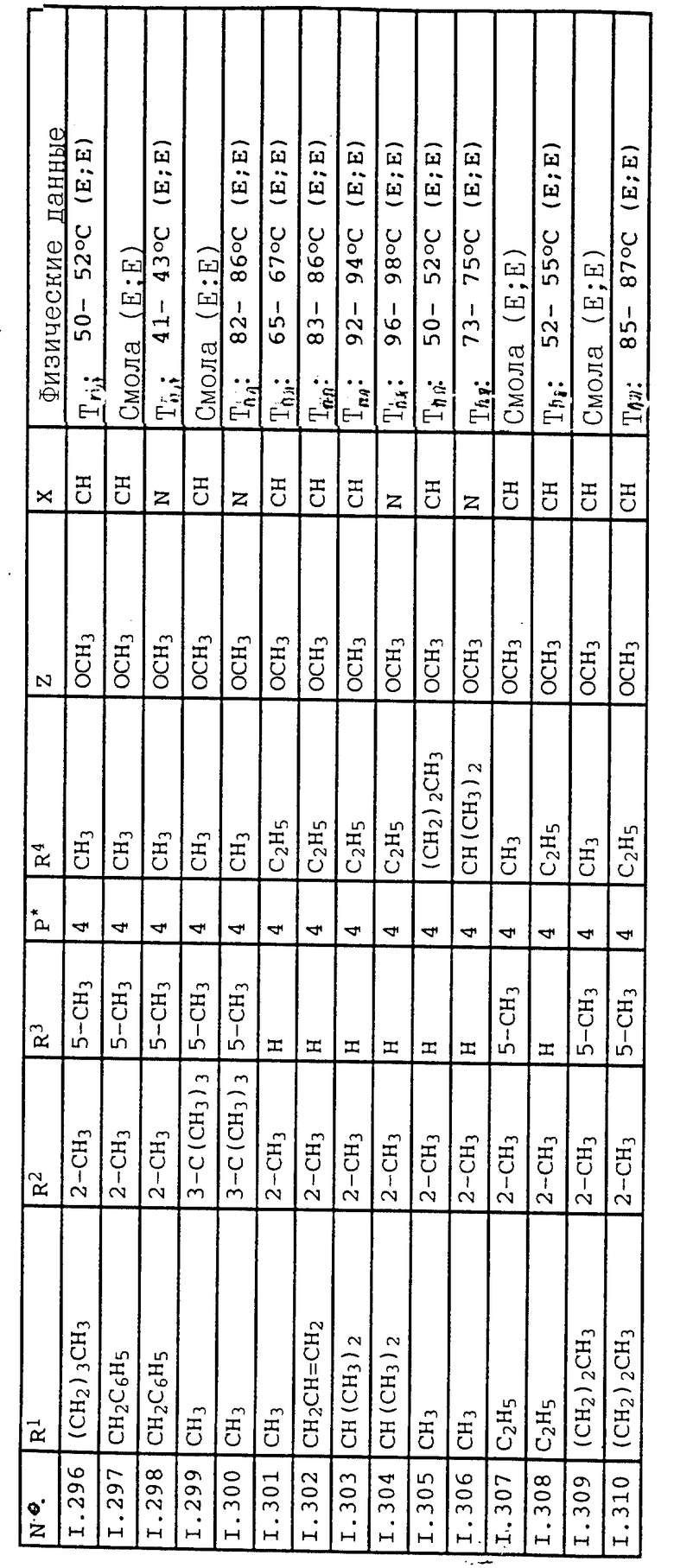
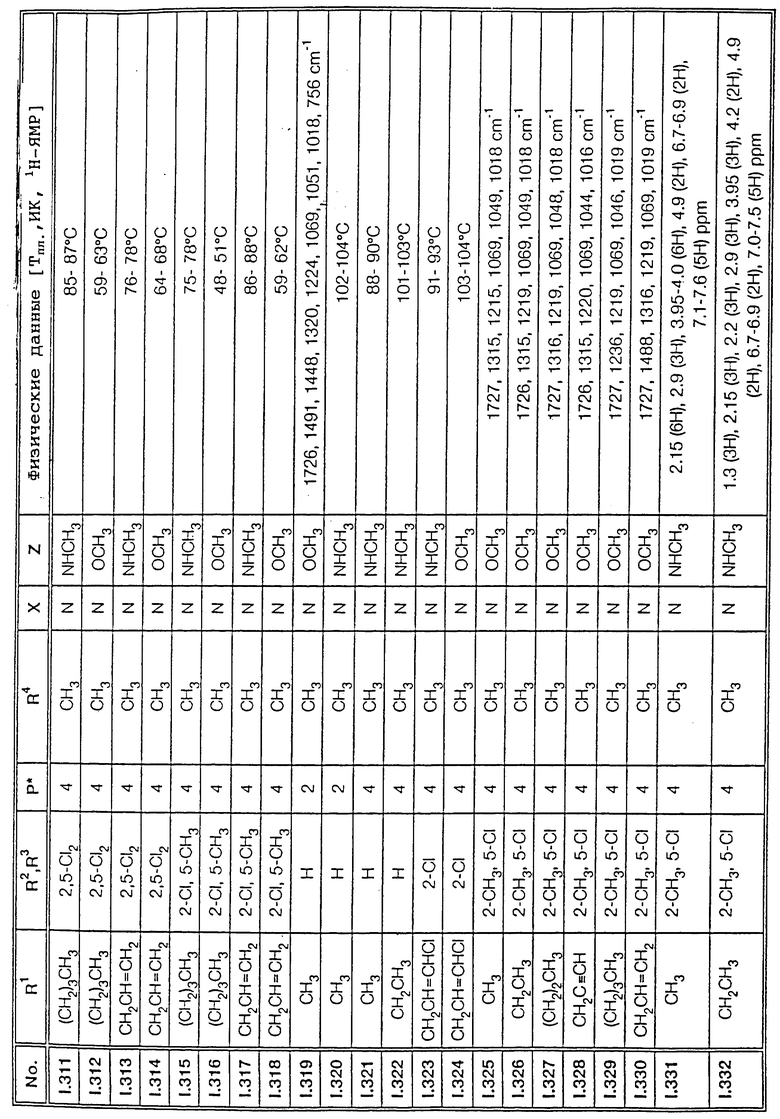
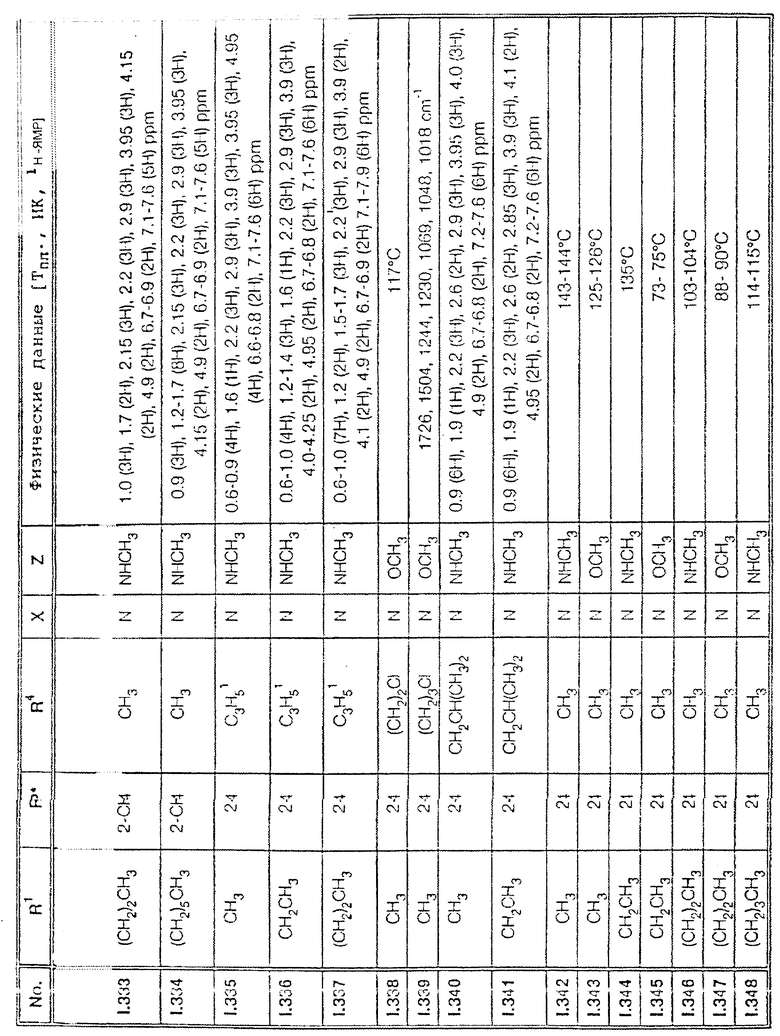
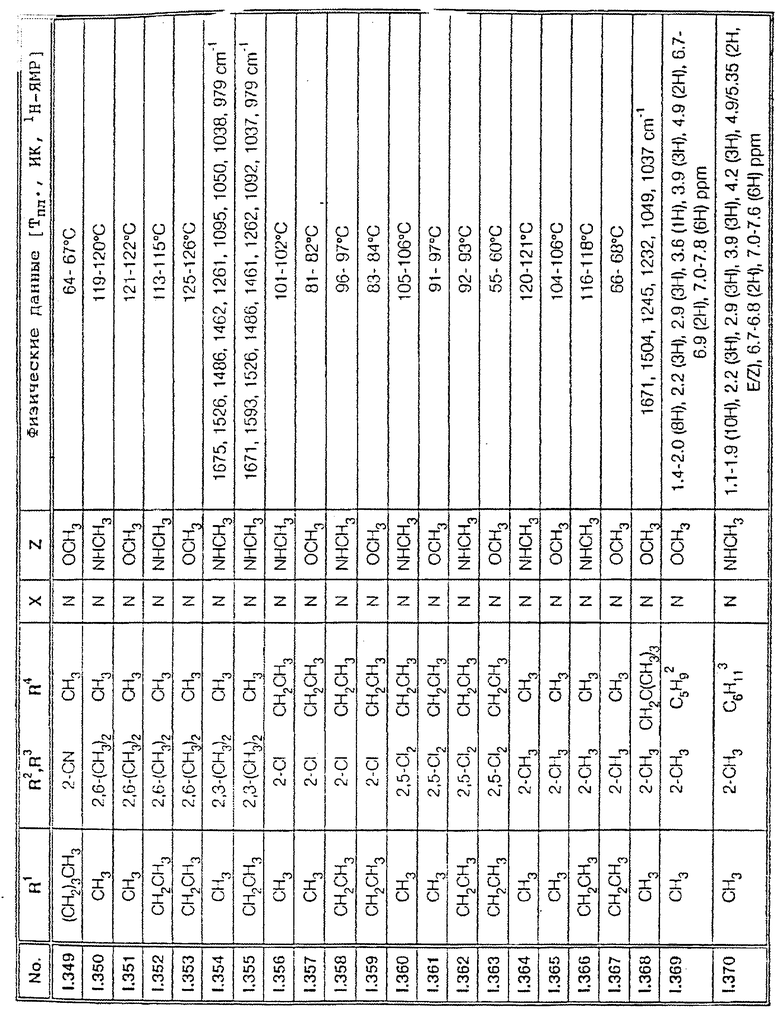
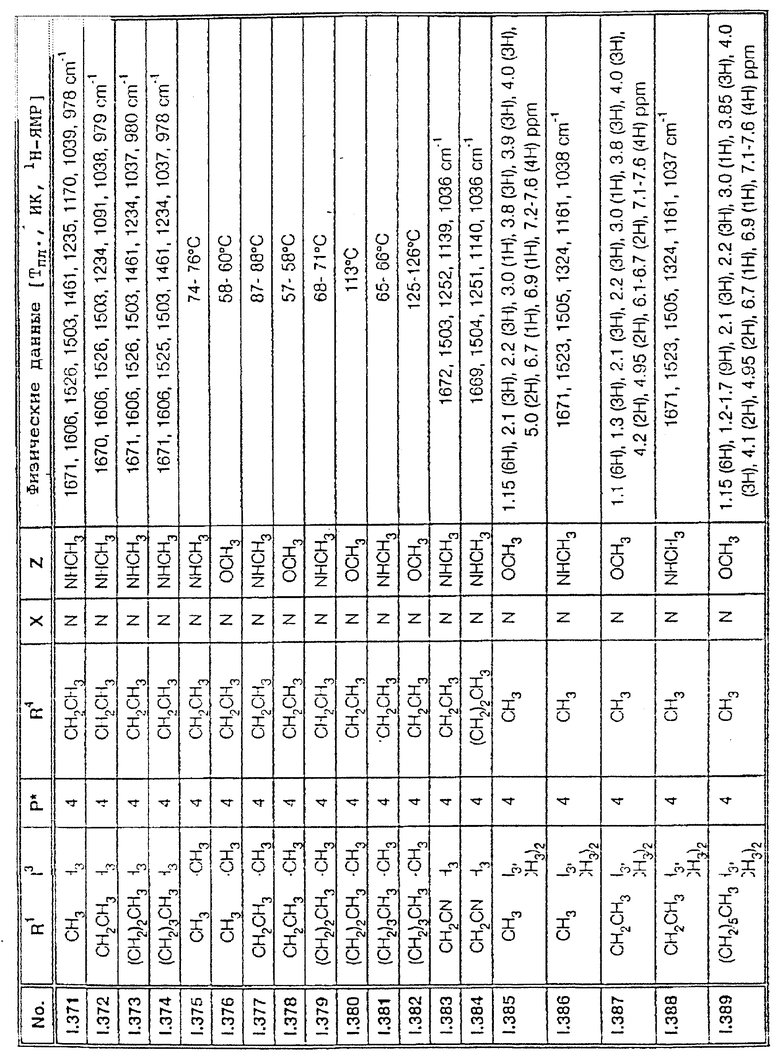
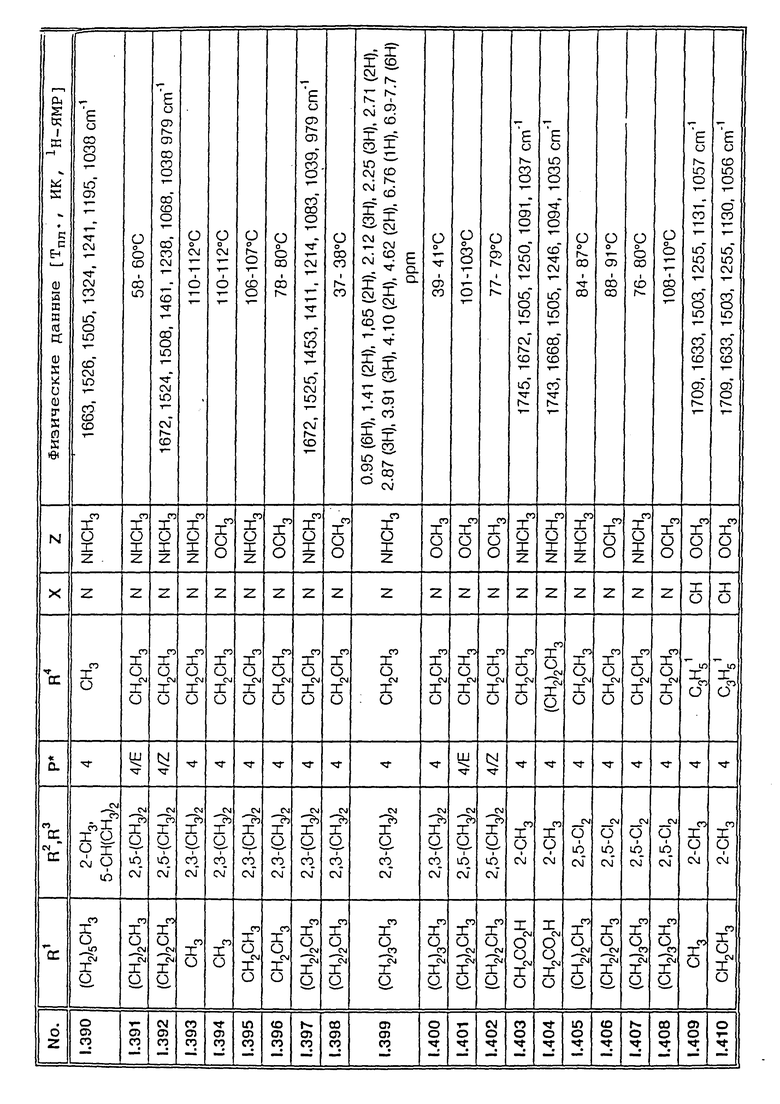
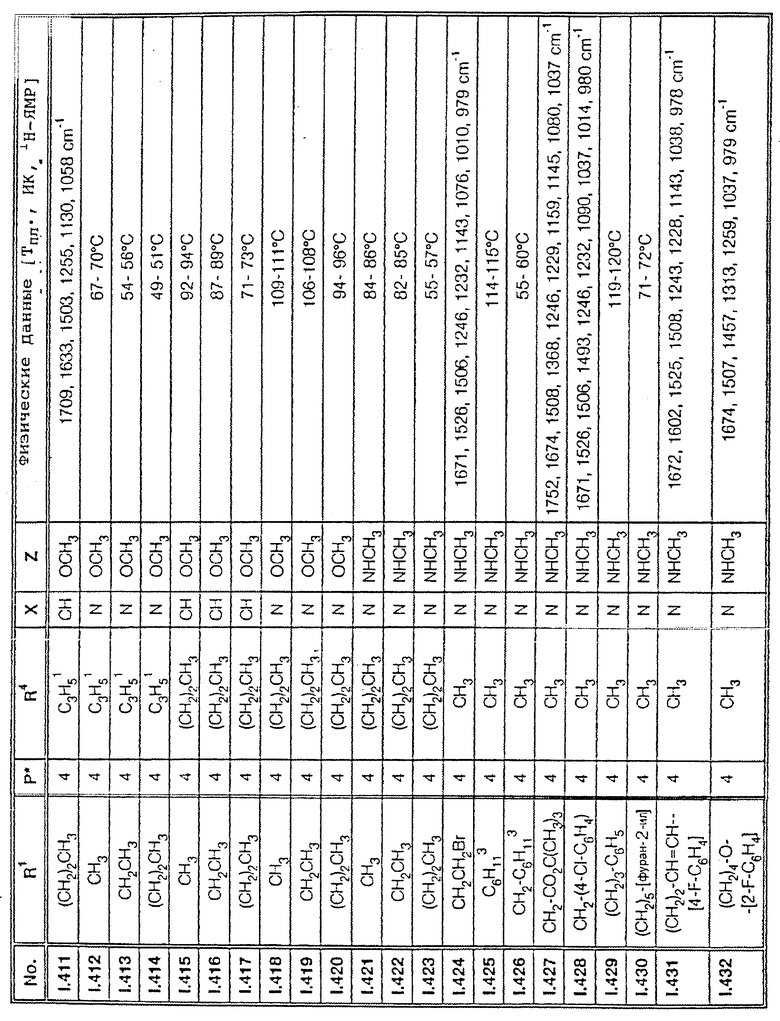
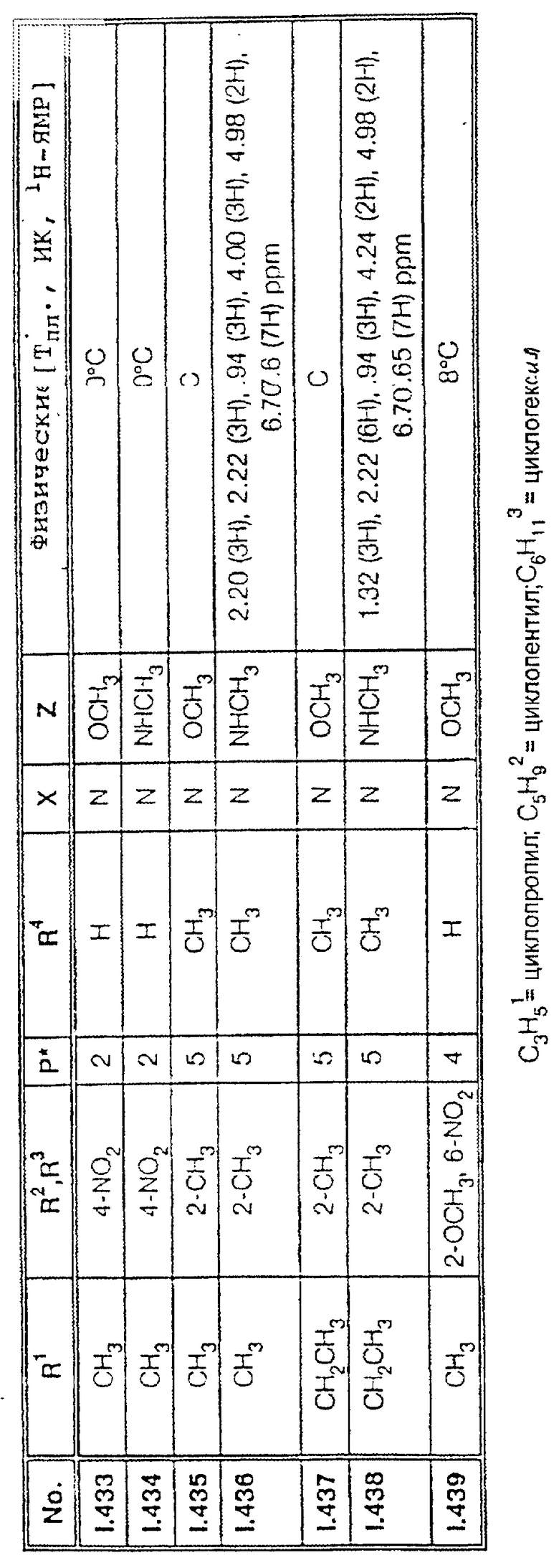
Соответствующим образом можно получить соединения I, указанные в следующей табл. I, в которых Z обозначает NR5R6. Соединение IA, в которых Z обозначает OR7, можно получить согласно EP N 386561. Они также приведены в табл. 1.
Приведенные ниже группы соединений 1, 2, 5, 11, 18-22 соответствующие соединениям общей формулы I, в которых Z обозначает NR5R6, имеют особое значение в связи с их биологической активностью, направленной против вредителей (растительных патогенных грибков, а также насекомых, паукообразных и нематодов).
Кроме того, группы соединений 3, 4, 12-17, 23-27, соответствующие общей формуле IA, в которых Z обозначает OR7, обладают также биологической активностью, направленной против животных-вредителей (насекомых, паукообразных и нематодов).
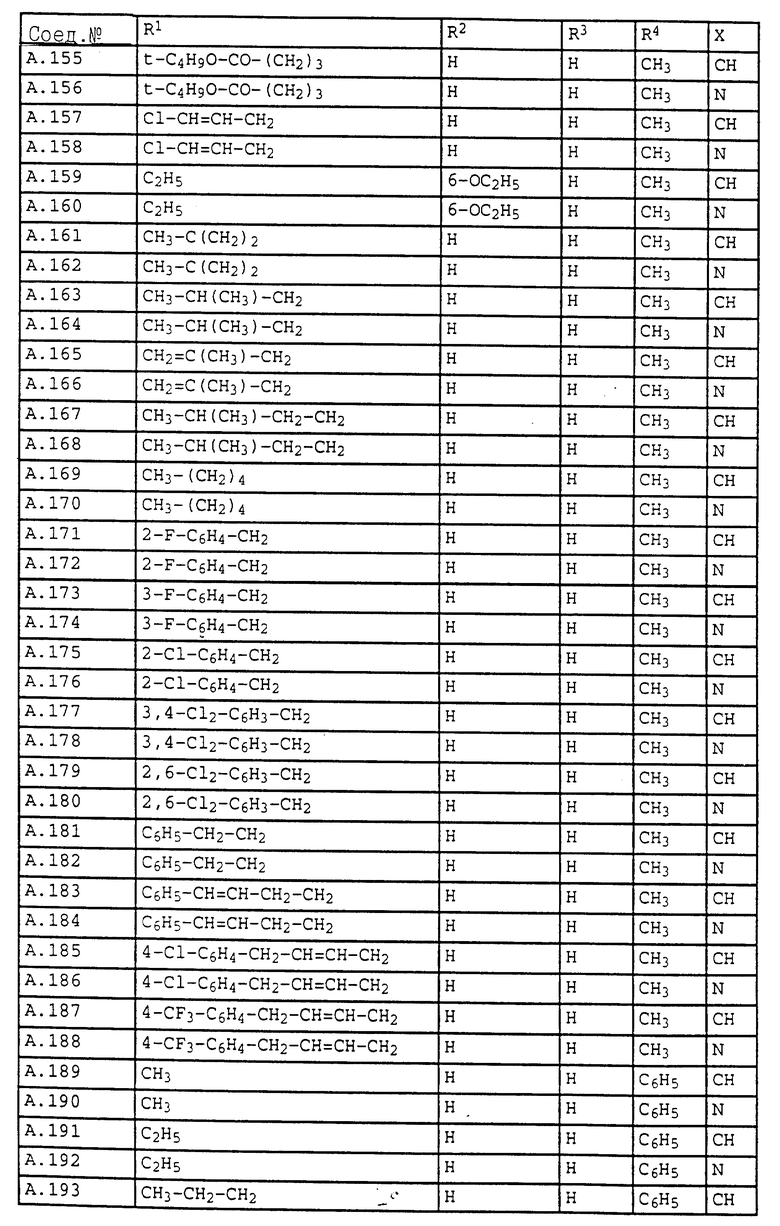
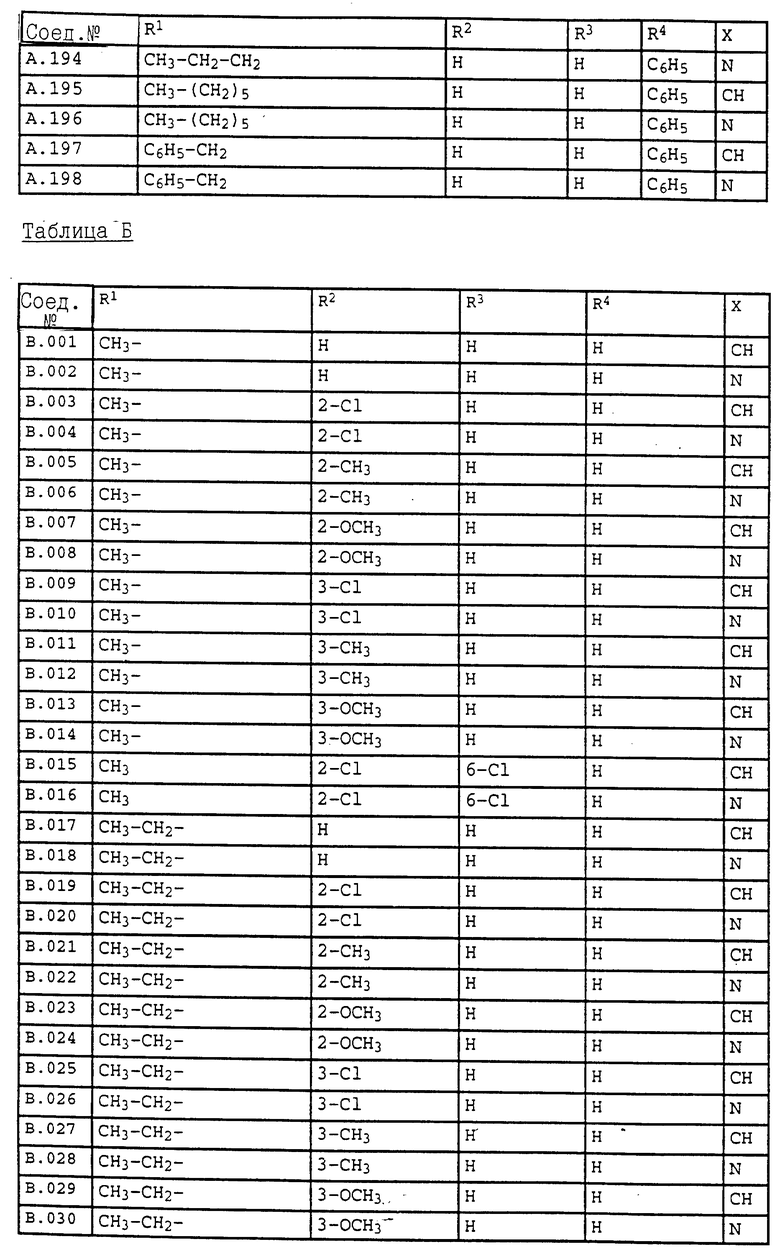
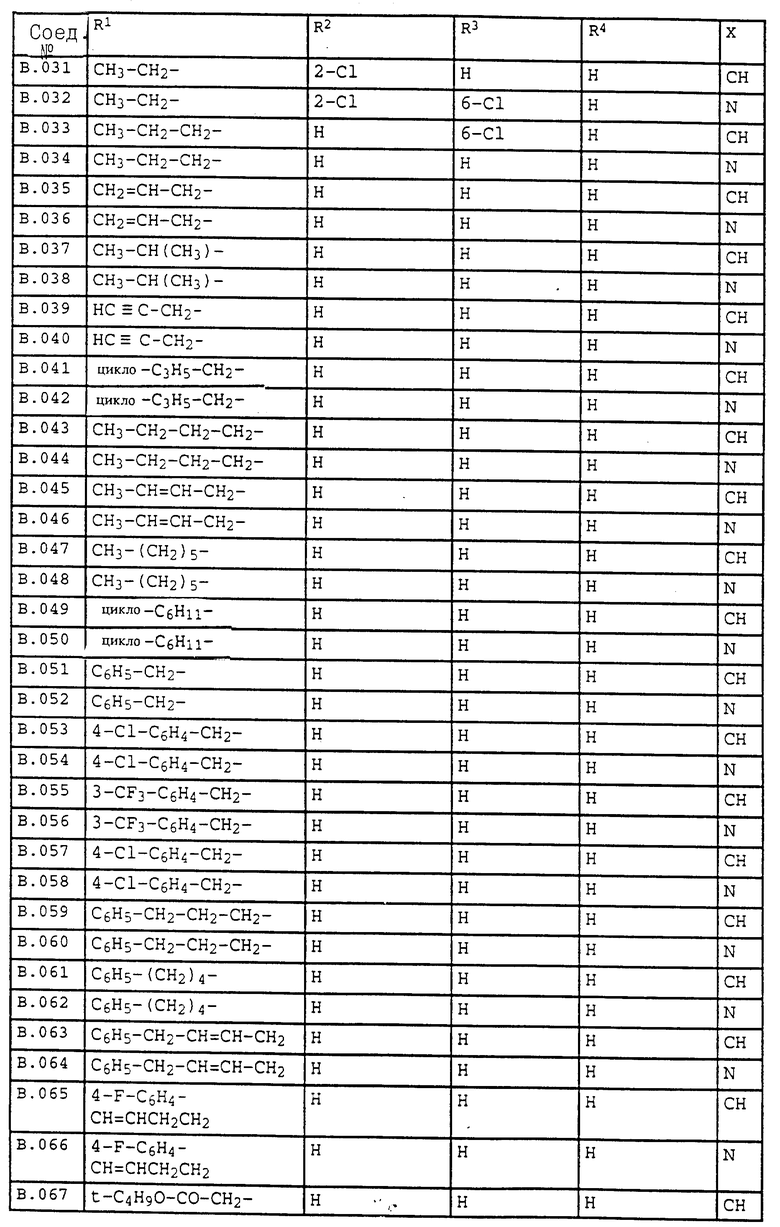
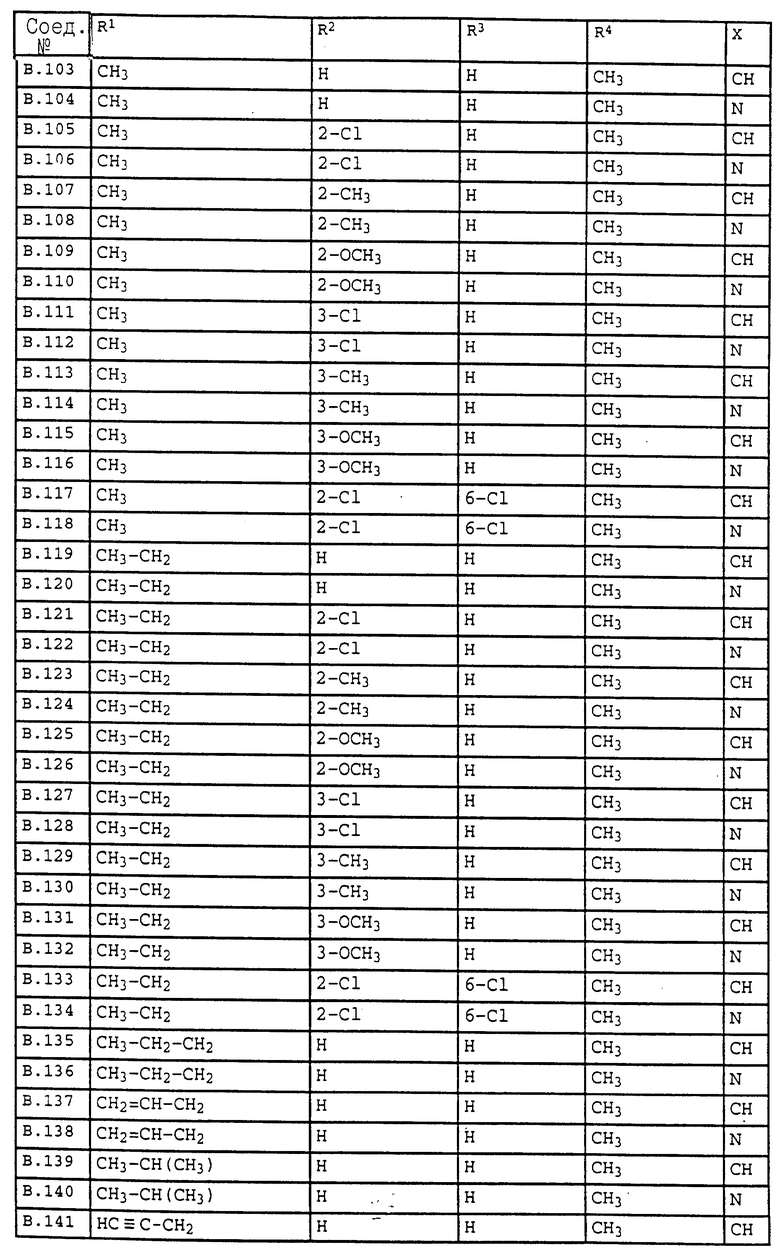
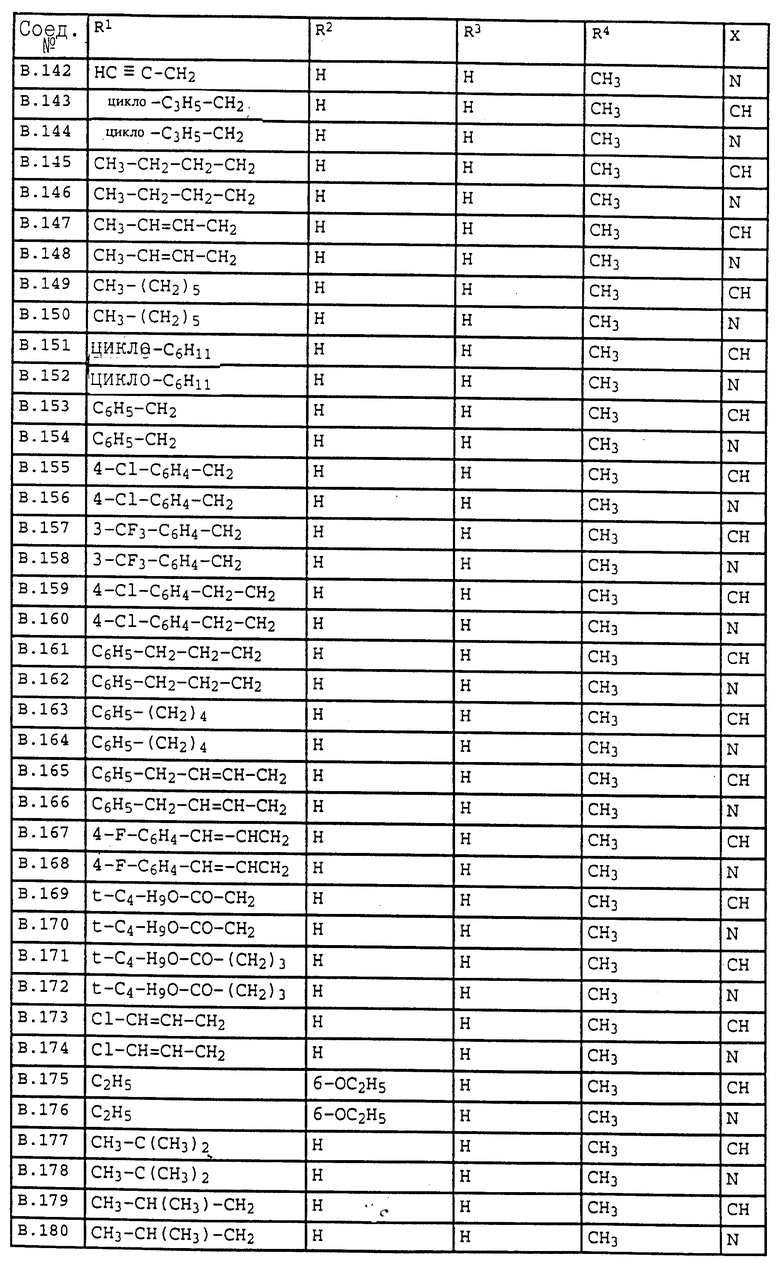
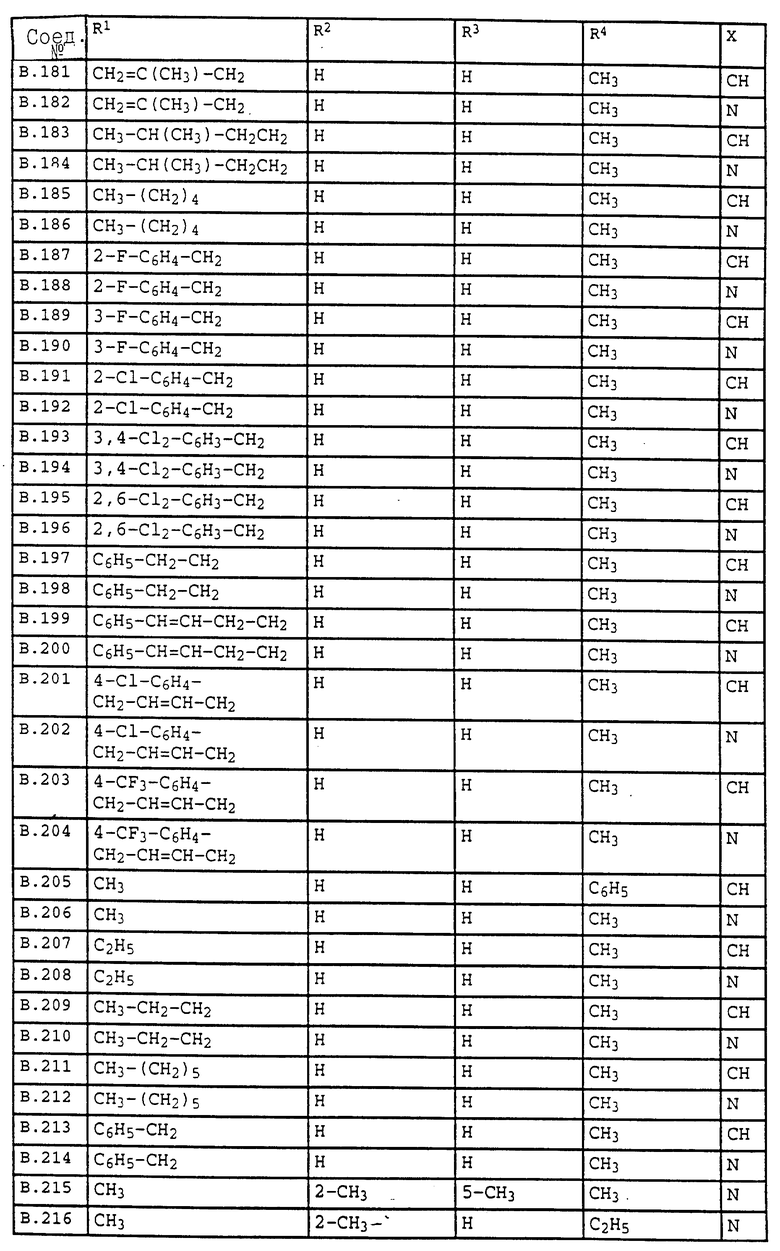
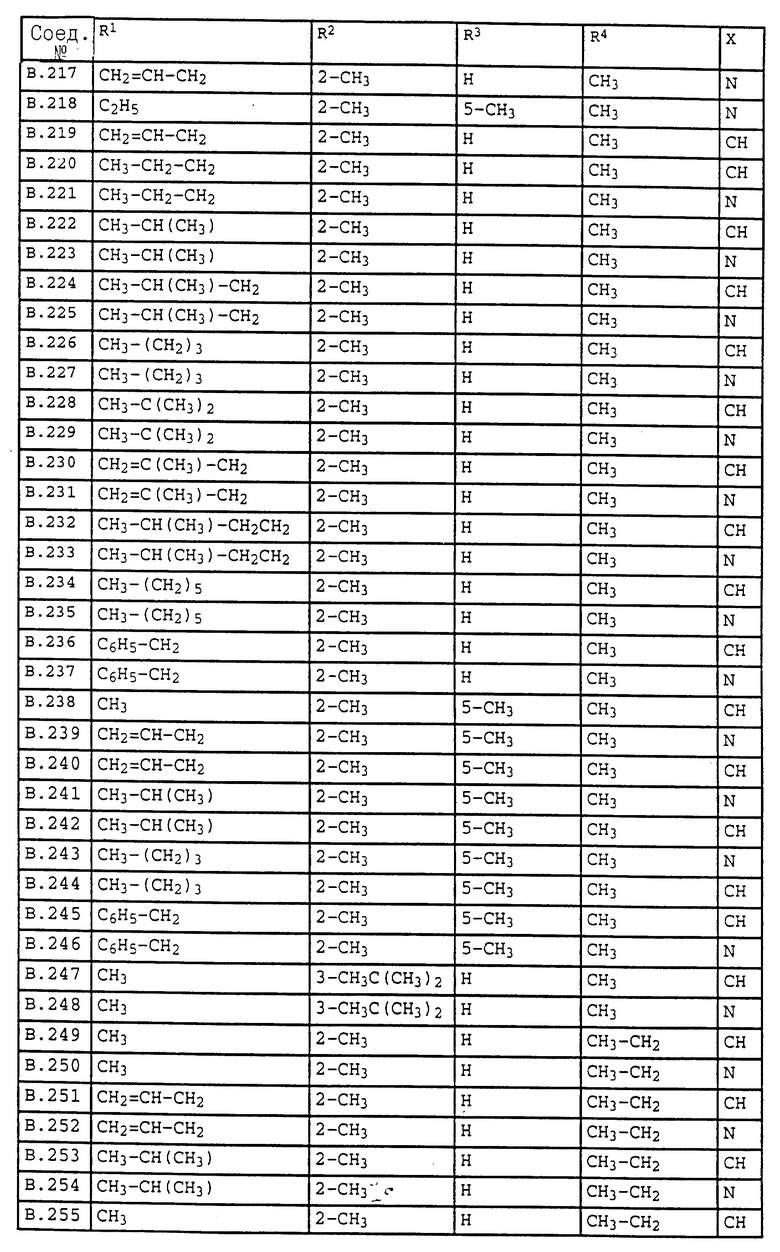
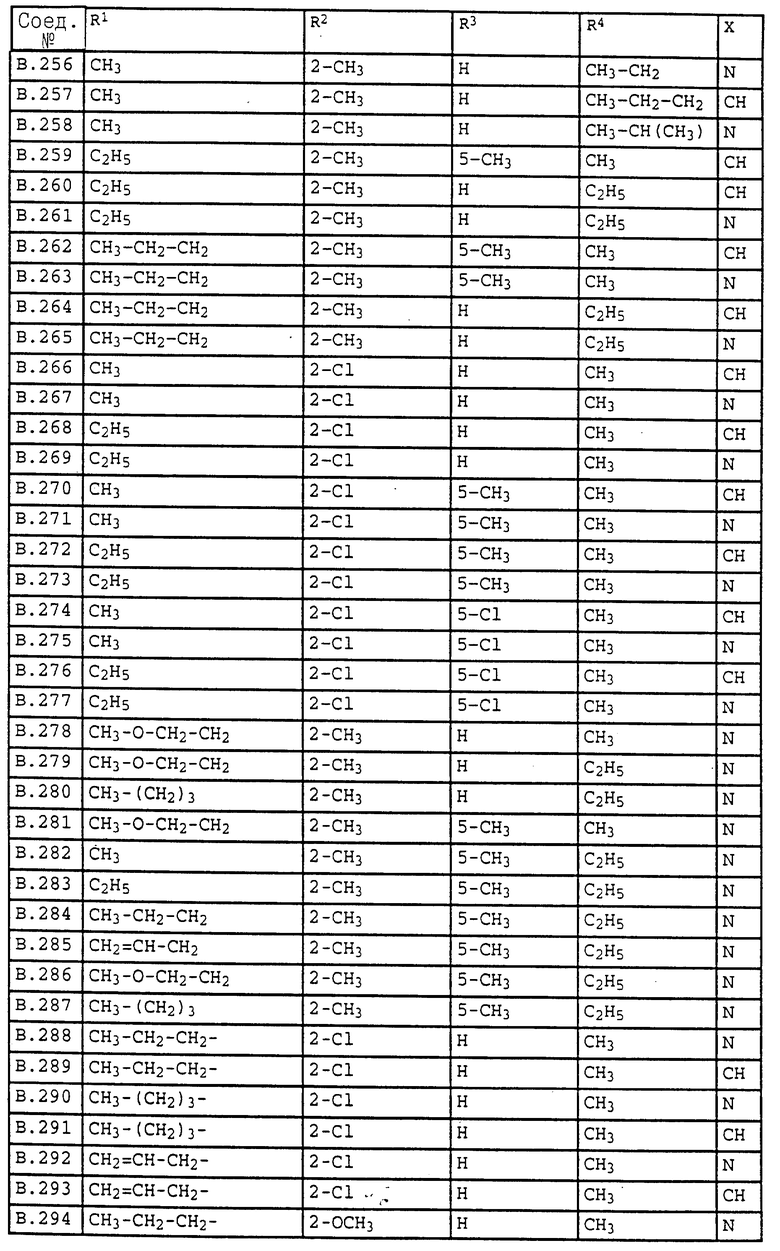
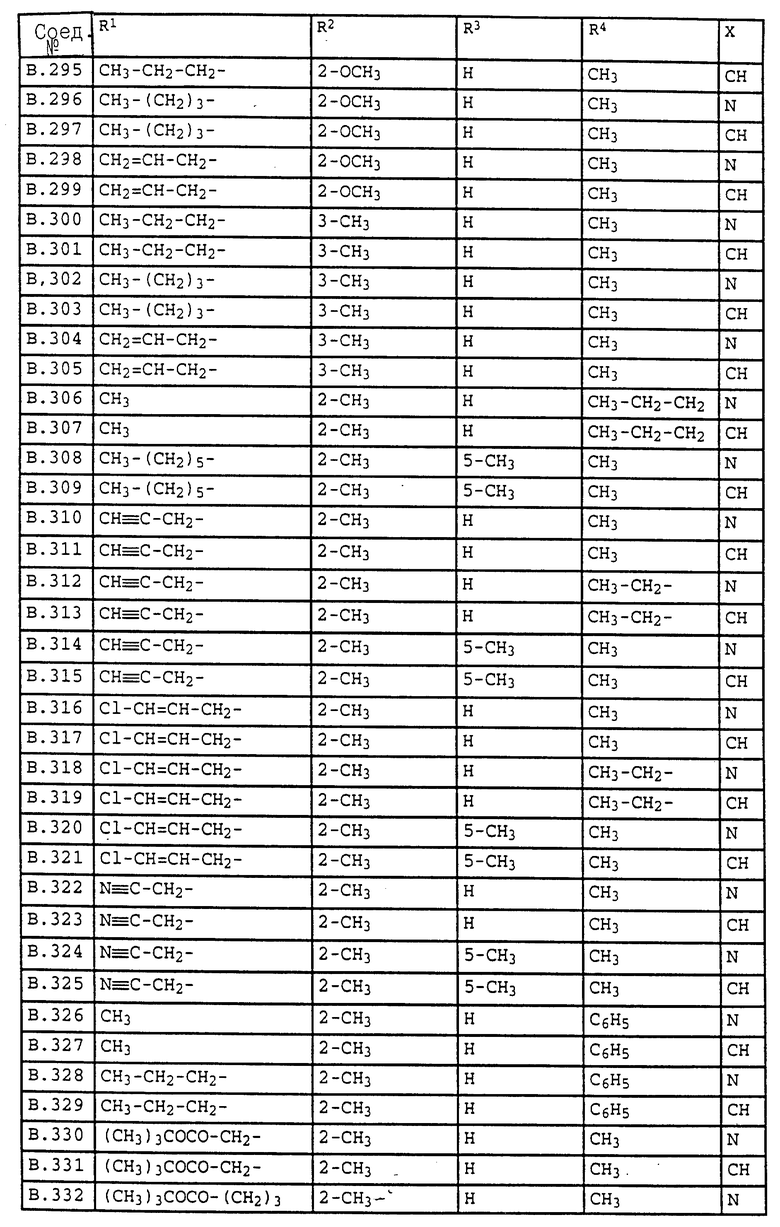
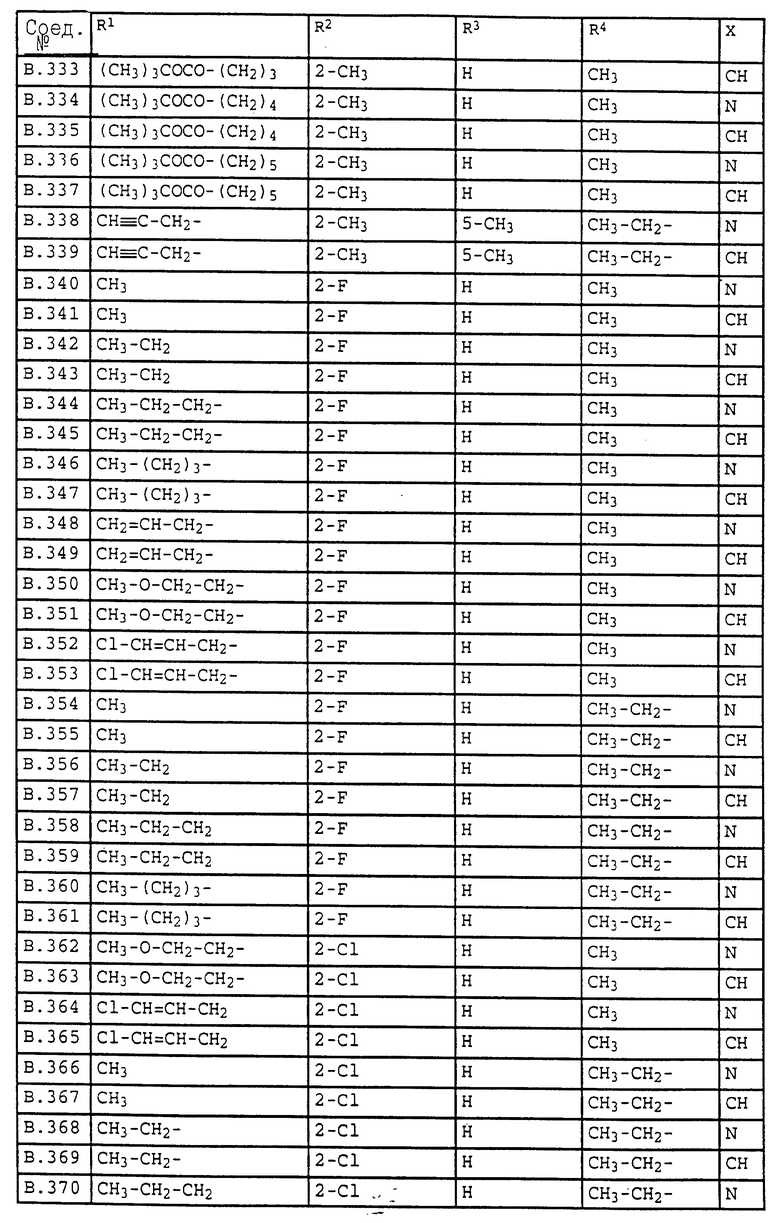
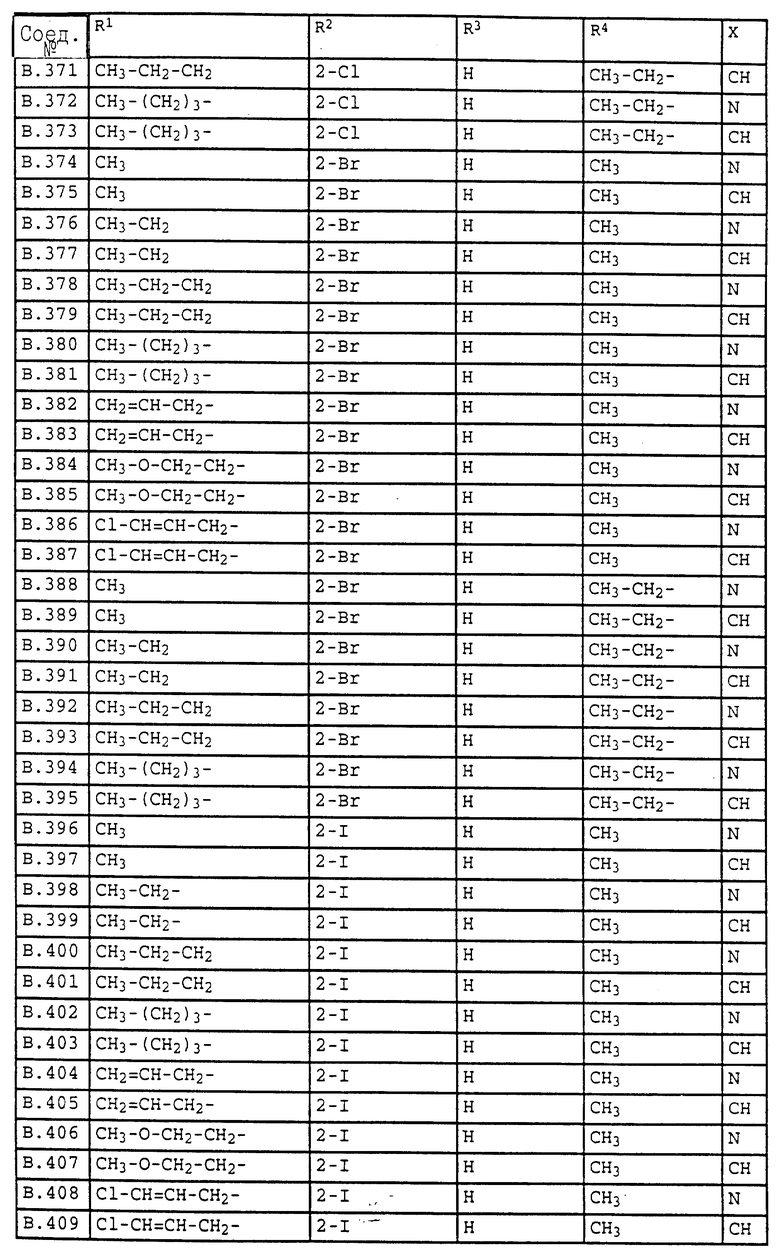
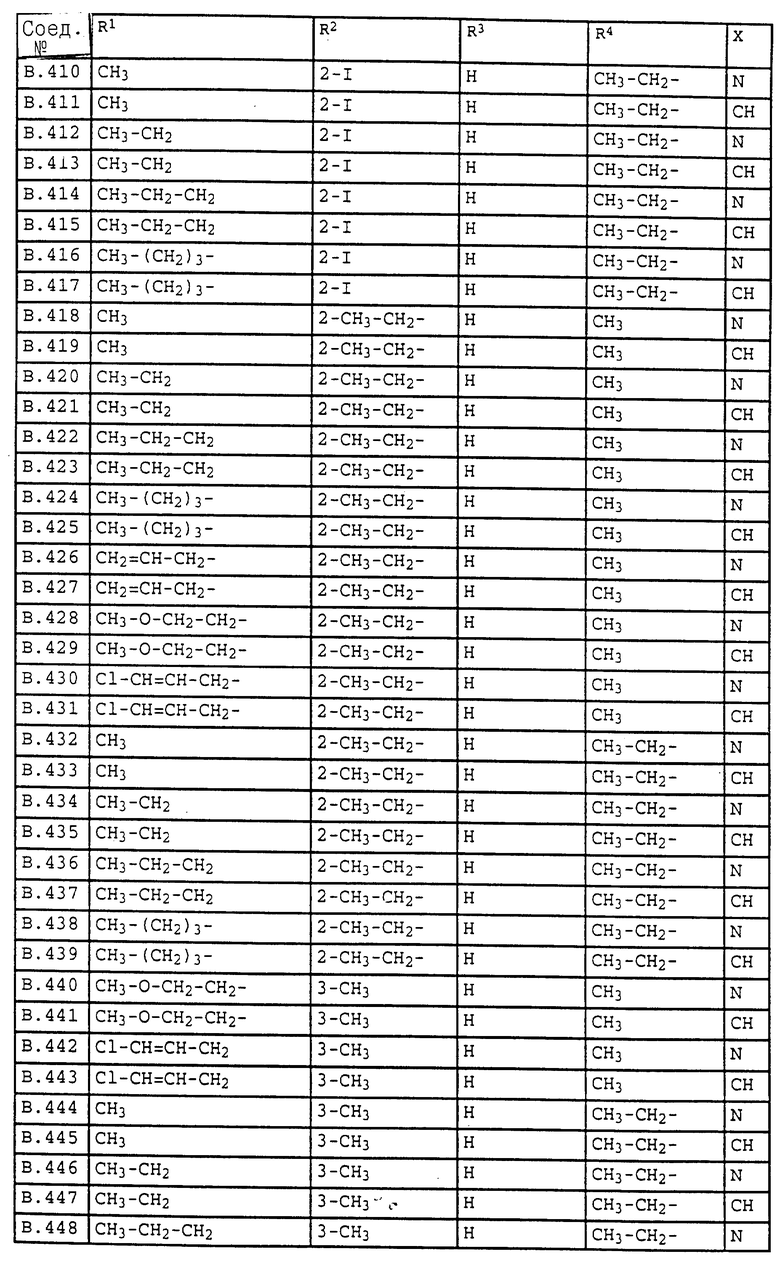
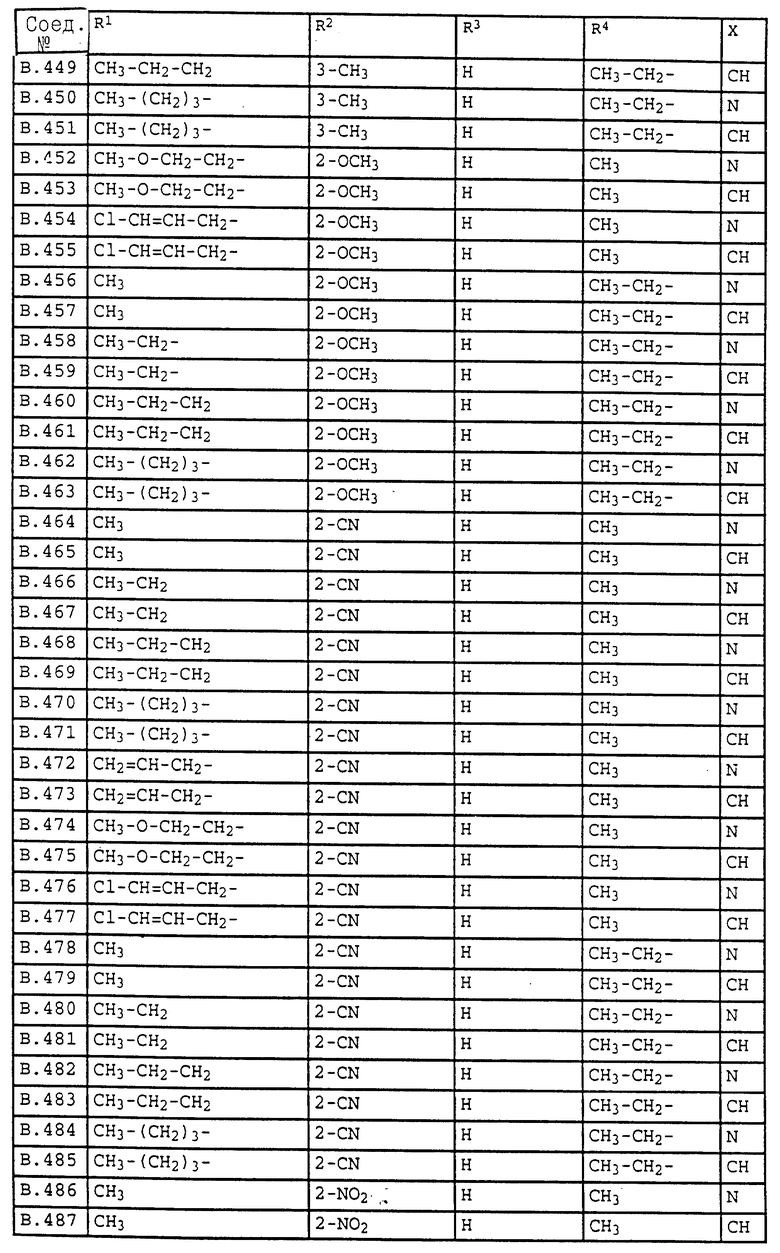
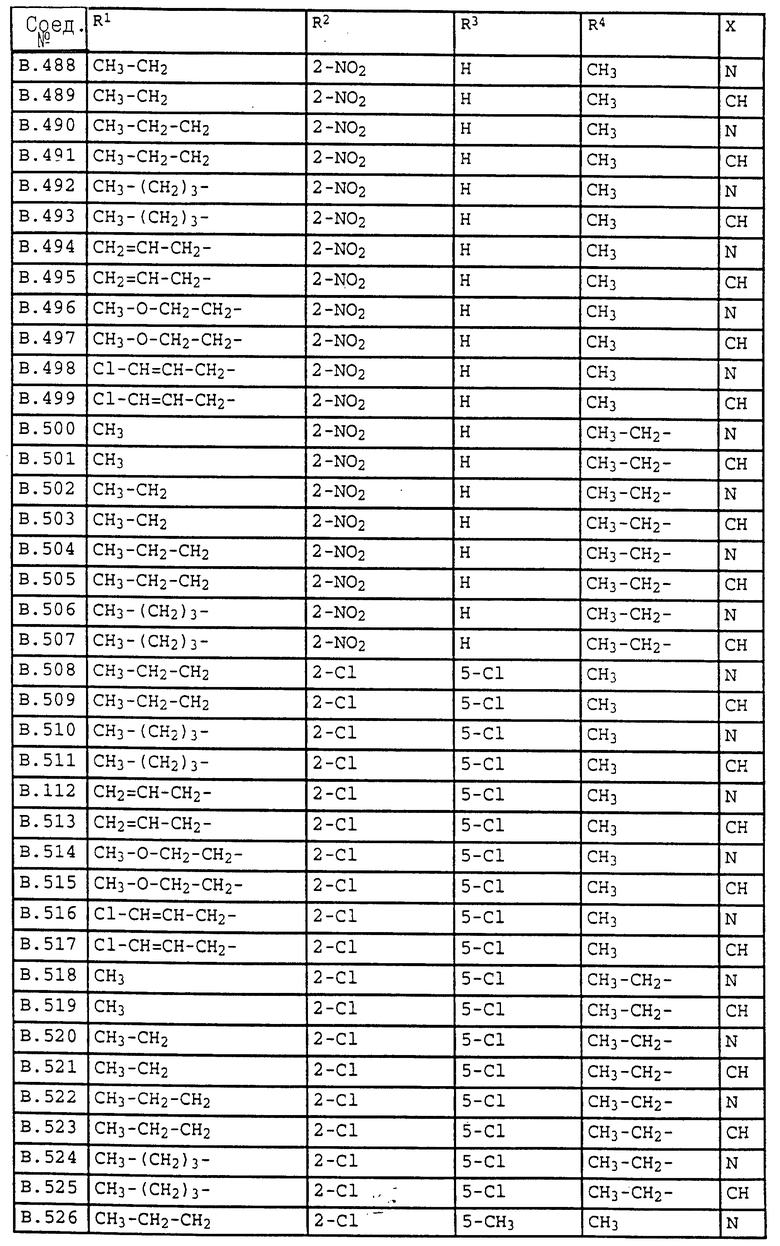
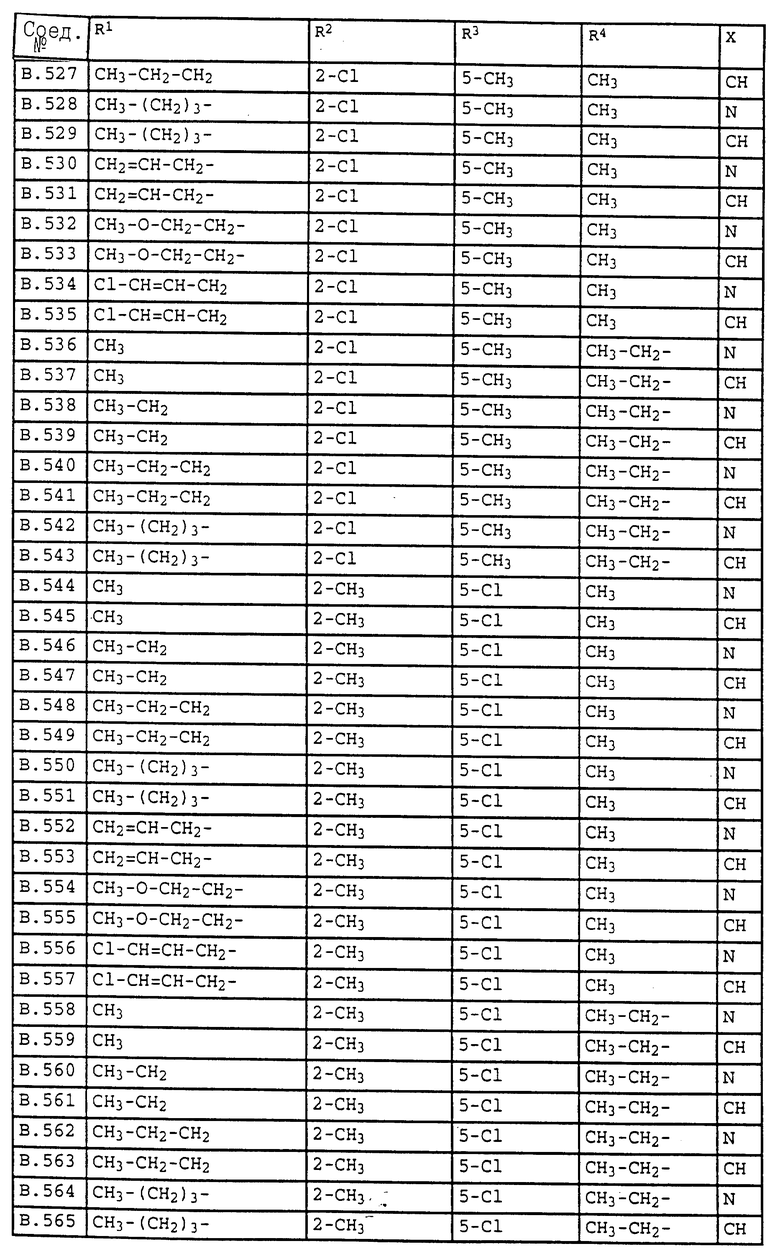
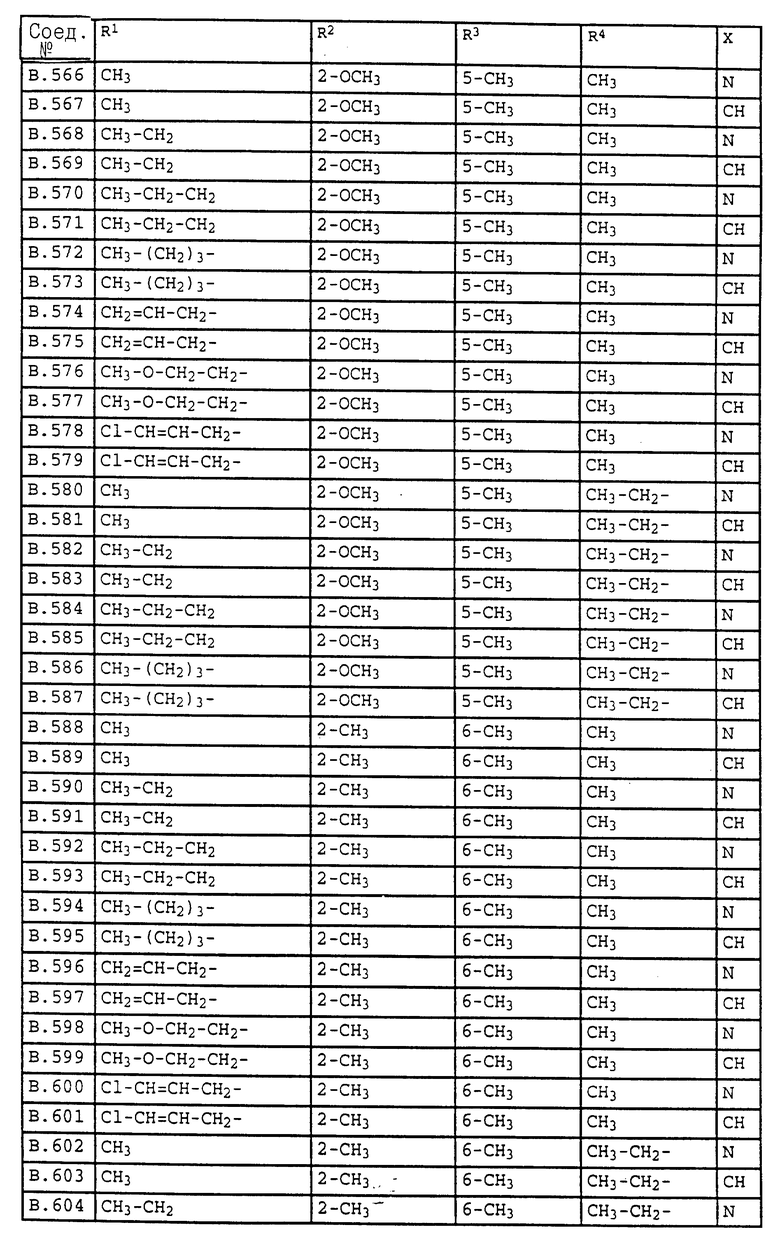
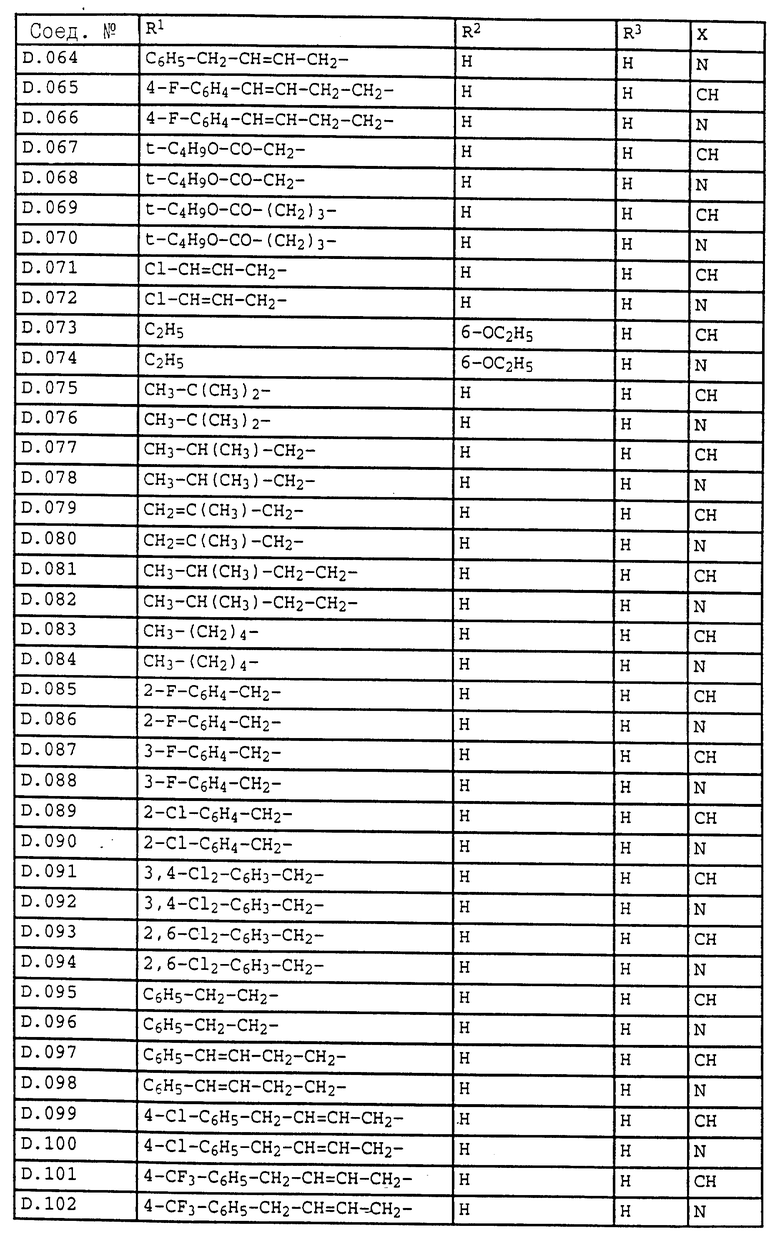
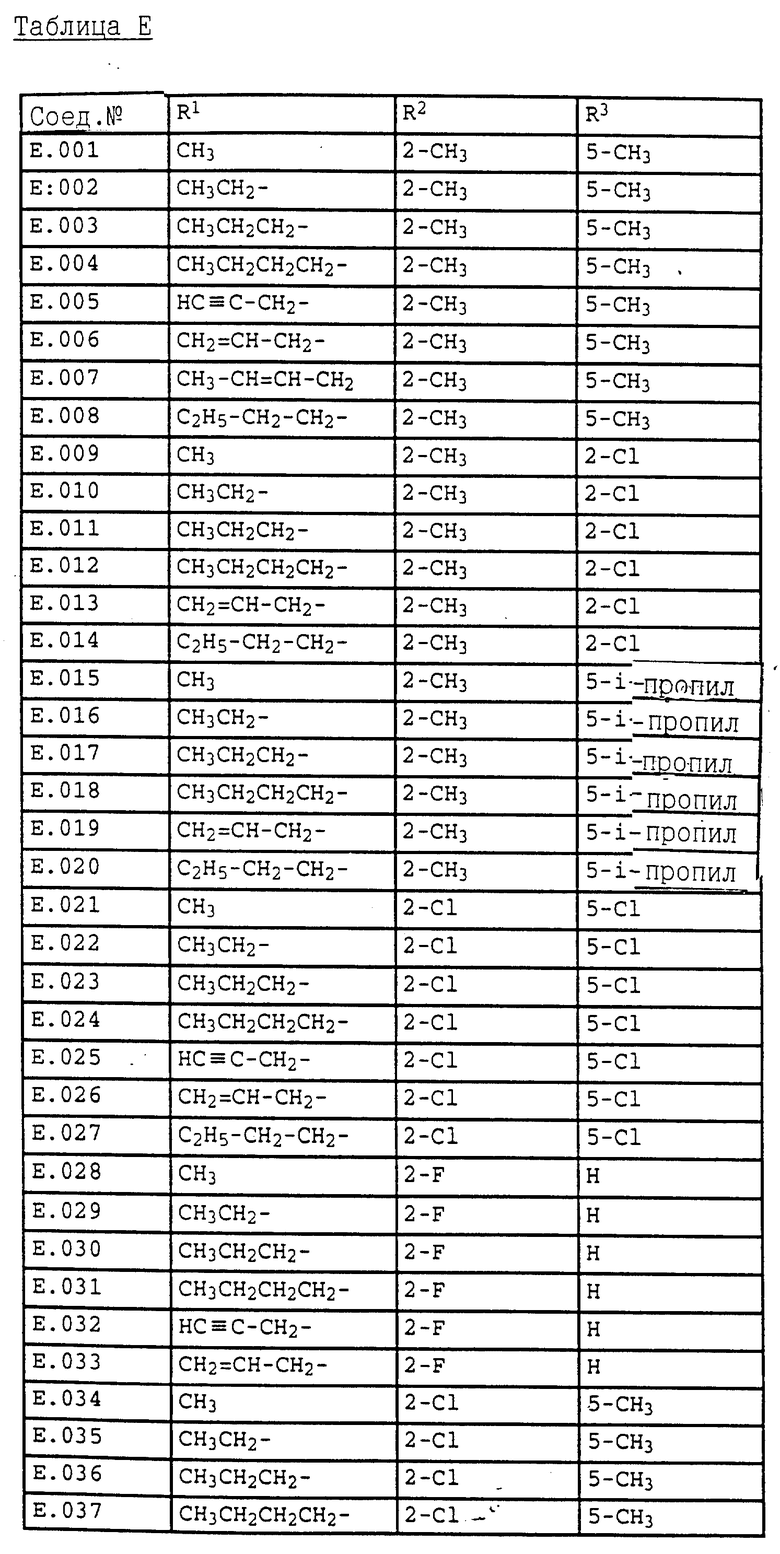
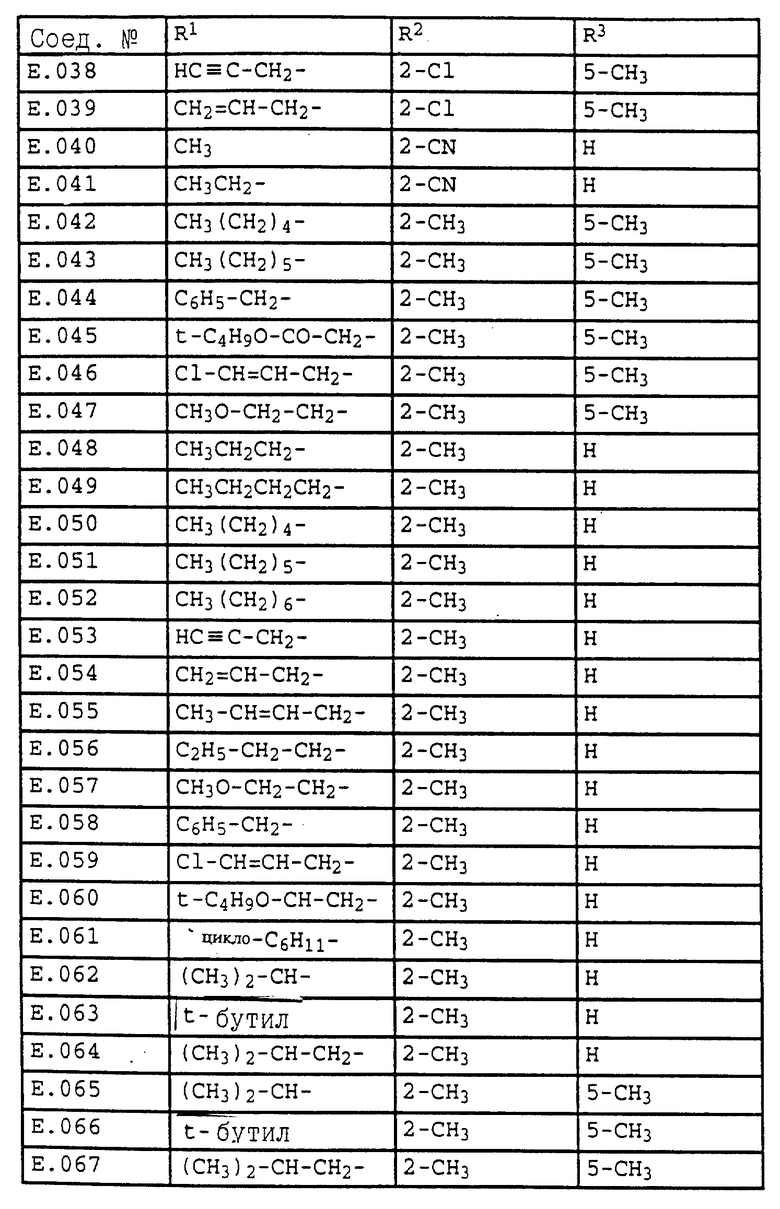
Ниже приводятся соединения, имеющие общие формулы I.1 - I.5 с различными положениями радикалов в фенильном ядре со значениями R1, R2, R3, R4, R5, R6 и X, указанными в табл. A - E.
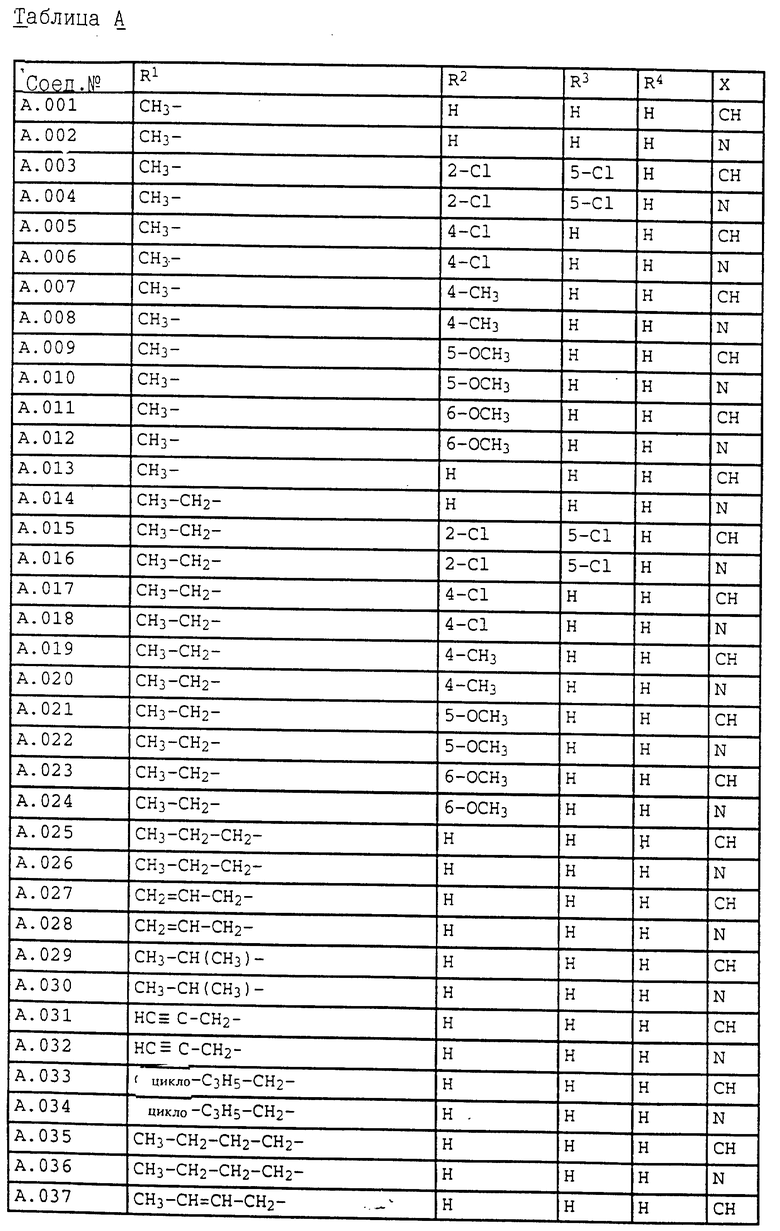
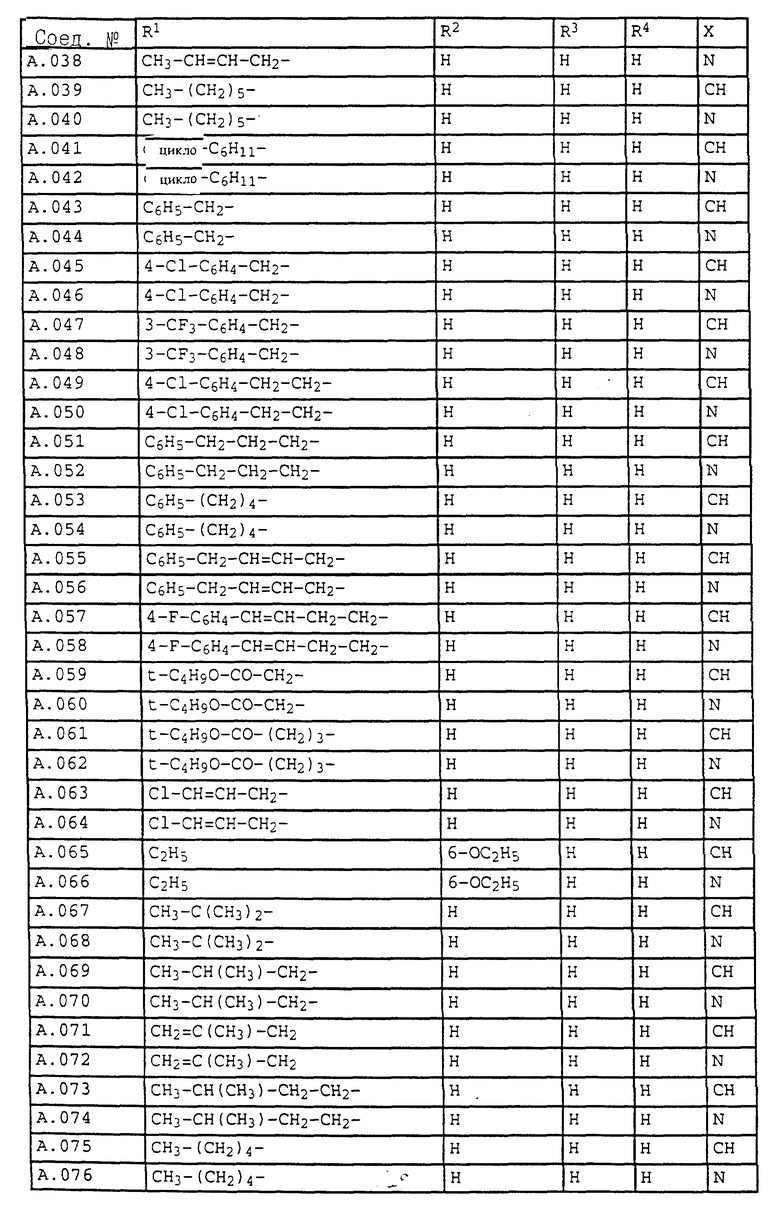
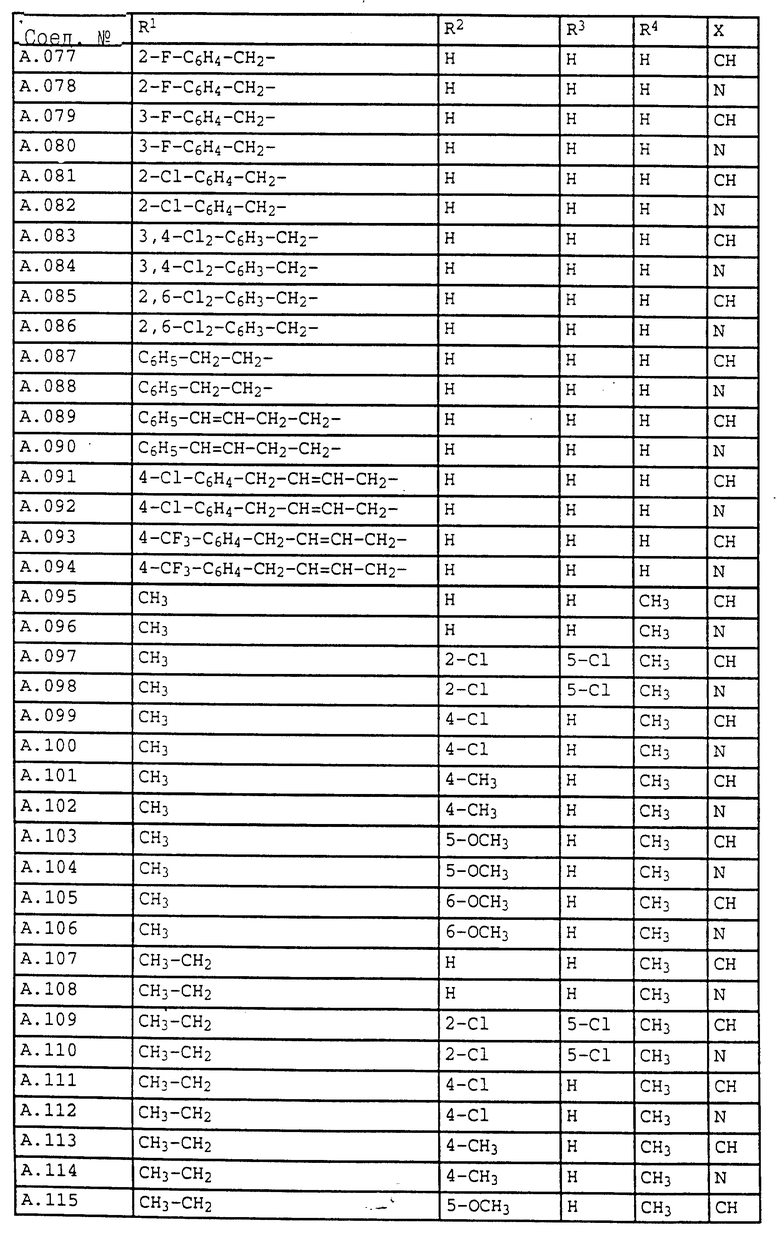
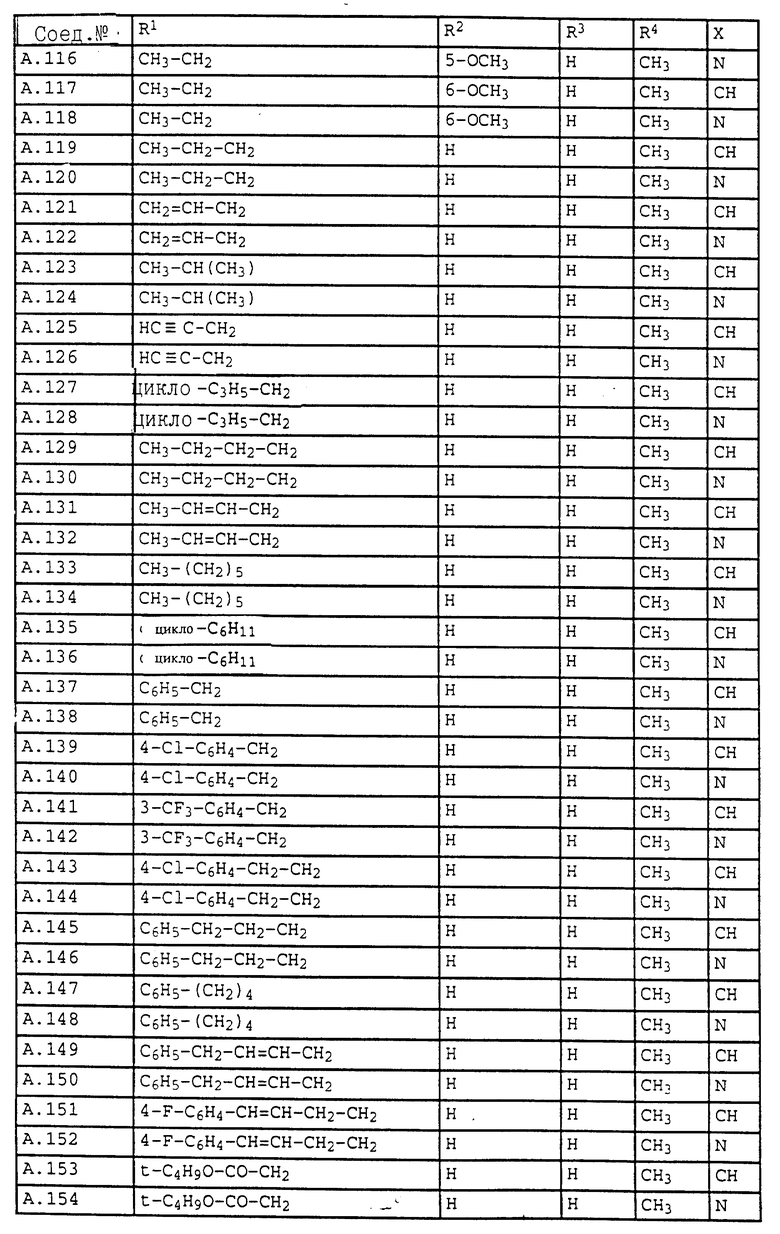
1. Соединения общей формулы I.1, в которых заместители R1, R2, R3, R4 и X имеют соответствующие значения, указанные в табл. А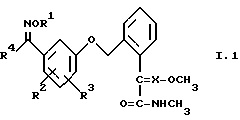
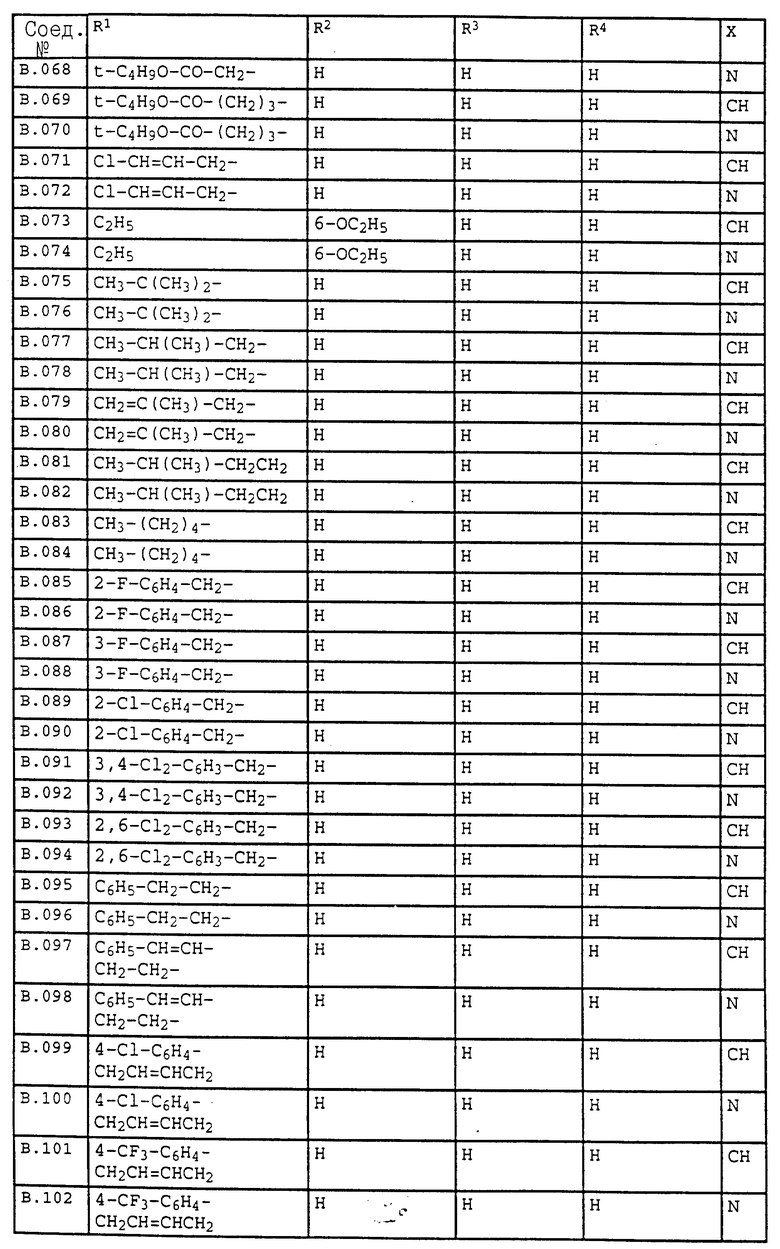
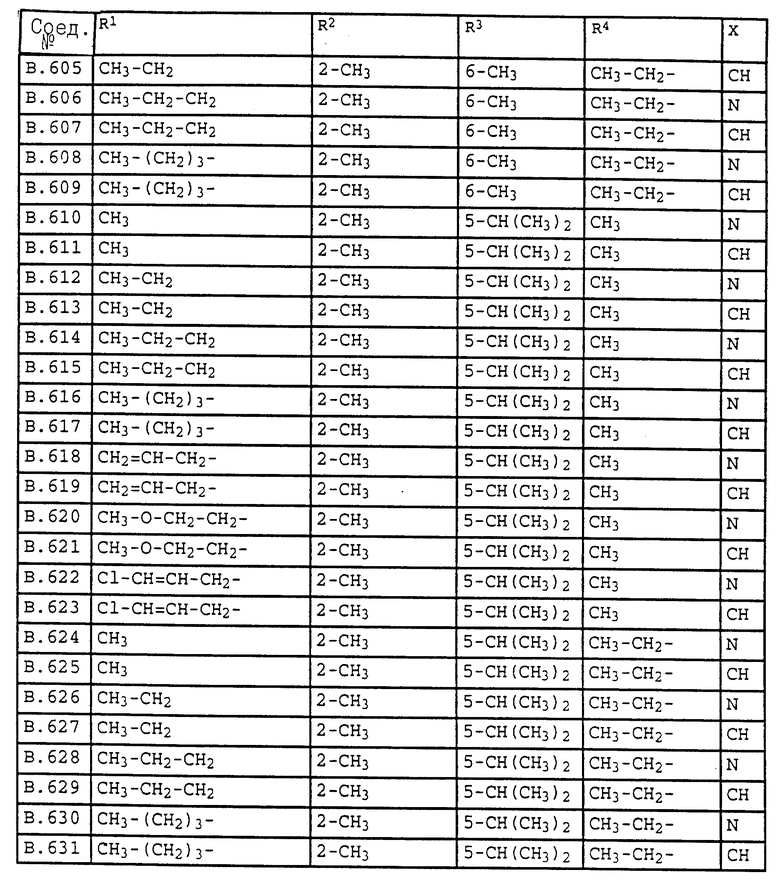
2. Соединения общей формулы I.2, в которых заместители R1, R2, R3, R4 и X имеют соответствующие значения, указанные в табл. B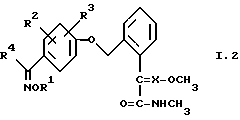
3. Соединения общей формулы I.3, в которых заместители R1, R2, R3 и X имеют соответствующие значения, указанные в табл. A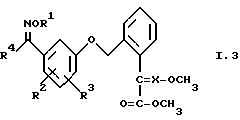
4. Соединения общей формулы I.4, в которых заместители R1, R2, R3, R4 и X имеют соответствующие значения, указанные в табл. B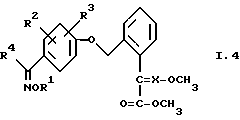
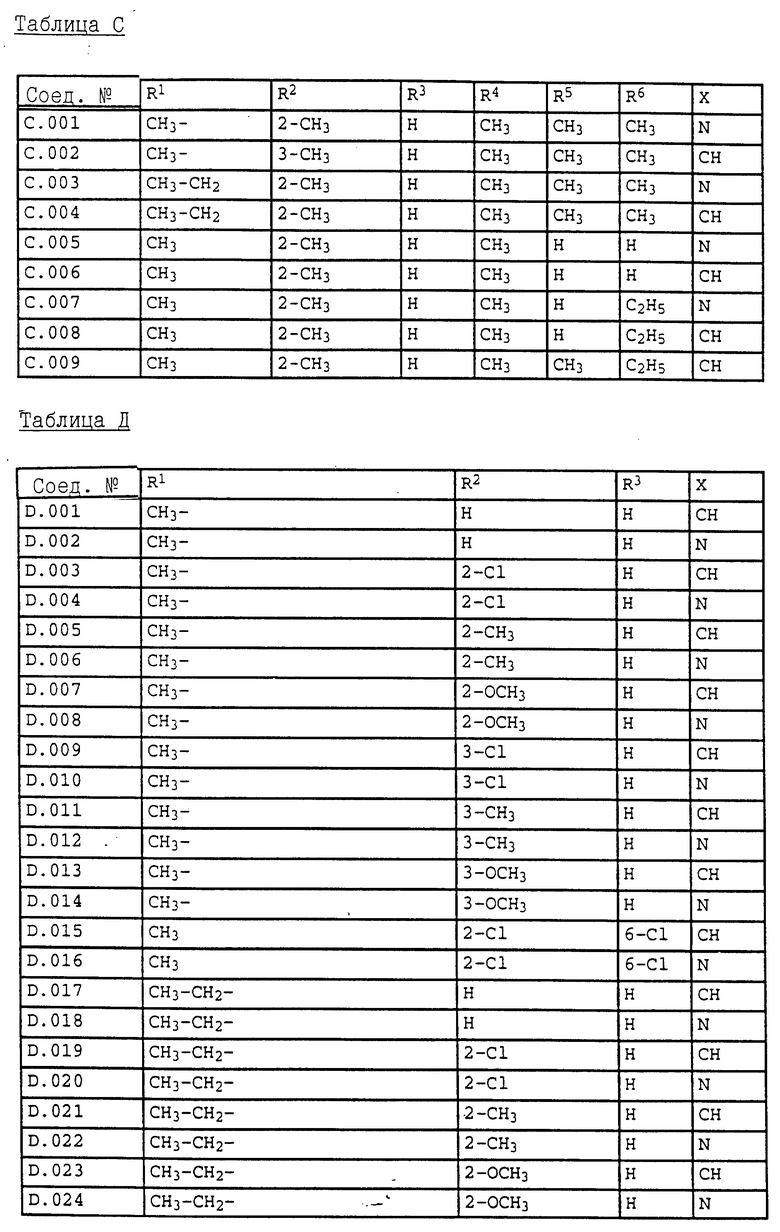
5. Соединения общей формулы I.5, в которых заместители R1, R2, R3, R4, R5, R6 и X имеют соответствующие значения, указанные в табл. C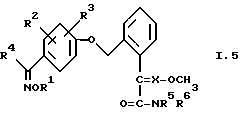
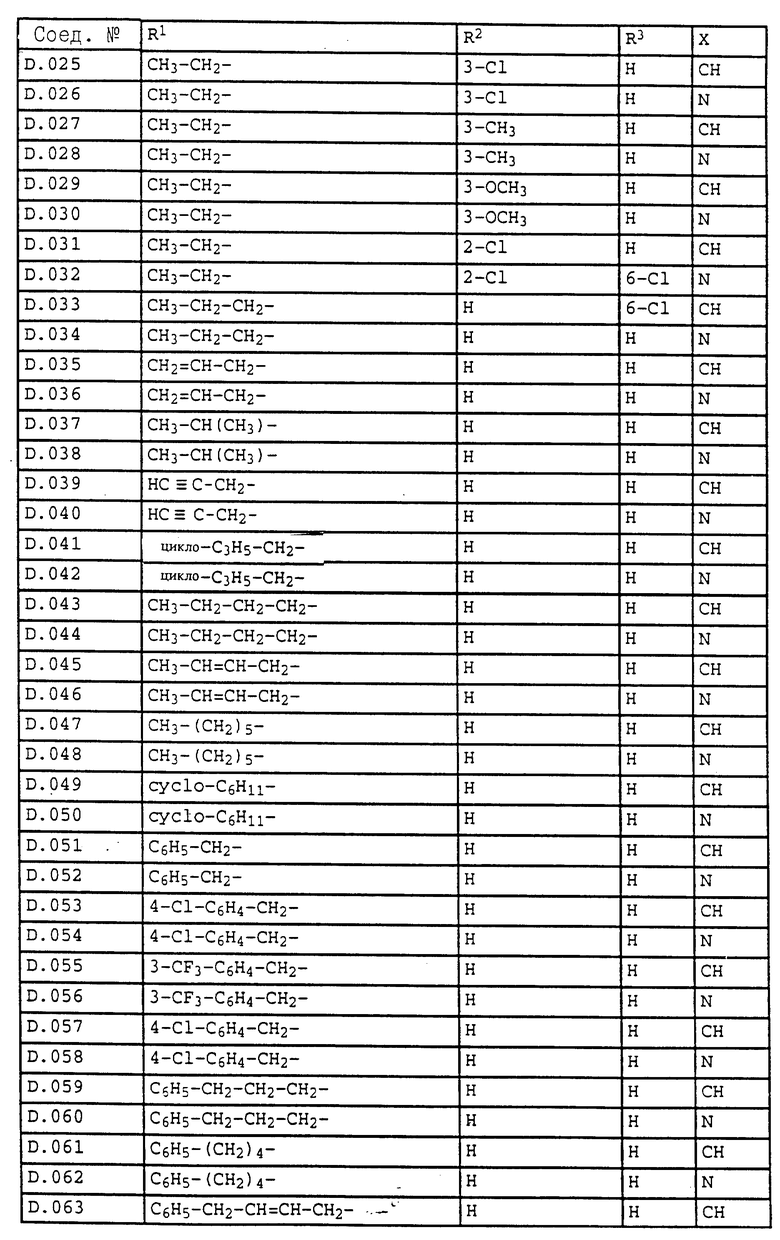
6. Соединения общей формулы I.2, в которых R4 обозначает циклопропил и заместители R1, R2, R3 и X имеют значения, указанные в табл. D.
7. Соединения общей формулы I.2, в которых R4 обозначает циклопентил и заместители R1, R2, R3 и X имеют значения, указанные в табл. D.
8. Соединения общей формулы I.2, в которых R4 обозначает циклогексил и заместители R1, R2, R3 и X имеют значения, указанные в табл. D.
9. Соединения общей формулы I.2, в которых R4 обозначает CF3 и заместители R1, R2, R3 и X имеют значения, указанные в табл. D.
10. Соединения общей формулы I.2, в которых R4 обозначает CH2Cl и заместители R1, R2, R3 и X имеют значения, указанные в табл. D.
11. Соединения общей формулы I.2, в которых R4 обозначает CH2CH2Cl и заместители R1, R2, R3 и X имеют значения, указанные в табл. D.
12. Соединения общей формулы I.4, в которых R4 обозначает циклопропил и заместители R1, R2, R3 и X имеют значения, указанные в табл. D.
13. Соединения общей формулы I.4, в которых R4 обозначает циклопентил и заместители R1, R2, R3 и X имеют значения, указанные в табл. D.
14. Соединения общей формулы I.4, в которых R4 обозначает циклогексил и заместители R1, R2, R3 и X имеют значения, указанные в табл. D.
15. Соединения общей формулы I.4, в которых R4 обозначает CF3 и заместители R1, R2, R3 и X имеют значения, указанные в табл. D.
16. Соединения общей формулы I.4, в которых R4 обозначает CH2Cl и заместители R1, R2, R3 и X имеют значения, указанные в табл. D.
17. Соединения общей формулы I.4, в которых R4 обозначает CH2CH2Cl и заместители R1, R2, R3 и X имеют значения, указанные в табл. D.
18. Соединения общей формулы I.2, в которых R4 обозначает циклопропил, = X- обозначает =N- и заместители R1, R2 и R3 имеют значения, указанные в табл. E.
19. Соединения общей формулы I.2, в которых R4 обозначает циклопентил, = X- обозначает =N- и заместители R1, R2 и R3 имеют значения, указанные в табл. E.
20. Соединения общей формулы I.2, в которых R4 обозначает циклогексил, = X- обозначает =N- и заместители R1, R2 и R3 имеют значения, указанные в табл. E.
21. Соединения общей формулы I. 2, в которых R4 обозначает CF3, =X- обозначает = N- и заместители R1, R2 и R3 имеют значения, указанные в табл. E.
22. Соединения общей формулы I.2, в которых R4 обозначает CH2CH2Cl, =X- обозначает = N- и заместители R1, R2 и R3 имеют значения, указанные в табл. E.
23. Соединения общей формулы I.4, в которых R4 обозначает циклопропил, = X- обозначает = N- и заместители R1, R2 и R3 имеют значения, указанные в табл. E.
24. Соединения общей формулы I.4, в которых R4 обозначает циклопентил, = X- обозначает = N- и заместители R1, R2 и R3 имеют значения, указанные в табл. E.
25. Соединения общей формулы I.4, в которых R4 обозначает циклогексил, = X- обозначает = N- и заместители R1, R2 и R3 имеют значения, указанные в табл. E.
26. Соединения общей формулы I. 4, в которых R4 обозначает CF3, =X- обозначает = N- и заместители R1, R2 и R3 имеют значения, указанные в табл. E.
27. Соединения общей формулы I.4, в которых R4 обозначает CH2CH2Cl, =X- обозначает = N- и заместители R1, R2 и R3 имеют значения, указанные в табл. E.
Новые соединения формулы I проявляют отличное действие против широкого спектра растительных патогенных грибков, в частности, из класса аскомицетов и базидиомицетов и могут применяться в качестве листовых и почвенных фунгицидов. Частично они обладают заслуживающей внимания высокой системной подвижностью и эффективностью при почвенном и, в частности, также листовом применении.
Особое значение имеют они для борьбы с множеством грибков на различных культурных растениях, как, например, пшеница, рожь, ячмень, овес, рис, кукуруза, злаки, хлопок, соя, кофейное дерево, сахарный тростник, виноградные, плодовые и декоративные растения и овощные растения, как, например, огурцы, бобы и тыквенные, а также на семенах этих растений.
Особенно подходят они для борьбы со следующими болезнями растений:
Erysiphe graminis (мучнистая роса) в зерновых культурах,
Erysiphe cichoracearum и Shaerotheca fuliginea на тыквенных растениях,
Podospheare leucotricha на яблонях,
Uncinula necator на винограде,
Puccinia - разновидности на зерновых культурах,
Rhizoctonia - разновидности на хлопке и зерне,
Ustilago - разновидности на злаках и сахарном тростнике,
Venturia inaequalis (парша) на яблонях,
Helminthosporium - разновидности на злаках,
Septoria nodorum на пшенице,
Botrytis cinerea (серая плесень) на землянике, винограде,
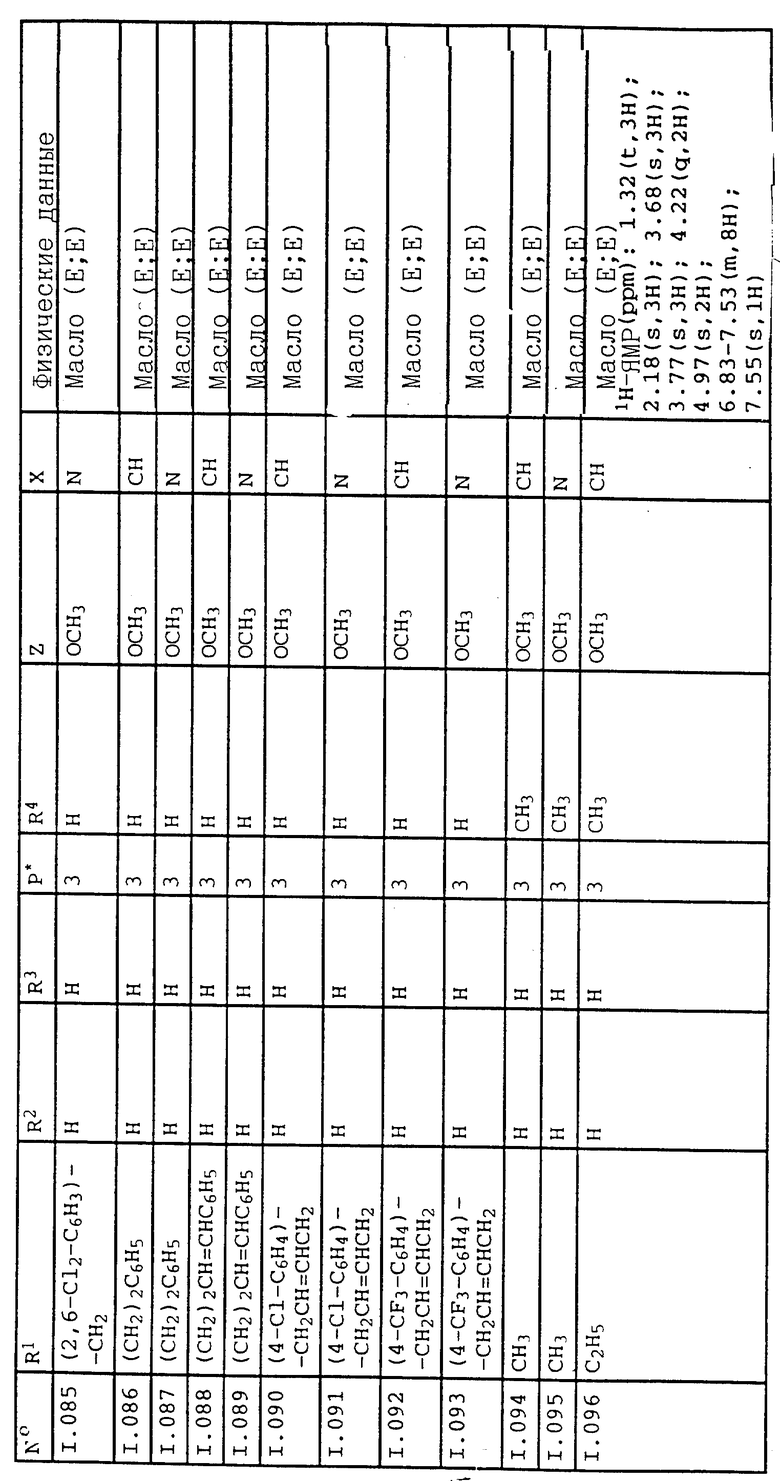
Cercospora arachidicola на земляных орехах,
Pseudocercosporella herpotrichoides на пшенице, ячмене,
Pyricularia oryzae на рисе,
Phytophtora infestans на картофеле и томатах,
Furasium- и Verticillium - разновидности на различных растениях,
Plasmopara viticola на винограде,
Alternaria - разновидности на овощах и фруктах.
Соединения I применяются путем обработки грибков или растений, посевного материала, защищаемых от поражения грибками, или почвы фунгицидно действующим количеством активных веществ. Применение осуществляется до или после заражения материалов, растений или семян грибками.
Соединения I могут быть добавлены в обычные составы, как, например, растворы, эмульсии, суспензии, пылевидные препараты, порошок, пасты и грануляты. Формы применения определяются целью применения; в каждом случае они должны обеспечивать тонкое и равномерное распределение орто-замещенного сложного бензилового эфира циклопропанкарбоновой кислоты. Составы получают известным способом, например, путем смешивания активного вещества с растворителями и/или наполнителями, в случае необходимости при использовании эмульгирующих и диспергирующих средств, причем, кроме воды, в качестве разбавителя могут применяться также другие органические растворители, такие как вспомогательные растворители. Для этой цели в качестве вспомогательных материалов в основном рассматриваются: растворители, как, например, ароматические углеводороды (например, ксилол), хлорированные ароматические углеводороды (например, хлорбензолы), парафины (например, нефтяные фракции), спирты (например, метанол, бутанол), кетоны (например, циклогексанон), амины (например, этаноламин, диметилформамид) и вода; наполнители, как, например, природные размолотые горные породы (например, каолин, глинозем, тальк, мел) и синтетические мелко размолотые горные породы (например, высокодисперсная кремневая кислота, силикаты); эмульгаторы, как, например, неионогенные и анионоактивные эмульгаторы (например, простой эфир полиоксиэтилена и спирта жирного ряда, алкилсульфонаты и арилсульфонаты) и диспергаторы, как, например, отработанный лигнин-сульфитный щелок и метилцеллюлоза.
Фунгицидные средства содержат в основном от 0,1 до 95, предпочтительно от 0,5 до 90 мас.% активного вещества.
Нормы расхода в зависимости от требуемого эффекта находятся в пределах от 0,01 до 3 кг активного вещества на га.
При обработке посевного материала обычно требуется активного вещества от 0,001 до 50 г, предпочтительно от 0,01 до 10 г на каждый килограмм посевного материала.
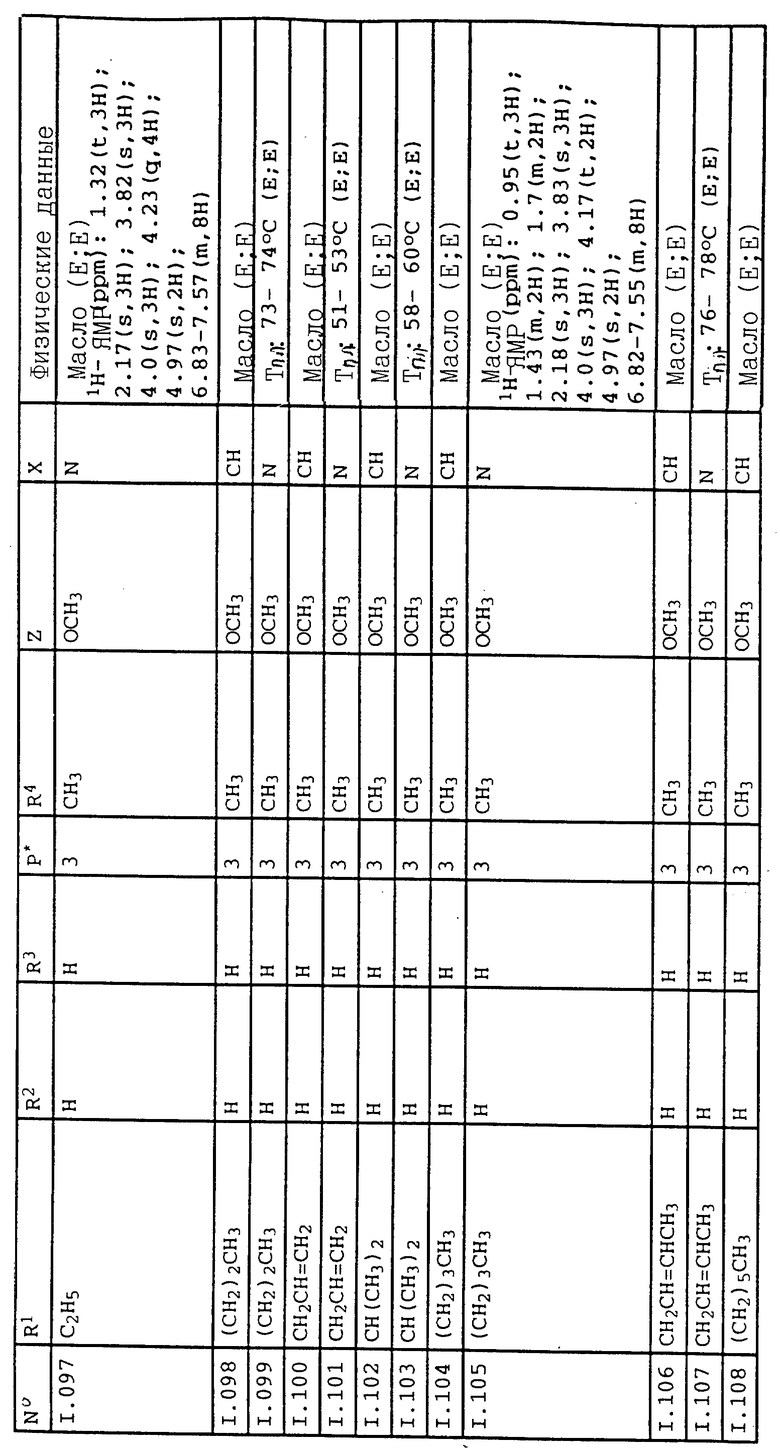
Предложенные в изобретении средства могут применяться в виде фунгицидов также вместе с другими активными веществами, например гербицидами, инсектицидами, регуляторами роста, фунгицидами или также с удобрениями.
При этом при смешивании с фунгицидами получают во многих случаях расширение спектра действия фунгицидов.
Кроме того, соединения формулы IA пригодны для борьбы с вредителями класса насекомых, паукообразных и нематодов. Они могут применяться для защиты растений, а также в области гигиены, защиты запасов продуктов и ветеринарии для борьбы с вредителями.
К вредным насекомым относятся из отряда бабочек /чешуекрылые/, например, Agrotis ypsilon, Agrotis segetum, Alabama argillacea, Anticarsia gemmatalis, Argyresthia conjugella, Autographa gamma, Bupalus piniarius, Cacoecia murinana, Capua reticulana, Cheimatobia brumata, Choristoneura fumiferana, Chotistoneura occidentalis, Cirphis unipunkta, Cydia pomonella, Dendrolimus pini, Diaphania nitidalis, Diatraea grndiosella, Earias insulana, Elasmopalpus lignosellus, Eupoecilia ambiquella, Evetria bouliana, Feltia subterranea, Galleria mellonella, Grapholita funebrana, Grapholita molesta, Heliothis armigera, Heliothis virescens, Heliothis zea, Hellula undalis, Hibernia defoliaria, Hyphantria cunea, Hyponomeuta malinellus, Keifferia lycopersicella, Lambdina fiscellaria, Laphygmy exigua, Leucoptera coffeella, Leucoptera scitella, Lithocolletis blancardella, Lobesia botrana, Loxostege sticticalis, Lymantria dispar, Lymantria monacha, Lyonetria clerkella, Malacosoma neustria, Mamestra brassicae, Orgyia pseudotsugata, Ostrinia nubilalis, Panolis flamea, Pectinophora gossypiella, Peridroma saucia, Phalera bucephala, Phthorimaea operculella, Phyllocnistis citrella, Pieris brassicae, Plathypena scarbra, Plutella xylostella, Pseudoplusia includens, Phyacionia frustrana; Scrobipalpula absoluta, Sitotroga cerelella, Sparganothis pilleriana, Spodoptera frugiperda, Spodoptera littoralis, Spodoptera litura, Thaumatopoea pityocampa, Tortrix viridana, Tricoplusia ni, Zeiraphera canadensis.
Из отряда жуков (жесткокрылые), например, Agrilus sinuatus, Agriotes lineatus, Agriotes obscurus, Amphimallus solstitialis, Anisandrus dispar, Anthonimus grandis, Anthonomus pomorum, Atomaria linearis, Blastophagus piniperda, Blitophaga undata, Bruchus rufimanus, Bruchus pisorum, Bruchus lentis, Bictiscus betulae, Cassida nebulosa, Cerotoma trifurcata, Ceuthorrhynchus assimilis, Ceuthorrynchus napi, Chaetochema fibialis, Conoderus vespertinus, Crioceris asparagi, Diabrotica longicornis, Diabrotica 12-punctata, Dicbrotica virgifera, Epilachna varivestis, Epitrix hirtipennis, Eutinobothrus brasiliensis, Hylobius abietis, Hypera brunneipennis, Hypera postica, Ips typographus, Lema bilineata, Lema melanopus, Leptinotarsa decemlineata, Limonius californicus, Lissorhoptrus oryzophilus, Melanotus communis, Meligethes aenueus, Melolontha hippocastani, Melolontha melolontha, Onlema oryzae, Ortiorrhynchus sulcatus, Otiorrhynchus ovatus, Phaedon cochleariae, Phyllotreta chrysocephala, Phyllophaga sp., Phyllopertha horticola, Phyllotreta striolata, Popillia japonica, Sitona lineatus, Sitophilus granaria.
Из отряда двукрылых, например, Aedes aegypti, Aedes vexans, Anastrepha ludens, Anopheles maculipennis, Ceratitus capitata, Chrisomya bezziana, Chrysomya hominivorax, Chrysomya macellaria, Gontarinia sorghicola, Cordylobia anthopophaga, Culex pipiens, Dacus cucurbitae, Dacus oleae, Dasineura brassicae, Fannia canicularis, Gasterophilus intestinalis, Glossia morsitans, Haematobia irritans, Haplodiplosis equetris, Hylemyia platura, Hypoderma lineata, Liriomyza sativae, Liriomyza trifolii, Lucilia caprina, Lucilia cuprina, Lucilia sericata, Lycoria pectoralis, Mayetiola destructor, Musca domestica, Muscina stabulans, Oestrus ovis, Oscinella frit, Pegormya hysocyami, Phorbia antiqua, Phobia brassicae, Phorbia coarctata, Rhagoletis cerasi, Phagoletis pomonella, Tabanus bovinus, Tipula oleracea, Tipula paludosa.
Из отряда трипсов (бахромчатокрылые), например, Frankliniella fusca, Frankliniella occidentalis, Frankliniella tritici, Scirtothrips citri, Thrips oryzae, Thrips palmi, Thrips tabaci.
Из отряда перепончатокрылых, например, Athalia rosae, Atta cephalotes, Atta sexdens, Atta texana, Hoplocampa minuta, Hoplocampa testudinea, Monomorium pharaonis, Solenopsis geminata, Solenopsis invicta.
Из отряда клопов (полужесткокрылые), например, Acrosternum hilare, Blussus leucopterus, Cyrtopeltis notatus, Dysdercus cingulatus, Disdercus intermedius, Eurygaster integriceps, Euchistus impictiventris, Leptoglossus phyllopus, Lygus lineolaris, Lygus pratensis, Nezara viridula, Piesma quadrata, Solubea insularis, Thyanta perditor.
Из отряда равнокрылых хоботных, например, Acyrthosiphon onobrychis, Adelges laricis, Aphidula nasturtii, Aphis fabae, Aphis pomi, Aphis sambuci, Brachycaudus cardui, Brevicoryne brassicae, Cerosipha gossypii, Dreyfusia nordmannianae, Dreyfusia piceae, Dyasphis radicola, Dysaulacorthum pseudosolani, Empoasca fabae, Macrosiphum avenae, Macrosiphum euphorbiae, Macrosiphon rosae, Meguora viciae, Metopolophium dirhodum, Myzodes persicae, Myzus cerasi, Nilaparvata lugens, Pemphigus bursarius, Perkinsella saccharicida, Phorodon humuli, Psylla mali, Psylla piri, Rhapalomyzus ascalonicus, Rhopalosiphum maidis, Sappaphis mala, Sappahis mali, Schizaphis graminum, Schizoneura lanuginosa, Trialeurodes vaporariorum, Viteus vitifolii.
Из отряда термитов, например, Calotermes flavicollis, Leucotermes flavipes, Retuculitermes lucifugus, Termes natalensis.
Из отряда прямокрылых, например, Acheta domestica, Blatta orientalis, Blatella germanica, Forficula auricularia, Gryllotalpa gryllotalpa, Locusta migratoria, Melanoplus birittatus, Melanoplus femur-rubrum, Melanoplus mexicanus, Melanoplus sanguinipes, Melanoplus spretus, Nomadacris septemfasciata, Periplaneta americana, Schistocerca americana, Schistocerca peregrina, Stauronotus maroccanus, Tachycines asynamorus.
Из отряда паукообразных, например, Amblyomma americanum, Amblyomma variegatum, Argas persicus, Boophilus annulatus, Boophilus decoloratus, Boophilus microplus, Brevipalpus phoenicis, Bryobia praetiosa, Dermacentor silvarum, Eotetranychus carpini, Eriophyes sheldoni, Hyalomma truncatum, Ixodes ricinus, lxodes rubicundus, Ornithodorus moubata, Otobins megnini, Paratetranychus pilosus, Permanyssus gallinae, Phyllocaptrata oleivora, Polyphagatarsonemus latus, Psoroptes ovis, Rhipicephalus appendiculatus, Rhipicephalus evertsi, Saccoptes scabiei, Tetranychus telarius, Tetranychus urticae.
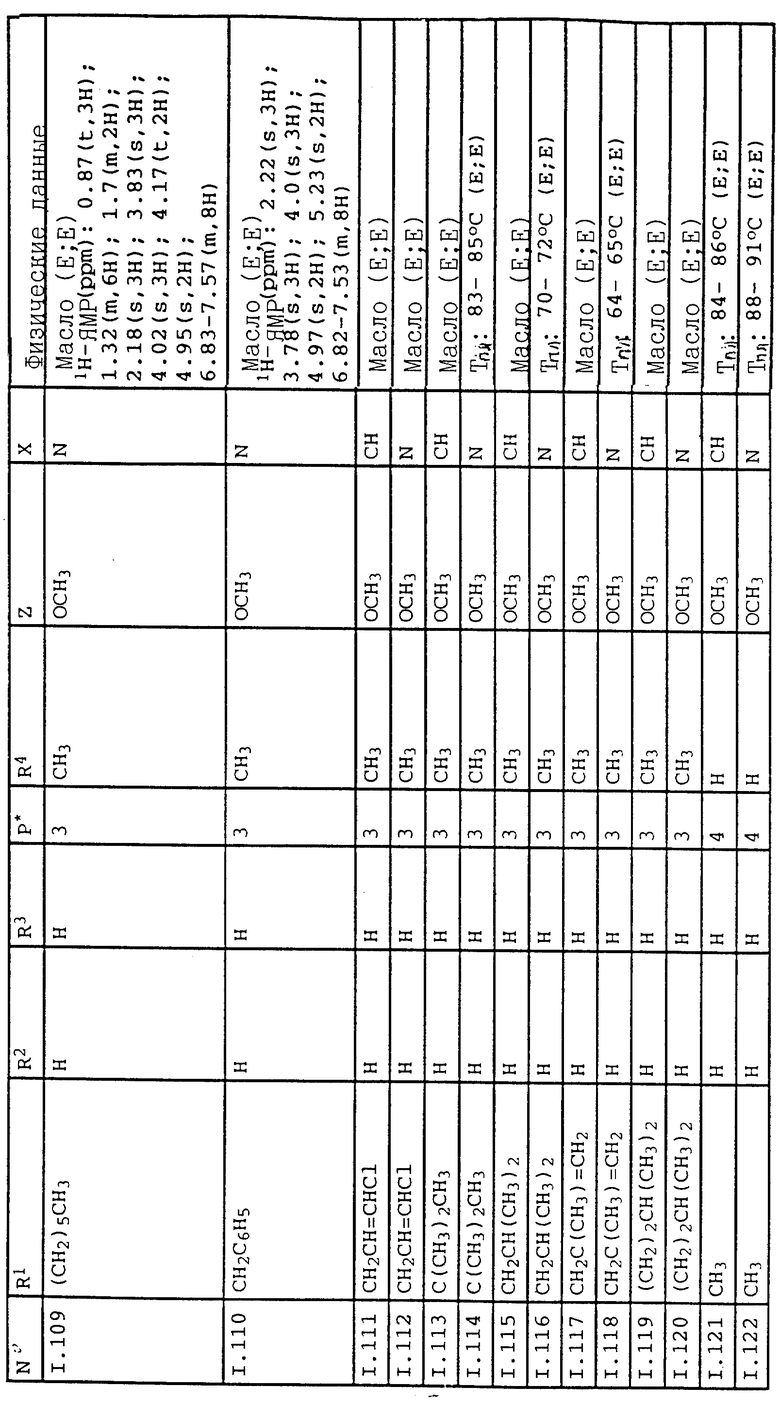
Из класса нематодов, например, корневые желчные круглые черви, например, Meloidogyne halpa, Meloidogyne incognita, Meloidogine javanica, нематоды, образующие кисту, например, Globodera rostochiensis, Heterodera avenae, Heterodera glycinae, Heterodera schatii, Heterodera trifolii, луковый и листовой дитиленх, например, Belonolaimus longicaudatus, Ditylenchus destructor, Ditylenchus dipsaci, Heliocotylenchus multicinctus, Longidorus elongatus, Radopholus similis, Rotylenchus robustus, Trichodorus primitivus, Tylenchorhynchus claytoni, Tylenchorhynchus dubius, Pratylenchus neglectus, Pratylenchus penetrans, Pratylenchus curvitatus, Pratylenchus goodeyi.
Активные вещества могут применяться в виде составов, либо в приготовленных из этих составов формах, готовых для применения, например, в виде непосредственно распыляемых растворов, порошков, суспензий или дисперсий, эмульсий, масляных дисперсий, паст, пылевидных препаратов, разбрасываемых препаратов, гранулятов посредством распыления, опыливания, опрыскивания, разбрасывания или поливки. Формы применения зависят от цели применения; в каждом случае они должны обеспечивать распределение предложенных в изобретении активных веществ, по возможности с очень тонким слоем.
Концентрации активного вещества в готовых к применению составах могут варьироваться в широком диапазоне.
В основном они находятся в пределах от 0,0001 до 10%, предпочтительно в пределах от 0,01 до 1%.
Активные вещества могут применяться также с большим успехом по способу сверхнизкого объема (ULV), причем можно получать составы с более чем 95 мас. % активного вещества или даже активное вещество без добавок.
Норма расхода активного вещества для борьбы с вредителями в условиях открытого грунта достигает от 0,01 до 2,0, предпочтительно от 0,2 до 1,0 кг/га.
Для получения непосредственно распыляемых растворов, эмульсий, паст или масляных дисперсий используются минеральные масляные фракции с температурой кипения от средней до высокой, как, например, керосин или дизельное масло, масла каменноугольной смолы, а также масла растительного или животного происхождения; алифатические, циклические и ароматические углеводороды, например бензол, толуол, ксилол, парафин, тетрагидронафталин; алкилированные нафталины или их производные; метанол, этанол, пропанол, бутанол, хлороформ, четыреххлористый углерод, циклогексанол, циклогексанон, хлорбензол, изофорон; сильнополярные растворители, например диметилформамид, диметилсульфоксид, N-метилпирролидон, вода.
Водные формы применения могут быть приготовлены из эмульсионных концентратов, паст, порошков (смачивающийся порошок, масляные дисперсии) путем добавления воды. Для получения эмульсий, паст или масляных дисперсий можно вещества, в исходном виде или растворенные в масле или растворителе, гомогенизировать в воде с помощью смачивающих средств, адгезивных добавок, диспергаторов или эмульгаторов. Однако могут быть получены также концентраты, состоящие из активного вещества, смачивающего средства, адгезивных добавок, диспергатора или эмульгатора и соответственно растворителя или масла, пригодные для разбавления водой.
В качестве поверхностно-активных веществ рассматриваются соли щелочных, щелочноземельных металлов, аммониевой соли лигнинсульфокислоты, нафталинсульфокислоты, фенолсульфокислоты, дибутилнафталинсульфокислоты, алкиларилсульфонаты, алкилсульфаты, алкилсульфонаты, сульфаты спиртов жирного ряда и кислоты жирного ряда, а также их соли щелочных и щелочноземельных металлов, соли сульфатированного простого гликолевого эфира и спирта жирного ряда, продукты конденсации сульфонированного нафталина и производных нафталина с формальдегидом, продукты конденсации нафталина или нафталинсульфокислоты с фенолом и формальдегидом, простой полиоксиэтиленоктилфеноловый эфир, этоксилированный изооктилфенол, октилфенол, нонилфенол, простой алкилфенолполигликолевый эфир, простой трибутилфенилполигликолевый эфир, алкиларилполиэфир многоатомных спиртов, изотридециловый спирт, конденсаты этиленоксида и спирта жирного ряда, этоксилированное касторовое масло, простой полиоксиэтиленалкиловый эфир, этоксилированный полиоксипропилен, ацеталь простого полигликолевого эфира лаурилового спирта, сложный сорбитовый эфир, отработанный лигнинсульфитный щелок и метилцеллюлоза.
Порошки, гранулы и пылевидные препараты могут быть получены путем перемешивания или размалывания активных веществ с твердым наполнителем.
Составы содержат активное вещество, в основном в пределах от 0,01 до 95 мас. %, предпочтительно от 0,1 до 90 мас.%. При этом активные вещества применяются с чистотой от 90 до 100%, предпочтительно от 95 до 100% (по ЯМР-спектру).
Примерами составов являются:
Грануляты, например грануляты в оболочке, пропиточные и гомогенные грануляты. Они могут быть получены путем связывания активных веществ с твердыми наполнителями. Твердыми наполнителями являются, например, природный асфальт, как, например, силикагель, кремневые кислоты, силикаты, тальк, каолин, глинозем, известняк, известь, мел, болюс, лесс, глина, доломит, диатомовая земля, сульфат кальция и магния, окись магния, размолотые синтетические материалы, удобрения, как, например, сульфат аммония, фосфат аммония, нитрат аммония, мочевина и растительные продукты, как, например, зерновая мука, мука из древесной коры, древесная мука и мука из ореховой скорлупы, целлюлозный порошок и другие твердые наполнители.
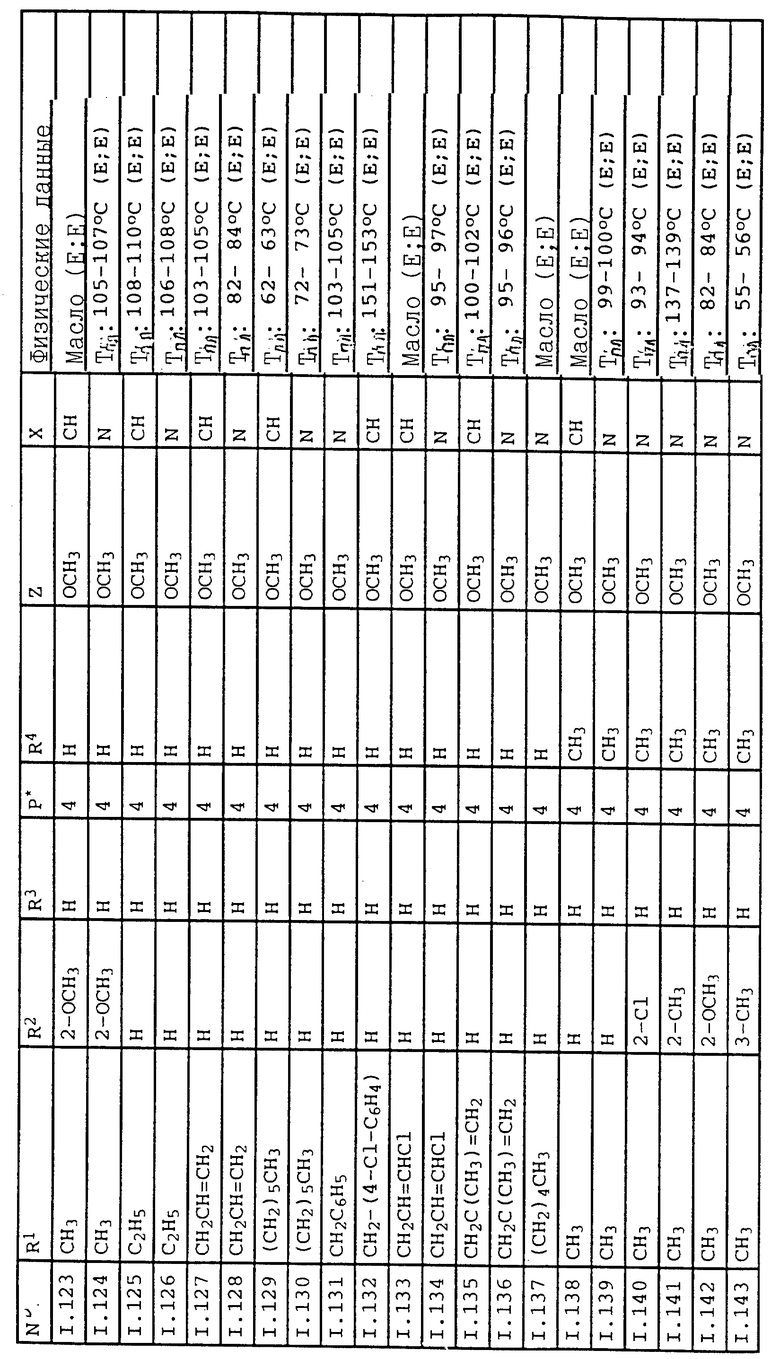
К активным веществам могут быть добавлены масла различного типа, гербициды, фунгициды, другие пестициды, бактерициды также непосредственно перед применением. Эти средства могут смешиваться с предложенными в изобретении средствами в массовом соотношении от 1:10 до 10:1.
Предложенные в изобретении средства могут находиться в этих формах применения также вместе с другими активными веществами, как, например, гербицидами, инсектицидами, регуляторами роста и фунгицидами или в смеси с удобрениями. При смешивании с фунгицидами во многих случаях получают увеличение спектра фунгицидного действия.
Примеры применения активных веществ для воздействия против вредных грибков.
В качестве сравнительных активных веществ использовались следующие соединения: сложный метиловый эфир О-метилоксима 2-(2'-метилфеноксиметил) фенилглиоксиловой кислоты (A) формулы, описанный в EP 253213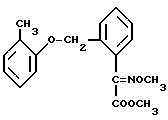
и сложный метиловый эфир О-метилоксима 2-[2'-метил-4'- (метоксииминоэт-1''-ил)-феноксиметил] фенилглиоксиловой кислоты (B) формулы, описанный в EP 386561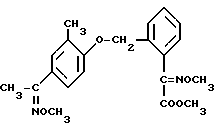
A.1. Действие против Plasmopara viticola
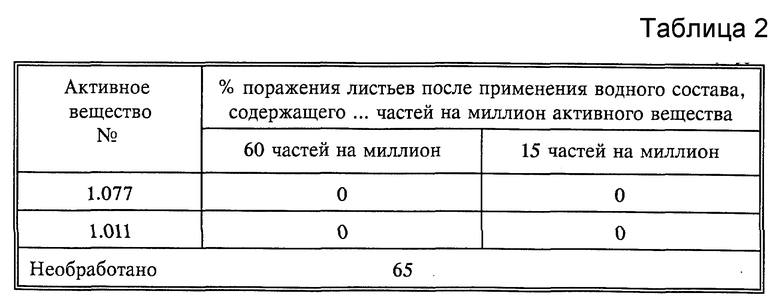
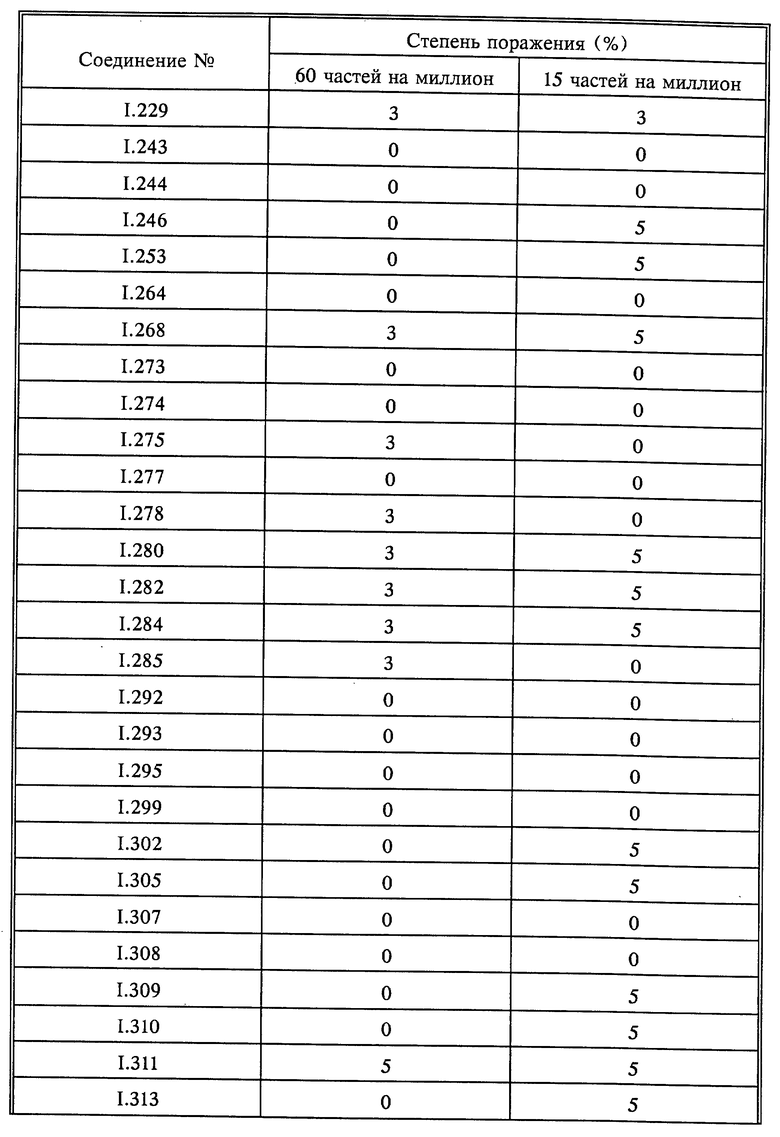
Листья горшечного винограда сорта "Muller Thurgau" обрабатывают водным раствором для опрыскивания, содержащим 80% активного вещества и 20% эмульгатора в сухом веществе. Для анализа длительности действия активных веществ растения после высушивания нанесенного слоя помещают в теплицу на 8 дней. Лишь после этого листья инфицируют взвесью зооспор Plasmopara viticola (виноградные споры). Затем виноград помещают сначала на 48 часов в камеру, насыщенную водяным паром, при температуре 24oC и затем на 5 дней в теплицу при температуре в пределах от 20 до 30oC. По истечении этого времени для ускорения разрыва спорангиеносца растения вторично помещают во влажную камеру на 16 часов. Затем следует оценка размера разрыва грибка на обратной стороне листьев (см. табл.2)
A.2. Действие против бурой ржавчины на пшенице
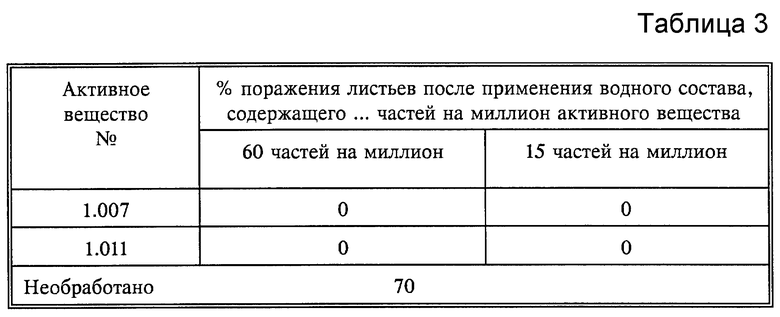
Листья выращенных в горшках сеянцев пшеницы сорта "Канцлер" опыляют спорами бурой ржавчины (Puccinia recondita). Затем горшки помещают в камеру с высокой влажностью воздуха (90-95%) на 24 часа при температуре от 20 до 22oC. В течение этого времени споры прорастают и проростки проникают в ткань листьев. Затем инфицированные растения опрыскивают водным раствором, содержащим 80% активного вещества и 20% эмульгатора в сухом веществе, до мокрого состояния. После высыхания нанесенного слоя опытные растения ставят в теплицу при температуре от 20 до 22oC и относительной влажности воздуха от 65 до 70%. Через 8 дней определяют состояние развития ржавчинных грибков на листьях (см. табл.3)
A.3. Действие против ржавчины на фасоли
Листья фасоли обыкновенной кустовой сорта "Фори" опрыскивают водной споровой суспензией фасолевой ржавчины с обратной стороны листа равномерным слоем. Затем растения выдерживают в течение 24 часов в климатической камере с высокой влажностью воздуха при температуре 19oC и затем ставят в теплицу при температуре 22-25oC. Через 2-3 дня осуществляют обработку активными веществами путем распыления на нижнюю (базальную) половину верхней стороны листа. Оценка состояния развития грибков на листьях осуществляется через 10-12 дней после опрыскивания. Благодаря временному и пространственному разделению обработки листьев спорами и обработки листьев активными веществами исключается непосредственный контакт между грибком и активным веществом; поэтому впитывание активного вещества и перемещение активного вещества в листе должно предшествовать действию фунгицида (системное передвижение). Проверка различных зон листьев позволяет установить трансламинарное или апикальное движение испытуемых активных веществ в листе.
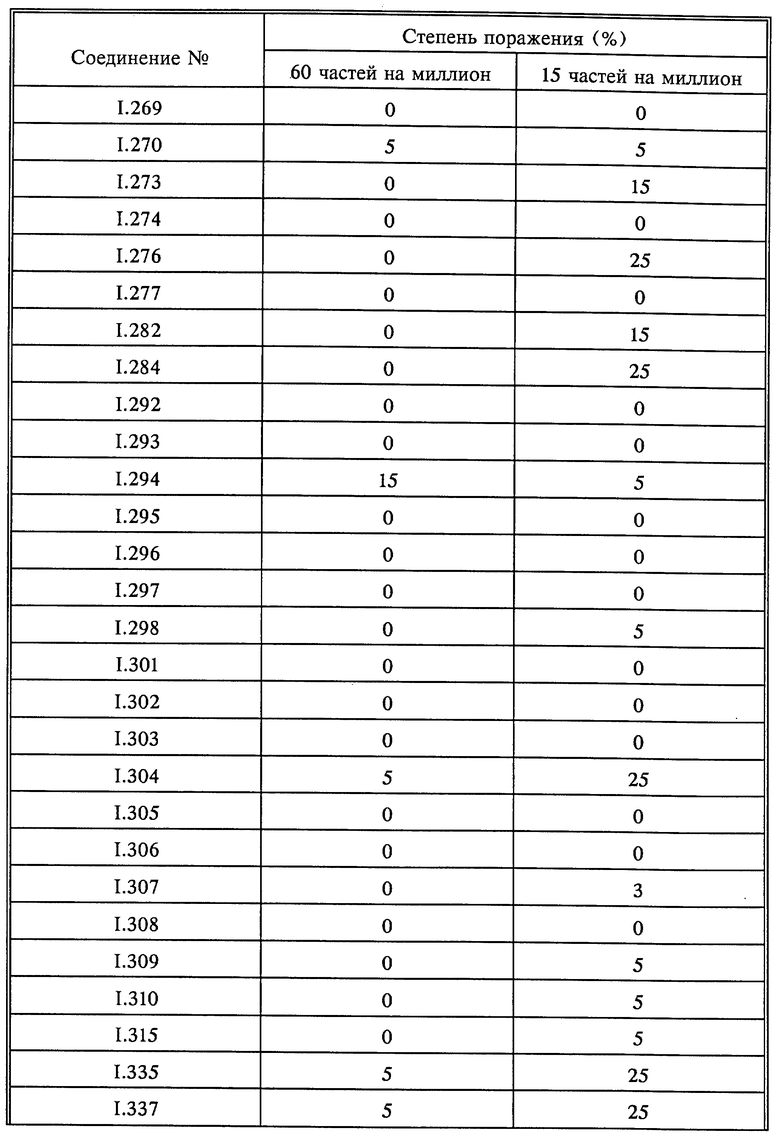
Результат опыта показывает, что после обработки раствором, содержащим 50 частей на миллион активного вещества, активные вещества I.003, I.007 и I.014 на нижней стороне листьев и частично также на необработанной части фасолевых листьев показали фунгицидное действие, в то время как известные соединения A и B не показали фунгицидного действия.
В табл. 4 представлены результаты примера A.3.
Результаты этих испытаний ясно показывают, что соединения в соответствии с заявкой на патент серийный N 08/091254 обладают определенными преимуществами и улучшенным действием в борьбе с нежелательными грибами.
Примеры применения на действие против вредителей
Действие соединений общей формулы IA против вредителей из класса насекомых, паукообразных и нематодов можно показать на следующих опытах:
Активные вещества подготавливают
а) в виде 0,1%-ного раствора в ацетоне или
б) в виде 10%-ной эмульсии в смеси из 70 мас.% циклогексанола, 20 мас.% неканила®LN(Лутензол®AP6, смачиватель с эмульгирующим и диспергирующим действием на основе этоксилированных алкилфенолов) и 10 мас.% эмульфора®EL(эмулан®EL, эмульгатор на основе этоксилированных спиртов жирного ряда)
и разбавляют в соответствии с требуемой концентрацией ацетоном в случае а) или водой в случае б).
После окончания опытов определяют самую низкую концентрацию, при которой соединение по сравнению с необработанными контрольными испытаниями еще вызывает 80%-ное подавление развития или смертность (порог действия или минимальная концентрация).
B.1. Aphis fabae (черная вошь), контактное действие
Сильно пораженную кустовую фасоль (Vicia faba) обрабатывают водным составом активного вещества. Через 24 часа определяют процент смертности.
В этом тесте соединения I.007, I.011, I.015, I.003, I.001, I.017, I.058, I.086, I.096 и I.029 показала пороги действия от 200 до 1000 частей на миллион.
B.2. Nephotettix cincticeps (зеленые рисовые цикады), контактное действие
Круглые фильтры обрабатывают водным составом активного вещества и затем накрывают ими 5 взрослых цикад. Через 24 часа определяют процент смертности.
В этом испытании соединения I.007, I.011, I.014, I.015, I.003, I.002, I. 004, I.017, I.117, I.307, I.192, I.193, I.195 и I.201 показали порог действия от 0,4 до 0,1 мг.
B. 3. Prodenia litura (Египетский хлопковый червь), опыт по культивированию
Пять личинок в стадии развития L3 (10-12 мм) помещают в стандартную питательную среду (3,1 л воды, 80 г агара, 137 г пивных дрожжей, 515 г кукурузной муки, 130 г проростков пшеницы, а также обычные добавки и витамины (20 г соли Вессона, 5 г нипагина, 5 г сорбина, 10 г целлюлозы, 18 г аскорбиновой кислоты, 1 г лютавит® бледна (витамин), 5 мл спиртового раствора биотина), предварительно смоченную водным составом активного вещества.
Наблюдение продолжается до вылупления бабочек в контрольном опыте без активного вещества.
В этом тесте соединения I.003, I.014, I.015, I.017, I.057, I.064, I.068, I. 076, I.100, I.108, I.109, I.112, I.119 и I.079 показали порог действия от 200 до 0,1 частей на миллион.
B.4. Agrotis ypsilon (почвообитающая личинка), контактное действие
Листья кукурузы на 3 секунды погружают в водный состав активного вещества и после стекания капель помещают в чашку Петри (диаметр 12 см) на круглый фильтр. В каждую чашку помещают 5 личинок 3 и 4 стадии развития (примерно 15 мм длины). Через 24 и 48 часов определяют действие по % сохранения листьев от поедания и % смертности.
В этом опыте соединения I.060, I.070, I.086, I.090, I.096, I.117, I.121, I. 129, I.140, I.177, I.307, I.189, I.190, I.191, I.192, I.193, I.195, I.201 и I.213 показали порог действия от 10 до 1000 частей на миллион.
B.5. Sitophilus granaria (долгоносик), контактное действие
Дно опытного сосуда смачивают ацетоновым раствором активного вещества и после выпаривания растворителя помещают 50 жуков. Через 4 часа жуков помещают в необработанные картонные чашечки. Эти чашечки ставят затем в сосуд для проведения опыта. Через 24 часа определяют смертность, причем жуки, которые не могут покинуть чашку, считаются мертвыми или сильно пораженными.
В этом опыте соединение I.115 показало порог действия 1 мг.
B.6. Musca domestica (муха комнатная), контактное действие
Дно сосуда для проведения опыта смачивают ацетоновым раствором активного вещества и после выпаривания растворителя в сосуд помещают 10 мух. Через 4 часа определяют процент смертности.
В этом опыте соединения I.064, I.071, I.077, I.080, I.083, I.085, I.098, I. 100, I.103, I.106, I.111, I.115, I.117, I.126, I.127, I.130, I.133, I.309 и I.184 показали порог действия от 0,01 до 2 мг.
B.7. Musca domestica (муха комнатная), опыт по культивированию
25 мл сухой кормовой смеси (1 кг отрубей, 250 г дрожжевого порошка, 35 г рыбной муки) смешивают с активным веществом и 25 мл раствора молока с сахаром (1 л молока, 42 г сахара) и затем на эту смесь помещают 20 личинок 1 стадии развития. После вылупления личинок в контрольном эксперименте определяют процент смертности.
В этом опыте соединение I.064 показало порог действия 4 части на миллион.
B.8. Prodenia litura (Египетский хлопковый червь), контрольное действие
Круглые фильтры (диаметр 9 см) обрабатывают 1 см3 водного состава активного вещества и помещают в пластиковую чашку Петри (диаметр 94 мм). Затем помещают 5 личинок Prodenia L3 в стадии развития и закрывают чашку Петри. Испытание продолжается 24 часа.
В этом опыте соединения I.098, I.100, I.102, I.106, I.111, I.115 и I.184 показали порог действия от 0,1 до 1 мг.
B.9. Prodenia litura (Египетский хлопковый червь)
5 личинок стадии развития L3 (10-12 мм) помещают в стандартную питательную среду (3,1 л воды, 80 г агара, 137 г пивных дрожжей, 515 г кукурузной муки, 130 г проростков пшеницы, а также обычные добавки и витамины (20 г соли Вессона, 5 г нипагина, 5 г сорбина, 10 г целлюлозы, 18 г аскорбиновой кислоты, 1 г лютавит® бленда (витамин), 5 мл спиртового раствора биотина)), предварительно смоченную водным составом активного вещества. Наблюдение продолжается до вылупления бабочек в контрольном опыте без активного вещества.
В этом опыте соединения I.128, I.272, I.292, I.293, I.307 и I.310 показывают порог действия от 1 до 1000 частей на миллион.
B.10. Plutella maculipennis (моль капустная), контактное действие
Листья молодых капустных растений смачивают водным составом активного вещества и затем кладут на увлажненный фильтр. Затем на обработанные листья помещают 10 личинок 4 стадии развития. Через 48 часов определяют процент смертности.
В этом опыте соединения I.064, I.065, I.068, I.079, I.081, I.084, I.086, I.088, I.090, I.117 и I.130 показали порог действия от 200 до 1000 частей на миллион.
B.11. Aedes aegypti (мошка желтой лихорадки), опыт по культивированию
Пластиковые стаканы емкостью 250 мл (диаметр 8 см) заполняют 200 мл водопроводной воды при температуре воды 23oC и в них помещают 30-40 личинок Aedes 3 - 4 стадии развития. В сосуд добавляют испытуемое вещество в виде водной эмульсии и в суспензии через 24 часа определяют смертность в сосудах. Затем культивирование продолжается до вылупления мошек. Комнатная температура достигает 25oC.
В этом опыте соединение I.128 показало порог действия 0,1 частей на миллион.
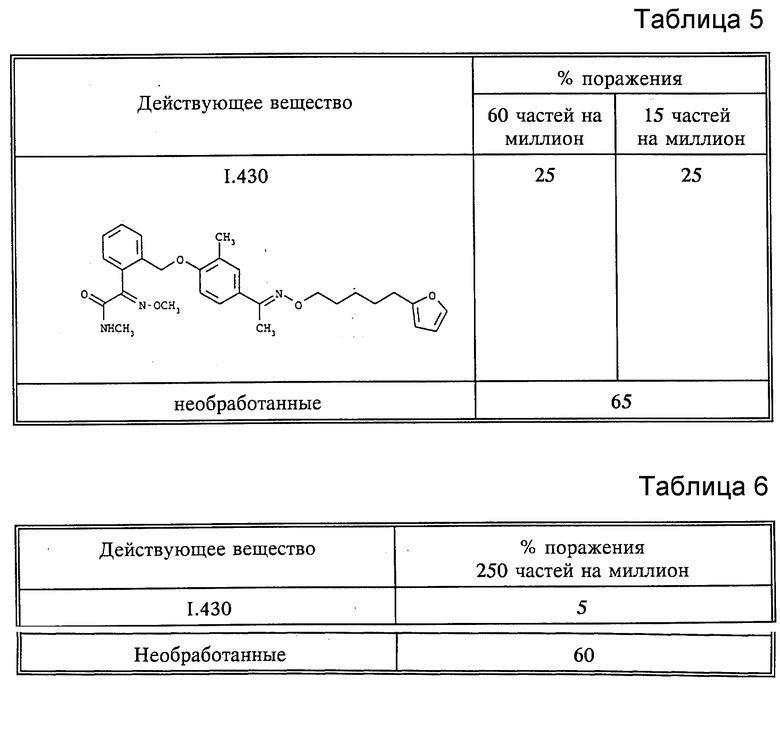
1. Действие против Plasmopara viticola (ложная мучнистая роса винограда)
Виноград в горшочках (сорт "Muller-Thurgau") интенсивно опрыскивали до появления капель приготовленным раствором действующего вещества. Через 8 дней растение опрыскивали взвесью зооспор грибов Plasmopara viticola и затем выдерживали в течение 5 дней при 20-30oC при высокой влажности воздуха. По истечении этого времени растение для ускорения формирования зооспорангий оставляли на 16 часов во влажной камере. Затем определяли степень поражения на нижней стороне листа визуальным способом (см. табл. 5).
2. Действие против Pyricularia oryzae (защитн.)
Листья из выращенных в горшочках проростков риса сорта "Tail-Nong 67" интенсивно до появления капель опрыскивались составом, содержащим действующее вещество в количестве 10%, 63% циклогексанона и 27% эмульгатора. На следующий день растение инокулировали водной суспензией спор Pyricularia oryzae. После этого исследуемое растение помещали в камеру с искусственным климатом при 22-24oC и относительной влажности 95-99% на 6 дней. Затем визуально определяли процент повреждения на нижней стороне листа (см. табл. 6).
Пример, доказывающий действие против грибков
Фунгицидное действие соединений общей формулы I доказывается с помощью следующих опытов.
Активные вещества приготовлены в виде 20%-ной эмульсии, состоящей из смеси 70 мас.% циклогексанона, 20 мас.% Nekanil® (Lutensol® AP6, смачивающее средство с действием эмульгатора и диспергатора на основе алкилфенола) и 10 мас. % Wettol® EM (неионный эмульгатор на основе этоксилированного рецинолевого масла), и соответственно эмульсия разбавляется водой до необходимой концентрации.
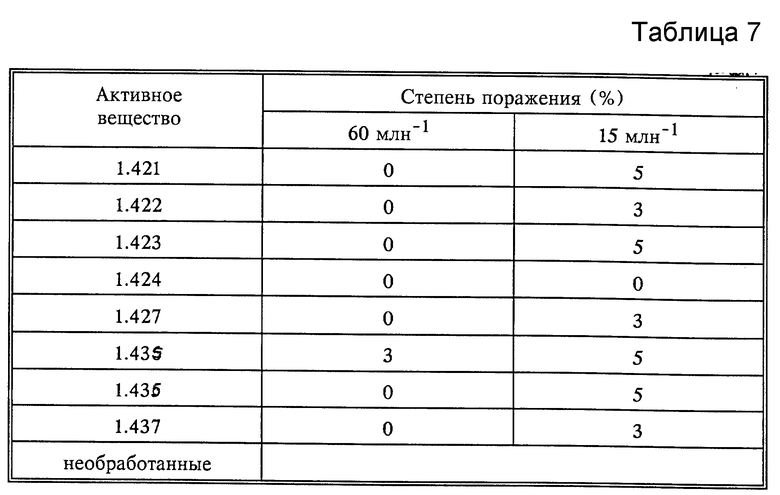
Действие против Plasmopara viticola (Rebenpersonospora)
Высаженный в горшок виноград (сорт Mueller Thurgau) был опрыскан приготовленным раствором активного вещества до образования капель. Через 8 дней растения были опрысканы раствором спор грибка Plasmopara viticola и растения выдерживались 5 дней при температуре 20-30oC при высокой влажности воздуха. Перед контролем растения выдерживались 16 часов при высокой влажности воздуха. Контроль проводился визуально (см. табл. 7).
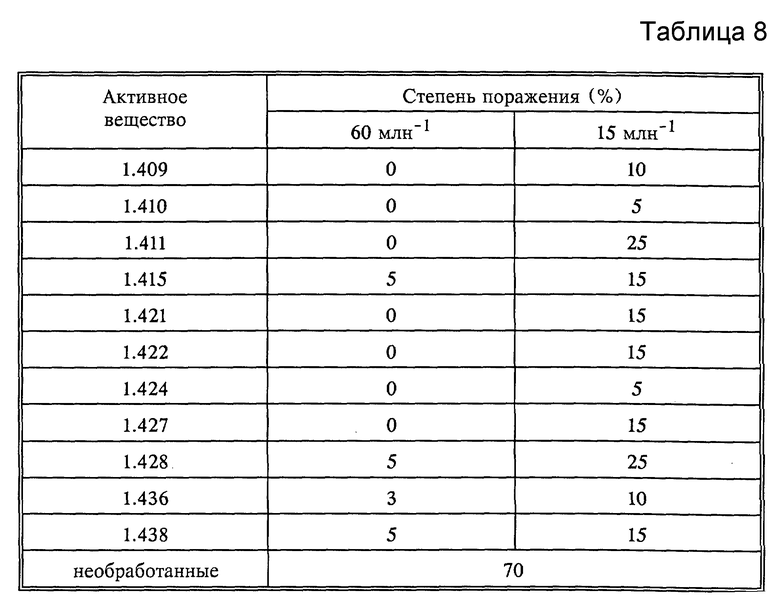
Действие против Puccinia recondita (красная ржавчина пшеницы)
Листья проростков пшеницы (сорт Kanzler) посыпались спорами красной ржавчины Puccinia recondita. Обработанные таким образом растения выдерживались 24 часа при температуре 20-22oC и относительно высокой влажности воздуха 90-95%, а затем обрабатывались водным раствором эмульсии. Через следующие 8 дней выдержки при температуре 20-22oC и влажности воздуха 65-70% проводился контроль развития грибков. Контроль проводился визуально (см. табл. 8).
Фунгицидное действие соединений формулы I в соответствии с изобретением иллюстрируют нижеследующие эксперименты.
С использованием активнодействующих компонентов готовили 20%-ную эмульсию в смеси 70 мас.% циклогексанона, 20 мас.% Nekanil® (Lutensol® AP6, поверхностно-активное вещество с эмульгирующим и диспергирующим действием на основе оксиэтилированных алкилфенолов) и 10 мас.% Emulphor® EL (Emulan®EL, эмульгатор на основе оксиэтилированных жирных спиртов) и разбавляли водой до желаемой концентрации.
Действие на Plasmopara viticola (ложная мучнистая роса).
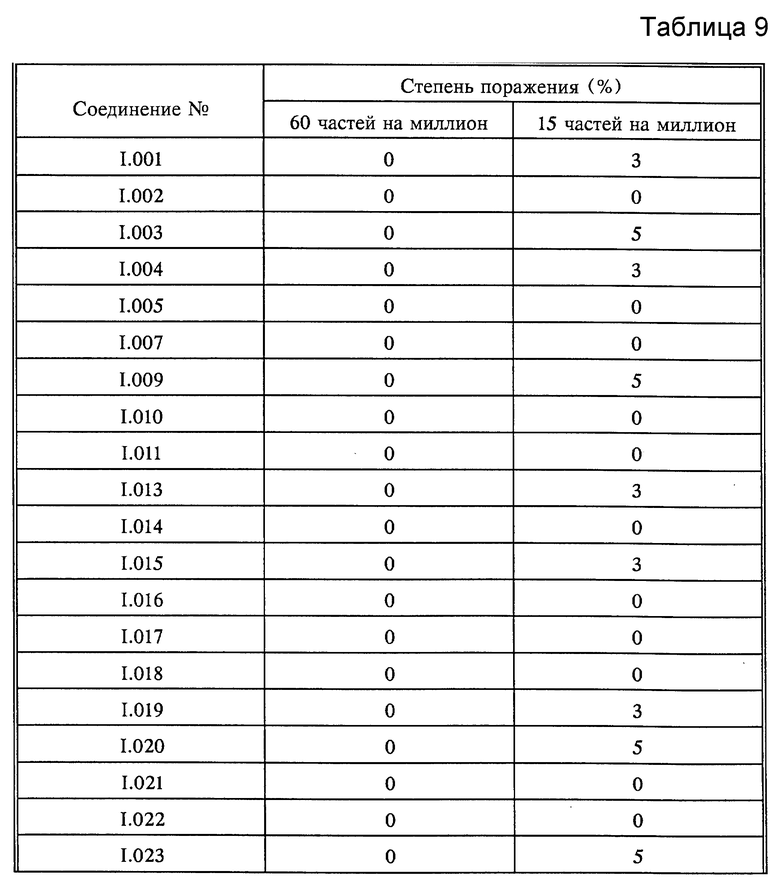
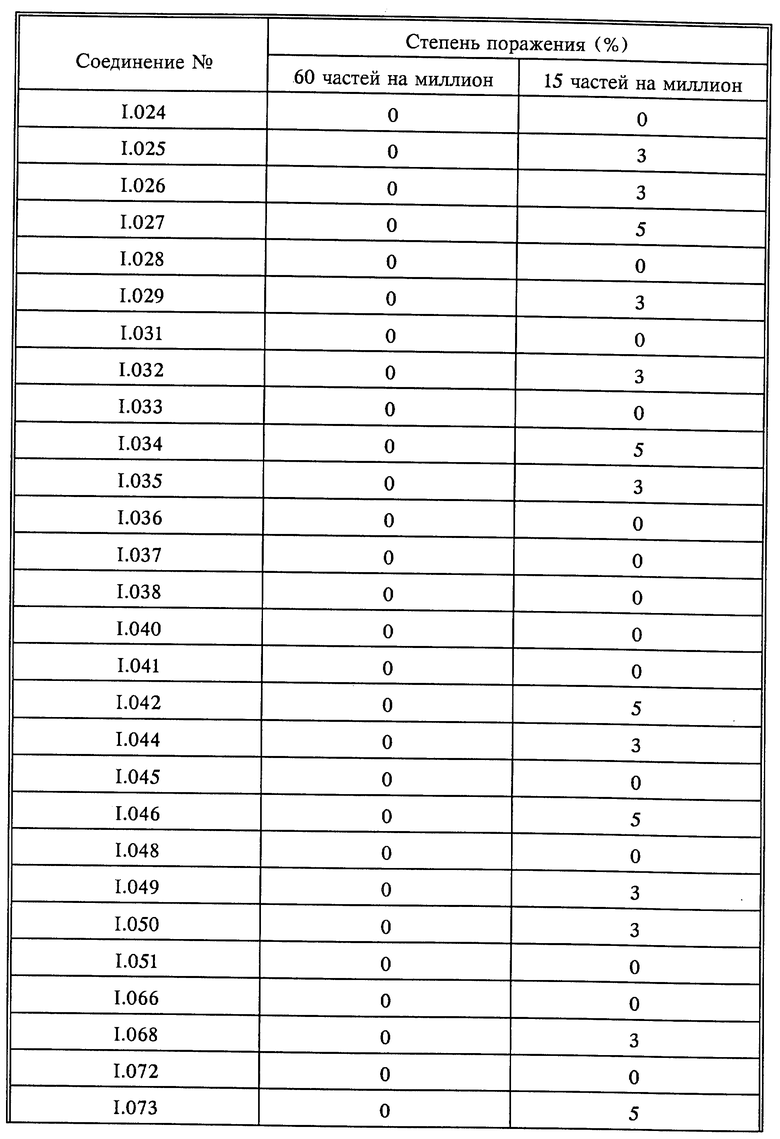
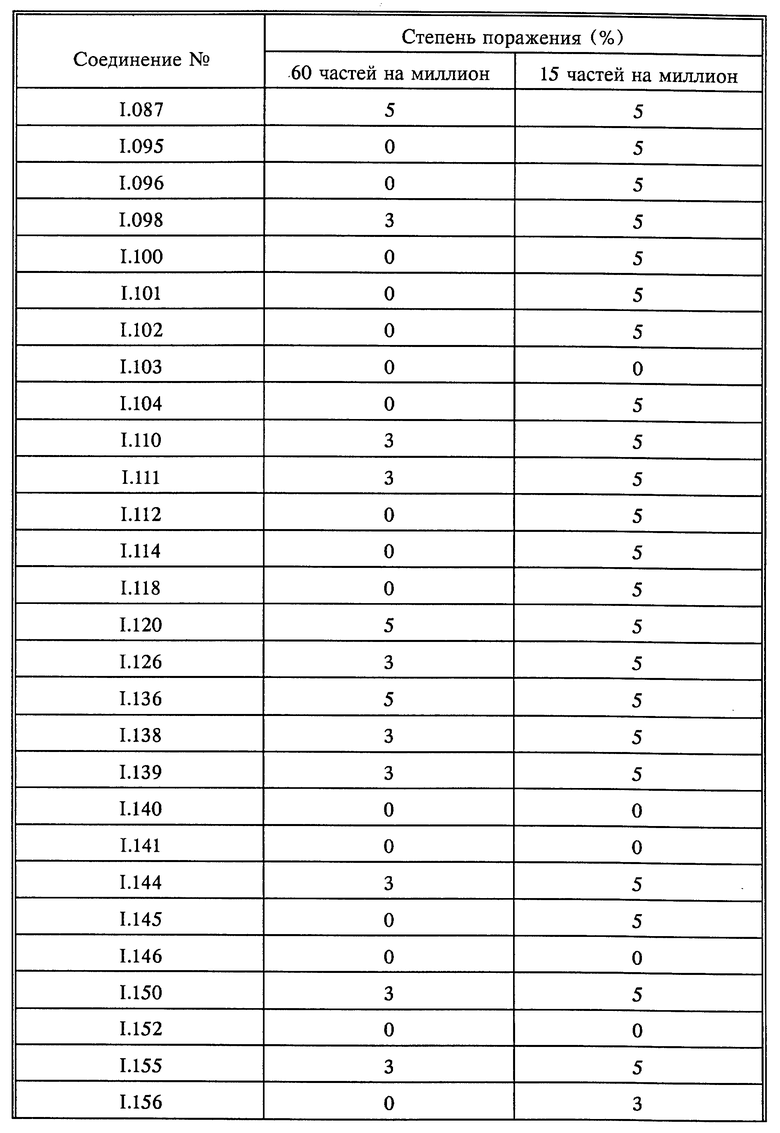
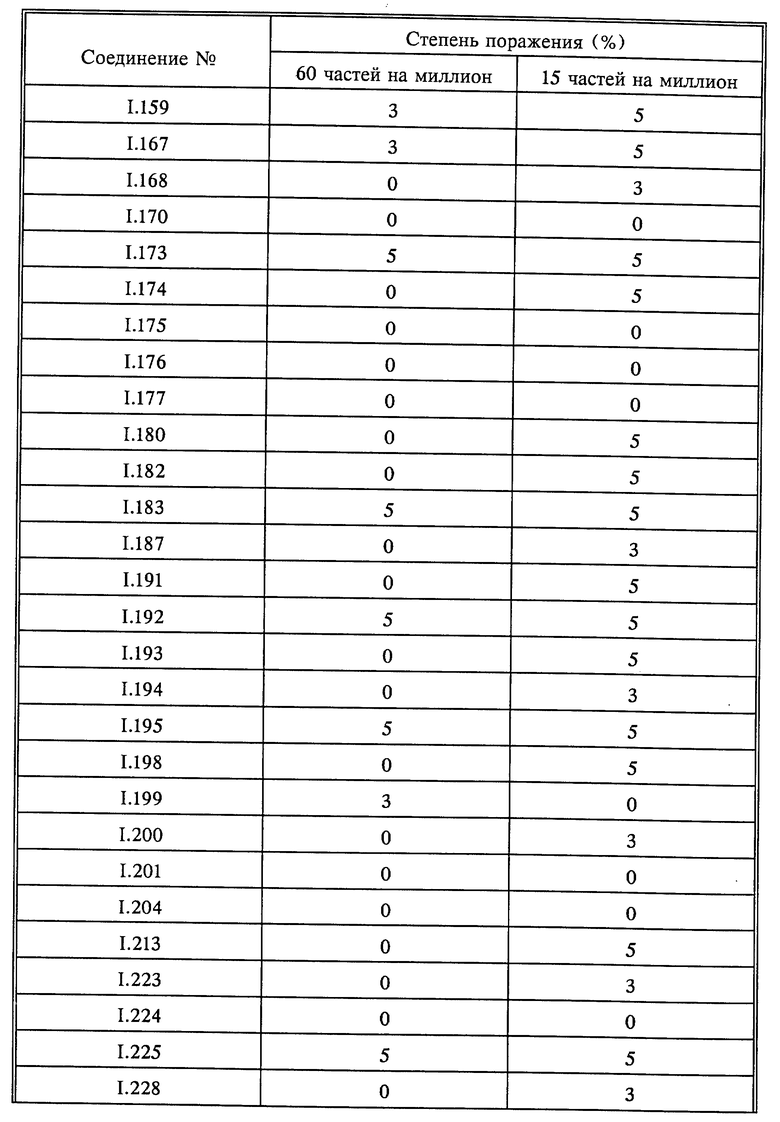
Растения горшечного винограда сорта "Muller Thurgau" опрыскивали до стекания жидкости композициями активнодействующих компонентов. По истечении 8 дней растения опрыскивали зооспорной суспензией плесени Plasmopara viticola и выдерживали в течение 5 дней при 20-30oC и высокой относительной влажности. В дальнейшем растения выдерживали при высокой относительной влажности в течение 16 часов и оценивали. Оценку производили визуально (см. табл. 9).
Действие на Puccinia recondita (бурная ржавчина злаков)
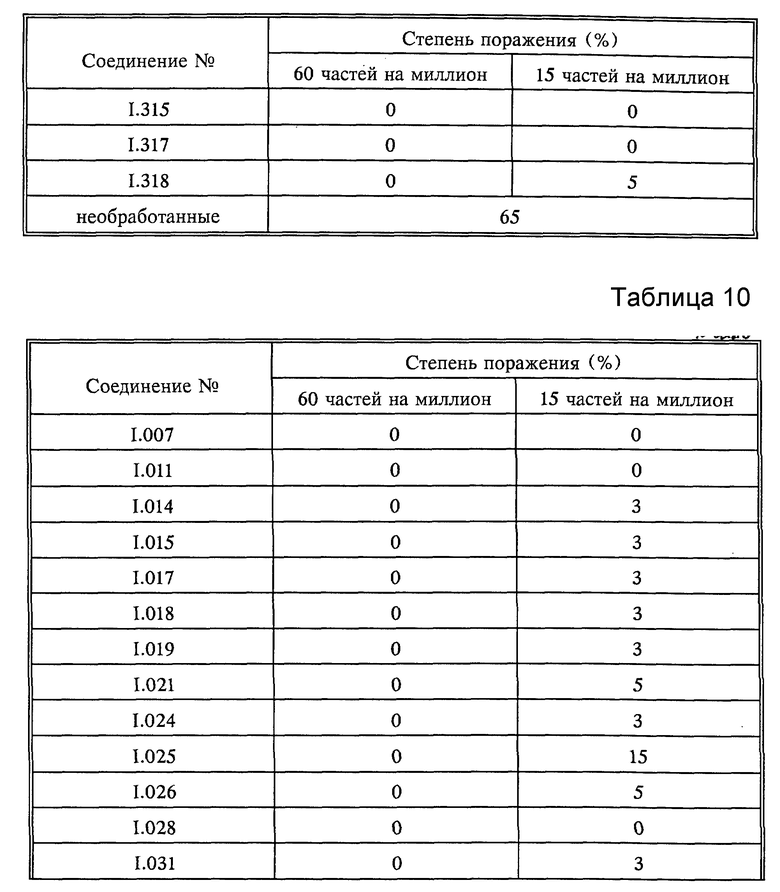
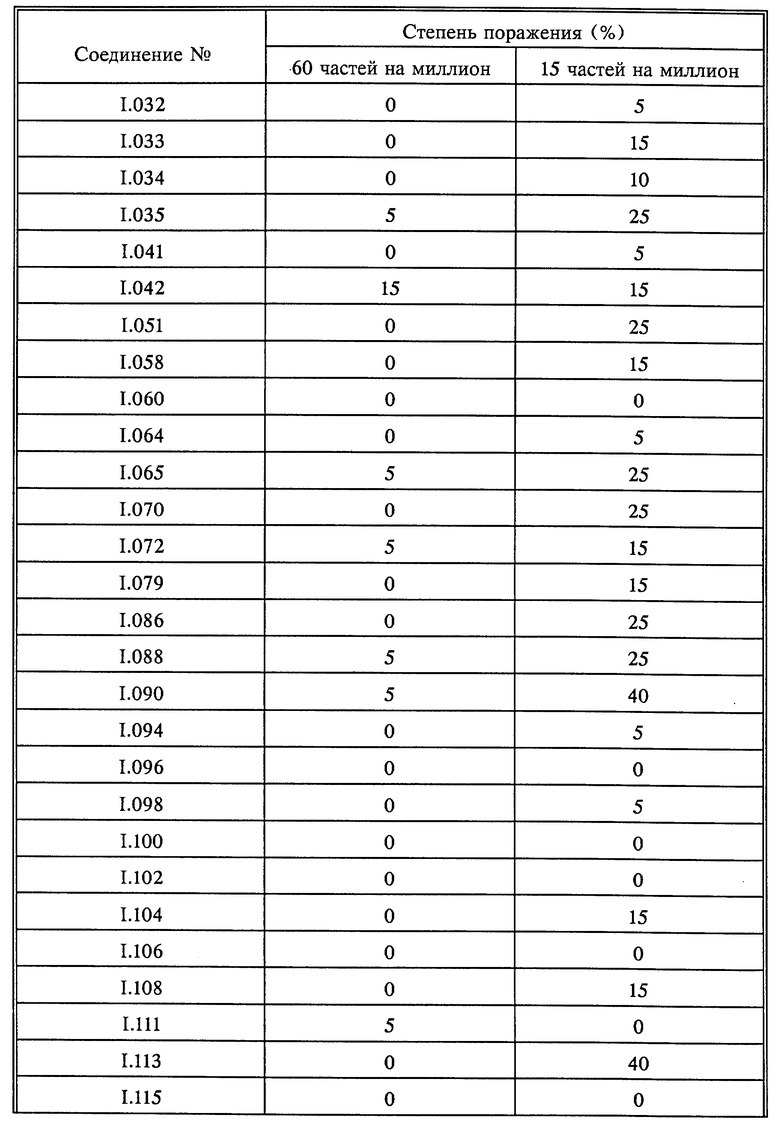
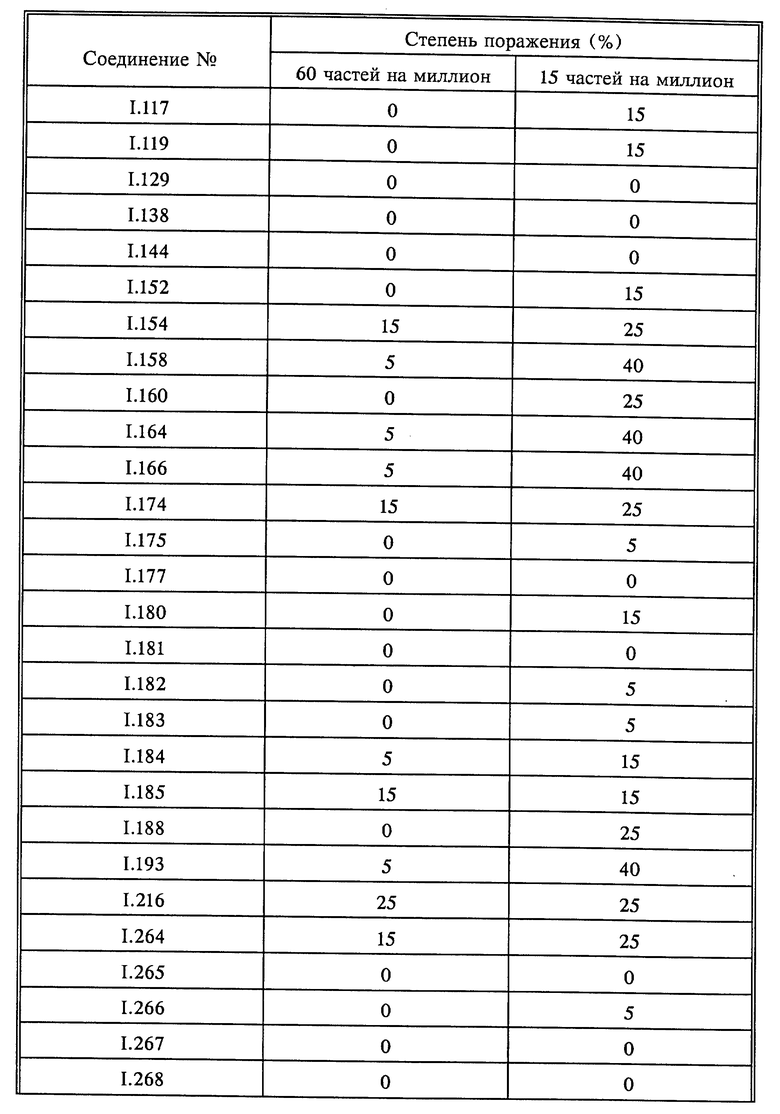
Листья всходов пшеницы сорта "Kanzler" опыляли спорами бурой ржавчины пшеницы (Puccinia recondita). Обработанные таким образом растения инкубировали в течение 24 часов при 20-22oC и относительной влажности 90-95%, а затем обрабатывали водными композициями активнодействующих компонентов. По истечении последующих 8 дней при 20-22oC и относительной влажности 65-70% определяли степень роста плесени. Результаты оценивали визуально; они представлены в табл. 10.
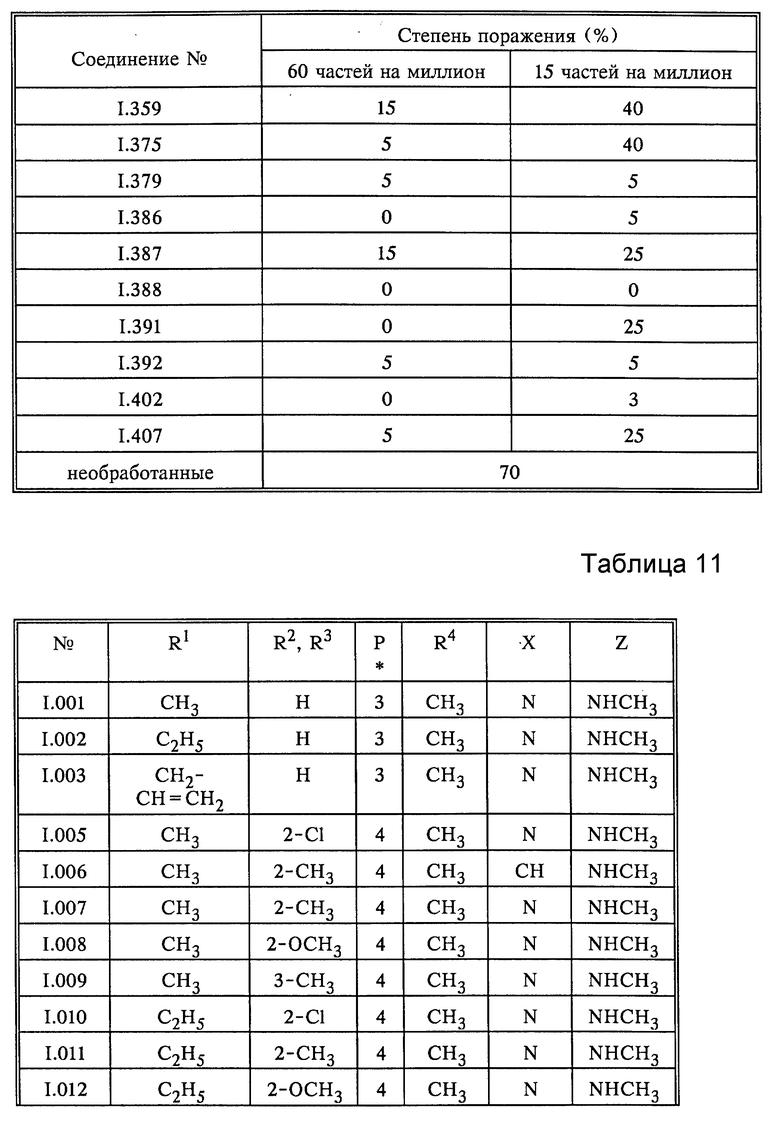
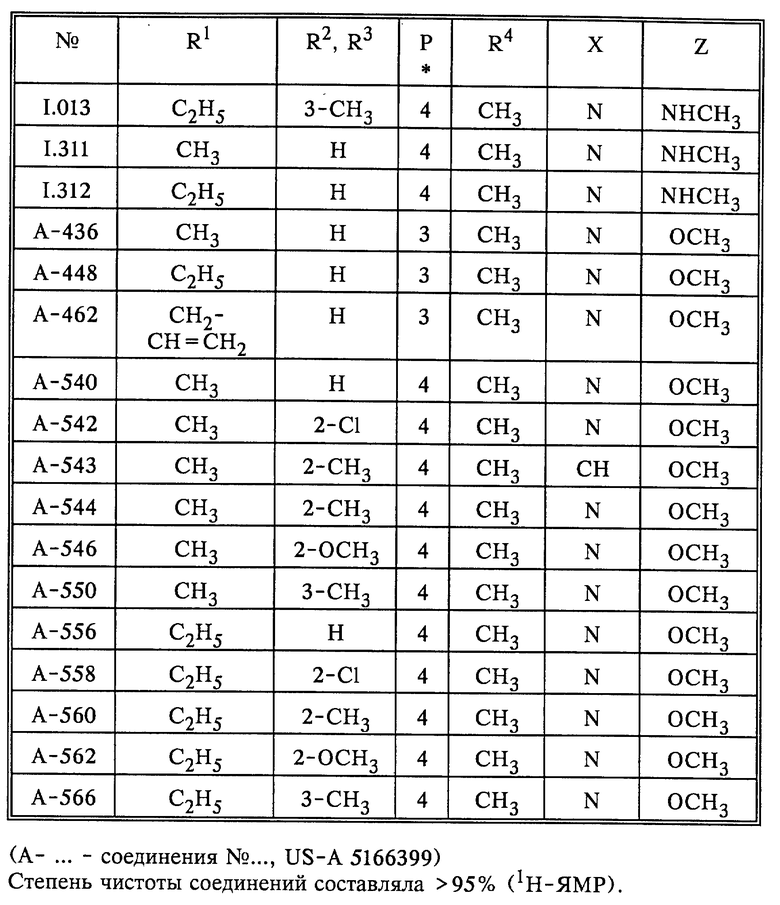
Результаты испытания соединения формулы I согласно данному изобретению и соединения формулы Ia из US A5166399, приведены в табл. 11.
С использованием соединений готовили 20%-ную эмульсию в смеси, содержащей 70 мас. % циклогексанона, 20 мас.% Nekanil®LN(Lutensol®AP6, поверхностно-активное вещество с эмульгирующим и диспергирующим действием на основе оксиэтилированных алкилфенолов) и 10 мас.% Emulphor® EL (Emulan®EL, эмульгатор на основе оксиэтилированных жирных спиртов). Концентраций, приведенных в примерах, достигали разбавлением композиции соединений водой.
Биологическое действие соединений табл.11 испытывали следующим образом.
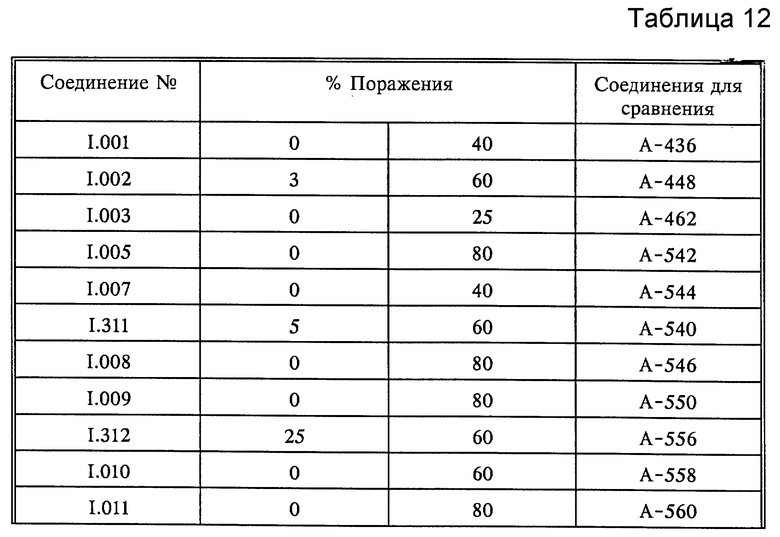
A. Puccinia recоndita
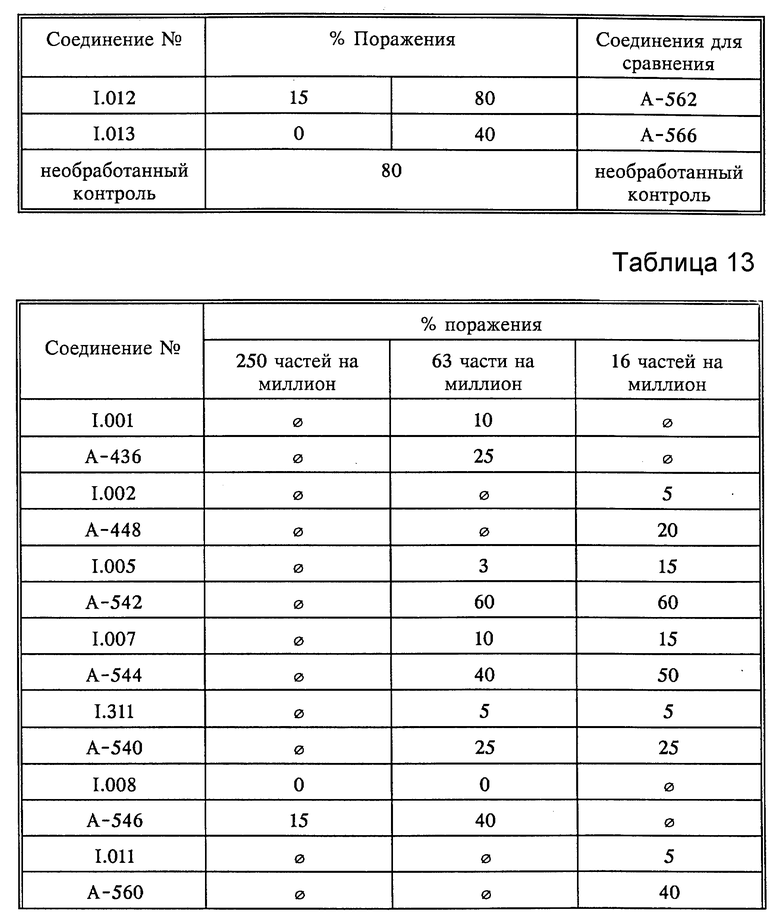
Листья всходов пшеницы сорта "Kanzler" опыляли спорами бурой ржавчины пшеницы (Puccinia recondita). Обработанные таким образом растения инкубировали в течение 24 часов при 20-22oC и относительной влажности 90-95%, а затем обрабатывали водными композициями, содержащими 250 частей на миллион активнодейстующих компонентов. По истечении последующих 8 дней при 20-22oC и относительной влажности 65-70% определяли степень роста плесени. Результаты оценивали визуально; они представлены в табл. 12.
B. Erysiphe graminus var. tritici
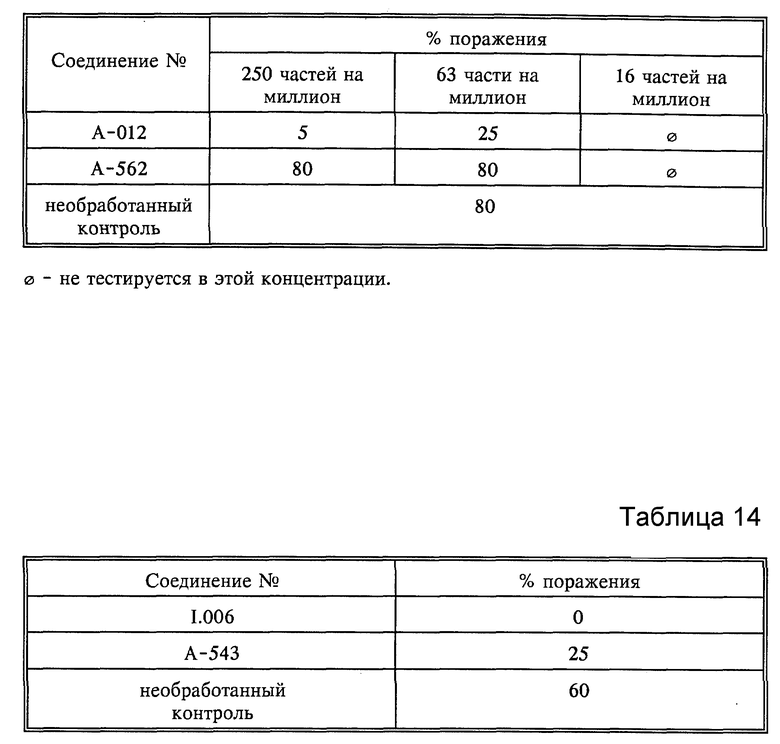
Листья всходов пшеницы сорта "Fruhgold" вначале обрабатывали водными композициями активнодействующих компонентов. По истечении приблизительно 24 часов растения опыляли спорами мучнистой росы пшеницы (Erysiphe graminus var. tritici). Обработанные таким образом растения инкубировали в течение 7 дней при 20-22oC и относительной влажности 75-80%. Затем определяли степень роста плесени. Результаты оценивали визуально; они представлены в табл. 13.
C. Pyricularia oryzae
Всходы риса сорта "Tai Nong 67" опрыскивали до стекания жидкости водными композициями, содержащими 250 частей на миллион частей активнодействующих компонентов. По истечении 24 часов растения опрыскивали водной суспензией спор гриба Pyricularia oryzae и выдерживали в течение 6 дней при 22-24oC и относительной влажности 95-99%. Результаты оценивали визуально; они представлены в табл. 14.
Примеры действия против вредителей
Действие соединений общей формулы I против вредителей класса насекомых, паукообразных и нематод показано с помощью нижеприведенных опытных данных. Пределы действия отдельных веществ приведены в таблицах.
Рисовые цикады (Nephotettix cincticeps)
Хлопчатниковый червь (Prodenia litura), контактные опыты
Листовая тля (Aphis fabae).
Для этих видов вредителей точные данные опытов даны в разделах B.1, B.2 и B.8.
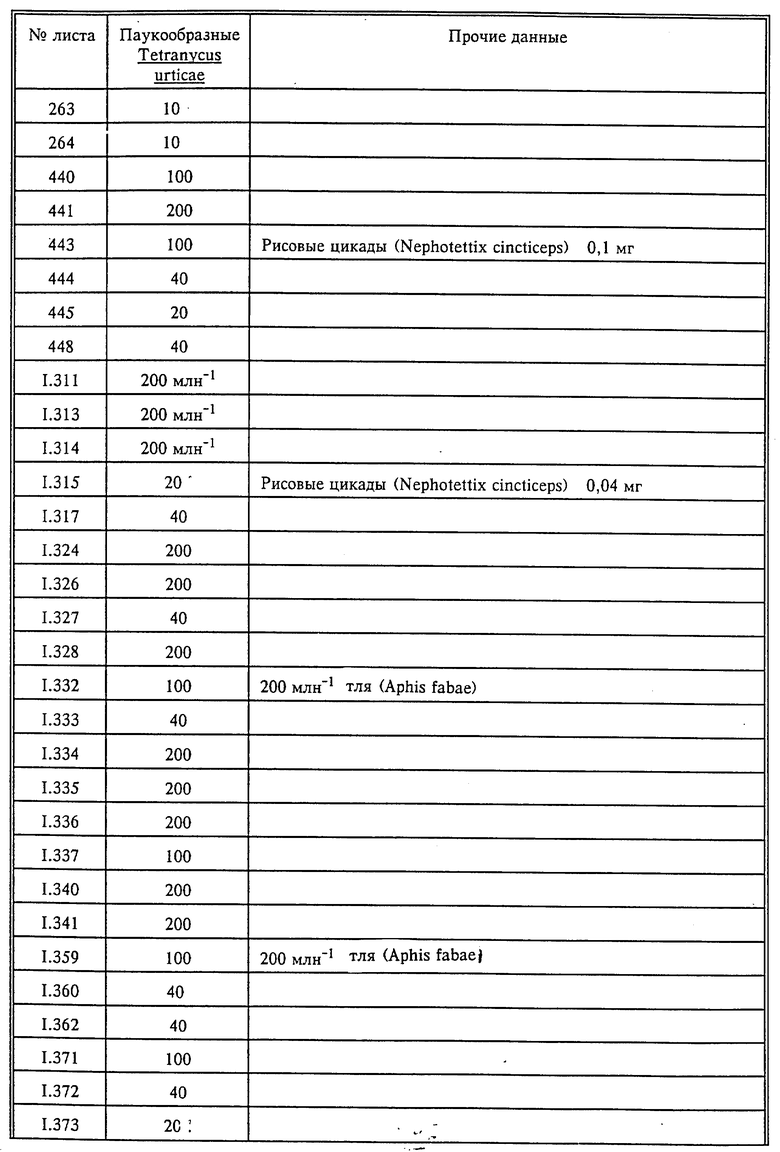
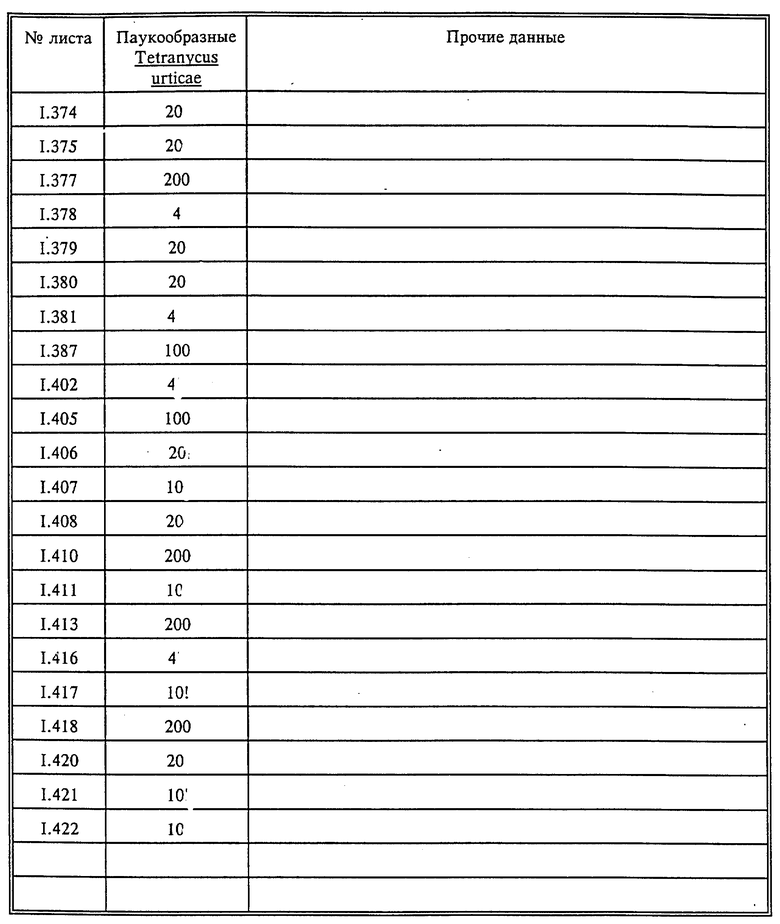
Паутинный клещ (Tetranychus urticae)
Описание испытаний и результат опытов приведены в табл. 15. Вторая и третья колонки табл.15 относятся к порогу действия, а именно к минимальной концентрации, при которой достигается по меньшей мере 60%-ное повреждение соответствующего вредителя, по отношению к которому применяется испытываемое соединение.
25A - Tetranychus urticae, бобовый паутинный клещ
Вид опытов - контактное действие, опрыскивание
Проведение опытов
Выращенные в горшке кустовые бобы с полностью развитой парой листьев опрыскивались в кабине водным раствором активного вещества до образования капель. Затем растения с помощью направляющей шины перемещались на вращающийся поддон кабины и опрыскивались со всех сторон с помощью трех различно расположенных сопел 30 см3 раствора активного вещества. Процесс орошения продолжался приблизительно 20 секунд. Растения должны были иметь сильное поражение клещом и отложенными яйцами.
Контроль проводился через 5 дней с помощью бинокулярной линзы. При этом определялось, развиваются ли все стадии равномерно. В ходе опыта растения находились в обычных условиях парника.
Оценка - % поражения
Поражение:
100% отсутствие живых гусениц и яиц
80%: ≤ 4 живых гусениц и яиц
60%: 5-10 живых гусениц и яиц
0% >: 10 живых гусениц и яиц
Начальная концентрация: 0,04%
Стандарт: Plictran (Cyhexatin)у
| название | год | авторы | номер документа |
|---|---|---|---|
| СОЕДИНЕНИЯ ТРИАЗОЛА И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ИХ ОСНОВЕ | 1995 |
|
RU2167869C2 |
| ПРОИЗВОДНЫЕ 3-ГАЛОГЕН-3-ГЕТАРИЛКАРБОНОВОЙ КИСЛОТЫ, ГЕРБИЦИДНОЕ СРЕДСТВО | 1994 |
|
RU2146255C1 |
| СОЕДИНЕНИЕ ПИРИМИДИНА(ВАРИАНТЫ) И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, ОБЛАДАЮЩАЯ СРОДСТВОМ К ДОПАМИН D3-РЕЦЕПТОРАМ | 1995 |
|
RU2172736C2 |
| ИМИНООКСИМЕТИЛЕНАНИЛИДЫ, СПОСОБ ИХ ПОЛУЧЕНИЯ (ВАРИАНТЫ), СРЕДСТВА ДЛЯ БОРЬБЫ С ВРЕДИТЕЛЯМИ, СПОСОБ БОРЬБЫ С ВРЕДИТЕЛЯМИ, ПРОМЕЖУТОЧНЫЕ СОЕДИНЕНИЯ | 1995 |
|
RU2143423C1 |
| ЗАМЕЩЕННЫЕ ПРОИЗВОДНЫЕ ПИРАЗИНА И ГЕРБИЦИДНОЕ СРЕДСТВО НА ИХ ОСНОВЕ | 1995 |
|
RU2155756C2 |
| ПРОИЗВОДНЫЕ 2-ИМИНООКСИФЕНИЛУКСУСНОЙ КИСЛОТЫ И СРЕДСТВО, СОДЕРЖАЩЕЕ ЭТИ СОЕДИНЕНИЯ | 1996 |
|
RU2170229C2 |
| АННЕЛИРОВАННЫЕ (ОКСА)-ГИДАНТОИНЫ, СПОСОБЫ ИХ ПОЛУЧЕНИЯ, ГЕРБИЦИДНЫЙ СОСТАВ И СПОСОБ КОНТРОЛЯ СОРНЫХ РАСТЕНИЙ | 1993 |
|
RU2113439C1 |
| ОКСИМОВЫЙ ЭФИР, ОБЛАДАЮЩИЙ ФУНГИЦИДНОЙ, АКАРИЦИДНОЙ И ИНСЕКТИЦИДНОЙ АКТИВНОСТЬЮ | 1995 |
|
RU2180899C2 |
| ПЕСТИЦИДЫ | 1994 |
|
RU2142938C1 |
| ЛЕКАРСТВЕННОЕ СРЕДСТВО НА ОСНОВЕ ПРОИЗВОДНЫХ ТИАЗОЛА ИЛИ ТИАДИАЗОЛА, ПРОИЗВОДНЫЕ ТИАЗОЛА ИЛИ ТИАДИАЗОЛА И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 1995 |
|
RU2173687C2 |



Замещенные простые оксимовые эфиры общей формулы I, где R1 - С1-6-алкил, С3-6-алкенил, С1-6-галогеналкил, С1-4- алкокси-С1-6-алкил, С1-6-алкоксикарбонилалкил, С3-6-циклоалкилалкил, фенилалкил, фенилоксиалкил, причем фенил может быть замещен галогеном, цианалкил, фенил-С3-6-алкенил, причем фенил может быть замещен галогеном, С1-2-галогеналкилом, фуран-2-ил-С1-6-алкил; R2 и R3 - Н, алкил, алкокси, галоген, циано-или нитрогруппа; R4 - Н, фенил, алкил, С3-6-циклоалкил, галогеналкил; R5 и R6 - Н или алкил; 4 X обозначает -СН или азот. Соединения формулы I проявляют фунгицидную, инсектицидную, арахноицидную активность и проявляют отличное действие против широкого спектра растительных патогенных грибков и могут применяться в качестве листовых и почвенных фунгицидов. 2 с. и 5 з.п. ф-лы, 18 табл.
в которой R1 обозначает C1-C6-алкил, C3-C6-алкенил, C3-C4-алкинил, C1-C6-галогеналкил, C3-C6-галогеналкенил, C1-C4-алкокси- C1-C6-алкил,
C1-C6-алкоксикарбонил-C1-C6-алкил, C3-C6-циклоалкил, C3-C6-циклоалкил,
C1-C6-алкил, фенил-C1-C6-алкил, фенилокси-C1-C6-алкил, причем фенил может быть замещен галогеном, циан-C1-C6-алкил, фенил- C3-C6-алкенил, причем фенил может быть замещен галогеном, C1-C2-галогеналкилом, фуран-2-ил- C1-C6-алкил;
R2 и R3 являются одинаковыми или различными и обозначают водород, C1-C4-алкил, C1-C4-алкоксигруппу, галоген, циано- или нитрогруппу;
R4 обозначает водород, фенил, C1-C6-алкил, C3-C6-циклоалкил, галоген-C1-C7-алкил;
R5 и R6 являются одинаковыми или различными и обозначают водород или C1-C4-алкил;
X обозначает -CH или азот.
Приоритет по пунктам:
15.07.92. - по п.1, кроме R4 - циклоалкил, галогеналкил, пп.2, 3, 6, 7;
31.03.93 - по п.1, где R4 - циклоалкил, галогеналкил, пп.4, 5.
| ВЕНТИЛЬНЫЙ ПРИВОД постоянного ТОКА с ШИРОТНО- ИМПУЛЬСНЫМ УПРАВЛЕНИЕМ | 0 |
|
SU253213A1 |
| EP 386561, 1990 | |||
| Справочник по пестицидам | |||
| - М.: Химия, 1985, с | |||
| Способ обделки поверхностей приборов отопления с целью увеличения теплоотдачи | 1919 |
|
SU135A1 |
Авторы
Даты
1999-03-10—Публикация
1993-07-06—Подача