Изобретение относится к новым биологически активным соединениям, а именно к соединению включения 9-(2-оксиэтоксиметил)гуанина формулы: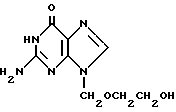
с β- циклодекстрином.
Новое соединение обладает антигерпесной активностью, что позволяет предполагать возможность его использования в медицине.
Известно, что начиная с 1978 года (года создания) 9-(2-оксиэтоксиметил)гуанин (ацикловир) является стандартным антигерпесным препаратом и эталоном для новых противовирусных средств [Schaeffer H.J., Beauchamp L.M., de Miranda P. , Elion G.B., Bauer D.J., Collins P., Nature (London), 1978, 272, p.583-585].
Ацикловир эффективен против вируса простого герпеса I, вируса простого герпеса II, вируса герпеса Zoster, вируса Эпштейна-Барра и цитомегаловируса. Ацикловир по своей активности значительно превосходит другие противовирусные препараты. По результатам испытаний, проведенных на модели простого герпеса в культуре ткани, ингибирующая концентрация (микромоль/л) ацикловира - 0,1. В то же время ингибирующая концентрация цитарабина - 0,2, идоксуридина - 1,0, видарабина - 1,6. Поэтому ацикловир широко используют в медицинской практике. Препарат применяют в различных лекарственных формах: в виде крема и глазной мази для местного применения, в таблетированной форме и в виде лиофилизованного порошка Na-соли ацикловира для инъекций.
Недостатком ацикловира является его очень малая растворимость - 1 мг/мл и как следствие этого невысокая биоусвояемость, которая составляет 15 - 30%. Поэтому постоянно ведутся поиски путей повышения биодоступности ацикловира.
Увеличение биоусвояемости ацикловира достигается обычно двумя путями: или введением в состав лекарственной формы гидрофильных или гидрофильно-липофильных добавок без структурных изменений самого ацикловира, или получением соответствующих производных ацикловира, в основном их кислотно-аддитивных фармацевтически приемлемых солей.
В качестве гидрофильных добавок в водную фазу мазей и кремов вводят не менее 30 мас.% многоатомного спирта, смешивающегося с водой, например глицерина, пропиленгликоля, полиэтиленгликоля или бутан-1,3-диола [EP 0 044 543, A 61 K 9/10] , а в качестве гидрофильно-липофильных добавок - двухкомпонентные смеси, содержащие помимо C3-C4-диолов или их эфиров соответствующие добавки типа эмульгаторов, способствующие проникновению в клетку, в частности C7-C18-алкенолы или алкеновые кислоты или их производные, при весовом соотношении диола и второй компонентной добавки, равном 10 - 50 : 1 [EP 0095813, A 61 K 1/52].
Таким образом, введение гидрофильных или гидрофильно-липофильных добавок способствует решению проблемы биоусвояемости ацикловира в случае использования препарата в виде кремов и мазей, т.е. при наружном (местном) применении.
В ряде случаев биоусвояемость ацикловира увеличивают путем добавления в готовые формы от 0,01 до 30%, преимущественно от 0,2 до 5% солей лития, например хлорида, цитрата, ацетилсалицилата, оротата или сукцината лития [ЕП 0135312, A 61 K 31/52].
Определенный интерес представляют производные ацикловира, получаемые взаимодействием ацикловира с N-замещенным валином или изолейцином с последующим удалением защитной группы и выделением целевого продукта в виде основания или переведением его в фармацевтически приемлемую соль действием как органических, так и неорганических кислот [ЕП 0308065, C 07 D 473/18]. В этом случае процент биоусвояемости для аддуктов составляет 63 и 50% соответственно против 15% самого ацикловира. Однако спектр действия данных производных не столь широк, как у ацикловира, в основном они эффективны против вируса пузырькового лишая.
Обычно же при оральном применении ацикловира (таблетки, капсулы) низкую биоусвояемость ацикловира компенсируют повышением его суточной дозы, позволяющей создать эффективную лечебную концентрацию препарата в крови, что значительно удорожает химико-терапевтический курс лечения.
Новое соединение включения 9-(2-оксиэтоксиметил)гуанина с β- циклодекстрином (декстравир) позволяет повысить биоусвояемость ацикловира при оральном применении.
В качестве объекта для образования соединения включения с 9-(2-оксиэтоксиметил)гуанином был выбран β-циклодекстрин (β-ЦД). β-ЦД представляет собой циклический олигомер, где семь мономерных единиц α-D-глюкозы в пиранозной форме, имеющие конформацию кресла, связаны 1→4- гликозидными связями и образуют цилиндрическую форму с внутренней полостью. Внутренняя область β-циклодекстрина мало полярна и достаточно велика (внутренний диаметр составляет около 7,5 E, а глубина - около 6,7 E) для размещения неполярных соединений соответствующего размера, а высокая электронная плотность внутри полости циклического олигосахарида, обусловленная обилием гидроксильных групп с их неподеленными парами электронов кислородных атомов, объясняет легкость образования соединений включения [Cramer F., Saenger W., Spatz H., J. Amer. Chem. Soc. , 1967, 89, p. 14; James W.J., French D., Rundle R.E., Acta Crystal. , 1959, 12, p. 385; "Химия углеводов", изд-во "Химия", М., 1967, стр. 425,607-608].
Важно подчеркнуть, что циклодекстрины нетоксичны. Исследования, проведенные на животных, показали, что при введение β-ЦД как перорально, так и внутривенно отсутствуют патологические изменения, которые можно обнаружить биохимическими и гистологическими методами. Кроме того, β-ЦД не оказывает эмбриотоксического и тератогенного действия [Frumming K. H., International Symposium on Cyclodextrins, Ist. Proceedings. Budapest., 1982, p. 367-376; Nagai T., International Symposium on Cyclodextrins, Ist. Proceedings. Budapest., 1982, p. 15-24; Szejtli J., Bolla-Pusztai E., Sturke, 1980, Bd. 32, S. 386-391].
Сама реакция включения молекулы ацикловира во внутреннюю полость молекулы β-ЦД представляет собой равновесный обмен между водой, заполняющей полость β-ЦД, и молекулой 9-(2-оксиэтоксиметил)гуанина.
Декстравир может быть получен двумя методами.
По первому методу декстравир получают поэтапным растворением компонентов (β-циклодекстрина и ацикловира) в воде или водно-спиртовых растворах при нагревании с последующей концентрацией раствора образовавшегося комплекса и выделением готового соединения включения.
Первоначально получают раствор β-циклодекстрина в воде или водно-спиртовом растворе. β-Циклодекстрин относится к труднорастворимым соединениям (растворимость при 20oC - 1,48 г/100 мл воды), поэтому растворение β-ЦД проводят при 65-80oC, растворимость β-ЦД в этом интервале температур от 10,18 г до 19,86 г в 100 мл воды.
Последующее добавление к образовавшемуся раствору β-ЦД ацикловира и его постепенное растворение, сопровождающееся образованием соединения включения, проводят в тех же температурных режимах, т.е. при 65-80oC. Выбранный температурный режим позволяет сократить время растворения β-ЦД, время комплексообразования и выдержать определенное объемно-массовое соотношение разбавителя и общей массы компонентов. Наиболее оптимальное объемно-массовое соотношение разбавителя и реагентов равно 10 - 20 : 1 соответственно.
Общее время комплексообразования колеблется от 7 до 14 часов и находится в прямо пропорциональной зависимости от процентного содержания ацикловира в получаемом декстравире.
Содержание ацикловира в декстравире определяется и регламентируется объемом полости молекулы-"хозяина", т.е. β-циклодекстрина. Экспериментально показано, что комплексообразование происходит при молярном соотношение β-ЦД : ацикловир 2 - 1 : 1 - 2 соответственно. При этом получают декстравир с содержанием ацикловира от 10 до 30 мас.%.
Образовавшийся раствор декстравира концентрируют в вакууме до 1/3 - 1/4 начального объема, остаток (в виде суспензии) постепенно охлаждают до 2 - 5oC и выдерживают при этой температуре в течение 4 - 8 часов. Осадок декстравира отфильтровывают, промывают спиртом и сушат до постоянного веса в сушильном шкафу. Выход декстравира составляет 90 - 95%.
Второй метод является твердофазным. По этому методу декстравир получают механическим измельчением смеси ацикловира с β-ЦД в вибромельнице. При этом может быть использована, например, вибромельница со следующими параметрами: объем металлических барабанов вибромельницы - 45 см3, количество стальных шаров - 30, диаметр каждого шара - 0,5 см. Интенсивность подвода механической энергии (по калориметрическим данным) составляла 700 кал/мин, амплитуда колебаний - 2 мм.
Оптимальные условия получения соединения включения 9-(2-оксиэтоксиметил) гуанина с β-ЦД были подобраны экспериментально, конкретно для данного случая, для конкретной комплексообразующей пары (ацикловира и β-ЦД). Контроль за комплексообразованием проводили методами ТСХ, УФ-спектроскопии и дериватографии. Процесс измельчения проводили импульсами: в течение 30 секунд измельчения, затем 5-минутный перерыв во избежание слипания порошка и для остывания барабанов. Общее суммарное время измельчения составило 5 минут. Выход декстравира количественный.
Декстравир, полученный любым из вышеизложенных методов, представляет собой новое соединение включения ацикловира β-ЦД. Это белое кристаллическое вещество, которое удачно сочетает в себе качества исходных компонентов. Главным отличием нового соединения включения от ацикловира является растворимость, которая благодаря комплексообразованию с β-циклодекстрином, увеличивается по крайней мере на порядок и составляет 1 г на 280 мл воды.
Структура нового соединения подтверждена данными УФ-, ИК- и ЯМР-спектроскопии и дериватографией.
Пример 1. 22,7 г (0,02 моль) β-циклодекстрина суспендируют в 250 мл воды, суспензию нагревают до 70-75oC и перемешивают в течение часа до образования раствора. Затем добавляют 2,21 г (0,01 моль) ацикловира и перемешивают при 70 - 75oC в течение 5 часов до полного растворения ацикловира. Образовавшийся раствор выдерживают при той же температуре в течение 2 - 3 часов, затем концентрируют в вакууме при температуре 50 - 53oC и остаточном давлении 10 мм рт. ст. до объема 60 - 70 мл. Охлаждают и выдерживают при +4oC в течение 6 часов. Осадок отфильтровывают, промывают на фильтре 96%-ным этанолом (2х25 мл), сушат в вакуум-сушильном шкафу при 60oC и остаточном давлении 1 - 2 мм рт. ст. над P2O5 в течение 6 часов. Получают 24,9 г декстравира с содержанием ацикловира 10 мас.%. Выход целевого продукта 91,5%. Rf = 0,43 - 0,45 (ТСХ, пластинки Silufol UV-254; система: хлороформ-метанол-вода 20 : 14 : 1, обнаружение УФ и при нагревании); УФ-спектр (H2O): λmax 196,2±1 нм, 251,4±1 нм, λmin 222,1±1 нм.
Пример 2. Суспензию 2,27 г (0,002 моль) β-циклодекстрина в смеси 12,5 мл воды и 12,5 мл спирта нагревают до 65-70oC и перемешивают в течение получаса до образования раствора. Затем добавляют 0,45 г (0,002 моль) ацикловира и перемешивают при 65-70oC в течение 7 часов.
Образовавшийся раствор концентрируют в вакууме до 1/4 начального объема, охлаждают и выдерживают при 4oC в течение 4 часов.
Осадок отфильтровывают, промывают на фильтре этанолом (2х20 мл) и сушат в вакууме над P2O5 до постоянного веса. Получают 2,56 г декстравира с содержанием ацикловира 20 мас.%. Выход комплекса - 94,1%. Rf = 0,43 - 0,45 (ТСХ, пластинки Silufol UV-254; система: хлороформ-метанол-вода 20 : 14 : 1; обнаружение УФ и при нагревании); УФ-спектр (H2O): λmax 196,0±1 нм, 251,5±1 нм, λmin 222,1±1 нм.
Пример 3. К 283,75 г (0,25 моль) β-циклодекстрина приливают 6,0 л дистиллированной воды, суспензию перемешивают при 70-75oC в течение часа до полного растворения β-ЦД. Затем добавляют 112,72 г (0,5 моль) ацикловира и перемешивают при 75-80oC в течение 12,5 часов. Образовавшийся раствор фильтруют в горячем состоянии от механических примесей и нерастворившегося осадка - примесного гуанина, маточник упаривают в вакууме при температуре 50- 55oC и остаточном давлении 10-12 мм рт.ст. Собирают 4,25 л отгона. Остаток постепенно охлаждают, при этом выпадает белый осадок.
Суспензию выдерживают при 4oC в течение 6 часов. Осадок отфильтровывают, промывают 0,5 л этанола (2х250 мл), сушат в сушильном шкафу при 60oC в течение 6 часов и получают 324,3 г комплекса с содержанием ацикловира 30 мас. %. Выход декстравира 95,3%. Rа = 0,43 - 0,45 (ТСХ, пластинки Silufol UV-254; система: хлороформ-метанол-вода 20 : 14 : 1, обнаружение УФ и при нагревании); УФ-спектр (H2O): λmax 196,8±1 нм, 251,5±1 нм, λmin 221,0±1 нм.
Пример 4. В вибромельницу (с вышеуказанными параметрами) загружают 2,27 г (0,002 моль) β-циклодекстрина и 0,221 г (0,001 моль) ацикловира. Смесь механически измельчают. Процесс измельчения состоит из 10 циклов, каждый из которых включает 30 секунд работы вибромельницы, т.е. непосредственного механического измельчения смеси, и 5 минут перерыва, в течение которого происходит охлаждение как самой мельницы, так и препаративной смеси, благодаря чему не происходит слипания порошка, структура образующегося комплекса остается кристаллической. В процессе повторения этих циклов происходит образование декстравира. Получают в виде мелкодисперсного подвижного порошка 2,49 г целевого продукта с выходом 91,5%. Rf = 0,43 - 0,45 (ТСХ, пластинки Silufol UV-254; система: хлороформ-метанол-вода 20 : 14 : 1, обнаружение УФ и при нагревании); УФ-спектр (H2O): λmax 196,2±1 нм, 251,4±1, λmin 222,1±1 нм.
Была изучена антигерпесная активность заявляемого соединения включения.
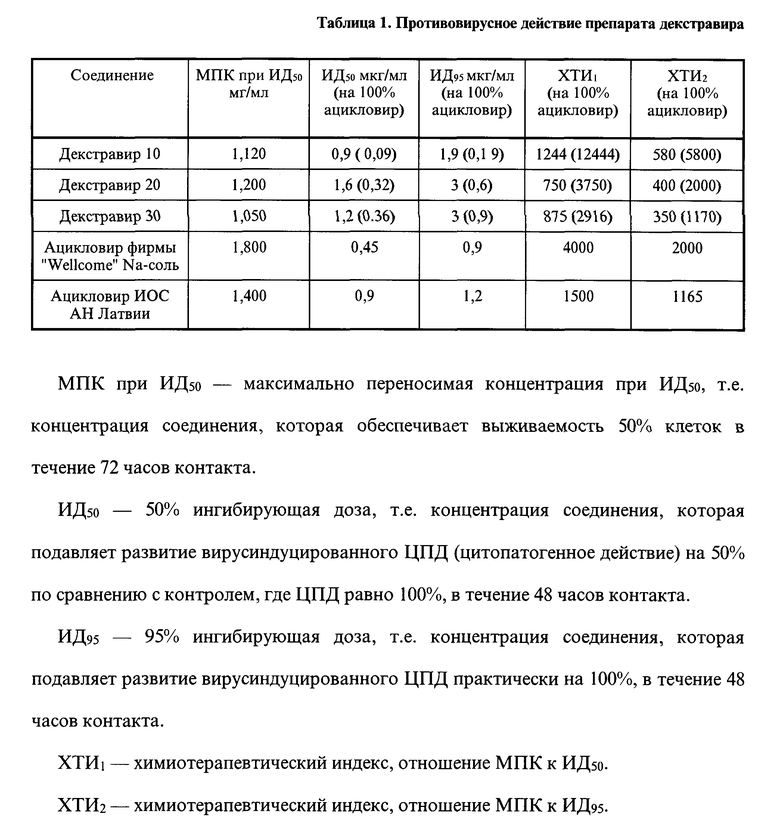
Предварительно противовирусную эффективность образцов декстравира с различным содержанием ацикловира (10, 20, 30%) оценивали в культуре клеток Vero в отношении вируса герпеса ВПГ-1 штамм α2, выращенного в присутствии различных концентраций препарата, по сравнению с контрольными культурами без препарата. Для сравнения использовали препараты ацикловира фирмы "Wellcome" и Института органического синтеза АН Латвии. Подсчет инфекционного титра вируса ВПГ-1 в культуре ткани проводили по методу Кербера и П.Ф.Рокитского.
Результаты представлены в таблице 1.
Результаты предварительного изучения свидетельствуют, что препарат декстравир полностью сохранил противовирусное действие исходного ацикловира, в то же время по ингибирующему действию и терапевтическому индексу он даже превосходит водорастворимую Na-соль ацикловира - инъекционный препарат фирмы "Wellcome". Кроме того, все соединения группы декстравир малотоксичны.
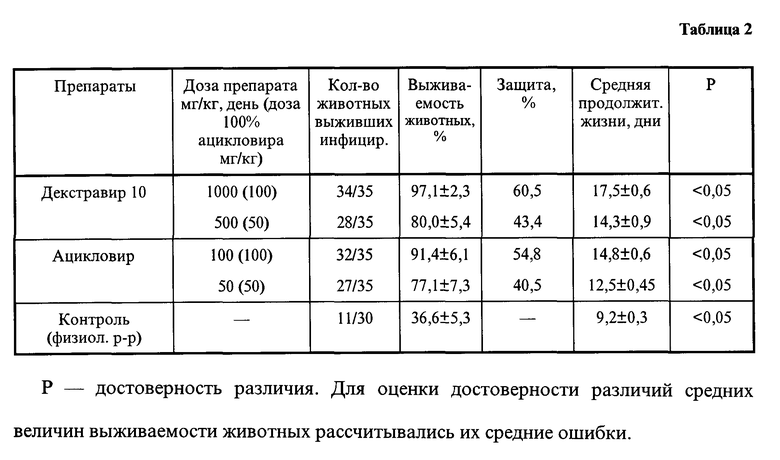
Высокую активность препарата подтвердили и исследования, проведенные на животных при экспериментальной инфекции белых мышей, вызванной вирусом простого герпеса при внутрибрюшинном заражении животных. Исследование эффективности декстравира in vivo проводили на белых мышах массой 8 - 10 г при внутрибрюшном заражении по 0,2 мл. Препарат вводили внутрибрюшинно по 0,2 мл 5 раз через 4 часа после заражения и далее в течение 4 дней ежедневно. Растворы препаратов стерилизовались путем фильтрации через фильтр "Миллипор" 0,45 мкм. Наблюдение за животными проводили в течение 21 дня.
Инфицирование животных осуществляли адаптированным к мозговой ткани вирусом простого герпеса ВПГ-1, штамм 0,2, внутрибрюшинно инфицирующей дозой 50 ЛД50/0,2 мл, что обеспечивало 36,6%-ную выживаемость животных в контроле. В предварительных опытах ВПГ-1 был пропассирован и протитрован на животных для определения инфицирующей дозы. Результаты исследования эффективности препарата in vivo суммированы в таблице 2.
Как следует из таблицы, декстравир обеспечивает выживаемость животных, зараженных вирусом простого герпеса, не уступая ацикловиру. Величина противовирусного действия препарата сравнима с активностью ацикловира. Данные по биоусвояемости и растворимости декстравира свидетельствуют о лучшей усвояемости препарата и его более высокой терапевтической активности.
Таким образом, новое соединение включения 9-(2-оксиэтоксиметил)гуанина с β-ЦД по своей антигерпесной активности не уступает препарату ацикловир, а по своей терапевтической активности превосходит последний.
| название | год | авторы | номер документа |
|---|---|---|---|
| ПРОИЗВОДНЫЕ 5'-H-ФОСФОНАТА 3'-АЗИДО-3'-ДЕЗОКСИТИМИДИНА И ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ НА ИХ ОСНОВЕ | 2001 |
|
RU2187509C1 |
| ЗАМЕЩЕННЫЕ АММОНИЕВЫЕ СОЛИ 5'-Н-ФОСФОНАТА 3'-АЗИДО-3'-ДЕЗОКСИТИМИДИНА, ЯВЛЯЮЩИЕСЯ СЕЛЕКТИВНЫМИ ИНГИБИТОРАМИ ПРОДУКЦИИ ВИРУСА ИММУНОДЕФИЦИТА ЧЕЛОВЕКА ВИЧ-1 И ВИЧ-2 | 1998 |
|
RU2207343C2 |
| МОДИФИЦИРОВАННЫЕ НУКЛЕОЗИД-5'-ТРИФОСФАТЫ КАК АНТИВИРУСНЫЕ АГЕНТЫ | 1996 |
|
RU2183213C2 |
| СОЛИ 5'-АМИНОКАРБОНИЛФОСФОНАТА 3'-АЗИДО-3'-ДЕЗОКСИТИМИДИНА, ЯВЛЯЮЩИЕСЯ СЕЛЕКТИВНЫМИ ИНГИБИТОРАМИ ПРОДУКЦИИ ВИРУСА ИММУНОДЕФИЦИТА ЧЕЛОВЕКА ВИЧ-1 | 2010 |
|
RU2441016C1 |
| КЛАТРАТНЫЙ КОМПЛЕКС β-ЦИКЛОДЕКСТРИНА С ПРОИЗВОДНЫМ 5-ГИДРОКСИ-4-АМИНОМЕТИЛ-1-ЦИКЛОГЕКСИЛ(ИЛИ ЦИКЛОГЕПТИЛ)-3-АЛКОКСИКАРБОНИЛИНДОЛА, СПОСОБ ЕГО ПОЛУЧЕНИЯ (ВАРИАНТЫ), ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ И ЛЕКАРСТВЕННОЕ СРЕДСТВО | 2011 |
|
RU2464042C1 |
| КЛАТРАТНЫЕ КОМПЛЕКСЫ БЕТА-ЦИКЛОДЕКСТРИНА С 1-{[6-БРОМ-1-МЕТИЛ-5-МЕТОКСИ-2-ФЕНИЛТИОМЕТИЛ-1-Н-ИНДОЛ-3-ИЛ]КАРБОНИЛ}-4-БЕНЗИЛПИПЕРАЗИНОМ, ОБЛАДАЮЩИЕ ПРОТИВОВИРУСНОЙ АКТИВНОСТЬЮ, ИХ ПОЛУЧЕНИЕ И ПРИМЕНЕНИЕ | 2010 |
|
RU2448120C1 |
| ЛЕЧЕБНО-ПРОФИЛАКТИЧЕСКАЯ ПОМАДА С ПРОТИВОВИРУСНОЙ АКТИВНОСТЬЮ И СПОСОБ ЕЕ ПРИГОТОВЛЕНИЯ | 2002 |
|
RU2282473C2 |
| 5`-ХОЛИНФОСФАТ 3`-АЗИДО-3`-ДЕЗОКСИТИМИДИНА КАК АНТИВИРУСНЫЙ АГЕНТ | 2002 |
|
RU2293739C2 |
| МОДИФИЦИРОВАННЫЕ 5'-ФОСФОНАТЫ АЗТ В КАЧЕСТВЕ АКТИВНЫХ КОМПОНЕНТОВ ДЛЯ ПОТЕНЦИАЛЬНЫХ ПРОТИВОВИРУСНЫХ ПРЕПАРАТОВ | 2004 |
|
RU2322450C2 |
| КЛАТРАТНЫЙ КОМПЛЕКС ЦИКЛОДЕКСТРИНА ИЛИ АРАБИНОГАЛАКТАНА С 9-ФЕНИЛ-СИММ-ОКТАГИДРОСЕЛЕНОКСАНТЕНОМ, СПОСОБ ЕГО ПОЛУЧЕНИЯ (ВАРИАНТЫ), ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ И ЛЕКАРСТВЕННОЕ СРЕДСТВО | 2011 |
|
RU2451680C1 |
Изобретение относится к новым биологически активным соединениям, а именно к соединению включения 9-(2-оксиэтоксиметил)гуанина с β-циклодекстрином с содержанием 9-(2-оксиэтоксиметил)гуанина 10 - 30 мас. %, обладающему антигерпесной активностью (декстравир). Декстравир получают двумя методами. По первому методу проводят поэтапное растворение компонентов (β-циклодекстрина и ацикловира) в воде или водно-спиртовых растворах при нагревании с последующей концентрацией раствора образовавшегося комплекса и выделением готового соединения включения. Второй метод является твердофазным. По этому методу декстравир получают механическим измельчением смеси ацикловира с β-ЦД в вибромельнице. Главным отличием нового соединения включения от ацикловира является растворимость, которая благодаря комплексообразованию с β-циклодекстрином составляет 1 г на 280 мл воды. 2 табл.
Соединение включения 9-(2-оксиэтоксиметил)гуанина формулы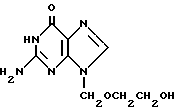
с β-циклодекстрином с содержанием 9-(2-оксиэтоксиметил) гуанина 10 - 30 мас.%.
| Грузчик для угольных машин | 1952 |
|
SU95813A1 |
| SU 915807 А, 1982 | |||
| US 5486508 А, 1996 | |||
| Химия углеводов | |||
| - М.: Химия, 1967, с | |||
| ПРИБОР ДЛЯ ОПРЕДЕЛЕНИЯ СКОРОСТИ ТЕЧЕНИЯ ВОДЫ И ОДНОВРЕМЕННОГО ПОЛУЧЕНИЯ ПРОБ ЕЕ | 1925 |
|
SU425A1 |
Авторы
Даты
1999-04-10—Публикация
1996-08-14—Подача